Физиология человека, 2023, T. 49, № 2, стр. 65-73
Особенности влияния вегетативной нервной системы на регуляторно-метаболические параметры лимфоцитов у здоровых детей и у детей с особыми возможностями здоровья
О. В. Смирнова 1, *, Е. С. Овчаренко 1, Э. В. Каспаров 1, В. В. Фефелова 1
1 Научно-исследовательский институт медицинских проблем Севера,
ФГБНУ “Федеральный исследовательский центр “Красноярский научный центр СО РАН”
Красноярск, Россия
* E-mail: ovsmirnova71@mail.ru
Поступила в редакцию 24.05.2022
После доработки 06.06.2022
Принята к публикации 24.06.2022
- EDN: GBPOYW
- DOI: 10.31857/S0131164622600434
Аннотация
Целью данного исследования было изучить особенности содержания биогенных моноаминов (катехоламины и серотонин) и метаболических параметров (активность сукцинатдегидрогеназы (СДГ) и кислой фосфатазы – КФ) лимфоцитов у детей в норме и у детей с особыми возможностями здоровья (ОВЗ) в зависимости от типа вегетативной регуляции. В обследовании принимали участие 168 детей младшего школьного возраста. Из них 114 относительно здоровых детей и 54 ребенка с нарушением интеллектуального развития (легкая (F70) и умеренная (F71) степень умственной отсталости). Группы были сопоставимы по полу и возрасту. В обеих исследованных группах зафиксировано увеличение параметров СДГ и катехоламинов от ваготонического к гиперсимпатикотоническому типам исходного вегетативного тонуса. Также в группе детей с ОВЗ установлено снижение активности КФ по мере увеличения активности симпатического отдела вегетативной нервной системы (ВНС). В целом у здоровых детей на фоне превалирующего эйтонического типа вегетативной регуляции, фиксируются оптимальные регуляторно-метаболические параметры клетки, что определяет достаточные адаптационно-приспособительные реакции в данной группе. В группе детей с ОВЗ доминирующая активность симпатического отдела ВНС, проявляется на клеточном уровне гиперкатехоламинемий, сниженным содержанием серотонина и активности КФ.
Вегетативная нервная система (ВНС) является одной из важнейших систем организма, обеспечивающей взаимодействие органов и тканей между собой [1]. Парасимпатический отдел ВНС контролирует оптимальное функционирование организма в состоянии относительного покоя, обеспечивая гомеостатические реакции. Тогда как симпатическое звено ВНС реализует адаптационно-приспособительные реакции к внутренним и внешним стимулам [2]. ВНС оказывает регуляторное влияние на системы органов, органы и клетки посредством специфических молекул, взаимодействующих с соответствующими клеточными рецепторами с последующим изменением метаболических параметров клеток.
В качестве клеточной модели при исследовании физиологических и патофизиологических процессов в организме нередко используются лимфоциты, поскольку они присутствуют в кровеносном русле в достаточном количестве и являются биологически доступным материалом. Кроме того, лимфоциты имеют набор клеточных органоидов, обеспечивающих протекание метаболических реакций, соответствующих основным клеткам организма. При этом функции клеток (в том числе и лимфоцитов) зависят от активности ферментов, определяющих метаболические реакции, которые, в свою очередь, находятся под контролем моноаминергических систем, связанных с ВНС. По данным Е.В. Неудахина и др. [3] параметры метаболических процессов лимфоцитов достаточно информативно характеризуют адаптационные реакции в условиях стрессовых воздействий. В лимфоцитах выявлены рецепторы и транспортеры к основным регуляторным соединениям [4]. По мнению T. Barkan et al. [5], лимфоциты являются оптимальной клеточной моделью. Структурная схожесть лимфоцитов и клеток центральной нервной системы (ЦНС) обеспечила широкое распространение лимфоцитов в качестве периферического “зеркала” клеток ЦНС [6]. В настоящее время лимфоциты активно используются для диагностики оценки тяжести заболевания и клинической эффективности терапии при таких заболеваниях как депрессия, болезнь Альцгеймера, шизофрения [7].
Среди физиологических и гигиенических исследований значительное внимание уделяется изучению адаптационных возможностей школьников. Учитывая ведущую роль ВНС в реализации адаптационно-приспособительных реакций организма, понимание механизмов регуляторного влияния ВНС на органы и клетки может способствовать раннему выявлению донозологических состояний, связанных с функциональным напряжением регуляторных систем, и проведению своевременных коррекционных мероприятий. Особенно важно учитывать адаптационные возможности школьников с особыми возможностями здоровья (ОВЗ), в том числе связанными с нарушением интеллектуального развития.
Цель исследования – изучить особенности содержания биогенных моноаминов (катехоламины и серотонин) и метаболических параметров (активность сукцинатдегидрогеназы (СДГ) и кислой фосфатазы – КФ) лимфоцитов у детей в норме и у детей с ОВЗ в зависимости от типа вегетативной регуляции.
МЕТОДИКА
Обследовали 168 детей младшего школьного возраста. Из них 114 относительно здоровых детей (I–II группа здоровья) (средний возраст 9 ± ± 1.2 года) и 54 ребенка с ОВЗ, связанными с нарушением интеллектуального развития (легкая (F70) и умеренная (F71) степень умственной отсталости), средний возраст 9.1 ± 1.2 года). Группы были сопоставимы по полу и возрасту. Обследование проводили в медицинских кабинетах школ г. Красноярска. Определение активности метаболических ферментов лимфоцитов (СДГ, КФ) и содержания биогенных моноаминов (катехоламины и серотонин) проводили на базе Научно-исследовательского института медицинских проблем Севера (НИИ МПС, г. Красноярск).
Анализ вегетативной регуляции проводили по параметрам вариабельности сердечного ритма, записанным программно-техническим комплексом “ORTO Valeo” (НПП “Живые системы”, Россия). По параметрам вариационной пульсометрии рассчитывали индекс-напряжения (ИН), на основании которого определяли исходный вегетативный тонус для каждого ребенка (ваготония (ВТ) при ИН < 30 усл. ед., эйтония (ЭТ) при ИН от 31 до 90 усл. ед., симпатикотония (СТ) при ИН от 91 до 160 усл. ед., и гиперсимпатикотония (ГСТ) при ИН > 161 усл. ед.) [8].
Активность СДГ в лимфоцитах определяли цитохимическим методом [9], основанным на реакции взаимодействия фермента СДГ с субстратом (сукцинат) в присутствии п-нитротетразолия фиолетового с образованием нерастворимых гранул. Активность СДГ определяли как среднее число гранул в одной клетке, при подсчете 30 лимфоцитов под масляной иммерсией при увеличении 10 × 90.
Активность КФ в лимфоцитах оценивали методом A.F. Goldberg, T. Barka [10]. Подготовленные согласно методике мазки, инкубировали в среде с использованием нафтола Аs-Е-фосфата. Активность фермента оценивали по интенсивности розового окрашивания в единицах Kaplow.
Содержание серотонина и катехоламинов в лимфоцитах крови определяли люминесцентно-гистохимическим методом по H. Yokoo еt al. (1982) в модификации В.П. Новицкой (2000) [11]. Данный метод основан на реакции взаимодействия серотонина и катехоламинов с формальдегидными парами, с образованием люминесцирующего комплекса, дающего зеленую флуоресценцию. Подготовленные мазки исследовали при помощи флуоресцентного микроскопа “ЛЮМАМ-И3” с насадкой “ФМЭЛ-1” (напряжение 700 В, сопротивление 5 × 10–6 Ом). Сигнал выводили на цифровой вольтметр, эталонный фон измеряли на стандартном стекле-мишени. В каждом мазке измеряли флуоресценцию 15 клеток, вычисляли усредненное значение и вычитали усредненное значение фонового свечения, снимаемого в 3-х точках мазка. Полученный на вольтметре сигнал флуоресценции в мкВ выражали в условных единицах.
Статистический анализ проводили с помощью пакета прикладных программ STATISTICA 10.0 (StatSoft Inc., США). Нормальность распределения проверяли с помощью критерия Шапиро–Уилка с последующей оценкой равенства дисперсий по критерию Левена. В том случае, когда распределение в экспериментальных группах было нормальным и соблюдалось межгрупповое равенство дисперсий, дальнейшую обработку проводили с помощью метода параметрической статистики – критерия Ньюмена–Кейлса. При распределении, отличном от нормального, и несоблюдении межгруппового равенства дисперсий использовали методы непараметрической статистики – критерий Краскела–Уоллиса и U-критерий Манна–Уитни. Результаты представлены в виде медианы (Me) и перцентилей (25 и 75). Для качественных признаков сравнение групп осуществляли с использованием частотного метода (χ-квадрат). Различия оценивали как статистически значимые при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В нашей работе, опубликованной ранее, были представлены данные распределения исследуемых детей младшего школьного возраста по типам исходного вегетативного тонуса (ИВТ) [12]. Было выявлено, что в группе здоровых детей преобладает эйтонический тип ИВТ (47%, p < 0.05) (ваготонический тип – 13%, симпатикотонический – 21%, гиперсимпатикотонический – 19%), тогда как в группе детей с ОВЗ в 50% доминирует симпатический отдел вегетативной регуляции (симпатикотонический тип ИВТ – 33%, гиперсимпатикотонический – 24%, эйтонический тип – 26%, ваготонический – 18%).
В данной работе была поставлена задача – оценить особенности влияния ВНС на клеточном уровне (на примере лимфоцитов). Для этого исследовалось содержание регуляторных медиаторов, связанных с деятельностью ВНС (катехоламины и серотонин), а также активность ферментов, характеризующих метаболические параметры лимфоцитов, на которые способна влиять ВНС.
При анализе содержания катехоламинов (КА) в лимфоцитах крови в зависимости от типа исходного вегетативного тонуса в группе здоровых детей было выявлено, что содержание данных моноаминов зависит от преобладающей активности одного из звеньев ВНС (рис. 1, А). Так минимальные значения содержания катехоламинов зафиксированы при ваготонии. При увеличении влияния симпатического отдела ВНС показатели содержания катехоламинов пропорционально увеличиваются, достигая максимальных значений при гиперсимпатикотонии (H (n = 114) = 26.186 (p = 0.001)). Аналогичные закономерности выявлены в группе детей с ОВЗ – нарастание показателя содержания катехоламинов от ваготонии к гиперсимпатикотонии (H (n = 54) = 21.157 (p = = 0.001)) (рис. 1, Б). Выявленные особенности содержания катехоламинов в обеих исследуемых нами группах детей младшего школьного возраста вполне обоснованы, учитывая медиаторную функцию катехоламинов для симпатического отдела ВНС [13, 14]. При сравнении детей двух групп установлено, что содержание катехоламинов в группе детей с ОВЗ статистически значимо выше при симпатическом (р = 0.027) и гиперсимпатикотоническом (р = 0.018) типах исходного вегетативного тонуса по сравнению со здоровыми детьми.
Рис. 1.
Содержание катехоламинов в лимфоцитах крови в зависимости от исходного вегетативного тонуса у здоровых детей (А) и у детей с особыми возможностями здоровья (ОВЗ) (Б) младшего школьного возраста. ВТ – ваготония, ЭТ – эйтония, СТ – симпатикотония, ГСТ – гиперсимпатикотония. * – статистическая значимость различий относительно ваготонии (р = 0.001). Данные представлены в виде Ме, Р25–Р75.

При анализе метаболических характеристик у здоровых детей младшего школьного возраста было зафиксировано, что активность митохондриального фермента СДГ также зависит от типа исходного вегетативного тонуса. Самые низкие значения активности СДГ выявлены при ваготонии, самые высокие – при гиперсимпатикотонии (H (n = 114) = 16.764 (p = 0.002)) (рис. 2, А). У детей с ОВЗ активность СДГ также зависит от выраженности симпатического отдела ВНС – минимальные значения фиксируются при ваготонии, максимальные – при гиперсимпатикотонии (H (n = 54) = = 20.538 (p = 0.002)) (рис. 2, Б). При анализе данного фермента в исследуемых группах выявлено, что активность СДГ в группе детей с ОВЗ статистически значимо снижена при эйтоническом типе исходного вегетативного тонуса (р = 0.044) по сравнению со здоровыми детьми.
Рис. 2.
Активность сукцинатдегидрогеназы (СДГ) лимфоцитов крови в зависимости от исходного вегетативного тонуса у здоровых детей (А) и у детей с особыми возможностями здоровья (ОВЗ) (Б) младшего школьного возраста. * – статистическая значимость различий относительно ваготонии (р = 0.002). Остальные обозначения см. рис. 1.

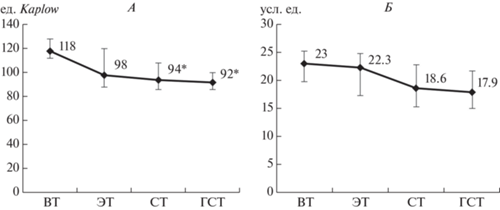
В группе детей с ОВЗ нами также были выявлены особенности активности КФ в зависимости от характера вегетативной регуляции. Максимальные значения лизосомального фермента фиксируется при ваготонии, тогда как самые низкие значения выявлены при гиперсимпатикотонии (H (n = 54) = 27.237 (p = 0.0002)) (рис. 3, А). При сравнении детей двух групп по показателю КФ установлено, что активность данного фермента у детей с ОВЗ статистически значимо снижена при эйтоническом (р = 0.037), симпатическом (р = = 0.026) и гиперсимпатикотоническом (р = = 0.0006) типах исходного вегетативного тонуса по сравнению со здоровыми детьми (активность КФ в группе здоровых детей при ЭТ – 122 ед. Kaplow, СТ – 115 ед. Kaplow, ГСТ – 122 ед. Kaplow). По показателю содержания серотонина в лимфоцитах крови нами не установлено значимых отличий, однако можно отметить тенденцию (H (n = 54) = 6.88 (p = 0.083)) снижения значений данного параметра от ваготонии к гиперсимпатикотонии в группе детей с ОВЗ (рис. 3, Б). Также выявлено, что показатели данного моноамина в группе детей с ОВЗ статистически значимо снижены вне зависимости от типа исходного вегетативного тонуса (р < 0.05) относительно группы здоровых детей (содержания серотонина в группе здоровых детей при ВТ – 36.4 усл. ед., ЭТ – 36.4 усл. ед., СТ – 36.4 усл. ед., ГСТ – 36.8 усл. ед.).
Рис. 3.
Активность кислой фосфатазы (КФ) (А) и содержание серотонина (Б) в лимфоцитах крови в зависимости от исходного вегетативного тонуса в группе детей с особыми возможностями здоровья (ОВЗ). * – статистическая значимость различий относительно ваготонии (р = 0.0002). Остальные обозначения см. рис. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Вегетативная нервная система является уникальной физиологической системой организма, регулирующей практически все органы и ткани, а также обеспечивающей поддержание гомеостаза и перестройку метаболических процессов для реализации компенсаторно-приспособительных механизмов при действии различных стрессовых факторов. Вегетативная дисфункция является признаком многих патологических состояний, в том числе психоневрологических заболеваний и расстройств [15]. Выявленное нами преобладание симпатической направленности вегетативной регуляции у детей с ОВЗ, связанными с интеллектуальными нарушениями, свидетельствует о незрелости регуляторных механизмов и, как следствие, о сниженных адаптационно-приспособительных возможностях организма детей данной группы. Изменение регуляторной деятельности ВНС проявляется на всех структурно-функциональных уровнях организации детского организма – от органного до клеточного [16].
На уровне клетки вегетативное влияние осуществляется с помощью регуляторных молекул, одними из основных являются катехоламины [13, 14]. Катехоламины представляют собой группу соединений (адреналин, норадреналин, дофамин), относящихся к биогенным моноаминам и синтезируемых из аминокислоты тирозина [17]. Катехоламины как медиаторы симпатического отдела ВНС обеспечивают быстрые реакции организма на изменяющиеся условия. Регулируя деятельность сердечно-сосудистой системы катехоламины способствуют увеличению частоты сердечных сокращений и артериального давления, ударного объема крови, системного сосудистого сопротивления, улучшению проведения возбуждения в миокарде, ускорению продолжительности потенциала действия кардиомиоцитов за счет изменения кальциевого тока, сужению сосудов [18]. В то же время избыточное влияние катехоламинов вследствие хронической симпатической активации сопровождается структурно-функциональными изменениями миокарда (в том числе за счет перегрузки миокардиоцитов кальцием, митохондриальной дисфункции и развития окислительного стресса), что провоцирует развитие сердечной недостаточности и является фактором преждевременной смерти [18, 19].
Полученные нами результаты соответствуют представлениям о медиаторной роли катехоламинов для симпатического отдела ВНС. При ваготоническом типе исходного вегетативного тонуса зафиксировано самое низкое содержание катехоламинов. При симпатическом и гиперсимпатикотоническом типах ИВТ содержание катехоламинов статистически значимо выше относительно ваготонического типа ИВТ, и в группе детей с ОВЗ, и группе здоровых детей. Аналогичные результаты были получены в ряде исследований [20, 21]. Детей с высокой активностью симпатического отдела ВНС (симпатический и гиперсимпатикотонический исходный тонус) и, соответственно, высоким уровнем катехоламинов, можно отнести к группе риска, которая требуют повышенного внимания и проведения своевременных коррекционных мероприятий.
Серотонин также относится к биогенным моноаминам, синтезируется из незаменимой аминокислоты триптофана и выполняет широкий спектр функций в организме, регулируя функционирование практически всех систем (выделительная, когнитивные функции, цикл сна/бодрствования и др.) [22]. В частности, серотонин регулирует вазотонус, повышает проницаемость сосудистой стенки, способствует развитию положительного инотропного эффекта в миокарде предсердий, взаимодействие с 5-HT1A-рецепторами способствует развитию брадикардии. Также выявлен опосредованный эффект серотонина на сердечно-сосудистую систему, посредством регуляции высвобождения норадреналина [23]. По данным ряда авторов серотонин относят к стресс-лимитирующим системам [24, 25], что, может быть, связано с контролем серотонином эффективности работы других трансмиттеров. Так установлено, что при дефиците серотонина наблюдается усиление эффектов адренергической системы [26]. Кроме того, серотонин способен активировать ГАМК-ергическую систему, тем самым ограничивая стрессовые реакции и предотвращая повреждения внутренних систем организма под действием стрессовых факторов [27].
В ходе нашего исследования не были выявлены достоверные различия по содержанию серотонина в зависимости преобладающей активности звеньев ВНС. Однако в группе детей с ОВЗ зафиксирована выраженная тенденция (0.1 < p > 0.05): самое высокое содержание серотонина фиксируется при ваготоническом типе исходного вегетативного тонуса, по мере усиления активности симпатического отдела ВНС содержание серотонина снижается. Наши данные не противоречат имеющимся в литературе работам. По данным C.M. Hildreth et al. [28], деятельность серотонина связана с парасимпатическим отделом ВНС. В экспериментальных исследованиях было установлено, что при блокаде функции SERT (специфического переносчика серотонина) усиливается симпатическая реакция на стресс [26]. В ряде работ фиксируется низкое содержание серотонина и триптофана на фоне снижения активности парасимпатического отдела ВНС [29, 30].
Биогенные моноамины связываются со специфическими рецепторами на поверхности клетки и посредством активации вторичных мессенджеров изменяют направленность метаболических процессов [18, 22], и, в первую очередь, регулируют энергетический статус клеток.
СДГ является ключевым ферментом синтеза энергии (АТФ) в митохондриях [3, 31, 32], состоит из четырех субъединиц (SDHA, SDHB, SDHC и SDHD). Уникальность данного фермента заключается в объединении цикла трикарбоновых кислот и электрон-транспортной цепи митохондрий, за счет формирования “якорной площадки” на внутренней мембране митохондрий субъединицами SDHC и SDHD [33]. Считается, что нарушение активности СДГ способствует митохондриальной дисфункции, нарушению синтеза АТФ и энергетического гомеостаза клетки [34], что способствует формированию различных патологических состояний [32]. В литературе имеются данные о связи ВНС и энергетического состояния клетки [35, 36].
По результатам нашего исследования в группе детей с ОВЗ и в группе здоровых детей активность СДГ зависит от активности симпатического отдела ВНС: самые низкие показатели СДГ установлены при ваготонии, при симпатикотонии и гиперсимпатикотонии выявлены статистически значимо высокие показатели СДГ относительно ваготонии. Выявленная высокая активность СДГ при преобладающем тонусе симпатического отдела ВНС может определяться высоким содержанием катехоламинов, на фоне сниженного содержания серотонина. По данным N. Fedotcheva et al. [37] катехоламины обладают стимулирующим влиянием на СДГ, в то время как серотонин проявляет подавляющее действие на активность СДГ. По мнению Н.В. Хундеряковой и др. [36] СДГ является непосредственной мишенью для катехоламинов.
Стоит отметить, что активированное состояние фермента СДГ при симпатическом и гиперсимпатикотоническом типах исходного вегетативного тонуса характеризует высокую продукцию энергетических субстратов в состоянии покоя, что при длительном симпатическом доминировании может способствовать истощению энергетических ресурсов организма и снизить адаптационные возможности при действии стрессовых факторов. Таким образом, активность СДГ можно рассматривать как маркер напряжения адаптационных механизмов [35].
В то же время высокая активность СДГ свидетельствует о высокой продукции активных форм кислорода [38], которые, в свою очередь, являются одним из факторов повреждения и гибели клеток [39].
Еще одни важным маркером метаболических процессов в клетке признана КФ [40]. КФ является лизосомальным ферментом и характеризует катаболическую направленность метаболических реакций [3]. Данный фермент катализирует распад фосфорных моноэфиров с отделением фосфатных групп в кислой среде и участвует в различных физиологических процессах (фагоцитоз, иммунные реакции, формирование воспалительных реакций, старение клеток и др.) [41, 42].
В доступной нам литературы нет данных о связи активности КФ и функционировании ВНС. Однако полученные нами результаты свидетельствуют о явном наличии такой взаимосвязи – снижение активности данного фермента по мере снижения активности симпатического отдела ВНС в группе детей с ОВЗ. При этом диаметрально противоположные показатели активности КФ и СДГ, в зависимости от преобладающей активности звеньев ВНС, свидетельствуют о переключении метаболических реакций в соответствии с нуждами организма.
Стоит отметить, что у здоровых детей и детей с ОВЗ, связанными с нарушением интеллектуального развития, установлены одинаковые закономерности распределения регуляторно-метаболических параметров лимфоцитов в зависимости от доминирующего типа вегетативной регуляции, что может свидетельствовать об общефизиологических особенностях регуляторного влияния ВНС на клеточном уровне в норме и при отклонении в развитии.
ЗАКЛЮЧЕНИЕ
Таким образом, по данным исследования у здоровых детей превалирует эйтонический тип вегетативной регуляции, ассоциированный с оптимальным содержанием биогенных моноаминов (катехоламинов и серотонина), и активностью ферментов, определяющих метаболические процессы в клетке. Все это определяет достаточные адаптационно-приспособительные реакции в данной группе детей. В группе с ОВЗ доминирует активность симпатического отдела ВНС, характеризующегося смещением регуляторного влияния в сторону стресс-реализующих компонентов (гиперкатехоламинемия и низкое содержание серотонина) и нарушением метаболических процессов (снижение активности КФ). Высокое содержание катехоламинов в группе детей с ОВЗ является фактором риска развития сердечно-сосудистых заболеваний, а сниженное содержание серотонина может способствовать прогрессированию психологических и когнитивных нарушений. Низкая активность лизосомального фермента КФ свидетельствует о снижении процессов аутофагии в клетке, и, как следствие, о риске инфекционных заболеваний у детей с ОВЗ. Нарушение баланса регуляторных влияний на лимфоциты (в том числе на их метаболические реакции) требует медикаментозной коррекции для оптимизации адаптационно-приспособительных возможностей детей с ОВЗ.
Кроме того, исследуемые регуляторные и метаболические параметры лимфоцитов продемонстрировали свою информативность в качестве маркеров функциональной активности звеньев ВНС как у здоровых детей, так и у детей с ОВЗ, и могут использоваться как маркеры состояния вегетативной регуляции при разработке соответствующих референтных значений. Исследование состояния ВНС проводится с помощью функциональных методик (кардиоинтервалография, исследование дермографизма, кожно-гальванической реакции), однако в ряде случаев их применение может быть затруднено. Выявление лабораторных маркеров деятельности ВНС может позволить оперативно фиксировать отклонения ее функционирования и представляется весьма перспективным.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Научно-исследовательского комитета медицинских проблем Севера (Красноярск).
Информированное согласие. Родители или законные представители исследуемых детей подписали добровольное письменное информированное согласие после разъяснения потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена за счет средств, выделяемых для выполнения государственного задания.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Rudd K.L., Yates T.M. The implications of sympathetic and parasympathetic regulatory coordination for understanding child adjustment // Dev. Psychobiol. 2018. V. 60. № 8. P. 1023.
Mulkey S.B., du Plessis A.J. Autonomic nervous system development and its impact on neuropsychiatric outcome // Pediatr. Res. 2019. V. 85. № 2. P. 120.
Неудахин Е.В., Морено И.Г. К вопросу патогенеза атеросклероза и коррекции атерогенных нарушений у детей // Русский медицинский журн. 2018. № 9. P. 62. Neudakhin E.V., Moreno I.G. [Revisiting the pathogenesis of atherosclerosis and correction of atherogenic disorders in children] // Russian Medical J. 2018. № 9. P. 62.
Peña S., Baccichet E., Urbina M. et al. Effect of mirtazapine treatment on serotonin transporter in blood peripheral lymphocytes of major depression patients // Int. Immunopharmacol. 2005. V. 5. № 6. P. 1069.
Barkan T., Peled A., Modai I. et al. Serotonin transporter characteristics in lymphocytes and platelets of male aggressive schizophrenia patients compared to non–aggressive schizophrenia patients // Eur. Neuropsychopharmacol. 2006. V. 16. № 8. P. 572.
Marazziti D., Landi P., Baroni S. et al. The role of platelet/lymphocyte serotonin transporter in depression and beyond // Curr. Drug Targets. 2013. V. 14. № 5. P. 522.
Romay-Tallon R., Rivera-Baltanas T., Allen J. et al. Comparative study of two protocols for quantitative image-analysis of serotonin transporter clustering in lymphocytes, a putative biomarker of therapeutic efficacy in major depression // Biomark. Res. 2017. V. 5. P. 27.
Баевский Р.М., Кириллов О.И., Клецкин С.З. Математический анализ изменений сердечного ритма при стрессе. М.: Наука, 1984. 221 с. Baevsky R.M., Kirillov O.I., Kletskin S.Z. [The mathematical analysis of changes of a cardiac rhythm at stress]. M.: Science, 1984. 221 p.
Нарциссов Р.П. Применение n-нитротетразолия фиолетового для количественной цитохимии дегидрогеназ лимфоцитов человека // Архив анатомии, гистологии и эмбриологии. 1969. Т. 56. № 5. С. 85. Narcissov R.P. [Application of n-nitrotetrazolium violet for quantitative cytochemistry dehydrogenases human lymphocytes] // Arh. Anat. Gistol. Ehmbriol. 1969. V. 56. № 5. P. 85.
Goldberg A.F., Barka T. Acid phosphatase activity in human blood cells // Nature. 1962. V. 195. № 3438. P. 297.
Новицкая В.П. Модификация метода определения моноаминов в лейкоцитах на мазках периферической крови // Клиническая и лабораторная диагностика. 2000. № 1. С. 24. Novitskaya V.P. [Modification of the method for determining monoamines in leukocytes on smears of peripheral blood] // Klin. Lab. Diagn. 2000. № 1. P. 24.
Смирнова О.В., Овчаренко Е.С., Каспаров Э.В., Фефелова В.В. Параметры физического развития детей с особыми возможностями здоровья с различными типами исходного вегетативного тонуса // Рос. физиол. журн. им. И.М. Сеченова. 2021. Т. 107. № 1. С. 85. Smirnova O.V., Ovcharenko E.S., Kasparov E.V., Fefelova V.V. Parameters of physical development of children with special health possibilities with various types of initial vegetative tonus // Russ. J. Physiol. 2021. V. 107. № 1. P. 85.
Ince L.M., Weber J., Scheiermann C. Control of leucocyte trafficking by stress–associated hormones // Front. Immunol. 2018. V. 9. P. 3143.
Kohler-Dauner F., Roder E., Krause S. et al. Reduced caregiving quality measured during the strange situation procedure increases child’s autonomic nervous system stress response // Child Adolesc. Psychiatry Ment. Health. 2019. V. 13. P. 41.
Wehrwein E.A., Orer H.S., Barman S.M. Overview of the anatomy, physiology, and pharmacology of the autonomic nervous system // Compr. Physiol. 2016. V. 6. № 3. P. 1239.
Колодяжная Т.А., Зайцева О.И., Зайцева Ж.Г., Игнатова И.А. Синдром вегетативной дисфункции у детей младшего школьного возраста: факторы риска и структурно-функциональное состояние мембран эритроцитов // SJLSA. 2021. Т. 13. № 4. С. 115. Kolodyazhnaya T.A., Zaitzeva O.I., Zaitzeva Gh.G., Ignatova I.A. [Syndrome of autonomic dysfunction in children of young school age: risk factors and structural and functional state of erythrocyte membranes] // S-JLSA. 2021. V. 13. № 4. P. 115.
Elkhatib S.K., Case A.J. Autonomic regulation of T-lymphocytes: implications in cardiovascular disease // Pharmacol. Res. 2019. V. 146. P. 104292.
Riessen R., Tschritter O., Janssens U., Haap M. Katecholamine: Pro und Kontra // Med. Klin. Intensivmed. Notfmed. 2016. V. 111. № 1. P. 37.
Dhalla N.S., Ganguly P.K., Bhullar S.K., Tappia P.S. Role of catecholamines in the pathogenesis of diabetic cardiomyopathy // Can. J. Physiol. Pharmacol. 2019. V. 97. № 9. P. 815.
Шайхелисламова М.В., Ситдикова А.А., Ситдиков Ф.Г. Взаимосвязь симпато-адреналовой системы, коры надпочечников и вегетативного тонуса у детей 7–9 летнего возраста // Физиология человека. 2008. Т. 34. № 2. С. 83. Shayhelislamova M.V., Sitdikova A.A., Sitdikov F.G. Interrelation between the sympathoadrenal system, adrenal cortex and autonomic tone in seven-to nine-year-old children // Human Physiology. 2008. V. 34. № 2. P. 206.
Sica E., De Bernardi F., Nosetti L. et al. Catecholamines and children obstructive sleep apnea: a systematic review // Sleep Med. 2021. V. 87. P. 227.
Kanova M., Kohout P. Serotonin-its synthesis and roles in the healthy and the critically Ill // Int. J. Mol. Sci. 2021. V. 22. № 9. P. 4837.
Садыкова Д.И., Нигматуллина Р.Р., Афлятумова Г.Н. Роль серотонинергической системы в развитии заболеваний сердца и сосудов у детей // Казанский медицинский журн. 2015. Т. 96. № 4. P. 665. Sadykova D.I., Nigmatullina R.R., Aflyatumova G.N. [The role of serotonergic system in cardiovascular diseases development in children] // Kazan Medical J. 2015. V. 96. № 4. P. 665.
Гостюхина А.А., Cамощина Т.А., Cайцев К.В. и др. Адаптивные реакции крыс после световых десинхронозов и физического переутомления // Бюллетень сибирской медицины. 2018. Т. 17. № 3. С. 22. Gostyukhina A.A., Zamoshchina T.A., Zaitsev K.V. et al. [Adaptive reactions of rats after light desynchronosis and physical overwork] // Bulletin of Siberian Medicine. 2018. V. 17. № 3. P. 22.
Carhart-Harris R.L., Nutt D.J. Serotonin and brain function: a tale of two receptors // J. Psychopharmacol. 2017. V. 31. № 9. P. 1091.
Brindley R.L., Bauer M.B., Walker L.A. et al. Adrenal serotonin derives from accumulation by the antidepressant-sensitive serotonin transporter // Pharmacol. Res. 2019. V. 140. P. 56.
Троицкий М.С., Токарев А.Р., Паньшина М.В. Возможности немедикаментозной и лекарственной терапии тревожных расстройств (обзор литературы) // Вестник новых медицинских технологий. 2018. Т. 25. № 1. С. 61. Troitsky M.S., Tokarev A.R., Panshina M.V. [Possibilities of non-medicine and medicinal therapies of alert disorders (literature review)] // J. New Medical Technologies. 2018. V. 25. № 1. P. 61.
Hildreth C.M., Padley J.R., Pilowsky P.M., Goodchild A.K. Impaired serotonergic regulation of heart rate may underlie reduced baroreflex sensitivity in an animal model of depression // Am. J. Physiol. Heart Circ. Physiol. 2008. V. 294. № 1. P. 474.
Chang W.H., Lee I.H., Chi M.H. et al. Prefrontal cortex modulates the correlations between brain–derived neurotrophic factor level, serotonin, and the autonomic nervous system // Sci. Rep. 2018. V. 8. № 1. P. 2558.
Lin S., Lee I.H., Tsai H. et al. The association between plasma cholesterol and the effect of tryptophan depletion on heart rate variability // Kaohsiung J. Med. Sci. 2019. V. 35. № 7. P. 440.
Settas N., Faucz F.R., Stratakis C.A. Succinate dehydrogenase (SDH) deficiency, carney triad and the epigenome // Mol. Cell. Endocrinol. 2018. V. 469. P. 107.
Moosavi B., Zhu X.L., Yang W.C., Yang G.F. Genetic, epigenetic and biochemical regulation of succinate dehydrogenase function // Biol. Chem. 2020. V. 401. № 3. P. 319.
Rasheed M., Tarjan G. Succinate dehydrogenase complex: an updated review // Arch. Pathol. Lab. Med. 2018. V. 142. № 12. P. 1564.
Farshbaf M.J., Kiani-Esfahani A. Succinate dehydrogenase: prospect for neurodegenerative diseases // Mitochondrion. 2018. V. 42. P. 77.
Гурьева Е.Н., Морено И.Г., Неудахин Е.В. и др. Вегетативный статус и состояние тканевого энергообмена у детей с метаболическим синдромом и первичной артериальной гипертензией // Вопросы практической педиатрии. 2012. Т. 7. № 2. С. 78. Gur’eva E.N., Moreno I.G., Neudakhin E.V. et al. [The vegetative status and the state of tissue energy metabolism in children with metabolic syndrome and primary arterial hypertension] // Clinical Practice in Pediatrics. 2012. V. 7. № 2. P. 78.
Хундерякова Н.В., Захарченко М.В., Захарченко А.В. и др. Исследование цитобиохимическим методом сигнального действия янтарной кислоты на митохондрии // Биологические мембраны. 2012. Т. 29. № 6. С. 442. Khunderyakova N.V., Zakharchenko M.V., Zakharchenko A.V. et al. [Signal action of succinate on mitohondria studied by cytobiochemical method] // Biologicheskie Membrany. 2012. V. 29. № 6. P. 442.
Fedotcheva N., Leont’ev D., Kondrashova M. Reciprocal effect of adrenaline and serotonin on oxidation of succinate and a-ketoglutarate in rat liver and brain homogenates // Mitochondrion. 2002. V. 1. № 6. P. 519.
Manhas N., Duong Q.V., Lee P. et al. Computationally modeling mammalian succinate dehydrogenase kinetics identifies the origins and primary determinants of ROS production // J. Biol. Chem. 2020. V. 295. № 45. P. 15262.
Титко О.В. Энергетический обмен в головном мозге при окислительном стрессе // Вестник Гродненского государственного университета имени Янки Купалы. Серия 5. Экономика. Социология. Биология. 2019. Т. 9. № 1. С. 144. Titko O.V. [Energy metabolism in the brain during oxidative stress] // Vesnik of Yanka Kupala State University of Grodno. Series 5. Economics. Sociology. Biology. 2019. V. 9. № 1. P. 144.
Anand A., Srivastava P.K. A molecular description of acid phosphatase // Appl. Biochem. Biotechnol. 2012. V. 167. № 8. P. 2174.
Цыганкова О.В., Бондарева З.Г., Рагино Ю.И. и др. Уровни маркерных лизосомальных гидролаз у мужчин различного возраста с ишемической болезнью сердца через призму уровня половых стероидов // Атеросклероз. 2015. Т. 11. № 3. С. 42. Tsygankova O.V., Bondareva Z.G., Ragino Yu.I. et al. [Levels of marker lysosomal hydrolases in men of different age with ischemic heart disease through levels of sex steroids] // Ateroskleroz. 2015. V. 11. № 3. P. 42.
Аминова Г.Г. Определение активности кислой фосфатазы в нервной ткани // Морфология. 2016. Т. 150. № 6. С. 66. Aminova G.G. Demonstration of acid phosphatase activity in nervous tissue // Neurosci. Behav Physiol. 2017. V. 47. № 8. P. 1015.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


