Цитология, 2019, T. 61, № 1, стр. 45-55
Временные характеристики передачи с помощью экзосом белка p53, меченного GFP, при совместном культивировании клеточных линий HEK293 и GFP-HEK293
Р. А. Пантина 1, Е. Ю. Варфоломеева 1, В. С. Бурдаков 1, 2, С. Б. Ланда 1, В. Ю. Байрамуков 1, Р. А. Ковалёв 1, М. В. Филатов 1, 3, *
1 Отделение молекулярной и радиационной биофизики Петербургского института ядерной физики
им. Б.П. Константинова НИЦ “Курчатовский институт”
188300 Гатчина, Россия
2 Кафедра биофизики С.-Петербургского политехнического университета Петра Великого
194064 Санкт-Петербург, Россия
3 С.-Петербургский научно-исследовательский институт фтизиопульмонологии
191036 Санкт-Петербург, Россия
* E-mail: fil_53@mail.ru
Поступила в редакцию 23.04.2018
После доработки 27.09.2018
Принята к публикации 25.09.2018
Аннотация
В работе представлена модельная система для визуализации переноса между клетками белка, меченного GFP, с помощью внеклеточных микровезикул (экзосом). Проанализированы временные параметры накопления меченного флуоресцентной меткой белка в клетках-реципиентах. В качестве донора экзосом использован клон трансфицированных плазмидой p53∆Y126-GFP клеток HEK293 (GFP-клон). В качестве реципиента была взята исходная культура клеток HEK293. Полученные результаты доказывают, что передача GFP-белка от клетки к клетке осуществляется именно через экзосомы. Показано, что при совместном культивировании клеточных линий для существенного накопления клетками-реципиентами передаваемого данным образом белка требуется достаточно продолжительное время. Временные характеристики этого процесса различны для клеток даже одной клеточной популяции.
Нормальные и опухолевые клетки различных типов способны активно обмениваться продуктами своей жизнедеятельности. В частности, они могут влиять на своих удаленных партнеров посредством продуцируемых ими экзосом, содержащих биологически активные белки, специфические мРНК и миРНК, ДНК, липиды и транскрипционные факторы (Simons, Raposo, 2009; Ogorevc et al., 2013; Chen et al., 2014; Jørgensen et al., 2015; Fujita et al., 2016; Бурдаков и др., 2017; Sh-tam et al., 2017;). Экзосомы – это секретируемые клетками-продуцентами в межклеточное пространство мембранные везикулы нанометрового размера (Филатов и др., 2010; Штам и др., 2012). Внутреннее содержимое экзосом различно и зависит от продуцирующих их клеток (Théry et al., 2002; Samsonov et al., 2016; Yentrapalli et al., 2017). Наряду с конститутивной секрецией экзосом на их количественный уровень и состав влияют определенные изменения условий культивирования (Parolini et al., 2009; Jelonek et al., 2016). Многочисленные данные свидетельствуют о возможности увеличения количества конкретного белка в экзосомах путем изменения уровня его экспрессии в клетках (Graner et al., 2009; Meckes et al., 2010; Adamczyk et al., 2011; Higginbotham et al., 2011; Бурдаков и др., 2017).
Кинетические характеристики продуцирования экзосом и их захвата клетками-реципиентами могут оказаться важным показателем, способствующим лучшему пониманию особенностей коммуникации между клетками. Однако временные параметры этих биологических процессов мало изучены и требуют более детального рассмотрения.
Целью настоящего исследования является оценка временных параметров накопления в клетках-реципиентах меченного флуоресцентной меткой белка при его транспортировке посредством экзосом от клеток-продуцентов.
В работе использован метод совместного культивирования клеточных линий HEK293 и GFP-клона (клон трансфицированных плазмидой p53∆Y126-GFP клеток HEK293, стабильно экспрессирующий белок p53 с делецией единичной аминокислоты и несущий на N-конце зеленый флуоресцентный белок), позволяющий следить в реальном времени за передачей между клетками меченного GFP мутантного белка р53 (GFP-p53) с помощью экзосом и анализировать временные параметры накопления его в клетках-реципиентах. Эта модельная система выбрана нами не случайно. В последние годы все больше данных свидетельствует о важной роли экзосом (в первую очередь их протеома) в формировании, развитии и подавлении различных типов рака (Raimondo et al., 2011; Ung et al., 2014; Webber et al., 2015; Yu et al., 2015). Экзосомы являются транспортерами белков, участвующих в онкопроцессе (в частности, важнейшего онкосупрессора р53) (Soldevilla et al., 2014; Jørgensen et al., 2015; Gopal et al., 2016; You et al., 2016; Бурдаков и др., 2017). Ранее в экспериментах in vitro было показано, что экзосомы из клеток, содержащих белок p53 дикого типа, могут подавлять рост раковых клеток линий K562 (хроническая миелогенная лейкемия) и GL-V (первичная культура глиомных клеток), в которых данный белок отсутствует, что указывает на возможность регресса опухоли экзосомами, содержащими эндогенный белок p53 дикого типа (Бурдаков и др., 2017).
Представленные нами результаты наглядно демонстрируют возможность отслеживать передачу белка р53 как с помощью предварительно выделенных экзосом, продуцируемых клетками GFP-клона, так и при совместном культивировании клеток. Проведенные исследования показали, что в используемой модельной системе временные интервалы, необходимые для заметного накопления передаваемого посредством экзосом белка в клетках-реципиентах, могут быть весьма продолжительными, а кинетические характеристики этого процесса различны даже для клеток одной клеточной популяции.
МАТЕРИАЛ И МЕТОДИКА
Клетки и культивирование. Работа проведена на клеточной линии HEK293 (эмбриональные клетки почки человека). Клетки выращивали при 37°С в среде ДМЕМ/F12 (Биолот, Россия), содержащей 10% сыворотки эмбрионов коров (Биолот, Россия). Трансфекцию клеток HEK293, первоначально имеющих низкий уровень экспрессии белка p53 дикого типа, проводили плазмидой p53∆Y126-GFP по стандартной методике с использованием набора Effectene Transfection Reagent (Qiagen, Германия). Плазмида кодирует мутантный белок р53 с делецией тирозина в 126-м положении пептидной цепи белка, несущий на N-конце зеленый флуоресцентный белок (GFP). Мутантная форма белка р53 обладает некоторыми функциями белка p53 дикого типа. В частности, белок p53ΔY126 может работать как транскрипционный фактор, активируя индукцию белка p21, и вызывать клеточную гибель, однако по сравнению с диким типом белка р53 его активность снижена (Бурдаков и др., 2017; Makarov et al., 2017). Через 2 сут клетки высевали во флаконы Карреля и добавляли яд G418 (Invitrogen, США) в концентрации 400 мкг/мл. В присутствии G418 клетки культивировали 10 сут, меняя питательную среду каждые 3 сут. Далее клетки пересевали в 96-луночные планшеты для клонирования, т.е. для получения клеточных линий, являющихся потомками одной клетки.
Получено несколько линий, которые были названы GFP-HEK293. Наиболее яркий по уровню флуоресценции меченного GFP белка клон (далее в тексте GFP-клон) с высоким уровнем экспрессии белка GFP-p53ΔY126 был использован в дальнейшей работе. Ранее показано, что в клетках GFP-клона детектируются как белок GFP-p53ΔY126, так и белок p53 дикого типа, в то время как в секретируемых этими клетками экзосомах обнаружен только мутантный белок GFP-p53ΔY126 (Бурдаков и др., 2017).
При совместном культивировании исходной линии клеток HEK293 и GFP-клона на начальном этапе клетки были посеяны в соотношении 9 : 1. В дальнейшем пересев смеси клеток осуществлялся по мере образования клетками монослоя. Клетки обрабатывали раствором Версен/трипсин 1 : 1 (Биолот, Россия) в течение 10 мин, переносили в центрифужную пробирку, осаждали 5 мин при 1000 об./мин, ресуспендировали в питательной среде и 1/20 часть суспензии клеток переносили в свежий флакон. Анализ полученных клеточных линий (клонов) и отбор линий с высоким содержанием GFP проводили на цитометре Cell LabQuanta (Beckman Coulter (США)). Для прижизненного наблюдения клетки сеяли в чашки диаметром 35 мм с оптическим дном (MatTek corporation, США) и визуализировали на конфокальном микроскопе Leica SP5 (Leica, Германия).
Выделение экзосом. Экзосомы выделяли из культуральной среды, в которой росли клетки GFP-клона, по стандартной методике (Théry et al., 2006). Для культивирования клеток с экзосомами осадок, полученный после центрифугирования, ресуспендировали в 1.5 мл питательной среды, содержащей 10% сыворотки. Суспензию экзосом переносили в чашки с оптическим дном к растущим клеткам. Для анализа экзосом конечный осадок ресуспендировали в 0.5 мл фосфатно-солевого буферного раствора (PBS), содержащего для предотвращения агрегации частиц 5 мМ EDTA.
Анализ экзосом с помощью атомно-силовой микроскопии. Для прямой визуализации экзосом использовали технику атомно-силовой микроскопии. Анализ образцов проводили с помощью сканирующего зондового микроскопа серии Solver Bio (NT-MDT, Россия). Для измерений исходный раствор экзосом разбавляли в 50 раз в PBS, содержащем 5 мМ EDTA, и 2 мкл раствора наносили на свежесколотую слюду. Через 3 мин инкубации каплю сдували потоком воздуха, слюду промывали потоком дистиллированной воды, после чего высушивали при комнатной температуре. Для сканирования поверхности с целью выявления ее неоднородностей использовали кантилеверы NSG03 (NT-MDT) с константой жесткости 1.74 Н/м, радиус острия зонда составлял 10 нм, скорость сканирования – 1 Гц. Полученные CЗM-изображения обрабатывали с помощью прилагаемого программного обеспечения Image Analysis Nova.
Регистрация экзосом с помощью лазерной корреляционной спектроскопии (ЛКС). Регистрацию экзосом в культуральной среде проводили методом динамического светорассеяния (Лебедев и др., 1987). Измерения проводили на лазерном корреляционном спектрометре ПЛСС производства ООО ИНТОКС МЕД (Регистрационное удостоверение на медицинское изделие МЗ РФ № РЗН 2014/1650 от 09.06.2014). Прибор разработан и создан в Отделении молекулярной и радиационной биофизики ФГБУ ПИЯФ им. Б. П. Константинова НИЦ “Курчатовский институт” и утвержден комитетом по новой медицинской технике МЗ РФ для определения размеров микрочастиц в биологических жидкостях (Сертификат RU. C. 39.003. А № 5381).
Расчет размеров частиц в исследуемых образцах проводили согласно программным продуктам, описанным ранее (Ланда и др., 2008). Результат измерений представляется в виде гистограммы распределения частиц по размерам (гистограмма субфракционного состава), в которой горизонталь – это шкала размеров в нм, а по вертикали отложен вклад в общее рассеяние образца частиц данного размера в %. При этом суммарное рассеяние всех частиц образца принимается за 100%. Для каждого образца измерения проводили не менее 10 раз и данные, полученные в результате регуляризации, усредняли. Процедура позволяет получить среднее и дисперсию размера, а также вклада в рассеяние для каждой фракции частиц, имеющихся в измеряемом образце.
Иммуноаффинная хроматография. Для удаления экзосом из культуральной среды, в которой росли клетки GFP-клона, использовали антитела, связывающие белковые маркеры, присутствующие на поверхности экзосом (главный комплекс гистосовместимости первого типа HLA-ABC и CD63). Процедуру проводили в соответствии с описанной ранее методикой (Филатов и др., 2010). Моноклональные антитела к HLA-ABC или CD63 (Beckman Coulter, США) добавляли к исследуемой среде в разведении 1 : 100. Суспензию белка А из Staphylococcus aureus, пришитого к сефарозному носителю ковалентной связью (производство Института Пастера, Санкт-Петербург, Россия), добавляли в разведении 1 : 20.
РЕЗУЛЬТАТЫ
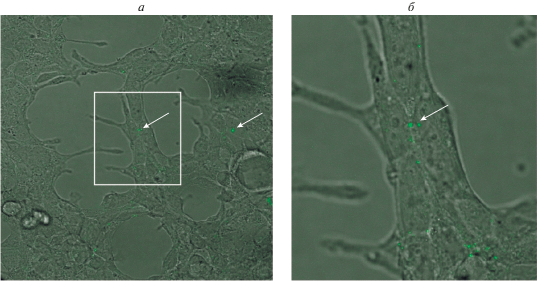
После трансфекции клеток HEK293 плазмидой p53∆Y126-GFP и селекции их на яде G418 были выделены клоны, в клетках которых произошло встраивание плазмидной ДНК в геномную ДНК клеток. При культивировании полученных клонов в клетках экспрессируется белок р53, несущий на N-конце GFP. На рис. 1 представлены исходная линия клеток HEK293 (рис. 1а) и полученный при трансфекции плазмидой устойчивый клон (GFP-клон) (рис. 1б). Меченный GFP белок р53 в клетках GFP-клона локализуется как в ядре, так и в цитоплазме. Кроме того, часть синтезированного белка накапливается в цитоплазме клеток в отдельных образованиях (внутриклеточных везикулах) (рис. 1б). Размеры везикул и их количество в клетках варьируют. Культуральную среду до и после выращивания в ней клеток изучали методом динамического светорассеяния (ДСР) (рис. 2). После культивирования клеток в среде накапливаются частицы двух типов с гидродинамическим радиусом порядка 20 и 100 нм (рис. 2б). Размеры этих частиц соответствуют размерам экзосом (Филатов и др., 2010).
Рис. 1.
Прижизненная визуализация клеток HEK293 (а) и их GFP-клона (б). Конфлокальная микроскопия. Посев на чашки с оптическим дном. Стрелки (б) указывают на скопления белка, меченного GFP, в клетках GFP-клона. Увел. об. 63×.
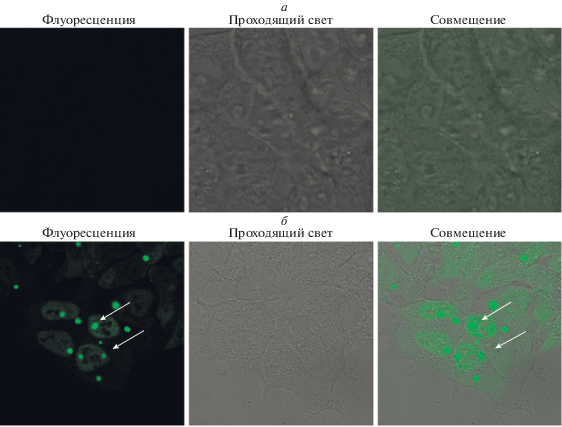
Рис. 2.
Демонстрация появления новых фракций частиц в культуральной среде после культивирования в ней клеток GFP-клона с помощью метода динамического светорассеяния. Распределение субфракций по размерам частиц в исходной культуральной среде (контроль, (а)) и в среде через 6 сут культивирования в ней клеток GFP-клона (б). Здесь и на рис. 3: по горизонтали – гидродинамический диаметр частиц (Dh), нм; по вертикали – в клад в рассеяние, %. Черные столбики – экзосомы.
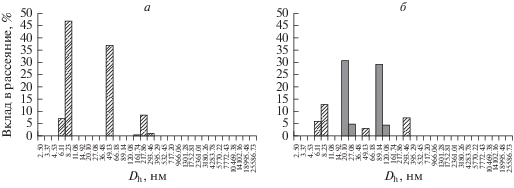
Метод динамического светорассеяния не дает информации о природе частиц исследуемого образца и их концентрации в растворе, а позволяет судить только о распределении частиц по размерам и доле каждого класса частиц (т.е. частиц с определенным гидродинамическим радиусом) в суммарном светорассеянии анализируемого образца жидкости (Landa et al., 2018). Пики частиц размером 5–8, 50 и 200 нм на гистограмме субфракционного состава образца культуральной среды, исследуемого методом ДСР (рис. 2а), характеризуют компоненты сыворотки, так как они отсутствуют на гистограммах при исследовании бессывороточных сред. По-видимому, пик в диапазоне 5–8 нм дают глобулярные белки, а пик около 200 нм – агломераты криоглобулинов, образующиеся при хранении сыворотки в холодильнике. Вклад конкретного типа частиц в суммарное светорассеяние нелинейно зависит от размера этих частиц. Поэтому если принять относительную концентрацию частиц размером 5 нм за 100%, можно утверждать, что относительная концентрация частиц размером около 50 нм будет менее 1%, а частиц размером около 200 нм вообще близка к 0 (0.006%) (рис. 2а). Очевидно, что эти показатели относительной концентрации частиц в культуральной среде крайне низки и для наших исследований методом ДСР несущественны.
Для подтверждения предположения о том, что частицы, появляющиеся в процессе культивирования клеток и регистрируемые с помощью метода ДСР на гистограмме субфракционного состава анализируемого образца (рис. 2б), действительно являются экзосомами, мы использовали иммуноаффинную преципитацию со специфическими для экзосом антителами.
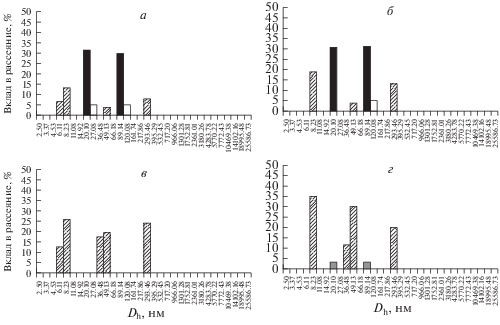
Мы продемонстрировали, что появляющиеся в культуральной среде частицы несут молекулярные маркеры, соответствующие поверхностным молекулам плазматической мембраны клеток (главный комплекс гистосовместимости первого типа (HLA-ABC)), и характерный для экзосом маркер СD63. Моноклональные антитела к HLA-ABC и СD63 добавляли к исследуемой среде. Затем с помощью белка А из Staphylococcus aureus, пришитому к сефарозному носителю ковалентной связью, удаляли добавленные антитела и связавшиеся с ними антигены. Рис. 3 демонстрирует, что такая процедура практически полностью удаляет из среды рассматриваемые частицы. Этот эксперимент доказывает, что частицы действительно являются экзосомами, так как несут и антигенные детерминанты, свойственные главному комплексу HLA-ABC, и характерный для экзосом маркер СD63.
Рис. 3.
Демонстрация появления экзосом в культуральной среде после культивирования в ней клеток GFP-клона с помощью метода динамического светорассеяния. Распределение субфракций по размерам частиц: в исходной культуральной среде через 6 сут культивирования в ней клеток GFP-клона (а); после добавления к этой среде белка А, иммобилизованного на агарозных микросферах (б); после инкубации этой культуральной среды с моноклональными антителами к HLA-ABC и белком А, иммобилизованным на агарозных микросферах (в); после инкубации этой культуральной среды с моноклональными антителами к CD63 и белком А, иммобилизованным на агарозных микросферах (г).
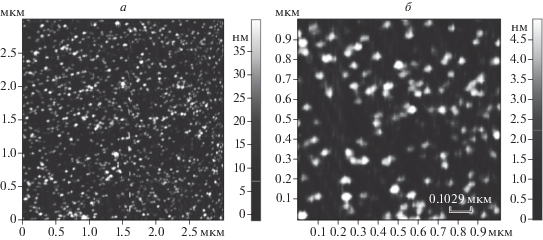
После получения клона с хорошо идентифицируемым зеленым белком мы выделили экзосомы из культуральной среды, в которой росли клетки GFP-клона, и исследовали их с помощью атомной силовой микроскопии (рис. 4). Размеры частиц, полученные при сканировании образцов, также соответствуют размерам экзосом.
Рис. 4.
Изображения экзосом, нанесенных на слюду, полученные с помощью атомно-силовой микроскопии. Поле сканирования: 3 × 3 мкм (а) и 1 × 1 мкм (б). Шкалы показывают соотношение высоты рельефа анализируемого образца (нм) с цветом в точке сканирования.
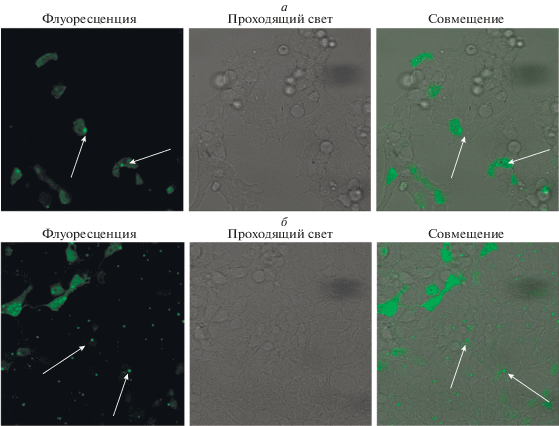
Для визуализации переноса белка, меченного GFP, полученные экзосомы добавляли в среду к растущим клеткам HEK293 (рис. 5). Через 4 ч можно было наблюдать появление небольшого количества клеток, несущих зеленый флуоресцентный белок (данные не приведены). Через 1 сут культивирования клеток в среде с экзосомами количество клеток, содержащих в цитоплазме GFP, незначительно возросло (рис. 5). Однако в большей части клеток не наблюдали наличия такого белка. Вероятно, этого времени также недостаточно, чтобы абсолютное большинство клеток захватило сколько-нибудь заметное количество белка, передаваемого экзосомами.
Рис. 5.
Визуализация GFP-меченного белка в клетках HEK293 через 24 ч культивирования в среде, содержащей экзосомы, выделенные из культуральной среды GFP-клона тех же клеток. Конфокальная микроскопия. б – Увеличение (zoom 5) выделенной зоны (а). Стрелки – скопления GFP-белка в цитоплазме клеток HEK293. Посев на чашки с оптическим дном. Увел. об. 63×.
Для более детального изучения временных параметров процесса передачи белка с помощью экзосом мы использовали метод совместного культивирования двух типов клеток – GFP-клона в качестве продуцента белка, меченного GFP, и клеток линии HEK293 в качестве клеток-реципиентов (в соотношении 1 : 9). Эти две клеточные линии (HEK 293 и GFP-клон) сокультивировали в течение длительного времени, при этом смесь клеток периодически исследовали на проточном цитофлуориметре (рис. 6). На рис. 6, а представлена гистограмма распределения смеси клеток по каналам (интенсивности) флуоресценции. Крайний левый пик на гистограмме соответствует клеткам, не содержащим белок, меченный GFP, т.е. исходной культуре клеток HEK293, крайний правый – клеткам с наличием такого белка, т.е. клеткам GFP-клона. Отметим, что наблюдается практически полное отсутствие клеток в промежутке между двумя пиками (рис. 6, а). Однако со временем наблюдаемая картина радикальным образом изменяется. Постепенно нарастает количество клеток, которые регистрируются в изначально пустой области гистограммы (рис. 6, б–г). Этот факт свидетельствует о появлении популяции клеток, содержащих различное количество белка с GFP-меткой, т.е. клетки-реципиенты HEK293 постепенно накапливают такой белок. Исследования с помощью конфокального микроскопа подтвердили цитометрические результаты (рис. 7).
Рис. 6.
Гистограммы распределения клеток по интенсивности флуоресценции (ИФ) в смеси клеток HEK293 и их GFP-клона в соотношении 9 : 1. Исходная смесь (а), через 1 нед. (б), 3 (в) и 4.5 (г) мес. совместного культивирования. Проточная цитометрия.
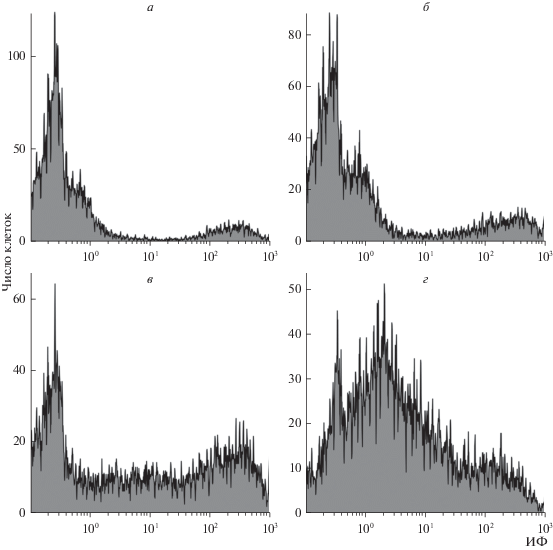
Рис. 7.
Прижизненная визуализация GFP-белка в клетках HEK293 после совместного культивирования клеток HEK293 и их GFP-клона (в соотношении 9 : 1) через 24 ч (а) и 4.5 мес. (б). Конфокальная микроскопия. Посев на чашки с оптическим дном. Увел. об. 63×. Стрелки – скопления GFP-белка в цитоплазме клеток.
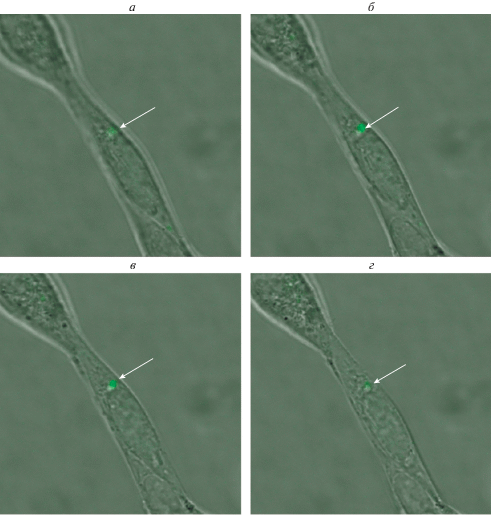
Через 4.5 мес. культивирования смеси клеток в цитоплазме многих из них наблюдаются включения разного размера, содержащие зеленый флуоресцентный белок (рис. 5, б). Внутриклеточное расположение включений показано при сканировании клетки с помощью конфокального микроскопа по оси Z (рис. 8).
Рис. 8.
Локализация скопления GFP-белка (стрелка) внутри клетки HEK293 после культивирования в среде, содержащей экзосомы. Последовательные сканы клетки (а–г) с помощью конфокального микроскопа. Шаг сканирования по оси Z 1.5 мкм. Конфокальная микроскопия, увел. об. 63×, zoom 5.
По нашим наблюдениям, присутствие большого количества белка с GFP-меткой в клетках GFP-клона существенно не сказывается на их жизнедеятельности. Во всяком случае, скорость образования монослоя во флаконах как для культуры клеток HEK293, так и клеток GFP-клона одинакова. Совместное культивирование этих клеточных линий не приводит к подавлению роста ни одной из культур, что подтверждается цитометрическими данными (рис. 4). Величина пика, соответствующего клеткам с постоянно экспрессирующимся белком, меченным GFP, на протяжении длительного времени сокультивирования линий не меняется, составляя порядка 10% от общего количества исследуемых клеток.
Анализируя результаты, полученные с помощью конфокального микроскопа, и цитометрические данные, можно с уверенностью сказать, что в предложенной системе флуоресцентно меченый белок выбрасывается с помощью экзосом в межклеточное пространство клетками GFP-клона, откуда затем постепенно захватывается клетками, его не продуцирующими. Возможно, что далеко не все клетки-реципиенты в течение первых нескольких суток захватывают экзосомы, несущие белок с GFP-меткой. В то же время в клетках, содержащих меченый белок, в цитоплазме визуализируется различное количество визикул с GFP (рис. 5). Захват клетками экзосом происходит постепенно. Сокультивирование клеток HEK293 и клеток GFP-клона в соотношении 9 : 1 показывает, что передача GFP-меченного белка посредством экзосом клеткам-реципиентам в смеси клеток может быть длительным процессом, до нескольких месяцев. За это время практически все клетки-реципиенты накапливают GFP-белок в достаточном для визуализации количестве.
ОБСУЖДЕНИЕ
Факт, что практически все типы клеток обмениваются между собой различными сигнальными молекулами с помощью внеклеточных микровезикул, в том числе и экзосом, в настоящее время является общепризнанным. Белковый состав экзосом интенсивно исследуется методами иммуноблотинга и масс-спектрометрии (Simpson et al., 2009; Palazzolo et al., 2012). Трансфекция культур клеток системой, несущей вектор, кодирующий CD63-GFP (плазмидой, лентивирусом), приводит к секреции клетками экзосом, меченных зеленым флуоресцентным белком (Koumangoye et al., 2011; Suetsugu et al., 2013). Нагрузка экзосом флуоресцентно меченой РНК позволила визуализировать процесс передачи экзосом и их содержимого в клетки-реципиенты (Shtam et al., 2013). Однако временные параметры транспортировки с помощью экзосом изучаемых белков, так же как и эффективность захвата экзосом клетками, могут быть существенными факторами межклеточной коммуникации. Эти параметры практически не рассматриваются в литературе.
Используемая нами система сокультивирования в течение длительного времени исходной культуры клеток HEK293 и GFP-клона (9 : 1) позволила прижизненно наблюдать за передачей клеткам-рецепиентам флуоресцентно меченого белка, экспрессирующегося непосредственно в клетках-продуцентах, и оценить кинетику этого процесса. Возможно, похожие временные характеристики имеют место в условиях и in vitro, и in vivo при обмене клетками различными сигнальными молекулами с помощью экзосом. Однако это предположение требует дальнейших исследований.
Суперэкспрессия белка, меченного GFP, клетками GFP-клона, приводит к накоплению его не только в ядре, но и в цитоплазме клеток в виде отдельных гранул (рис. 1). Меченый белок выбрасывается в межклеточное пространство посредством экзосом. После захвата клетками-реципиентами экзосом белок накапливается в них также в виде гранул (рис. 7). Именно этот факт и позволил визуализировать передачу и накопление белка с GFP-меткой при совместном культивировании исследуемых клеточных линий.
Оценить временные интервалы передачи белка посредством экзосом возможно как при совместном культивировании клеток-продуцентов с клетками-реципиентами, так и с помощью выделенных ранее экзосом (рис. 5–7). Мы показали, что в течение первых суток культивирования клеток HEK293 в питательной среде в присутствии экзосом, выделенных из культуральной среды клеток GFP-клона, лишь в малой части клеток определяется присутствие GFP-меченного белка (рис. 5). Таким образом, и в этом случае для существенного накопления клетками-реципиентами передаваемого данным образом белка необходимо достаточно продолжительное время. При этом наблюдается различная концентрация GFP-белка во внутриклеточных везикулах клеток-реципиентов, что говорит о различной эффективности захвата экзосом клетками одной клеточной популяции.
Обобщая полученные данные, можно предположить, что далеко не все исследуемые клетки в конкретный момент времени способны эффективно захватывать экзосомы. Вероятно, обмен экзосомами, а следовательно, и информационными молекулами или сигналами, передаваемыми с их помощью – достаточно продолжительный процесс, что может существенно осложнить анализ этого биологического явления в различных клеточных популяциях. Этот факт необходимо учитывать при рассмотрении межклеточных коммуникаций с помощью микровезикул, в том числе экзосом, в системах как in vitro, так и in vivo.
Список литературы
Бурдаков В.С., Ковалев Р.А., Пантина Р.А., Варфоломеева Е.Ю., Макаров Е.М., Филатов М.В. 2017. Экзосомы осуществляют передачу белка p53 между клетками и могут подавлять рост p53-отрицательных клеток. Цитология. 59 (9) : 588–594. (Burdakov V.S., Kovalev R.A., Pan-tina R.A., Varfolomeeva E.Yu., Makarov E.M., Filatov M.V. 2017. Exosomes transfer p53 between cells and can suppress growth and proliferation of p53-dR. Tsitologiya. 59(9) : 588–594.)
Ланда С.Б., Филатов М.В., Арутюнян А.В., Варфоломеева Е.Ю. 2008. Исследование образования мегамолекулярных комплексов в плазме крови методом лазерной корреляционной спектроскопии. Клин. лаб. диагностика. 4 : 37-41. (Landa S.B., Filatov M.V., Arutiunian A.V., Varfolomeeva E.Y. 2008. Study of plasma megamolecular complexation by laser correlation spectroscopy. Klin. Lab. Diagn. 4 : 37–41.)
Лебедев А.Д., Левчук Ю.H., Ломакин А.В., Носкин В.A. 1987. Лазерная корреляционная спектроскопия в биологии. Киев: Наукова Думка. 256 с. (Lebedev A.D., Levchuk Yu.N., Lomakin A.V., Noskin V.A. 1987. Laser correlation spectroscopy in biology. Kiev: Sci. Thought. 256 p.)
Филатов М.В., Ланда C.Б., Пантина Р.А., Гармай Ю.П. 2010. Исследование экзосом, секретируемых различными нормальными и злокачественно трансформированными клетками in vitro и in vivo. Клиническая лабораторная диагностика. 12 : 35–43. (Filatov M.V., Landa S.B., Pantina R.A., Garmai Iu.P. 2010. Investigation of exosomes secreted by different normal and malignant cells in vitro and in vivo. Klin. Lab. Diagn. 12 : 35–43.)
Штам Т.А., Нарыжный С.Н., Ланда С.Б., Бурдаков В.С., Артамонова Т.О., Филатов М.В. 2012. Получение и анализ экзосом, секретируемых злокачественно трансформированными клетками человека в системах in vitro. Цитология. 54(5) : 430–438. (Shtam T.A., Naryzhny S.N., Landa S.B., Burdakov V.S., Artamonova T.O., Filatov M.V. 2012. Purification and in vitro analysis of exosomes secreted by malignantly tansformed human cells. Tsitologiya. 54(5) : 430–438.)
Adamczyk K.A., Klein-Scory S., Tehrani M.M., Warnken U., Schmiegel W., Schnölzer M., Schwarte-Waldhoff I. 2011. Characterization of soluble and exosomal forms of the EGFR released from pancreatic cancer cells. Life Sci. 89 : 304–312.
Chen W.X., Cai Y.Q., Lv M.M., Chen L., Zhong S.L., Ma T.F., Zhao J.H., Tang J.H. 2014. Exosomes from docetaxel-resistant breast cells alter chemosensitivity by delivering microRNAs. Tumour Biol. 35 : 9649–9659.
Fujita Y., Yoshioka Y., Ochiya T. 2016. Extracellular vesicle transfer of cancer pathogenic components. Cancer Sci. 107 : 385–90.
Gopal S.K., Greening D.W., Hanssen E.G., Zhu H.J., Simpson R.J., Mathias R.A. 2016. Oncogenic epithelial cell-derived exosomes containing Rac1 and PAK2 induce angiogenesis in recipient endothelial cells. Oncotarget. 7 : 19709–19722.
Graner M.W., Alzate O., Dechkovskaia A.M., Keene J.D., Sampson J.H., Mitchell D.A., Bigner D.D. 2009. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 23 : 1541–1557.
Higginbotham J.N., Demory Beckler M., Gephart J.D., Franklin J.L., Bogatcheva G., Kremers G.J., Piston D.W., Ayers G.D., McConnell R.E., Tyska M.J., Coffey R.J. 2011. Amphiregulin exosomes increase cancer cell invasion. Curr. Biol. 21 : 779–786.
Jelonek K, Widlak P, Pietrowska M. 2016. Influence of ionizing radiation on exosome composition, secretion and intercellular communication. Protein Pept. Lett. 23 : 656–663.
Jørgensen M.M., Rikke Bæk R., Varming K. 2015. Potentials and capabilities of the extracellular vesicle (EV) array. J. Extracell. Vesicles. 4 : 26048. doi 10.3402/jev.v4.26048
Koumangoye R.B., Sakwe A.M., Goodwin J.S., Patel T., Ochieng J. 2011. Detachment of breast tumor cells induces rapid secretion of exosomes which subsequently mediate cellular adhesion and spreading (cGFP-CD63). PLoS One. 6 (9) : e24234. doi 10.1371/journal.pone.0024234
Landa S.B., Korabliov P.V., Semenova E.V., Filatov M.V. 2018. Peculiarities of the formation and subsequent removal of the circulating immune complexes from the bloodstream during the process of digestion. F1000 Research. 7 : 618. doi 10.12688/f1000research.14406.1
Makarov E.M., Shtam T.A., Kovalev R.A., Pantina R.A., Varfolomeeva E.Y., Filatov M.V. 2017. The rare nonsense mutation in p53 triggers alternative splicing to produce a protein capable of inducing apoptosis. PLoS One. 12(9) : e0185126. doi 10.1371/journal.pone.0185126
Meckes D.G., Shair K.H., Marquitz A.R., Kung C.P., Edwards R.H., Raab-Traub N. 2010. Human tumor virus utilizes exosomes for intercellular communication. Proc. Nat. Acad. Sci. USA. 107 : 20 370–20 375.
Ogorevc E., Kralj-Iglic V., Veranic P. 2013. The role of extracellular vesicles in phenotypic cancer transformation. Radiol. Oncol. 47 : 197–205.
Palazzolo G., Albanese N.N., DI Cara G., Gygax D., Vittorelli M.L., Pucci-Minafra I. 2012. Proteomic analysis of exosome-like vesicles derived from breast cancer cells. Anticancer Res. 32 : 847–860.
Parolini I., Federici C., Raggi C., Lugini L., Palleschi S., De Milito A., Coscia C., Iessi E., Logozzi M., Molinari A., Colone M., Tatti M., Sargiacomo M., Fais S. 2009. Microenvironmental pH is a key factor for exosome traffic in tumor cells. J. Biol. Chem. 284 : 34 211-34 222.
Raimondo F., Morosi L., Chinello C., Magni F., Pitto M. 2011. Advances in membranous vesicle and exosome proteomics improving biological understanding and biomarker discovery. Proteomics. 11 : 709–720.
Samsonov R., Burdakov V., Shtam T., Radzhabova Z., Vasilyev D., Tsyrlina E., Titov S., Ivanov M., Berstein L., Filatov M., Kolesnikov N., Gil-Henn H., Malek A. 2016. Plasma exosomal miR-21 and miR-181 a differentiates follicular from papillary thyroid cancer. Tumour Biol. 37 : 12 011–12 021.
Shtam T.A., Kovalev R.A., Varfolomeeva E.Y., Makarov E.M., Kil Y.V., Filatov M.V. 2013. Exosomes are natural carriers of exogenous siRNA to human cells in vitro. Cell Commun. Signal. 11: 88. doi 10.1186/1478-811X-11-88
Shtam T.A., Samsonov R., Kamyshinsky R., Pantina R.A., Verlov N.A., Vasiliev A., Konevega A.L., Malek A.V. 2017. Exosomes: some approaches to cancer diagnosis and therapy. AIP Conference Proceedings 1882. 020066. doi org/10.1063/1.5001645.10.1063/1.5001645
Simons M., Raposo G. 2009. Exosomes – vesicular carriers for intercellular communication. Curr. Opin. Cell Biol. 21 : 575–581.
Simpson R.J., Lim J.W., Moritz R.L., Mathivanan S. 2009. Exosomes: proteomic insights and diagnostic potential. Expert Rev. Proteomics. 6 : 267–283.
Soldevilla B., Rodriguez M., San Millan C., Garcia V., Fernandez-Perianez R., Gil-Calderon B., Martin P., Garcia-Grande A., Silva J., Bonilla F., Dominguez G. 2014. Tumor-derived exosomes are enriched in DeltaNp73, which promotes oncogenic potential in acceptor cells and correlates with patient survival. Hum. Mol. Genet. 3 : 467–478.
Suetsugu A., Honma K., Saji Sh., Moriwaki H., Ochiya T., Robert M., Hoffman R.M. 2013. Imaging exosome transfer from breast cancer cells to stroma at metastatic sites in orthotopic nude-mouse models. Adv. Drug Deliv. Rev. 65 : 383–390.
Théry C., Amigorena S., Raposo G., Clayton A. 2006. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr. Protoc. Cell Biol. 3 : Unit 3.22.
Théry C., Zitvogel L., Amigorena S. 2002. Exosomes: composition, biogenesis and function. Nat. Rev. Immunol. 2 : 569–579.
Ung T.H., Madsen H.J., Hellwinkel J.E., Lencioni A.M., Graner M.W. 2014. Exosome proteomics reveals transcriptional regulator proteins with potential to mediate downstream pathways. Cancer Sci. 105 : 1384–1392.
Webber J., Yeung V., Clayton A. 2015. Extracellular vesicles as modulators of the cancer microenvironment. Semin. Cell Develop. Biol. 40 : 27–34.
Yentrapalli R., Merl-Pham J., Azimzadeh O., Mutschelknaus L., Peters C., Hauck S.M., Atkinson M.J., Tapio S., Moertl S. 2017. Quantitative changes in the protein and miRNA cargo of plasma exosome-like vesicles after exposure to ionizing radiation. Int. J. Radiat. Biol. 93 : 569–580.
You B., Cao X., Shao X., Ni H., Shi S., Shan Y., Gu Z., You Y. 2016. Clinical and biological significance of HAX-1 overexpression in nasopharyngeal carcinoma. Oncotarget. 7 : 12505–12524.
Yu S., Cao H., Shen B., Feng J. 2015. Tumor-derived exosomes in cancer progression and treatment failure. Oncotarget. 6 : 37 151–37 168.
Дополнительные материалы отсутствуют.


