Цитология, 2019, T. 61, № 1, стр. 35-44
Мультипотентные мезенхимные стволовые клетки, выделенные из костного мозга овцы: получение и криоконсервирование
Д. Г. Коровина 1, *, И. М. Волкова 1, С. А. Васильева 1, М. И. Гулюкин 1, И. П. Савченкова 1
1 Федеральный научный центр – Всероссийский научно-исследовательский институт
экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко РАН
109428 Москва, Россия
* E-mail: darya.korovina@gmail.com
Поступила в редакцию 13.07.2018
После доработки 26.09.2018
Принята к публикации 20.09.2018
Аннотация
Овцы часто используются в качестве доклинических крупных животных моделей для тестирования терапевтического потенциала мультипотентных мезенхимных стволовых клеток (ММСК). В результате оптимизации метода выделения в градиент плотности фиколла из костного мозга (КМ) овец получена культура клеток с характеристиками, подобными ММСК. Продемонстрировано преимущество использования протоколов со специализированной пробиркой SepMate-15 по сравнению с выделением по классическому методу. Полученные клетки обладали сильной адгезией к культуральному пластику, фибробластоподобной морфологией, способностью при индукции формировать in vitro клетки жировой, костной и хрящевой тканей. При адипогенной дифференцировке на 14-е сут формировались адипоциты с липидными везикулами, которые выявлялись окраской специфическим красителем жировым красным O. В остеогенной среде на 14-е сут появлялась специфическая активность эндогенной щелочной фосфатазы. Окрашивание ММСК методом серебрения Косса выявило наличие нерастворимых солей кальция в межклеточном пространстве. Хондрогенная дифференцировка обнаруживалась на 14-е сут и сопровождалась появлением многослойных скоплений с большим количеством матрикса, в которых визуализировались изогенные группы, подобные лакунам гиалинового хряща. На 21-е сут клетки формировали плотные микрогранулы, в которых выявлся гликозаминогликановый матрикс. Сравнительный анализ жизнеспособности клеток на нулевом пассаже после заморозки в трех криозащитных средах свидетельствует о хорошем состоянии размороженных клеток (более 70%). Полученная культура ММСК КМ овцы на 2–3-м пассажах депонирована в специализированную Коллекцию перевиваемых соматических клеточных культур сельскохозяйственных и промысловых животных при ВИЭВ им. К.И. Скрябина и Я.Р. Коваленко РАН и может использоваться в доклинических исследованиях.
Из-за низкой стоимости овцы часто используются в качестве крупных животных моделей, для доклинического тестирования терапевтического потенциала мультипотентных мезенхимных стволовых клеток (ММСК) или тканеинженерных конструкций на их основе для лечения дегенеративных заболеваний суставов (Zscharnack et al., 2010; Sanjurjo-Rodriguez et al., 2017). Описаны эксперименты по возможному замещению имплантатами костных дефектов у баранов (Свиридова и др., 2010). При этом отмечено существенное сокращение сроков регенерации костной ткани при использовании аутогенных ММСК в конструкциях на основе натуральных кораллов (Сергеева и др., 2009).
Первая опубликованная работа по выделению ММСК из КМ овец показала, что данные клетки имели фибробластоподобную морфологию и могли быть индуцированы в адипогенном и остеогенном направлениях in vitro (Jessop et al., 1994). С тех пор сообщалось о получении ММСК овец из пуповинной крови, жировой ткани, периферической крови, печени, амниотической жидкости, пульпы зуба, синовиальной мембраны, дермиса, волосяных фолликул и эндометрия (Music et al., 2018).
ММСК, выделенные из костного мозга (КМ) овцы, так же как и других видов животных, являются негемопоэтическими клетками, которые характеризуются in vitro адгезией к пластику, фибробластоподобной морфологией, способностью при индукции формировать клетки жировой, костной и хрящевой тканей (McCarty et al., 2009; Кульнева и др., 2010а, 2010б; Desantis et al., 2018), мигрировать in vivo в пораженные органы (Behr et al., 2007; Lacitignola et al., 2014). В организме ММСК млекопитающих продуцируют ростовые факторы и цитокины для поддержания гемопоэза, а при системном введении в кровь обладают выраженными иммуносупрессивными свойствами (Caplan, Correa, 2011; Carrade, Borjesson, 2013; Eaker et al., 2013).
Несмотря на разнообразие исходных тканей, все методы выделения ММСК из них могут быть разделены на три основные группы – селекция по размеру (массе), адгезия к пластику и отбор по CD-маркеру. Первым и по сей день наиболее часто используемым методом получения ММСК из КМ является выделение в градиент плотности фиколла. Раствор помещается на дно конической пробирки, а затем сверху наслаивается разбавленный аспират КМ. В результате центрифугирования образуются слои, один из которых представляет собой ММСК. После отделения клеточной фракции, предположительно представленной мононуклеарными клетками крови и ММСК, используют селективную адгезию к пластику. На протяжении многих лет методы разделения, основанные на использовании градиента плотности фиколла, претерпевали изменения, что привело к созданию специализированных растворов, пробирок или колонок для выделения клеток. Одним из таких приспособлений является пробирка Sep-Mate-15 (StemCell Technologies, Канада), содержащая пористую вставку, которая образует физический барьер между раствором и образцом. Она позволяет быстро нанести образец, избежать необходимости наслаивать его непосредственно на фиколл и уменьшает длительность стадии осаждения. Полученный верхний слой, содержащий плазму и мононуклеарные клетки, можно вылить в новую пробирку одним движением (Eaker et al., 2013; Oliver-Vila et al., 2018).
Следует отметить, что исследования влияния условий выделения и культивирования на клеточные характеристики в основном выполняются с ММСК человека. Изучение особенностей поведения ММСК человека в культуре показало влияние условий культивирования на их основные характеристики (Савченкова, Савченкова, 2014; Савченкова и др., 2017). Имеются схожие данные для ММСК овцы (Adamzyk et al., 2013; Colosimo et al., 2013). Не отмечено статистически значимой корреляции между потенциалом пролиферации этих клеток in vitro и возрастом или породой овец-доноров (Rhodes et al., 2004). Считается, что длительное культивирование этих клеток приводит к их старению и потере функциональных свойств (Uder et al., 2018). Таким образом, использование ММСК в клеточной биотехнологии или ветеринарной медицине требует изучения свойств культур клеток на ранних этапах после выделения с целью их сохранения, поэтому методы замораживания данных клеток не менее важны, чем методы их выделения или культивирования.
В связи с этим цель настоящей работы заключалась в сравнении некоторых из существующих коммерческих продуктов (раствора фиколла, Lympholyte-H и пробирки SepMate-15) лля выделения из КМ овцы клеток с фенотипом подобным ММСК и оценки их выживаемости после криоконсервирования.
МАТЕРИАЛ И МЕТОДИКА
КМ получали от здоровых овец (n = 3, романовская порода, возраст 3–4 мес.) после седации диазепамом (0.05 мг/кг внутривенно) и местной анестезии 2%-ным гидрохлоридом лидокаина. Пункцию брали с помощью иглы для биопсии (Jorgensen Labs, США) после асептической подготовки кожи. Из-за лучшей доступности и больших размеров использовали плечевую или большеберцовую кости, а не подвздошный гребень, как общепринято в клинической практике. Все манипуляции с животными выполняли в операционной кафедры ветеринарной хирургии ФГБОУ ВПО МГАВМиБ с соблюдением “Правил проведения работ с использованием экспериментальных животных” (Приказ Минздрава СССР № 755 “О мерах по дальнейшему совершенствованию организационных форм работы с использованием лабораторных животных” от 12 августа 1977 г.). Полученные пробы КМ объемом 1–5 мл от каждой овцы переносили в стерильные пробирки с напылением из Li-гепарина и перевозили в лабораторию при 4°С в течение 1 ч. ММСК выделяли согласно трем протоколам, описанным ниже.
Выделение в градиент плотности Lympholyte-H (Cedarlane, Канада) в пробирке SepMate-15 (1). КМ разбавляли эквивалентным количеством бессывороточной среды, состоящей из фосфатно-солевого буфера Дюльбекко без ионов Са2+ и Mg2+ (ФСБ-2), дополненного антибиотиками пенициллином 100 ед./мл и стрептомицином 100 мкг/мл (Gibco, США). В пробирку SepMate-15 (StemCell Technologies, Канада) добавляли раствор Lympholyte-H и подготовленный КМ в соотношении 1 : 2, далее центрифугировали при 800 g 20 мин. Одним движением сливали верхний слой в новую центрифужную пробирку, разбавляли бессывороточной средой (уменьшая плотность раствора) и центрифугировали при 800 g 10 мин. После удаления надосадочной жидкости к смеси клеток добавляли ФСБ-2 с антибиотиками, дополненный 2% сыворотки крови плодов коров (СКПК) (HyClone, США), дважды проводили осаждение центрифугированием при 300 g 8 мин.
Выделение в градиент плотности фиколла (ПанЭко, Россия) в пробирке SepMate-15 (2). Использовали инструкцию производителя пробирки (StemCell Technologies, Канада). КМ разбавляли эквивалентным количеством среды, состоящей из ФСБ-2 с антибиотиками, дополненной 2% СКПК. Подготовленный КМ добавляли в пробирку с фиколлом в соотношении 2 : 1 и центрифугировали при 1200 g 10 мин. Далее манипуляции выполняли так же, как описано выше в первом протоколе.
Выделение в градиент плотности фиколла по классическому методу (3). КМ разбавляли в 4 раза вышеуказанной бессывороточной средой. Для выделения использовали стандартные центрифужные пробирки объемом 15 мл (Corning-Costar, США). Подготовленный КМ осторожно по стенке наслаивали на раствор фиколла в соотношении 1 : 4 и центрифугировали при 1000 g 30 мин. Собирали пипеткой опалесцирующий слой на границе раздела фаз и переносили в новую центрифужную пробирку. Взвесь разбавляли четырехкратным избытком среды (ФСБ-2 с антибиотиками, дополненной 2% СКПК) для уменьшения плотности раствора и нейтрализации воздействия фиколла и трижды осаждали центрифугированием при 400 g 10 мин.
Во всех случаях выделения отобранные клетки ресуспендировали в культуральной среде, состоящей из минимальной среды Игла МЕМ в модификации Дюльбекко с низким содержанием глюкозы (1 г/л; DMEM-LG) (Lonza, Бельгия), содержащей L-глутамин (Gibco, США), 10% СКПК и антибиотики, и переносили в стерильный флакон для культивирования с площадью поверхности 25 см2. Через 24 ч непрекрепившиеся клетки удаляли заменой среды. В дальнейшем среду меняли каждые 3–4 сут до достижения 80–90% конфлюэнтного монослоя, затем клетки субкультивировали, используя 0.25%-ный раствор трипсина (ПанЭко, Россия). Кроме того, в работе использовали ММСК, выделенные ранее из пуповинной крови (ПК) лошади (Коровина и др., 2015).
Морфологический анализ нативных и окрашенных красителем Гимза препаратов проводили с помощью инвертированного фазово-контрастного микроскопа (Carl Zeiss, Германия) с программным обеспечением AxioVision Rel. 4.8.
Среднее время удвоения числа клеток td рассчитывали по формуле: td = t/lg2(Nt/N0), где t – время между начальным и конечным счетом числа клеток, N0 и Nt – число клеток в начале и конце эксперимента соответственно (Узбеков, 2004). При этом долю клеток в фазе G0 не учитывали.
Способность клонообразования оценивали на 10-е сут культивирования. Для этого пассировали клетки при плотности 1.5 × 103 в культуральный флакон (25 см2) и рассчитывали как отношение числа образовавшихся клонов к общему числу посеянных клеток. Митотический индекс (‰) рассчитывали в фазе логарифмического роста как отношение числа митозов к общему числу подсчитанных клеток, умноженное на 1000.
Для кариологического анализа клетки на стадии логарифмического роста обрабатывали 0.6 мкг/мл колхицина в среде в течение 2 ч при 37°С в СО2-инкубаторе. Митотически делящиеся клетки снимали 0.25%-ным раствором трипсина в течение 5 мин при комнатной температуре. После обработки гипотоническим 0.56%-ным раствором KCl в течение 10–15 мин при 37°С клетки осаждали центрифугированием (5 мин, 100 g). ММСК фиксировали смесью метанола и ледяной уксусной кислоты в объемном соотношении 3 : 1. Полученную суспензию использовали для приготовления хромосомных препаратов.
Способность ММСК к направленной дифференцировке в адипо-, остео- и хондрогенном направлениях in vitro изучали с использованием наборов для дифференцировки StemPro® (Gibco, США). Клетки на 3-м пассаже переносили в 24-луночные планшеты при плотности 104 кл./см2. По достижении 70–80%-ного монослоя питательную среду заменяли средой для направленной дифференцировки. Далее индукционные среды меняли каждые 3–4 сут. Эффективность дифференцировки оценивали через 14 и 21 сут культивирования. Клетки фиксировали метанолом, охлажденным до −20°С (Macron Fine Chemicals, США), в течение 30 мин и окрашивали специфическими красителями. Липидные включения в цитоплазме клеток при адипогенной дифференцировке выявляли с помощью окрашивания жировым красным О (Bio-Optica, Италия), ядра докрашивали гематоксилином Майера (Sigma-Aldrich, США). Эффективность остеогенной дифференцировки анализировали с помощью набора для метода серебрения Косса (Bio-Optica, Италия), выявляя карбонаты и фосфаты кальция. Для выявления активности щелочной фосфатазы (ЩФ), раннего маркера остеогенной дифференцировки, использовали набор реактивов (Sigma-Aldrich, США). Дифференцировку в хондрогенном направлении в монослое выявляли окрашиванием полисахаридов и муцинов альциановым синим (БиоВитрум, Россия) в сочетании с гематоксилином Гарриса (Лабпоинт, Россия).
Криозащитные среды. Кондиционированную среду для криоконсервирования получали культивированием ММСК до конфлюэнтного монослоя, далее среду отбирали и центрифугировали при 400 g 10 мин, пропускали через фильтры с диаметром пор 0.22 мкм (Millipore, США). Три образца каждой клеточной культуры замораживали в следующих криозащитных средах: среда 1 – 50% DMEM-LG, 40% СКПК и 10% ДМСО (ПанЭко, Россия); среда 2 – готовая коммерческая бессывороточная криосреда Bambanker и 10% ДМСО (Lymphotec, Япония); среда 3 – кондиционированная среда, собранная с ММСК, (90%) и 10% ДМСО.
Дезагрегированные трипсином ММСК овцы центрифугировали при 100 g 5 мин, клеточный осадок ресуспендировали в DMEM-LG без добавления сыворотки, повторно осаждали в тех же условиях и замораживали в вышеуказанных средах в концентрации 106 кл./мл. Криопробирки замораживали с помощью постепенного снижения температуры (1°C/мин) до −70°C и через 24 ч перемещали в криохранилище с жидким азотом (Thermo Fisher Scientific, США). Клетки размораживали, помещая криопробирки в водяную баню с температурой 37°C. Затем переносили в центрифужные пробирки объемом 15 мл и промывали культуральной средой. Оценку жизнеспособности проводили с помощью автоматического счетчика Luna-II (Logos Biosystems, Корея), используя раствор трипанового синего (0.4%).
Результаты выражены значениями среднего арифметического и его стандартной ошибки. Достоверность различий оценивали по t-критерию Стьюдента при P < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты наших исследований показали, что пункция КМ в объеме 1–5 мл достаточна для успешного выделения клеток с характеристиками ММСК. Другие авторы считают, что количество аспирата КМ овцы, необходимое для получения ММСК с помощью градиента плотности фиколла, перколла, гистопака и др., составляет 22.5–35 мл (Mrugala at al., 2008; Delling et al., 2015; Vivas et al., 2018). Это может свидетельствовать о том, что пункции КМ были разбавлены периферической кровью животных. Известно, что ММСК выделяют из периферической крови овцы (Landa-Solis et al., 2016).
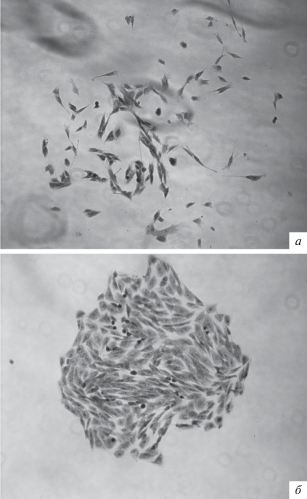
В эксперименте сравнивали три протокола выделения ММСК из КМ. Эффективность выделения клеток оценивали через 2, 9 и 14 сут. В качестве критериев оценки использовали морфологическую характеристику клеток и способность образования конфлюэнтного монослоя. Через 2 сут культивирования отобранных клеточных фракций наблюдали прикрепленные к пластику единичные фибробластоподобные клетки (рис. 1, а–в). Клетки, выделенные по протоколам 1 и 2, на 9-е сут культивирования имели схожие морфологические характеристики (рис. 1, г, д). Отмечено большое число узких веретенообразных клеток с фибробластоподобной морфологией. Встречались мелкие округлые клетки и единичные большие плоские клетки (диаметром 40–60 мкм). Эти наблюдения согласуются с данными электронной микроскопии о наличии в популяции ММСК КМ овцы клеток морфологически различных типов (Desantis et al., 2015). В клеточных культурах, выделенных по протоколу 3, на 9-е сут культивирования визуализировались клетки с округлой формой и вакуолизированной цитоплазмой (рис. 1, е). Считается, что эти изменения могут быть следствием цитотоксичности градиента плотности фиколла (Posel et al., 2012). Более длительное культивирование ММСК подтвердило целесообразность их выделения по протоколам 1 и 2, что видно из результатов, представленных на рис. 1, ж–и.
Рис. 1.
Клетки с фенотипом ММСК, выделенные из костного мозга (КМ) овцы с использованием разных протоколов (1–3), на разных этапах культивирования. Нативный препарат. Стрелками указаны единичные фибробластоподобные клетки. Об.: 20× (г–и) или 40× (а, б, в).

Одной из характеристик ММСК животных является способность их при низкой плотности образовывать клоны. Результаты наших исследований показали, что эффективность клонообразования ММСК овцы составляет 87 ± 0.1%. При посевной плотности 1.5 × 103 в культуральных флаконах площадью 25 см2 на 10-е сут наблюдали формирование клонов. По морфологии они отличались от клонов, которые формировали ММСК, выделенные из ПК лошади, несмотря на схожие значения эффективности клонообразования (89 ± 0.7%). Клоны были представлены кластерами с нечеткими границами, в которых клетки не создавали плотных контактов по сравнению с клонами, сформированными ММСК ПК лошади (рис. 2, б).
Рис. 2.
Клонообразующие потенции ММСК сельскохозяйственных животных на 10-е сут культивирования: кластеры ММСК КМ овцы (а) и клон ММСК ПК лошади (б). Краситель Гимза. Об. 10×.
Результаты кариологического анализа показали, что модальное число хромосом составляет 54 и соответствует диплоидному набору хромосом этого вида животного. Так, анализ клеток на 3-м и 10-м пассажах обнаружил, что из 40 и 50 метафазных пластинок 40 и 50 имели диплоидный кариотип 54 XX или XY хромосом соответственно.
Несмотря на то что в доклинических исследованиях по восстановлению хрящевой ткани овцы были самыми используемыми крупными животными в период с 2013 по 2017 г. (Music et al., 2018), число опубликованных работ по изучению биологии ММСК овец in vitro все еще недостаточно. В связи с этим мы изучали свойства данных клеток в культуре. Мы показали, что время удвоения ММСК овцы составляет 33 ± 0.4 ч, митотический индекс – 2.8‰. Данные согласуются с полученными нами ранее значениями времени цитогенерации ММСК, выделенных из КМ и жировой ткани крупного рогатого скота (24 ± 0.01 и 36 ± 0.3 ч соответственно) (Волкова и др., 2012), и в 2 раза превосходят по скорости удвоения ММСК ПК лошади (Коровина и др., 2017). Согласно данным из литературы, среднее значение времени удвоения ММСК овцы у разных авторов сильно различается и составляет от 12 ч (Mrugala at al., 2008) до 50 (Rentsch et al., 2010). Скорость пролиферации ММСК овцы зависит от концентрации сыворотки в среде (5–20%). Самые высокие показатели были достигнуты в присутствии 20% СКПК (Heidari et al., 2013).
Сообщалось о том, что ММСК овцы окрашиваются антителами против антигенов CD44, CD105, виментина, α-актина гладких мышц, десмина и не окрашиваются антителами против CD31, CD34 и CD45 (Mrugala at al., 2008). Для идентификации клеток была предложена следующая панель моноклональных антител: >99% против CD90 и CD105, >95% против CD73 и CD271, <1% против CD117 (Khan et al., 2016). Из-за отсутствия специфичных антител мы оценивали принадлежность полученных клеток к ММСК по функциональным свойствам – по способности формировать клетки жировой, костной и хрящевой тканей при индукции.
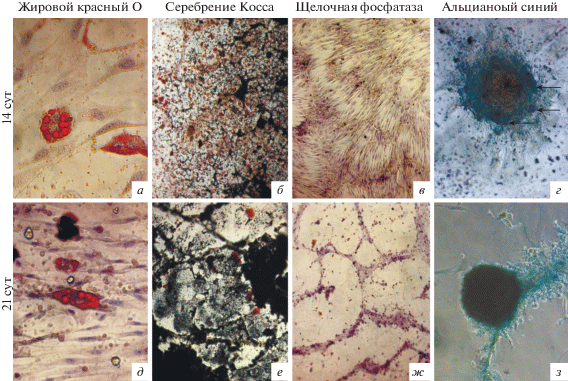
На 14–21-е сут при культивировании ММСК в среде, содержащей индукторы, которые направляют дифференцировку в клетки жировой ткани, выявляли формирование адипоцитов с липидными везикулами, которые окрашивались жировым красным О (рис. 3, а, д). Окраска методом серебрения Косса выявила наличие солей кальция в межклеточном пространстве (рис. 3, б, е) на 21-е сут, что свидетельствует о дифференцировке клеток в остеогенном направлении. Наличие ЩФ в отличие продуктов реакции Косса обнаружено раньше, на 14-е сут (рис. 3, в, ж). Известно о зависимости между остеогенной дифференцировкой и специфической активностью ЩФ, которая может использоваться в качестве раннего маркера (Савченкова и др., 2010). Наши результаты согласуются с данными других авторов о выявлении при индукции в остеогенном направлении экспрессии ЩФ через 7–18 сут (Caminal et al., 2017). Имеется сообщение, что при остеогенной стимуляции ММСК КМ и жировой ткани овцы в часто применяемой для дифференцировки ММСК человека среде, содержащей β-глицерофосфат, не обнаружено активности ЩФ. Эти результаты указывают на значительные различия между ММСК овцы и человека, и авторы предполагают, что методы стандартной остеогенной дифференцировки in vitro могут не подходить для ММСК всех видов (Kalaszczynska et al., 2013). В случае хондродифференцировки в монослое через 14 сут ММСК овцы образовывали многослойные скопления с большим количеством матрикса, отмечали изогенные группы, подобные лакунам гиалинового хряща. Через 21 сут клетки формировали микрогранулы с диаметром в диапазоне 370–710 мкм (рис. 3, г, з). Характерное продуцирование гликозаминогликанового матрикса при хондрогенной дифференцировке подтверждали окрашиванием альциановым синим в сине-зеленый цвет (глюкозаминогликаны и мукополисахариды). Описано использование аналогичной среды StemPro® (но с предварительным осаждением клеток) для хондрогенной дифференцировки ММСК синовиальной оболочки коленных суставов человека с образованием сфер размером около 1500 мкм (Далина и др., 2013). Как правило, выделенные ММСК осаждают для образования культуры микромасс, чтобы способствовать хондрогенной дифференцировке (Rentsch et al., 2010). Необходимые для запуска программ хондрогенеза плотные межклеточные контакты в загруженном ММСК матриксе также формируются путем высокоскоростного центрифугирования (Тепляшин и др., 2007). Таким образом, было показано, что полученные нами из КМ овец популяции клеток обладают фенотипом, характерным для ММСК.
Рис. 3.
Направленная дифференцировка ММСК КМ овцы в клетки жировой, костной и хрящевой тканей через 14 и 21 сут культивирования в адипогенной (а, д), остеогенной (б, в, е, ж) и хондрогенной (г, з) средах. Стрелками указаны изогенные группы, морфологически сходные с лакунами гиалинового хряща. Об.: 10× (б, в, е, ж), 20× (з) или 40× (а, г, д).
Для сокращения возможного негативного влияния условий длительного культивирования выделенных клеток, а также в экономических целях применяется криоконсервирование. Общепринятым криопротектором при замораживании различных клеток считается ДМСО (5–10%), а сочетание раствора ДМСО и СКПК используется уже несколько десятилетий для сохранения многих типов клеток и тканей. Ранее для ММСК овцы, выделенных из различных тканей, применяли методы криоконсервирования, аналогичные методам для ММСК человека, с использованием СКПК (90%) и ДМСО (10%) (Lyahyai et al., 2012; Colosimo et al., 2013; Delling et al., 2015). Было показано, что снижение содержания сыворотки в криосреде (20%) не влияет на значения жизнеспособности клеток, которые составляли 90 ± ± 1.99% (Renzi et al., 2012). Известно, что ММСК секретируют множество ростовых факторов и цитокинов, которые способствуют снижению апоптоза, воспаления и окислительного стресса при сердечно-сосудистых и нейродегенеративных заболеваниях (Pawitan, 2014). Появились данные, которые свидетельствуют о том, что кондиционированная среда, полученная от ММСК, используется при замораживании (Lin et al., 2013; Kadekar et al., 2016; Maia et al., 2017). В связи с этим представляло интерес сравнить влияние трех криозащитных сред при криоконсервировании на жизнеспособность ММСК овцы сразу после размораживания на 0-м пассаже. Как видно из результатов, представленных в табл. 1, наилучшие показатели жизнеспособности клеток были выявлены в группах, где в качестве криопротектора применяли используемую в нашей лаборатории (среда 1) или готовую коммерческую среду (среда 2). В случае кондиционированной среды в качестве компонента для среды замораживания жизнеспособность ММСК КМ овцы снижалась на 8%. Полученные нами результаты согласуются с опубликованными данными, согласно которым при использовании кондиционированной среды при замораживании ММСК, выделенных из пуповины лошади, их жизнеспособность составляла 70.3 ± 20.6% (Maia et al., 2014). Выживаемость ММСК овцы во всех трех группах в наших экспериментах была выше 70%, что свидетельствует о хорошем состоянии размороженных клеток.
Таблица 1.
Влияние криозащитных сред на жизнеспособность клеток после криоконсервирования
| Среда | Жизнеспособность в пробах 1–3, % | |||
|---|---|---|---|---|
| 1 | 2 | 3 | Среднее | |
| 1 | 84.2 | 84.1 | 83.8 | 84.00 ± 0.13 |
| 2 | 81.5 | 82.4 | 82.1 | 82.00 ± 0.26 |
| 3 | 76.6 | 75.7 | 76.7 | 76.00 ± 0.4 |
Таким образом, в результате оптимизации классического метода выделения в градиент плотности фиколла из КМ овец была получена культура клеток с характеристиками, подобными ММСК. Клетки имели высокую адгезию к пластику и фибробластоподобную морфологию, обладали способностью при посеве в низкой плотности формировать клоны с эффективностью 87% и при индукции формировать клетки жировой, костной и хрящевой тканей. Полученные нами культуры клеток на 2–3-м пассажах депонированы в специализированную Коллекцию перевиваемых соматических клеточных культур сельскохозяйственных и промысловых животных при ВИЭВ имени К.И. Скрябина и Я.Р. Коваленко.
Работа выполнена в рамках НИР № 0578-2018-0006 “Создание новых клеточных систем с заданными свойствами на основе стволовых клеток млекопитающих, в том числе сельскохозяйственных животных для ветеринарии, вирусологии и биотехнологии”.
Список литературы
Волкова И.М., Викторова Е.В., Савченкова И.П., Гулюкин М.И. 2012. Характеристика мезенхимных стволовых клеток, выделенных из костного мозга и жировой ткани крупного рогатого скота. Сельскохоз. биол. 2 : 32–38. (Volkova I.M., Viktorova E.V., Savchenkova I.P., Gulyukin M.I. 2012. Сharacteristic of mesenchymal stem cells, isolated from bone marrow and fatty tissue of cattle. Sel’skokhozyaistvennaya Biol. 2 : 32–38.)
Далина А.Д., Мухамбетова А.Е., Батпенов Н.Д., Раймагамбетов Е.К., Огай В.Б. 2013. Влияние ростовых факторов TGF-β1, IGF-I, BMP-2 и BMP-4 на хондрогенную дифференцировку мезенхимальных стволовых клеток, выделенных из синовиальной оболочки человека. Биотехнология. Теория и практика. 1 : 12–15. (Dalina A.D., Mukhambetova A.E., Batpenov N.D., Raymagambetov E.K., Ogay V.B. 2013. Vliyanie rostovykh faktorov TGF-β1, IGF-I, BMP-2 i BMP-4 na khondrogennuyu differentsirovku mezenkhimalnykh stvolovykh kletok vydelennykh iz sinovialnoy obolochki cheloveka. Biotekhnologiya. Teoriya i praktika. 1 : 12–15.)
Коровина Д.Г., Юров К.П., Алексеенкова С.В., Савченкова Е.А., Савченкова И.П. 2017. Характеристика мультипотентных мезенхимных стволовых клеток, выделенных из пуповинной крови лошадей. Рос. сельскохоз. наука. 2 : 51–54. (Korovina D.G., Yurov K.P., Alexeenkova S.V., Savchenkova E.A., Savchenkova I.P. 2017. Characterization of multipotent mesenchymal stem cells isolated from equine cord blood. Russ. Agricul. Sci. 43(3) : 262–265.)
Коровина Д.Г., Юров К.П., Волкова И.М., Алексеенкова С.В., Васильева С.А., Савченкова Е.А., Савченкова И.П. 2015. Пуповинная кровь лошадей как источник мультипотентных мезенхимных стволовых клеток. Коневодство и конный спорт. 6 : 31–33. (Korovina D.G., Yurov K.P., Volkova I.M., Alekseenkova S.V., Vasilieva S.A., Savchenkova E.A., Savchenkova I.P. 2015. Equine umbilical cord blood is as source of multipotent mesenchymal stem cells. Konevodstvo i Konny Sport. 6 : 31–33.)
Кульнева Е.И., Девришов Д.А., Тепляшин А.С., Коржикова С.В. 2010а. Характеристика клеток, подобных мультипотентным мезенхимным стромальным клеткам, выделенным из костного мозга овцы. Ветеринарная мед. 3–4 : 102–104. (Kulneva E.I., Devrishov D.A., Teplyashin A.S., Korzhikova S.V. 2010a. Characteristics of multipotent mesenchymal stromal cell-like cells isolated from the ovine bone marrow. Veterinarnaya Med. 3–4 : 102–104.)
Кульнева Е.И., Коржикова С.В., Тепляшин А.С., Девришов Д.А. 2010б. Эффективность адипогенной дифференцировки ММСК, выделенных из костного мозга овцы при использовании сред с различной концентрацией индукторов. Ветеринарная медицина. 3–4 : 104–105. (Kulneva E.I., Korzhikova S.V., Teplyashin A.S., Devrishov D.A. 2010b. The effective adipogenic differentiation of MMSCs isolated from ovine bone marrow after treatment with media containing inductors. Veterinarnaya meditsina. 3–4 : : 104–105.)
Савченкова И.П., Савченкова Е.А. 2014. Изменение экспрессии интегринов мультипотентными мезенхимными стромальными клетками, выделенными из подкожно-жировой ткани человека, при длительном культивировании. Цитология. 56 (8) : 574–580. (Savchenkova I.P., Savchenkova E.A. 2014. Change of expression of integrins on multipotent mesenchymal stromal cells isolated from human adipose tissue during long cultivation. Tsitologiya. 56(8) : 574–580.)
Савченкова И.П., Савченкова Е.А., Гулюкин М.И. 2017. Изменения мультипотентных мезенхимных стромальных клеток, выделенных из подкожно-жировой ткани человека, в результате длительного культивирования. Цитология. 59 (5) : 307–314. (Savchenkova I.P., Savchenkova E.A., Gulyukin M.I. 2017. Changes in the multipotent mesenchymal stromal cells isolated from human adipose tissue during long-term cultivation. Tsitologiya. 59(5) : : 307–314.)
Савченкова И.П., Эрнст Л.К., Гулюкин М.И., Викторова Е.В. 2010. Методические наставления по выделению мультипотентных мезенхимных стволовых клеток из тканей взрослых особей млекопитающих, изучению их свойств и признаков. М.: Спутник+. 23 с. (Savchenkova I.P., Ernst L.K., Gulyukin M.I., Viktorova E.V. 2010. Metodicheskie nastavleniya po vydeleniyu multipotentnykh mezenkhimnykh stvolovykh kletok iz tkaney vzroslykh osobey mlekopitayushchikh, izucheniyu ikh svoystv i priznakov. Moscow: Sputnik+. 23 p.)
Свиридова И.К., Сергеева Н.С., Франк Г.А., Тепляков В.В., Кирсанова В.А., Ахмедова С.А., Мыслевцев И.В., Шанский Я.Д. 2010. Скелет натуральных кораллов сем. Aсropora в замещении дефекта костной ткани у мелких и крупных лабораторных животных. Клеточная трансплантология и тканевая инженерия. 5(4) : 43–48. (Sviridova I.K., Sergeeva N.S., Frank G.A., Teplyakov V.V., Kirsanova V.A., Akhmedova S.A., Myslevtsev I.V., Shansky Ya.D. 2010. A skeleton of Асrороrа corals in replacing bone tissue defects in small and large laboratory animals. Genes and Cells. 5(4) : 43–48.)
Сергеева Н.С., Франк Г.А., Свиридова И.К., Кирсанова В.А., Ахмедова С.А., Антохин А.И. 2009. Роль аутогенных мультипотентных мезенхимальных стромальных клеток в тканеинженерных конструкциях на основе натуральных кораллов и синтетических биоматериалов при замещении костных дефектов у животных. Клеточная трансплантология и тканевая инженерия (Гены и клетки). 4(4) : 56–64. (Sergeeva N.S., Frank G.A., Sviridova I.K., Kirsanova V.A., Akhmedova S.A., Antochin A. J. 2009. A role of multipotential mesenchymal stromal cells in tissue-engineering constructions based on skeleton of natural corals and synthetic biomaterials for bone defects substitution on animals. Genes and Cells. 4(4) : 56–64.)
Тепляшин А.С., Коржикова С.В., Шарифуллина С.З., Ростовская М.С., Чупикова Н.И., Васюнина Н.Ю., Андронова Н.В., Трещалина Е.М., Савченкова И.П. 2007. Дифференцировка мультипотентных мезенхимных стромальных клеток костного мозга человека в клетки хрящевой ткани при культивировании их в трехмерных матриксах Opla. Цитология. 49(7) : 544–551. (Teplyashin A.S., Korjikova S.V., Sharifullina S.Z., Rostovskaya M.S., Chupikova N.I., Vasyunina N.Yu., Andronova N.V., Treshalina E.M., Savchenkova I.P. 2007. Differentiation of multipotent mesenchymal stromal cells of human bone marrow into cells of cartilage tissue by culturing in three-dimensional OPLA scaffolds. Cell Tiss. Biol. (Tsitologiya). 1(2) : 125–132.)
Узбеков Р.Э. 2004. Анализ клеточного цикла и методика исследования динамики уровня экспрессии белков на его различных фазах с использованием синхронизированных клеток. Биохимия. 69(5) : 597–611. (Uzbekov R.E. 2004. Analysis of protein expression level dynamics in the cell cycle using synchroni- zed cells. Biochemistry (Moscow). 69(5) : 485–496.)
Adamzyk C., Emonds T., Falkenstein J., Tolba R., Jahnen-Dechent W., Lethaus B., Neuss S. 2013. Different culture media affect proliferation, surface epitope expression, and differentiation of ovine MSC. Stem Cells Int. : 387324.
Behr L., Hekmati M., Fromont G., Borenstein N., Noel L.H., Lelievre-Pegorier M., Laborde K. 2007. Intra renal arterial injection of autologous mesenchymal stem cells in an ovine model in the postischemic kidney. Nephron Physiol. 107 : : 65–76.
Caminal M., Velez R., Rabanal R.M., Vivas D., Batlle-Morera L., Aguirre M., Barquinero J., Garcia J., Vives J. 2017. A reproducible method for the isolation and expansion of ovine mesenchymal stromal cells from bone marrow for use in regenerative medicine preclinical studies. J. Tissue Eng. Regen. Med. 11 : 3408–3416.
Caplan A.I., Correa D. 2011. The MSC: An injury drugstore. Cell Stem Cell. 9 : 11–15.
Carrade D.D., Borjesson D.L. 2013. Immunomodulation by mesenchymal stem cells in veterinary species. Comp. Med. 63 : 207–217.
Colosimo A., Russo V., Mauro A., Curini V., Marchisio M., Bernabo N., Alfonsi M., Mattioli M., Barboni B. 2013. Prolonged in vitro expansion partially affects phenotypic features and osteogenic potential of ovine amniotic fluid-derived mesenchymal stromal cells. Cytotherapy. 15 : 930–950.
Delling U., Brehm W., Ludewig E., Winter K., Julke H. 2015. Longitudinal evaluation of effects of intra-articular mesenchymal stromal cell administration for the treatment of osteoarthritis in an ovine model. Cell Transplant. 24 : 2391–2407.
Desantis S., Accogli G., Crovace A., Francioso E.G., Crovace A.M. 2018. Surface glycan pattern of canine, equine, and ovine bone marrow-derived mesenchymal stem cells. Cytometry A. 93 : 73–81.
Desantis S., Accogli G., Zizza S., Mastrodonato M., Blasi A., Francioso E., Rossi R., Crovace A., Resta L. 2015. Ultrastructural study of cultured ovine bone marrow-derived mesenchymal stromal cells. Ann. Anat. 201 : 43–49.
Eaker S., Armant M., Brandwein H., Burger S., Campbell A., Carpenito C., Clarke D., Fong T., Karnieli O., Niss K., Van’t Hof W., Wagey R. 2013. Concise review: guidance in developing commercializable autologous/patient-specific cell therapy manufacturing. Stem Cells Transl. Med. 2 : 871–883.
Heidari B., Shirazi A., Akhondi M. M., Hassanpour H., Behzadi B., Naderi M.M. 2013. Comparison of proliferative and multilineage differentiation potential of sheep mesenchymal stem cells derived from bone marrow, liver, and adipose tissue. Avicenna J. Med. Biotechnol. 5 : 104–117.
Jessop H.L., Noble B.S., Cryer A. 1994. The differentiation of a potential mesenchymal stem cell population within ovine bone marrow. Biochem. Soc. Trans. 22 : 248S.
Kadekar D., Rangole S., Kale V., Limaye L. 2016. Conditioned medium from placental mesenchymal stem cells reduces oxidative stress during the cryopreservation of ex vivo expanded umbilical cord blood cells. PLoS One. 11 : e0165466.
Kalaszczynska I., Ruminski S., Platek A.E., Bissenik I., Zakrzewski P., Noszczyk M., Lewandowska-Szumiel M. 2013. Substantial differences between human and ovine mesenchymal stem cells in response to osteogenic media: how to explain and how to manage? BioRes. Open Access. 2 : 356–363.
Khan M.R., Chandrashekran A., Smith R.K., Dudhia J. 2016. Immunophenotypic characterization of ovine mesenchymal stem cells. Cytometry Part A. 89 : 443–450.
Lacitignola L., Staffieri F., Rossi G., Francioso E., Crovace A. 2014. Survival of bone marrow mesenchymal stem cells labelled with red fluorescent protein in an ovine model of collagenase-induced tendinitis. Vet. Comp. Orthop. Traumatol. 27 : 204–209.
Landa-Solis C., Granados-Montiel J., Olivos-Meza A., Ortega-Sanchez C., Cruz-Lemini M., Hernandez-Flores C., Chang-Gonzalez M.E., Garcia R.G., Olivos-Diaz B., Velasquillo-Martínez M.C., Pineda C., Ibarra C. 2016. Cryopreserved CD90+ cells obtained from mobilized peripheral blood in sheep: a new source of mesenchymal stem cells for preclinical applications. Cell Tiss. Bank. 17 : 137–145.
Lin H.D., Bongso A., Gauthaman K., Biswas A., Choolani M., Fong C.Y. 2013. Human Wharton’s jelly stem cell conditioned medium enhances freeze-thaw survival and expansion of cryopreserved CD34+ cells. Stem Cell Rev. 9 : 172–183.
Lyahyai J., Mediano D.R., Ranera B., Sanz A., Remacha A.R., Bolea R., Zaragoza P., Rodellar C., Martin-Burriel I. 2012. Isolation and characterization of ovine mesenchymal stem cells derived from peripheral blood. BMC Vet. Res. 8 : 169.
Maia L., Dias M.C., de Moraes C.N., de Paula Freitas-Dell’Aqua C., da Mota L.S., Santiloni V., da Cruz Landim-Alvarenga F. 2017. Conditioned medium: a new alternative for cryopreservation of equine umbilical cord mesenchymal stem cells. Cell Biol. Int. 41 : 239–248.
Maia L., Moraes C.N., Freitas-Dell’Aqua C.P., Queiroz C.M., Mota L.S.L.S., Santiloni V., Landim-Alvarenga F.C. 2014. Development of a cryopreservation protocol for equine mesenchymal stem cells obtained from umbilical cord. JEVS. 34 : 235. doi 10.1016/j.jevs.2013.10.167
McCarty R.C., Gronthos S., Zannettino A.C., Foster B.K., Xian C.J. 2009. Characterisation and developmental potential of ovine bone marrow derived mesenchymal stem cells. J. Cell. Physiol. 219 : 324–333.
Mrugala D., Bony C., Neves N., Caillot L., Fabre S., Moukoko D., Jorgensen C., Noel D. 2008. Phenotypic and functional characterisation of ovine mesenchymal stem cells: application to a cartilage defect model. Ann. Rheum. Dis. 67 : 288–295.
Music E., Futrega K., Doran M.R. 2018. Sheep as a model for evaluating mesenchymal stem/stromal cell (MSC)-based chondral defect repair. Osteoarthritis Cartilage. 26 : 730–740.
Oliver-Vila I., Ramirez-Moncayo C., Grau-Vorster M., Marin-Gallen S., Caminal M., Vives J. 2018. Optimisation of a potency assay for the assessment of immunomodulative potential of clinical grade multipotent mesenchymal stromal cells. Cytotechnol. 70 : 31–44.
Pawitan J. A. 2014. Prospect of stem cell conditioned medium in regenerative medicine. Biomed. Res. Int. 2014. doi 10.1155/ 2014/965849
Posel C., Moller K., Frohlich W., Schulz I., Boltze J., Wagner D.C. 2012. Density gradient centrifugation compromises bone marrow mononuclear cell yield. PLoS One. 7 : e50293.
Rentsch C., Hess R., Rentsch B., Hofmann A., Manthey S., Scharnweber D., Biewener A., Zwipp H. 2010. Ovine bone marrow mesenchymal stem cells: isolation and characterization of the cells and their osteogenic differentiation potential on embroidered and surface-modified polycaprolactone-co-lactide scaffolds. In Vitro Cell. Develop. Biol. Anim. 46 : 624–634.
Renzi S., Lombardo T., Dotti S., Dessi S.S., De Blasio P., Ferrari M. 2012. Mesenchymal stromal cell cryopreservation. Biopreserv. Biobank. 10 : 276–281.
Rhodes N.P., Srivastava J.K., Smith R.F., Longinotti C. 2004. Heterogeneity in proliferative potential of ovine mesenchymal stem cell colonies. J. Mater. Sci. Mater. Med. 15 : 397–402.
Sanjurjo-Rodriguez C., Castro-Vinuelas R., Hermida-Gomez T., Fernandez-Vazquez T., Fuentes-Boquete I.M., de Toro-Santos F.J., Diaz-Prado S.M., Blanco-Garcia F.J. 2017. Ovine mesenchymal stromal cells: morphologic, phenotypic and functional characterization for osteochondral tissue engineering. PLoS One. 12 : e0171231.
Uder C., Bruckner S., Winkler S., Tautenhahn H.M., Christ B. 2018. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 : 32–49.
Vivas D., Caminal M., Oliver-Vila I., Vives J. 2018. Derivation of multipotent mesenchymal stromal cells from ovine bone marrow. Curr. Protoc. Stem Cell Biol. 44 : 2B.9.1–2B.9.22.
Zscharnack M., Hepp P., Richter R., Aigner T., Schulz R., Somerson J., Josten C., Bader A., Marquass B. 2010. Repair of chronic osteochondral defects using predifferentiated mesenchymal stem cells in an ovine model. Amer. J. Sports Med. 38 : 1857–1869.
Дополнительные материалы отсутствуют.


