Цитология, 2019, T. 61, № 1, стр. 16-34
Современные концепции стимуляции регенерации костной ткани с использованием биологически активных скаффолдов
И. Н. Щаницын 1, А. Н. Иванов 1, *, В. Ю. Ульянов 1, И. А. Норкин 1
1 Саратовский государственный медицинский университет им. В.И. Разумовского, Научно-исследовательский
институт травматологии, ортопедии и нейрохирургии Министерства здравоохранения РФ
410002 Саратов, Россия
* E-mail: lex558452@gmail.com
Поступила в редакцию 05.07.2018
После доработки 02.08.2018
Принята к публикации 01.08.2018
Аннотация
В настоящее время основными методами лечения дефектов кости являются имплантация ауто- или аллографтов и применение недеградируемых имплантатов, которые имеют ряд значительных недостатков. Технологии тканевой инженерии позволяют преодолевать эти ограничения и являются альтернативой для стимуляции регенерации при больших дефектах, обусловленных травмой или патологией костей. В последние несколько десятилетий интенсивно развиваются методы тканевой инженерии и активно исследуется применение различных видов клеток и факторов роста для регенерации костной ткани. В настоящем обзоре рассматриваются результаты исследований, обосновывающих целесообразность использования различных биологически активных веществ при создании трехмерных матриц или скаффолдов, а также приводятся примеры применения различных их типов для восстановления костной ткани. Обобщены результаты последних разработок в области тканевой инженерии костной ткани, посвященных факторам роста, стволовым клеткам, ангио- и остеогенезу. Представленные данные литературы свидетельствуют о том, что тканевая инженерия, клеточная терапия и трансдукция генов открывают новые возможности для развития технологий стимуляции регенерации костной ткани.
Замена и регенерация поврежденной кости являются серьезной проблемой в ортопедии. Костная ткань уступает только крови по количеству трансплантаций – ежегодно проводится более 2 млн операций трансплантации кости (Giannoudis et al., 2005; Laurencin et al., 2006). Золотым стандартом при лечении больших или сложных дефектов костей является применение ауто- или аллотрансплантатов, которые составляют 58 и 34% соответственно от всех костных трансплантатов (James et al., 2011). Однако как алло-, так и аутотрансплантация имеют недостатки. Так, не всегда можно осуществить забор аутотрансплантата, для его получения необходимо дополнительное оперативное вмешательство, что сопряжено с риском возникновения местных осложнений. При аллотрансплантации доступность донорской кости ограниченна, а также есть риск передачи болезней и инфицирования. Ограничения этих двух подходов можно преодолеть за счет использования синтетических заменителей костей или скаффолдов. Целью настоящего обзора является рассмотрение эволюции скаффолдов в контексте механизма регенерации костной ткани, а также результатов исследований современных биоактивных композитных скаффолдов с акцентом на васкуляризацию и остеоинтеграцию.
ЭВОЛЮЦИЯ СКАФФОЛДОВ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ
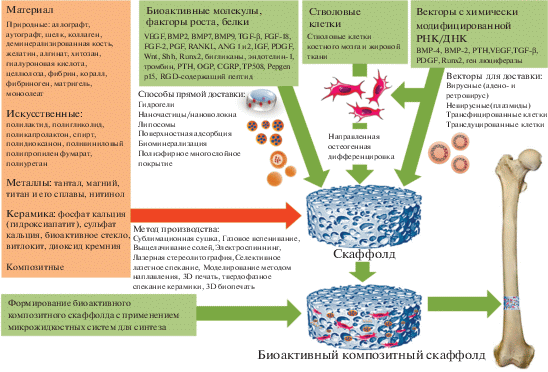
Выделяют четыре поколения материалов для трансплантации кости (рис. 1). Костные трансплантаты первого поколения, металлы и сплавы, имеют отличные механические свойства, но не биоактивны и не резорбируются. Продолжительность жизни этих трансплантатов ограничена, и, следовательно, их необходимо удалять и заменять хирургическим путем. К материалам второго поколения относят биоактивную керамику и рассасывающиеся полимеры. Полимерные скаффолды не обладают достаточной биологической активностью и требуемыми механическими свойствами, в то время как керамические скаффолды слишком хрупкие, чтобы их можно было использовать при больших нагрузках. Трансплантаты третьего поколения представлены композитными скаффолдами, которые сочетают в себе прочность, жесткость и остеокондуктивность керамики с гибкостью и способностью к резорбции полимеров. Трансплантаты четвертого поколения представляют собой полимер-керамические композитные скаффолды с включением остеогенных клеток, факторов роста (ФР) или костных морфогенетических белков отдельно или сочетанно (Yunus Basha et al., 2015).
Производство современных биокомпозитных скаффолдов представляет собой сложный процесс, учитывающий многие критерии – биосовместимость и низкую иммуногенность, механическую прочность, контролируемую биорезорбируемость, остеокондуктивность, остеоиндуктивность, определенные поверхностные свойства, пористость и в особенности васкуляризацию (Mohammadi et al., 2018).
Считается, что скаффолды должны способствовать образованию новой ткани без выраженных воспалительных и гистопатогенных реакций (Ivanov et al., 2015). Однако исследования показали, что в полностью инертных скаффолдах из полиуретана васкуляризация выражена весьма слабо (Laschke et al., 2009). Напротив, умеренная стимуляция воспаления активирует миграцию клеток и ангиогенез (Santos et al., 2013; Иванов, 2015). Следовательно, биосовместимость скаффолдов не подразумевает полного отсутствия воспалительного ответа (Santos et al., 2013).
Кроме того, трансплантат должен быть достаточно прочным для сдерживания гидростатического давления и механических нагрузок. Также показана зависимость продукции клетками внеклеточного матрикса от жесткости скаффолда (Correia et al., 2012).
Биодеградация скаффолда необходима для того, чтобы образовывался собственный внеклеточный матрикс. Трансплантат должен деградировать с контролируемой скоростью, создавая пространство для роста новой костной ткани. Продукты деградации не должны оказывать токсическое действие и вызывать воспаление. Предпочтительной считается поверхностная деградация, поскольку она позволяет поддерживать объемную структуру, обеспечивая более длительную механическую стабильность (Goonoo et al., 2017). Кроме того, скорость резорбции скаффолда должна меняться в зависимости от области применения; например, для хирургии позвоночника продолжительность резорбции составляет не менее 9 мес, для челюстно-лицевой хирургии – 3–6 мес. (Bose et al., 2012).
Костный трансплантат должен способствовать миграции и направлять рост и дифференцировку остеогенных клеток (Goonoo et al., 2017). Остеоиндуктивность – способность стимулировать дифференцировку экзогенных мультипотентных мезенхимных стромальных клеток (ММСК) или других клеток в остеогенном направлении, тем самым вызывая образование эктопической кости (Goonoo et al., 2017). На остеокондуктивность и остеоиндуктивность влияют кроме химического состава пористость, поверхностные свойства и нанотопография скаффолда (шероховатость и умеренная гидрофильность) (Goonoo et al., 2017).
Взаимодействие клеток с микроокружением и нанотопография определяют успех имплантации скаффолда. Использование нанотехнологий (микрожидкостные системы синтеза, 3D-биопечать и электроспиннинг) для изготовления структур на молекулярном уровне повышает функциональность скаффолдов (Mohammadi et al., 2018). Для улучшения адгезии клеток и белков внеклеточного матрикса, а также для ограничения адгезии и пролиферации бактерий применяют методы поверхностной нанокристаллизации, поверхностного структурирования посредством литографии, фототравления и анодирования (Lin et al., 2014).
Пористая структура естественной костной ткани, воспроизводимая в искусственных трансплантатах, создает благоприятные условия для заселения и роста экзогенных клеток, миграции собственных клеток и усиленной остеогенной дифференцировки. Кроме того, наличие пористой структуры играет важную роль в неоваскуляризации (Goonoo et al., 2017). Для создания пористых каркасов используют различные методы, такие как выщелачивание солей, газовое вспенивание и лиофилизация, 3D-биопечать и электроспиннинг. Выбор метода изготовления зависит исключительно от типа материала. Например, пористые скаффолды из биостекла, стеклокерамики и кристаллической керамики могут быть получены только путем процесса лазерного спекания (Karageorgiou, Kaplan, 2005).
Для регенерации большинства тканей решающее значение имеет создание функциональной сосудистой системы. В костях кровеносные сосуды не только служат источником кислорода и питательных веществ, но также обеспечивают поступление ионов кальция и фосфатов для минерализации. Недостаточная васкуляризация скаффолдов в конечном итоге приводит к нарушению формирования кости (Bose et al., 2012; Иванов и др., 2015). Для модулирования микрососудистой геометрии в скаффолдах и стимуляции васкуляризации предложены различные методы – микрожидкостные системы синтеза, электроспиннинг, биопринтинг и фотолитография (Pearlin et al., 2018).
Несмотря на бурное развитие методов получения скаффолдов с любыми заданными механическими свойствами, биологически инертные трансплантаты значительно уступают аутокости, что в первую очередь связано с тем, что регенерация дефекта кости представляет собой комплекс сложных, скоординированных по времени процессов, включающих в себя взаимодействие множества молекулярных, клеточных, биохимических и механических сигналов, среди которых васкуляризация и остеоинтеграция имеют особое значение (Cao et al., 2014).
Вышеупомянутые проблемы привели к разработке многофункциональных и биоактивных скаффолдов, которые способствуют ангио- и остеогенезу. Введение определенных биологически активных молекул в структуру скаффолда ускоряет процесс заживления и регенерации кости, повышая концентрацию препарата в месте имплантации и снижая при этом системную токсичность (Bagherifard, 2017). Среди наиболее распространенных биоактивных агентов отмечают антибиотики, противовоспалительные препараты, ФР, цитокины, ферменты и другие белки, а также гены, кодирующие ФР, в составе плазмидных и вирусных векторов или стволовых клеток (Cao et al., 2014) (рис. 2). Успешность применения скаффолдов определяется их способностью корректировать собственные регуляторные механизмы, обеспечивающие адекватное протекание всех этапов восстановления кости. В этой связи в качестве биологически активных компонентов скаффолдов наиболее часто используются аналоги гуморальных и клеточных факторов, участвующих в репаративной регенерации костной ткани.
МЕХАНИЗМ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ
Процесс регенерации кости можно разделить на четыре последовательных этапа. Первый этап начинается с образования гематомы, за которым следует воспалительная фаза удаления потенциальных антигенов и посторонних агентов (Stroncek, Reichert, 2008). Содержащиеся в гематоме лейкоциты выделяют ряд провоспалительных цитокинов, пик продукции которых происходит в первые 24 ч после травмы и завершается в течение 1 нед. Провоспалительные цитокины – фактор некроза опухоли-альфа (TNF-α), интерлейкины (IL)-1, -6, -11 и -18, макрофагальный колониестимулирующий фактор (M-CSF) и трансформирующий ФР-β (TGF-β) стимулируют ангиогенез, выработку эндотелиального ФР (EGF), а также дифференцировку остеобластов и остеокластов. ММСК мигрируют в область перелома из окружающих мягких тканей, костного мозга и с током крови (Marsell, Einhorn, 2011). Сгусток крови постепенно заменяется грануляционной тканью, решающую роль в этом процессе играют ФР эндотелия сосудов (VEGF) и ангиопоэтины (Bao et al., 2009). TGF-β, основной ФР фибробластов (FGF), тромбоцитарный ФР (PDGF, platelet-derived growth factor) и инсулиноподобный ФР-1 (IGF-1) способствуют образованию в грануляционной ткани первичной мозоли, состоящей из соединительной и хрящевой тканей (Marzona, Pavolini, 2009). Формирование мягкого каллуса происходит через 7–9 сут после травмы (Oryan et al., 2014).
Третий этап характеризуется дальнейшей клеточной пролиферацией и дифференцировкой, уплотнением и минерализацией межклеточного матрикса (Oryan et al., 2014). Происходит окостенение соединительнотканных (интрамембранозная оссификация) и хрящевых (энхондральное окостенение) элементов первичной мозоли, которая замещается твердым каллусом. Значительную роль в этом процессе играют белки семейства Wnt. В резорбции хряща принимают участие M-CSF, лиганд рецептора-активатора ядерного фактора каппа-В (RANKL), остеопротегерин и TNF-α (Ai-Aql et al., 2008).
Конечной стадией заживления кости является фаза ремоделирования, когда M-CSF и RANKL опосредуют активность макрофагов и остеокластов для резорбции остатков твердых тел (Ai-Aql et al., 2008). Эти фазы способствуют формированию полностью перестроенной кости, которая структурно и функционально подобна нативной кости. Процесс ремоделирования осуществляется при поддержании баланса резорбции остеокластами твердой костной мозоли и пластинчатым осаждением кости остеобластами. Этот процесс начинается уже на 3–4-й нед., однако может продолжаться годами до полной регенерации (Mohammadi et al., 2018) (рис. 3).
Рис. 3.
Цитокины и факторы роста, принимающие участие в различных этапах регенерации кости. RANKL – Лиганд рецептора-активатора ядерного фактора каппа-В, OPG – остеопротегерин, M-CSF – макрофагальный колониестимулирующий фактор, TNF-α – фактор некроза опухоли-альфа, IL – интерлейкин, TGF-β – трансформирующий фактор роста-β, IGF-1 – инсулиноподобный фактор роста-1, PlGF – плацентарный фактор роста, PTH – паратиреоидный гормон, SDF-1 – фактор стромальных клеток-1, VEGF – эндотелиальный фактор роста сосудов, BMP – костный морфогенетический белок, FGF – фактор роста фибробластов, PDGF – тромбоцитарный фактор роста, MSCs – мезенхимальные стволовые клетки, Wnt – семейство сигнальных белков, GDF – фактор роста и дифференцировки, Ang – ангиопоэтин, CCL – фактор хемотаксиса моноцитов семейства CC-хемокин.

ФАКТОРЫ, СТИМУЛИРУЮЩИЕ ОСТЕОГЕНЕЗ И ВАСКУЛЯРИЗАЦИЮ
Важность кровеносных сосудов в образовании скелета и в восстановлении кости определили еще в XVIII в. (Kanczler, Oreffo, 2008). Тем не менее, исследование остеогенеза в течение следующего столетия было сосредоточено в основном на роли и функции остеобластов. В 1963 г. Труерта с коллегами предположили существование сосудистого стимулирующего фактора, который высвобождается в области перелома (Kanczler, Oreffo, 2008). Более глубокое понимание молекулярных и клеточных процессов, организующих ангиогенный каскад, может помочь разработать новые методы лечения травмы костей, особенно в клинических ситуациях с ограниченной ангиогенной реакцией организма при больших дефектах костей или переломах с обширной травмой мягких тканей.
Ключевые факторы, необходимые для васкуляризации, включают в себя ФР эндотелия сосудов (VEGF, vascular endothelial growth factor), семейство трансформирующего ФР (TGF-β, BMP-2, BMP-7 и BMP-9), FGF, плацентарный ФР (PlGF, placental growth factor), RANKL, ФР гепатоцитов (HGF, hepatocyte growth factor), PDGF, семейство инсулиноподобных факторов роста, ангиопоэтины (ANG 1 и 2, angiopoietin), бигликаны, эндотелин-1 и нейротрофины (Kanczler, Oreffo, 2008; Pearlin et al., 2018) (табл. 1).
Таблица 1.
ФР и белки, принимающие участие в регенерации костей
| ФР и белки | Миграция ММСК | Рост и проли-ферация ММСК | Остеогенная дифференци-ровка ММСК | Синтез матрикса | Ангио-генез | Индукция VEGF | Литературный источник |
|---|---|---|---|---|---|---|---|
| EGF | + | + | + | D’Mello et al., 2017 | |||
| PDGF-BB | + | + | + | + | + | Nyberg et al., 2016; D’Mello et al., 2017 | |
| TGF-β | + | + | + | + | + | То же | |
| BMP | + | + | + | + | + | » | |
| VEGF | + | + | + | + | » | ||
| FGF | + | + | + | + | » | ||
| Активин | + | + | D’Mello et al., 2017 | ||||
| IGF-1 | + | + | + | + | + | Nyberg et al., 2016; D’Mello et al., 2017 | |
| Wnt | + | D’Mello et al., 2017 | |||||
| Runx2 | + | + | Pearlin et al., 2018 | ||||
| Ангиопоэтин 1 и 2 | + | + | Stegen et al., 2015 | ||||
| TNF-α | + | + | Vo et al., 2012 | ||||
| Интерлейкин 1 и 6 | + | + | То же | ||||
| Интерферон-γ | + | + | » | ||||
| Простагландины | + | + | » | ||||
| PTH | + | + | + | » | |||
| Тромбин (ТP508) | + | + | + | + | Pountos et al., 2016 | ||
| OGP | + | + | + | + | То же | ||
| CGRP | + | + | + | » | |||
| Pepgen p15 | + | + | + | + | » | ||
| RGD-содержащий пептид | + | + | + | » |
Важнейшим условием при разработке скаффолдов с контролируемой системой доставки является выбор одного или более ФР для максимального улучшения регенерации костной ткани. В табл. 1 представлены основные ФР и другие белки, принимающие участие в регенерации кости. Подробный обзор вклада различных ФР можно найти в обзоре Каналис c соавторами (Canalis et al., 1993).
Различные ФР изучены в доклинических и клинических испытаниях (Mohammadi et al., 2018). Члены семейства трансформирующего ФР (TGF-β, активины, факторы дифференцировки роста, BMP и их различные изоформы) играют важную роль в эмбриональном развитии, морфогенезе, пролиферации и дифференцировке клеток (Vo et al., 2012). Известно, что TGF-β влияет на метаболизм остеопрогениторных клеток, модулирует воспалительный ответ и способствует ангиогенезу (Kim et al., 2005). IGF способствует пролиферации, минерализации и миграции остеопрогениторных клеток (Matsuda et al., 1992).
Семейство BMP, в частности BMP-2, BMP-4 и BMP-7, являются наиболее широко изученными остеогенными молекулами для индукции образования кости de novo, включая дефекты трубчатых костей критического размера (Vo et al., 2012). Есть данные, свидетельствующие о том, что применение BMP на различных моделях костных дефектов у животных приводит к увеличению в 1.2–50 раз костной массы и улучшению регенерации (Gothard et al., 2014). FDA одобрило использование BMP-2 при острых открытых переломах большеберцовой кости, поскольку большие многоцентровые рандомизированные исследования подтвердили его эффективность при переломах длинных трубчатых костей (Mohammadi et al., 2018). Продолжительное высвобождение BMP-2 способствует клеточной инфильтрации скаффолда и соответственно остеогенезу (Bagherifard, 2017). Исследования подтвердили зависимость регенерации от типа доставки и дозы BMP-2. Кроме того, BMP-2 стимулирует ангиогенез, что также в значительной степени увеличивает скорость заживления кости (Bagherifard, 2017) (табл. 2).
Таблица 2.
Применение биоактивных композитных скаффолдов с прямой доставкой ФР при большом дефекте длинных трубчатых костей
| Биоактивный материал (БМ) | Скаффолд | Модель | Результаты использования БМ | Литературный источник |
|---|---|---|---|---|
| ВMP-2 | Коллаген | Крыса | Бо́льшая площадь новой кости и улучшенные результаты механических испытаний | Tölli et al., 2011 |
| Желатин–ТКФ | Лошадь | Ускоренная регенерация кости | Tsuzuki et al., 2012 | |
| Коллаген | Мышь | БМ важен на ранних этапах регенерации, индуцируя пролиферацию и дифференцировку ММСК в хрящевую и костную ткань | Yu et al., 2010 | |
| Альгинат | Крыса | Функциональные осевые нагрузки и БМ увеличивают объем кости в пределах дефекта | Boerckel et al., 2012 | |
| ПЛГК | Овца | Лечение больших сегментных дефектов костей | Kirker-Head et al., 1998 | |
| ПЛГК–желатин | Собака | Потенциальный костный трансплантат у собак | Itoh et al., 1998 | |
| Коллаген | Кролик | БМ ускоряет скорость развития костной мозоли и коркового слоя, но не влияет на количество продуцируемой кости и хряща | Bax et al., 1999 | |
| Хитозан–ПЛГК | » | Раннее формирование кости со значительно улучшенной прочностью. | Jiang et al., 2010 | |
| ПКЛ–ТКФ | Овца | Ускоренное формирование кости, но структурные свойства аналогичны скаффолдам без БМ | Cipitria et al., 2015 | |
| Коллаген или желатин–ПКЛ или ПЛГК | Кролик | Результаты регенерации лучше при долгосрочном высвобождении БМ (до 4 нед). Быстрая доставка БМ приводит к тяжелому воспалительному ответу | Shim et al., 2014 | |
| Титан–гепарин или апатит | Крыса | Усиление горизонтального и вертикального образования кости. Наличие БМ не влияет на контакт кости с имплантом | Ishibe et al., 2009 | |
| ППФ–ТКФ | » | Улучшает регенерацию кости | Chu et al., 2007 | |
| Хитозан | Кролик | Применение БМ значительно увеличивает васкуляризацию с полным восстановлением через 12 нед | Cao et al., 2014 | |
| Альгинат | Крыса | Применение окисленного альгината для доставки БМ значительно повышает минеральную плотность костей через 8 нед и предполагает наличие более зрелой кости через 12 нед | Priddy et al., 2014 | |
| Коллаген–хитозан | Кролик | Перспективный носитель БМ при лечении дефектов костей | Hou et al., 2012 | |
| ПЭГ | » | Результаты лечения в группе БМ через 12 нед намного лучше, чем в контрольной | Yang et al., 2013a | |
| Коллаген | Человек | Усиление заживления раны и сращения перелома | Govender et al., 2002 | |
| Коллаген | » | Сокращение времени операции и снижение в 1.4 раза интраоперационной кровопотери | Tressler et al., 2011 | |
| Аллографт–коллаген | » | БМ безопасен и эффективен аналогично традиционной аутотрансплантации | Jones et al., 2006 | |
| Коллаген | » | БМ при открытых переломах снижает частоту трансплантации кости и вторичных вмешательств. Доказана клиническая эффективность применения скаффолда для лечения тяжелых открытых переломов | Swiontkowski et al., 2006 | |
| ПМК–пара-Д-ПЭГ | Собака | В группе с БМ через 12 нед восстановлены дефекты костей | Murakami et al., 2003 | |
| BMP-7 | Альгинат–хитозан–ДП-Г-ФХ | Кролик | Локальное контролируемое высвобождение, остеогенность и биосовместимость сводят к минимуму терапевтические дозы БМ и ускоряют дистракционный остеогенез | Haidar et al., 2010 |
| Коллаген | Обезьяна | Возможная альтернатива аллотрансплантации, устраняющая осложнения, связанные с забором аутокости, и риск заражения | Cook et al., 2002 | |
| Собака | Увеличение образования костной ткани в 1.5 раза | Takigami et al., 2007 | ||
| Коза | Увеличение образования костной ткани в 1.25 раза | Blokhuis et al., 2001 | ||
| Ауто- и аллографт | Собака | Увеличение образования костной ткани в 8.3 раза | Salkeld et al., 2001 | |
| Коллаген | Крыса | Улучшение регенерации дефектов кости в 29.5 раза | Kidder et al., 2009 | |
| Крыса | БМ сохраняет остеоиндуктивную способность при инфицированном сегментарном дефекте | Chen et al., 2002 | ||
| Человек | В группе с БМ отмечено значительное ускорение образование новой кости, что подтвердило остеогенную активность OP-1 | Geesink et al., 1999 | ||
| » | Скаффолд с БМ – безопасное и эффективное средство при несращенном переломе большеберцовой кости. Результаты сопоставимы с аутотрансплантацией | Friedlaender et al., 2001 | ||
| Аутографт | » | Добавление БМ к аутотрансплантату приводит к регенерации несрастающихся переломов в 100% случаев | Giannoudis et al., 2009 | |
| Коллаген | » | Стоимость лечения несрастающихся переломов можно уменьшить ранним применением БМ в случае сложного перелома или ложного сустава | Dahabreh et al., 2007 | |
| Собака | Аллогенный коллагеновый трансплантат в сочетании с БМ – эффективная замена аутотрансплантату | Fukuroku et al., 2007 | ||
| Коза | Локальное введение БМ на любом носителе ускоряет регенерацию закрытого перелома | den Boer et al., 2002 | ||
| ПКЛ–ТКФ | Овца | Результаты трансплантации эквивалентны аутотрансплантации или высокой дозе БМ | Cipitria et al., 2013 | |
| Коллаген | Человек | БМ ускоряет сращение переломов большеберцовой кости в условиях внешней фиксации | Ristiniemi et al., 2007 | |
| VEGF | ПМК | Мышь | Увеличение образования костной ткани в 1.65 раза. Повышение васкуляризации | Kanczler et al., 2008b |
| FGF | Нейлон-титан | » | Увеличение процентного объема кости в 5 раз | Carli et al., 2012 |
| PDGF | Коллаген | Крыса | Увеличение регенерация дефекта в 2.4–9 раз, объема кости – в 1.9–2.4 раза | Moore et al., 2009 |
| BMP-2 + VEGF | ППФ/ желатин–ПЛГК |
» | Эктопическое формирование костной ткани и отсутствие значимого синергетического эффекта от VEGF | Kempen et al., 2009 |
| BMP-2 + TGF-β | Титан–ПВБФ-со-ГМ | Кролик | Улучшенная способность к остеоинтеграции | Thorey et al., 2011 |
| BMP-2 + TGF-β | ПЛГК–АГАК–альгинат | Крыса | Неполное сращение и образование плотной минерализованной матрицы с достаточной интеграцией и механической прочностью по сравнению с контролем | Oest et al., 2007 |
| BMP-2 + FGF | Желатин | » | Стимуляция регенерации кости для BMP-2, тогда как bFGF не влиял на скорость регенерации. Совместное применение БМ тормозило остеогенез в условиях данного эксперимента | Wang et al., 2013b |
| BMP-2 + FGF | Пористый титан–желатин | » | Включение в пористый титановый скаффолд наноструктурированных коллоидных желатиновых гелей, позволяющих осуществлять время- и дозозависимую доставку BMP-2 и FGF-2, является многообещающей стратегией улучшения регенерации больших дефектов костей | van der Stok et al., 2013 |
| BMP-7 + PDGF | биостекло–шелк | » | Увеличение объема костей в области дефекта в 2 раза | Zhang et al., 2012 |
| BMP-7 + PDGF | ПКЛ–ТКФ | Овца | Скаффолды без ММСК и с их включением показали меньшую остеоиндуктивность по сравнению с аутотрансплантатами БМ. In vivo применение БМ позволяет преодолеть ограничения аутотрансплантата | Reichert et al., 2012 |
| BMP-7 + PTH | ТКФ | Кролик | Комбинация ФР приводит к увеличению объема кости, а также лучшей микроструктурной организации и интеграции этой кости с окружающими тканями | Morgan et al., 2008 |
| TGF-β + PDGF | ПЛГК | » | Увеличение образования костной ткани в 10 раз | Reyes et al., 2012 |
| BMP-2 + тобрамицин | Коллаген | Крыса | Площадь кости in vivo увеличена почти на 20% по сравнению с группой BMP-2 + тобрамицин | Glatt et al., 2009 |
| OGP | ПЛГК | Кролик | Повышение скорости формирования и объема кости | Shuqiang et al., 2008 |
| TP508 | ППФ | » | Улучшенная регенерация кости | Hedberg et al., 2005 |
| ППФ–ПЛГК | » | Инъекция БМ значительно улучшает процесс консолидации кости в модели дистракционного остеогенеза. Доставка БМ в микрочастицах ППФ–ПЛГК улучшает качество костного образования по сравнению с доставкой в солевом растворе | Wang et al., 2008 | |
| Биологически активный белок P-15 | ГАП + коллаген | Крыса | Имплантация неорганического костного матрикса с БМ оказывает положительное влияние на заживление костей, без иммунной реакции и риска инфицирования, в отличие от алло- и аутотрансплантации | Cakmak et al., 2006 |
| Человек | Полная консолидация переломов достигнута в 90% случаев. Применение неорганического костного матрикса с БМ – безопасная, экономичная и клинически полезная альтернатива аутотрансплантату | Gomar et al., 2007 |
Примечание. АГАК – Аргининглицинаспарагиновая кислота, ГАП – гидроксиапатит, ГК – гиалуроновая кислота, ДП-Г-ФХ – 1,2-дипальмитоил-Sn-глицеро-3-фосфохолин, КМЦ – карбоксиметилцеллюлоза, пара-Д-ПЭГ – пара-диоксанон-полиэтиленгликоль, ПВБФ-со-ГМ – поливинилбензола фосфонат-со-глицидилметакрилат, ПКЛ – поликапролактон, ПЛГК – полилактокогликолевая кислота, ПМК – полимолочная кислота, ППФ – полипропилен фумарат, ПЭГ – полиэтиленгликоль, ТКФ – трикальций-фосфат, ФС – фосфатидилсерин, TP508 – пептид тромбина 508.
Ангиогенез регулируется в основном такими ФР, как VEGF, PDGF, FGF и IGF. Исследования ангиогенных факторов для стимуляции регенерации костной ткани в основном фокусировались на роли VEGF в васкуляризации и миграции остеогенных клеток. Показано, что адресная доставка VEGF в область дефекта увеличивает плотность кровеносных сосудов и стимулирует регенерацию кости у кроликов и крыс (Vo et al., 2012). Недавние исследования показали, что комбинированная доставка VEGF с остеоиндуктивными ФР синергически усиливает остеогенез (Vo et al., 2012).
В табл. 2 представлены результаты исследований применения различных ФР в биоактивных композитных скаффолдах in vivo при больших дефектах длинных трубчатых костей у животных и человека. В последние годы выявлены новые ангиогенные факторы, которые секретируются остеобластами. Так, идентифицирован фактор DJ-1, продуцируемый ММСК человека (Kim et al., 2012), который индуцирует прямой ангиогенный ответ посредством активации FGF и косвенно регулирует ангиогенез путем повышения продукции VEGF остеобластами. Кроме того, DJ-1 стимулирует дифференцировку ММСК, а экзогенное введение DJ-1 улучшает регенерацию костных дефектов у грызунов.
Провоспалительные цитокины и ФР, включая TNF-α, IL, интерферон-γ и простагландины, стимулируют миграцию и дифференциацию остеобластов и остеокластов (Vo et al., 2012). Кроме того, их высвобождение активирует вторичный сигнальный каскад, необходимый для усиления ангиогенеза и восстановления кости. Для направленного прорегенеративного и прорезорбтивного действия воспалительных агентов, ряд исследователей предлагают также включать в скаффолды контролируемое высвобождение иммуномодулирующих и противовоспалительных агентов, таких как пептидные факторы, кортикостероиды и нестероидные противовоспалительные препараты (Vo et al., 2012) (табл. 2).
Поскольку повреждение кости связано с системным физиологическим ответом, важная роль в остеогенезе и ангиогенезе принадлежит системным регуляторам минерального обмена, таким как паратиреоидный гормон (ПТГ), гормон роста, стероиды, кальцитонин и витамин Д (Vo et al., 2012). Хотя механизм их влияния на остеогенную активность не изучен полностью, исследования показали, что периодическое действие ПТГ может стимулировать образование костей у крыс и людей. Введение кальцитонина и витамина Д также может усиливать ограниченное формирование кости и дифференцировку остеобластов (Vo et al., 2012).
Несмотря на явный потенциал и наличие методов, позволяющих производить факторы роста высокой чистоты в больших количествах, их применение при лечении переломов костей все еще значительно ограниченно. Системное введение ФР малоэффективно и может представлять опасность из-за нестабильности белка, неравномерного распределения in vivo и возможных нежелательных побочных эффектов. Требуется тщательное дозирование ФР, поскольку высокая доза и неконтролируемое высвобождение могут приводить к аномальному формированию костей и сосудов, фиброзу костного мозга, остеолизу, почечной недостаточности и экстрамедуллярному гемопоэзу (Кузнецова и др., 2014; Stegen et al., 2015; Bagherifard, 2017). Кроме того, при системном введении существует теоретическая опасность стимуляции канцерогенеза (Pountos et al., 2016).
Для разработки оптимального скаффолда требуются сохранение биоактивности ФР и контролируемое их высвобождение локально в оптимальной концентрации в течение необходимого периода времени (Кузнецова и др., 2014). Предложены различные стратегии доставки ФР в скаффолд. Возможно прямое включение за счет ковалентного или нековалентного связывания с полимером скаффолда или доставка с обогащенной тромбоцитами плазмой (PRP, platelet rich plasma), однако данный метод не позволяет контролировать процесс высвобождения ФР (Luginbuehl et al., 2004).
Возможно включение в состав скаффолда микрочастиц (микросферы, липосомы, гидрогели, наночастицы и нановолокна) (Luginbuehl et al., 2004), которые позволяют регулировать скорость резорбции. Однако есть ограничения при обработке скаффолдов, т.к. растворители и высокая температура разрушают микрочастицы.
Одним из подходов, который отвечает основным требованиям, необходимым для регенерации костей (остеокондуктивность и остеоиндуктивность), является использование скаффолдов, содержащих различные остеогенные клетки. Проведены успешные исследования биоактивных скаффолдов с добавленными in vitro культурами эндотелиальных клеток и ММСК (Park et al., 2012; Wang et al., 2013a). Показано, что ММСК модулируют иммунный ответ за счет секреции противовоспалительных цитокинов, таких как простагландины, оксид азота и IL-10, и подавления Т-клеточного ответа (Almubarak et al., 2016).
Методы тканевой инженерия позволяют использовать как соматические, так и стволовые клетки (D’Mello et al., 2017). В отличие от стволовых, соматические клетки обладают ограниченной потенцией, не обладают способностью к самообновлению и образуют только один тип клеток. В результате большая часть исследований сосредоточена на использовании ММСК, которые получают из жировой ткани, костного мозга, пуповины и зубов (зубная пульпа и периодонтальные связки). Эти клетки способны дифференцироваться в клетки костной ткани под влиянием соответствующих стимулов. Генетически модифицированные ММСК можно культивировать для получения различных комбинаций ФР, таких как FGF и VEGF, BMP-2 и BMP-7, а также VEGF и BMP-4 (D’Mello et al., 2017).
Проведены исследования различных материалов для культивирования клеток. При применении скаффолдов на основе фосфатов, гидроксиапатита и демиелинизированной кости наблюдали лучшие результаты по сравнению с бычьей губчатой костью (Huan, Chang, 2009; Verboket et al., 2018). Максимальный рост клеток и остеогенную дифференцировку отмечали при использовании демиелинизированной кости (Huan, Chang, 2009).
Появление 3D-печати позволило значительно расширить возможности включения в состав полимерных и керамических скаффолдов различных материалов, выступающих в качестве носителей биологически активных веществ. В 2017 г. Донг с соавторами методом 3D-печати получили скаффолд из поликапролактона в сочетании с чувствительными к температуре гидрогелем на основе хитозана и ФР (BMP-2) (Dong et al., 2017). При его трансплантации отмечали более высокую степень пролиферации, улучшенную адгезию ММСК, более эффективный остеогенез и формирование костной матрицы.
Еще одним активно изучаемым материалом стало биоактивное боратное стекло из-за его способности усиливать ангиогенез. Скаффолд из 3D-биоактивного стекла в сочетании с поликапролактоном, заселенный ММСК из жировой ткани, показал потенциальное улучшение остеогенеза in vitro (Murphy et al., 2017). Добавление мезопористого биологически активного стекла в скаффолд также привело к повышенной пролиферации костных стволовых клеток, адгезии, экспрессии остеогенных маркеров и увеличению образования костной ткани после трансплантации in vivo (Qi et al., 2017).
Несмотря на значительное количество успешных доклинических исследований применения ММСК в регенерации кости (табл. 3), существует ряд проблем, ограничивающих дальнейший переход в клинику: низкая выживаемость после имплантации, высокая стоимость культивирования, риск малигнизации и этические проблемы (Vo et al., 2012; Mohammadi et al., 2018). Чтобы увеличить продолжительность жизни клеток, которая напрямую зависит от васкуляризации, предложены методы совместной трансплантации ММСК с ангиогенными клетками, такими как эндотелиальные стволовые клетки (Zigdon-Giladi et al., 2015). Для получения достаточного количества клеток требуется несколько недель, что значительно увеличивает срок до проведения операции по замещению дефекта кости. Имеются свидетельства того, что в ходе этого процесса ММСК могут накапливать генетические мутации (Verboket et al., 2018).
Таблица 3.
Применение биоактивных композитных скаффолдов с непрямой доставкой ФР вирусными и невирусными векторами и стволовыми клетками in vivo при большом дефекте длинных трубчатых костей
| Биоактивный материал (БМ) | Скаффолд | Модель | Результаты использования БМ | Литературный источник |
|---|---|---|---|---|
| BMP-2 (pDNA) | Коллаген + ТКФ | Крыса | Улучшение регенерации костной ткани, снижение дозы плазмидной ДНК | Endo et al., 2006 |
| VEGF (pDNA) | Коллаген | Кролик | Улучшение образования костей и сосудов через 12 нед | Geiger et al., 2005 |
| VEGF (pDNA) | Коллаген–ТКФ | Мышь | Проведение трансфекции без дополнительных векторов и формирование кости | Keeney et al., 2010 |
| PTH и (или) BMP-4 (pDNA) | Коллаген | Крыса | Исследование демонстрирует, что можно генетически управлять восстановлением фибробластов кости in vivo | Fang et al., 1996 |
| PTH 1–34 (pDNA) | » | Собака | Имплантация ген-активированной матрицы в область дефекта позволяет осуществлять экспрессию плазмидной ДНК не менее 6 нед, и стабильно, воспроизводимо, время- и дозозависимо повышать регенерацию кости | Bonadio et al., 1999 |
| BMP-7 + PDGF (аденовирус) | Биостекло–шелк | Крыса | Исследование демонстрирует потенциальную способность генной терапии повышать остеоиндуктивность за счет замедленного высвобождения БМ, что может быть особенно полезно при переломах на фоне остеопороза | Zhang et al., 2012 |
| BMP-7 (ММСК) | Коралл | Коза | Увеличение образования костной ткани в 2.5 раза | Zhu et al., 2010 |
| VEGF (ММСК) | » | Кролик | В группах с доставкой VEGF прямым способом и VEGF-трансфицированными ММСК отмечена усиленная васкуляризация, остеогенез и резорбция скаффолда по сравнению с контрольной группой. Наибольшую степень остеогенеза отмечали в группе с ММСК костного мозга, а самую высокую васкуляризацию и быструю резорбцию скаффолда – в группе с VEGF-трансфицированными ММСК | Geiger et al., 2007 |
| FGF-2 (ММСК) | ТКФ | » | Применение FGF-трансфицированных ММСК может ускорить регенерацию кости, особенно при атрофических ложных суставах. | Guo et al., 2006 |
| ММСК костного мозга | ПКЛ | Овца | Доказана возможность заселения ПКЛ-скаффолда аутологичными ММСК | Rodrigues et al., 2011 |
| Биостекло–коллаген–ГК–ФС | Крыса | Скаффолд биосовместим и остеокондуктивен, включение трансплантированных ММСК усиливает регенерацию дефекта кости | Xu et al., 2010 | |
| ПМК–ПКЛ | Мышь | Усиление роста костной ткани в группе с ММСК костного мозга по сравнению с группой носителей скаффолда без клеток и контрольной группой | Khan et al., 2010 | |
| ПЛГК–ГАП | Кролик | Через 12 нед дефекты кости полностью восстановились со значительно лучшим образованием кости в группе ММСК костного мозга, засеянных на скаффолд ПЛГК−ГАП. Применение ГАП значительно улучшает жизнеспособность и скорость пролиферации клеток на ПЛГК-скаффолдах | Wang et al., 2013a | |
| ММСК костного мозга + VEGF + + PDGF | Гелевая мембрана PRP | » | Усиление регенерации костной ткани | El Backly et al., 2013 |
| ММСК жировой ткани | ПЛГК | Крыса | Восстановление дефекта большеберцовой кости ускоряется | Park et al., 2012 |
| ТКФ-коллаген | Кролик | Усиление остеогенеза в дефектах кости | Yang et al., 2013b | |
| Коллаген-ПЛГК–ТКФ | » | Улучшение остеогенеза | Hao et al., 2010 |
ГЕННОАКТИВИРОВАННЫЕ СКАФФОЛДЫ
Генная терапия позволяет осуществлять доставку необходимых для регенерации кости ФР и других белков посредством переноса нуклеиновых кислот в соматические клетки. Преимущество непрямой доставки заключается в том, что соответствующие концентрации остеогенных ФР стабильно создаются в конкретном участке. Показана возможность использования различных векторов для непрямой доставки ФР, таких как генетически модифицированные клетки или векторы с химически модифицированной РНК/ДНК (вирусные и невирусные), для естественного высвобождения ФР (Wang, Wang, 2006). Существуют две основные стратегии генной терапии для регенерации костной ткани. Как обсуждалось ранее, генная терапия на основе клеток включает в себя введение в организм генетически модифицированных клеток, несущих терапевтические гены. Более простой подход заключается в использовании прямой генной терапии, при которой терапевтические гены доставляются в организм с помощью вирусных или невирусных векторов. Эффективность прямой генной терапии для восстановления кости продемонстрирована с различными векторами на разных видах животных (табл. 3).
Необходимым фактором генной терапии является разработка систем доставки, способных преодолеть клеточные барьеры для эффективной трансфекции клеток in vivo (Malafaya et al., 2007). Вирусные и невирусные векторы имеют определенные недостатки. Вирусопосредованная доставка использует внутреннюю инфекционную способность аденовирусов, адено-ассоциированных вирусов (AAV) и ретровирусов, таких как лентивирус, для эффективной доставки генов (Vo et al., 2012). Вирусные векторы обладают иммунологическими рисками, ограниченным тропизмом и ограничением на размер введенного трансгена (Vo et al., 2012). Контролируемая доставка генов с использованием невирусных векторов включает в себя доставку ДНК в клетки либо напрямую, инъекцией, либо в натуральных или синтетических полимерных комплексах – липосомах (Vo et al., 2012). Эффективность невирусных систем трансфекции и соответственно уровень экспрессии трансгена низкие. С другой стороны, они обладают небольшой иммуногенностью, не имеют ограничений по размеру генов и просты в обращении, что делает их пригодными для массового производства.
Имплантированные скаффолды с генноактивированной матрицей в своем составе облегчают экспрессию генов и производство белка в течение длительного периода времени, тем самым стимулируя остеогенез и восстановление кости (Fang et al., 1996; Bonadio et al., 1999; Geiger et al., 2005; Endo et al., 2006; Keeney et al., 2010; Zhang et al., 2012). Локализованная генная терапия снижает системную токсичность, возникающую в результате демпинга дозы, который может возникать при прямой доставке ФР (D’Mello et al., 2017). Производить in vitro плазмидную ДНК в больших количествах относительно просто и экономично по сравнению с производством белка (D’Mello et al., 2017). Однако отсутствие доклинических испытаний на крупных животных вследствие высокой стоимости и трудоемкости продолжает оставаться серьезным барьером для клинических исследований. Кроме того, не исключена пока токсичность самих частиц для человека. Таким образом, необходимы дополнительные исследования для оценки иммунных и воспалительных реакций, возникающих при имплантации скаффолдов, содержащих плазмиды.
ЗАКЛЮЧЕНИЕ
Развитие тканевой инженерии способствует появлению альтернативных подходов к восстановлению костной ткани, которые потенциально могут повлиять на повседневную клиническую практику. Представленные данные литературы позволяют заключить, что на сегодняшний день методы тканевой инженерии позволяют создавать скаффолды, которые не уступают, а по ряду характеристик и превосходят ауто- и аллотрансплантаты костной ткани.
Эволюция скаффолдов для стимуляции регенерации костной ткани характеризуется постепенным смещением акцентов от оптимальных биомеханических и остеоиндуктивных характеристик у недеградируемых имплантатов к биорезорбции и остеиндуктивным свойствам, позволяющим активировать естественные репаративные процессы костей. Современные скаффолды для костной ткани являются многокомпонентными трехмерными системами, сочетающими высокую биомеханическую прочность, оптимальную геометрию, включая большое соотношение площади поверхности к объему, с биосоместимостью и способностью к биорезорбции с определенной скоростью. Изготовление таких скаффолдов требует иерархического проектирования от нано- до микроструктурного уровня для имитации костной матрицы и создания платформ, которые можно было бы фиксировать в зоне дефекта. Сочетание нанотехнологий с другими технологиями производства, такими как компьютерные методы изготовления и биообработки материала, обеспечивает возможность создания скаффолдов, обладающих требуемыми физико-химическими свойствами, из неорганических, природных и синтетических материалов в различных конфигурациях.
Характерным признаком современного этапа развития технологий получения скаффолдов является использование разнообразных биологически активных компонентов. Результаты исследований физиологических и репаративных механизмов остеогенеза позволяют выделить ряд ключевых регуляторов для использования при создании скаффолдов. Кроме того, следует отметить, что в рамках данного направления уже в течение многих лет разрабатывается концепция терапевтического ангиогенеза. Как обсуждалось в настоящем обзоре, доклинические данные указывают на то, что локальная доставка ангиогенных ФР коррелирует с положительным результатом регенерации костей. На сегодняшний день среди ангиогенных и остеогенных факторов роста наиболее часто в состав скаффолдов включаются молекулы семейств BMP, VEGF и FGF. Вместе с тем исследование других факторов, обеспечивающих функциональные взаимосвязи ангио- и остеогенеза, в том числе цитокинов и микроРНК, может помочь в разработке новых методов лечения, а идентификация наиболее эффективного фактора или комбинаций факторов роста и их профилей высвобождения в разных дефектах костей может повысить остеоиндуктивность in vivo.
Идеальный скаффолд для поддержания роста кости должен обеспечивать устойчивое высвобождение ФР и ангиогенных факторов. В литературе имеется целый комплекс современных исследований технологий адресной доставки биологически активных веществ скаффолдами, которые посвящены решению проблем, связанных с пространственно-временны́м высвобождением ФР, долговечностью, биоактивностью и кинетикой их высвобождения. Данные литературы свидетельствуют о том, что использование композитных скаффолдов, содержащих различные биоматериалы, гидрогели и полимеры, позволяет осуществлять успешную доставку и долгосрочную активность ФР.
Альтернативным вариантом создания высоких концентраций ФР в зоне имплантации скаффолдов является генная терапия с использованием вирусных/невирусных векторов и стволовых клеток. Эффективность генной терапии продемонстрирована с различными векторами на различных животных моделях, что обусловливает перспективы ее использования для доставки ФР in vivo. Однако использование технологий генной терапии требует дальнейшего поиска более безопасных и эффективных средств доставки, а также новых остеогенных генов. Применение стволовых клеток, в том числе предварительно дифференцированных популяций остеогенных клеток, повышает терапевтическую эффективность скаффолдов. Данные ряда авторов демонстрируют хорошие результаты применения биоактивных скаффолдов с генетически модифицированными ММСК (продуцирующими различные комбинации ФР) для стимуляции регенерации костной ткани в эксперименте (Park et al., 2012; Wang et al., 2013a; D’Mello et al., 2017). Дальнейшее понимание механизмов формирования костей при использовании различных видов клеток и идентификация новых источников клеток позволят усовершенствовать технологии регенерации костной ткани.
Разработки в области тканевой инженерии имеют многочисленные ограничения, некоторые из которых уже решаются к этому времени, а многие другие еще должны быть решены. Ожидается, что тенденции в развитии генной инженерии, связанные с использованием новаторских технологий производства соответствующих платформ для создания комбинированных биоактивных скаффолдов, позволят значительно снизить финансовое и социальное бремя болезней, уменьшить частоту хирургических осложнений, сократить время госпитализации, минимизировать цитотоксичность и побочное действие, обеспечивая своевременное индивидуальное лечение. Наиболее перспективные результаты могут быть достигнуты при разработке мультидисциплинарных подходов, которые интегрируют биологические и инженерные разработки в тесном сотрудничестве с материаловедами, клиницистами и инженерами.
Список литературы
Иванов А.Н., Козадаев М.Н., Пучиньян Д.М., Сальковский Ю.Е., Норкин И.А. 2015. Изменения микроциркуляции при стимуляции регенерации тканей скаффолдом на основе поликапролактона. Регионарное кровообращение и микроциркуляция. 14 : 70–75. (Ivanov A.N., Kozadaev M.N., Puchin’yan D.M., Sal’kovskii Yu.E., Norkin I.A. 2015. Microcirculatory changes during stimulation of tissue regeneration by polycaprolactone scaffold. Regional Haemodynamics and Microcirculation. 14 : 70–75.)
Кузнецова Д.С., Тимашев П.С., Баграташвили В.Н., Загайнова Е.В. 2014. Костные имплантаты на основе скаффолдов и клеточных систем в тканевой инженерии (обзор). Современные технологии в медицине. 6 : 201–212. (Kuznetsova D.S., Timashev P.S., Bagratashvili V.N., Zagainova Ye.V. 2014. Scaffold- and cell system-based bone grafts in tissue engineering (review). Modern technologies in Medicine. 6 : 201–212.)
Ai-Aql Z.S., Alagl A.S., Graves D.T., Gerstenfeld L.C., Einhorn T.A. 2008. Molecular mechanisms controlling bone formation during fracture healing and distraction osteogenesis. J. Dent. Res. 87 : 107–118.
Almubarak S., Nethercott H., Freeberg M., Beaudon C., Jha A., Jackson W., Marcucio R., Miclau T., Healy K., Bahney C. 2016. Tissue engineering strategies for promoting vascularized bone regeneration. Bone. 83 : 197–209.
Bagherifard S. 2017. Mediating bone regeneration by means of drug eluting implants: from passive to smart strategies. Mater. Sci. Eng. C. Mater. Biol. Appl. 71 : 1241–1252.
Bao P., Kodra A., Tomic-Canic M., Golinko M. S., Ehrlich H. P., Brem H. 2009. The role of vascular endothelial growth factor in wound healing. J. Surg. Res. 153 : 347–358.
Bax B.E., Wozney J.M., Ashhurst D.E. 1999. Bone morphogenetic protein-2 increases the rate of callus formation after fracture of the rabbit tibia. Calcified tissue international. 65 : 83–89.
Blokhuis T.J., den Boer F.C., Bramer J.A., Jenner J.M., Bakker F.C., Patka P., Haarman H.J. 2001. Biomechanical and histological aspects of fracture healing, stimulated with osteogenic protein-1. Biomaterials. 22 : 725–730.
Boerckel J.D., Kolambkar Y.M., Stevens H.Y., Lin A.S.P., Dupont K.M., Guldberg R.E. 2012. Effects of in vivo mechanical loading on large bone defect regeneration. J. Orthop. Res. 30 : 1067–1075.
Bonadio J., Smiley E., Patil P., Goldstein S. 1999. Localized, direct plasmid gene delivery in vivo: prolonged therapy results in reproducible tissue regeneration. Nature Medicine. 5 : 753–759.
Bose S., Roy M., Bandyopadhyay A. 2012. Recent advances in bone tissue engineering scaffolds. Trends in Biotechnol. 30 : 546–554.
Cakmak G., Bolukbasi S., Simsek A., Erdem O., Yilmaz G., Senkoylu A. 2006. Effect of synthetic cell-binding peptide on the healing of cortical segmental bone defects. Saudi Med. J. 27 : 777–780.
Canalis E., Pash J., Varghese S. 1993. Skeletal growth factors. Critical Reviews in Eukaryotic Gene Expression. 3 : 155–166.
Cao L., Wang J., Hou J., Xing W., Liu C. 2014. Vascularization and bone regeneration in a critical sized defect using 2-N,6-O-sulfated chitosan nanoparticles incorporating BMP-2. Biomaterials. 35 : 684–698.
Carli A., Gao C., Khayyat-Kholghi M., Li A., Wang H., Ladel C., Harvey E.J., Henderson J.E. 2012. FGF18 augments osseointegration of intra-medullary implants in osteopenic FGFR3(–/–) mice. Europ. Cells & Materials. 24 : 107–167.
Chen X., Kidder L.S., Lew W.D. 2002. Osteogenic protein-1 induced bone formation in an infected segmental defect in the rat femur. J. Orthop. Res: Official Publication of the Orthopaedic Research Society. 20 : 142–150.
Chu T.-M.G., Warden S.J., Turner C.H., Stewart R.L. 2007. Segmental bone regeneration using a load-bearing biodegradable carrier of bone morphogenetic protein-2. Biomaterials. 28 : 459–467.
Cipitria A., Reichert J.C., Epari D.R., Saifzadeh S., Berner A., Schell H., Mehta M., Schuetz M.A., Duda G.N., Hutmacher D.W. 2013. Polycaprolactone scaffold and reduced rhBMP-7 dose for the regeneration of critical-sized defects in sheep tibiae. Biomaterials. 34 : 9960–9968.
Cipitria A., Wagermaier W., Zaslansky P., Schell H., Reichert J.C., Fratzl P., Hutmacher D.W., Duda G.N. 2015. BMP delivery complements the guiding effect of scaffold architecture without altering bone microstructure in critical-sized long bone defects: A multiscale analysis. Acta biomaterialia. 23 : 282–294.
Cook S.D., Salkeld S.L., Patron L.P., Sargent M.C., Rueger D.C. 2002. Healing course of primate ulna segmental defects treated with osteogenic protein-1. J. Invest. Surg. 15 : 69–79.
Correia C., Bhumiratana S., Yan L.-P., Oliveira A.L., Gimble J.M., Rockwood D., Kaplan D.L., Sousa R.A., Reis R.L., Vunjak-Novakovic G. 2012. Development of silk-based scaffolds for tissue engineering of bone from human adipose-derived stem cells. Acta biomaterialia. 8 : 2483–2492.
Dahabreh Z., Dimitriou R., Giannoudis P.V. 2007. Health economics: a cost analysis of treatment of persistent fracture non-unions using bone morphogenetic protein-7. Injury. 38 : 371–377.
Den Boer F.C., Bramer J.A.M., Blokhuis T.J., Van Soest E.J., Jenner J.M.G.T., Patka P., Bakker F.C., Burger E.H., Haarman H.J.T.M. 2002. Effect of recombinant human osteogenic protein-1 on the healing of a freshly closed diaphyseal fracture. Bone. 31 : 158–164.
D’Mello S., Atluri K., Geary S.M., Hong L., Elangovan S., Salem A.K. 2017. Bone regeneration using gene-activated matrices. The AAPS J. 19 : 43–53.
Dong L., Wang S.-J., Zhao X.-R., Zhu Y.-F., Yu J.-K. 2017. 3D-printed poly(ε-caprolactone) scaffold integrated with cell-laden chitosan hydrogels for bone tissue engineering. Scientific Reports. 7 : 13412.
El Backly R.M., Zaky S.H., Muraglia A., Tonachini L., Brun F., Canciani B., Chiapale D., Santolini F., Cancedda R., Mastrogiacomo M. 2013. A platelet-rich plasma-based membrane as a periosteal substitute with enhanced osteogenic and angiogenic Properties: a new concept for bone repair. Tissue Eng. Part A. 19 : 152–165.
Endo M., Kuroda S., Kondo H., Maruoka Y., Ohya K., Kasugai S. 2006. Bone regeneration by modified gene-activated matrix: effectiveness in segmental tibial defects in rats. Tissue Eng. 12 : 489–497.
Fang J., Zhu Y.Y., Smiley E., Bonadio J., Rouleau J.P., Goldstein S.A., McCauley L.K., Davidson B.L., Roessler B.J. 1996. Stimulation of new bone formation by direct transfer of osteogenic plasmid genes. Proc. Nat. Acad. Sci. USA. 93 : 5753–5758.
Friedlaender G.E., Perry C.R., Cole J.D., Cook S.D., Cierny G., Muschler G.F., Zych G.A., Calhoun J.H., LaForte A.J., Yin S. 2001. Osteogenic protein-1 (bone morphogenetic protein-7) in the treatment of tibial nonunions. J. Bone Joint Surg. Amer. 83–A. Suppl 1. : S151–158.
Fukuroku J., Inoue N., Rafiee B., Sim F.H., Frassica F.J., Chao E.Y.S. 2007. Extracortical bone-bridging fixation with use of cortical allograft and recombinant human osteogenic protein-1. J. Bone Joint Surg. Amer. 89 : 1486–1496.
Geesink R.G., Hoefnagels N.H., Bulstra S.K. 1999. Osteogenic activity of OP-1 bone morphogenetic protein (BMP-7) in a human fibular defect. J. Bone Joint Surg. Br. 81 : 710–718.
Geiger F., Bertram H., Berger I., Lorenz H., Wall O., Eckhardt C., Simank H.-G., Richter W. 2005. Vascular endothelial growth factor gene-activated matrix (VEGF165-GAM) enhances osteogenesis and angiogenesis in large segmental bone defects. J. Bone and Mineral Res. 20 : 2028–2035.
Geiger F., Lorenz H., Xu W., Szalay K., Kasten P., Claes L., Augat P., Richter W. 2007. VEGF producing bone marrow stromal cells (BMSC) enhance vascularization and resorption of a natural coral bone substitute. Bone. 41 : 516–22.
Giannoudis P.V, Dinopoulos H., Tsiridis E. 2005. Bone substitutes: an update. Injury. 36, Suppl. 3 : S20–S27.
Giannoudis P.V, Kanakaris N.K., Dimitriou R., Gill I., Kolimarala V., Montgomery R.J. 2009. The synergistic effect of autograft and BMP-7 in the treatment of atrophic nonunions. Clin. Orthop. Relat. Res. 467 : 3239–3248.
Glatt V., Kwong F.N., Park K., Parry N., Griffin D., Vrahas M., Evans C.H., Harris M. 2009. Ability of recombinant human bone morphogenetic protein 2 to enhance bone healing in the presence of tobramycin: evaluation in a rat segmental defect model. J. Orthop. Trauma. 23 : 693–701.
Gomar F., Orozco R., Villar J.L., Arrizabalaga F. 2007. P-15 small peptide bone graft substitute in the treatment of non-unions and delayed union. A pilot clinical trial. Int. Orthop. 31 : 93–99.
Goonoo N., Bhaw-Luximon A., Passanha P., Esteves S.R., Jhurry D. 2017. Third generation poly(hydroxyacid) composite scaffolds for tissue engineering. J. Biomed. Mater. Res. B. Appl. Biomater. 105 : 1667–1684.
Gothard D., Smith E.L., Kanczler J.M., Rashidi H., Qutachi O., Henstock J., Rotherham M., El Haj A., Shakesheff K.M., Oreffo R.O.C. 2014. Tissue engineered bone using select growth factors: a comprehensive review of animal studies and clinical translation studies in man. Eur. Cells and Materials. 28 : 166–208.
Govender S., Csimma C., Genant H.K., Valentin-Opran A., Amit Y., Arbel R., Aro H., Atar D., Bishay M., Börner M.G., Chiron P., Choong P., Cinats J., Courtenay B., Feibel R., Geulette B., Gravel C., Haas N., Raschke M., Hammacher E., van der Velde D., Hardy P., Holt M., Josten C., Ketterl R.L., Lindeque B., Lob G., Mathevon H., McCoy G., Marsh D., Miller R., Munting E., Oevre S., Nordsletten L., Patel A., Pohl A., Rennie W., Reynders P., Rommens P.M., Rondia J., Rossouw W.C., Daneel P.J., Ruff S., Rüter A., Santavirta S., Schildhauer T.A., Gekle C., Schnettler R., Segal D., Seiler H., Snowdowne R.B., Stapert J., Taglang G., Verdonk R., Vogels L., Weckbach A., Wentzensen A., Wisniewski T., BMP-2 Evaluation in Surgery for Tibial Trauma (BESTT) Study Group. 2002. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures: a prospective, controlled, randomized study of four hundred and fifty patients. J. Bone Joint Surg. Amer. 84–A : 2123–2134.
Guo X., Zheng Q., Kulbatski I., Yuan Q., Yang S., Shao Z., Wang H., Xiao B., Pan Z., Tang S. 2006. Bone regeneration with active angiogenesis by basic fibroblast growth factor gene transfected mesenchymal stem cells seeded on porous beta-TCP ceramic scaffolds. Biomed. Materials (Bristol, England). 1 : 93–99.
Haidar Z.S., Tabrizian M., Hamdy R.C. 2010. A hybrid rhOP-1 delivery system enhances new bone regeneration and consolidation in a rabbit model of distraction osteogenesis. Growth Factors (Chur, Switzerland). 28 : 44–55.
Hao W., Pang L., Jiang M., Lv R., Xiong Z., Hu Y.-Y. 2010. Skeletal repair in rabbits using a novel biomimetic composite based on adipose-derived stem cells encapsulated in collagen I gel with PLGA-beta-TCP scaffold. J. Orthop. Res. 28 : 252–257.
Hedberg E.L., Kroese-Deutman H.C., Shih C.K., Crowther R.S., Carney D.H., Mikos A.G., Jansen J.A. 2005. Effect of varied release kinetics of the osteogenic thrombin peptide TP508 from biodegradable, polymeric scaffolds on bone formation in vivo. J. Biomed. Mater. Res. A. 72 : 343–353.
Hou J., Wang J., Cao L., Qian X., Xing W., Lu J., Liu C. 2012. Segmental bone regeneration using rhBMP-2-loaded collagen/chitosan microspheres composite scaffold in a rabbit model. Biomed. Materials (Bristol, England). 7 : 35002.
Huan Z., Chang J. 2009. Novel bioactive composite bone cements based on the β-tricalcium phosphate–monocalcium phosphate monohydrate composite cement system. Acta Biomaterialia. 5 : 1253–1264.
Ishibe T., Goto T., Kodama T., Miyazaki T., Kobayashi S., Takahashi T. 2009. Bone formation on apatite-coated titanium with incorporated BMP-2/heparin in vivo. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontics. 108 : 867–75.
Itoh T., Mochizuki M., Nishimura R., Matsunaga S., Kadosawa T., Kokubo S., Yokota S., Sasaki N. 1998. Repair of ulnar segmental defect by recombinant human bone morphogenetic protein-2 in dogs. J. Vet. Med. Sci. 60 : 451–458.
Ivanov A.N., Kozadaev M.N., Bogomolova N.V., Matveeva O.V., Puchin’yan M.D., Norkin I.A., Salkovsky Y.E., Lyubun G.P. 2015. Biocompatibility of polycaprolactone and hydroxyapatite matrices in vivo. Cell and Tissue Biol. 9 : 422–429.
James R., Deng M., Laurencin C.T., Kumbar S.G., James R., Deng M., Laurencin C.T., Kumbar S.G. 2011. Nanocomposites and bone regeneration. Frontiers of Materials Science. 5 : 342–357.
Jiang T., Nukavarapu S.P., Deng M., Jabbarzadeh E., Kofron M.D., Doty S.B., Abdel-Fattah W.I., Laurencin C.T. 2010. Chitosan-poly(lactide-co-glycolide) microsphere-based scaffolds for bone tissue engineering: in vitro degradation and in vivo bone regeneration studies. Acta biomaterialia. 6 : 3457–3470.
Jones A.L., Bucholz R.W., Bosse M.J., Mirza S.K., Lyon T.R., Webb L.X., Pollak A.N., Golden J.D., Valentin-Opran A., BMP-2 Evaluation in Surgery for Tibial Trauma-Allgraft (BESTT-ALL) Study Group. 2006. Recombinant human BMP-2 and allograft compared with autogenous bone graft for reconstruction of diaphyseal tibial fractures with cortical defects. A randomized, controlled trial. J. Bone Joint Surg. Amer. 88 : 1431–1441.
Kanczler J.M., Ginty P.J., Barry J.J.A., Clarke N.M.P., Howdle S.M., Shakesheff K.M., Oreffo R.O.C. 2008. The effect of mesenchymal populations and vascular endothelial growth factor delivered from biodegradable polymer scaffolds on bone formation. Biomaterials. 29 : 1892–1900.
Kanczler J.M., Oreffo R.O.C. 2008. Osteogenesis and angiogenesis: the potential for engineering bone. Eur. Cells & Materials. 15 : 100–114.
Karageorgiou V., Kaplan D. 2005. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 : 5474–5491.
Keeney M., van den Beucken J.J.J.P., van der Kraan P.M., Jansen J.A., Pandit A. 2010. The ability of a collagen/calcium phosphate scaffold to act as its own vector for gene delivery and to promote bone formation via transfection with VEGF165. Biomaterials. 31 : 2893–2902.
Kempen D.H.R., Lu L., Heijink A., Hefferan T.E., Creemers L.B., Maran A., Yaszemski M.J., Dhert W.J.A. 2009. Effect of local sequential VEGF and BMP-2 delivery on ectopic and orthotopic bone regeneration. Biomaterials. 30 : 2816–2825.
Khan F., Tare R.S., Kanczler J.M., Oreffo R.O.C., Bradley M. 2010. Strategies for cell manipulation and skeletal tissue engineering using high-throughput polymer blend formulation and microarray techniques. Biomaterials. 31 : 2216–2228.
Kidder L.S., Chen X., Schmidt A.H., Lew W.D. 2009. Osteogenic protein-1 overcomes inhibition of fracture healing in the diabetic rat: a pilot study. Clin. Orthop. Related Research. 467 : 3249–3256.
Kim I.Y., Kim M.M., Kim S.-J. 2005. Transforming growth factor-beta: biology and clinical relevance. J. Biochem. Mol. Biol. 38 : 1–8.
Kim J.-M., Shin H.-I., Cha S.-S., Lee C. S., Hong B. S., Lim S., Jang H.-J., Kim J., Yang Y.R., Kim Y.-H., Yang Y.R., Kim Y.H., Yun S., Rijal G., Lee-Kwon W., Seo J.K., Gho Y.S., Ryu S.H., Hur E.M., Suh P.G. 2012. DJ-1 promotes angiogenesis and osteogenesis by activating FGF receptor-1 signaling. Nature Commun. 3 : 1296.
Kirker-Head C.A., Gerhart T.N., Armstrong R., Schelling S.H., Carmel L.A. 1998. Healing bone using recombinant human bone morphogenetic protein 2 and copolymer. Clin. Orthop. Relat. Res. 349 : 205–217.
Laschke M.W., Strohe A., Scheuer C., Eglin D., Verrier S., Alini M., Pohlemann T., Menger M.D. 2009. In vivo biocompatibility and vascularization of biodegradable porous polyurethane scaffolds for tissue engineering. Acta Biomaterialia. 5 : 1991–2001.
Laurencin C., Khan Y., El-Amin S. F. 2006. Bone graft substitutes. Expert Review of Medical Devices. 3 : 49–57.
Lin L., Wang H., Ni M., Rui Y., Cheng T.-Y., Cheng C.-K., Pan X., Li G., Lin C. 2014. Enhanced osteointegration of medical titanium implant with surface modifications in micro/nanoscale structures. J. Orthop. Translation. 2 : 35–42.
Luginbuehl V., Meinel L., Merkle H.P., Gander B. 2004. Localized delivery of growth factors for bone repair. Eur. J. Pharm. Biopharm. 58 : 197–208.
Malafaya P.B., Silva G.A., Reis R.L. 2007. Natural–origin polymers as carriers and scaffolds for biomolecules and cell delivery in tissue engineering applications. Adv. Drug Deliv. Rev. 59 : 207–233.
Marsell R., Einhorn T.A. 2011. The biology of fracture healing. Injury. 42 : 551–555.
Marzona L., Pavolini B. 2009. Play and players in bone fracture healing match. Clin. Cases Miner. Bone Metab. 6 : 159–162.
Matsuda N., Lin W.-L., Kumar N.M., Cho M.I., Genco R.J. 1992. Mitogenic, chemotactic, and synthetic responses of rat periodontal ligament fibroblastic cells to polypeptide growth factors in vitro. J. Periodontol. 63 : 515–525.
Mohammadi M., Mousavi Shaegh S.A., Alibolandi M., Ebrahimzadeh M.H., Tamayol A., Jaafari M.R., Ramezani M. 2018. Micro and nanotechnologies for bone regeneration: recent advances and emerging designs. J. Controlled release. 274 : 35–55.
Moore D.C., Ehrlich M.G., McAllister S.C., Machan J.T., Hart C.E., Voigt C., Lesieur-Brooks A.M., Weber E.W. 2009. Recombinant human platelet-derived growth factor-BB augmentation of new-bone formation in a rat model of distraction osteogenesis. J. Bone Joint Surg. Amer. 91 : 1973–1984.
Morgan E.F., Mason Z.D., Bishop G., Davis A.D., Wigner N.A., Gerstenfeld L.C., Einhorn T.A. 2008. Combined effects of recombinant human BMP-7 (rhBMP-7) and parathyroid hormone (1-34) in metaphyseal bone healing. Bone. 43 : 1031–1038.
Murakami N., Saito N., Takahashi J., Ota H., Horiuchi H., Nawata M., Okada T., Nozaki K., Takaoka K. 2003. Repair of a proximal femoral bone defect in dogs using a porous surfaced prosthesis in combination with recombinant BMP-2 and a synthetic polymer carrier. Biomaterials. 24 : 2153–2159.
Murphy C., Kolan K., Li W., Semon J.A., Semon J., Day D., Leu M. 2017. 3D bioprinting of stem cells and polymer/bioactive glass composite scaffolds for bone tissue engineering. Int. J. Bioprint. 33 : 53–63.
Nyberg E., Holmes C., Witham T., Grayson W.L. 2016. Growth factor-eluting technologies for bone tissue engineering. Drug Deliv. Transl. Res. 6 : 184–194.
Oest M.E., Dupont K.M., Kong H.-J., Mooney D.J., Guldberg R.E. 2007. Quantitative assessment of scaffold and growth factor-mediated repair of critically sized bone defects. J. Orthop. Res. 25 : 941–950.
Oryan A., Alidadi S., Moshiri A., Maffulli N. 2014. Bone regenerative medicine: classic options, novel strategies, and future directions. J. Orthop. Surg. Res. 9 : 18.
Park B.-H., Zhou L., Jang K.Y., Park H.S., Lim J.M., Yoon S.J., Lee S.Y., Kim J.R. 2012. Enhancement of tibial regeneration in a rat model by adipose-derived stromal cells in a PLGA scaffold. Bone. 51 : 313–323.
Pearlin J., Nayak S., Manivasagam G., Sen D. 2018. Progress of regenerative therapy in orthopedics. Curr. Osteoporosis Rep. 16 : 169–181.
Pountos I., Panteli M., Lampropoulos A., Jones E., Calori G.M., Giannoudis P.V. 2016. The role of peptides in bone healing and regeneration: a systematic review. BMC Medicine. 14 : 103.
Priddy L.B., Chaudhuri O., Stevens H.Y., Krishnan L., Uhrig B.A., Willett N.J., Guldberg R.E. 2014. Oxidized alginate hydrogels for bone morphogenetic protein-2 delivery in long bone defects. Acta biomaterialia. 10 : 4390–4399.
Qi X., Pei P., Zhu M., Du X., Xin C., Zhao S., Li X., Zhu Y. 2017. Three dimensional printing of calcium sulfate and mesoporous bioactive glass scaffolds for improving bone regeneration in vitro and in vivo. Sci. Rep. 7 : 42556.
Reichert J.C., Cipitria A., Epari D.R., Saifzadeh S., Krishnakanth P., Berner A., Woodruff M.A., Schell H., Mehta M., Schuetz M.A., Duda G.N., Hutmacher D.W. 2012. A tissue engineering solution for segmental defect regeneration in load-bearing long bones. Sci. Translational Med. 4 : 141ra93.
Reyes R., De la Riva B., Delgado A., Hernández A., Sánchez E., Évora C. 2012. Effect of triple growth factor controlled delivery by a brushite-PLGA system on a bone defect. Injury. 43 : 334–342.
Ristiniemi J., Flinkkilä T., Hyvönen P., Lakovaara M., Pakarinen H., Jalovaara P. 2007. RhBMP-7 accelerates the healing in distal tibial fractures treated by external fixation. J. Bone Joint Surg. Br. 89 : 265–272.
Rodrigues M.T., Gomes M.E., Viegas C.A., Azevedo J.T., Dias I.R., Guzón F.M., Reis R.L. 2011. Tissue-engineered constructs based on SPCL scaffolds cultured with goat marrow cells: functionality in femoral defects. J. Tissue Eng. Regen. Med. 5 : 41–49.
Salkeld S.L., Patron L.P., Barrack R.L., Cook S.D. 2001. The effect of osteogenic protein-1 on the healing of segmental bone defects treated with autograft or allograft bone. J. Bone Joint Surg. Amer. 83 : 803–816.
Santos S.G., Lamghari M., Almeida C.R., Oliveira M.I., Neves N., Ribeiro A.C., Barbosa J.N., Barros R., Maciel J., Martins M.C.L., Gonçalves R.M., Barbosa M.A. 2013. Adsorbed fibrinogen leads to improved bone regeneration and correlates with differences in the systemic immune response. Acta biomaterialia. 9 : 7209–7217.
Shim J.-H., Kim S.E., Park J.Y., Kundu J., Kim S.W., Kang S.S., Cho D.-W. 2014. Three-dimensional printing of rhBMP-2-loaded scaffolds with long-term delivery for enhanced bone regeneration in a rabbit diaphyseal defect. Tissue Eng. Part A. 20 : 1980–1992.
Shuqiang M., Kunzheng W., Xiaoqiang D., Wei W., Mingyu Z., Daocheng W. 2008. Osteogenic growth peptide incorporated into PLGA scaffolds accelerates healing of segmental long bone defects in rabbits. J. Plast. Reconstr. Aesthet. Surg. 61 : 1558–60.
Stegen S., van Gastel N., Carmeliet G. 2015. Bringing new life to damaged bone: the importance of angiogenesis in bone repair and regeneration. Bone. 70 : 19–27.
Stroncek J.D., Reichert W.M. 2008. Overview of wound healing in different tissue types. In: Indwelling neural implants: strategies for contending with the in vivo environment. Atlanta: CRC Press/Taylor and Francis. 153 p.
Swiontkowski M.F., Aro H.T., Donell S., Esterhai J.L., Goulet J., Jones A., Kregor P.J., Nordsletten L., Paiement G., Patel A. 2006. Recombinant human bone morphogenetic protein-2 in open tibial fractures. A subgroup analysis of data combined from two prospective randomized studies. J. Bone Joint Surg. Amer. 88 : 1258–1265.
Takigami H., Kumagai K., Latson L., Togawa D., Bauer T., Powell K., Butler R.S., Muschler G.F. 2007. Bone formation following OP-1 implantation is improved by addition of autogenous bone marrow cells in a canine femur defect model. J. Orthop. Res. 25 : 1333–1342.
Thorey F., Menzel H., Lorenz C., Gross G., Hoffmann A., Windhagen H. 2011. Osseointegration by bone morphogenetic protein-2 and transforming growth factor beta2 coated titanium implants in femora of New Zealand white rabbits. Ind. J. Orthop. 45 : 57–62.
Tölli H., Kujala S., Jämsä T., Jalovaara P. 2011. Reindeer bone extract can heal the critical-size rat femur defect. Int. Orthopaedics. 35 : 615–622.
Tressler M.A., Richards J.E., Sofianos D., Comrie F.K., Kregor P.J., Obremskey W.T. 2011. Bone morphogenetic protein-2 compared to autologous iliac crest bone graft in the treatment of long bone nonunion. Orthopaedics. 34 : e877–e884.
Tsuzuki N., Otsuka K., Seo J., Yamada K., Haneda S., Furuoka H., Tabata Y., Sasaki N. 2012. In vivo osteoinductivity of gelatin β-tri-calcium phosphate sponge and bone morphogenetic protein-2 on an equine third metacarpal bone defect. Res. Vet. Sci. 93 : 1021–1025.
Van der Stok J., Wang H., Amin Yavari S., Siebelt M., Sandker M., Waarsing J.H., Verhaar J.A.N., Jahr H., Zadpoor A.A., Leeuwenburgh S.C.G., Weinans H. 2013. Enhanced bone regeneration of cortical segmental bone defects using porous titanium scaffolds incorporated with colloidal gelatin gels for time- and dose-controlled delivery of dual growth factors. Tissue Eng. Part A. 19 : 2605–2614.
Verboket R., Leiblein M., Seebach C., Nau C., Janko M., Bellen M., Bönig H., Henrich D., Marzi I. 2018. Autologous cell-based therapy for treatment of large bone defects: from bench to bedside. Eur. J. Trauma Emerg. Surg. 44 : 649–665.
Vo T.N., Kasper F.K., Mikos A.G. 2012. Strategies for controlled delivery of growth factors and cells for bone regeneration. Adv. Drug Deliv. Rev. 64 : 1292–1309.
Wang D.-X., He Y., Bi L., Qu Z.-H., Zou J.-W., Pan Z., Fan J.-J., Chen L., Dong X., Liu X.-N., Pei G.X., Ding J.D. 2013a. Enhancing the bioactivity of Poly(lactic-co-glycolic acid) scaffold with a nano-hydroxyapatite coating for the treatment of segmental bone defect in a rabbit model. Int. J. Nanomed. 8 : 1855–1865.
Wang H., Zou Q., Boerman O.C., Nijhuis A.W.G., Jansen J.A., Li Y., Leeuwenburgh S.C.G. 2013b. Combined delivery of BMP-2 and bFGF from nanostructured colloidal gelatin gels and its effect on bone regeneration in vivo. J. Control. Release. 166 : 172–181.
Wang M., Wang M. 2006. Composite scaffolds for bone tissue engineering. Amer. J. Biochem. Biotechnol. 2 : 80–84.
Wang Y., Wan C., Szöke G., Ryaby J.T., Li G. 2008. Local injection of thrombin-related peptide (TP508) in PPF/PLGA microparticles-enhanced bone formation during distraction osteogenesis. J. Orthop. Res. 26 : 539–546.
Xu C., Su P., Wang Y., Chen X., Meng Y., Liu C., Yu X., Yang X., Yu W., Zhang X., Xiang A.P. 2010. A novel biomimetic composite scaffold hybridized with mesenchymal stem cells in repair of rat bone defects models. J. Biomed. Mater. Res. A. 95 : 495–503.
Yang F., Wang J., Hou J., Guo H., Liu C. 2013a. Bone regeneration using cell-mediated responsive degradable PEG-based scaffolds incorporating with rhBMP-2. Biomaterials. 34 : 1514–1528.
Yang P., Huang X., Wang C., Dang X., Wang K. 2013b. Repair of bone defects using a new biomimetic construction fabricated by adipose-derived stem cells, collagen I, and porous beta-tricalcium phosphate scaffolds. Exp. Biol. Med. (Maywood). 238 : 1331–1343.
Yu Y.Y., Lieu S., Lu C., Colnot C. 2010. Bone morphogenetic protein 2 stimulates endochondral ossification by regulating periosteal cell fate during bone repair. Bone. 47 : 65–73.
Yunus Basha R., Sampath Kumar T.S., Doble M. 2015. Design of biocomposite materials for bone tissue regeneration. Mater. Sci. Eng. C Mater. Biol. Appl. 57 : 452–463.
Zhang Y., Cheng N., Miron R., Shi B., Cheng X. 2012. Delivery of PDGF-B and BMP-7 by mesoporous bioglass/silk fibrin scaffolds for the repair of osteoporotic defects. Biomaterials. 33 : 6698–6708.
Zhu L., Chuanchang D., Wei L., Yilin C., Jiasheng D. 2010. Enhanced healing of goat femur-defect using BMP7 gene-modified BMSCs and load-bearing tissue-engineered bone. J. Orthop. Res. 28 : 412–418.
Zigdon-Giladi H., Bick T., Lewinson D., Machtei E.E. 2015. Co-transplantation of endothelial progenitor cells and mesenchymal stem cells promote neovascularization and bone regeneration. Clin. Implant Dent. Relat. Res. 17 : 353–359.
Дополнительные материалы отсутствуют.