Цитология, 2019, T. 61, № 12, стр. 951-963
Роль родительского происхождения хромосом в нестабильности соматического генома клеток мозга дрозофилы и формировании памятного следа в норме и при стрессе
С. А. Васильева 1, 2, *, Е. В. Токмачева 1, А. В. Медведева 1, А. А. Ермилова 2, Е. А. Никитина 1, 2, **, Б. Ф. Щеголев 1, С. В. Сурма 1, Е. В. Савватеева-Попова 1
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, Россия
* E-mail: Swetlana.gorohowa@yandex.ru
** E-mail: 21074@mail.ru
Поступила в редакцию 09.07.2019
После доработки 02.09.2019
Принята к публикации 05.09.2019
Аннотация
Функционирование нервной системы невозможно представить без контролируемой нестабильности генома, которая приводит к “соматическому мозаицизму мозга” – одному из базовых механизмов структурной и функциональной гетерогенности нейронов. Источником такой нестабильности является наличие в геноме “горячих точек” (повторяющихся ДНК-последовательностей, провоцирующих неаллельную рекомбинацию), а также двухцепочечных (ДЦ) разрывов ДНК, возникающие при матричных процессах и физиологической активности нейронов, вовлеченных в формирование памяти и обучения. Реализация сценария норма–патология находится под эпигенетическим контролем, в частности, зависит от родительского эффекта происхождения геномов и стресса. В настоящей работе на модели синдрома Уильямса дрозофилы, несущей мутацию agnts3 гена для LIMK1 (ключевого фермента ремоделирования актина) с использованием реципрокных гибридов с линией дикого типа Canton-S был изучен вклад материнского и отцовского геномов в процессы обучения и памяти, а также формирование перестроек хромосом у нейробластов, обусловленных ДЦ-разрывами и нарушениями митотического аппарата в норме и при стрессовом воздействии слабым статическим магнитным полем. Показана превалирующая роль отцовского генома в формировании памятного следа. Установлено патроклинное наследование: частоты хромосомных перестроек и ДЦ-разрывов, а также хроматидных мостов в анафазных нейробластах при стрессе в случае отцовской линии agnts3. В потомстве самок agnts3 по материнскому типу наследуются нарушения митоза. На основании предыдущих исследований выявлены контексты микроРНК, которые могут потенцировать патроклинные эффекты.
Нервная система состоит из различных по морфологии и функциональной значимости нейронов, которые необходимы для создания уникальных нейронных сетей. В последнее время появились данные о существовании не только функциональных, но и геномных различий между нейронами. Предполагается, что эти различия являются результатом соматических мутаций, накапливающихся по мере развития и старения организма. Эти мутации создают генетическое разнообразие нейронов, так называемый “соматический мозаицизм мозга” (somatic brain mosaicism) (Verheijen et al., 2018). Наибольшее значение в этой связи приобретают разрывы ДНК и нарушения митоза. Разрывы ДНК сопутствуют интенсивным матричным процессам при нейрогенезе. Двухцепочечные (ДЦ) разрывы являются показателем физиологической активности нейронов, и предполагается, что разрывы ДНК необходимы при ремоделировании хроматина и экспрессии генов, вовлеченных в процессы формирования памяти и обучения (Suberbielle et al., 2013).
Возраст некоторых нейронов может быть равен возрасту организма, а проходящие в нем процессы транскрипции вместе с повреждающим действием свободных радикалов (продуктов окислительного метаболизма) часто сопровождаются ДЦ-разрывами (McKinnon, 2013). Одноцепочечные и ДЦ-разрывы ДНК репарируются белками клеточного цикла в результате гомологичной рекомбинации, однако, при неаллельной гомологичной и негомологичной рекомбинации возникают повреждения, которые влекут за собой усиление мутационного груза и развитие болезней старения (van Leeuwen, Hoozemans, 2015). Поскольку разрывы ДНК характеризуют как норму, так и патологию, а хромосомный мозаицизм значительно чаще встречается у лиц с различными заболеваниями (нервные и психические заболевания, аутоиммунные состояния) (Iоurоv et аl., 2008), то изучение механизмов формирования разрывов ДНК и их функциональных последствий позволит разработать способы уменьшения риска развития геномных болезней.
Полногеномные исследования выявили генетические варианты, которые предрасполагают к различным психиатрическим заболеваниям. Наибольшее значение приобретают “горячие точки” генома – повторяющиеся последовательности ДНК. При неаллельной гомологичной рекомбинации в последних возникают вариации числа копий повторов (genomic copy number variants – CNVs), а также инсерции и делеции (INDELs), нижняя граница размеров которых может составлять 10 п. н. и менее. CNVs способствуют изменению организации ядра и хромосом, что влияет на экспрессию пограничных генов, находящихся дистальнее точек разрыва и воссоединения ДНК (Gheldof et al., 2013; Loviglio et al., 2017).
В генетических рисках патологий, связанных с делеционно-дупликационными синдромами, выявлена императивная роль родительского происхождения геномов (parent-of-origin effects (POE)), которая открывает новые возможности превентивного и терапевтического вмешательства (Varona, 2015; Zayats et al., 2015). При синдроме Уильямса (WBS) человека, обусловленном делецией 7q11.23 (размером 1.5 Mb), включающей от 24 до 28 генов, в том числе гены limk1 и GTF2I (general transcription factor II-I), отклонения в развитии и микроцефалия сильнее выражены в случае передачи хромосомы с делецией от матери (Luis et al., 1996). Более того, при отцовском происхождении аллели гена GTF2I снижается его экспрессия, что влияет на активность и ряда других генов, входящих в состав делеции. Продукт гена GTF2I необходим для развития мозга человека и регулирует транскрипцию, непосредственно связываясь с ДНК и гистоновой деацетилазой (HDAC) (Collette et al., 2009).
Когнитивные и морфологические особенности, выявляемые при WBS, наблюдаются уже в случае делеции двух генов – limk1 и eln (Frangiskakis et al., 1996). Ген eln кодирует тропоэластин – ключевой белок экстраклеточного матрикса, который обусловливает упругость и эластичность тканей. Гемизиготное состояние гена при WBS приводит к различным стенозам, истончениям стенок артерий, недоразвитию мышц. Видимо с этим связана специфическая эльфоидная внешность пациентов. Ген limk1 кодирует LIM-киназу 1 (регулятор динамики актина) относится к числу генов, ответственных за нейрокогнитивное фенотипическое проявление (Meng et al., 2002). LIMK1 за счет наличия двух доменов LIM и домена PDZ, обеспечивающих белок-белковое взаимодействие, участвует в клеточной сигнализации и узнает белки семейств рецепторов и ионных каналов (Медведева, 2008). LIMK1 контролирует баланс между мономерным и полимерным актином, что определяет его функции в цитоплазме и ядре. Актин непосредственно взаимодействует с комплексами ремоделирования хромосом, транскрипционными факторами и РНК-полимеразами, регулируя транскрипционный выход клетки. Отдельно следует отметить значение актина и в активации молчащих генов при транскрипционном репрограммировании. Переключение актина с мономерного на полимерное состояние регулирует активность HDAC 1 и 2 (Serebryannyy et al., 2016; Shinji Misu et al., 2017).
В лаборатории нейрогенетики Института физиологии им. И.П. Павлова РАН создана модель WBS на дрозофиле с мутационным повреждением гена CG1848 LIM-киназы 1 – agnostic (agnts3) (Nikitina et al., 2014a). Мутация по этому гену, локализованная в пределах района 11AB Х-хромосомы, при пермиссивной температуре нарушает обучение и память при условно-рефлекторном подавлении ухаживания у самцов, а при рестриктивной температуре эти показатели восстанавливаются до уровня дикого типа. Ген LIM-киназы 1 локализован в области АТ-богатых повторов ДНК, он содержит вставку из 28 п. н. в интроне 1 гена limk1, а также инсерцию мобильного S-элемента семейства Tc1/mariner на расстоянии 460 п. н. от 3′UTR limk1 (Savvateeva-Popova et al., 2017).
Поскольку мутант принадлежит CNVs-типу, его фенотипическая манифестация, по-видимому, связана не только с нарушением экспрессии затронутых перестройкой генов, но и с повреждением функции генов, локализованных совместно с ним в ядре (Никитина и др., 2018).
Таким образом, предложенная модель позволяет сопрягать особенности архитектуры гена agnts3 с процессами формирования памятного следа (Nikitina et al., 2014b) и влияния стрессовых воздействий, а также с эффектом родительского происхождения геномов при использовании реципрокных гибридов мутантов agnts3 с линиями дикого типа.
Стрессовые воздействия занимают важное место среди факторов, провоцирующих социально-значимые заболевания. Развитие всех биологических объектов происходит в магнитном поле (МП) Земли, обладающем огромной проникающей способностью во все биологические системы. Одним из новых и малоизученных стрессорных факторов являются слабые статические МП (ССМП). Величины индукции полей лежат в пределах от 5 до 500 мкТл (на широте С. Петербурга (в частности, Колтушей), эта величина составляет ~50 мкТл) и способны оказывать заметное воздействие на живые организмы. Воздействие ослабленного (например, за счет экранирования) статического МП Земли оказывает пагубное, и пока что до конца непонятое влияние в первую очередь на нервную систему и когнитивные функции живых организмов (Никитина и др., 2017).
В настоящей работе на мутационной модели WBS дрозофилы был изучен вклад родительских аллелей в наследование способности к обучению и формирование памятного следа с использованием реципрокных гибридов agnts3 с линиями дикого типа, а также в регуляцию генома в норме и при воздействии ССМП.
МАТЕРИАЛ И МЕТОДИКА
Объекты. Работа проведена на животных из ЦКП Биоколлекция Института физиологии РАН (Санкт-Петербург). Материалом исследования служили следующие линии Drosophila melanogaster: Сanton-S – линия дикого типа, agnts3 – линия, несущая температуро-чувствительную (ts) мутацию по гену limk, который кодирует ключевой фермент ремоделирования актина LIMK1 и реципрокные гибриды: Сanton-S × agnts3, agnts3 × Сanton-S. Развитие линий проходило при температуре 22 ± 0.5°С. Мух выращивали в стаканчиках на изюмно-дрожжевой среде. В качестве простых животных моделей используются мутантные линии дрозофилы с коротким жизненным циклом, дешевым содержанием и отсутствием законодательных ограничений.
Оценка способности к обучению и формированию среднесрочной памяти самцов. Для этой цели применяли методику условно-рефлекторного подавления ухаживания. Метод основан на естественных стимулах полового поведения дрозофилы. При ухаживании самца за оплодотворенной самкой сочетаются два безусловных стимула – аттрактивный (феромон афродизиак, стимулирующий ухаживание) и аверсивный (феромон антиафродизиак, подавляющий ухаживание). Антиафродизиаком обладают только оплодотворенные самки и высвобождают его в ответ на ухаживание самца. В результате сочетания аттрактивный стимул становится аверсивным условным стимулом, что снижает его аттрактивные свойства. Степень аттрактивности или аверсивности стимула определяется по таким реакциям животного, как приближение к стимулу или удаление от него.
Исследования проводили на взрослых самцах возрастом 5 суток при температуре 22 ± 0.5°С в первой половине дня. В качестве объектов ухаживания для самцов обеих линий использовали самок линии Сanton-S, оплодотворeнных за 1 сут до эксперимента.
В ходе эксперимента 5-суточного самца тестируемой линии, не имеющего опыта полового поведения, помещали в экспериментальную камеру диаметром 15 мм и высотой 5 мм, изготовленную из оргстекла, вместе с оплодотворeнной 5-суточной самкой CS. Этограмму поведения самца регистрировали в течение 300 с, фиксируя время начала отдельных элементов ухаживания (ориентация и преследование, вибрация, лизание, попытка копуляции), а также время выполнения элементов, не связанных с ухаживанием (побежка, прининг (трение ногой о ногу или ногами о другие части тела), покой). Регистрацию начинали через 45 с после помещения мухи в камеру. Для расшифровки и анализа данных использовали специально разработанные компьютерные программы (Kamyshev et al., 1999).
Оценку способности к обучению и формированию среднесрочной памяти проводили через разные интервалы времени: сразу после тренировки и через 3 ч. В каждой группе (контрольной, сразу после тренировки и через 3 ч после тренировки) тестировали не менее 20 пар мух. Для каждого самца вычисляли индекс ухаживания (ИУ), то есть время ухаживания самца за самкой, выраженное в процентах от общего времени наблюдения. Для количественной оценки результатов обучения сразу после тренировки и через 3 ч вычисляли индекс обучения (ИО) по формуле:
(1)
$\begin{gathered} {\text{ИО}} = \left[ {\left( {{\text{ИУН}}--{\text{ИУТ}}} \right)/{\text{ИУН}}} \right] \times 100\% = \\ = \left( {1 - {\text{ИУТ}}/{\text{ИУН}}} \right) \times 100\% , \\ \end{gathered} $Статистическую обработку результатов проводили при помощи рандомизационного анализа (Sokal et al., 1995).
Экранирование электромагнитного поля. Для экранирования МП Земли была изготовлена цилиндрическая камера, покрытая экранирующим материалом АМАГ-172. Конструкция съемной крышки цилиндра позволяет избежать появления “магнитных дыр” в экране. Коэффициент экранирования по постоянному МП равен 30. Все измерения МП были выполнены с помощью магнитометров Fluxmaster (Stefan Mayer Instruments, Dinslaken, Германия) (1 нTл–200 мкTл с разрешением 1 нТл) и HB0302.1A (Санкт-Петербург, Россия) (0.1 мкТл–100 мкТл с разрешением 0.1 мкТл).
Экранирование проводили в течение 12 ч, при этом нахождение объектов в экранирующей камере совпадало по времени с темновой фазой циркадного ритма мух. После воздействия ССМП мух оставляли в течение 1 ч при температуре 25°С и нормальном уровне МП Земли, а затем использовали в эксперименте.
Для изучения влияния ССМП на характер хромосомных перестроек экранирование проводили на стадии личинки 3-го возраста. Отбирали личинок 3 возраста по физиологическим критериям (активному перемещению по стенкам пробирок и по размерам). Чтобы оценить влияние стресс-фактора на способность к обучению и формированию среднесрочной памяти, воздействие проводили на имаго.
Во всех вариантах эксперимента применяли интактный контроль (без воздействия).
Анализ перестроек анафазных хромосом клеток нервного ганглия личинок дрозофилы. Анафазный анализ у линий Сanton-S и agnts3 и их реципрокных гибридов осуществляли с использованием давленых препаратов нервных ганглиев, окрашенных 4%-ным ацетоорсеином. Для каждой особи вычисляли частоту таких перестроек – отношение числа анафаз с перестройками к общему числу анафазных клеток в нервном ганглии личинки. Кроме того, вычисляли профиль перестроек каждого типа – мостов, фрагментов и отстающих хромосом. Для этого рассчитывали отношение числа каждого из типов перестроек к общему числу аберрантных анафаз. Для обработки результатов вычислений применяли двухфакторный рандомизационный анализ. На каждую экспериментальную точку было проанализировано от 20 до 30 особей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
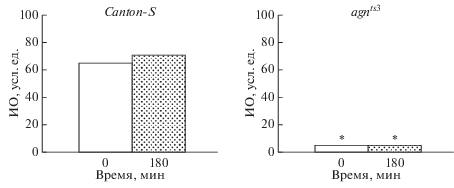
Оценка способности к обучению и формированию среднесрочной памяти самцов дрозофилы в норме и при стрессовом воздействии ССМП. У исследуемых линий была изучена динамика условно-рефлекторного подавления ухаживания в контроле и после воздействия ССМП. На рис. 1 показано, что у линии дикого типа Сanton-S в контроле ИО в течение 3 ч сохранялся на высоком уровне, полученном сразу после тренировки, что свидетельствует о нормальном протекании процессов обучения и памяти.
Рис. 1.
Способность к обучению и формированию памяти линий Canton-S и agnts3 Drosophila melanogaster в интактном контроле. ИО достоверно отличается от линии дикого типа Canton-S (двусторонний тест рандомизации) при *P < 0.05. Здесь и на рис. 2, 3: ИО – индекс обучения, усл. ед. Черные столбики – ИО обученных самцов сразу после тренировки (0), светлые столбики – ИО обученных самцов через 180 мин после тренировки. Размер выборок для каждой точки: 20 самцов.
При действии ССМП (рис. 2) наблюдается снижение активности ухаживания. Так же, как и в контроле, сразу после тренировки отмечено условно-рефлекторное подавление ухаживания. Однако через 3 ч ИО достоверно снижается, что свидетельствует о нарушении процессов формирования среднесрочной памяти.
Рис. 2.
Способность к обучению и формированию памяти линий Canton-S и agnts3 Drosophila melanogaster после воздействия слабого статического магнитного поля (ССМП). ИО достоверно отличается от линии дикого типа (&) Canton-S и от интактного контроля после воздействия ССМП (*) при P < 0.05 (двусторонний тест рандомизации).
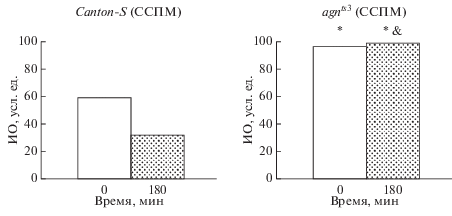
У мутанта agnts3 в контроле (рис. 1) выработки условно-рефлекторного подавления ухаживания не происходило. После воздействия ССМП (рис. 2) на стадии имаго после тренировки наблюдали высокий ИО, сохранявшийся и через 3 ч, что свидетельствует о восстановлении процессов обучения и памяти после действия стрессового фактора и подтверждает предыдущие исследования (Медведева и др., 2008, Никитина и др., 2017).
Таким образом, подтверждено тормозящее действие ССМП на деятельность нервной системы у линии дикого типа. Напротив, у мутантной линии ag-nts3 это стрессовое воздействие на стадии имаго приводит к восстановлению способности к обучению и формированию памяти.
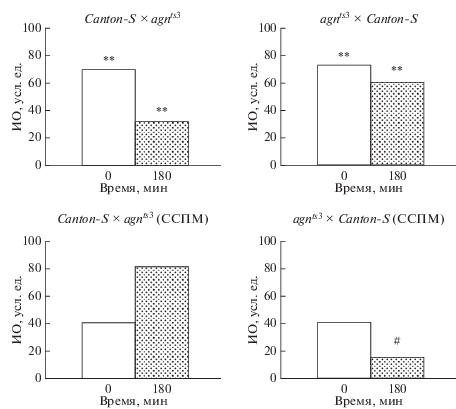
В экспериментах были использованы реципрокные гибриды, образованные agnts3 и линией дикого типа Сanton-S. На рис. 3 представлены показатели обучения и формирования памяти у реципрокных гибридов. Согласно полученным данным наблюдается патроклинное наследование формирования памятного следа. ИО гибридов через 3 ч после обучения не отличается от показателя отцовских линий Сanton-S или agnts3. Продемонстрировано патроклинное наследование и реакции на стресс у гибридов. В случае отцовской линии agnts3 происходит восстановление способности к обучению и формированию памяти при стрессе, в то время как у гибридов agnts3 × CS показатели существенно ниже.
Рис. 3.
Способность к обучению и формированию памяти реципрокных гибридов Canton-S × agnts3 и agnts3 × Canton-S Drosophila melanogaster в интактном контроле и после воздействия ССМП. Двусторонний тест рандомизации: **ИО достоверно отличается от ИО линии agnts3, * ИО достоверно отличается от ИО линии Canton-S (ИО достоверно не отличается от ИО линии agnts3) и # ИО в отсроченном тесте ниже, чем в тесте сразу после тренировки. Во всех случаях P < 0.05.
Согласно данным из литературы, наследование экспрессии генов по отцовскому типу связано, по большей части, с транс-действующими факторами (Wittkopp et al., 2006). К таким факторам относятся некодирующие РНК, роль которых в эпигенетической регуляции памяти и обучения уже показана (Savvateeva-Popovа et al., 2007, 2008). У agnts3 наблюдается сниженный уровень микроРНК мир-314-3p и мир-956-3p (Savvateeva-Popova et al., 2017), содержание которых возрастает при формировании долгосрочной памяти (Maniatis, 2017). Показано, что эти микроРНК экспрессируются в семенниках и поэтому могут влиять на проявление признака у потомства (Mohammed et al., 2014), что в рассмотренном здесь случае приводит к резкому ухудшению памяти у гибридов от скрещиваний, где в качестве отцовской линии выступает agnts3.
При стрессовом воздействии наблюдается патроклинное наследование реакции на стресс. ССМП вызвало улучшение показателей формирования памяти у гибридов линий Berlin, agnts3, где отцовской линией является agnts3, подобно наблюдаемому у ag-nts3 после теплового шока (Savvateeva-Popova et al., 2017). По-видимому, патроклинные эффекты при воздействии ССМП опосредуются через микроРНК мир-956. Она экспрессируется в семенниках и функционально объединяет реакцию на стресс и когнитивные характеристики. Известно, что температурный стресс изменяет профиль мир-956 (Marrone et al., 2012). Ответ организма на тепловой шок аналогичен событиям окислительного стресса и выражается в повышении уровня свободных форм кислорода на фоне падении экспрессии супероксиддисмутазы (Slimen et al., 2014). Именно образование свободных радикалов и функционирование митохондрий модулируются ослабленным МП (Бучаченко, 2014; Спивак и др., 2016; Богданов и др., 2018). Возможно, связующим звеном двух стрессовых воздействий является микроРНК мир-956.
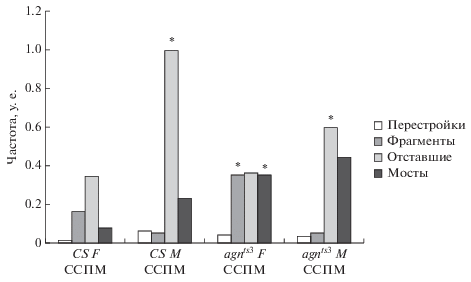
Анафазный анализ перестроек хромосом клеток нервного ганглия личинок в норме и при стрессорном воздействии ССМП. На рис. 4 представлены данные о частоте хромосомных аберраций у исследуемых линий в нормальных условиях. Показано, что самцы и самки контрольной линии Сanton-S не различаются по уровню хромосомных аберраций за исключением хромосомных фрагментов, которые у самцов Сanton-S отсутствуют. Напротив, самцы и самки agnts3 различаются по всем показателям уровня хромосомных перестроек, которые выше у самок, за исключением частоты хроматидных мостов, которая выше у самцов.
Рис. 4.
Частота хромосомных аберраций в нервных ганглиях личинок Canton-S (CS) и agnts3 Drosophila melanogaster в интактном контроле. х – Достоверные межполовые различия CS F и CSM; agnts3F и agnts3M. (+) – Межлинейные различия CSF и ag-nts3F; CSM и agnts3M. P < 0.05.
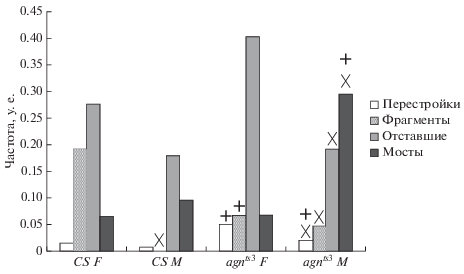
Межлинейные различия выражены высоким уровнем показателя частоты перестроек и профиля фрагментов у самок и самцов agnts3, а также частот хроматидных мостов у самцов agnts3 по сравнению с Сanton-S. Эти данные могут отражать роль каскада ремоделирования актина в регуляции динамики клеточного цикла и репарации, а также эффект постоянно возникающих в ходе матричных процессов разрывов ДНК. Оба явления имеют в своей основе единый контролирующий фактор, что подтверждено многочисленными исследованиями (Baker et al., 1982). В данном случае таким фактором является ген limk1, продукт которого киназа LIM1 является ключевым ферментом ремоделирования актина, вовлеченным как в регуляцию митоза, так и в кластеризацию и репарацию ДЦ-разрывов (Hurst et al., 2019).
Особенностью линии agnts3 является измененное по сравнению с контролем содержание белков аппарата процессинга микроРНК и РНК-зависимой регуляции экспрессии генов. Показано, что у agnts3 снижен уровень белка Dicer, который катализирует первую стадию в процессе РНК-интерференции и инициирует образование RISC (RNA-induced silencing complex), каталитический компонент которого, белок Argonaute, является эндонуклеазой, деградирующей мРНК, комплементарные ведущей цепи siRNA.
Согласно последним данным, малые некодирующие РНК участвуют в репарации ДЦ-разрывов ДНК, приобретая функции молекулы-гида, которая доставляет белки комплекса RISC либо в компартменты транскрипционной и (или) трансляционной репрессии, либо в районы повреждения ДНК. В связи с этим белковые компоненты биогенеза малых РНК имеют особое значение в клеточном ответе на повреждение ДНК (Peng, Karpen, 2007; Keller, Bühler 2013; Hawley et al., 2017).
Кроме того, повышенная частота перестроек характерна для самок, мутантных по генам, контролирующим стабильность хромосом, что возможно связано с дифференциальной экспрессией генов в соматических клетках самок и самцов (Gatti, 1979). В случае agnts3 отсутствие эффекта компенсации дозы гена limk1, по-видимому, усугубляет различия в частоте перестроек между самками и самцами. Превалирование частот хроматидных мостов у самцов agnts3, по-видимому, является следствием аномальной структуры Х-хромосомы самца, содержащей вставку генетического материала. АТ-богатая вставка, а также S-элемент в хромосоме Х мутантных самцов agnts3 создает новую нехарактерную топографию домена Х-хромосомы, что приводит к атипичным межхромосомным контактам с последующими ошибками репарации в случае разрыва ДНК (Savvateeva-Popova et al., 2017).
При 12-часовом действии ССМП (рис. 5) не наблюдается достоверных различий по частоте перестроек у самок Сanton-S. Однако у самцов Сanton-S достоверно увеличилась частота перестроек и отстающих хромосом.
Рис. 5.
Частота хромосомных аберраций в нервных ганглиях личинок Canton-S (CS) и agnts3 Drosophila melanogaster после воздействия ССМП. Отличия от контрольной линии CS достоверны при *P < 0.05.
Воздействие ССМП не повлияло на частоту перестроек у линии agnts3. Вместе с тем изменился профиль перестроек. У самок agnts3 увеличилась частота хромосомных фрагментов и мостов, у самцов – частота отстающих хромосом.
Одной из причин чувствительности биологических систем к слабым МП может явиться описанная Бинги и Чернавским (2005) динамика магнитосом в цитоскелете. Как отмечалось выше, через актиновый цитоскелет осуществляется связь клеточного цикла и репарации ДЦР. Наличие редокс-чувствительных сайтов у ГТФаз Rho и актина создает возможность регулирования соответствующих каскадов свободными радикалами (Heo, 2011), образование которых модулируется ССМП Земли в связи со сбоем в работе фермента супероксиддисмутазы (Spivak et al., 2016; Богданов и др., 2018). Таким образом, LIMK1 и актиновый цитоскелет оказываются мишенью воздействия ССМП.
Для выяснения роли генетических (инсерция хромосомного материала в Х-хромосому у agnts3) и эпигенетических составляющих нестабильности хромосомного аппарата в норме и в условиях стресса, был изучен уровень хромосомных перестроек у реципрокных гибридов Сanton-S × agnts3 и agnts3 × Сanton-S. Реципрокные гибриды различаются по родительскому происхождению хромосом, самцы гибридов в первом варианте скрещивания получают Х-хромосому от Сanton-S, а во втором случае – хромосому с инсерцией от agnts3, что позволяет выявить роль генетической составляющей. Самки реципрокных гибридов существенно не различаются по родительским ядерным геномам, но отличны друг от друга по эпигенетическим факторам, которые передаются через цитоплазму яйцеклетки самки: в первом варианте – Сanton-S, во втором – agnts3.
На рис. 6 представлен сравнительный анализ показателей хромосомных перестроек у гибридов Сanton-S × agnts3 и родительских линий. Критерием эпигенетического наследования таких метрик служит отсутствие различий между соответствующими показателями одного из родителей по отношению к гибридам F1 обоих полов.
Рис. 6.
Сравнение параметров хромосомных перестроек в нервных ганглиях личинок реципрокных гибридов Canton-S (CS) × × agnts3 и родительских линий CS и agnts3 Drosophila melanogaster в интактном контроле. Черные кружки над столбиками показывают достоверные отличия от материнской линии. P < 0.05.
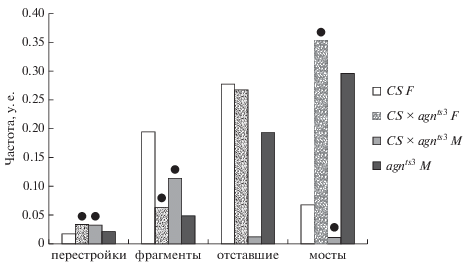
Спектр хромосомных перестроек у самок F1 не отличается по всем показателям (частота перестроек, мостов и фрагментов хромосом) от самцов agnts3. Вместе с тем, в случае самок Сanton-S такие различия по уровню хромосомных аберраций достоверны. Частоты отстающих хромосом не различаются у родителей и самок F1.
Спектр перестроек у самцов F1 не отличается по частоте перестроек и фрагментов (ДЦ-разрывов) от самцов agnts3. От самок Сanton-S самцы F1 отличаются по всем показателям, кроме частоты встречаемости хроматидных мостов.
Таким образом, представленные данные, полученные на базе предложенного нами критерия эпигенетического наследования, свидетельствуют о патроклинном наследовании уровня перестроек и ДЦ-разрывов (присутствие фрагментов хромосом в анафазных клетках). Следовательно, через цитоплазму сперматозоидов самцов agnts3 передаются факторы, влияющие на стабильность хромосомного материала в отношении хромосомных аберраций.
У самцов дрозофилы в качестве эпигенетического регулятора экспрессии генома преимущественно выступают малые некодирующие микроРНК, которые модифицируют экспрессию генов на уровне транскрипции и трансляции (Castel, Martienssen, 2013; Heardand, Martienssen, 2014). Анализ спектра микро-РНК линии agnts3 выявил существенные отклонения от такового контрольной линии (Savvateeva-Popova et al., 2017). Возможным кандидатом на роль патроклинного регулятора клеточного цикла и стабильности хромосом является микроРНК let-7, содержание которой снижено у agnts3. Основными критериями выбора именно этой микроРНК является ее экспрессия в семенниках, участие в формировании нервной системы, в частности грибовидных тел. Известно, что let-7 регулирует также циркадные ритмы и базовый сон дрозофилы (Ma et al., 2016; Goodwin et al., 2018; Xue, Zhang, 2018). Наиболее интереснoй в данном контексте является регуляция let-7 киназы Aurora B (Mäki-Jouppila et al., 2015). Aurora B образует комплекс с конденсином и когезином, участвуя в компактизации хромосом и регуляции пункта сборки веретена деления и расхождения гомологичных хромосом в анафазе (Giet, Glover, 2001).
МикроРНК мир-314, сопрягающая регуляцию когнитивных функций и репарацию повреждений, также экспрессируется в семенниках (Mohammed et al., 2014), и ее уровень ниже у agnts3 (Savvateeva-Popova et al., 2017). Показано, что содержание мир-314 возрастает при формировании долгосрочной памяти (Maniatis, 2017). В то же время известно, что ген mus309, влияющий на репарацию ДЦ-разрывов при гомологичном кроссинговере (Portin, 2005), является мишенью мир-314 (Chandra et al., 2016).
У самок F1, у которых Х-хромосома с инсерцией находится в гетерозиготном состоянии, частота формирования хроматидных мостов на клетку выше таковой самок Сanton-S. В то же время не обнаружено отличий по этому показателю между самцами F1 (содержат Х-хромосому матери Сanton-S без вставки) и самками Сanton-S. Это позволяет сделать вывод, что частота формирования хроматидных мостов в нейробластах зависит от наличия в геноме хромосомы со вставкой генетического материала.
На рис.7 представлен сравнительный анализ параметров перестроек гибридов agnts3 × Сanton-S и родительских линий. Частота отставаний хромосом является единственным признаком, по которому самки и самцы F1 не отличаются от самок agnts3. Различия по этому признаку с самцами Сanton-S находятся на границе достоверности (р(H0) = 0.054).
Рис. 7.
Сравнение параметров хромосомных перестроек в нервных ганглиях личинок реципрокных гибридов agnts3 × Canton-S (CS) и родительских линий agnts3 и CS Drosophila melanogaster в интактном контроле. Черные и белые кружки над столбиками показывают достоверные отличия соответственно от материнской и от отцовской линии при P < 0.05.
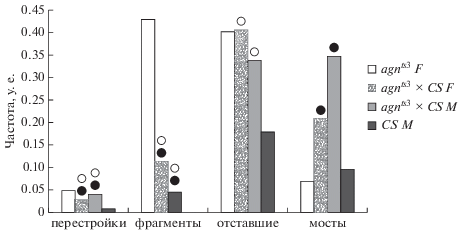
Полученные данные свидетельствуют в пользу эпигенетического наследования высокой частоты отставания хромосом у гибридов первого поколения, при этом матроклинно наследуются свойства agnts3. Вместе с тем отставание, без сомнения, зависит и от структуры хромосомы, поскольку в единственном случае отсутствия аберрантной хромосомы у самцов F1 от скрещивания Сanton-S × agnts3 частота отставаний минимальна даже по сравнению с уровнем самок и самцов Сanton-S.
На рис. 8 и 9 представлены данные о вкладе материнского и отцовского организма в формирование перестроек хромосом при стрессе – 12-часовое действие ССМП. На рис. 8 произведен сравнительный анализ уровня перестроек хромосом у гибридов Сanton-S × agnts3 и родительских линий при стрессе. У самок и самцов F1 при стрессе частоты возникновения хромосомных аберраций и мостов не отличаются от таковых у самцов agnts3. По показателям частоты хромосомных фрагментов и отстающих хромосом не наблюдается различий между гибридами и их родителями – самками Сanton-S и самцами agnts3. Следовательно, при стрессе наблюдается патроклинное наследование уровня частот хромосомных перестроек и мостов. При этом если частота таких перестроек в оптимальных условиях регулируется эпигенетически, то при стрессе, по-видимому, появляется дополнительный фактор в сперме agnts3, влияющий на частоту формирования хромосомных мостов в нейробластах у потомства.
Рис. 8.
Сравнение параметров хромосомных перестроек в нервных ганглиях личинок реципрокных гибридов Canton-S (CS) × × agnts3 и родительских линий CS и agnts3 Drosophila melanogaster после воздействия ССМП. Черные кружки над столбиками показывают достоверные отличия от материнской линии при P < 0.05.
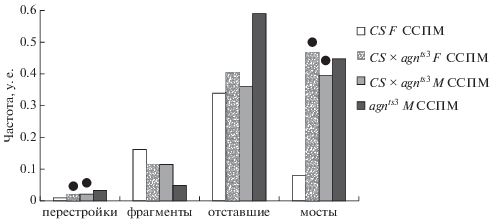
Рис. 9.
Сравнение параметров хромосомных перестроек в нервных ганглиях личинок реципрокных гибридов agnts3 × Canton-S (CS) и родительских линий agnts3 и CS Drosophila melanogaster после воздействия ССМП. Черные и белые кружки над столбиками показывают достоверные отличия соответственно от материнской и от отцовской линии при P < 0.05.
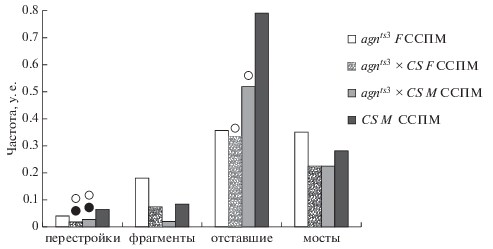
Анализ данных, приведенных на рис. 9, позволяет предположить эпигенетическое наследование признака отставания хромосом, обусловленного нарушением митотического аппарата (Gregan et al., 2011), через цитоплазму яйцеклетки agnts3 при стрессе в скрещивании agnts3 × Сanton-S.
Подводя итоги этой части исследования, можно сделать следующие выводы. 1) В потомстве самцов agnts3 наблюдается отцовское наследование высокой частоты перестроек у гибридов F1. В нормальных условиях таким же способом наследуется низкий уровень ДЦ-разрывов, а при стрессе – высокая частота формирования хромосомных мостов. 2) в потомстве самок agnts3 выявлено материнское наследование у гибридов F1 нарушений митоза, а именно высокой частоты отставания хромосом в норме и при стрессе.
Таким образом, настоящее исследование позволило установить превалирующую роль отцовского генома в формировании памятного следа, а также патроклинное наследование частоты хромосомных перестроек и ДЦ-разрывов в случае отцовской линии agnts3. Как показали другие исследования (Suberbielle et al., 2013), эти процессы функционально связаны. При этом возможное значение приобретают экспрессируемые в семенниках микроРНК: мир-956, let-7 и мир-314. Патроклинные эффекты, вызванные ССМП, по-видимому, опосредуются мир-956. В потомстве самок agnts3 выявлено материнское наследование нарушений аппарата деления клетки.
Список литературы
Бинги В. Н., Чернавский Д.С. 2005. Стохастический резонанс магнитосом, закрепленных в цитоскелете. Биофизика. 50(4) : 684–688. (Binhi V.N., Chernavsky D.S. 2005. Stochastic resonance of magnetosomes fixed in the cytoskeleton. Biophysics. 50(4) : 599-603.)
Богданов В.А., Cакута Г.А., Cтефанов В.Е., Cуpма C.В., Заxаpов Г.А., Щеголев Б.Ф. 2018. Воздействие ослабленного магнитного поля Земли на пролиферативную активность и жизнеспособность клеток К562 и C3H10T1/2. Биофизика. 63(6) : 1164–1170. (Bogdanov V.A., Sakuta G.A., Stefanov V.E., Surma S.V., Zakharov G.A., Shchegolev B.F. 2018. The effects of a weakened magnetic field of the earth on the proliferative activity and viability of K562 and c3h10t1/2 сells. Biophysics. 63(6) : 1164–1170.)
Бучаченко А.Л. 2014. Магнито-зависимые молекулярные и химические процессы в биохимии, генетике и медицине. Успехи химии. 83(1) : 1–12. (Buchachenko, A.L. 2014. Magnetic field-dependent molecular and chemical processes in biochemistry, genetics and medicine. Russ. Chem. Rev. 83(1) : 1–12.)
Медведева А.В., Молотков Д.А., Никитина Е.А., Попов А.А., Карагодин Д.А., Баричева Е.М., Савватеева-Попова Е.В. 2008. Системная регуляция генетических и цитогенетических процессов сигнальным каскадом ремоделирования актина: локус agnostic дрозофилы. Генетика. 44(6) : 669–681. (Medvedeva A.V., Molotkov D.A., Nikitina E.A., Popov A.V., Karagodin D.A., Baricheva E.M., Savvateeva-Popova E.V. 2008. Systemic regulation of genetic and cytogenetic processes by a signal cascade of actin remodeling: locus agnostic in Drosophila. Russ. J. Genetics. 2008. 44(6) : 771–83.)
Никитина Е.А., Медведева А.В., Герасименко М.С., Проников В.С., Сурма С.В., Щеголев Б.Ф., Савватеева-Попова Е.В. 2017. Ослабленное магнитное поле Земли: влияние на транскрипционную активность генома, обучение и память у Dr. melanogaster. Журн. высшей нервной деятельности им. И.П. Павлова. 67(2) : 246–256. (Nikitina Е.А., Мedvedeva A.V., Gerasimenko M.S., Pronikov V.S., Surma S.V., Shchegolev B.F., Savvateeva-Popova E.V. 2017. Weakened geomagnetic field: impact on transcriptional activity of the genome, learning and memory formation in Dr. melanogaster. Zhurnal VND. 67(2) : 246–256.)
Никитина Е.А., Медведева А.В., Журавлев А.В., Васильева С.А., Токмачева Е.В., Захаров Г.А., Савватеева-Попова Е.В. 2018. Формирование пространственной организации ядра: роль гена limk1 дрозофилы. Цитология. 60(11) : 895–898. (Nikitina E.A., Medvedeva A.V., Zhuravlev A.V., Vasilieva S.A., Tokmatcheva E.V., Zakharov G.A., Savvateeva–Popova E.V. 2018. Formation of nuclear spatial organization: role of Drosophila limk1 gene. Tsitologiya. 60(11) : 895–898).
Спивак И.М., Куранова М.Л., Мавропуло–Столяренко Г.Р., Сурма С.В., Щеголев Б.Ф., Стефанов В.Е. 2016. Клеточный ответ на воздействие сверхслабых статических магнитных полей. Биофизика. 61(3) : 516–522. (Spivak I.M., Kuranova M.L., Mavropulo–Stolyarenko G.R., Surma S.V., Shchegolev B.F., Stefanov V.E. 2016. Cell response to extremely weak static magnetic fields. Biophysics. 61(3) : 435–439.)
Baker B. S., Smith D.A., Gatti M. 1982. Region-specific effects on chromosome integrity of mutations at essential loci in Drosophila melanogaster (mutagen-sensitive mutants/chromosome aberrations/mitotic cell cycle mutants/late larval lethals). Proc. Natl. Acad. Sci. 79 : 1205–1209.
Castel S.E., Martienssen R.A. 2013. RNA interference in the nucleus: roles for small RNAs in transcription, epigenetics and beyond. Nat. Rev. Genet. 14 : 100–112.
Chandra S., Khatoon R., Pandey A., Saini S., Vimal D., Singh P., Chowdhuri D.K. 2016. Dme-miR-314-3p modulation in Cr(VI) exposed Drosophila affects DNA damage repair by targeting mus309. J. Hazard Mater. 304 : 360–369.
Collette J.C., Xiao-Ning Chen, Debra L. Mills, Albert M. Galaburda, Allan L. Reiss, Ursula Bellugi, Julie R. Korenberg. 2009. William’s syndrome: Gene expression is related to parental origin and regional coordinate control. J. Hum. Genet. 54 : 193–198.
Frangiskakis J.M., Ewart A.K., Morris C.A., Mervis C.B., Bertrand J., Robinson B.F., Klein B.P., Ensing G.J., Everett L.A., Green E.D. 1996. LIM-kinase1 hemizygosity implicated in impaired visuospatial constructive cognition. Cell. 86 : 59–69.
Gatti M. 1979. Genetic control of chromosome breakage and rejoining in Drosophila melanogaster: Spontaneous chromosome aberrations in X-linked mutants defective in DNA metabolism. Proc. Natl. Acad. Sci. USA. 76 : 1377–1381.
Gheldof N., Witwicki R.M., Migliavacca E., Leleu M., Didelot G., Harewood L., Rougemont J., Reymond A. 2013. Structural variation-associated expression changes are paralleled by chromatin architecture modifications. PLoS One. 8(11) : e79973.
Giet R., Glover D.M. 2001. Drosophila aurora B kinase is required for histone H3 phosphorylation and condensin recruitment during chromosome condensation and to organize the central spindle during cytokinesis. J. Cell Biol. 152 : 669–682.
Goodwin P.R., Meng A., Moore J., Hobin M., Fulga T.A., Van Vactor D., Griffith L.C. 2018. MicroRNAs regulate sleep and sleep homeostasis in Drosophila. Cell Rep. 23 : 3776–3786.
Gregan J., Polakova S., Zhang L., Tolić-Nørrelykke I.M., Cimini D. 2011. Merotelic kinetochore attachment: Causes and effects. Trends Cell Biol. 21 : 374–381.
Hawley B.R., Lu W.-T., Wilczynska A., Bushell M. 2017. The emerging role of RNAs in DNA damage repair. Cell Death Differ. 24 : 580–587.
Heardand E., Martienssen R.A. 2014. Transgenerational epigenetic inheritance: Myths and mechanisms. Cell. 157: 95–109.
Heo J. 2011. Redox control of GTPases: From molecular mechanisms to functional significance in health and disease. Antioxid. Redox Signal. 14 : 689–724.
Hurst V., Shimada K., Gasser S.M. 2019. Nuclear actin and actin-binding proteins in DNA repair. Trends Cell Biol. 29(6): 462–476.
Iourov I.Y., Vorsanova S.G., Yurov Y.B. 2008. Chromosomal mosaicism goes global. Mol. Cytogenet. 1 : 1–26.
Kamyshev N.G., Iliadi K.G., Bragina J.V. 1999. Drosophila conditioned courtship: Two ways of testing memory. Learn. Mem. Cold Spring Harb. 6 : 1–20.
Keller C., Bühler M. 2013. Chromatin-associated ncRNA activities. Chromosome Res. 21 : 627–641.
Loviglio M.N., Leleu M., Reymond A. 2017. Chromosomal contacts connect loci associated with autism, BMI and head circumference phenotypes. Mol. Psychiatry. 22 : 836–849.
Luis A. Jurado P., Peoples R., Kaplan P., Ben C.J. Hame, Francke U. 1996. Molecular definition of the chromosome 7 deletion in Williams syndrome and parent-of-origin effects on growth. Am. J. Hum. Genet. 59 : 781–792.
Ma Q., de Cuevas M., Matunis E.L. 2016. Chinmo is sufficient to induce male fate in somatic cells of the adult Drosophila ovary. Development. 143 : 754–763.
Mäki-Jouppila J.H.E., Pruikkonen S., Tambe M.B., Aure M. R., Halonen T., Salmela A.-L., Laine L., Børresen-Dale A.-L., Kallio M.J. 2015. MicroRNA let-7b regulates genomic balance by targeting Aurora B kinase. Mol, Oncol. 9 : 1056–1070.
Maniatis S. 2017. Classical conditioning alters short noncoding RNA expression in Drosophila. Doctoral diss. Harvard University, Graduate School Arts Sci.
Marrone A.K., Edeleva E.V., Kucherenko M.M., Hsiao N.-H., Shcherbata H.R. 2012. Dg-Dys-Syn1 signaling in Drosophila regulates the microRNA profile. BMC Cell Biol. 13 : 26. https://doi.org/10.1186/1471-2121-13-26
McKinnon P.J. 2013. Maintaining genome stability in the nervous system. Nat. Neurosci. 16 : 1523–1529.
Meng Y., Zhang Y., Tregoubov V., Janus C., Cruz L., Jackson M., Lu W.Y., MacDonald J.F., Wang J.Y., Falls D.L., Jia Z. 2002. Abnormal spine morphology and enhanced LTP in LIMK-1 knockout mice. Neuron. 35 : 121–133.
Mohammed J., Bortolamiol-Becet D., Flynt A.S., Gronau I., Siepel A., Lai E.C. 2014. Adaptive evolution of testis-specific, recently evolved, clustered miRNAs in Drosophila. RNA. 20 : 1195–1209.
Nikitina E.A., Medvedeva A.V., Zakharov G.A., Savvateeva-Popova E.V. 2014a. The Drosophila agnostic locus: Involvement to formation of cognitive defects in Williams syndrome. Acta Naturae. 6(2) : 53–61.
Nikitina E.A., Medvedeva A.V., Zakharov G.A., Savvateeva-Popova E.V. 2014b. Williams syndrome as a model for elucidation of the pathway genes – the brain – cognitive functions: Genetics and epigenetics. Acta Naturae. 6(1) : 9–22.
Peng J.C., Karpen G.H. 2007. H3K9 methylation and RNA interference regulate nucleolar organization and repeated DNA stability. Nat. Cell Biol. 9 : 25–35.
Portin P. 2005. Mus309 mutation, defective in DNA double-strand break repair, affects intergenic but not intragenic meiotic recombination in Drosophila melanogaster. Genet Res. 86 : 185–191.
Savvateeva-Popova E.V., Popov A.V., Grossman A.I., Nikitina E.A., Medvedeva A.V., Peresleni A.I., Korochkin L.I., Moe G., Davidowitz E., Pyatkov K.I., Myasnyankina E., Zatsepina O.G., Schostak N., Zelentsova E.S., Evgen`ev M.B. 2007. Pathogenic chaperone-like RNA induces congophilic aggregates and facilitates neurodegeneration in Drosophila. Cell Stress Chaperones. 12 : 9–19.
Savvateeva-Popova E.V., Popov A.V., Grossman A., Nikitina E.A., Medvedeva A.V., Peresleni A.I., Molotkov D.A., Kamyshev N.G., Pyatkov K.I., Zatsepina O.G., Schostak N., Zelentsova E.S., Pavlova G., Panteleev D., Riederer P., Evgen`ev M.B. 2008. Non-coding RNA as a trigger of neuropathologic disorder phenotypes in transgenic Drosophila. J. Neuronal Transmission. 115 : 1629–1642.
Savvateeva-Popova E.V., Zhuravlev A.V., Brázda V., Zakharov G.A., Kaminskaya A.N., Medvedeva A.V., Nikitina E.A., Tokmatcheva E.V., Dolgaya J.F., Kulikova D.A., Zatsepina O.G., Funikov S.Y., Ryazansky S.S., Evgen‘ev M.B. 2017. Drosophila model for the analysis of genesis of LIM-kinase 1-dependent Williams-Beuren syndrome cognitive phenotypes: INDELs, transposable elements of the Tc1/Mariner Ssperfamily and microRNAs. Front. Genet. 8 : 123. https://doi.org/10.3389/fgene.2017.00123
Serebryannyy L.A., Cruz C.M., Primal de Lanerolle. 2016. A role for nuclear actin in HDAC 1 and 2 Regulation. Sci. Rep. 6 : 28 460. https://doi.org/10.1038/srep28460
Shinji Misu, Takebayashi M., Kei Miyamoto. 2017. Nuclear actin in development and transcriptional reprogramming. Front Genet. 8 : 27. https://doi.org/10.3389/fgene.2017.00027
Slimen I.B., Najar T., Ghram A., Dabbebi H., Ben Mrad M., Abdrabbah M. 2014. Reactive oxygen species, heat stress and oxidative-induced mitochondrial damage. Int. J. Hyperthermia. 30 : 513–523.
Sokal R.R., Rohlf F.J. 1995. Biometry: The Principles and Practice of Statistics in Biological Research. N.-Y.: Freeman WH & Co. 803–820.
Suberbielle E., Sanchez P., Kravitz A. 2013. Physiologic brain activity causes DNA double-strand breaks in neurons, with exacerbation by amyloid-b. Nature. Neurosci. 16 : 613–621.
Van Leeuwen L.A., Hoozemans J.J. 2015. Physiological and pathophysiological functions of cell cycle proteins in post-mitotic neurons: Implications for Alzheimer’s disease. Acta Neuropathol. 129 : 511–525.
Varona L., Munila S., Casselas J., Moreno C., Altarriba J. 2015. Consequences of paternally inherited effects on the genetic evaluation of maternal effects. Gen. Select. Evol. 47 : 63. https://doi.org/10.1534/g3.115.016725
Verheijen Bert M., Vermulst M., Fred W. van Leeuwen. 2018. Somatic mutations in neurons during aging and neurodegeneration. Acta Neuropathol. 135 : 811–826.
Wittkopp P.J., Haerum B.K., Clark A.G. 2006. Parent-of-origin effects on mRNA expression in Drosophila melanogaster not caused by genomic imprinting. Genetics. 173 : 1817–1821.
Xue Y., Zhang Y. 2018. Emerging roles for microRNA in the regulation of Drosophila circadian clock. BMC Neurosci. 19 : 1. https://doi.org/10.1186/s12868-018-0401-8
Zayats T., Johansson S., Haavik J. 2015. Expanding the toolbox of ADHD genetics. How can we make sense of parent of origin effects in ADHD and related behavioral phenotypes? Behav. Brain. Funct. 11 : 33. https://doi.org/10.1503/jpn.100173
Дополнительные материалы отсутствуют.


