Цитология, 2019, T. 61, № 4, стр. 259-271
Акцессорные белки: противоречивая роль в жизни про-и эукариотов
А. С. Романенко 1, Л. А. Ломоватская 1, *
1 Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, Россия
* E-mail: lidal@sifibr.irk.ru
Поступила в редакцию 11.01.2018
После доработки 25.01.2019
Принята к публикации 26.01.2019
Аннотация
Акцессорные, или вспомогательные, белки присутствуют в организмах различного уровня сложности и относятся к особому классу полипептидов с разнообразными функциями. В число таких функций входит контроль на посттрансляционном уровне правильной укладки макромолекул различной природы, специфичности и целевой доставки их к внутриклеточным компартментам или к пограничной мембране. Акцессорные белки влияют на эффективность и специфичность трансдукции сигналов в системе рецептор–G белок–эффектор, участвуют в организации и динамике структур цитоскелета. В присутствии акцессорных белков происходит формирование и интернализация эндосом, встраивание в клеточную мембрану секреторных везикул, осуществляется репликация и репарация поврежденной ДНК. У патогенных бактерий токсины могут защищаться акцессорными белками. Кроме того, такие белки способствуют секреции полипептидов путем их разворачивания вблизи мембраны и последующего рефолдинга в периплазме. Свой вклад акцессорные белки вносят в формирование и регуляцию защитных реакций организма. В представленном обзоре сделана попытка обобщения имеющихся сведений о роли акцессорных белков в жизнедеятельности про- и эукариотов, предложены некоторые перспективы дальнейших исследований таких белков.
Акцессорные (или вспомогательные) белки, широко распространенные в живой природе, контролируют в клетках про- и эукариотов сохранность молекул, участвующих в большинстве, если не во всех ключевых реакциях метаболизма. Первые сведения о таких белках появились в начале 90-х гг.в прошлого столетия. Так было установлено, что в мутантах дрожжей, дефицитных по белку SHR3, который в норме локализован в ЭР, пермеазы, транспортирующие аминокислоты из внешней среды в клетку, не доставлялись к плазматической мембране, а оставались и накапливались в цистернах ЭР (Ljungdahl et al., 1992). Авторы пришли к выводу, что функция SHR3 заключается в фолдинге синтезируемых на ассоциированных с ЭР рибосомах молекул пермеаз для обеспечения их нормального функционирования. Термин “акцессорные белки” появился позднее (Herrmann et al., 1999). Со временем было выяснено, что акцессорные белки могут регулировать эффективность и специфичность трансдукции сигнала от рецептора к G-белку или от G-белка к эффектору, участвуя в формировании функционального комплекса передачи сигнала (Sato et al., 2006; Sato, 2013). Эти белки контролируют правильность укладки синтезированных на рибосомах полипептидов различной природы, включая “грузовые белки”, для обеспечения их соответствующей конформации, специфичности и целевой доставки. Тем самым предотвращается их деградация в мембранной системе ERAD (endoplasmic reticulum-associated protein degradation), представляющей собой убиквитин-протеасомный путь (Buck et al., 2007; Yamamoto, 2009). Организация и динамика цитоскелетных структур в значительной степени определяются сложным взаимодействием с многочисленными акцессорными белками, способными образовывать, разъединять, осуществлять поперечную связь, ослаблять или укреплять отдельные микрофиламенты (Peer, 2011; Huber et al., 2013; King, 2017). Полимерные спирали акцессорных белков участвуют в инициации кривизны и затем в опоясывании перешейка инвагинирующей мембраны эукариотов, что способствует формированию и отделению эндоцитозных пузырьков, облегчает отпочкование от цистерн аппарата Гольджи (АГ) или мембран ЭР пузырьков, осуществляющих целевой транспорт груза (Takenawa, Suetsugu, 2007; Neumann, Schmid, 2013; Хайтлина, 2014; Traub, 2015). Репликация и репарация поврежденной ДНК также происходят в присутствии акцессорных белков (Hubscher et al., 1996; Modesti, Kanaar, 2001). Есть сведения о том, что такие белки способствуют транспорту эпидермального фактора роста в комплексе с рецептором из плазматической мембраны непосредственно в ядро для активации транскрипции генов, стимулирующих рост клетки (Wells, Marti, 2002; Шаназаров и др., 2009).
Свой вклад акцессорные белки вносят в формирование и регуляцию защитных реакций организма. Например, биологические эффекты полипептидных медиаторов – цитокинов, опосредуются через специфические клеточные рецепторные комплексы, а поддержание конформации комплекса лиганд-рецептор осуществляется с помощью акцессорного белка (Wesche et al., 1997; Evavold, Kagan, 2018). Однако при патогенезе, в частности, при инфицировании ретровирусами, активируется вирусный ген, кодирующий акцессорный белок, необходимый для поддержания репликации вируса при его взаимодействии с клеткой-хозяином (Cohen et al., 1996; Swanstrom, Wills, 1997). Продуцируемый бактерией Clostridium botulinum токсин ботулизма при попадании в организм с пищей становится опасен, поскольку он защищен продуцируемыми патогеном акцессорными белками от повреждающего воздействия ферментов и кислоты желудочного сока (Wood, 2009).
Недавно обнаружен интересный факт защиты эмбрионов человека одними видами вирусов от других. Так Wysocka и ее коллеги выяснили, что на ранней стадии развития эмбриона ретровирус HERVK, вместе с синтезируемым в клетке-хозяине акцессорным белком HERVK Rec, защищают эти клетки от инфицирования другими вирусами (Grow et al., 2015). Таким образом, в зависимости от организма (хозяина или патогена), в котором продуцируются акцессорные белки, они играют прямо противоположные роли – либо обеспечивают целостность и регуляцию собственных продуктов метаболизма (белков, нуклеиновых кислот, элементы цитоскелета) и защиту от атаки патогеном, либо способствуют инфицированию, предохраняя факторы вирулентности от разрушения клетками хозяина.
В последние годы акцессорным белкам посвящали обзорные работы, но в них авторы рассматривали отдельных представителей этих белков, участвующих в конкретных событиях клеточного метаболизма (Huber et al., 2013; Sato 2013; Park, 2015; Csorba, Burgyán, 2016; Hama, Park, 2016). Поэтому в нашем обзоре предпринята попытка более подробного обсуждения различных видов и функций акцессорных белков, синтезируемых про- и эукариотами.
АКЦЕССОРНЫЕ БЕЛКИ И ТРАНСДУКЦИЯ СИГНАЛОВ
Сигналы через рецепторы, сопряженные с G-белками, (GPCRs), широко используются для передачи внешней информации через плазматическую мембрану внутрь клетки. GPCRs активируют гетеротримерные G-белки, выполняющие роль посредников для трансляции сигналов на внутриклеточные эффекторные молекулы (Birnbaumer, 2007). Комбинация трех субъединиц гетеротримерных G-белков определяет прохождение или подавление сигнала, инициированного взаимодействием лиганда с рецептором. В этой системе были обнаружены и другие участники – акцессорные белки. Эти компоненты изменяют активацию субъединиц Gα или образуют комплексы с Gα или Gβγ, которые отличаются от типичного гетеротримера Gαβγ. Такая регуляция активности G-белков может протекать в ассоциации с GPCRs, а также независимо от них. Тем самым обеспечивается дополнительное разнообразие входящих сигналов (Sato et al., 2006; Sato, 2013; Park, 2015).
Один из основных классов акцессорных белков относится к семейству регуляторов передачи сигнала G белка (RGS), которые участвуют в повышении активности ГТФазы и могут также функционировать в качестве эффекторов или белков скаффолда (Ross, Wilkie, 2000; Hollinger, Hepler, 2002). Первоначально существование таких регуляторных белков было обнаружено у дрожжей, а генетические исследования проводили на опосредованном через G-белок контроле яйцекладки у нематоды Caenorhabditis elegans (Blumer et al., 2007).
По действию на субъединицы G-белков акцессорные белки были разделены на 4 класса (Sato, 2013; Park, 2015).
1. Факторы обмена нуклеотидов (GEF). Этот класс акцессорных белков стимулирует обмен ГДФ/ГТФ субъединицей Gα, функционирующей как ГТФаза при восприятии сигнала от рецептора (Park, 2015). К таким акцессорным белкам относятся активатор сигнала G-белка AGS1 (Cismowski et al., 2000; Park, 2015) и презенилин-1 (Smine et al., 1998). Оба белка функционируют независимо от рецептора. Презенилин-1, нарушение экспрессии гена которого способствует развитию синдрома Альцгеймера, преимущественно присутствует в АГ и цистернах транс-Гольджи (Smine et al., 1998). Кроме того, еще один акцессорный белок, радиксин, связываясь с ГТФ-связанной формой субъединицы Gα13, способствует изменению их конформации для связывания с F-актином (Park, 2015). Из 4-х членов семейства Gα белки GEF предпочтительно активируют Gα-субъединицы ингибирующего типа (Gαi), прерывающие последующую трансдукцию сигнала (Downes, Gautam, 1999).
2. Ингибиторы диссоциации гуанинового нуклеотида (GDI) от субъединицы Gα. Большая часть этой группы акцессорных белков имеет общий структурный домен, называемый регулятором G‑белка (GPR). Мотив GPR стабилизирует измененную под влиянием ГДФ конформацию Gα, что приводит к ингибированию Gα-опосредованной сигнализации (Blumer et al., 2012). Мотив GPR найден в активаторах сигнала G-белков, включающих AGS3, AGS5, AGS11 (Park, 2015), и в активирующих ГТФазу белках RGS12, RGS14, Rap1 (Blumer et al., 2012; Park, 2015).
3. Белки, активирующие ГТФазу субъединицы Gα (GAPs). Большинство белков в этой группе являются GAPs для Gαi/Gαo (Hendriks-Balk et al., 2008). К GAPs относятся регуляторы сигналов G-белков (RGS): RGS2, RGS4, RGS5, RGS7 (Park, 2015).
4. Акцессорные белки, взаимодействующие с субъединицами Gβγ. Такие G-белки регулируют различные эффекторные молекулы, в частности, кальциевые каналы и связанную с G-белком рецепторную киназу 2 (GRK2) (Birnbaumer, 2007; Park, 2015).
В современном представлении механизм регуляции сигналов G-белков с участием акцессорных белков можно рассмотреть на примере болезни почек – поликистоза. В норме почка обладает множеством функций, включая фильтрацию для удаления отходов из крови, контроль баланса жидкости и электролитов, кислотно-основное регулирование и производство эндокринных гормонов (Hama, Park, 2016). В этих процессах участвует нетипичный рецептор поликистин-1 (РС-1). В отличие от обычных GPCR, имеющих 7-спиральную трансмембранную конфигурацию, РС-1 обладает 11 трансмембранными областями и участвует в передаче физических сигналов от внешнего стимула в клетку. Кроме РС-1, функционирует катионный канал поликистин-2 (РС-2). При поликистозе почки образование кисты происходит из-за поврежденных продуктов генов белков РС-1 и РС-2 – PKD1 и PKD2, соответственно. Эти аномалии приводят к нарушению проведения сигналов, зависимых от гетеротримерных G-белков. Как и GPCR, PC-1 может выборочно связывать многие активированные субъединицы Gα-ГТФ или Gβγ через их взаимодействие с цитоплазматическим доменом GBD С-конца РС-1, поскольку GBD участвует в регуляции сигнала, поступающего от этих субъединиц. В свою очередь, GBD связан на терминальном С-конце РС-1 со свернутым в спираль (coiled coil) доменом, с которым взаимодействует акцессорный белок (в данном случае RGS7 – регулятор сигнала белков Gα). Например, при контакте RGS7 с Gαi блокируется апоптоз, комплекс RGS7/Gαq активирует кальцийнейрин для содействия переноса ядерного фактора активированных Т-клеток (NFAT) в ядро (Hama, Park, 2016). Другие акцессорные белки, такие как AGS3, вблизи РС-1 могут преграждать путь субъединицам G-белка для содействия регуляции катионного канала РС-2 через Gβγ-зависимый механизм (Kwon et al., 2012). Однако есть сведения о том, что AGS3 может контролировать PC-1-зависимую сигнализацию G-белка, взаимодействуя не с самим РС-1, а с активированными субъединицами G‑белка. В частности, AGS3 способен связывать несколько неактивных субъединиц Gαi/o-ГДФ и функционировать как ингибитор диссоциации этого комплекса (Hama, Park, 2016).
Акцессорные белки взаимодействуют также с другими типами рецепторов, образующих комплекс с цитокинами – полипептидными медиаторами, участвующими в формировании и регуляции защитных реакций организма (Wesche et al., 1997; Evavold, Kagan, 2018). К числу цитокинов, ответственных за инициацию воспаления, относится интерлейкин-1 (IL-1), активирующий Т-хелперы и лимфоциты. Для рецептора IL-1 известен акцессорный белок (AcP), роль которого сводится к поддержанию конформации комплекса рецептор-лиганд (Wesche et al., 1997; Evavold, Kagan, 2018). Члены семейства toll-подобных мембранных рецепторов миеломоноцитарных клеток (TLR-2 и TLR-4) обеспечивают первичное распознавание различных типов патогенов. В случае бактериальных липополисахаридов (ЛПС) возможность их взаимодействия с рецептором TLR-4 наступает после освобождения липида А – токсического компонента ЛПС из клеточной стенки после разрушения полисахаридной капсулы бактерий во время клеточного деления или их гибели под действием бактерицидных факторов (Сусков и др., 2012). TLR-2 и TLR-4 формируют высокоаффинный комплекс для распознавания ЛПС с участием акцессорных молекул CD14, CD11/CD18 и МD2 (Trono, 1995; Сусков и др., 2012).
Т-лимфоциты и другие иммунокомпетентные клетки содержат рецептор CD-4, с которым связываются РНК-содержащие ретровирусы, в частности, вирусы иммунного дефицита приматов и HIV-1 человека (Trono, 1995). После проникновения вируса в клетку начинается репликация вирусного генома, кодирующего, помимо репликативных и регуляторных белков, еще и акцессорные белки (Trono, 1995; Swanstrom, Wills, 1997). Например, вирусный акцессорный белок Vpu понижает уровень рецептора CD-4 и усиливает высвобождение вириона из инфицированных клеток, а белок Vif проявляет себя в начале инфекции, в частности, при упаковке белков в вирион или при его модификации в процессе сборки. Акцессорный Vpr накапливается в ядре инфицированных клеток, нарушая клеточный цикл, а Nef синтезируется на всех стадиях экспрессии вирусных генов (Trono, 1995; Wildum et al., 2006).
Недавно механизм функционирования двух вирусных акцессорных белков (Nef и Vpu) был исследован более подробно. Оказалось, что оба белка уменьшают клеточную поверхность и содержание трансмембранного рецептора CD28, который обеспечивает презентацию вирусного антигена T-лимфоцитам для стимуляции иммунного ответа (Pawlak et al., 2018). Удаление рецептора CD28 с клеточной поверхности осуществляется эндоцитозом с помощью белков Nef и Vpu с последующей деградацией рецептора в мембранной системе ERAD. С использованием мутантных вирусов, дефицитных по дилейциновому мотиву LL165 в акцессорном белке Nef, участвующем в образовании комплекса адаптерных белков, а также по мотиву, состоящему из двух остатков аспарагиновой кислоты (DD175), причастному к связыванию вакуолярной АТФазы, показана критическая роль таких мотивов в регуляции поверхности клетки и общего уровня рецептора CD28. Аналогичный эффект оказывало и отсутствие фосфорилирования сериновых остатков в мотиве S52/56 акцессорного Vpu (Pawlak et al., 2018). Таким образом, клетки млекопитающих, призванные защищать организм, участвуют в поддержании противоположного процесса – обеспечении жизнеспособности вируса и соответственно развитию иммунодефицита организма-хозяина.
Факторы ESCRT (эндосомного сортирующего комплекса) вместе с компонентами раннего секреторного пути и белки, гомологичные ретикулону хозяина (RHP), вовлечены в комплексе с акцессорными белками в динамику мембран при взаимодействии вирусных белков с мембранами клеток растения-хозяина (Jiang, Laliberté, 2016).
В растениях “замолкание” РНК является эволюционно консервативным механизмом и участвует в поддержании фитоиммунитета. Важными компонентами эффекторных комплексов замолкания являются белки Argonaute (AGO) (Carbonell, Carrington, 2015). AGO вместе с акцессорными белками образуют эффекторный комплекс замолкания. Например, AGO4 растений Arabidopsis связывается с акцессорным белком для образования транскрипционного комплекса замолкания, индуцируемого РНК (RITSC) (Csorba, Burgyán, 2016).
ФУНКЦИИ АКЦЕССОРНЫХ БЕЛКОВ В МЕМБРАННОМ ТРАНСПОРТЕ
Около трети эукариотического протеома проходит секреторным путем к конечному использованию внутри или вне клетки. Поэтому необходимы специфическая сортировка и доставка белков (Wiseman et al., 2007). Эти белки включают в себя растворимые и интегральные мембранные компоненты, именуемые “грузовыми белками” (Van Vilet et al., 2003). Их перенос осуществляется по мембранной системе, содержащей органеллы секреторных и эндоцитозных путей, включающих ЭР, АГ, промежуточный компартмент между ЭР и АГ, лизосомы, эндосомы и плазматическую мембрану (Корнилова, 2014; Фокин и др., 2014). В клетках растений дополнительно присутствуют вакуоли, которые могут обладать функцией лизосом (Ferguson, 2012).
В общем случае везикулярный транспорт, вероятно, функционирует с помощью похожих молекулярных механизмов во всех эукариотических клетках. Об этом свидетельствует участие многих малых ГТФаз (Rab-белков), SNARE (рецепторных белков), осуществляющих слияние пузырьков с мембранами при антероградном (ЭР → АГ) и ретроградном (АГ → ЭР) транспорте, а также с плазматической или лизосомной мембранами (Ueda, Nakano, 2002; Jackson, 2009; Корнилова, 2014). Значительная роль в этих процессах отводится акцессорным белкам. С их участием секреторный и эндоцитозный транспорт обеспечивает высокий уровень регуляции разнообразных белков, в том числе мембранных, таких как рецепторы, транспортеры и ионные каналы, позволяя клетке быстро приспосабливаться к меняющимся условиям окружающей среды (Richter et al., 2009; Peer, 2011; Хайтлина, 2014).
АКЦЕССОРНЫЕ БЕЛКИ ПРОКАРИОТ И НИЗШИХ ЭУКАРИОТ
У бактерий многие белки после синтеза на рибосомах секретируются во внешнюю среду. В грамотрицательных бактериях, в отличие от грамположительных, такие белки секретируются из цитоплазмы в периплазматическое пространство, а затем – за пределы клетки. Транспорт в периплазму происходит при участии одного из трех разных путей: Sec, Tat и SRP. Через транслокон Tat белки транспортируются в неизменном виде, а через Sec-путь (по которому у прокариот переносится наибольшая доля секретируемых и мембранных белков) молекулы в ходе транслокации должны быть полностью развернуты до состояния вытянутой полипептидной цепи, после чего подвергаются рефолдингу в периплазме с участием цитоплазматического шаперона SecB и акцессорных белков SecD, SecF, YidC и YajC. Путь SRP является ко-трансляционным, т.е. осуществляет экспорт полипептидной цепи, которая продолжает синтезироваться на рибосоме (Аксамбаева, Шустов, 2015).
Для дрожжей показано, что акцессорные белки Shr3p и Gsf2p участвуют в правильной укладке грузовых белков AAP и Hxt1p соответственно, и для разрешения их транспорта из ЭР (Kota, Ljungdahl, 2005).
У некоторых целлюлитических бактерий и аскомицетов (сумчатых грибов), осуществляющих гидролиз целлюлозы, были найдены акцессорные белки сволленины, имеющие некоторую гомологию с экспансинами, играющими роль в росте клеток растений, созревании фруктов или в других процессах, связанных с ослаблением клеточной стенки (Walsh, 2014). Сволленины также обнаружены в разрушающих древесину базидиомицетах: трутовике Laetiporus sulphureus и вешенке Pleurotus ostreatus (Valadares et al., 2016).
АКЦЕССОРНЫЕ БЕЛКИ ЭНДОПЛАЗМАТИЧЕСКОГО РЕТИКУЛУМА
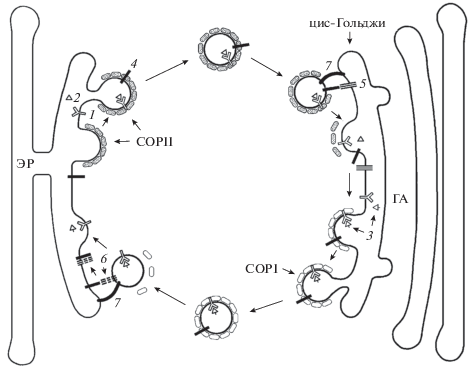
После синтеза на рибосомах, связанных с ЭР, грузовые белки пересекают мембрану ЭР, внутри которого они правильно сворачиваются и обрабатываются. Фолдинг белков в пределах секреторного пути должен обеспечить нормальную их конформацию и специфичность. Неправильно упакованные молекулы, на долю которых приходится около 30% от общего количества полипептидов в клетке, направляются на деградацию (Yamamoto, 2009). После укладки белки переносятся в промежуточный компартмент между ЭР и цис-Гольджи, именуемый везикулярно-тубулярным кластером, или непосредственно в цис-Гольджи с участием акцессорных белков через пузырьки ЭР, окаймленные комплексом II (везикулы COPII) для дальнейшей обработки и сортировки. Сортировка может также происходить в эндосомах (Ferguson, 2012; Хайтлина, 2014). На рис. 1 приведен пример антероградного и ретроградного переноса резидентного белка ЭР с участием акцессорного рецептора.
Рис. 1.
Антероградный и ретроградный перенос резидентного белка эндоплазматического ретикулума в системе ЭР–АГ. Акцессорный рецептор K/HDEL (1) распознает С-концевой тетрапептидный мотив возвратного сигнала KDEL резидентного белка ЭР (2). Этот комплекс загружается в почкующуюся от ЭР везикулу с окаймлением COPII и переносится в цис-Гольджи. После модификации резидентный белок (3) вместе с рецептором возвращается в ЭР в везикулах – производных АГ с окаймлением COPI; 4 – v-SNARE – рецептор прикрепления пузырька-донора ЭР к цистерне цис-Гольджи; 5 – t-SNARE – трехчленный рецептор на мембране цис-Гольджи, он связывается c v-SNARE после удаления окаймления COPII и прикрепления везикулы к мембране цис-Гольджи; 6 – t-SNARE – трехчленный рецептор на мембране ЭР; связывается с v-SNARE после удаления окаймления и привязки везикулы АГ к мембране ЭР; 7 – привязочный трос. Схема построена на основе данных, представленных в работе Barlowe, Miller, 2013.
Селективно рекрутируемые в пузырьки секреторные грузовые белки можно разделить на две группы: 1) белки, которые непосредственно связываются с компонентами окаймления COPII через последовательности мотивов выхода из ЭР и 2) белки, которые нуждаются в специфических акцессорных белках для связывания их с пузырьками COPII (Baines, Zhang, 2007). В ЭР некоторые акцессорные белки несут экспортный мотив, распознаваемый окаймлением COPII, а также имеют домен, взаимодействующий с секретируемым грузом, позволяющий его загружать (Wendeler et al., 2007; Ferguson, 2012). Акцессорные белки в ЭР разделяют на три группы: экипировщики, конвоиры (или эскорты) и транспортные рецепторы (или гиды) (Herrmann et al., 1999; Ferguson, 2012).
Экипировщики участвуют в установлении или поддержании нужной конформации грузового белка и включают в себя специфические катализаторы фолдинга и, по мнению авторов, шапероны, которые остаются в ЭР. В этом случае сам белок должен иметь в ЭР мотив выхода и нуждается в экипировщике, обеспечивающем правильную конфигурацию, позволяющую этому мотиву взаимодействовать с пузырьками COPII (Herrmann et al., 1999). Примером является экипировщик Shr3p в дрожжах, переносящий пермеазы аминокислот, например, Gap1p, в плазматическую мембрану (Ljungdahl et al., 1992). Еще одна роль экипировщиков заключается в “маркировке” грузовых белков при выходе из ЭР (например, для их фосфорилирования в цис-Гольджи), или в активном участии в доставке груза в везикулу COPII (Saito et al., 2009).
Конвоиры обладают аналогичными функциями, но отличаются от экипировщиков тем, что сопровождают свои грузовые белки в цис-цистерны Гольджи, поэтому включают в себя регуляторные молекулы, необходимые для предотвращения преждевременного связывания субстратов с грузовым белком (Herrmann et al., 1999). Хорошо изученным примером эскортного белка млекопитающих является RAP, участвующий в правильной локализации семейства рецепторов для липопротеинов низкой плотности (ЛНП). При отсутствии RAP рецепторы ЛНП слишком быстро связываются с лигандами и избыточно накапливаются в ЭР, поэтому подлежат деградации (Bu, Schwartz, 1998; Barlowe, Miller, 2013). Белки Rab из семейства ГТФаз синтезируются как растворимые молекулы в цитозоле, где они распознаются эскортным белком REP и предоставляются ферменту геранилгеранилтрансферазе для добавления одной или двух липидных групп геранилгеранила к цистеиновым остаткам С-конца белков Rab. Это обеспечивает стабильную и целенаправленную вставку Rab-ГТФаз в мембрану (Agola et al., 2011).
Транспортные рецепторы или проводники третьей группы акцессорных белков также циркулируют между ЭР и АГ, однако они участвуют в непосредственном взаимодействии с окаймлением везикул COPII, обеспечивая информацию, необходимую для селективного поглощения грузовых молекул (Herrmann et al., 1999). Например, транспортными рецепторами млекопитающих является комплекс белков LMAN1/MCFDC, участвующих в переносе факторов V и VIII свертывания крови и двух лизосомных белков – катепсона C и катепсона Z. Цитоплазматический хвост LMAN1 содержит мотив выхода из ЭР – это два фенилаланина, взаимодействующих с окаймлением COPII, что позволяет осуществлять избирательную доставку груза (Baines, Zhang, 2007).
Открытие трех акцессорных белков у ЭР Arabidopsis thaliana – AXR4, PHF1 и NAR2.1 – показывает, что такие соединения функционируют также в растениях. AXR4 является предполагаемым экипировщиком, избирательно регулирующим локализацию переносчика ауксина в плазматической мембране. AXR4 имеет два консервативных домена эстеразы и липазы на С-конце (Dharmasiri et al., 2006). Поэтому этот белок может способствовать мембранному обороту путем модификации переносчика ауксина, что позволяет ему быть узнаваемым в качестве груза везикулами COPII (Dharmasiri et al, 2006; Ferguson, 2012). Переносчик фосфата PHF1 также является экипировщиком, поскольку он локализуется в ЭР и не обнаружен в везикулах COPII (González et al., 2005). Другим возможным растительным акцессорным белком-экипировщиком в ЭР является NAR2.1, регулирующий локализацию в плазматической мембране белка NRT2.1 с высоким сродством к нитрату (Wirth et al., 2007). Недавно было показано, что у растений (Арабидопсис, рис) присутствуют акцессорные белки UreD, UreF и UreG, взаимодействующие с уреазой, доставляющей никель из окружающей среды в корневые клетки. Наиболее важным компонентом, обеспечивающим максимальную активность уреазы, является UreG (Myrach et al., 2017). Этот белок имеет на N-конце высококонсервативную последовательность, охватывающую два сайта, связывающих металл (Myrach et al., 2017).
АКЦЕССОРНЫЕ БЕЛКИ, АССОЦИИРОВАННЫЕ С АППАРАТОМ ГОЛЬДЖИ
Известно, что белки, после их модификации в АГ, транспортируются в окаймленных пузырьках COPI в трех направлениях: ретроградном в ЭР, антероградном в лизосомный компартмент и к плазматической мембране в виде секреторных везикул. При ретроградном движении пузырьки доставляют из цис-АГ в ЭР резидентные рециклирующие белки, например, маркерный белок ЭР – KDEL-R (Фокин и др., 2014), глицерофосфолипиды с ферментами гликозилирования (Jackson, 2009). Акцессорный белок рабаптин-5, взаимодействуя с адаптерами клатрина, в частности, с γ1-адаптином – субъединицей комплекса клатринового адаптера АР-1, участвует в транспорте пузырьков от транс-Гольджи к эндосомному компартменту (Bonifacino, 2004). Коробко с соавторами показали, что γ-изоформа рабаптина-5 также ассоциирована с транс-Гольджи, причем, в везикулах АГ, свободных от клатринового окаймления (Коробко и др., 2014). Попутно отметим, что рабаптин-5, в комплексе с рабекс-5 (фактором обмена нуклеотидов для ГТФазы Rab5) является эффектором этой ГТФазы и необходимым компонентом в процессе слияния ранних эндосом, а также может участвовать в Rab4-зависимой быстрой рециклизации эндосом (Коробко и др., 2014).
УЧАСТИЕ АКЦЕССОРНЫХ БЕЛКОВ В ФОРМИРОВАНИИ ЭНДОЦИТОЗНЫХ И СЕКРЕТОРНЫХ ПУЗЫРЬКОВ
Рецептор-опосредованный эндоцитоз (РОЭ) представляет собой избирательный способ поглощения клеткой лигандов, к которым относятся пептидные факторы роста, ЛНП, трансферрин, транспортеры, ионные каналы и др., а также токсины и вирусы (Lajoie, Nabi, 2007; Корнилова, 2014). Клатрин-зависимый РОЭ начинается через формирование окаймленных клатрином ямок, инициируемое адаптерными белками (АР-2), захватывающими молекулы грузов после связывания рецептора с лигандом и запускающими сборку клатрина на плазматической мембране (рис. 2). В этот процесс вовлекаются акцессорные белки: β-аррестины, регулирующие трансдукцию сигнала от рецепторов GPCR, способствующие отбору грузовых белков, и CALM, участвующие в правильном образовании клатриновой решетки (Попова и др., 2013). Дополнительное искривление мембраны усиливается такими акцессорными белками как амфифизин и эндофилин, содержащими домены BAR (bin/amphiphysin/rvs) серповидной формы. Показано, что большая часть известных BAR-доменных белков вовлечена в клатрин-зависимый или кавеолин-зависимый эндоцитоз, причем, такие белки связываются с мембранами за счет электростатических взаимодействий положительно заряженных аминокислотных остатков BAR-домена с отрицательно заряженными липидами (Neumann, Schmid, 2013). Дальнейшая деформация мембраны и полимеризация клатрина приводят к формированию окаймленного клатрином пузырька, связанного с основной частью мембраны только узким перешейком. Для полного отсоединения пузырька необходим дополнительный акцессорный белок динамин, обладающий ГТФазной активностью. Предполагается, что амфифизин рекрутирует к формирующемуся пузырьку динамин и облегчает его олигомеризацию (Попова и др., 2013). После гидролиза ГТФ динамином происходит его самосборка в подобные воротнику структуры вокруг суженной шейки ямки, что катализирует отделение мембраны, приводящее к образованию окаймленного клатрином пузырька (Попова и др., 2013).
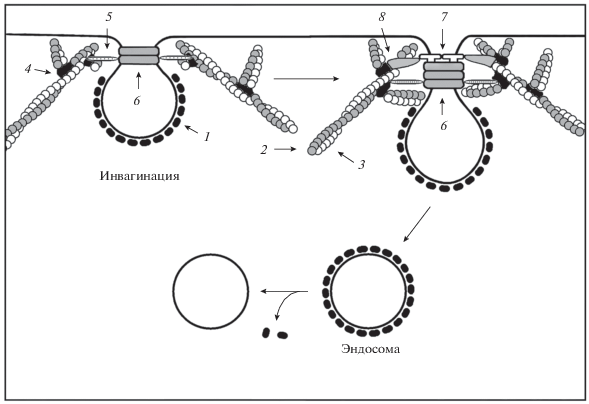
Рис. 2.
Образование клатрин-зависимых пузырьков при рецептор-опосредованном эндоцитозе. Адаптерный белок АР-2 (на схеме не показан), захватывает молекулы грузов после связывания рецептора с лигандом, инициирует кривизну мембраны и запускает на ней сборку клатрина (1). Под мембраной в этом участке начинается олигомеризация актина (2, 3) с образованием дендрито-подобных филаментов с участием акцессорного белка Arp2/3 (4) и кортактина (5), рекрутирующих динамин (6), охватывающий перешеек инвагинации, что способствует ее углублению. Далее в этот процесс вовлекаются акцессорные белки: содержащий BAR-домены амфифизин (7) и белок WASP (8). В итоге из инвагинации формируется эндоцитозный пузырек с последующим сбрасыванием клатринового окаймления.
При другом виде РОЭ – кавеолин-рафт-зависимом эндоцитозе – пузырьки-кавеолы, содержащие груз, формируются из мембранных участков, включающих рафты – плотно упакованные липиды, обогащенные холестерином и сфинголипидом, а также кавеолин-1, встроенный во внутреннюю часть липидного бислоя со стороны цитозоля. Отсоединению кавеол от мембраны способствуют динамин-2 (Dyn2) и регуляторы актинового цитоскелета (Lajoie, Nabi, 2007).
Интересные данные были получены при моделировании на липосомах механизма образования трубочек и пузырьков. Оказалось, что из трех акцессорных белков (амфифизин, эндофилин и нексин SNX9, распознающие молекулы грузов) только первые два способны формировать трубочки из плоских мембранных шаблонов и совместно с акцессорным белком мультидоменным Dyn2 катализировать высвобождение пузырьков в присутствии ГТФ (Neumann, Schmid, 2013). Таким образом, в экспериментах in vitro для выхода пузырьков так же, как и при эндоцитозе, необходима ГТФазная активность Dyn2 (Traub, 2015). Более того, даже после образования трубок в присутствии амфифизина, добавление Dyn2 без ГТФ вызывало их быстрое разрушение, не говоря уже об отсутствии формирования пузырьков (Neumann, Schmid, 2013). Все три акцессорных белка содержат домен SH3 для их взаимодействия с Dyn2, а у амфифизина и эндофилина есть также домен N-BAR с N-концевой спиралью, повышающей чувствительность мембраны к кривизне. Но у нексина указанный домен не имеет такой спирали и соседствует с доменом РХ, связывающим фосфоинозитиды, что, вероятно, не способствует формированию трубок. Разные эффекты амфифизина, эндофилина и нексина на катализируемое Dyn2 образование трубок и пузырьков указывают на возможность того, что иерархия взаимодействий домена SH3 может регулировать функцию Dyn2 in vivo (Neumann, Schmid, 2013). Кроме того, динамин вовлекается в открепление от АГ новообразованных пузырьков, и участвует в их слиянии с мембраной при экзоцитозе (Orth et al., 2002; Хайтлина, 2014).
ЦИТОСКЕЛЕТ И АКЦЕССОРНЫЕ БЕЛКИ
В эукариотических клетках транспортная система, охватывающая все виды органелл, а также мембранный оборот при эндо- и экзоцитозе, осуществляется с помощью цитоскелетных элементов – актиновых микрофиламентов и микротрубочек с целью передачи сигналов и доставки грузов к соответствующим компартментам (Lajoie, Nabi, 2007; Гиоева, 2014; Хайтлина, 2014; King, 2017). В отношении третьего компонента цитоскелета – промежуточных филаментов – известно, что ему и клетке в целом свойственна высокая сопротивляемость различным деформациям, что, вероятно, обусловлено сложными взаимодействиями этих структур с микрофиламентами и микротрубочками через моторы и сшивающие агенты (линкеры), относящиеся к акцессорным белкам (Huber et al., 2013). Такие белки благодаря их специализированным функциям, зависящим от задач, играют существенную роль в организации и динамике микрофиламентов и микротрубочек.
Типичные акцессорные белки актина классифицируют по их способу действия на три категории: 1) регуляторы зарождения (нуклеации) новых филаментов, 2) линкеры и 3) регуляторы де- и полимеризации (Huber et al., 2013). Так, спонтанная нуклеация подавляется такими акцессорными белками как профилин, тимозины, в то же время позволяющими мономерному актину и другим строительным блокам оставаться доступными для двух типов высокоэффективных инициаторов нуклеации – Arp2/3 (actin-related proteins) и форминов (Huber et al., 2013). Arp2/3 может присутствовать в пассивной и активированной форме, причем функцию активации комплекса Arp2/3 выполняют белки семейства WASP/Scar. Когда с филаментом актина связывается комплекс Arp2/3, он служит нуклеатором полимеризации новых нитей под углом 70°, при этом медленный минус-конец филамента диссоциирует на мономеры с участием кофилина (Huber et al., 2013; Хайтлина, 2014). К сшивающим микрофиламенты агентам относятся акцессорные белки фасцин, филамин, α-актинин (Huber et al., 2013). На динамику полимеризации актина существенно влияют такие акцессорные белки, как кэпирующие (запирающие) на плюс-конце филамента capZ и гельзолин, усилители элонгации формины, стабилизаторы филаментов тропомиозины, усилители деполимеризации и индукторы расчленения филаментов кофилин, северин (Huber et al., 2013). Например, в расслабленной мышце (в отсутствие ионов кальция) тропомиозины вместе с комплексом другого акцессорного белка, тропонина, препятствуют доступу миозина к своему месту связывания на актине. В присутствии ионов кальция комплексы тропомиозин/тропонин допускают взаимодействия миозина c актином, обеспечивая, тем самым, начало сократительной активности филамента (King, 2017).
При образовании наружных выпячиваний (ламеллоподий и филоподий), в частности, у ползущих по субстрату фибробластов, полимеризация актина происходит изнутри в сторону мембраны. В этом случае кортикальный слой (по периметру клетки) формирует плотную сеть актиновых микрофиламентов. Этот слой постоянно меняет свое агрегатное состояние, переходя из структурированного геля в жидкий золь. Здесь, в ассоциации с актиновыми микрофиламентами, находятся акцессорные белки-стабилизаторы (например, филамин), образующие сшивки в местах пересечения филаментов, придавая жесткость кортикальному слою. Такая жесткость может быть снята взаимодействием филаментов с другими акцессорными белками, например, гельзолином, вызывающими разборку филаментов и, тем самым, разжижение геля (Huber et al., 2013).
В отношении микротрубочек идентифицирован ряд сшивающих агентов и других акцессорных белков, которые могут вызывать связывание нитей между собой и (или) мономеров тубулина, влиять на скорость полимеризации или (де)стабилизировать всю нить через изменения динамики связывания и разъединения (Huber et al., 2013). Наиболее важные из этих белков, включая белок Таu, относятся к семейству MAP (microtubule accessory proteins). Например, MAP2 и Tau имеют общий взаимодействующий с тубулином домен и обычно присутствуют в нейронах.
Акцессорные белки, регулирующие полимеризацию цитоскелета и участвующие в инициации кривизны мембраны с последующим формированием секреторных и эндоцитозных пузырьков, функционируют в кооперации друг с другом. Так, при клатрин-зависимом эндоцитозе направление полимеризации актина c формированием ветвящегося конца может быть обращено к эндоцитозным пузырькам. Белки, содержащие домены BAR, EFC или RCB/IMD, рекрутируют акцессорные белки динамин, кортактин и белки семейства WASP/Scar, регулируемые малыми ГТФазами и протеинкиназами для индукции кривизны и образования перешейка мембранного пузырька с одновременной полимеризацией актина, запускаемой нуклеатором Arp2/3 (Takenawa, Suetsugu, 2007; Huber et al., 2013; Traub, 2015). Удлиненный ветвящийся конец актина отталкивает формирующийся пузырек от мембраны, обеспечивая дополнительные условия для ее отделения (рис. 2).
На короткое расстояние пузырьки переносятся с помощью скользящего по микрофиламенту миозинового мотора, а при переносе на большие дистанции по микротрубочкам используются двигатели-транспортеры кинезины, регуляция перемещения которых, как полагают, происходит в их кооперации с АБ (Гиоева, 2014). Передвижение пузырьков на большое расстояние также может осуществляться актиновыми “кометоподобными хвостами”, в формировании которых участвует семейство белков WASP как активаторов дендрито-подобной полимеризации актина (Orth et al., 2002; Cheng et al., 2012; Хайтлина, 2014).
АКЦЕССОРНЫЕ БЕЛКИ РЕПЛИКАЦИИ ДНК
Осуществляемая в ядре репликация ДНК требует согласованных действий многих ферментов и других кофакторов. При подготовке к синтезу ДНК, она должна стать одноцепочечной в качестве шаблона для репликативных ДНК-полимераз. Именно эта форма ДНК склонна к повреждениям любого вида. Существует набор белков, поддерживающих репликативный пул при выполнении точного и быстрого синтеза ДНК, а также предотвращающих повреждение промежуточной одноцепочечной ДНК. Эти белки называются акцессорными белками репликации ДНК. Из них наиболее известны три: фактор процессивности или скользящий зажим (sliding clamp), погрузчик зажима (clamp loader) или фактор репликации С (RF-C) и белок, связывающийся с одноцепочечной ДНК или белок репликации А (RP-А). RP-А участвует также в репарации ДНК и рекомбинации гомологичной ДНК (Hubscher et al., 1996). Упрощенная модель работы погрузчика зажима и скользящего зажима показана на рис. 3.
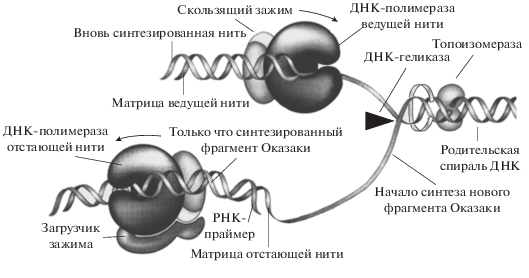
Рис. 3.
Акцессорные белки репликации ДНК. После раскручивания топоизомеразой двухцепочечной ДНК и ее расщепления ДНК-геликазой на две одноцепочечные нити, белок скользящего зажима и загрузчик зажима помещают ДНК-полимеразу на праймер РНК и поддерживают их стабильную связь с матрицей. Сборка зажима вокруг ДНК требует гидролиза АТФ с помощью загрузчика зажима, когда он поставляет его к развилке матрицы праймера. Скользящий зажим удерживает полимеразу на ДНК, пока этот фермент движется (синтезирует фрагмент Оказаки), но освобождает ее, как только полимераза должна работать впереди двухцепочечной области ДНК. Загрузчик зажима диссоциирует в раствор после того, как зажим будет собран. Публикуется по: Спивак, 2011 с любезного разрешения автора.
Другие акцессорные белки репликации ДНК участвуют в функционировании 3'-5'-экзонуклеазы, ДНК-праймазы, РНКазы H, 5'-3'- экзонуклеазы, ДНК-хеликаз и ДНК-лигаз (Hubscher et al., 1996). Интересно, что бактериальные NAD-зависимые ДНК-лигазы способны значительно увеличивать выход длинных продуктов ПЦР при проведении амплификации с использованием бактериальных ДНК-полимераз семейства А. ДНК-лигазы Taq и Tth способны улучшать результаты ПЦР даже в отсутствие NAD и, следовательно, в отсутствие лигазной активности. На этом основании предположили, что бактериальные ДНК-лигазы взаимодействуют с этими ДНК-полимеразами как АБ, повышающие эффективность синтеза ДНК (Игнатов, Крамаров, 2009).
ЗАКЛЮЧЕНИЕ
Итак, в жизнедеятельности организмов любого уровня сложности исключительно важную роль играют акцессорные белки, осуществляющие контроль над правильным протеканием большинства, если не всех, биохимических процессов в клетке: фолдинга макромолекул, целевой доставки груза, трансдукции сигналов, реорганизации элементов цитоскелета, репликации ДНК, участия в защитных реакциях. В последние годы становится очевидным комплексное взаимодействие нескольких видов акцессорных белков как между собой (вероятно, для взаимного контроля правильной укладки собственных полипептидов), так и с другими регуляторными молекулами для обеспечения тонкой регулировки c целью повышения эффективности работы всех звеньев метаболизма (Walsh, 2014). Появляется все больше сведений о том, что такой важный процесс, как передача сигналов через GPCR и сопряженный с ним G-белок, дополнительно регулируется и акцессорными белками, благодаря которым такая сигнализация может контролироваться по интенсивности, продолжительности и, возможно, месту действия (Park, 2015). В этой связи возникают вопросы, требующие дальнейших исследований.
Например, необходимо установить, зависит ли эффективность связывания акцессорных белков от подтипа субъединиц Gα и степени их активности, а также от комплекса Gβγ. Также следует выяснить, являются ли Gα или Gβγ основными сигнальными эффекторами после взаимодействия с акцессорными белками, и есть ли положительное или отрицательное влияние этих компонентов на эффективность сигнализации. Существуют ли различия в структуре акцессорных белков и шаперонов, поскольку последние, как и акцессорные белки, могут участвовать в фолдинге белковых цепей, предотвращая их агрегацию или деградацию. В последнее время некоторые авторы к акцессорным белкам бактерий и архей относят многие ферменты (ДНК- и РНК-рестриктазы, хеликазы, протеазы, АТФазы, ABC-транспортеры), участвующие в защитных ответах, направленных против атаки патогенов (Shah et al., 2018). На наш взгляд, есть основания различать ферментные системы от собственно акцессорных белков, которые должны обеспечивать сохранность и, соответственно, активность таких ферментов и других полипептидов. Рассмотренные примеры позволяют сделать вывод об исключительной важности функционирования АБ в организмах любого уровня сложности, причем, как на стороне хозяина, так и, в случае инфицирования, на стороне патогена. Но несмотря на накопленный массив данных, поле для исследований многообразия механизмов действия таких необходимых для метаболизма структур как АБ, продолжает оставаться широким.
Список литературы
Аксамбаева А.С., Шустов А.В. 2015. Секреторная экспрессия белков в E. coli. Eurasian J. Applied Biotechnol. Theory and Practice. 1 : 4–16. (Aksambaeva A.S., Shustov A.V. 2015. Secretory protein expression in E. coli. Eurasian J. Applied Biotechnol. Theory and Practice. 1 : 4–16.)
Гиоева Ф.К. 2014. Роль моторных белков в передаче сигнала. Биохимия. 79(9) : 1061–1069. (Gyoeva F.K. 2014. The role of motor proteins in signal propagation. Biochemistry (Moscow). 79 : 849-855.)
Игнатов К.Б., Крамаров В.М. 2009. ДНК-лигазы термофильных бактерий повышают эффективность ПЦР-амплификации длинных последовательностей ДНК. Биохимия. 74(5) : 685–6900. (Ignatov K.B., Kramarov V.M. 2009. DNA ligases from thermophilic bacteria enhance PCR amplification of long DNA sequences. Biochemistry (Moscow). 74 : 557–561.)
Корнилова Е.С. 2014. Рецептор-опосредованный эндоцитоз и цитоскелет. Биохимия. 79(9) : 1079–1094. (Kornilova E.S. 2014. Receptor-mediated endocytosis and cytoskeleton. Biochemistry (Moscow). 79 : 865–878.)
Коробко Е.В., Киселев С.Л., Коробко И.В. 2014. Характеризация γ-изоформы рабаптина-5. Биохимия. 79(9) : 1070-1078. (Korobko E.V., Kiselev S.L., Korobko I.V. 2014. Characterization of rabaptin5 γ isoform. Biochemistry (Moscow). 79 : 856-864.)
Попова Н.В., Деев И.Е., Петренко А.Г. 2013. Клатрин-зависимый эндоцитоз и белки-адапторы. Acta Naturae. 5 : 66–77. (Popova N.V., Deyev I.E., Petrenko A.G. 2013. Clathrin-mediated endocytosis and adaptor proteins. Acta Naturae. 5 : 62–74.)
Спивак И.М. 2011. Ключевые ферменты, участвующие в синтезе ДНК. В кн.: Репликация ДНК. СПб : СПбГПУ. 31–36.
Сусков С.И., Глебова М.В., Сускова В.С., Онищенко Н.А., Ермакова Л.П., Габриэлян Н.И. 2012. Механизмы противоинфекционной функции врожденного иммунитета при трансплантации: роль TOLL-подобных рецепторов. Вестник трансплантол. искусствен. органов. 14(2) : 116–123. (Suskov S.I., Glebova M.V., Suskova V.S., Onischenko N.A., Ermakova L.P., Gabrielyan N.I. 2012. Mechanisms of antiinfectious functions of innate immunity: role of toll-like receptors. Bull. Transplantol. Artificial Organs. 14 : 116–123.)
Фокин А.И., Бродский И.Б., Бураков А.В., Надеждина Е.С. 2014. Взаимодействие везикул раннего секреторного пути и аппарата Гольджи с микротрубочками и микротрубочковыми моторами. Биохимия. 79(9) : 1095–1109. (Fokin A.I., Brodsky I.B., Burakov A.V., Nadezhdina E.S. 2014. Interaction of early secretory pathway and Golgi membranes with microtubules and microtubule motors. Biochemistry (Moscow). 79 : 879–893.)
Хайтлина С.Ю. 2014. Внутриклеточный транспорт, основанный на полимеризации актина. Биохимия. 79(9) : 1135–1147. (Khaitlina S.Yu. 2014. Intracellular transport based on actin polymerization. Biochemistry (Moscow). 79 : 917–927.)
Шаназаров Н.А., Сабиров А.Х., Сироткина С.М. 2009. Роль эпидермального фактора роста и его рецептора в канцерогенезе: молекулярные механизмы их действия. Российский биотерапевт. журн. 8(4) : 85–90. (Shanazarov N.A., Sabirov A.Kh., Sirotkina S.M. 2009. Epidermal growth factor and its receptor participation in cancerogenesis: molecular mechanisms of action. Rus. Biotherapeut. J. 8 : 85–90.)
Agola J.O., Jim P.A., Ward H.H., Basu Ray S., Wandinger-Ness A. 2011. Rab GTPases as regulators of endocytosis, targets of disease and therapeutic opportunities. Clin. Genet. 80 : 305–318.
Baines A.C., Zhang B. 2007. Receptor-mediated protein transport in the early secretory pathway. Trends Biochem. Sci. 32 : 381–388.
Barlowe C.K., Miller E.A. 2013. Secretory protein biogenesis and traffic in the early secretory pathway. Genetics. 193 : 383–410.
Birnbaumer L. 2007. Expansion of signal transduction by G proteins: The second 15 years or so. From 3 to 16 alpha subunits plus betagamma dimmers. Biochim. Biophys. Acta. 1768 : 772–793.
Blumer J.B., Oner S.S., Lanier S.M. 2012. Group II activators of G-protein signalling and proteins containing a G-protein regulatory motif. Acta Physiol. 204 : 202–218.
Blumer J.B., Smrcka A.V., Lanier S.M. 2007. Mechanistic pathways and biological roles for receptor-independent activators of G-protein signaling. Pharmacol. Therapeut. 113 : 488–506.
Bonifacino J.S. 2004. GGA proteins, adaptors on the move. Nature Rev. Molec. Cell Biol. 5 : 23–32.
Bu G., Schwartz A.L. 1998. RAP, a novel type of ER chaperone. Trends Cell Biol. 8 : 272–276.
Buck T.M., Wright C.M., Brodsky J.L. 2007. The activities and function of molecular chaperones in the endoplasmic reticulum. Seminars in Cell Develop. Biol. 18 : 751–761.
Carbonell A.C., Carrington J.C. 2015. Antiviral roles of plant ARGONAUTES. Curr. Opinion Plant Biol. 27 : 111–117.
Cheng J., Grassart A., Drubin D.G. 2012. Myosin1E coordinated actin assembly and cargo trafficking during clathrin-mediated endocytosis. Mol. Biol. Cell 23 : 2891–2904.
Cismowski M.J., Ma C., Ribas C., Xie X., Spruyt M., Lizano J.S. 2000. Activation of heterotrimeric G-protein signaling by a ras-related protein: implications for signal integration. J. Biol. Chem. 275 : 23 421–23 424.
Cohen E.A., Subbramanian R.A., Göttlinger H.G. 1996. Role of auxiliary proteins in retroviral morphogenesis. Curr. Top Microbiol. Immunol. 214 : 219–235.
Csorba T., Burgyán J. 2016. Antiviral silencing and suppression of gene silencing in plants. In: Current Research Topics in Plant Virology. Switzerland: Springer Internat. Publ, 1–34.
Dharmasiri S., Swarup R., Mockaitis K., Dharmasiri N., Singh S.K., Kowalchyk M., Marchant A., Mills S., Sandberg G., Bennett M.J. Estelle M. 2006. AXR4 is required for localization of the auxin influx facilitator AUX1. Sci. 312 : 1218–1220.
Downes G.B., Gautam N. 1999. The G protein subunit gene families. Genomics. 62 : 544–552.
Evavold C.L., Kagan J.C. 2018. How inflammasomes inform adaptive immunity. J. Mol. Biol. 430 : 217–237.
Ferguson A. 2012. Identification and characterization of Arabidopsis ER accessory proteins. Thesis. UK: University of Nottingham. 228 p.
González G., Solano R., Rubio V., Leyva A., Paz-Ares J. 2005. Phosphate transporter traffic facilitator1 is a plant-specific SEC12-related protein that enables the endoplasmic reticulum exit of a high-affinity phosphate transporter in Arabidopsis. Plant Cell. 17 : 3500–3512.
Grow E.J., Flynn R.A., Chavez S.L., Bayless N.L., Wossidlo M., Wesche D.J., Martin L., Ware C.B., Blish C.A., Chang H.Y., Pera R.A.R., Wysocka J. 2015. Intrinsic retroviral reactivation in human preimplantation embryos and pluripotent cells. Nature. 522 : 221–225.
Hama T., Park F. 2016. Heterotrimeric G protein signaling in polycystic kidney disease. Physiol. Genomics. 48 : 429–445.
Hendriks-Balk M.C., Peters S.L., Michel M.C., Alewijnse A.E. 2008. Regulation of G protein-coupled receptor signalling: focus on the cardiovascular system and regulator of G protein signalling proteins. Eur. J. Pharmacol. 585 : 278–291.
Herrmann J.M., Malkus P., Schekman R. 1999. Out of the ER – outfitters, escorts and guides. Trends in Cell Biol. 9 : 5–7.
Hollinger S., Hepler J.R. 2002. Cellular regulation of RGS proteins: modulators and integrators of G protein signaling. Pharmacol. Rev. 54 : 527–559.
Huber F., Schnauß J., Rönicke S., Rauch P., Müller K., Fütterer C., Käs J. 2013. Emergent complexity of the cytoskeleton: from single filaments to tissue. Advances in Physics. 62 : 4–8.
Hubscher U., Maga G., Podust V.N. 1996. Chapter 17. DNA replication accessory proteins. In: DNA replication in eukaryoric cells. Zurich, Switzerland: Cold Spring Harbor Lab. Press, 525–543.
Jackson C.L. 2009. Mechanisms of transport through the Golgi complex. J. Cell Sci. 122 : 443–452.
Jiang J., Laliberté J.-F. 2016. Membrane association for plant virus replication and movement. In: Current Research Topics in Plant Virology. Switzerland: Springer Internat. Publishing, 67–86.
King M.W. 2017. Muscle biochemistry: structure and function. Organization of actin thin filaments. Med. Biochem. www.themedicalbiochemistrypage.org
Kota J., Ljungdahl P.O. 2005. Specialized membrane-localized chaperones prevent aggregation of polytopic proteins in the ER. J. Cell Biol. 168 : 79–88.
Kwon M., Pavlov T.S., Nozu K., Rasmussen S.A., Ilatovskaya D.V., Lerch-Gaggl A., North L.M., Kim H., Qian F., Sweeney W.E. Jr., Avner E.D., Blumer J.B., Staruschenko A., Park F. 2012. G-protein signaling modulator 1 deficiency accelerates cystic disease in an orthologous mouse model of autosomal dominant polycystic kidney disease. Proc. Nal. Acad. Sci. USA. 109 : 21462–21467.
Lajoie P., Nabi I.R. 2007. Regulation of raft-dependent endocytosis. J. Cell Mol. Med. 11 : 644–653.
Ljungdahl P.O., Gimeno C.J., Styles C.A., Fink G.R. 1992. SHR3: A novel component of the secretory pathway specifically required for localization of amino acid permeases in yeast. Cell. 71 : 463–478.
Modesti M., Kanaar R. 2001. Homologous recombination: from model organisms to human disease. Gen. Biol. 2 : 1014.1–1014.5.
Myrach T., Zhu A., Witte C.-P. 2017. The assembly of the plant urease activation complex and the essential role of the urease accessory protein G (UreG) in delivery of nickel to urease. J. Biol. Chem. 292 : 14 556–14 565.
Neumann S., Schmid S.L. 2013. Dual role of BAR domain-containing proteins in regulating vesicle release catalyzed by the GTPase, Dynamin-2. J. Biol. Chem. 288 : 25119–25128.
Orth J.D., Krueger E.W., Cao H., McNive M.A. 2002. The large GTPase dynamin regulates actin comet formation and movement in living cells. Proc. Nat. Acad. Sci. USA. 99 : 167–172.
Park F. 2015. Accessory proteins for heterotrimeric G-proteins in the kidney. Front. Physiol. : 1–27. doi org/https://doi.org/10.3389/ fphys.2015.00219
Pawlak E.N., Dirk B.S., Jacob R.A., Johnson A.L., Dikeakos J.D. 2018. The HIV‑1 accessory proteins Nef and Vpu down regulate total and cell surface CD28 in CD4+ T cells. Retrovirology. 15 : 1–22. doi https://doi.org/10.1186/s12977-018-0388-3
Peer W.A. 2011. Plasma membrane protein trafficking. In: The Plant Plasma Membrane, Plant Cell Monographs. 19. Berlin-Heidelberg: Springer-Verlag, 31–56.
Richter S., Voß U., Jürgens G. 2009. Post-Golgi traffic in plants. Traffic. 10 : 819-828.
Ross E.M., Wilkie T.M. 2000. GTPase activating proteins for heterotrimeric G proteins: Regulators of G protein signaling (RGS) and RGS-like proteins. Annu. Rev. Biochem. 69 : 795–827.
Saito K., Chen M., Bard F., Chen S., Zhou H., Woodley D., Polischuk R., Schekman R., Malhotra V. 2009. TANGO1 facilitates cargo loading at endoplasmic reticulum exit sites. Cell. 136 : 891–902.
Sato M. 2013. Roles of accessory proteins for heterotrimeric G-protein in the development of cardiovascular diseases. Circ. J. 77 : 2455–2461.
Sato M., Blumer J.B., Simon V., Lanier S.M. 2006. Accessory proteins for G proteins: Partners in signaling. Annu. Rev. Pharmacol. Toxicol. 46 : 151–187.
Shah S.A., Alkhnbashi O.S., Behler J., Han W., She Q., Hess W.R., Garrett R.A., Backofen R. 2018. Comprehensive search for accessory proteins encoded with archaeal and bacterial type III CRISPR-cas gene cassettes reveals 39 new cas gene families. RNA Biology. 1–13. doi https://doi.org/10.1080/15476286.2018.1483685
Smine A., Xu X., Nishiyama K., Katada T., Gambetti P., Yadav S.P. 1998. Regulation of brain G-protein go by Alzheimer’s disease gene presenilin-1. J. Biol. Chem. 273 : 16281–16288.
Swanstrom R., Wills J.W. 1997. Synthesis, assembly, and processing of viral proteins. Accessory proteins and assembly. In: Retroviruses. N.Y., Cold Spring Harbor: Cold Spring Harbor Laboratory Press, : 263–334.
Takenawa T., Suetsugu S. 2007. The WASP-WAVE protein network: connecting the membrane to the cytoskeleton. Nature Rev. Mol. Cell Biol. 8 : 37–48.
Traub L.M. 2015. F-BAR/EFC Domain proteins: some assembly required. Developmental Cell. 35 : 664-666.
Trono D. 1995. HIV accessory proteins: Leading roles for the supporting cast. Cell. 82 : 189–192.
Ueda T., Nakano A. 2002. Vesicular traffic: An integral part of plant life. Current Opinion Plant Biol. 5 : 513–517.
Valadares F., Gonçalves T.A., Gonçalves D.S.P.O., Segato F., Romanel E., Milagres A.M.F., Squina F.M., Ferraz A. 2016. Exploring glycoside hydrolases and accessory proteins from wood decay fungi to enhance sugarcane bagasse saccharification. Biotechnol. Biofuels. 9 : 1–44.
Van Vilet C., Thomas E.C., Merino-Trigo A., Teasdale R.D., Gleeson P.A. 2003. Intracellular sorting and transport of proteins. Progress in Biophys. Mol. Biol. 83 : 1–45.
Walsh G. 2014. Accessory proteins. In: Proteins. Biochemistry and Biotechnology. Manhattan, USA: John Wiley & Sons, Wiley-Blackwel. 340–366.
Wells A., Marti U. 2002. Signaling shortcuts: cell-surface receptors in the nucleus? Nature Rev. Mol. Cell Biol. 3 : 697–702.
Wendeler M.W., Paccaud J.-P., Hauri H.-P. 2007. Role of Sec24 isoforms in selective export of membrane proteins from the endoplasmic reticulum. EMBO Rep. 8 : 258–264.
Wesche H., Korherr C., Kracht M., Falk W., Resch K., Martin M.U. 1997. The interleukin-1 receptor accessory protein (IL-1RAcP) is essential for IL-1-induced activation of interleukin-1 receptor-associated kinase (IRAK) and stress-activated protein kinases (SAP kinases). J. Biol. Chem. 272 : 7727–7731.
Wildum S., Schindler M., Munch J., Kirchhoff F. 2006. Contribution of Vpu, Env, and Nef to CD4 down-modulation and resistance of human immunodeficiency virus type 1-infected T cells to superinfection. J. Virol. 80 : 8047–8059.
Wirth J., Chopin F., Santoni V., Viennois G., Tillard P., Krapp A., Lejay L., Daniel-Vedele F., Gojon A. 2007. Regulation of root nitrate uptake at the NRT2.1 protein level in Arabidopsis thaliana. J. Biol. Chem. 282 : 23 541–23 552.
Wiseman R.L., Powers E.T., Buxbaum J.N., Kelly J.W., Balch W.E. 2007. An adaptable standard for protein export from the endoplasmic reticulum. Cell. 131 : 809–821.
Wood M. 2009. Bashing botulism: scientists sleuth world’s most powerful toxins. Agricult. Res. 57 : 4–6.
Yamamoto K. 2009. Intracellular lectins involved in folding and transport in the endoplasmic reticulum. Biol. Pharmacol. Bull. 32 : 767–773.
Дополнительные материалы отсутствуют.
Инструменты
Цитология


