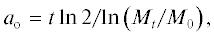Цитология, 2019, T. 61, № 4, стр. 272-285
Характеристика неиммортализованной линии мезенхимных стволовых клеток, выделенных из эпикардиальной жировой ткани человека
А. С. Мусорина 1, В. В. Зенин 1, В. И. Турилова 1, Т. К. Яковлева 1, Г. Г. Полянская 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: poljansk@incras.ru
Поступила в редакцию 15.11.2018
После доработки 28.12.2018
Принята к публикации 10.01.2019
Аннотация
Охарактеризована новая неиммортализованная линия мезенхимных стволовых клеток (МСК) из эпикардиальной жировой ткани человека (ADH-MSC), полученная от 50-летнего донора в процессе аортокоронарного шунтирования. В процессе длительного культивирования (пассажи 8–16) постепенно увеличивается доля стареющих клеток. Оценка активности β-галактозидазы показывает, что к пассажу 16 доля стареющих клеток достигает 66%. К этому времени проявляются и другие признаки, свидетельствующие о наступлении активной фазы репликативного старения: увеличиваются размеры клеток и степень их распластанности, существенно снижается эффективность клонирования и индекс пролиферации, увеличивается время удвоения клеточной популяции. В целом, полученные результаты подтверждают ограниченный срок жизни клеток линии ADH-MSC, характерный для неиммортализованных клеточных популяций. Кариотипический анализ показал, что на раннем 8-ом пассаже имеет место нормальный кариотип человека, но уже к пассажу 12 существенно увеличивается кариотипическая гетерогенность, усиливающаяся к пассажу 16 и превышающая допустимый уровень хромосомных нарушений в нормальных МСК. Показано образование новых структурных вариантов кариотипа (СВК). Обнаружено преимущественное участие короткого плеча одного из гомологов хромосомы 21 в клональных и неклональных перестройках, а также в дицентриках по типу теломерных ассоциаций. Показано уменьшение частоты полиплоидов в процессе длительного культивирования. На пассажах 8 и 16 выявлена высокая экспрессия поверхностных антигенов, характерных для МСК человека (CD44, CD73, CD90, виментин, CD105, HLA-ABC) и отсутствие экспрессии CD34, CD45, HLA-DR. На 8-м пассаже присутствует значительная экспрессия маркера ранней дифференцировки ЭCК – SSEA-4, которая существенно снижается на пассаже 16. На пассажах 8 и 16 клетки линии ADH-MSC способны с одинаковой интенсивностью дифференцироваться в остеогенном и хондрогенном направлениях. Интенсивность адипогенной дифференцировки снижается к пассажу 16. В целом, представленные результаты подтверждают статус МСК для полученной линии и свидетельствуют о существенных изменениях, происходящих в процессе раннего репликативного старения,связанных, возможно, с измененным микроокружением, в котором находились клетки донора с заболеванием сердца. Раннее старение и кариотипическая нестабильность могут быть связаны и с более значительными нарушением системы репарации ДНК клеток ADH-MSC по сравнению с другими линиями.
Важность исследований характеристик МСК вытекает из особенностей взаимодействия их с уникальным микроокружением (нишей), характерным для определенной ткани, которое регулирует пролиферацию, выживаемость, миграцию, старение, дифференцировочный потенциал и другие клеточные свойства посредством межклеточных взаимодействий и различных биоактивных молекул. Таким образом, происхождение МСК может определять их функциональные характеристики. Согласно требованиям Международного общества клеточной терапии, статус МСК разного происхождения определяется рядом общих характеристик. (Dominici et al., 2006; Sensebé et al., 2010).
Многие МСК, полученные из взрослых и эмбриональных тканей, имеют ограниченное применение из-за инвазивного способа их получения, малого количества полученных клеток в связи с невысоким пролиферативным потенциалом или этических проблем (Bongso, Fong, 2013). Тем не менее, несмотря на указанные сложности, отказываться от стволовых клеток из таких тканей нельзя. Благодаря определенной ниши, а значит и определенной модификации свойств МСК, некоторые из таких клеток могут оказаться важными как для фундаментальных, так и для прикладных исследований. Одним из таких важных объектов для фундаментальных и прикладных исследований являются стволовые клетки, выделенные из эпикардиальной жировой ткани взрослого человека, можно получить только при хирургической операции – аортокоронарном шунтировании (Krylova et al., 2011). Показано, что жировая ткань разного происхождения – подкожная и абдоминальная (висцеральная), расположенная между внутренними органами, обладает паракринными функциями (Berg et al., 2005; Hassan et al., 2012). Эпикардиальная жировая ткань представляет собой особую форму висцерального жира, расположенную вокруг сердца между миокардом и висцеральным перикардом, окружая оба желудочка. Есть данные, что эпикардиальная жировая ткань, являясь метаболически активным органом, генерирующим биологически активные вещества, влияющие на сердечную мышцу, проявляет повышенную секрецию медиаторов воспаления и хемокинов по сравнению с подкожной жировой тканью (Hassan et al., 2012). В настоящее время жировая ткань разной локализации широко используется для получения и характеристики стволовых клеток человека, обладающих, как правило, широким дифференцировочным потенциалом (Zuk et al., 2001; Krylova et al., 2011; Rada et al., 2011; Ogura et al., 2014; Lee et al., 2016; Nepali et al., 2018; Petersen et al., 2018).
Поскольку клеточные популяции каждого донора являются генетически уникальным материалом, важно исследовать генетический вклад индивидуального донора в характеристики МСК. Есть ряд данных, указывающих на вариации характеристик МСК между разными донорами (Bernardo et al., 2007; Redaelli et al., 2012; Lo Surdo et al., 2013; Stultz et al., 2016; Крылова и др., 2018). Тем не менее, необходимо подчеркнуть, что в настоящем исследовании мы имеем дело с нездоровыми донорами. Причем степень заболевания и, возможно, причины его могут быть разными. Поэтому помимо генетических причин, могут оказывать влияние еще специфические условия (микроокружение), в котором существовала ткань до выделения клеток. Учитывая эти факторы, необходимо исследовать не только характеристики, подтверждающие статус МСК на раннем пассаже, но и исследовать характеристики клеток в процессе длительного культивирования, включая репликативное старение.
Известно, что репликативное старение – комплексный процесс. Он характеризуется существенным снижением или прекращением пролиферации, морфологическими изменениями, увеличенной активностью β-галактозидазы, повышением уровня экспрессии туморсупрессорных генов, укорочением теломер, уменьшением дифференцировочного потенциала, рядом эпигенетических изменений и другими признакими. Процесс клеточного старения в МСК может начинаться на ранних пассажах и постепенно усиливаться в процессе культивирования (Wagner et al., 2008; Kuilman et al., 2010; Redaelli et al., 2012; Estrada et al., 2013; Savickiene et al., 2016; Danisovic et al., 2017; Кольцова и др., 2017, 2018; Alessio et al., 2018; Крылова и др., 2018; Truong et al., 2018). Репликативное старение связано с уменьшением репарации ДНК и антиоксидатной активности стареющих клеток, благодаря снижению экспрессии соответствующих генов (Niedernhofer et al., 2018; Yu et al., 2018). Причем на характер репликативного старения могут оказывать влияние стрессовые факторы, включая болезни (Yin, Pickering., 2016; Facchin et al., 2018; Сardenes et al., 2018; Shakeri et al., 2018; Stein et al., 2018; Sugihara et al., 2018).
Ранее из эпикардиальной жировой ткани 3-х доноров возраста от 45 до 50 лет в процессе аортокоронарного шунтирования были выделены фибробластоподобные клетки. Эти клетки были криоконсервированы на раннем пассаже. В результате дальнейшего культивирования от одного из доноров была получена неиммортализованная клеточная линия проявляющая свойства МСК (Krylova et al., 2011). Представляло интерес исследовать свойства фибробластоподобной линии, полученной от другого донора.
В настоящей работе стояли следующие задачи: 1) длительное культивирование фибробластоподобных клеток, выделенных из 2-го донора; анализ характеристик, подтверждающих статус МСК, для полученной линии на раннем пассаже (8); 2) сравнительный анализ доли клеток, проявляющих активность фермента β-галактозидазы, характеризующей процесс репликативного старения; 3) анализ ростовых характеристик, кариотипической изменчивости; наличие маркеров недифференцированных эмбриональных стволовых клеток (ЭСК), маркеров ранней дифференцировки ЭСК, поверхностных маркеров, дифференцировочного потенциала полученной линии при длительном культивировании.
МАТЕРИАЛ И МЕТОДИКА
Клетки. В работе использовали фибробластоподобные клетки, ранее выделенные из эпикардиальной жировой ткани от донора возраста около 50 лет в процессе аортокоронарного шунтирования (Krylova et al., 2011). В результате декриоконсервации и дальнейшего культивирования клеток до 8-го пассажа в ростовой среде при 5% СО2, 37°С и 90% влажности была получена неиммортализованная фибробластоподобная клеточная линия, названная ADH-MSC. Состав ростовой среды: 85% среды α-МЕМ (Биолот, Россия), 15% эмбриональной бычьей сыворотки (HyClone, США), 5нг/мл фактора роста βFGF (Sigma-Aldrich, США). Микробиологический анализ подтвердил отсутствие бактериальной, грибковой и микоплазменной контаминации в полученной линии.
Морфологический анализ клеток проводили с помощью инвертированного микроскопа (NICON, Япония).
Репликативное старение клеток оценивали по активности фермента β-галактозидазы. Клетки ADH-MSC выращивали в чашках Петри 3.5 см до образования субконфлюента. Затем среду удаляли и окрашивали клетки с помощью набора реактивов (Senescence β-galactosidase staining kit; Cell Signaling, США) согласно инструкции. У клеток, вступающих в фазу репликативного старения, цитоплазма имеет ярко-синюю окраску. Анализ проводили с помощью инвертированного микроскопа (NICON, Япония) на 8-, 12- и 16-м пассажах. Долю окрашенных клеток (%) определяли путем подсчета не менее 1000 клеток в разных полях зрения на одну временную точку.
Эффективность клонирования на 8- и 16-м пассажах определяли в чашках Петри в условиях редкого пассажа (3–4 кл./см2). Через 14 сут клетки окрашивали 1%-ным водным раствором кристалл-виолета и считали число колоний. Эффективность клонирования определяли по отношению числа выросших колоний (клонов) к числу посеянных клеток (%). Учитывали колонии, состоящие из не менее 20 клеток. Эксперимент повторяли трижды.
Для характеристики пролиферативной активности оценивали индекс пролиферации (ИП) – отношение числа клеток в текущий момент к исходному числу посеянных клеток и строили кривые роста клеточных популяций. Для измерения среднего времени удвоения клеточной популяции каждый экспериментальный вариант повторяли 3 раза, ежедневно считая клетки в течение 5 сут (120 ч). Среднее время одного удвоения клеточной популяции (ao) определяли по формуле (Седова, 2008):
где Mt – число клеток в момент времени t; M0 – начальное число клеток; t – время логарифмической фазы роста клеточной культуры. Пролиферативную активность анализировали на пассажах 8 и 16.Кариотипический анализ проводили на 8-, 12- и 16-м пассажах. Для получения препаратов метафазных хромосом за 3 ч до фиксациив клеток в среду вводили KaryoMAX (0.1 мкг/мл; Gibco, США), клетки диссоциировали с помощью 0.25%-ного раствора трипсина с ЭДТА (Gibco, Англия) и проводили гипотоническую обработку смесью 0.075 М раствора КСl и 1%-ного раствора цитрата натрия. Клетки фиксировали смесью метанола с ледяной уксусной кислотой (3 : 1) (Реактив, Россия). Для кариотипического анализа проводили дифференциальное G-окрашивание хромосом (Ozkinay, Mitelman, 1979). Анализировали 100 метафаз на каждом пассаже. Количество полиплоидов определяли при подсчете 1000 клеток в каждом варианте. Kариотип линии анализировали с помощью микроскопа Axio Imager.M1 (Carl Zeiss, Германия) с системой автоматического кариотипирования (Ikaros 4 karyotyping system; MetaSystems, ФРГ) и описывали в соответствии с Международной системой цитогенетической номенклатуры хромосом человека ISCN (Shaffer et al., 2009).
Для определения статуса полученных клеточных линий анализировали наличие поверхностных антигенов с помощью проточной цитофлуориметрии на цитометре Beckman Coulter (США). Присутствие каждого маркера оценивали по результатам 3-х экспериментов для клеток, находящихся на 8- и 16-м пассажах. Иммунофенотипирование проводили с помощью панели конъюгатов CD-маркерных моноклональных антител с флуорохромами. В работе использовали моноклональные антитела против CD34, CD45, HLA-ABC и HLA-DR (Caltac, США), CD44, CD73, CD105 (Beckman Coulter, США), СD90, а также CD31 (BD Pharmingen, США) для анализа спонтанной эндотелиальной дифференцировки. В качестве негативного контроля использовали очищенные мышиные антитела IgG1/Fitc и IgG1/RFE (DAKO, Дания). Клетки снимали с поверхности чашки с помощью 0.05%-ного раствора трипсина с ЭДТА (Gibco, США) и отмывали от него раствором РВS, не содержащем ионов Са2+ и Mg2+ (Биолот, Россия). Полученную суспензию клеток (1 млн/мл) в РВS делили на пробы по 30 мкл, добавляли к каждой из них по 3 мкл антител и инкубировали при 4°С в течение 30 мин. Далее пробы доводили до оптимального объема (0.3–0.4 мл) с помощью Stain Buffer (BD Pharmingen, США).
Для иммунофлуоресцентного анализа наличия маркеров ранней дифференцировки ЭСК в производные 3-х зародышевых листков использовали антитела к α-актинину (тест на мезодерму), α-фетопротеину (тест на энтодерму) (Sigma, США) и нестину (тест на эктодерму) (Chemicon, США). Для определения маркера недифференцированных ЭСК использовали антитела против транскрипционного фактора OCT-4 (Santa Cruz, США). Клетки фиксировали 4%-ным раствором параформальдегида в течение 20 мин при комнатной температуре, блокировали 1%-ным раствором BSA (Sigma, ФРГ) в течение 1 ч. Пермеабилизацию проводили 0.1%-ным раствором тритона Х-100 в течение 15 мин при комнатной температуре. Далее все клетки инкубировали с первыми антителами в течение ночи при 4°С. Вторые антитела (Alexa Fluor 488; Life technologies, США) разводили в соотношении 1 : 500 и инкубировали с ними препараты в течение 1 ч в темноте при комнатной температуре. В качестве отрицательного контроля использовали клетки, окрашенные только вторыми антителами. Визуализацию проводили с помощью микроскопа Zeiss LSM 5 Pascal (Германия). Анализировали клетки 8-го пассажа.
Для количественной оценки маркеров недифференцированных ЭСК SSEA-4, (Santa Cruz, США) и SOX2 (Sigma, Германия), а также виментина, используемого для подтверждения статуса МСК, использовали метод проточной цитофлуориметрии после проведения реакции иммунофлуоресценции в клеточной суспензии на пассажах 8 и 16.
Для подтверждения статуса МСК проводили индукцию остеогенной, адипогенной и хондрогенной дифференцировки по модифицированному методу (Reyes et al., 2001) на пассажах 8 и 16. Клетки (в концентрации необходимой для образования конфлуента) высевали на чашки Петри в ростовой среде. После прикрепления и распластывания клеток ростовую среду заменяли на дифференцировочную остеогенную или адипогенную среду (HyClone Thermo Scientific HyClone Product, США). Хондрогенную дифференцировку проводили в культуре микромасс в хондрогенной дифференцировочной среде (HyClone Thermo Scientific HyClone Product, США). Индукцию проводили в течение 21 сут, меняя среду каждые 3–4 сут.
Для идентификации адипогенной дифференцировки клетки промывали PBS без ионов Ca2+ и Mg2+, фиксировали в метаноле в течение 2 мин при −20°С. Фиксированные клетки промывали 50%-ным этанолом и окрашивали красным масляным (Oil Red O) в течение 10 мин. Окрашенные клетки промывали 50%-ным этанолом, затем дистиллированной водой и заключали в 70%-ный глицерин.
Для идентификации остеогенной дифференцировки использовали реакцию Вон Косса. Для этого клетки фиксировали 2 мин в метаноле при −20°С и окрашивали 2%-ным раствором нитрата серебра (AgNO3) (Вектон, Россия) в течение 1 ч под лампой мощностью 60 Вт. Окрашенные клетки промывали дистиллированной водой и помещали на 5 мин в 2.5%-й раствор тиосульфата натрия. Затем клетки снова промывали водой и высушивали.
Идентификацию хондрогенной дифференцировки проводили с помощью окрашивания клеток 1%-ным раствором толуидинового синего в 50%-ном изопропаноле (MP Biomedicals, США), 0.1%-ным водным раствором сафранина О или 1%-ным раствором альцианового синего в 3%-ной уксусной кислоте. Время окраски составляло 30 мин при комнатной температуре для всех красителей.
Результаты обрабатывали статистически с использованием t-критерия Стьюдента. Различия считали достоверными при вероятности нулевой гипотезы Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате культивирования в течение 8 пассажей получена линия фибробластоподобных клеток, которую назвали, согласно источнику получения из эпикардиальной жировой ткани человека, ADH-MSC.
Морфологический анализ этой линии показал однородность клеточных популяций со средними по размеру вытянутыми фибробластоподобными клетками (рис. 1).
Рис. 1.
Прижизненные фотографии клеток линии ADH-MSC на 8-м и 16-м пассажах. Инвертированный микроскоп NICON, Япония. Масштабная линейка: 50 мкм.
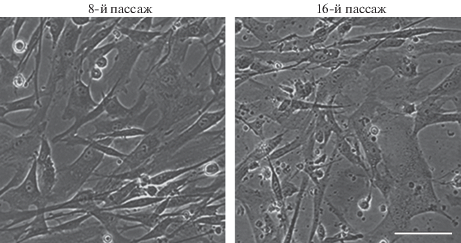
Процесс репликативного старения при длительном культивировании клеток (пассажи 8–16) ADH-MSC оценивали по активности β-галактозидазы в клеточных популяциях (табл. 1). Уже на 8-м пассаже обнаружена небольшая доля стареющих клеток, которая существенно увеличивается к 12-му пассажу (P < 0.01). Процесс репликативного старения протекает быстро, и к 16-му пассажу доля стареющих клеток увеличивается вдвое по сравнению с пассажем 12 (P < 0.01). Кроме усиления активности β-галактозидазы в клеточной популяции к 16-му пассажу, существенно изменяется и морфология клеток, выражающаяся в увеличении размеров и степени их распластанности, а также в появлении дебриса, что свидетельствует о наступлении активного репликативного старения (рис. 1). Надо подчеркнуть, что линии МСК из разных источников от здоровых доноров, полученные нами ранее, старели более медленно при длительном культивировании (Крылова и др., 2018; Кольцова и др., 2018). Возможно, что настоящий результат связан именно с тем, что клеточный материал был взят во время операции из эпикарда пациента с болезнью сердца.
Таблица 1.
Доля клеток с выраженной активностью β-галактозидазы (β-гал) в процессе культивирования линии ADH-MSC
| Пассаж | Число клеток | Доля окрашенных на β-гал, % |
|---|---|---|
| 8 | 2362 | 10.2 ± 0.6 |
| 12 | 1718 | 35.0 ± 1.2 |
| 16 | 1405 | 66.6 ± 1.3 |
Ростовые характеристики. Эффективность клонирования клеток ADH-MSC на 8-м пассаже была невысокой и составила 6.3 ± 0.2%. На 16-м пассаже она значительно снижалась и составила 1.4 ± 0.1% (Р < 0.01). Ранее полученные результаты по анализу клоногенной активности в МСК разного происхождения свидетельствуют о ее больших колебаниях между разными линиями и о существенном снижении этой активнсти на поздних пассажах (Lo Surdo et al., 2013; Szepesi et al., 2016; Кольцова и др., 2018; Крылова и др., 2018).
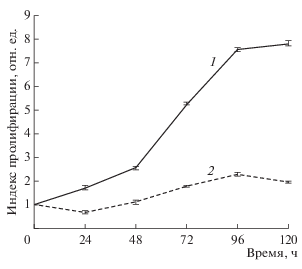
Характеристика пролиферативной активности клеток ADH-MSC в процессе длительного культивирования свидетельствуют об активном делении клеток на 8-м пассаже и значительном снижении ИП к пассажу 16 (рис. 2). Анализ кривой роста клеток показал, что время логарифмической фазы роста на 8-м пассаже составляет 96 ч. Увеличение ИП начинается в 1-е сут и значимо увеличивается в течение 96 ч, а далее снижается. Среднее время одного удвоения клеточной популяции составляет 32.9 ± 0.2 ч. К 8-му пассажу культура ADH-MSC проходит 17–18 удвоений.
На позднем 16-м пассаже, когда идут процессы активного репликативного старения, время логарифмической фазы сокращается и составляет 72 ч. Причем обращает внимание снижение ИП в течение 24 ч. В отличие от культур здоровых доноров, адаптация клеток ADH-MSC после пересева связана с гибелью части популяции. При дальнейшем культивировании в течение 72 ч величина ИП увеличивается, а затем снижается (рис. 2). Среднее время одного удвоения клеточной популяции увеличивается по сравнению с 8-м пассажем и составляет 61.2 ± 2.1 ч. Таким образом, наше исследование показывает, что в процессе длительного культивирования присутствуют явные признаки репликативного старения: существенно снижается эффективность клонирования и ИП (рис. 2), значительно увеличиваются размеры клеток и их распластанность, появляется дебрис (рис. 1), увеличивается доля клеток с выраженной активностью β-галактозидазы (табл. 1). В целом, полученные результаты подтверждают ограниченный срок жизни клеток линии ADH-MSC, характерный для неиммортализованных клеточных популяций (Hayflick, 1965; Matsumura et al., 1979; Bonab et al., 2006). Наблюдаемое более раннее наступление репликативного старения этой линии по сравнению с другими линиями МСК, возможно, связано с тем, что клетки, выделенные из эпикардиальной жировой ткани больного сердца, находились в другом микроокружении по сравнению с МСК, полученными от здоровых доноров.
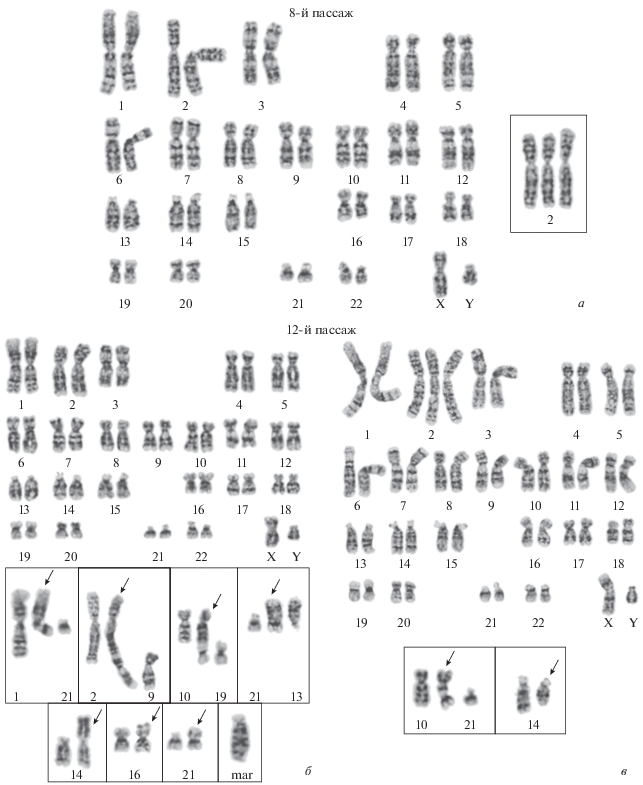
Кариотипический анализ клеток ADH-MSC. На 8-м пассаже клетки имеют нормальный кариотип человека: 46,XY (97.0 ± 1.7%). В 3-х клетках (3.0 ± 1.7%) обнаружена клональная перестройка – трисомия по хромосоме 2, 47,XY,+2. (рис. 3а). На 12-м пассаже обнаружено 2 типа структурных вариантов кариотипа (СВК): 1) нормальный кариотип, 46,ХY (42.0 ± 4.9%); 2) трисомия по хромосоме 2, 47,ХY,+2 (48.0 ± 5.0%) (рис. 3б, 3в). В 1-м СВК присутствует 8 неклональных перестроек (рис. 3б). Во 2-м СВК – 2 неклональные перестройки (рис. 3в). Таким образом, в процессе культивирования от 8- до 12-го пассажа происходят существенные изменения в структуре кариотипа: значительно возрастает частота клеток с клональной перестройкой (трисомией по хромосоме 2) и появляются неклональные перестройки. Надо отметить, что кариотипический анализ МСК, выделенных из эпикардиальной жировой ткани сердца от предыдущего донора того же возраста, также показал увеличение частоты клеток с трисомией по хромосоме 2 на пассаже 12 (Krylova et al., 2011).
Рис. 3.
Кариотип клеточной линии ADH-MSC на пассаже 8 (а) и структурные варианты кариотипа на пассаже 12 (б, в). а – 46,XY; врезка – трисомия хромосомы 2 (47,XY,+2). б – 46,XY, на врезках показаны структурно перестроенные хромосомы (стрелки), обнаруженные в отдельных клетках: дицентрические хромосомы (верхний ряд) dic(1;21)(1pter→ 1q12::21p13→21qter); dic(2;9)(2pter→2q37::9p24→9qter); dic(10;19)(10pter→10q26::19p13.3→19qter); der(21)(13qter→ 13q12::21p13→21qter) в клетке с кариотипом 45,XY,–13 и (нижний ряд) add(14)(?::p13→qter); add(16)(?::p13.3→qter); add(21)1(?::p13→qter); mar в клетке с кариотипом 47,XY,+mar. в – 47,XY,+2, на врезке показаны структурно перестроенные хромосомы (стрелки), обнаруженные в отдельных клетках: дицентрическая хромосома dic(10;21)(10pter→10q21::21p13→21qter); делеция хромосомы 14, del(14)(pter→q24:).
При продолжении культивирования до 16-го пассажа увеличивается кариотипическая гетерогенность. Можно выделить три СВК: 1) нормальный кариотип 46,XY (6.0 ± 2.4%) (рис. 4а); 2) СВК с перестройкой хромосомы 21, 46,XY,add(21)2(p13) (39 ± 4.9%) (рис. 4б); 3) СВК с трисомией по хромосоме 2, 47,XY,+2 (55 ± 5.0%) (рис. 4в). Во всех 3-х СВК в 65% клеток выявлены клональные и неклональные хромосомные перестройки с вовлечением преимущественно короткого плеча одного из гомологов хромосомы 21 (рис. 4а–4в). Гетероморфизм гомологов ядрышкообразующей хромосомы 21 по короткому плечу позволяет определить, что во все перестройки с ее участием вовлекался один и тот же гомолог. Следует отметить, что обнаруженная на 12-м пассаже в 1-м СВК неклональная перестройка add(21)1(p13), на 16-м пассаже в 3-м СВК превращается в клональную перестройку (16.0 ± 3.7%). Также обнаружены дицентрические хромосомы по типу теломерных ассоциаций (9.0 ± 1.4%). Причем в большинстве таких дицентрических хромосом (в 7 из 9) затронуто короткое плечо хромосомы 21.
Рис. 4.
Структурные варианты кариотипа клеточной линии ADH-MSC на пассаже 16. а – 46,XY; на врезках показаны структурно перестроенные хромосомы (стрелки), обнаруженные в отдельных клетках: клональная перестройка хромосомы 21, add(21)1(?::p13→qter); add(21)1(?::p13→qter) и дицентрическая хромосома dic(8;16)(8pter→8q24.3::16q24→16pter); хромосома 1 и der(21)(1qter→1q12::21p13→21qter), экстракопирование длинного плеча хромосомы 1; дицентрическая хромосома dic(16;21)(21qter→21p13::16p13.3→16qter). б – 46,XY, add(21)2(?::p13→qter); на врезках показаны клональная перестройка хромосомы 21 и структурно перестроенные хромосомы (стрелки), обнаруженные в отдельных клетках: в верхнем ряду – add(21)2(?::p13→qter) и дицентрическая хромосома dic(4;16)(4pter→4q27::16p13.3→16qter); add(21)2(?::p13→qter) и дицентрическая хромосома dic(14;16)(14pter→14q24::16p13.3→16qter), в нижнем ряду – add(21)2(?::p13→qter) и дицентрическая хромосома dic(16;17)(17pter→17q24::16p13.3→16qter); add(21)2(?::p13→qter) и add(16)(?::p13.3→qter). в – 47,XY,+2; на врезках показаны структурно перестроенные хромосомы (стрелки), обнаруженные в отдельных клетках: в верхнем ряду – клональная перестройка хромосомы 21, add(21)1(?::p13→qter) (15% клеток); add(21)1(?::p13→qter) и дицентрическая хромосома dic(8;16)(8pter→8q24.3::16p13.3→16qter); клональная перестройка дицентрическая хромосома dic(16;21)(21qter→ 21p13::16p13.3→16qter) (4% клеток); del(5)(pter→q23:) и add(21)(?::p13→qter), в нижнем ряду – дицентрические хромосомы dic(9;21)(21qter→21p13::9p24→9qter); dic(12;14)(14pter→14q32::?::12p13→12qter); dic(21;22)(22pter→22q13.3::21p13→21qter); dic(21;22)(22qter→22p12::21p12→21qter); der(21;22)(22qter→22q10::21q10→21qter).
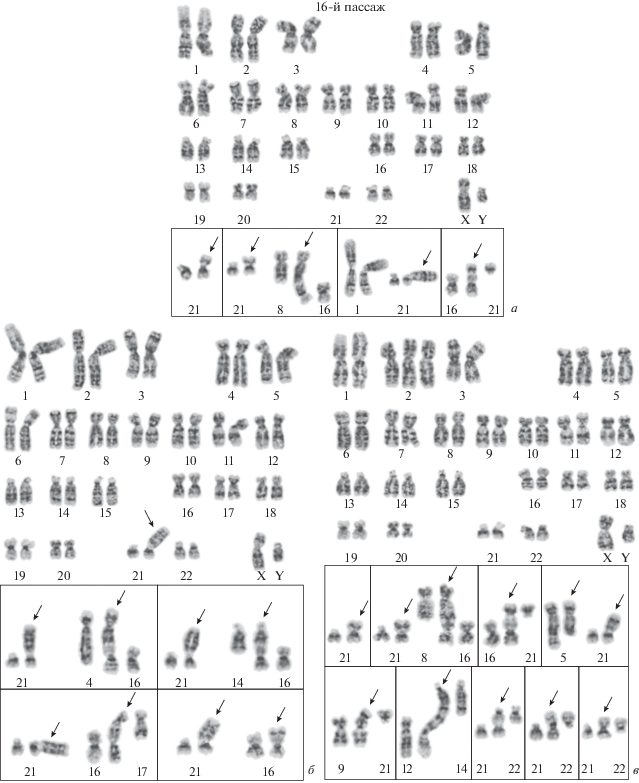
Появление теломерных ассоциаций было ранее показано в разных “безмаркерных” иммортализованных и неиммортализованных диплоидных линиях в стрессовых ситуациях и при старении, которое также можно условно считать стрессом, так как оно сопровождается рядом нежелательных для организма или для клеточной культуры явлениями. По-видимому, их роль состоит не в создании кариотипической нестабильности, которая связана с обычными хромосомными аберрациями, а в образовании генетических структур, обеспечивающих систему адаптации клеточной популяции к неблагоприятным факторам (Poljanskaya, Vakhtin, 2003).
Анализ частоты полиплоидных клеток в процессе длительного культивирования показал, что их доля составляет 9.0 ± 0.9% на пассаже 8, значительно снижается на пассаже 12 (2.2 ± 0.3%, Р < 0.01) и не изменяется к пассажу 16 (3.0 ± 0.8), несмотря на усиление процесса репликативного старения. Эти данные подтверждают наши предыдущие результаты, свидетельствующие о том, что уровень полиплоидов не является маркером стареющих клеток (Кольцова и др., 2017, 2018). Таким образом, кариотипический анализ в клетках ADH-MSC показал, что на раннем пассаже имеет место нормальный кариотип человека, но уже к пассажу 12 существенно увеличивается кариотипическая гетерогенность, усиливающаяся к 16 пассажу и превышающая допустимый уровень хромосомных нарушений для кариотипически нормальных МСК (Meisner, Johnson, 2008; Shaffer et al., 2009; Barkholt et al., 2013). В более ранних работах при проведении кариотипического анализа при длительном культивировании МСК, полученных от здоровых доноров из разных тканей, в процессе репликативного старения нами не была выявлена частота кариотипических изменений, превышающая допустимый барьер по частоте клональных перестроек (Кольцова и др., 2017, 2018). Несмотря на значительную кариотипическую нестабильность, при продолжении культивирования клетки погибают из-за отсутствия адаптивных кариотипических изменений, способствующих иммортализации и последующей малигнизации клеток (Tarte et al., 2010; Zaman et al., 2014). Возможно, что клетки, выделенные из эпикардиальной жировой ткани сердца, находились в другом микроокружении по сравнению со здоровым донором.
Для подтверждения статуса МСК для линии ADH-MSC анализировали клеточные поверхностные маркеры, характерные для МСК, с помощью проточной цитофлуориметрии. Анализ подтвердил наличие статуса МСК для этой линии (табл. 2). Из представленных результатов следует наличие у клеток на 8-м пассаже поверхностных антигенов, характерных для МСК человека: CD44, CD73, CD90, CD105, виментина и HLA-ABC. Выявлено отсутствие или низкая частота встречаемости антигенов CD34, CD45 и HLA-DR. Таким образом, согласно требованиям Международного общества клеточной терапии (Domonici, 2006; Sensebé et al., 2010), для линии ADH-MSC подтвержден статус МСК. Этот статус в целом сохраняется и на позднем 16-м пассаже (табл. 2). Отмечено небольшое, не противоречащее статусу МСК, снижение уровня CD90, виментина и HLA-ABC и увеличение HLA-DR (Р < 0.1). С помощью иммунофлуоресцентного анализа мы не выявили транскрипционный фактор Oct-4 (данные не представлены). На пассаже 8 показан высокий уровень маркера ранней дифференцировки ЭCК – SSEA-4 и отсутствие SOX2. На пассаже 16 уменьшается доля клеток с проявлением маркера SSEA-4 (Р < 0.1), а маркер SOX2 отсутствует, как и на пассаже 8 (табл. 2).
Таблица 2.
Доля клеток (%), несущих поверхностные маркеры в линии ADH-MSC
| Маркер | Пассаж | |
|---|---|---|
| 8 | 16 | |
| CD44 | 99.12 ± 0.10 | 98.55 ± 0.21 |
| CD73 | 96.74 ± 2.56 | 94.47 ± 0.96 |
| CD90 | 99.49 ± 0.21а | 96.45 ± 0.40а |
| CD105 | 94.86 ± 3.62 | 92.26 ± 0.56 |
| Виментин | 98.15 ± 0.04а | 94.94 ± 0.28а |
| CD31 | 1.95 ± 0.53 | 1.07 ± 0.20 |
| CD34 | 0.11 ± 0.03 | 0.33 ± 0.09 |
| CD45 | 2.84 ± 0.39 | 1.50 ± 0.40 |
| HLA-ABC | 91.09 ± 0.25а | 73.09 ± 0.78а |
| HLA-DR | 0.17 ± 0.03а | 0.62 ± 0.07а |
| SSEA-4 | 74.84 ± 6.86а | 18.47 ± 0.70а |
| SOX2 | 0.58 ± 0.13 | 0.57 ± 0.04 |
Отсутствие поверхностного маркера CD31 на ранних и поздних пассажах свидетельствует об отсутствии спонтанной эндотелиальной дифференцировки в клетках ADH-MSC. Тем не менее, в клетках линии, выделенной из этой же ткани в тех же условиях, но из другого донора, показано наличие спонтанной эндотелиальной дифференцировки (Krylova et al., 2011). Различия могут быть связаны как с генетическими особенностями доноров, так и с особенностями заболевания.
К настоящему времени получено много экспериментальных данных, включая и наши собственные, подтверждающих наличие маркеров недифференцированных ЭСК у разных линий МСК и их динамика в процессе длительного культивирования. Наличие этих маркеров связано с регуляцией пролиферативной активности и дифференцировочного потенциала в МСК (Gang et al., 2007; Riekstina et al., 2009; Yoon et al., 2011; Park et al., 2012; Seo et al., 2013; Aghajani et al., 2016; Reumann et al., 2018). Наблюдаемая корреляция между сниженной экспрессией маркера SSEA-4 и сниженной пролиферативной активностью на поздних пассажах, косвенно подтверждает это предположение.
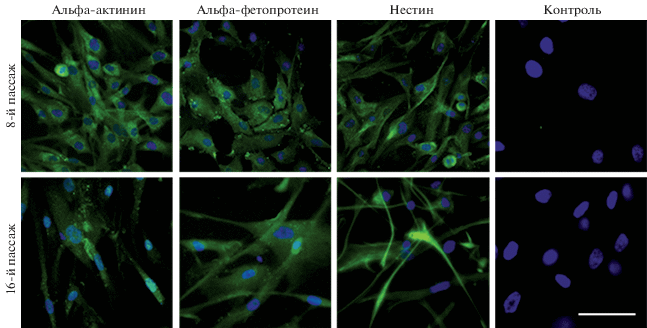
Присутствие маркеров ранней дифференцировки ЭСК в производных трех зародышевых листков в клетках линии ADH-MSC показано с помощью иммунофлуоресцентного анализа (рис. 5). Идентифицированы следующие маркеры: альфа-актинин (маркер мезодермы), альфа-фетопротеин (маркер энтодермы) и нестин (маркер эктодермы). Эти результаты совпадают с более ранними данными, полученными разными методами, о наличии маркеров ранней дифференцировки ЭСК в МСК разного происхождения. Возможно, что с присутствием маркеров ранней дифференцировки ЭСК связана дифференцировочная пластичность МСК (Riekstina et al., 2009; Huang et al., 2010; Antonucci et al., 2011; Mamidi et al., 2011; Крылова и др., 2018; Wu et al., 2013; Кольцова и др., 2018).
Рис. 5.
Идентификация маркеров ранней дифференцировки эмбриональных стволовых клеток в клетках линии ADH-MSC на пассажах 8 и 16 по флуоресценции в зеленом спектре соответствующих моноклональных антител.
Показаны маркеры мезодермы (альфа-актинина), эндодермы (альфа-фетопротеина) и эктодермы (нестина). Масштабная линейка: 100 мкм.
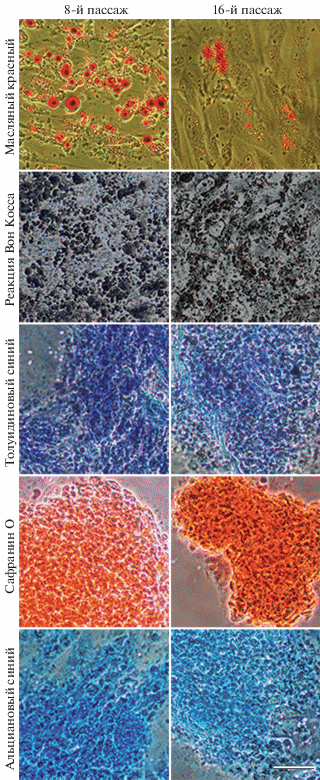
Индукция остеогенной, хондрогенной и адипогенной дифференцировок клеток линии ADH-MSC выявила их способность формировать адипогенную, хрящевую и костную ткань на пассажах 8 и 16, что подтверждает статус МСК. Тем не менее, в отличие от остеогенной и хондрогенной дифференцировок, характер адипогенной дифференцировки, выявляемый с помощью красителя масляного красного, различен у клеток на пассажах 8 и 16 (рис. 6). На 8-м пассаже через 21 сут после начала индукции выявляется активная адипогенная дифференцировка. На 16-м пассаже интенсивность адипогенной дифференцировки снижается. В литературе есть данные, показывающие зависимость интенсивности дифференцировки МСК, полученных из разных источников, от длительности культивирования, т.е. от процесса репликативного старения (Рark et al., 2005; Bonab et al., 2006; Lo Surdo et al., 2013; Bianchi et al, 2017; Кольцова и др., 2017; Крылова и др., 2018). Культивирование клеток в остеогенной среде способствовало формированию минеральных комплексов при использовании реакции Вон Косса, позволяющей выявить нерастворимые соли кальция в межклеточном пространстве. Культивирование клеток в хондрогенной среде приводило к образованию структур, которые выявляются с помощью окрашивания толуидиновым синим (идентификация сульфатированных гликозаминогликанов), сафранином (идентификация протеогликанов) и альциановым синим (идентификация кислых гликозаминогликанов). Различий между клетками 8-го и 16-го пассажа по интенсивности этих дифференцировок не наблюдали (рис. 5).
Рис. 6.
Идентификация дифференцировки клеток линии ADH-MSC в следующих направлениях: адипогенном (окрашивание жировых включений масляным красным), остеогенном (реакция Вон Косса на нерастворимые соли кальция в межклеточном пространстве) и хондрогенном (окрашивание сульфатированных гликозаминогликанов толуидиновым синим, протеогликанов сафранином О и кислых гликозаминогликанов альциановым синим). Масштабная линейка: 25 мкм.
Таким образом, представленные результаты подтверждают статус МСК для полученной линии и свидетельствуют о существенных изменениях, происходящих в процессе репликативного старения. Причем в клетках этой линии имеет место наступление более раннего репликативного старения, чем в клетках других линий МСК, полученных нами от здоровых доноров разного возраста. Это явление может быть связано с нарушенным микроокружением, в котором находились клетки от донора, имеющего заболевание сердца, требующего аортокоронарного шунтирования. Возможно, что эта же причина повлияла на значительную кариотипическую нестабильность, возникшую в процессе раннего репликативного старения. Оба эти явления (раннее старение и кариотипическая нестабильность) могут быть связаны с более значительными нарушениями системы репарации ДНК в клетках ADH-MSC, чем у клеток других линий.
Список литературы
Кольцова А.М. Крылова Т.А., Мусорина А.С., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2017. Динамика свойств двух линий мезенхимных стволовых клеток, полученных из Вартонова студня пупочного канатика человека, при длительном культивировании. Цитология. 59(9) : 574–587. (Koltsova A.M., Krylova T.A., Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2017. Dynamics properties of two lines of mesenchymal stem cells, derived from the Wharton’ jelly of the human umbilical cord, during long-term cultivation. Tsitologiia. 59(9) : 574–587.)
Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и характеристика линии мезенхимных стволовых клеток, выделенных из пульпы молочного зуба человека. Цитология. 60(12) : 955–968. (Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The derivation and characterization of mesenchymal stem cell line, isolated from human pulp of a deciduous tooth. Tsitologiia. 60(12) : 955–968.)
Крылова Т.А., Мусорина А.С., Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и сравнительная характеристика линий мезенхимных стволовых клеток, полученных из крайней плоти двух доноров одного возраста”. Цитология. 60(4) : 262–272. (Krylova T.A., Musorina A.S., Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The derivation and comparative characterization of mesenchymal stem cell lines isolated from foreskin of two donors of the same age. Tsitologiya. 60(4) : 262–272.)
Седова Г.П. 2008. Количественные аспекты злокачественного роста. Математическая морфология. Электронный математический и медико-биологический журнал. 7(2). URL: Http://www.smolensk.ru/user/sgma/mmorph/n-18-html/cont.htm. (Sedova G.P. 2008. Quantitative aspects of malignant body height. Mathematical morphology. Electronic Math. Medicobiol. j. 7(2). URL: Http://www.smolensk.ru/user/sgma/mmorph/n-18-html/cont.htm)
Aghajani F., Hooshmand T., Khanmohammadi M., Khanjani S., Edalatkhah H., Zarnani A.H., Kazemnejad S. 2016. Comparative immunophenotypic characteristics, proliferative features, and osteogenic differentiation of stem cells isolated from human permanent and deciduous teeth with bone marrow. Mol. Biotechnol. 58(6) : 415–427.
Alessio N., Pipino C., Mandatori D., Di Tomo P., Ferone A., Marchiso M., Melone M.A.B., Peluso G., Pandolfi A., Galderisi U. 2018. Mesenchymal stromal cells from amniotic fluid are less prone to senescence compared to those obtained from bone marrow: An in vitro study. J Cell Physiol. doi https://doi.org/10.1002/jcp.26845
Antonucci I., Stuppia L., Kaneko Y., Yu S., Tajiri N., Bae E.C., Chheda S.H., Weinbren N.L., Borlongan C.V. 2011. Amniotic fluid as rich source of mesenchymal stromal cells for transplantation therapy. Cell Transplant. 20 : 789–795.
Barkholt L., Flory E., Jekerle V., Lucas-Samuel S., Ahnert P., Bisset L., Büscher D., Fibbe W., Foussat A., Kwa M., Lantz O., Mačiulaitis R., Palomäki T., Schneider C.K., Sensebé L., Tachdjian G., Tarte K., Tosca L., Salmikangas P. 2013. Risk of tumorigenicity in mesenchymal stromal cell-based therapies–bridging scientific observations and regulatory viewpoints. Cytother. 15 : 753–759.
Berg A.H., Scherer P.E. 2005. Adipose tissue, inflammation, and cardiovascular disease. Circ. Res. 96(9) : 939–949.
Bernardo M.E., Zaffaroni N., Novara F., Cometa A.M., Avanzini M.A., Moretta A., Montagna D., Maccario R., Villa R., Daidone M.G., Zuffardi O., Locatelli F. 2007. Human bone marrow derived mesenchymal stem cells do not undergo transformation after long-term in vitro culture and do not exhibit telomere maintenance mechanisms. Cancer Res. 67 : 9142–9149.
Bianchi M.V., Awaja F., Altankov G. 2017. Dynamic adhesive environment alters the differentiation potential of young and ageing mesenchymal stem cells. Mater. Sci. Eng. C Mater. Biol. Appl. 78 : 467–474.
Bonab M.M., Alimoghaddam K., Talebian F., Ghaffari S.H., Ghavamzadeh A., Nikbin B. 2006. Aging of mesenchymal stem cell in vitro. BMC Cell Biol. 7 : 14. doi
Bongso A., Fong C.Y. 2013. The therapeutic potential, challenges and future clinical directions of stem cells from the Wharton’s jelly of the human umbilical cord. Stem Cell. Rev. 9 : 226–240.
Cárdenes N., Álvarez D., Sellarés J., Peng Y., Corey C., Wecht S., Nouraie S.M., Shanker S., Sembrat J., Bueno M., Shiva S., Mora A.L., Rojas M. 2018. Senescence of bone marrow-derived mesenchymal stem cells from patients with idiopathic pulmonary fibrosis. Stem Cell. Res. Ther. 9 : 257–266.
Danisovic L., Oravcova L., Krajciova L., Varchulova Novakova Z., Bohac M., Varga I., Vojtassak J. 2017. Effect of long-term culture on the biological and morphological characteristics of human adipose tissue-derived stem cells. J. Physiol. Pharmacol. 68 : 149–158.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Int. Soc. Cell. Ther. Position Statement. Cytother. 8 : 315–317.
Estrada J.C., Torres Y., Benguría A., Dopazo A., Roche E., Carrera-Quintanar L., Pérez R.A., Enríquez J.A., Torres R., Ramírez J.C., Samper E., Bernad A. 2013. Human mesenchymal stem cell-replicative senescence and oxidative stress are closely linked to aneuploidy. Cell Death Dis. 4 : e691. doi https://doi.org/10.1038/cddis.2013.211
Facchin F., Bianconi E., Romano M., Impellizzeri A., Alviano F., Maioli M., Canaider S., Ventura C. 2018. Comparison of oxidative stress effects on senescence patterning of human adult and perinatal tissue-derived stem cells in short and long-term cultures. Int. J. Med Sci. 15 : 1486–1501.
Gang E.J., Bosnakovski D., Figueiredo C.A., Visser J.W., Perlingeiro R.C. 2007. SSEA-4 identifies mesenchymal stem cells from bone marrow. Blood. 109 : 1743–1751.
Hassan M., Latif N., Yacoub M. 2012. Adipose tissue: friend or foe? Nat. Rev. Cardiol. 9 : 689–702.
Hayflick L. 1965. The limited in vitro lifetime of human diploid cell strains. Exp. Cell Res. 37 : 614–636.
Huang H.I., Chen S.K., Ling Q.D., Chien C.C., Liu H.T., Chan S.H. 2010. Multilineage differentiation potential of fibroblast-like stromal cells derived from human skin. Tiss. Eng. (A). 16 : 1491–1501.
Krylova T.A., Bystrova O.A., Jakovleva T.K., Zenin V.V., Moiseeva O.M., Parfenov V.N., Martynova M.G. 2011. Characteristics of human subepicardial adipose tissue-derived stem cells. Stem Cell Studies 1. e18 : 115–122. doi https://doi.org/10.4081/scs.2011.e18
Kuilman T., Michaloglou C., Mooi W.J., Peeper D.S. 2010. The essence of senescence. Genes Dev. 24 : 2463–2479.
Lee N.E., Kim S.J., Yang S.J., Joo S.Y., Park H., Lee K.W., Yang H.M., Park J.B. 2016. Comparative characterization of mesenchymal stromal cells from multiple abdominal adipose tissues and enrichment of angiogenic ability via CD146 molecule. Cytotherapy. 19 : 170–180.
Lo Surdo J.L., Millis B.A., Bauer S.R. 2013. Automated microscopy as a quantitative method to measure differences in adipogenic differentiation in preparations of human mesenchymal stromal cells. Cytotherapy. 15 : 1527–1540.
Mamidi M.K., Pal R., Mori N.A., Arumugam G., Thrichelvam S.T., Noor P.J., Abdullah H.M., Gupta P.K., Das A.K., Zakaria Z., Bhonde R. 2011. Co-culture of mesenchymal-like stromal cells derived from human foreskin permits long term propagation and differentiation of human embryonic stem cells. J. Cell Biochem. 112 : 1353–1363.
Matsumura T., Zerrudo Z., Hayflick L. 1979. Senescent human diploid cells in culture: survival, DNA synthesis and morphology. J. Gerontol. 34 : 328–334.
Meisner L.F., Johnson J.A. 2008. Protocols for cytogenetics studies of human embryonic stem cells. Methods. 45 : 133–141.
Nepali S., Park M., Lew H., Kim O. 2018. Comparative analysis of human adipose-derived mesenchymal stem cells from orbital and abdominal fat. Stem Cells Int. doi https://doi.org/10.1155/2018/3932615
Niedernhofer L.J., Gurkar A.U., Wang Y., Vijg J., Hoeijmakers J.H.J., Robbins P.D. 2018. Nuclear genomic instability and aging. Annu. Rev. Biochem. 87 : 295–322.
Ogura F., Wakao S., Kuroda Y., Tsuchiyama K., Bagheri M., Heneidi S., Chazenbalk G., Aiba S., Dezawa M. 2014. Human adipose tissue possesses a unique population of pluripotent stem cells with nontumorigenic and low telomerase activities: potential implications in regenerative medicine. Stem Cells Dev. 23 : 717–728.
Ozkinay C., Mitelman F. 1979. A simple trypsin-Giemsa technique producing simultaneous G- and C-banding in human chromosomes. Hereditas. 90 : 1–4.
Park J.S., Kim H.Y., Kim H.W., Chae G.N., Oh H.T., Park J.Y., Shim H., Seo M., Shin E.Y., Kim E.G., Park S.C., Kwak S.J. 2005. Increased caveolin-1, a cause for the declined adipogenic potential of senescent human mesenchymal stem cells. Mech. Ageing Dev. 126 : 551–559.
Park S.B., Seo K.W., So A.Y., Seo M.S., Yu K.R., Kang S.K., Kang K.S. 2012. SOX2 has a crucial role in the lineage determination and proliferation of mesenchymal stem cells through Dickkopf-1 and c-MYC. Cell Death Differ. 19 : 534–545.
Petersen E.D., Zenchak J.R., Lossia O.V., Hochgeschwender U. 2018. Neural stem cells derived directly from adipose tissue. Stem Cells Dev. 27 : 637–647.
Poljanskaya G.G., Vakhtin Y.B. 2003. The karyotypic structure of cell populations in vitro as integral system. Tsitologiia. 45(2): 115–131.
Rada T., Reis R.L., Gomes M.E. 2011. Distinct stem cells subpopulations isolated from human adipose tissue exhibit different chondrogenic and osteogenic differentiation potential. Stem Cell Rev. 7 : 64–76.
Redaelli S., Bentivegna A., Foudah D., Miloso M., Redondo J., Riva G., Baronchelli S., Dalprà L., Tredici G. 2012. From cytogenomic to epigenomic profiles: monitoring the biologic behavior of in vitro cultured human bone marrow mesenchymal stem cells. Stem Cell Res. Ther. 3 : 47. doi https://doi.org/10.1186/scrt138
Reumann M.K., Linnemann C., Aspera-Werz R.H., Arnold S., Held M., Seeliger C., Nussler A.K., Ehnert S. 2018. Donor site location is critical for proliferation, stem cell capacity, and osteogenic differentiation of adipose mesenchymal stem/stromal cells: implications for bone tissue engineering. Int. J. Mol. Sci. 19. pii : E1868. doi https://doi.org/10.3390/ijms19071868
Reyes M., Lund T., Lenvik T., Aguiar D., Koodie L., Verfaillie C.M. 2001. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood. 98 : 2615–2625.
Riekstina U., Cakstina I., Parfejevs V., Hoogduijn M., Jankovskis G., Muiznieks I., Muceniece R., Ancans J. 2009. Embryonic stem cell marker expression pattern in human mesenchymal stem cells derived from bone marrow, adipose tissue, heart and dermis. Stem Cell Rev. 5 : 378–386.
Shaffer I.G., Slovak M.L., Campbell L.J. (Eds.). 2009. An international system for human cytogenetic nomenclature. Basel: S. Karger. 138 p.
Savickienė J., Baronaitė S., Zentelytė A., Treigytė G., Navakauskienė R. 2016. Senescence-associated molecular and epigenetic alterations in mesenchymal stem cell cultures from amniotic fluid of normal and fetus-affected pregnancy. Stem Cells Int. 2016 : 2019498.
Sensebé L., Krampera M., Schrezenmeier H., Bourin P., Giordano R. 2010. Mesenchymal stem cells for clinical application. Vox Sang. 98 : 93–107.
Seo E., Basu-Roy U., Gunaratne P.H., Coarfa C., Lim D.S., Basilico C., Mansukhani A. 2013. SOX2 regulates YAP1 to maintain stemness and determine cell fate in the osteo-adipo lineage. Cell Rep. 3 : 2075–2087.
Shakeri H., Lemmens K., Gevaert A.B., De Meyer G.R.Y., Segers V. 2018. Cellular senescence links aging and diabetes in cardiovascular disease. Am. J. Physiol. Heart Circ. Physiol. 315 : H448–H462.
Stein J.Y., Levin Y., Uziel O., Abumock H., Solomon Z. 2018. Traumatic stress and cellular senescence: The role of war-captivity and homecoming stressors in later life telomere length. J. Affect Disord. 238 : 129–135.
Stultz B.G., McGinnis K., Thompson E.E., Lo Surdo J.L., Bauer S.R., Hursh D.A. 2016. Chromosomal stability of mesenchymal stromal cells during in vitro culture. Cytother. 18 : 336–343.
Sugihara H., Teramoto N., Yamanouchi K., Matsuwaki T., Nishihara M. 2018. Oxidative stress-mediated senescence in mesenchymal progenitor cells causes the loss of their fibro/adipogenic potential and abrogates myoblast fusion. Aging (Albany NY). 10 : 747–763.
Szepesi Á., Matula Z., Szigeti A., Várady G., Szalma J., Szabó G., Uher F., Sarkadi B., Német K. 2016. In vitro characterization of human mesenchymal stem cells isolated from different tissues with a potential to promote complex bone regeneration. Stem Cells Int. 2016 : 3 595 941. doi https://doi.org/10.1155/2016/3595941
Tarte K., Gaillard J., Lataillade J.J., Fouillard L., Becker M., Mossafa H., Tchirkov A., Rouard H., Henry C., Splingard M., Dulong J., Monnier D., Gourmelon P., Gorin N.C., Sensebé L. on behalf of Société Française de Greffe de Moelle et Thérapie Cellulaire. 2010. Clinical-grade production of human mesenchymal stromal cells: occurrence of aneuploidy without transformation. Blood. 115 : 1549–1553.
Truong N.C., Bui K.H., Van Pham P. 2018. Characterization of senescence of human adipose-derived stem cells after long-term expansion. Adv. Exp. Med. Biol. doi https://doi.org/10.1007/5584_2018_235
Wagner W., Horn P., Castoldi M., Diehlmann A., Bork S., Saffrich R., Benes V., Blake J., Pfister S., Eckstein V., Ho A.D. 2008. Replicative senescence of mesenchymal stem cells: a continuous and organized process. PLoS One. 3 : e2213. doi https://doi.org/10.1371/journal.pone.0002213
Wu R., Gu B., Zhao X., Tan Z., Chen L., Zhu J., Zhang M. 2013. Derivation of multipotent nestin(+)/CD271(-)/STRO-1(-) mesenchymal-like precursors from human embryonic stem cells in chemically defined conditions. Hum. Cell. 26 : 19–27.
Yin H., Pickering J.G. 2016. Cellular senescence and vascular disease: novel routes to better understanding and therapy. Can. J. Cardiol. 32 : 612–623.
Yoon D.S., Kim Y.H., Jung H.S., Paik S., Lee J.W. 2011. Importance of Sox2 in maintenance of cell proliferation and multipotency of mesenchymal stem cells in low-density culture. Cell Prolif. 44 : 428–440.
Yu J., Shi J., Zhang Y., Zhang Y., Huang Y., Chen Z., Yang J. 2018. The replicative senescent mesenchymal stem/stromal cells defect in DNA damage response and anti-oxidative capacity. Int. J. Med. Sci. 15 : 771–781.
Zaman W.S., Makpol S., Sathapan S., Chua K.H. 2014. Long-term in vitro expansion of human adipose-derived stem cells showed low risk of tumourigenicity. J. Tissue Eng. Regen. Med. 8 : 67–76.
Zuk P.A., Zhu M., Mizuno H., Huang J., Futrell J.W., Katz A.J., Benhaim P., Lorenz H.P., Hedrick M.H. 2001. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 : 211–228.
Дополнительные материалы отсутствуют.