Цитология, 2019, T. 61, № 6, стр. 494-499
Действие формальдегида и фиксатора Кларка на морфологию клеток волосков тычиночных нитей традесканции (морфометрический анализ)
А. Ю. Буданцев *
Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Россия
* E-mail: budantsev@mail.ru
Поступила в редакцию 26.02.2019
После доработки 21.03.2019
Принята к публикации 22.03.2019
Аннотация
Апикальные клетки волосков тычиночных нитей традесканции (КВТН) практически не изменяют своей формы при фиксации в формалине (сжатие клеток происходит в одинаковой степени в продольном и поперечном направлении). Срединные и базальные клетки приобретают более укороченную форму, так как наибольшее сжатие происходит вдоль продольной оси клеток. Сжатие клеток приводит к уменьшению их объема и площади поверхности. Формалин вызывает в клетках плазмолиз, наиболее сильно выраженный в базальных клетках, меньше в срединных и апикальных клетках. Усиление вариабельности морфометрических параметров КВТН после фиксации, по сравнению с контрольными клетками, по-видимому, связано с разной степенью деформации отдельных клеток в формалине. После фиксации в формалине клетки обесцвечиваются, хорошо сохраняются клеточная стенка и ядра с четко обозначенными хроматиновыми структурами. В цитоплазме отмечается появление мелких ячеистых структур. После фиксатора Кларка наблюдается сжатие цитоплазмы и ядер, клеточная стенка теряет свою упругость, местами она образует складки, клетки теряют свою нативную форму, волоски сильно искривлены. Наиболее сильные изменения отмечены в группе апикальных клеток. Таким образом, фиксатор Кларка, при выбранных условиях фиксации, приводит к резким нарушениям формы КВТН, что не позволяет провести их морфометрический анализ.
Хорошо известно, что формальдегид и его смеси с другими соединениями являются наиболее часто используемыми химическими фиксаторами при изготовлении постоянных препаратов для микроскопического анализа клеток и тканей животных и растений. Также известно, что формальдегид вызывает сшивание белковых молекул, образуя между ними метиленовые мостики. Однако показано, что формалинсодержащие фиксаторы приводят к изменению и разрушению молекулярной структуры белков и нуклеопротеидов (Dapson, 1993; Srinivasan et al., 2002; Ваганова, 2015 и др.).
Относительно нарушения морфологической структуры клеток и тканей, фиксированных в формалине, имеется неоднозначное мнение, но в большинстве случаев отмечается сжатие ткани (Baker, 1958; O’Brien, McCully, 1981; Барыкина и др., 2004; Kiernan, 2008 и др.).
Фиксатор Кларка – известный спиртсодержащий фиксатор, быстро проникает в ткань и вызывает ее значительное сжатие (Baker, 1958; Berlin, Miksche, 1976).
В данной работе приведены результаты морфологического и морфометрического анализа геометрии клеток волосков тычиночных нитей традесканции (КВТН) после фиксации в забуференном растворе формальдегида и морфологического анализа действия фиксатора Кларка на КВТН.
МАТЕРИАЛ И МЕТОДИКА
Опыты проведены на КВТН, выделенных из Tradescantia pallida, выращенной в обычном цветочном грунте в условиях естественного освещения (июнь 2018 г.). Были изучены волоски из полностью раскрытых цветков (489 клеток). Волоски, вместе с небольшим кусочком тычиночной нити, помещали в забуференный раствор формалина (фосфатный буфер, рН ≈ 7.0) (Sigma, США) или в фиксатор Кларка – смесь 100%-ного этанола с ледяной уксусной кислотой (в соотношении 3 : 1, v : v, формула Фармера, (Berlin, Miksche, 1976)). Для удаления воздуха из препаратов КВТН в начале фиксации в формалине проводили вакуумную инфильтрацию клеток (давление над фиксатором около 300 мм рт. ст.) в течение 10 мин. Фиксацию в формалине и фиксаторе Кларка проводили при температуре 8°С в течение 24 ч. После быстрой промывки в воде волоски переносили в микрокамеру и фотографировали на микроскопе Олимпус 71 цифровым фотоаппаратом Олимпус-330 (Япония). Для калибровки линейных и объемных характеристик использовали объект-микрометр ОМ-О. Максимальную длину (L) и ширину (D) профиля клеток, длину периметра клеток (LP), площадь профиля клеток (SP) и площадь цитоплазмы после фиксации (SC) измеряли с помощью программы AnalySIS-Olympus. Рассчитывали отношение L/D и SC/SP. Измерение объема (V) и площади поверхности клеток (S) проводили на объемных моделях клеток, построенных с использованием программы 3D-studio MAX, 2009 (детали метода построения объемных моделей клеток см.: Буданцев и др., 2018). Статистическую обработку результатов проводили с помощью программы Statistica 6.0.
РЕЗУЛЬТАТЫ
Забуференный 4%-ный формалин. Также, как в предыдущих работах, клетки каждого волоска разделяли на почти равные по числу клеток группы: апикальные, срединные и базальные клетки (Буданцев и др., 2018; Буданцев, 2019). Общий вид трех групп клеток в контрольных волосках и после их фиксации в формалине показан на рис. 1, а их морфометрические параметры приведены в табл. 1.
Рис. 1.
Общий вид ВКТН. Контрольные клетки (а) и клетки, фиксированные в формалине (б). 1 – апикальные клетки, 2 – срединные клетки, 3 – базальные клетки. Об. 40×.
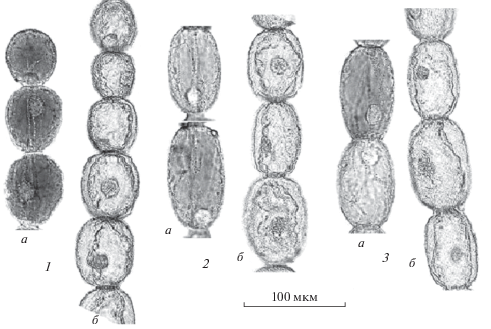
Таблица 1.
Микрометрические параметры клеток в контроле и после фиксации в формалине
| Апикальные клетки | ||||||||
|---|---|---|---|---|---|---|---|---|
| контроль | формалин | |||||||
| Параметр | n | M ± m | σ | Var % | n | M ± m | σ | Var % |
| S, мкм2 × 103 | 61 | 11.79 ± 0.35 | 2.74 | 23 | 150 | 7.99 ± 0.23 (–32%) | 2.77 | 35 |
| V, мкм3 × 103 | 61 | 113.61 ± 4.87 | 38.05 | 33 | 150 | 64.28 ± 2.74 (–43%) | 33.63 | 52 |
| L, мкм | 63 | 76.40 ± 1.79 | 14.18 | 18 | 155 | 66.05 ± 1.03 (–14%) | 12.82 | 19 |
| D, мкм | 63 | 50.41 ± 0.73 | 5.76 | 11 | 155 | 42.11 ± 0.78 (–17%) | 9.76 | 23 |
| L/D | 1.53 | 0.26 | 17 | 1.57 | ||||
| SP, мкм2 × 103 | 63 | 3.30 ± 0.11 | 0.86 | 26 | 155 | 2.33 ± 0.07 | 0.85 | 36 |
| SС, мкм2 × 103 | 155 | 1.86 ± 0.05 | 0.65 | 35 | ||||
| SC/SP формалин | 0.80 | |||||||
| Срединные клетки | ||||||||
| S, мкм2 ×103 | 58 | 16.02 ± 0.31 | 2.40 | 15 | 167 | 12.76 ± 0.18 (–20%) | 2.32 | 18 |
| V, мкм3 ×103 | 58 | 167.52 ± 4.84 | 36.87 | 15 | 167 | 124.00 ± 2.73 (–26%) | 35.45 | 28 |
| L, мкм | 58 | 99.71 ± 1.51 | 11.49 | 22 | 167 | 82.69 ± 0.63 (–17%) | 8.15 | 10 |
| D, мкм | 58 | 52.59 ± 0.66 | 5.02 | 11 | 167 | 50.14 ± 0.47 (–5%) | 6.03 | 12 |
| L/D | 1.91 | 1.65 | ||||||
| SP, мкм2 × 103 | 58 | 4.58 ± 0.09 | 0.65 | 15 | 167 | 3.47 ± 0.05 | 0.60 | 17 |
| SС, мкм2 × 103 | 167 | 2.81 ± 0.03 | 0.42 | 15 | ||||
| SC/SP формалин | 0.81 | |||||||
| Базальные клетки | ||||||||
| S, мкм2 × 103 | 83 | 18.08 ± 0.40 | 3.69 | 20 | 172 | 15.48 ± 0.25 (–14%) | 3.25 | 21 |
| V, мкм3 × 103 | 83 | 198.46 ± 6.60 | 60.15 | 30 | 172 | 164.22 ± 3.97 (–17%) | 52.04 | 32 |
| L, мкм | 83 | 107.51 ± 1.68 | 15.28 | 14 | 167 | 91.91 ± 1.04 (–14%) | 13.43 | 15 |
| D, мкм | 83 | 54.13 ± 0.59 | 5.40 | 10 | 167 | 53.17 ± 0.51 (–2%) | 6.65 | 12 |
| L/D | 83 | 1.99 | 1.72 | |||||
| SP, мкм2 × 103 | 83 | 5.14 ± 0.12 | 1.06 | 21 | 167 | 4.22 ± 0.08 | 1.06 | 25 |
| SС, мкм2 × 103 | 167 | 3.22 ± 0.06 | 0.84 | 26 | ||||
| SC/SP формалин | 0.76 | |||||||
Примечание: S – площадь поверхности, V – объем, L – длина клеток, D – максимальная ширина клеток, SP – площадь профиля клеток, SC – площадь профиля цитоплазмы после фиксатора, n – число измеренных клеток, M ± m – среднее значение ± ошибка средней величины, Var – коэффициент вариабельности (Var = (σ/M) × 100%).
По результатам анализа препаратов можно отметить следующие морфологические изменения КВТН после фиксации. 1) Наблюдается сжатие клеток, что видно по уменьшению объема клеток и площади их поверхности. Особенно сильно сжатие выражено в зоне апикальных клеток (уменьшение объема клеток в среднем на 43% и площади клеток – на 32%), в меньшей степени – в зоне срединных клеток (26 и 20%) и базальных клеток (17 и 14%). 2) Изменяется форма клеток: наибольшее продольное сжатие происходит в зоне срединных и базальных клеток (на 17 и 14%); в меньшей степени происходит поперечное сжатие этих клеток (на 5 и 2%). В апикальной зоне сжатие клеток одинаково выражено в продольном и поперечном направлении (14 и 17%). Для апикальных клеток отношение (L/D формалин/L/D контроль) равно 1.03, для срединных и базальных клеток – 0.86. Эти данные показывают, что апикальные клетки практически не изменяют своей формы при фиксации, в то время как срединные и базальные клетки укорачиваются. 3) В клетках наблюдается плазмолиз, наиболее сильно выраженный в базальных клетках (SC формалин/SP формалин = 0.76) и несколько меньше – в срединных и апикальных клетках (0.81 и 0.80). 4) При фиксации в формалине все три группы КВТН, по-видимому, в разной степени подвергаются деформации, что отражается в увеличении коэффициента вариабельности морфометрических параметров клеток по сравнению с контрольными клетками. 5) Нативные КВТН сильно окрашены в фиолетовый цвет за счет антоциана. При фиксации происходит обесцвечивание клеток. 6) В клетках хорошо сохраняются ядра с четко обозначенными хроматиновыми структурами. 7) В цитоплазме отмечается появление мелких ячеистых структур. Хорошо сохраняется клеточная стенка, поэтому при фиксации практически не меняется нативная форма клеток. Изменяются только их линейные и объемные параметры.
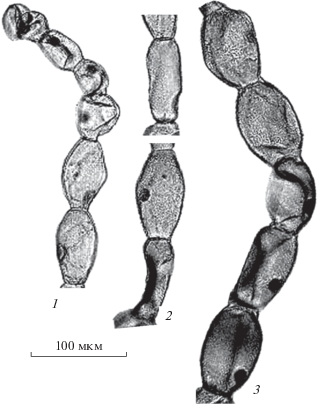
Фиксатор Кларка. На рис. 2 показаны КВТН после фиксации в фиксаторе Кларка. Видны катастрофические изменения морфологии клеток: сжатие цитоплазмы и ядер, клеточная стенка теряет свою упругость, местами она образует складчатую форму, что резко “ломает” общую поверхность клетки. Клетки теряют форму, волоски сильно искривлены. Наиболее сильные изменения отмечены в группе апикальных клеток. При таких результатах фиксации невозможно проводить морфометрический анализ и построение модельных объемных моделей клеток.
ОБСУЖДЕНИЕ
Применение формальдегида как фиксатора началось в 1865 г. после работ Ф. Блюма. Невзирая на длительную историю использования этого фиксатора и исследований механизмов его фиксирующего действия на ткань, ряд вопросов остаются неясными. Особенно это касается морфологических и биохимических артефактов, возникающих в клетках и тканях при фиксации, скорости проницаемости фиксатора в ткань растений и животных и др. Также неоднозначны данные об артефактах при использовании спиртсодержащих фиксаторов, в частности, фиксатора Кларка. Общие вопросы фиксации клеток и тканей в формалине, формалинсодержащих фиксаторах и фиксаторе Кларка обсуждаются в ряде статей и обзоров (Baker, 1958; Berlin, Miksche, 1976; O’Brien, McCully, 1981; Dapson, 1993; Барыкина, 2004; Kiernan, 2008; Das et al., 2013; Ваганова, 2015 и др.). В статье Фокса (Fox et al., 1985) указано, что осмотическое давление 4%-ного раствора формальдегида (1.3 М) равно при стандартных условиях 1300 мосм. Это значительно больше, чем осмотическое давление культуральной среды для тканей животных, которое равно 250–350 мосм. Добавление буфера увеличивает осмотическое давление раствора формальдегида. Гиперосмотичность фиксатора особенно проявляется при фиксации растительных клеток, имеющих вакуоли. Для измерения степени сжатия ткани в формалине Фокс подсчитывал число ядер на единицу площади препарата. Было показано, что после 24 ч фиксации при комнатной температуре число ядер на краях блока ткани печени объемом 1 см3 было равно 24, а в центре блока – 18. Насыщение срезов (толщина 16 мкм) почек крыс формальдегидом при фиксации в растворе 14С‑формальдегида при 37°С наблюдали через 16 ч и через 30 ч при 25°С (Fox et al., 1985). Поэтому наблюдаемое нами сжатие КВТН и их цитоплазмы может объясняться гиперосмотичностью забуференного раствора формальдегида по отношению к цитоплазме растительных клеток.
Катастрофическое действие фиксатора Кларка на морфологию КВТН, по-видимому, обусловлено присутствием спирта, который относится к коагулирующим фиксаторам и вызывает самое сильное сжатие ткани по сравнению с другими фиксаторами (Baker, 1958).
Для фиксации тканей животных в последние годы широко применяются различные модификации состава фиксаторов, в частности, формалинсодержащих фиксаторов, и разные протоколы фиксации, например, с использованием микроволновой техники. Наряду с морфологическими изменениями тканей при фиксации в формалин- и спиртсодержащих фиксаторах, исследуется сохранение внутриклеточных соединений, в частности, РНК (Cox et al., 2006). Показано, что использование модифицированного фиксатора Карнуа (“methacorn” – абсолютный метанол + хлороформ + ледяная уксусная кислота, 6 : 3 : 1, v/v) был наиболее предпочтительным для сохранения РНК и структуры клеток по сравнению с фиксатором Боуэна и забуференным формалином (Puchtler et al., 1970; Shibutani et al., 2000; Cox et al., 2006).
Действие забуференного формалина на волосковые клетки томатов происходит в первые минуты фиксации (Mersey, МcCully, 1978). Отмечается везикуляция цитоплазмы, “танцевание” митохондрий, мелких цитоплазматических частиц и мелких мембранных частичек и др.
Очевидно, что минимизация морфологических и биохимических артефактов, возникающих при химической фиксации тканей и клеток, требует минимального времени фиксации и минимальной концентрации фиксатора. Время фиксации, в свою очередь, зависит от скорости проникновения (диффузии) фиксатора в ткань, размера фиксируемого образца ткани, плотности клеток и тканей и концентрации фиксатора.
Пример определения минимальной концентрации формалина и глутаральдегида для фиксации эндотелиальных клеток пупочной вены человека описан в работе Ф. Зенга и сотр. (Zeng et al., 2013). Показано, что при фиксации в формалине (получен из параформа) в концентрации 0.5–1% в течение 20 мин можно достичь полной фиксации используемых образцов клеток и тканей. В другой работе с использованием микровидеографии было показано, что через 25 мин фиксации в забуференном формалине наблюдается иммобилизация внутриклеточных структур ВКТН после проникновения фиксатора через частично растворенные клеточные стенки (Mineyuki, Gunning, 1988).
Одним из наиболее перспективных составов “универсального идеального” фиксатора является смесь формалина с сульфатом цинка. Цинк−формалин дает лучшее разрешение морфологической структуры клеток и иммунореактивности, что сохраняется даже после длительной фиксации. Считается, что образование координационных связей ионов цинка с макромолекулами стабилизирует их конформационную структуру, что способствует их сохранению при фиксации (Dapson, 1993). Таким образом, для уменьшения морфологических артефактов при фиксации малоклеточных структур растений, таких как ВКНТ, необходимо разработать протокол фиксации, который должен включать минимальные значения концентрации фиксатора и времени фиксации и включение в состав фиксаторов соединений, влияющих на “качество” фиксатора. Это в равной степени относится не только к формалину, но также к пикринсодержащим и спиртсодежащим фиксаторам.
Список литературы
Барыкина Р.П., Веселова Т.Д., Девятов А.Г, Джалилова Х.Х., Ильина Г.М., Чубатова Н.В. 2004. Справочник по ботанической микротехнике. Основы и методы. М.: МГУ. 311 с. (Barykina R.P., Veselova T.D., Devyatov A.G., Dgalilova Kh.Kh., Ilyna G.M., Chubatova N.V. 2004. Handbook for botanical microtechnic. M.: Moscov University Publ. 311 p.)
Буданцев А.Ю. 2019. Влияние фиксатора Боуэна на морфологию клеток волосков тычиночных нитей традесканции (морфометрический анализ). Цитология. 61(4) : 1–5. (Budantsev A.Yu. 2019. The influence of Bouin’s fixative on the morphology of the hairs cells stamen of Tradescantia (morphometric analysis). Tsitologiya. 61(4) : 1–5.)
Буданцев А.Ю., Демьянов А.Ю., Погорелова М.А. 2018. Микрометрический анализ клеток волосков тычиночных нитей традесканции. Цитология. 60(8) : 653–658. (Budantsev A.Yu., Demyanov A.Yu., Pogorelova M.A. 2018. Micrometric analysis of stamen hair cells of Tradescantia. Tsitologiya. 60(8) : 653–658.)
Ваганова А.Н. 2015. Влияние фиксации гистологического материала на результат иммуногистохимического окрашивания. Гены и клетки. 10(3) : 113–119. (Vaganova A.N. 2015. Impact of histological material fixation on the results of immunohistochemistry. Genes and Cells. 10(3) : 113–119.).
Baker J.R. 1958. Principles of biological microtechnique. A study of fixation and dyening. London: Methuenand Co LTD. 357 p.
Berlin G.P., Miksche J.P. 1976. Botanical microtechnique and cytochemistry. Ames Iowa: Iowa State Univ. Press. 321 p.
Cox M.L., Schray C.L., Luster C.N., Stewart Z.S., Korytko H.J., Khan K.N.M., Paulauskis J.D., Dunstan R.W. 2006. Assessment of fixatives, fixation and tissue processing on morphology and RNA integrity. Exp. Mol. Pathol. 80 : 183–191.
Dapson R.W. 1993.Fixation for the 1990’s: A review of needs and accomplishments. Biotechnic and Histochemistry. 68 : 75–82.
Das K., Dumais J., Dasigas S., Krzyzanowski G.D. 2013. Carbon-13-nuclear magnetic resonance anakysis of formaldehyde free. Acta Histochem. 115: 481–486.
Fox C.H., Jonson F.B., Whiting J., Roller P.P. 1985. Formaldehyde fixation. J. Histochem. Cytochem. 33 : 845–853.
Kiernan J. 2008. Histological and histochemical methods, 4-th edition: Theory and practice. Cold Spring Harbor Laboratory Press. 606 p.
Mersey B., McCully M.E. 1978. Monitoring of the course of fixation of plant cells. J. Microscopy. 114 : 49–76.
Mineyuki Y., Gunning B.E.S. 1988. Streak time-lapse video microscopy: Analysis of protoplasmic motility and cell division in Tradescantia stamen hair cells. J. Microscopy. 150 : 41–55.
O’Brien, McCully. 1981. The study of plant structure. Principles and selected methods. Melbourne: Termagrarphi PTY. LTD. 450 p.
Puchtler H., Waldrop F.S., Meloan S.N., Mary S., Terry M.S., Conner M. 1970. Methacarn (methanol-Carnoy) fixation. Histochemie. 21 : 97–116.
Shibutani M., Uneyama C., Miyazaki K., Toyodo K., Hirose M. 2000. Methacarn fixation: A novel tool for analysis of gene expressions in paraffin-embedded tissue specimens. Labor. Invest. 80 : 199–208.
Srinivasan M., Sedmak D., Jewell S. 2002. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. Amer. J. Pathol. 161 : 1961–1971.
Zeng F., Yang W., Huang J., Yuan Ch., Yong Ch. 2013. Determination of the lowest concentrations of aldehyde fixatives for completely fixing various cellular structures by real-time imaging and quantification. Histochem.Cell Biol. 139 : 735–740.
Дополнительные материалы отсутствуют.