Цитология, 2019, T. 61, № 6, стр. 439-454
Влияние моноклональных антител к эндоглину человека на функциональные характеристики клеток эндотелия EA.hy926
А. Ю. Столбовая 1, *, И. В. Смирнов 1, А. А. Пиневич 1, 2, М. А. Берлина 1, А. Р. Козырева 3, О. А. Шашкова 1, Д. И. Соколов 3, С. А. Сельков 3, М. П. Самойлович 1, 2
1 Российский научный центр радиологии и хирургических технологий
им. акад. А.М. Гранова Министерства Здравоохранения РФ
197758 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
3 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
* E-mail: anastasia.stolbovaya@gmail.com
Поступила в редакцию 07.03.2019
После доработки 21.03.2019
Принята к публикации 22.03.2019
Аннотация
Эндотелий кровеносных сосудов играет существенную роль в регуляции нормальных и патологических процессов, происходящих в тканях. Моноклональные антитела (МКАТ) к эндоглину (CD105), маркеру эндотелиальных клеток, рассматривают в качестве потенциальных агентов для воздействия на функциональные характеристики эндотелиальных клеток. Цель настоящего исследования – изучение in vitro способности МКАТ, направленных к различным эпитопам эндоглина, изменять функциональные характеристики эндотелиальных клеток человека линии EA.hy926. Было показано, что разные МКАТ могут замедлять пролиферацию или миграцию клеток, усиливать адгезию моноцитоподобных клеток или снижать интенсивность накопления растворимой формы эндоглина в ростовой среде. Два из восьми исследованных МКАТ были способны оказывать влияние на несколько функциональных характеристик клеток эндотелия.
Функциональное состояние сосудистого эндотелия определяет течение многих нормальных и патологических процессов, происходящих в тканях и внутри кровеносных сосудов. Развитие атеросклероза и гипертонии связано с дисфункцией эндотелия. Прогрессия ряда онкологических заболеваний солидной природы зависит от интенсивности опухолевого ангиогенеза (Carmeliet, Jain, 2011). Неоваскуляризация сетчатки глаза служит причиной некоторых офтальмологических заболеваний (Usui et al., 2015). В настоящее время ведется поиск средств направленного воздействия на функциональное состояние клеток эндотелия. Одним из таких агентов могут быть моноклональные антитела (МКАТ) к эндоглину – мембранному маркеру эндотелиальных клеток (CD105).
Эндоглин – трансмембранный гликопротеин, состоящий из двух доменов: орфанного и ZP (zona pellucida). Помимо эндотелия этот антиген обнаружен на мембранах клеток трофобласта (St-Jacques et al., 1994), мезенхимных стволовых клеток (Barry et al., 1999) и опухолевых клеток различного гистогенеза (Postiglione et al., 2005; Самойлович и др., 2018).
Эндоглин играет заметную роль в регуляции функций микрососудистого русла. Во-первых, этот гликопротеин является компонентом рецепторных комплексов, обеспечивающих трансдукцию сигнала от молекул TGF-β1, TGF-β3, BMP-2, -7, -9, -10 и активина А (Barbara et al., 1999). Во-вторых, благодаря взаимодействию с молекулами интегринов α5β1 эндоглин вовлечен в процессы адгезии и миграции клеток, экспрессирующих его (Guerrero-Esteo et al., 1999; Henry et al., 2010; Lakshman et al., 2010; Rossi et al., 2012). Показано, что эндоглин входит в состав фокальных контактов клеток и посредством адаптерных белков взаимодействует с актиновым цитоскелетом (Conley et al., 2004; Sanz-Rodriguez et al., 2004). Эндоглин также принимает участие в процессе трансмиграции лейкоцитарных клеток в ткани через эндотелий сосудов на этапе плотной адгезии (Rossi et al., 2012). В-третьих, получены данные о взаимосвязи уровней экспрессии этого гликопротеина и пролиферации эндотелиальных клеток (Pal et al., 2014; Dolinsek et al., 2015). В-четвертых, растворимая форма эндоглина (sEng), образующаяся в результате протеолиза (Hawinkels et al., 2010), способна изменять проницаемость сосудистой стенки капилляров (Rossi et al., 2015).
Рядом исследователей получены сведения о том, что МКАТ к эндоглину способны изменять функциональные свойства эндотелиальных клеток. Добавление антител в ростовую среду вызывает ингибирование сигнальных путей, активируемых TGF-β1 или BMP-9 (Kumar et al., 2013; Nolan-Stevaux et al., 2013), снижение скорости деления клеток (She et al., 2003), изменение их миграционной способности (Kumar et al., 2013; Liu et al., 2014) и адгезионных свойств (Gougos et al., 1992), а также приводит к изменению интенсивности образования растворимой формы антигена (Kumar et al., 2013). Показано, что действие МКАТ на характеристики клеток зависят не только от их аффинитета, но и от функциональной значимости распознаваемых ими детерминант (Takahashi et al., 2001).
В настоящее время МКАТ к эндоглину исследуют в качестве средства для направленного подавления опухолевого ангиогенеза. В экспериментах на мышах было показано, что введение антител препятствовало увеличению опухолевой массы первичных узлов и ограничивало метастазирование клеток за счет снижения интенсивности опухолевого ангиогенеза (Takahashi et al., 2001). На основе МКАТ SN6j, обладающего выраженными анти-ангиогенными свойствами, были созданы химерные антитела TRC105 (TRACON Pharmaceuticals Inc., США), предназначенные для терапии онкологических заболеваний (Shiozaki et al., 2005). На фазе I клинических испытаний положительный клинический эффект от введения препарата наблюдали примерно у 50% пациентов, страдавших онкологическими заболеваниями солидной природы различного гистогенеза (Rosen et al., 2012; Karzai et al., 2014). Однако последующие испытания (фаза II) не смогли подтвердить его эффективность (Duffy et al., 2015; Apolo et al., 2016). Вопрос об ограниченной эффективности TRC105 в настоящее время не имеет ответа.
В лаборатории гибридомной технологии РНЦРХТ им. акад. А.М. Гранова МЗ РФ (Санкт-Петербург) создана панель из восьми МКАТ к эндоглину человека (1B4, 2C8, 4C9, 4E4, 5B6, 5F1, 5G7 и 5H7), способных связывать антиген, экспрессированный на мембране клеток (Смирнов и др., 2015).
Цель настоящего исследования заключалась в определении in vitro способности этих восьми антител оказывать влияние на функциональные характеристики эндотелиальных клеток. В качестве модельного объекта использовали клетки линии EA.hy926, обладающие основными характеристиками эндотелия. Изучали влияние МКАТ на пролиферацию, миграцию, адгезию клеток к твердому субстрату и экспрессию ими основных адгезионных молекул, кроме того, исследовали действие МКАТ на прикрепление моноцитарных клеток к монослою эндотелия, а также на скорость накопления sEng в ростовой среде эндотелиальных клеток.
Полученные результаты свидетельствуют о том, что присутствие в ростовой среде МКАТ, направленных к разным детерминантам эндоглина, вызывает различные функциональные изменения в клетках эндотелия EA.hy926. Выявлено два антитела, способных оказывать влияние на ряд функциональных характеристик клеток.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Линия EA.hy926 эндотелия человека предоставлена И.С. Фрейдлин с любезного разрешения автора (Edgell et al., 1983); клеточные линии THP-1 и HEK293 были получены из Российской коллекции клеточных культур позвоночных (Институт цитологии РАН, Санкт-Петербург); клетки U937 – из Российской коллекции клеточных культур (НИИ гриппа МЗ РФ, Санкт-Петербург). Клетки EA.hy926 культивировали в среде DMEM/F12, содержавшей 5% эмбриональной телячьей сыворотки (ЭТС), 0.5 мкМ аминоптерина, 16 мкМ тимидина и 100 мкМ гипоксантина. Моноцитоподобные клетки THP-1 и U-937 культивировали в среде RPMI-1640, содержащей 5% ЭТС. Клетки линии HEK293 культивировали в среде DMEM/F12 в присутствии 5% ЭТС.
МКАТ. Создание и основные свойства использованных в работе МКАТ (1B4, 2C8, 4C9, 4E4, 5B6, 5F1, 5G7, 5H7) к эндоглину человека описаны ранее (Смирнов и др., 2015; Smirnov et al., 2016). В качестве изотипического контрольного реагента были использованы МКАТ 3A7, специфичные к белку CagA Helicobacter pylori (Klimovich et al., 2010) и не распознающие эпитопы эндоглина.
Рекомбинантные белки. Рекомбинантные фрагменты эндоглина получали в клетках HEK293 (Smirnov et al., 2018) или E.coli (Смирнов и др., 2015). Клетки HEK293 трансфецировали методом кальций-фосфатной преципитации (Jordan et al., 1996). В работе был использован коммерческий препарат рекомбинантного TGF-β1.
Иммуноферментный анализ (ИФА). Основные варианты ИФА, использованные в работе, были описаны ранее (Смирнов и др., 2015; Smirnov et al., 2016, 2018). Для оценки содержания sEng в ростовой среде клеток, культивированных в присутствии МКАТ к эндоглину, были разработаны оригинальные варианты двухцентрового ИФА, которые ввиду их значимости для восприятия результатов исследования, описаны в разделе “Результаты”.
ПЦР в реальном времени. Уровень экспрессии мРНК L- и S-эндоглина оценивали с помощью ПЦР в реальном времени как изложено ранее (Самойлович и др., 2018).
Проточная цитофлуориметрия. Связывание МКАТ с эндоглином, экспрессированным на мембране клеток, оценивали с помощью метода проточной цитофлуориметрии. Клетки инкубировали в блокирующем растворе (ФСР, 3% ЭТС, 1 мг/мл NaN3), содержавшем МКАТ к эндоглину в различных концентрациях. Связанные с мембраной клеток антитела детектировали с помощью поликлональных козьих антител против иммуноглобулинов мыши, конъюгированных с изотиоцианатом флуоресцеина. Интенсивность флуоресценции клеток оценивали с помощью проточного цитофлуориметра FACSAria III (BD, США).
Оценка пролиферации клеток. Клетки эндотелия EA.hy926 засевали в лунки 96-луночных планшетов в концентрации 2.5 × 104 кл./мл (2.5 × 103 на лунку). Спустя 24 ч заменяли среду и вносили МКАТ к эндоглину в рабочей концентрации и/или TGF-β1 (1 нг/мл). Клетки культивировали в течение 3 сут, затем окрашивали 0.2%-ным раствором кристаллического фиолетового, высушивали и лизировали 50%-ным раствором ледяной уксусной кислоты. Оптическую плотность полученных лизатов измеряли при 540 и 630 нм. Средние величины этих показателей использовали для оценки количества клеток в конце эксперимента. Все эксперименты в качестве позитивного контроля включали стимуляцию пролиферации клеток с помощью четырехкратного повышения концентрации ЭТС (от 2.5 до 10%), что приводило к увеличению показателя оптической плотности в 1.5–2 раза.
Оценка миграционной способности клеток. Скорость миграции клеток эндотелия EA.hy926 оценивали в тесте закрытия “раны” клеточного монослоя. Клетки, посеянные в дозе 3.0 × 105 кл./мл (3.0 × 104 на лунку) в покрытые желатиной лунки 96-луночного планшета, в течение 1 сут формировали монослой с конфлюентом 95–98%. Наконечником механического дозатора нарушали целостность монослоя нанесением “раны”. Открепившиеся клетки удаляли путем двукратного промывания ростовой средой с 1% ЭТС. Затем вносили полную ростовую среду (с 5% ЭТС), содержащую исследуемые антитела. Клетки культивировали в присутствии МКАТ в течение 24 ч, фиксировали 4%-ным раствором формальдегида и окрашивали 0.2%-ным раствором кристаллического фиолетового. Рану в монослое клеток фотографировали с помощью инвертированного микроскопа A-xio Zeiss (об. 5×, камера AxioCam MRm, Германия) сразу после ее нанесения и по окончании эксперимента.
Фотографии ран в монослое обрабатывали с помощью созданного в лаборатории скрипта на языке R с применением алгоритмов анализа изображений, реализованных в пакете EBImage (Pau et al., 2010). Фотографии, полученные непосредственно после нанесения раны, предварительно обрабатывали в графическом редакторе GIMP (версия 2.10.6) с целью повышения их контрастности. Фотографии окрашенных кристаллическим фиолетовым клеток использовали без предварительной обработки. На рис. 1а представлена оригинальная черно-белая фотография клеток эндотелия, окрашенных кристаллическим фиолетовым. Загруженные в память компьютера изображения представляли собой матрицы, содержавшие десятичные дроби от 0 (черный) до 1 (белый). На первом этапе происходила бинаризация изображений, т.е. всем пикселям выше порогового уровня присваивали значение 1, а ниже его – значение 0 (рис. 1б). Выбор порога отсечения был основан на методе анализа бимодальных распределений Оцу (Otsu). При необходимости пользователь мог самостоятельно корректировать выбранный порог. Далее с помощью алгоритма морфологического открытия с изображения происходило удаление мелких белых пятен и снижение степени детализации крупных пятен (рис. 1в). На завершающем этапе анализа скрипт производил сегментацию изображения путем выявления белых, не соприкасающихся друг с другом объектов. Объекты ранжировали по площади (в пикселях) от большего к меньшему. Таким образом, первым в этом ряду оказывался объект, соответствовавший начерченной ране (рис. 1г). Для каждой фотографии вычисляли долю площади (в %), занимаемой раной. Раны в каждой ячейке фотографировали в 3-х местах. Для анализа использовали усредненные значения площади ран.
Рис. 1.
Этапы обработки фотографических изображений разработанными в лаборатории скриптами на языке R с целью определения относительной площади раны в монослое клеток EA.hy926 (а–г) или подсчета прикрепившихся моноцитоподобных клеток, меченных CFSE (д–з). а – Оригинальное изображение раны монослоя; б – бинаризованное изображение; в – изображение после применения морфологического открытия; г – сегментированное изображение раны монослоя; д – оригинальное изображение прикрепившихся к эндотелию клеток THP-1, окрашенных CFSE; е – увеличенный фрагмент предыдущего изображения (д); ж – бинаризованное изображение окрашенных клеток; з – результат морфологической сегментации изображения: отдельные клетки окрашены в различные цвета.

В качестве зависимой величины при анализе изменения площади раны в ходе эксперимента выступал коэффициент закрытия раны, вычисляемый по формуле: C = (S1 – S2)/S1 × 100%, где C – степень закрытия раны, S1 – средняя площадь раны в день нанесения (в %), S2 – средняя площадь раны спустя 1 сут (в %). Число клеток, мигрировавших в область раны, считали на полученных изображениях визуально.
Оценка способности клеток эндотелия к адгезии на твердом субстрате. Клетки эндотелия EA.hy926 снимали с поверхности культурального флакона с помощью 0.02%-ного раствора Версена. Далее клетки суспендировали в среде DMEM/F12, содержащей 1% ЭТС и МКАТ в рабочей концентрации (5 мкг/мл) и засевали в лунки 96-луночных планшетов в концентрации 3 × 105 кл./мл (по 3 × 104 в лунку). Спустя 3 ч культивирования неприкрепившиеся к твердой фазе клетки отмывали ФСР. Клетки, оставшиеся на дне, окрашивали раствором CFSE (0.5 мкМ) и фотографировали. Для исследования действия МКАТ на адгезию моноцитоподобных клеток к эндотелию клетки EA.hy926 выращивали в 96-луночных планшетах до достижения 95–98%-ного конфлюента. Далее ячейки заполняли средой с МКАТ в рабочей концентрации и инкубировали 30 мин. Несвязавшиеся антитела удаляли, после чего вносили меченные CFSE (сarboxyfluorescein succinimidyl ester) клетки THP-1 или U937 в концентрации 3 × 105 кл./мл (по 3 × 104 в лунку). Совместную инкубацию эндотелия и моноцитоподобных клеток вели в течение 1 ч (без добавления цитокинов) или в течение 1 сут (в присутствии TGF-β1). Не прикрепившиеся клетки удаляли, а оставшиеся на дне лунок меченные CFSE клетки фотографировали.
Анализ изображений с целью подсчета количества прикрепившихся клеток во многом совпадал с анализом, проводимым с целью определения площади раны монослоя (рис. 1д–1ж). Однако сегментацию изображений осуществляли с помощью алгоритма whatershed (рис. 1з), который позволял корректно подсчитывать клетки, образовавшие дуплеты, триплеты и т.д. Объекты, имевшие площадь (в пикселях) меньше порогового значения, не использовали при подсчете числа клеток. Как правило, они представляли собой фрагменты клеточного дебриса, окрашенные CFSE.
Иммунопреципитация, электрофорез и вестерн-блот-анализ. Для получения препаративных количеств sEng, иммунопреципитацию антигена из образцов плазмы крови и ростовой среды клеток EA.hy926 проводили с помощью иммуноаффинной колонки с иммобилизованными МКАТ 4Е4, как было описано ранее (Smirnov et al., 2016).
Для исследования влияния МКАТ на накопление sEng в ростовой среде клетки эндотелия высевали в пару флаконов с площадью поверхности 75 см2 и выращивали до достижения 95–98%-ного конфлюента. Далее среду полностью удаляли, монослой клеток промывали ФСР, после чего вносили по 12 мл ростовой среды, не содержащей (контроль) или содержащей МКАТ к эндоглину в рабочей концентрации (эксперимент). Через 4 сут культивирования собирали надосадки. Среду из контрольного флакона делили на 2 части по 5 мл. К одной из них добавляли исследуемые МКАТ в рабочей концентрации (5 мкг/мл) и инкубировали в течение 1 ч при 37°С, вторую часть оставляли интактной. В каждый из трех образцов (два контрольных и один экспериментальный) добавляли по 15 мкл BrCN-сефарозы с иммобилизованными МКАТ 4С9 и по 5 мкг NaN3. Пробирки с образцами инкубировали в течение ночи при комнатной температуре на шейкере. Далее микросферы сефарозы осаждали центрифугированием и трижды промывали трис-солевым раствором, содержащем 0.5% Tween 20. Затем к осажденной сефарозе добавляли погрузочный буфер для электрофореза, содержавший 2% β-меркаптоэтанола, и инкубировали при 80°С в течение 10 мин. На дорожки полиакриламидных гелей наносили только жидкую фракцию.
Электрофорез белков вели по методу Лэммли (Laemmli, 1970), в восстанавливающих условиях в 7.5%-ном геле. Перенос на нитроцеллюлозные мембраны проводили полусухим методом в буфере Товбина (Towbin), содержащем 20% этанола. Мембраны блокировали трис-солевым раствором, содержащим 2.5 мг/мл казеина. Антиген выявляли прямым или непрямым методом с использованием МКАТ 2Е1, распознающего линейный эпитоп эндоглина (Смирнов и др., 2015). Детекцию пероксидазной активности на мембранах осуществляли с помощью ТМВ (tetramethylbenzidine).
Статистический анализ и представление данных. Статистический анализ данных проводили с помощью средств языка программирования R. Для оценки действия МКАТ на пролиферацию, миграцию и адгезию к твердому субстрату клеток эндотелия использовали регрессионные модели со смешанными эффектами. Базовый анализ моделей был выполнен средствами пакета lme4 (Bates et al., 2015). Ввиду того, что точное вычисление p-уровней значимости для коэффициентов смешанных моделей невозможно, примерные значения этого параметра были определены с помощью метода Саттерсвайта. Соответствующее расширение стандартных lmerMod-объектов предоставлял пакет lmerTest (Kuznetsova et al., 2017). Коррекцию p-уровней значимости при проведении множественных сравнений внутри моделей осуществляли методом Бонферрони.
Для визуализации данных применяли средства пакета ggplot2. Подготовку конечных рисунков проводили средствами пакета cowplot.
Использовали следующие реактивы и среды: культуральные среды DMEM/F12 и RMPI-1640 (Биолот, Россия); эмбриональную телячью сыворотку (Биолот, Россия или Hyclone, США); рекомбинантные молекулы TGF-β1 и эндоглина (R&D Systems, США); TMB для иммуноферментного анализа (Хема, Россия) и для вестерн-блот-анализа (Sigma, США); BrCN-сефарозуTMB (GE Healthcare, США).
РЕЗУЛЬТАТЫ
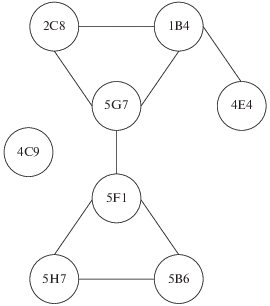
Ранее было установлено, что все изучаемые МКАТ (1B4, 2C8, 4C9, 4E4, 5B6, 5F1, 5G7 и 5H7) направлены к конформационным эпитопам эндоглина (Смирнов и др., 2015). Взаимное расположение распознаваемых ими детерминант определено методом конкурентного ИФА и схематически представлено на рис. 2 (Smirnov et al., 2016). Для локализации эпитопов, распознаваемых МКАТ, относительно аминокислотной последовательности эндоглина были использованы три рекомбинантных фрагмента эндоглина: Eng26-586 включал всю последовательность экстраклеточного участка эндоглина, Eng26-359 содержал только орфанный домен белка, а Eng239-359 воспроизводил центральный участок молекулы антигена (Смирнов и др., 2015; Smirnov et al., 2016). С помощью ИФА установлено, что все рассматриваемые МКАТ взаимодействуют с Eng26-586 и Eng26-359, но не связывают Eng239-359. Таким образом, сделан вывод о том, что детерминанты, связываемые этими антителами, локализованы в участке орфанного домена, в последовательности Glu26-Val238.
Рис. 2.
Взаиморасположение детерминант, распознаваемых МКАТ, на молекуле эндоглина. Частично перекрывающиеся детерминанты соединены линиями. Публикуется по Smirnov et al., 2016 с изменениями.
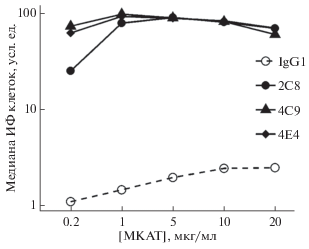
Проведению функциональных тестов предшествовало определение концентрации МКАТ, при которой происходило насыщение связывания молекул эндоглина на мембране клеток EA.hy926. Для этого в культуральную среду клеток эндотелия EA.hy926 вносили МКАТ в концентрации от 0.2 до 20 мкг/мл. Взаимодействие МКАТ с антигеном на мембране детектировали методом проточной цитофлуориметрии. Максимальная интенсивность флуоресценции клеток достигалась при использовании МКАТ в концентрации 1–5 мкг/мл (рис. 3). Таким образом, при проведении последующих экспериментов все МКАТ были использованы в концентрации 5 мкг/мл.
Рис. 3.
Кривые насыщения связывания МКАТ с эндоглином на мембране клеток EA.hy926. IgG1 – изотипический контроль; 2С8, 4С9 и 4Е4 – МКАТ к эндоглину. ИФ – интенсивность флуоресценции. МКАТ детектировали с помощью поликлональных козьих антител против иммуноглобулинов мыши, конъюгированных с изотиоцианатом флуоресцеина.
С помощью метода ПЦР в реальном времени и проточной цитофлуориметрии исследовали влияния МКАТ на экспрессию клетками EA.hy926 эндоглина при культивировании в течение 4 сут в среде, содержащей антитела. Ни одно из исследуемых МКАТ не оказывало значимого влияния ни на транскрипцию мРНК эндоглина, ни на плотность его молекул на цитоплазматической мембране клеток (данные не показаны).
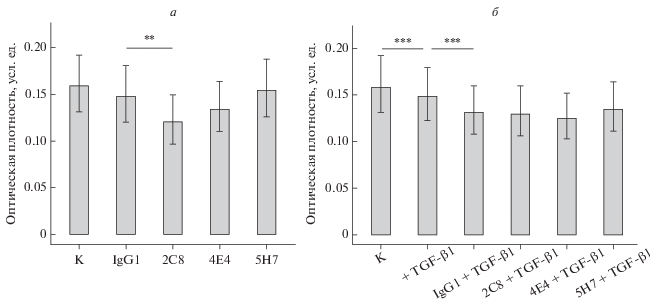
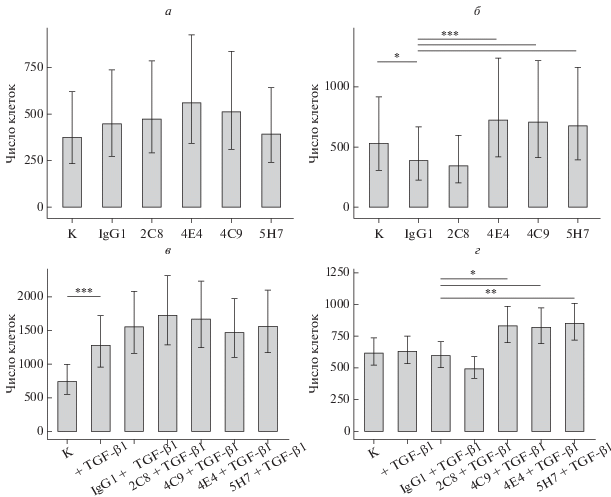
Среди исследуемых МКАТ выявлено одно (2С8), способное замедлять пролиферацию клеток EA.hy926 (рис. 4а). При добавлении в ростовую среду клеток рекомбинантного TGF-β1 (1 нг/мл) отмечено снижение интенсивности пролиферации клеток в присутствии не только МКАТ против эндоглина, но также и изотипических контрольных антител. Таким образом, специфичного для антител к эндоглину эффекта в отношении скорости роста эндотелиальных клеток в присутствии цитокина не установлено (рис. 4б). Здесь и далее для облегчения восприятия информации на рисунках приведены данные для тех МКАТ, которые оказывали влияние на функциональные характеристики клеток, и данные для одного или нескольких реагентов, эффекты которых не выявили.
Рис. 4.
Влияние МКАТ против эндоглина на пролиферацию клеток EA.hy926, культивируемых в стандартной среде в отсутствие (а) или в присутствии TGF-β1 (б). Здесь и на рис. 5–7 показаны средние значения и 95%-ные доверительные интервалы (вертикальные отрезки). Различия достоверны при: *P < 0.05, ** Р < 0.01, ***P < 0.001; n = 3. К – контроль (без добавления МКАТ), IgG1 – изотипический контроль. Пролиферацию оценивали по оптической плотности лизатов клеток, окрашенных 0.2%-ным раствором кристаллического фиолетового.
Исследование миграционной способности эндотелиальных клеток проводили с помощью метода нанесения “раны” на монослой. Результаты оценивали по двум параметрам: степени закрытия раны монослоем клеток (в %) и числу клеток, мигрировавших внутрь раны. Для оценки площади ран на фотографических изображениях, полученных с помощью инвертированного микроскопа, был разработан компьютерный скрипт, который позволял автоматически вычислять долю пикселей, приходящихся на изображение ран (рис. 1а–1г). При культивировании клеток эндотелия EA.hy926 в присутствии МКАТ к эндоглину не выявили изменения степени закрытия раны монослоя (рис. 5а). Добавление любых антител (в том числе изотипических) приводило к уменьшению числа клеток, мигрировавших в область раны (рис. 5б). Это может свидетельствовать о большем распластывании клеток в присутствии мышиных иммуноглобулинов, т.к. меньшее их количество занимало ту же площадь, что и в контрольном эксперименте. Тем не менее эффекта, специфичного для МКАТ к эндоглину, выявлено не было ни в отношении закрытия раны, ни в отношении числа мигрировавших в них клеток.
Рис. 5.
Влияние МКАТ против эндоглина на миграцию клеток эндотелия EA.hy926 (закрытие раны), культивируемых в стандартной среде в отсутствие (а, б) или в присутствии TGF-β1 (в, г). а, в – Степень закрытия ран в монослое; б, г – число клеток, мигрировавших внутрь раны; д – типичные фотографические изображения ран в монослое, которые получены в экспериментах при культивировании клеток в присутствии TGF-β1. n = 3.
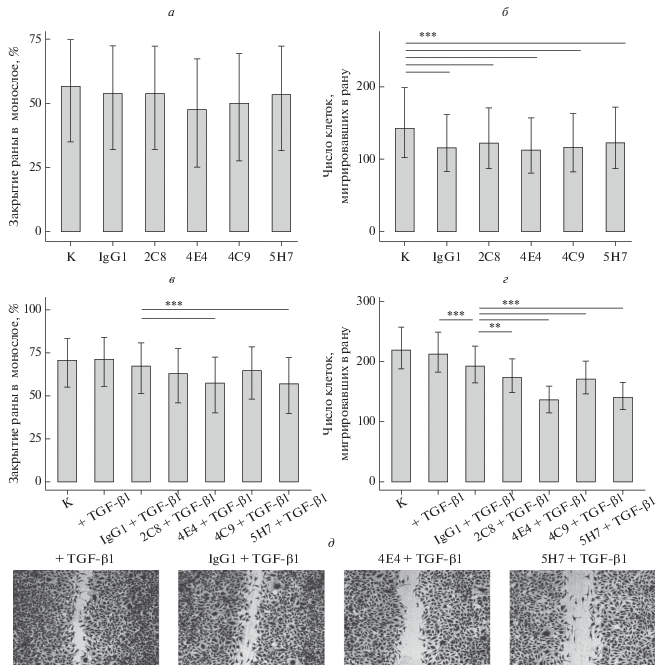
Аналогичные эксперименты, проведенные с добавлением в ростовую среду TGF-β1 (1 нг/мл), позволили зарегистрировать снижение степени закрытия раны в присутствии МКАТ к эндоглину. Наиболее выраженным эффектом обладали антитела 4Е4 и 5H7 (рис. 5в). Внесение этих антител снижало площадь закрытия раны до 84.6% (от уровня изотипического контроля). При добавлении антител 4Е4 или 5Н7 число клеток, мигрировавших в область раны, уменьшалось до 70.4% от числа в изотипическом контроле (рис. 5г). На рис. 5д представлены фотографии ран монослоя, зарастание которых происходило в присутствии TGF-β1 и 4Е4, 5H7 или изотипических контрольных антител.
Участие эндоглина в механизмах клеточной адгезии и трансмиграции лейкоцитов послужило поводом для проведения экспериментов, направленных на выявление МКАТ, способных оказывать влияние на прикрепление эндотелиальных клеток к твердому субстрату и на адгезию моноцитоподобных клеток к монослою эндотелия. В экспериментах использовали клетки эндотелия EA.hy926, меченные CFSE, и клетки моноцитоподобных линий THP-1 и U937. Количество прикрепившихся меченых клеток на фотографиях оценивали автоматически с помощью разработанного скрипта (рис. 1д–1з). Проведенные эксперименты не обнаружили влияния ни одного из МКАТ против эндоглина на процесс прикрепления клеток эндотелия к покрытому желатиной твердому субстрату (рис. 6). Внесение в ростовую среду любого из МКАТ против эндоглина также не вызывало изменений количества прикрепившихся к эндотелию клеток THP-1 (рис. 7а). Напротив, все МКАТ против эндоглина, а также изотипические антитела влияли на адгезию к эндотелию клеток линии U937. Снижение числа прикрепившихся к эндотелию моноцитоподобных клеток U937 до 73.0% от их числа в контрольном эксперименте наблюдали в присутствии МКАТ 2С8 или изотипического антитела. Однако в присутствии антител 4С9, 4E4 или 5H7 отмечен значимый рост числа прикрепившихся клеток U937 до 185.6% от значения в изотипическом контроле (рис. 7б). Аналогичные эксперименты были проведены на клетках эндотелия, культивируемых в присутствии рекомбинантного TGF-β1. Добавление в среду цитокина приводило к увеличению количества прикрепившихся клеток THP-1 до 173.7%. Однако статистически значимых изменений выявлено не было (рис. 7в). Напротив, присутствие TGF-β1 само по себе не оказывало влияния на адгезию клеток U937 к монослою эндотелия. Эффекты от внесения МКАТ к эндоглину имели тот же характер, что и в экспериментах без добавления цитокина (рис. 7г).
Рис. 6.
МКАТ к эндоглину не влияют на адгезию клеток эндотелия EA.hy926 к твердому субстрату, покрытому желатиной, n = 4.
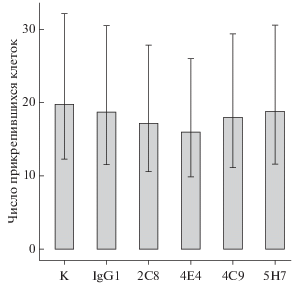
Рис. 7.
Влияние МКАТ к эндоглину на адгезию моноцитоподобных клеток THP-1 (а, в) и U937 (б, г) к монослою эндотелиальных клеток EA.hy926, культивируемых в стандартной среде в отсутствие (а, б) или в присутствии TGF-β1 (в, г). n = 3.
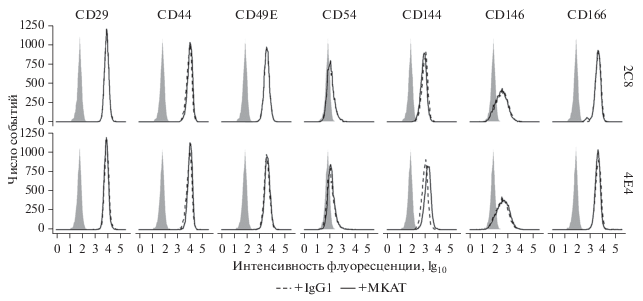
Влияние МКАТ к эндоглину на адгезию моноцитарных клеток может быть связано непосредственно с функцией эндоглина, а может быть вызвано изменениями уровня экспрессии других адгезионных молекул. Для проверки этого предположения с помощью метода проточной цитофлуориметрии изучили экспрессию основных адгезионных молекул эндотелия CD29 (интегрин β1), CD44 (HCAM), CD49E (интегрин α5), CD54 (ICAM-1), CD144 (VE-кадгерин), CD146 (MCAM) и CD166 (ALCAM) интактными клетками и клетками, культивируемыми в присутствии МКАТ в течение 24 ч. Добавление в среду МКАТ к эндоглину не приводило к значимым изменениям уровней экспрессии указанных молекул. На рис. 8 приведены результаты экспериментов с внесением 2С8 и 4Е4, обладавших отличающимся друг от друга действием на адгезию клеток U937. Как было отмечено выше, первое антитело не оказывало влияния на этот процесс, тогда как в присутствии второго МКАТ отмечен рост количества прикрепившихся клеток (рис. 7б, 7г).
Рис. 8.
МКАТ к эндоглину не оказывают влияния на экспрессию адгезионных молекул клетками эндотелия EA.hy926. Клетки культивировали в присутствии МКАТ 2С8 или 4Е4. Серые гистограммы – изотипический контроль. Данные проточной цитофлуориметрии.
Для исследования действия МКАТ на интенсивность накопления sEng в ростовой среде клеток были использованы системы двухцентрового ИФА, разработанные Смирновым с коллегами (Smirnov et al., 2016). Определение концентрации антигена с помощью ИФА в присутствии специфичных к нему МКАТ является нетривиальной задачей ввиду интерференционных взаимодействий антител: стерических и аллостерических. Первый вариант взаимодействия предполагает, что МКАТ, находящиеся в аналите и используемые для детекции антигена, направлены к идентичным или пространственно перекрывающимся эпитопам. Для минимизации этого типа конкуренции реагентов определение концентрации sEng вели с помощью трех систем ИФА. Принцип подбора пар МКАТ для этих систем состоял в том, что эпитопы, распознаваемые этими антителами, не должны перекрываться с МКАТ, находящимися в ростовой среде (рис. 2). Культуральные жидкости, содержавшие антитела 2С8, 5В6, 5G7 или 5H7, были тестированы с помощью системы ИФА на основе пары МКАТ 4Е4-4С9. Образцы, содержавшие 4Е4 и 1В4, исследовали посредством системы ИФА на основе пары МКАТ 5F1-4С9. Среды с добавлением 4С9 исследовали в системе ИФА 5F1-2C8.
Аллостерические взаимодействия характерны для МКАТ, направленных к пространственно удаленным эпитопам, однако связывание одного антитела вызывает конформационные изменения в молекуле антигена, приводящие к изменению аффинитета взаимодействия с ним других МКАТ. Для компенсации аллостерических эффектов антител, рекомбинантный калибратор предварительно инкубировали в среде, содержавшей исследуемые МКАТ в рабочей концентрации (5 мкг/мл) в течение 1 ч при 37°С. Таким образом, и в калибраторе, и в образцах присутствовали иммунные комплексы антигена с одноименными антителами.
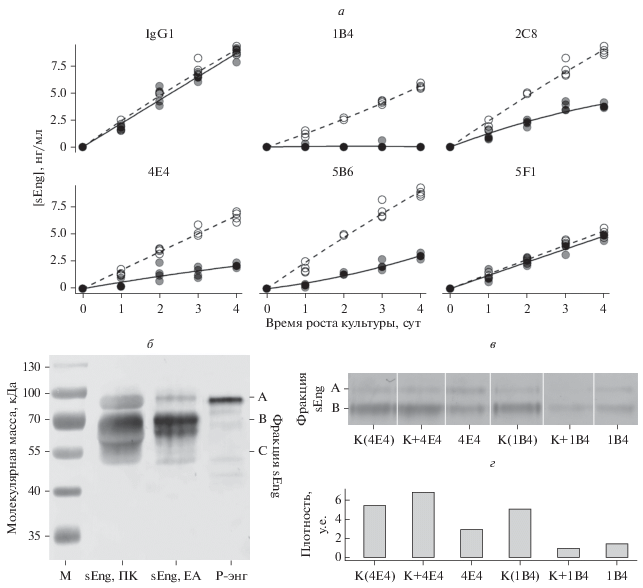
В культурах клеток эндотелия, не содержавших МКАТ против эндоглина, происходило линейное увеличение концентрации sEng в среде в течение 4 сут культивирования. При культивировании клеток эндотелия в среде, содержащей 1В4, 2С8, 4Е4 или 5В6 отмечено торможение накопления антигена в среде. Добавление других антител не имело значимого влияния на этот процесс (рис. 9а).
Рис. 9.
Влияние МКАТ к эндоглину на накопление растворимого эндоглина (sEng) в ростовой среде клеток эндотелия. а – Динамика накопления sEng в ростовой среде, определенная с помощью ИФА (n = 4); б – Вестерн-блот (непрямой метод), демонстрирующий гетерогенную природу молекул sEng, выделенных из плазмы крови (ПК) и ростовой среды клеток EA.hy926 (ЕА); Р-Eng – рекомбинантный эндоглин; в – Вестерн-блот (прямой метод), показывающий количество sEng, иммунопрецепитированного из культуральных сред клеток через 4 сут их роста в присутствии МКАТ 1В4 или 4Е4; г – денситометрическая оценка количества антигена (в). К(4E4) и К(1В4) – контроль, поставленный для эксперимента с указанными антителами; К+4E4 и К+1В4 – к контрольному образцу были добавлены указанные антитела; 4Е4 или 1В4 – антиген, выделенный из надосадочной жидкости клеток, культивированных в присутствии МКАТ.
Для подтверждения ингибиторного действия МКАТ 1В4, 2С8, 4Е4 и 5В6 на процесс образования sEng был использован метод иммунопреципитации с последующими электрофорезом и вестерн-блот-анализом. В каждом эксперименте клетки засевали в два идентичных флакона, в один из которых добавляли МКАТ к эндоглину, а второй служил контролем. Спустя 4 сут из всех флаконов собирали культуральные среды. Контрольный образец делили на две равные части. К одной из них добавляли исследуемые МКАТ в рабочей концентрации, а вторую оставляли интактной. Захват молекул sEng из раствора осуществляли посредством микрочастиц BrCN-сефарозы с иммобилизованными на них 4С9 (это антитело не конкурирует ни с одним из тестируемых МКАТ). Иммунопреципитацию sEng проводили из идентичных по объему образцов, антиген выявляли посредством меченного пероксидазой антитела 2Е1, которое распознает отдельный, не перекрывающийся с остальными, эпитоп эндоглина.
Присутствие в образцах антител не позволяло использовать более чувствительный непрямой метод детекции, в котором в качестве вторичного реагента выступали бы поликлональные антитела к иммуноглобулинам мыши. В отличие от рекомбинантного антигена, используемого в ИФА в качестве калибратора, молекулы sEng из плазмы крови и культуральной жидкости клеток эндотелия EA.hy926 являются гетерогенными (Smirnov et al., 2016, 2018) и при электрофорезе в восстанавливающих условиях формируют три фракции: А, B и C (рис. 9б). Менее чувствительный прямой метод детекции антигена, использованный в настоящем исследовании, позволил выявить только две основных фракции (А и В). С помощью изложенных выше процедур удалось подтвердить ингибирование накопления sEng в среде с помощью трех МКАТ: 2С8, 4Е4 и 5В6. Выявленный в ИФА ингибирующий эффект МКАТ 1В4 не был подтвержден. На рис. 9в, 9г представлены результаты эксперимента с двумя МКАТ, направленными к частично перекрывающимся эпитопам. В отличие от эксперимента с антителом 4Е4, добавление к контрольному образцу 1В4 приводило к снижению взаимодействия sEng с 4С9, используемым для преципитации. Вероятно, занижение количества антигена, определяемого ИФА в присутствии антитела 1В4, связано с гетерогенной природой sEng: связывание этого антитела вызывало более выраженные изменения конформации естественных молекул антигена по сравнению с рекомбинантным калибратором.
ОБСУЖДЕНИЕ
Настоящее исследование направлено на определение в экспериментах in vitro возможности изменения функциональных свойств клеток эндотелия посредством созданных в лаборатории МКАТ к эндоглину. В работе использовали методы, позволяющие провести скрининговую оценку влияния антител на различные функции эндотелиальных клеток. Клетки линии EA.hy926, выбранные в качестве модельного объекта, имеют как преимущества, так и недостатки. Недостаток этих клеток состоит в том, что в отличие от первичных эндотелиальных клеточных культур они менее чувствительны к внешним воздействиям вследствие их гибридомной природы (клеточная линия получена путем слияния эндотелиальных клеток HUVEC и клеток карциномы легкого человека А549 (Edgell at al., 1983)). Тем не менее, показано, что эти клетки сохраняют морфологические, биохимические и фенотипические характеристики эндотелиальных клеток (Thornhill et al., 1993; Ahn et al., 1995; Bouis et al., 2002). Преимущество использования постоянной клеточной линии состоит в возможности проведения неограниченного количества экспериментов на генетически идентичных клетках.
Установлено, что антигенные детерминанты, распознаваемые исследованными МКАТ, локализованы на участке орфанного домена Glu26-Val238. Аминокислотные остатки, участвующие в связывании BMP-9/10, RGD-мотив, обеспечивающий взаимодействие с белками внеклеточного матрикса, и участки ассоциации с рецепторами TGF-β1 I и II типов располагаются за пределами указанной последовательности (рис. 10). Эндоглин не имеет специфичного сайта связывания TGF-β1, а контактирует с ним лишь при сборке рецепторного комплекса (Barbara et al., 1999). В настоящее время неизвестна локализация последовательностей эндоглина, участвующих в рецепции BMP-2, -7, активина А и его взаимодействии с интегринами α5β1. Описано лишь одно МКАТ (SN6j/TRC105), способное изменять функциональные свойства эндотелиальных клеток посредством ингибирования связывания молекул BMP-9/10 (Nolan-Stevaux et al., 2013). МКАТ SN6a и RMAC8 могут распознавать эпитопы, которые вовлечены во взаимодействие эндоглина и рецепторов TGF I и II типов при сборке рецепторных комплексов. Однако прямого подтверждения того, что эти антитела ингибируют ассоциацию рецепторов пока не получено.
Рис. 10.
Схема локализации детерминат, распознаваемых МКАТ, и участков аминокислотной последовательности эндоглина, вовлеченных во взаимодействие с лигандами и рецепторами TGF-β I и II. ЛП – лидерный пептид; ТМ – трансмембранный участок; ЦП – цитоплазматический домен; RI и RII – рецепторы к TGF-β I и II типов соответственно. Данные получены в настоящей работе или взяты из литературных источников (Pichuantes et al., 1997; Takahashi et al., 2001). Сведения о локализации функционально-значимых аминокислот в последовательности эндоглина взяты из литературы (Gougos, Letarte, 1990; Guerrero-Esteo et al., 2002; Saito et al., 2017).
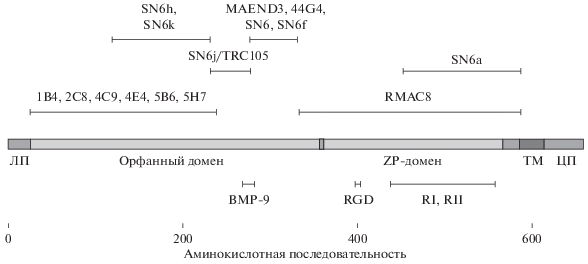
Тем не менее, описан широкий спектр специфичных к эндоглину антител, способных вызывать те или иные функциональные изменения в клетках, которые распознают детерминанты за пределами указанных функционально-значимых участков эндоглина (рис. 10). Например, наряду с МКАТ SN6j подавление опухолевого ангиогенеза у мышей также возможно и при введении других антител серии SN6. Более того, сочетанное введение мышам антител SN6f и SN6k приводило к аддитивному эффекту замедления роста опухолей (Takahashi et al., 2001).
Среди исследователей нет единого мнения о том, какой должна быть оптимальная рабочая концентрация МКАТ к эндоглину для проведения функциональных тестов. Так, для демонстрации ингибирования роста клеток HUVEC использовали антитела серии SN6 в концентрации от 10 до 100 мкг/мл (She et al., 2003). Показано, что химерные МКАТ к эндоглину SN6j ингибируют сигнальный каскад BMP-9 (Smad1/5/8) и вызывают функциональные изменения в клетках HUVEC уже в концентрации 10 мкг/мл (Nolan-Stevaux et al., 2013). Есть данные о значимом уменьшении количества фосфорилированного сигнального интермедиата Smad1 в клетках HUVEC и HMEC-1 при внесении TRC105 в концентрации 0.2–2 мкг/мл (Kumar et al., 2013). Другие авторы, напротив, в экспериментах на клетках HUVEC использовали TRC105 в концентрации 100 мкг/мл, так как меньшие дозы препарата не вызывали значимых изменений функциональных свойств клеток (Liu et al., 2014).
В настоящей работе рабочая концентрация МКАТ составила 5 мкг/мл. Эта доза была выбрана на основании насыщения молекул эндоглина на цитоплазматической мембране клеток EA.hy926. Кроме того, она не вызывала значимых изменений в уровне экспрессии антигена. Мы считаем, что применение более высоких доз антител может оказывать токсичный эффект на клетки вне зависимости от функциональной значимости распознаваемых ими детерминант, что противоречит целям исследования.
Влияние МКАТ к эндоглину на скорость пролиферации клеток вызывает разногласия среди исследователей. Получены сведения о том, что МКАТ MAEND3 способны ингибировать рост экспрессирующих эндоглин опухолевых клеток in vitro (Postiglione et al., 2005). Первые испытания антител серии SN6 (SN6, SN6a, SN6h, SN6j) показали снижение скорости пролиферации клеток HUVEC (She et al., 2003). Авторы этого исследования отмечают также наличие синергичного подавления роста клеток при внесении в ростовую среду TGF-β1 (1–100 пкг/мл) и МКАТ к эндоглину (10–100 мкг/мл). Более поздние исследования химерного МКАТ SN6j (TRC105) не подтвердили его эффект в отношении пролиферации клеток эндотелия первичных и перевиваемых культур (Kumar et al., 2013; Nolan-Stevaux et al., 2013).
Полученные в настоящей работе данные и выбранная модель статистического анализа свидетельствуют о том, что лишь одно МКАТ (2C8) способно снижать скорость роста клеток EA.hy926 (рис. 4а). Внесение TGF-β1 (1 нг/мл) вызывало снижение скорости пролиферации клеток, однако синергичного эффекта при добавлении МКАТ не выявлено (рис. 4б). Эти результаты могут быть объяснены, с одной стороны, меньшей чувствительностью гибридомных клеток EA.hy926 к сигналам, тормозящим их деление, по сравнению с первичными культурами эндотелиальных клеток. С другой стороны, отсутствие влияния на пролиферацию клеток может быть связано с неизменным уровнем экспрессии эндоглина при культивировании в присутствии МКАТ, так как некоторые опубликованным данные свидетельствуют о наличии взаимосвязи между этими параметрами (Lebrin et al., 2004; Jerkic et al., 2006).
Исследование действия химерного МКАТ TRC105 на миграционную способность клеток эндотелия также не позволило исследователям прийти к единому мнению. Так, в системе “transwell” наблюдали увеличение скорости миграции клеток HUVEC и HMEC-1 в присутствии TRC105 (Kumar et al., 2013). Авторы объяснили этот эффект снижением способности клеток к формированию межклеточных контактов. Другие авторы, напротив, наблюдали снижение миграционной активности клеток H-UVEC в тесте заживления раны монослоя (Liu et al., 2014). В настоящей работе не выявлено непосредственного влияния МКАТ к эндоглину на способность клеток EA.hy926 к миграции (рис. 5а, 5б). Однако при внесении в ростовую среду TGF-β1 было отмечено замедление процесса закрытия раны в присутствии двух МКАТ (4Е4 и 5Н7). Интересно, что другими исследователями также показано снижение миграционной способности клеток эндотелия при ингибировании экспрессии эндоглина анти-смысловой РНК только в присутствии TGF-β1 (Li et al., 2000; Warrington et al., 2005). В настоящей работе показано, что добавление любых МКАТ к эндоглину снижало количество клеток, мигрировавших в рану. Этот результат может свидетельствовать об усилении межклеточных контактов в присутствии антител, вследствие чего клетки в области раны занимали большую площадь (рис. 5в, 5г).
Действие МКАТ к эндоглину на адгезионные свойства клеток описан в литературе в меньшей степени. Нами показано, что внесение в среду большинства исследуемых антител не оказывало влияния на процесс прикрепления эндотелиальных клеток к твердому субстрату, покрытому желатиной (рис. 6). Другие авторы продемонстрировали, что МКАТ к эндоглину RMAC8, 44G4, 8E11, HEC-19 и 1G2 способы усиливать адгезию моноцитоподобных клеток U937 к монослою HUVEC (Gougos et al., 1992). Нами также установлено, что полученные в лаборатории МКАТ к эндоглину способны увеличивать количество прикрепившихся к эндотелию клеток U937. Лишь одно антитело (2С8) не оказывало эффекта на данный процесс. Интересно, что те же самые МКАТ не влияли на прикрепление клеток THP-1 (рис. 7). Аналогичное по времени культивирование клеток эндотелия в присутствии МКАТ к эндоглину не вызывало изменений экспрессии основных адгезионных молекул клетками эндотелия (рис. 8). Эти результаты свидетельствует в пользу того, что наблюдаемые эффекты обусловлены адгезионными свойствами эндоглина. Ввиду того, что моноциты и дифференцирующиеся из них тканевые макрофаги вносят существенный вклад в процессы воспаления, ангио- и канцерогенеза (Kim, Bae, 2016), полученные результаты представляют научный интерес.
МКАТ к эндоглину могут влиять на интенсивность образования растворимой формы антигена клетками эндотелия. Показано, что добавление TRC105 к культурам клеток HUVEC и HMEC-1 приводило к увеличению количества sEng в среде за счет повышения вероятности взаимодействия антигена и MMP-14, обеспечивающей отщепление его экстраклеточного домена (Kumar et al., 2013). В настоящей работе впервые показано, что внесение МКАТ к эндоглину 2С8, 4Е4 или 5В6, напротив, снижало интенсивность образования растворимой формы антигена клетками эндотелия EA.hy926 (рис. 9а, 9в, 9г). Возможно, что антитела, направленные против других детерминант (рис. 10), препятствовали взаимодействию эндоглина и MMP-14.
Проделанная работа демонстрирует возможность изменения функциональных свойств клеток эндотелия посредством МКАТ к эндоглину, созданных в лаборатории. Также она показывает, что антитела, направленные к разным эпитопам эндоглина, обладают различными эффектами в отношении функциональных характеристик клеток эндотелия. Среди исследованных МКАТ особый интерес вызывают два антитела (2С8 и 4Е4), которые способны оказывать влияние на несколько функций эндотелия. Оба МКАТ вызывали торможение миграции клеток в присутствии TGF-β1 и снижали интенсивность накопления sEng в ростовой среде эндотелия. Антитело 2С8 замедляло скорость роста клеток EA.hy926, а 4Е4 усиливалo адгезию моноцитоподобных клеток U937 к монослою эндотелия.
Список литературы
Самойлович М.П., Пиневич А.А., Вартанян Н.Л., Смирнов И.В., Крутецкая И.Ю., Столбовая А.Ю., Шашкова О.А., Грязева И.В., Берлина М.А., Смирнова Т.Д., Климович В.Б. 2018. Экспрессия эндоглина культивируемыми нетрансформированными и опухолевыми клетками различного гистогенеза. Цитология. 60(6) : 430-439. (Samoilovich M.P., Pinevich A.A., Vartanyan N.L., Smir-nov I.V., Krutetskaya I.Yu., Stolbovaya A.Yu., Shashkova O.A., Gryazeva I.V., Berlina M.A., Smirnova T.D., Klimovich V.B. 2018. Endoglin expression in non-tumor and tumor cells of different origin. Cell Tis. Biol. (Tsitologiya). 12 : 437–447.)
Смирнов И.В., Грязева И.В., Самойлович М.П., Терехина Л.А., Пиневич А.А., Крылова А.А., Крутецкая И.Ю., Никольский Н.Н., Климович В.Б. 2015. Панель моноклональных антител против эндоглина человека: получение и характеристика. Цитология. 57(7) : 499–508. (Smirnov I.V., Griazeva I.V., Samoilovich M.P., Terekhin L.A., Pinevich A.A., Krylova A.A., Krutetskaia I.Iu., Nikolsky N.N., Klimovich V.B. 2015. Production and characterization of monoclonal antibodies against human endoglin. Cell Tiss. Biol. (Tsitologiya). 9 : 473–482.)
Ahn K., Pan S., Beningo K., Hupe D. 1995. A permanent human cell line (EA.hy926) preserves the characteristics of endothelin converting enzyme from primary human umbilical vein endothelial cells. Life Sci. 56 : 2331–2341.
Apolo A.B., Karzai F.H., Trepel J.B., Alarcon S., Lee S., Lee M.J., Tomita Y., Cao L., Yu Y., Merino M.J., Madan R.A., Parnes H.L., Steinberg S.M., Rodriguez B.W., Seon B.K., Gulley J.L., Arlen P.M., Dawson N.A., Figg W.D., Dahut W.L. 2016. A phase II clinical trial of TRC105 (Anti-Endoglin Antibody) in adults with advanced/metastatic urothelial carcinoma. Clin. Genitourin. Cancer. 15 : 77–85.
Barbara N.P., Wrana J.L., Letarte M. 1999. Endoglin is an accessory protein that interacts with the signaling receptor complex of multiple members of the transforming growth factor-β superfamily. J. Biol. Chem. 274 : 584–594.
Barry F.P., Boynton R.E., Haynesworth S., Murphy J.M., Zaia J. 1999. The monoclonal antibody SH-2, raised against human mesenchymal stem cells, recognizes an epitope on endoglin (CD105). Biochem. Biophys. Res. Commun. 265 : 134–139.
Bates D., Mächler M., Bolker B., Walker S. 2015. Fitting linear mixed-effects models using lme4. J. Stat. Soft. 67 : 1–48.
Bouis D., Hospers G.A., Meijer C., Molema G., Mulder N.H. 2002. Endothelium in vitro: A review of human vascular endothelial cell lines for blood vessel-related research. Angiogenesis. 4 : 91–102.
Carmeliet P., Jain R.K. 2011. Molecular mechanisms and clinical applications of angiogenesis. Nature. 473 : 298–307.
Conley B.A., Koleva R., Smith J.D., Kacer D., Zhang D., Ber-nabeu C., Vary C.P. 2004. Endoglin controls cell migration and composition of focal adhesions: Function of the cytosolic domain. J. Biol. Chem. 279 : 27440–27449.
Dolinsek T., Markelc B., Bosnjak M., Blagus T., Prosen L., Kranjc S., Stimac M., Lampreht U., Sersa G., Cemazar M. 2015. Endoglin silencing has significant antitumor effect on murine mammary adenocarcinoma mediated by vascular targeted effect. Curr. Gene. Ther. 15 : 228–244.
Duffy A.G., Ulahannan S.V., Cao L., Rahma O.E., Makarova-Rusher O.V., Kleiner D.E., Fioravanti S., Walker M., Carey S., Yu Y., Venkatesan A.M., Turkbey B., Choyke P., Trepel J., Bollen K.C., Steinberg S.M., Figg W.D., Greten T.F. 2015. A phase II study of TRC105 in patients with hepatocellular carcinoma who have progressed on sorafenib. United. Eur. Gastroenterol. J. 3 : 453–461.
Edgell C.J., McDonald C.C., Graham J.B. 1983. Permanent cell line expressing human factor VIII-related antigen established by hybridization. PNAS USA. 80 : 3734–3737.
Gougos A., Letarte M. 1990. Primary structure of endoglin, an RGD-containing glycoprotein of human endothelial cells. J. Biol. Chem. 265 : 8361–8364.
Gougos A., St. Jacques S., Greaves A., O’Connell P.J., d’Apice A.J., Buhring H.J., Bernabeu C., van Mourik J.A., Letarte M. 1992. Identification of distinct epitopes of endoglin, an RGD-containing glycoprotein of endothelial cells, leukemic cells, and syncytiotrophoblasts. Int. Immunol. 4 : 83–92.
Guerrero-Esteo M., Lastres P., Letamendia A., Perez-Alvarez M.J., Langa C., Lopez L.A., Fabra A., Garcia-Pardo A., Vera S., Letarte M., Bernabeu C. 1999. Endoglin overexpression modulates cellular morphology, migration, and adhesion of mouse fibroblasts. Eur. J. Cell Biol. 78 : 614–623.
Guerrero-Esteo M., Sanchez-Elsner T., Letamendia A., Bernabeu C. 2002. Extracellular and cytoplasmic domains of endoglin interact with the transforming growth factor-β receptors I and II. J. Biol. Chem. 277 : 29197–29209.
Hawinkels L.J., Kuiper P., Wiercinska E., Verspaget H.W., Liu Z., Pardali E., Sier C.F., ten Dijke P. 2010. Matrix metalloproteinase-14 (MT1-MMP)-mediated endoglin shedding inhibits tumor angiogenesis. Cancer Res. 70 : 4141–4150.
Henry L.A., Johnson D.A., Sarrio D., Lee S., Quinlan P.R., Crook T., Thompson A.M., Reis-Filho J.S., Isacke C.M. 2010. Endoglin expression in breast tumor cells suppresses invasion and metastasis and correlates with improved cli-nical outcome. Oncogene. 30 : 1046–1058.
Jerkic M., Rodriguez-Barbero A., Prieto M., Toporsian M., Pericacho M., Rivas-Elena J.V., Obreo J., Wang A., Perez-Barriocanal F., Arevalo M., Bernabeu C., Letarte M., Lopez-Novoa J.M. 2006. Reduced angiogenic responses in adult Endoglin heterozygous mice. Cardiovasc. Res. 69 : 845–854.
Jordan M., Schallhorn A., Wurm F.M. 1996. Transfecting mammalian cells: optimization of critical parameters affecting calcium-phosphate precipitate formation. Nucleic Acids Res. 24 : 596–601.
Karzai F.H., Apolo A.B., Cao L., Madan R.A., Adelberg D.E., Parnes H., McLeod D.G., Harold N., Peer C., Yu Y., Tomita Y., Lee M.J., Lee S., Trepel J.B., Gulley J.L., Figg W.D., Dahut W.L. 2014. A phase I study of TRC105 anti-endoglin (CD105) antibody in metastatic castration-resistant prostate cancer. BJU Int. 116 : 546–555.
Kim J., Bae J.S. 2016. Tumor-associated macrophages and neutrophils in tumor microenvironment. Mediators Inflamm. 2016 : 6058147. https://doi.org/10.1155/2016/6058147
Klimovich A.V., Samoylovich M.P., Gryazeva I.V., Terekhina L.A., Suvorov A.N., Klimovich VB. 2010. Development of immunoreagents for diagnostics of CagA-positive Helicobacter pylori infections. Helicobacter. 15 : 193–200.
Kumar S., Pan C.C., Bloodworth J.C., Nixon A.B., Theuer C., Hoyt D.G., Lee N.Y. 2013. Antibody-directed coupling of endoglin and MMP-14 is a key mechanism for endoglin shedding and deregulation of TGF-β signaling. Oncogene. 33 : 3970–3979.
Kuznetsova A., Brockhoff P.B., Christensen R.H.B. 2017. lmer-Test Package: Tests in linear mixed effects models. J. Stat. Soft. 82 : 1–26.
Laemmli U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 : 680–685.
Lakshman M., Huang X., Ananthanarayanan V., Jovanovic B., Liu Y., Craft C.S., Romero D., Vary C.P., Bergan R.C. 2010. Endoglin suppresses human prostate cancer metastasis. Clin. Exp. Metastasis. 28 : 39–53.
Lebrin F., Goumans M.J., Jonker L., Carvalho R.L., Valdimarsdottir G., Thorikay M., Mummery C., Arthur H.M., ten Dijke P. 2004. Endoglin promotes endothelial cell proliferation and TGF-β/ALK1 signal transduction. EMBO J. 23 : 4018–4028.
Li C., Hampson I.N., Hampson L., Kumar P., Bernabeu C., Kumar S. 2000. CD105 antagonizes the inhibitory signaling of transforming growth factor β1 on human vascular endothelial cells. FASEB J. 14 : 55–64.
Liu Y., Tian H., Blobe G.C., Theuer C.P., Hurwitz H.I., Nixon A.B. 2014. Effects of the combination of TRC105 and bevacizumab on endothelial cell biology. Invest. New Drugs. 32 : 851–859.
Nolan-Stevaux O., Zhong W., Culp S., Shaffer K., Hoover J., Wickramasinghe D., Ruefli-Brasse A. 2013. Endoglin requirement for BMP9 signaling in endothelial cells reveals new mechanism of action for selective anti-endoglin antibodies. PLoS One. 7 : e50920. https://doi.org/10.1371/journal.pone.0050920
Pal K., Pletnev A.A., Dutta S.K., Wang E., Zhao R., Baral A., Yadav V.K., Aggarwal S., Krishnaswamy S., Alkharfy K.M., Chowdhury S., Spaller M.R., Mukhopadhyay D. 2014. Inhibition of endoglin-GIPC interaction inhibits pancreatic cancer cell growth. Mol. Cancer Ther. 13 : 2264–2275.
Pau G., Fuchs F., Sklyar O., Boutros M., Huber W. 2010. EBI-mage – an R package for image processing with applications to cellular phenotypes. Bioinformatics. 26 : 979–981.
Pichuantes S., Vera S., Bourdeau A., Pece N., Kumar S., Wayner E.A., Letarte M. 1997. Mapping epitopes to distinct regions of the extracellular domain of endoglin using bacterially expressed recombinant fragments. Tiss. Antigens. 50 : 265–276.
Postiglione L., Di Domenico G., Caraglia M., Marra M., Giuberti G., Del Vecchio L., Montagnani S., Macri M., Bruno E.M., Abbruzzese A., Rossi G. 2005. Differential expression and cytoplasm/membrane distribution of endoglin (CD105) in human tumour cell lines: Implications in the modulation of cell proliferation. Int. J. Oncol. 26 : 1193–1201.
Rosen L.S., Hurwitz H.I., Wong M.K., Goldman J., Mendelson D.S., Figg W.D., Spencer S., Adams B.J., Alvarez D., Seon B.K., Theuer C.P., Leigh B.R., Gordon M.S. 2012. A phase I first-in-human study of TRC105 (anti-endoglin antibody) in patients with advanced cancer. Clin. Cancer. Res. 18 : 4820–4829.
Rossi E., Sanz-Rodriguez F., Eleno N., Duwell A., Blanco F.J., Langa C., Botella L.M., Cabanas C., Lopez-Novoa J.M., Bernabeu C. 2012. Endothelial endoglin is involved in inflammation: Role in leukocyte adhesion and transmigration. Blood. 121 : 403–415.
Rossi E., Smadja D.M., Boscolo E., Langa C., Arevalo M.A., Pericacho M., Gamella-Pozuelo L., Kauskot A., Botella L.M., Gaussem P., Bischoff J., Lopez-Novoa J.M., Bernabeu C. 2015. Endoglin regulates mural cell adhesion in the circulatory system. Cell Mol. Life Sci. 73 : 1715–1739.
Saito T., Bokhove M., Croci R., Zamora-Caballero S., Han L., Letarte M., de Sanctis D., Jovine L. 2017. Structural basis of the human endoglin-BMP9 interaction: Insights into BMP signaling and HHT1. Cell Rep. 19 : 1917–1928.
Sanz-Rodriguez F., Guerrero-Esteo M., Botella L.M., Banville D., Vary C.P., Bernabeu C. 2004. Endoglin regulates cytoskeletal organization through binding to ZRP-1, a member of the Lim family of proteins. J. Biol. Chem. 279 : 32 858–32 868.
She X., Matsuno F., Harada N., Tsai H., Seon B.K. 2003. Synergy between anti-endoglin (CD105) monoclonal antibodies and TGF-β in suppression of growth of human endothelial cells. Int. J. Cancer. 108 : 251–257.
Shiozaki K., Harada N., Greco W.R., Haba A., Uneda S., Tsai H., Seon B.K. 2005. Antiangiogenic chimeric anti-endoglin (CD105) antibody: Pharmacokinetics and immunogenicity in nonhuman primates and effects of doxorubicin. Cancer Immunol. Immunother. 55 : 140–150.
Smirnov I.V., Gryazeva I.V., Samoylovich M.P. Terekhina L.A., Pinevich A.A., Shashkova O.A., Krutetskaya I.Yu., Sokolov D.I., Selkov S.A., Nikoloskiy N.N., Klimovich V.B. 2016. Diffe-rent pairs of monoclonal antibodies detect variable amounts of soluble endoglin in human blood plasma. Immunochem. Immunopathol. 2 : 1–5.
Smirnov I.V., Gryazeva I.V., Vasileva M.Y., Krutetskaia I.Y., Shashkova O.A., Samoylovich M.P., Stolbovaya A.Y., Solodovnikova N.G., Zazerskaya I.E., Sokolov D.I., Selkov S.A., Klimovich V.B. 2018. New highly sensitive sandwich ELISA system for soluble endoglin quantification in different biological fluids. Scand. J. Clin. Lab. Invest. 78 : 515–523.
St-Jacques S., Forte M., Lye S.J., Letarte M. 1994. Localization of endoglin, a transforming growth factor-β binding protein, and of CD44 and integrins in placenta during the first trimester of pregnancy. Biol. Reprod. 51 : 405–413.
Takahashi N., Haba A., Matsuno F., Seon B.K. 2001. Antiangiogenic therapy of established tumors in human skin/severe combined immunodeficiency mouse chimeras by anti-endoglin (CD105) monoclonal antibodies, and synergy between anti-endoglin antibody and cyclophosphamide. Cancer. Res. 61 : 7846–7854.
Thornhill M.H., Li J., Haskard D.O. 1993. Leucocyte endothelial cell adhesion: a study comparing human umbilical vein endothelial cells and the endothelial cell line EA-hy-926. Scand. J. Immunol. 38 : 279–286.
Usui Y., Westenskow P.D., Murinello S., Dorrell M.I., Scheppke L., Bucher F., Sakimoto S., Paris L.P., Aguilar E., Friedlander M. 2015. Angiogenesis and eye disease. Ann. Rev. Vis. Sci. 1 : 155–184.
Warrington K., Hillarby M.C., Li C., Letarte M., Kumar S. 2005. Functional role of CD105 in TGF-β1 signalling in murine and human endothelial cells. Anticancer. Res. 25 : 1851–1864.
Дополнительные материалы отсутствуют.


