Цитология, 2019, T. 61, № 7, стр. 571-579
Гистологический анализ каллусной культуры белены египетской (Hyoscyamus muticus L.)
В. М. А. Абделазиз 1, Ю. А. Костюкова 2, *, Л. З. Хуснетдинова 1, О. А. Тимофеева 1
1 Кафедра ботаники и физиологии растений института фундаментальной медицины и биологии
Казанского федерального университета
420008 Казань, Россия
2 Казанский институт биохимии – обособленное структурное подразделение Федерального исследовательского центра “Казанский научный центр РАН”
420111 Казань, Россия
* E-mail: j.kostyukova@mail.ru
Поступила в редакцию 21.01.2019
После доработки 17.04.2019
Принята к публикации 23.04.2019
Аннотация
Проведенные гистологические исследования каллусной культуры Hyoscyamus muticus L. показали, что каллусы обладают признаками, характерными для органогенных нодулярных клеточных культур. Нодулы представляют собой сферические структуры, в центре которых выделяется центр васкуляризации, окруженный удлиненными паренхимными клетками и элементами флоэмы. Нарастание биомассы каллуса происходит в результате дифференцировки нодул из прокамбиальных клеток. Накопление алкалоидов обнаружено в вакуолях поверхностных паренхимных клеток. Наличие аккумулирующих алкалоиды клеток в каллусах Hyoscyamus muticus L. открывает возможности для получения тропановых алкалоидов в культуре клеток.
Культура клеток и тканей растений является эффективной технологией получения различных вторичных метаболитов для фармацевтической, косметической, пищевой промышленностей, а также сельского хозяйства. Соединения, синтезированные в каллусных и суспензионных культурах, могут быть идентичны растительным, а выход вторичных метаболитов, в некоторых случаях, превосходит растительные источники.
Культуры каллусных клеток способны синтезировать и накапливать различные биологически активные соединения: фенольные соединения, алкалоиды, стеролы и др. (Loredo-Carrillo et al., 2013; Ochoa-Villarreal et al., 2016).
Каллусные культуры, применяющиеся для биотехнологической наработки вторичных соединений, должны обладать быстрым ростом и синтезировать достаточное количество целевого продукта. Как правило, быстрым ростом обладают каллусные культуры, образованные паренхимными клетками и не имеющие какой-либо дифференцировки. Каллусные культуры, состоящие из паренхимных клеток и продуцирующие вторичные метаболиты, описаны для Catharantus roseus (Biesbaer, 1983), Theobroma cacao (Eibl et al., 2018) и других растений. Тем не менее, известно, что клетки неморфогенных каллусов характеризуются генетической нестабильностью, которая становится причиной снижения продуктивности клеточных культур (Dubey et al., 2016; Karaboyaci, Kılıç, 2018).
Для многих клеточных культур обнаружена корреляция между способностью каллусов к синтезу вторичных метаболитов и дифференцировке с формированием определенных клеточных структур. Например, для гречихи татарской показано, что эмбриогенные каллусы, состоящие из проэмбриональных клеточных комплексов (ПЭКК) и мягкого каллуса, накапливают больше рутина, по сравнению с неморфогенными каллусами, состоящими из недефференциированных паренхимных клеток. По мнению исследователей, способность к синтезу фенольных соединений эмбриогенными каллусными культурами определяется дифференцировкой эмбриональных тканей, аналогичных зиготическим зародышам, в тканях которых происходит синтез и накопление рутина (Akulov et al., 2018).
Исследования каллусных культур зверобоя продырявленного (Hypericum perforatum L.) показали, что гиперецин и псевдогиперецин синтезируются только в каллусных культурах, образующих агрегаты клеток (Murthy et al., 2014). В эмбриогенных каллусах мака снотворного (Papaver somniferum L.) синтез тебаина возрастает с количеством эмбриодов в культивируемых тканях (Кунах, 2004), в которых, в отличие от зиготических зародышей, происходит дифференцировка специализированных клеток проводящих систем и млечников.
Потеря способности к дифференцировке или изменение уровня дифференцированности каллусных культур могут приводить к снижению синтеза вторичных метаболитов. На каллусной культуре Taxus было обнаружено, что разрыхление нодул в каллусной культуре, возникающее при уменьшении концентрации сахарозы в среде культивирования, сопровождалось снижением синтеза таксола (Ellis et al., 1996).
Представители рода белена Hyoscyamus – ценные лекарственные растения. Алкалоиды скополамин, гиосциамин и атропин, синтезирующиеся в этих растениях, обладают широким спектром фармакологического действия (Tytgat, Guido, 2007; Abdel-Motaal et al., 2009). Известны спазмолитические, противоастматические, антиастматические, антихолинергические, наркотические и анестезирующие свойства этих соединений (Tytgat, Guido, 2007; Ibrahim et al., 2009; Elmaksood et al., 2016).
Среди представителей рода Hyoscyamus Белена египетская (Hyoscyamus muticus L.) содержит наибольшее количество тропановых алкалоидов (Калинин и др., 1980). Известно, что трава белены египетской содержит 0.5–1.4% алкалоидов (Светличная, Толок, 2003), тогда как в траве белены черной содержание алкалоидов тропанового ряда составляет всего 0.04–0.16% (Самылина, Яковлев, 2014). Однако получение достаточного количества растительного сырья для выделения ценных алкалоидов из данного растения в природных условиях затруднительно, так как оно относится к редким эндемичным видам, запрещенным к сбору.
Исследования по индукции клеточных культур из растений рода Hyoscyamus были предприняты в 60-е годы прошлого века (Калинин и др., 1980). Инициированы каллусные культуры из стеблей (Lindsey, Yeoman, 1983), из корней, лепестков и листьев 4-х недельных проростков Hyoscyamus niger L. (Keng et al., 2009), из семядольных листьев H. muticus L. (Basu, Chand,1996). Нами впервые были получены каллусные культуры из корней белены египетской (Abdelazeez et al., 2017; Абделазиз и др., 2018). Каллусные культуры H. muticus L. имеют рыхлую структуру и состоят из паренхимных клеток, в которых визуализируются зеленые уплотнения.
В настоящей работе с целью изучения способности каллусных культур белены к синтезу тропановых алкалоидов, а также выяснения структурных особенностей каллусов были проведены биохимические и гистологические исследования каллусной культуры H. muticus.
МАТЕРИАЛ И МЕТОДИКА
Получение каллуса. Использовали экспланты корней 3-месячных проростков H. muticus L. Каллусные культуры поддерживали на среде Мурасиге и Скуга, дополненной бензиламинопурином (0.5 мг/л) и нафтилуксусной кислотой (1 мг/л) (Abdelazeez et al., 2017; Абделазиз и др., 2018).
Гистологические препараты. Материал фиксировали в 2.5%-ном глутаровом альдегиде (Fluca, Швейцария), приготовленном на 0.1 М фосфатном буфере (рН 7.3). Образцы промывали 0.1 М фосфатным буфером в течение 1 ч. Постфиксацию образцов осуществляли в течение 3 ч в 1%-ном растворе OsO4 (Alfa Aesar, США), приготовленном на 0.1 М фосфатном буфере (рН 7.3), содержащем сахарозу (25 мг/мл). Объекты обезвоживали в спиртах с постепенным возрастанием их концентрации, ацетоне и пропилене (Acros, США). Далее объекты заключали в эпоксидную смолу. Полутонкие срезы толщиной 3 мкм изготавливали на ультрамикротоме UltraсutE (Reichert-Jung, Австрия) и окрашивали 0.05%-ным толуидиновым синим (Serva, Германия) (Trump et al., 1961). Срезы изучали с помощью микроскопа Jenamed (Carl Zeiss, Германия), фотографировали цифровой камерой AxioCam MRc5 (Carl Zeiss, Германия).
Определение каллозы. Использовали специфический краситель анилиновый голубой (Serva, Германия) (Herburger, Holzinger, 2016). Свежеприготовленные препараты каллусной ткани белены помещали на 5 мин в 0.5%-ный раствор анилинового голубого, приготовленного на 0.1 М фосфатном буфере рН 8.2. Далее препараты промывали тем же буферным раствором. Для контрастирования клеточных стенок препараты, окрашенные анилиновым синим, дополнительно окрашивали 0.05%-ным калькофлюором (Sigma, США) (Herburger, Holzinger 2016), приготовленным на фосфатном буфере рН 7.2. Препараты просматривали на микроскопе LSM-510 Meta (Carl Zeiss, Германия) с использованием ртутной лампы НВО100 (Carl Zeiss, Германия). Фотографии сделаны камерой AxioCamHRc (Carl Zeiss, Германия) и проанализированы с помощью программы AxioVision 4.8 (Carl Zeiss, Германия).
Анализ содержания скополамина и атропина в полученных образцах проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) (Hosseini, 2011) на хроматографе Infinity 1220 (Agilent, Германия), снабженном колонкой Zorbax SB-C18 (4.6 × 150 мм, 5 мкм) и предколонкой С-8. В качестве элюента использовали смесь буферного раствора (рН 3), содержащего 50 мМ дигидрофосфата калия и ацетонитрила (с объемным соотношением 80 : 20). Элюент пропускали со скоростью 1.4 мл/мин, вещества определяли с помощью УФ-датчика при длине волны 215 нм. Содержание атропина и скополамина рассчитывали по калибровочному графику.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
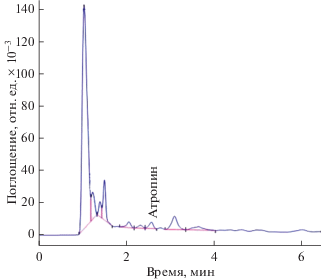
Анализ количественного содержания идентифицированных алкалоидов методом ВЭЖХ показал, что доминирующим алкалоидом в каллусах белены египетской является атропин (20 мкг на 1 г сухого веса), скополамин был обнаружен в следовых количествах (рис. 1).
Рис. 1.
Хроматограмма экстракта белены египетской Hy-oscyamus muticus L. Доминирующим алкалоидом в каллусах белены египетской является атропин (20 мкг на 1 г сухого веса). Высокоэффективная жидкостная хроматография.
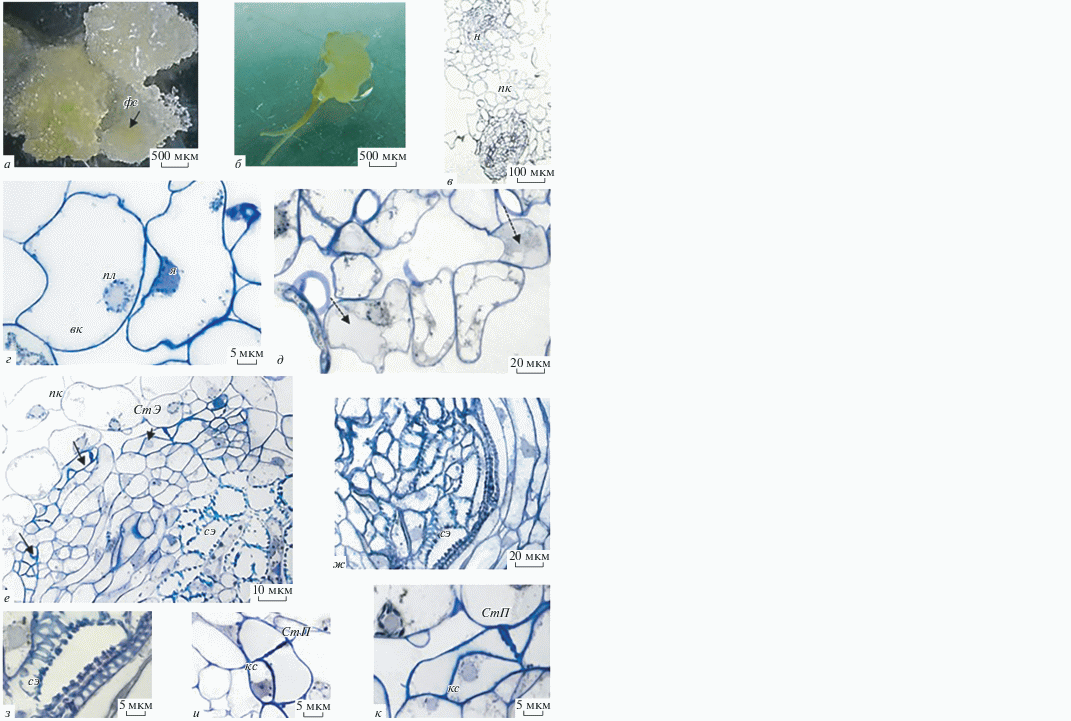
Каллусная ткань, полученная из корневых эксплантов, имела рыхлую структуру от светло-бежевого до светло-зеленого цвета с зеленоватыми нодулярными уплотнениями (рис. 2а). В редких случаях в каллусе наблюдали формирование единичных корней (рис. 2б), что может свидетельствовать о ризогенном потенциале каллусной культуры.
Рис. 2.
Морфо-гистологическая характеристика каллусной культуры H. muticus L. а – Сферические фотосинтезирующие уплотнения (фс) в массе паренхимных клеток; б – ризогенез в каллусной культуре; в – паренхимные клетки (пк) окружают нодулы (н); г – поверхность нодулы окружена округлыми вакуолизированными клетками паренхимного типа с округлыми ядрами (я) с большой центральной вакуолью (вк), около ядра обнаружены многочисленные пластиды (пл); д – фиксация каллусной культуры OsO4 показала, что в некоторых паренхимных клетках вакуоли (вк) окрасились (показаны стрелками); е, ж – центр нодулы образован сосудистыми элементами (сэ), окруженными удлиненными клетками паренхимного типа, в верхних слоях нодул обнаруживаются ситовидные элементы (СтЭ) с клетками-спутниками (показаны стрелками); ж, з – сосудистые элементы со спиральным утолщением оболочек; и, к – ситовидные элементы флоэмы с клетками-спутниками (кс), ситовидные элементы котнактируют ситовидными пластинками (СтП). Гистологические срезы окрашены 0.05%-ным толуидиновым синим.
Проведенные гистологические исследования каллусной культуры H. muticus показали, что каллусы обладают признаками, характерными для нодулярных клеточных культур. К нодулярным клеточным культурам относят каллусы, состоящие из отдельных единиц (узелков, уплотнений, нодул), отличающихся внутренней клеточной (тканевой) дифференциацией (Fortes et al., 2010). Термин “нодула” применяется для описания эмбриогенных и неэмбриогенных нодулярных культур. В отличие от эмбриогенных культур, в которых нодулы представлены сложно-организованными проэмбриональными клеточными комплексами (Betekhtin et al., 2017), нодулы большинства не эмбриогенных культур характеризуются васкуляризацией. Нодулярные каллусные культуры с васкуляризованным центром описаны для представителей рода Populus (McCown et al., 1988), Chicorium intybus (Pieron et al., 1993), Humulus lupulus (Batista et al., 2000), Vriesea reitzii (Alves et al., 2006).
Нодула каллуса белены египетской состоит из клеток разных типов (рис. 2). Поверхность нодулы окружена округлыми вакуолизированными клетками паренхимного типа (рис. 2в, 2д) с округлыми ядрами, с большой центральной вакуолью. Около ядра обнаружены многочисленные пластиды (рис. 2г). Центр нодулы васкуляризован (рис. 2е, 2ж). На срезах визуализируются сосудистые элементы со спиральным утолщением оболочек (рис. 2е). В центре сосудистые элементы расположены хаотично (рис. 2г), тогда как кнаружи сосудистые элементы удлинены, плотно прилегают друг к другу (рис. 2ж). Сосудистые элементы окружены удлиненными вакуолизированными клетками, которые расположены слоями (рис. 2е, 2ж). В верхних слоях удлиненных клеток визуализируются ситовидные элементы флоэмы (рис. 2е). Ситовидные элементы флоэмы контактируют ситовидными пластинками (рис. 2и, 2к). На ситовидных пластинках и на стенках ситовидных элементов откладывается каллоза (рис. 3). На рис. 3б, 3в показано свечение каллозы в ультрафиолетовом свете – характерный признак для полисахарида, откладывающегося на ситовидных пластинках. Каллоза откладывается в виде колец в местах соединения ситовидных элементов (рис. 3в) и, точечно, на стенках элементов (рис. 3б).
Рис. 3.
Препараты каллусной ткани белены H. muticus L., окрашенные анилиновым голубым. Флуоресцентное свечение в местах локализации каллозы. а – Свежеприготовленный препарат каллусной ткани белены без окрашивания анилиновым голубым; б – автофлуоресценция лигнифицированных сосудистых элементов (сэ) и флуоресценция каллозы (к) ситовидных полей СтЭ; в – флуоресценция каллозы в области ситовидной пластинки.

На гиcтологических срезах нодулы каллуса H. muticus клетки-спутники обнаруживали лишь около ситовидных элементов, расположенных поверхностно. Клетки спутники обладали округлыми ядрами (рис. 2и, 2к).
Образование ксилемы и флоэмы в растении происходит из прокамбия – васкулярной меристемы (Лотова, 2001; Schuetz et al., 2013). Прокамбиальные клетки плюрипотентны (Wang et al., 2011). В искусственных условиях культивирования прокамбиальные клетки инициируют сосудистые элементы ксилемы, ситовидные элементы флоэмы, паренхимные клетки, формирующие каллусные культуры (Kwaaitaal et al., 2007; Wang et al., 2011). Необходимо отметить, что остается пул прокамбиальных клеток, сохраняющих свое недифференцированное состояние (Kwaaitaal, Vries, 2007; Wang et al., 2011).
На гистологических срезах каллусной культуры белены прокамбиальные клетки были обнаружены в виде небольших групп в крупных нодулах и в виде рядов прокамбиальных клеток, окружающих сосудистые элементы в мелких уплотнениях (рис. 4а). Можно предположить, что формирование нодул происходит из пула прокамбиальных клеток, которые не дифференциируются в проводящие элементы, а делятся и в дальнейшем становятся инициалями новых уплотнений.
Рис. 4.
Формирование нодул каллуса H. muticus L. а – Формирование новых нодул происходит в результате деления прокамбиальных клеток (ПрК); б – комплексы клеток, в которых единичные сосудистые элементы (сэ) окружены удлиненными паренхимными клетками (выделены рамкой); в – нодула с несколькими центрами васкуляризации (центры васкуляризации показаны стрелками); пк – паренхимные клетки.
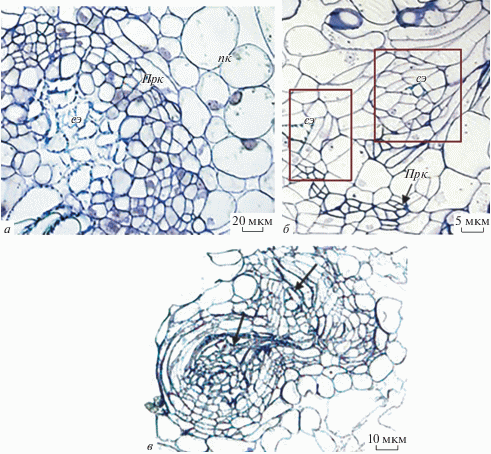
Начальные этапы формирования нодулы показаны на рис. 4б. На срезе визуализируются делящиеся прокамбиальные клетки, а также комплексы клеток, в которых единичные сосудистые элементы окружены удлиненными паренхимными клетками. Похожая схема разрастание нодул описана в каллусной культуре Humulus lupulus (Batista et al., 2000). Исследователи наблюдали формирование прокамбиоподобных клеток, которые в дальнейшем дифференциировались в центры васкуляризации.
Изменение количества васкуляризованных центров рассматривается исследователями в качестве этапов в развитии нодулы. Например, в нодулах каллуса Populus (McCown et al., 1988) исследователи выделяют три этапа в развитии нодулы: на первом этапе появляются инициальные меристематические клетки, на втором образуется уницентрическая нодула с одним центром васкуляризации, на третьем этапе формируются полицентрические нодулы с многочисленными центрами васкуляризации.
Нами показано, что дифференциация элементов ксилемы и флоэмы происходит в течение всего периода культивирования каллуса H. muticus. Благодаря одновременной дифференцировке прокамбиальных клеток в нескольких областях нодулы формируются структуры с двумя и более васкуляризованными центрами (рис. 4в). Формирование нодул с несколькими центрами васкуляризации описано для агрегатов суспензионной культуры H. niger L. (Dhoot, Henshaw, 1977), нодулярных каллусов Humulus lupulus L. (Batista et al., 2000).
Строение каллуса H. muticus более сложное по сравнению с агрегатами суспензии H. niger L. (Dhoot, Henshaw, 1977). В агрегатах суспензионной культуры H. niger авторы выделяли центральную корковую область из клеток сосудов, кнаружи от которых обнаруживали прокамбиальные клетки. Комплексы из сосудистых и прокамбиальных клеток были окружены паренхимными клетками. Так же, как и в каллусной культуре белены египетской, агрегаты суспензионной культуры H. niger имели несколько центров дифференциации сосудистых элементов. Однако в отличие от H. niger каллусы белены египетской обладают элементами флоэмы.
Клеточная организация нодулы каллусной культуры H. muticus наиболее близка к нодулам каллуса Taxus cuspidata, синтезирующим и накапливающим таксол. Нодулы каллуса T. cuspidata представляют сферические агрегаты, состоящие из центрально расположенных элементов ксилемы, окруженных камбием. В верхних слоях так же, как и в каллусах H. muticus, дифференциируются элементы флоэмы (Ellis et al., 1996).
Растения белены египетской представляют собой ценность для медицины благодаря тому, что они синтезируют и накапливают тропановые алкалоиды. Настоящая работа по гистологическому исследованию каллусной культуры белены не выявила специализированных клеток, аккумулирующих вторичные метаболиты. Однако на гистологических срезах нодул каллуса белены египетской были обнаружены клетки паренхимного типа с окрашенными вакуолями (рис. 2д). Изменение цвета в вакуолях клеток каллуса H. muticus может быть обусловлено образованием комплекса алкалоида с OsO4 (Wright et al., 1981). Для подтверждения этого предположения нами были проведены исследования каллусов в ультрафиолетовом свете. Автофлуоресценция тропановых алкалоидов была описана для различных представителей рода Solynaceae: Solanum aviculare, S. tuberosum, Hyoscyamus niger, Datura innoxia (Hashimoto et al., 1990).
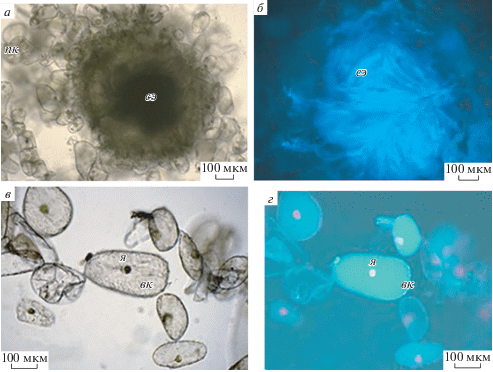
Изучение каллусной культуры белены египетской в ультрафиолетовом свете показало, что так же как и в растении, алкалоиды накапливаютcя в вакуолях округлых паренхимных клеток (De Luca, St Pierre, 2000). На свежеприготовленных препаратах при освещении ультрафиолетовым светом в вакуолях клеток наблюдали зеленоватое и голубое свечение (рис. 5г).
Рис. 5.
Локализация тропановых алкалоидов в клетках каллуса H. muticus L. а, в – Клетки каллуса белены в проходящем свете; б, г – каллусные культуры в ультрафиолетовом свете: сосудистые элементы (сэ) обладают автофлуоресценцией (б), в вакуолях (вк) отдельных паренхимных клеток наблюдали зеленоватое свечение и голубое свечение (г); я – ядро; пк – паренхимные клетки.
Наличие организованных структур в каллусной ткани, по-видимому, необходимо для синтеза вторичных метаболитов. Чем ближе по уровню организации каллусные культуры к целому растению или определенному органу, тем более вероятно, что в них будут реализовываться метаболические пути, характерные для интактного растения. Биосинтез алкалоидов представляет сложный процесс, требующий определенной клеточной компартментализации и специфических условий (De Luca, St Pierre, 2000; Pasquali et al., 2006). Ферменты биосинтетического пути алкалоидов могут быть локализованы в различных органах растений, в определенных тканях и клетках в пределах одного органа. Так, ферменты биосинтеза алкалоида виндолина в растении С. roseus имеют различную внутриклеточную (в хлоропластах, цитоплазме, эндоплазматическом ретикулуме, вакуоли) и тканевую (в клетках эпидермиса листа, млечниках и в клетках коры корней) локализацию (Pasquali et al., 2006). В корнях Hyoscyamus niger первый и конечный ферменты биосинтеза алкалиода гиосциамина путресцин N-метилтраснсфераза и гиосциамин-6β-гидролаза локализуются в перицикле, а промежуточные ферменты биосинтеза обнаружены в эндодермисе и клетках коры корней (De Luca, St Pierre, 2000). По мнению Де Лука с соавт. (De Luca, St. Pierre, 2000), клетки перицикла являются основной фабрикой по “производству” тропановых алкалоидов.
Таким образом, проведенные исследования продемонстрировали, что ризогенные каллусные культуры H. muticus имеют сложное строение и характеризуются наличием нодулярных структур, которые, по-видимому, необходимы для синтеза и накопления тропановых алкалоидов.
БЛАГОДАРНОСТИ
Авторы благодарны Н.И. Румянцевой (Казанский институт биохимии и биофизики ФИЦ “Казанский научный центр РАН”) за плодотворное обсуждение работы и полезные замечания, а также М.В. Агеевой (Казанский институт биохимии и биофизики ФИЦ “Казанский научный центр РАН”) за предоставленную возможность проведения флуоресцентного анализа каллусов.
ФИНАНСИРОВАНИЕ
Работа выполнена в рамках программы повышения конкурентоспособности Казанского (Приволжского) федерального университета среди ведущих мировых научно-образовательных центров. Работа по гистологическому исследованию локализации вторичных соединений в культивируемых клетках растений была выполнена в рамках госзадания Казанского института биохимии и биофизики ФИЦ “Казанский научный центр РАН”.
Список литературы
Абделазиз В.М.А., Хуснетдинова Л.З., Тимофеева О.А. 2018. Перспективность использования регуляторов роста растений на индукцию каллусогенеза различных типов эксплантов Hyoscyamus muticus L. in vitro. Самарский научный вестник. 7 (3) 24 : 10–13. (Abdelazeez W.M.A., Khusnetdinova L.Z., Timofeeva O.A. 2018. Future outlook of plant growth regulators application influencing callus induction from different type explant Hyoscyamus muticus L. in vitro. Samara Sci. Herald. 7 (3) 24 : 10–13.)
Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. 1980. Методы культуры тканей в физиологии растений. Киев: Наукова Думка. 488 с. (Kalinin F.L., Sarnatskaya V.V., Polishchuk V.E. 1980. Methods of tissue culture in plant physiology. Kiev: Naukova Dumka. 488 P.)
Кунах В.А., Кацан В.А. 2004. Биосинтез изохинолиновых алкалоидов мака в природе и культуре in vitro 2. Мак прицветниковый (Papaver bracteatum Lundl.). Укр.bioxim. ж. 76 (5) : 29–44. (Kunakh A.A., Katsan V.A. 2004. Biosynthesis of poppy isoquinoline alkaloids in nature and in vitro culture 2. Papaver bract (Papaver bracteatum Lundl.). Ukr. Bioxim. J. 75 (5) : 29–44.)
Лотова Л.И. 2001. Морфология и анатомия высших растений. М.: Эдиториал УРСС. 528 с. (Lotova L.I. 2001. Morphology and anatomy of higher plants. Moscow: Editorial URSS. 528 p.)
Самылина И.А., Яковлев Г.П. 2014. Фармакогнозия. М.: ГЭОТАР-Медиа. 976 с. (Samylina I.A., Yakovlev G.P. 2014. Pharmacognosy. M.: GEOTAR-Media. 976 p.)
Светличная Е.И., Толок И.А. 2003. Этимологический словарь латинских ботанических названий лекарственных растений. Харьков: НФаУ: Золотые страницы. 288 с. (Svetlichnaya E.I., Tolok I.A. 2003. Etymological dictionary of Latin botanical names of medicinal plants. Kharkiv: Publishing House of the NUPh: Golden Pages. 288 P.).
Abdelazeez W.M.A., Khusnetdinova L.Z., Timofeeva O. A. 2017. Effect of different plant growth regulators on the in vitro induction and maintenance of callus from different explants of Hyoscyamus muticus L. J. Appl. Environ. Biol. Sci. 7 : 27–35.
Abdel-Motaal F.F., El-Sayed M.A., El-Zayat S.A., Nassar M.S., Ito S. 2009. Leaf spot disease of Hyoscyamus muticus (Egyptian henbane) caused by Cladosporium herbarum. J. Gen. Plant Pathol. 75 : 437–439.
Alves G.M., Vesco L.L., Guerra M.P. 2006. Micropropagation of the Brazilian endemic bromeliad Vriesea reitzii trough nodule clusters culture. Sci. Horticulturae. 110 : 204–207.
Akulov A.N., Gumerova E.A., Rumyantseva N.I. 2018. Cell cultures of Fagopyrum tataricum as a source of biologically active phenolic compounds. In: Buckwheat Germplasms in the World. 25 : 259–270.
Basu P., Chand S. 1996. Anthocyanin accumulation in Hyoscyamus muticus L. tissue cultures. J. Biotechnol. 52 : 151–159.
Batista D., Ascensa˜o L., Joa˜o Sousa M., Salome´ Pais M. 2000. Adventitious shoot mass production of hop (Humulus lupulus L.) var. Eroica in liquid medium from organogenic nodule cultures. Plant Sci. 15 : 47–57.
Betekhtin A., Rojek M., Jaskowiak J., Milewska-Hendel A., Kwasniewska J., Kostyukova Y., Kurczynska E., Rumyantseva N., Hasterok R. 2017. Nuclear genome stability in long-term cultivated callus lines of Fagopyrum tataricum (L.) Gaertn. PLoS One. 12 : 1–17.
Biesbaer D. 1983. The detection of cells with a laticifer-like metabolism in Asclepias syriaca L. suspension cultures. Plant Cell Reports. 2 : 137–139.
De Luca V., St Pierre B. 2000. The cell and developmental biology of alkaloid biosynthesis. Trends Plant Sci. 5 : 168–173.
dhoot g.k., henshaw g.g. 1977. organization and alkaloid production in tissue cultures of hyoscyamus niger. ann. botany. 41 : 943–949.
Dubey S.K., Pandey A., Sangwan R.S. 2016. Current developments in biotechnology and bioengineering. Amsterdam, Netherlands: Elsevier. 310 p.
Eibl R., Meier P., Stutz I., Schildberger D., Hühn T., Eibl D. 2018. Plant cell culture technology in the cosmetics and food industries: current state and future trends. Appl. Microbiol. Biotechnol. 102 : 8661–8675.
Ellis D.D., Zeldin E.L., Brodhagen M., Russin W.A., McCown B.H. 1996. Taxol production in nodule cultures of Taxus. J. Natural Prod. 59 : 246–250.
Elmaksood W.M.A., Ebad F., Bosila H. 2016. In vitro propagation of the endangered medicinal plant Hyoscyamus muticus L. (Egyptian henbane). J. Appl. Environ. Biol. Sci. 6 : 2–34.
Fortes A.M., Santos F., Pais M.S. 2010. Organogenic nodule formation in hop: A tool to study morphogenesis in plants with biotechnological and medicinal applications. J. Biomed. Biotechnol. 1–16.
Hashimoto Y., Kawanishi K., Ichimaru M. 1990. Histochemistry of alkaloids. In: The Alkaloids: Chemistry and pharmacology (Ed. by A. Brossi). 39 : 165–193.
Herburger K., Holzinger A. 2016. Aniline blue and Calcofluor white staining of callose and cellulose in the streptophyte green algae Zygnema and Klebsormidium. Eur. PMC Funders Group Author Manuscript. Bio Protoc. 6 (20).
Hosseini N., Ebrahimi S.N., Salehi P., Asghari B., Ahmadi M. 2011. Simultaneous determination of atropine and scopolamine in different parts of Hyoscyamus arachnoideus Pojark plants by high-performance liquid chromatography (HPLC). J. Med. Plants Res. 5 : 3552–3557.
Ibrahim A., Abd E., Abdel M., Abd E. 2009. Alkaloid production and organogenesis from callus of Hyoscyamus Muticus L. in vitro. J. Appl. Sci. 5 : 82–92.
Karaboyacı Ö., Kılıç S. 2018. Bioengineering methods in the production, development and metabolism of essential oil in plants. Bilge Int. J. Sci. Technol. Res. 2 (Special Issue) : 1–9.
Keng C.L., Saidon N.A., Bhatt A. 2009. Somatic embryogenesis and root regeneration in Hyoscyamus niger L. for the production of hyoscyamine. African J. Biotechnol. 8 : 6952–6960.
Kwaaitaal M.A., de Vries S.C. 2007. The SERK1 gene isexpressed in procambium and immature vascular cells. J. Exp. Bot. 58 : 2887–2896.
Lindsey K., Yeoman M. 1983. The relationship between growth rate, differentiation and alkaloid accumulation in cell cultures. J. Exper. Botany. 34 : 1055–1061.
Loredo-Carrillo S.E., de Lourdes Santos-Díaz M., Leyva E., del Socorro Santos-Díaz M. 2013. Establishment of callus from Pyrostegia venusta (Ker Gawl.) Miers and effect of abiotic stress on flavonoids and sterols accumulation. J. Plant Biochem. Biotechnol. 22 : 312–318.
McCown B.H., Zeldin E.L., Pinkalla H.A., Dedolph R.R. 1988. Nodule culture: a developmental pathway with high potential for regeneration, automated micropropagation, and plant metabolite production from woody plants. In: Genetic manipulation of woody plants. Springer. 149–166.
Murthy H., Kim Y., Park S., Paek K. 2014. Hypericins: biotechnological production from cell and organ cultures. Appl. Microbiol. Biotechnol. 98 : 9187–9198.
Ochoa-Villarreal M., Howat S., Hong S., Jang M., Jin Y., Lee E., Loake G. 2016. Plant cell culture strategies for the production of natural products. BMB Rep. 49 : 149–58.
Pasquali G., Porto D.D., Fett-Neto A.G. 2006. Metabolic engineering of cell cultures versus whole plant complexity in production of bioactive monoterpene indole alkaloids: recent progress related to old dilemma. J. Biosci. Bioeng. 101 : 287–296.
Pieron S., Belaizi M., Boxus Ph. 1993. Nodule culture, a possible morphogenetic pathway in Cichorium intybus L. propagation. Sci. Horticulturae. 53 : 1–11.
Schuetz M., Smith R., Ellis B. 2013. Xylem tissue specification, patterning, and differentiation mechanisms. J. Exp. Bot. 64 : 11–31.
Trump B.A., Smuckler E., Bendit E. 1961. Methods for staining epoxy sections for light microscopy. J. Ultrustruct. Res. 5 : 343–348.
Tytgat G.N., Guido N. 2007. Hyoscine butylbromide. Drugs. 67 : 1343–1357.
Wang X.D., Nolan K., Irwanto R., Sheahan M., Rose R. 2011. Ontogeny of embryogenic callus in Medicago truncatula: the fate of the pluripotent and totipotent stem cells / Ann. Botany. 107 : 599–609.
Wright M.J., Schröder M., Nielson A. 1981. Tissue fixation and staining by osmium tetraoxide: a possible role for alkaloids. J. Histochem. Cytochem. 29 : 1347–1348.
Дополнительные материалы отсутствуют.


