Цитология, 2020, T. 62, № 4, стр. 278-285
Особенности строения нейро-глио-сосудистых ансамблей в гломерулах обонятельной луковицы крысы
Е. Ю. Кириченко 1, А. К. Логвинов 1, С. Ю. Филиппова 1, *, Р. А. Арефьев 2, В. Г. Семынина 2, Л. В. Лысенко 2
1 Лаборатория функциональной геномики и морфологии Академии биологии и биотехнологии им. И.Д. Ивановского
Южного федерального университета
344090 г. Ростов-на-Дону, Россия
2 Научно-исследовательский технологический Центр нейротехнологий Южного федерального университета
344090 г. Ростов-на-Дону, Россия
* E-mail: kiriche.evgeniya@yandex.ru
Поступила в редакцию 24.12.2019
После доработки 11.01.2020
Принята к публикации 14.01.2020
Аннотация
Гломерулы обонятельной луковицы млекопитающих являются первичными элементами кодирования обонятельной информации. Паттерн возбуждения, образуемый отдельными гломерулами в ответ на обонятельную стимуляцию, является стабильным и специфичным по отношению к определенным запахам. В первую очередь, это обусловлено строением нейрональных цепей обонятельной луковицы. Тем не менее, существует основание полагать, что определенную роль в организации первичной обработки обонятельного сигнала играют вспомогательные клетки нервной системы – астроциты. Известно, что астроциты оказывают непосредственное влияние на синаптическую активность и пластичность, а также координируют совместную работу нейрональных цепей и васкулярного компонента, образуя так называемые нейро-глио-сосудистые ансамбли. В настоящей работе мы провели морфологическое исследование периферических отростков и щелевых контактов астроцитов с целью изучения строения нейро-глио-сосудистых ансамблей на уровне организации нейропиля гломерул обонятельной луковицы. Исследование показало, что основная часть астроцитарных отростков внутри гломерулы расположена в области дендро-дендритических связей вставочных и проекционных нейронов обонятельной луковицы, в то время как в зоне первичного переключения обонятельного сигнала астроцитарные отростки практически отсутствуют. Также нами была обнаружена выраженная диспропорция в экспрессии основных коннексинов астроглии между разными функциональными полюсами нейро-глио-сосудистых ансамблей обонятельной луковицы и присутствие гетеротипических контактов с участием Cx30. Функциональное значение наблюдаемых особенностей экспрессии коннексинов в обонятельной луковице ещё предстоит изучить.
Вспомогательные клетки нервной системы – астроциты – являются самыми многочисленными клетками мозга человека. Известно, что астроциты обеспечивают энергетические потребности нейронов, отводят продукты метаболизма и участвуют в поддержании постоянства электролитного состава межклеточной среды в мозге (Banker, 1980). На настоящий момент в науке прочно укоренилось представление о “трехстороннем синапсе”, основанное на том, что астроциты также являются важными регуляторами синаптической передачи, и, следовательно, функции мозга и поведения животных (Pérez-Alvarez, Araque, 2013). Они устанавливают двустороннюю связь с нейронами, реагируя на высвобождаемые в синапсах нейротрансмиттеры, выделяя в ответ сигнальные молекулы, модулирующие синаптическую активность и пластичность. Кроме того, сигнализация между нейронами и астроцитами оказалась явлением высокой степени сложности, не гомогенным по всему нейропилю, но обладающим выраженной специфичностью для синапса, клетки и нейрональной цепи в целом (Guerra-Gomes et al., 2017; Savtchouk, Volterra, 2018).
Астроциты демонстрируют не только биохимическую специфичность по отношению к синапсам и нейронам. На морфологическом уровне они образуют тесную связь с нейрональными цепями с одной стороны и сосудистым компонентом с другой, формируя так называемые нейро-глио-сосудистые ансамбли (НГСА). Внутри этих комплексов осуществляется координация нейрональной и поддерживающей её метаболической активностей, а также происходит физическая сегрегация функциональных нейрональных компартментов. Существование таких комплексов показано для элементарных вычислительных модулей коры головного мозга млекопитающих – кортикальных колонок (Eilam et al., 2016). В частности, в баррелях 4-го слоя первичной соматосенсорной коры грызунов, представляющих собой цитоархитектонические группировки, в каждой из которых происходит обработка сигналов от отдельной вибриссы, астроциты образуют объединенные посредством щелевых контактов (ЩК) «острова», четко соответствующие границам барреля (Houades et al., 2008). В пределах этих структур также осуществляется управляемая астроцитами регуляция местного кровотока в ответ на нейрональную активность (Blinder et al., 2013). ЩК представляют собой зоны сближения мембран двух клеток, пронизанные множеством каналов, через которые происходит прямой обмен ионами и низкомолекулярными веществами между цитоплазмой соседних клеток. Каждый такой элементарный канал образован двумя полуканалами, состоящими у человека и других млекопитающих из белков коннексинов, состав которых специфичен для каждого типа клеток. В частности, для астроцитов основными коннексинами являются коннексин 43 (Сх43) и коннексин 30 (Сх30) (Nielsen et al., 2012).
В связи с изучением нейро-глио-сосудистых ансамблей большой интерес представляют собой гломерулы обонятельной луковицы (ОЛ) млекопитающих. Гломерулы обонятельной луковицы являются четко определяемыми анатомическими структурами, в которых происходит переключение сигнала от обонятельных нейронов на вставочные и проекционные нейроны ОЛ. Проекционные нейроны, к которым относятся митральные и пучковые клетки, передают возбуждение далее в ЦНС. Вставочные клетки являются тормозными нейронами, ограничивающими возбуждение проекционных нейронов в пределах ОЛ, это перигломерулярные, гранулярные и другие клетки, классификация которых ещё уточняется (Nagayama et al., 2014). Известно, что взаимодействие разных типов нейронов в гломерулах происходит строго упорядочено. Нейропиль гломерул можно разделить на два неперекрывающихся компартмента – в аксональном компартменте происходит передача сигнала с обонятельных нейронов на дендриты вставочных и проекционных клеток, а в дендритном компартменте в основном происходит передача сигналов между дендритами вставочных и проекционных клеток, в ходе которой осуществляется настройка чувствительности последних (Kasowski et al., 1999).
Наблюдаемая сложность в организации процессов первичной обработки обонятельной информации, по нашему мнению, должна быть поддержана и на уровне нейро-глио-сосудистых ансамблей. Из литературных источников известно, что астроциты демонстрируют тесную связь с отдельными гломерулами, распространяя свои многочисленные отростки и обеспечивая преимущественное распространение ионов через ЩК только в пределах одной гломерулы (Bailey, Shipley, 1993; Roux et al., 2011). Таким образом, на данном анатомическом уровне, вероятно, наблюдается опосредованная астроцитами компартментализация нейрональной активности, подобная компартментализации в баррельной коре грызунов (Houades et al., 2008; Eilam et al., 2016).
В настоящей работе мы предприняли комплексное морфологическое исследование периферических отростков и щелевых контактов астроцитов с целью изучения строения НГСА на тонком уровне организации нейропиля гломерул обонятельной луковицы крыс. Полученные нами данные свидетельствуют в пользу того, что астроциты, вероятно, принимают участие в образовании функциональных компартментов в нейропиле гломерул, имеющих большое значение для организации первичной обработки обонятельной информации. Кроме того, нами впервые обнаружены некоторые особенности астроцитарных щелевых контактов, которые отличают гломерулы обонятельной луковицы от других отделов ЦНС крыс.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследования послужили обонятельные луковицы белых беспородных крыс мужского пола в возрасте 250 сут, всего было использовано 3 животных. Животным вводили нембутал в дозе 60 мг/кг и проводили транскардиальную перфузию 4%-ным параформальдегидом на фосфатном буфере (рН 7.4). После окончания перфузии обонятельные луковицы извлекали и оставляли в растворе параформальдегида для дофиксации в холодильнике при температуре 4°С. Далее на вибратоме изготавливали фронтальные и тангенциальные срезы ОЛ толщиной 40 мкм.
Флуоресцентная микроскопия. Вибратомные 40 мкм срезы после криопротекции в 30%-ной сахарозе мгновенно замораживали при температуре –80°С с последующим быстрым размораживанием в фосфатном буфере для пермеабилизации ткани. Далее срезы были разделены на группы для инкубации с первичными антителами в двух вариантах: 1 – мышиные антитела к глиальному фибриллярному кислому белку (ГФКБ), 1 : 1000 (#G3893, Sigma-Aldrich, США) и кроличьи антитела к коннексину 43, 1 : 200 (#71-0700, Invitrogen, США); 2 – мышиные антитела к ГФКБ, 1 : 1000 (#G3893, Sigma-Aldrich, США) и кроличьи антитела к коннексину 30, 1 : 200 (#71-2200, Invitrogen, США) в течение 7 сут при температуре 20°С. Затем срезы промывали в фосфатном буфере и инкубировали в течение суток при температуре 20°С в смеси с присутствием вторичных антител, коньюгированных с флуоресцентной меткой: козьи антитела anti-Rabbit CF488A, 1 : 200 (#SAB4600045, Sigma-Aldrich, США) и козьи антитела anti-mouse CF555, 1 : 200 (#SAB4600302, Sigma-Aldrich, США). Далее срезы промывали в фосфатном буфере, монтировали на стекла в среде, препятствующей выцветанию флуоресцентных сигналов Fluorescence Mounting Medium (Omnis, #GM30411-2, Dako, Дания), и исследовали с использованием лазерного сканирующего микроскопа (Zeiss LSM880).
Электронная иммуногистохимия. Пермеабилизация срезов ОЛ толщиной 40 мкм производилась также как и для флуоресцентного мечения. Далее срезы инкубировали 4 сут при температуре 10°С с первичными поликлональными антителами в двух вариантах: кроличьими антителами против коннексина 43, 1 : 100, (#71-0700, Invitrogen, США) и кроличьими антителами против коннексина 30, 1 : 200 (#71-2200, Invitrogen, США). После промывки в фосфатном буфере срезы инкубировали во вторичных антителах, конъюгированных с пероксидазой хрена EnVision/HRP (EnVision FLEX, #K8024, Dako, Дания) всю ночь при температуре 10°С. Выявление иммунных комплексов проводили с использованием DAB+ Chromogen (EnVision FLEX, #K8024, Dako, Дания). Далее срезы постфиксировали в течение 1.5 ч в 1%-ном растворе OsO4, обрабатывали стандартными методами для электронной микроскопии и заливали в смолу EPON-812 плоско-параллельным методом. Из полученных срезов лезвием под стереотаксической лупой иссекали фрагменты исследуемых структур и приполимеризовывали их к заранее изготовленному блоку из эпоксидной смолы. Ультратонкие срезы толщиной 50 нм получали с помощью ультрамикротома (Ultraсut-E, Leiсa, Германия) и алмазного ножа ultra 450 (Diatome, Швейцария), контрастировали уранилацетатом и цитратом свинца и просматривали под электронным микроскопом Jem 1011 (Jeol, Япония) при ускоряющем рабочим напряжении 80 кВ.
РЕЗУЛЬТАТЫ
Основной белок астроцитов ГФКБ неравномерно распределен по ткани обонятельной луковицы. На фронтальных срезах астроциты вытянуты вдоль аксонов обонятельных нейронов (слой обонятельных нейронов, рис. 1а), в гломерулярном слое флуоресцентная метка концентрируется по краям гломерул и между ними, благодаря чему четко визуализируются контуры гломерул (рис. 1а, б). Распределение коннексина 43 (Сх43), основного белка, образующего ЩК астроцитов, также имеет особенности в разных слоях ОЛ. Иммуногистохимическое мечение в слое обонятельных нейронов практически отсутствует, в наружном плексиформном слое, слое митральных клеток и гранулярном слоях мечение более или менее равномерное, местами четко локализующееся вокруг тел нейронов (рис. 1а). В гломерулярном слое локализация Сх43 позволяет локализовать отдельные гломерулы, так как выявляемый белок ассоциирован с телами астроцитов, сосредоточенных в стенках гломерулы, а также с их ветвящимися отростками, направленными в центр гломерулы. Эти отростки, переплетаясь, формируют многочисленные щелевые контакты, содержащие Сх43, которые выявляются в виде отдельных флуоресцирующих гранул (рис. 1б). При большом увеличении в гломерулах наблюдаются Сх43-иммунонегативные области, области с повышенной интенсивностью флуоресцентного мечения с помощью антител к Сх43, а также крупные скопления Сх43-позитивных флуоресцентных точек на периваскулярных астроцитарных муфтах (рис. 1в).
Рис. 1.
Коннексин 43 (Сх43) в обонятельной луковице (ОЛ) крыс. а – Фронтальный срез ОЛ крысы с обозначением слоев, б – вид отдельной обонятельной гломерулы, в – распределение Сх43-иммунопозитивных зон флуоресценции на большом увеличении. Отмечаются области с повышенным содержанием Сх43 (толстые стрелки), области с Сх43-иммунонегативными участками (отмечены звездочками), а также более крупные гранулы Сх43 на периваскулярных астроцитарных муфтах (тонкая стрелка указывает на стенку кровеносного сосуда). г – Строение нейропиля гломерулы обонятельной луковицы крысы на ультраструктурном уровне (АК – аксональный компартмент, ДК – дендритный компартмент, А – продукты иммуногистохимической реакции при использовании антител к Сх43 в астроцитарном отростке). д, е – Периферические отростки астроцитов, окружающие дендриты вставочных и проекционных нейронов вблизи от химических синапсов (А – продукты иммуногистохимической реакции при использовании антител к Сх43 в астроцитарном отростке, звездочка – химический синапс, стрелками отмечены щелевые контакты). ж – Строение щелевого контакта астроцита. Черными стрелками отмечены продукты реакции, белыми стрелками отмечена типичная ультраструктура ЩК – две сближенные мембраны и узкая электроноплотная щель между ними. ГФКБ – глиальный фибриллярный кислый белок. Масштабные отрезки – 200 (а), 50 (б, в), 2 (г), 0.5 (д, е), 0.2 (ж) мкм.
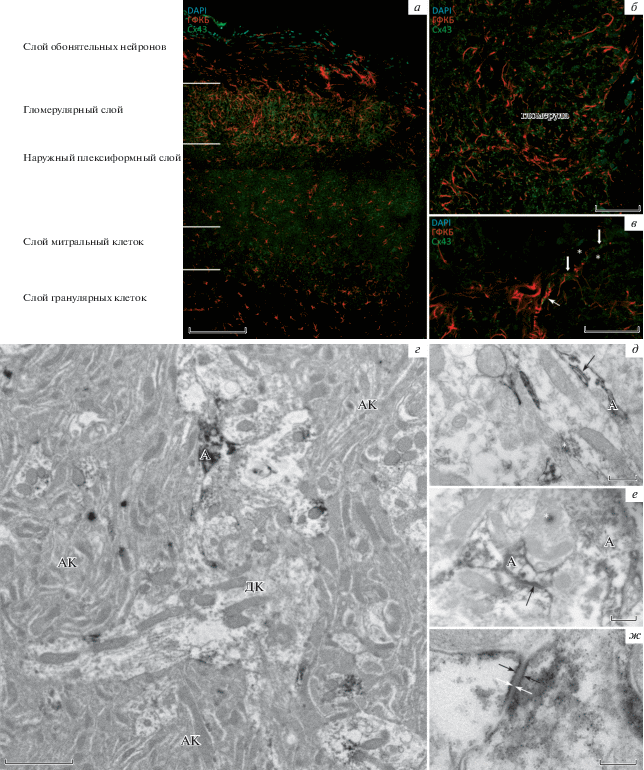
На ультраструктурном уровне отмечено, что электронноплотные продукты реакции пероксидазы с DAB, маркирующие зоны локализации Сх43, присутствуют в достаточно большом количестве и окрашивают самые тонкие отростки астроцитов даже в отсутствии видимых ЩК, что дает возможность наблюдать, как периферические отростки астроцитов взаимодействуют с нейритами. Нами отмечено, что периферические отростки астроцитов неравномерно распределены в нейропиле гломерул – они отсутствуют в зонах тесного расположения обонятельных аксонов – нейритов с темной цитоплазмой (рис. 1г). Вероятно, это именно те зоны, в которых не наблюдалось флуоресцентной метки на Сх43 на светооптическом уровне. Тончайшие периферические отростки астроцитов ассоциированы исключительно со скоплениями дендритов – крупных нейритов со светлой цитоплазмой. Одним из частых наблюдений является оборот астроцита вокруг дендрита, однако полноценного “чехла” астроцитарные отростки все же не образуют (рис. 1д). При большом увеличении отмечается, что периферические отростки астроцитов часто локализованы возле химических синапсов в дендритном компартменте (рис. 1д, е), а те синапсы, которые образуют обонятельные аксоны, ожидаемо остаются без контакта с астроцитом, так как астроцитарные отростки не проникают в аксональный компартмент нейропиля гломерул. В тех случаях, когда наблюдали два и более контактирующих друг с другом астроцитарных отростка, отмечалось наличие ЩК, образованного Сх43. Наличие ЩК устанавливали при большом увеличении по характерной семислойной структуре, отчетливо видимой даже в присутствии пероксидазной метки: две контактирующие трехслойные мембраны, между которыми располагается узкая щель шириной около 3 нм (рис. 1ж). При этом нами не было обнаружено гетеротипических ЩК с участием Сх43 – ЩК в обонятельной луковице встречались только между отростками, содержащими положительную реакцию на Сх43 с обеих сторон от контакта.
Характер локализации белка коннексина 30 (Сх30) на светооптическом уровне заметно отличался от Сх43. Флуоресцентная метка была сосредоточена в основном вокруг микрокапилляров, достаточно равномерно расположенных в гломерулярном слое ОЛ (рис. 2а–г). Точечная реакция в нейропиле была заметна только при больших увеличениях (рис. 2б).
Рис. 2.
Коннексин 30 (Сх30) в обонятельной луковице крыс. а – Тангенциальный срез гломерулы обонятельной луковицы крысы. Продукты реакции при использовании антител к Сх30 в основном сосредоточены вокруг микрокапилляров. б – Точечная иммуногистохимическая реакция на Сх30 в гломерулах обонятельной луковицы крысы при больших увеличениях (стрелками отмечены отдельные гранулы). в–г – Распределение продукта реакции на Сх30 вдоль сосудов (стрелкой отмечена колокализация Сх30 и ГФКБ). г – Строение нейропиля гломерулы обонятельной луковицы крысы на ультраструктурном уровне (АК – аксональный компартмент, ДК – дендритный компартмент, А – продукты иммуногистохимической реакции при использовании антител к Сх30 в астроцитарном отростке). д – Сх30 в составе периваскулярной астроцитарной муфты (А – продукты реакции на Сх30 в астроцитарном отростке). е – Гомотипический контакт в области периваскулярной астроцитарной муфты (белые стрелки – продукты реакции в обоих профилях), ж – гетеротипический контакт в области периваскулярной астроцитарной муфты (белые стрелки – продукты реакции только в одном профиле). з – Гомотипический ЩК, образованный Сх30 в нейропиле гломерулы ОЛ крысы, и – гетеротипический ЩК, образованный Сх30 в нейропиле гломерулы ОЛ крысы. к – Сх30-иммунонегативный ЩК в нейропиле гломерулы ОЛ крысы. Стрелками отмечены мембраны, образующие контакт. ГФКБ – глиальный фибриллярный кислый белок. Масштабные отрезки – 50 (а), 20 (б), 10 (в), 5 (г), 1 (д, е, з), 0.5 (ж), 0.1 (и–л) мкм.
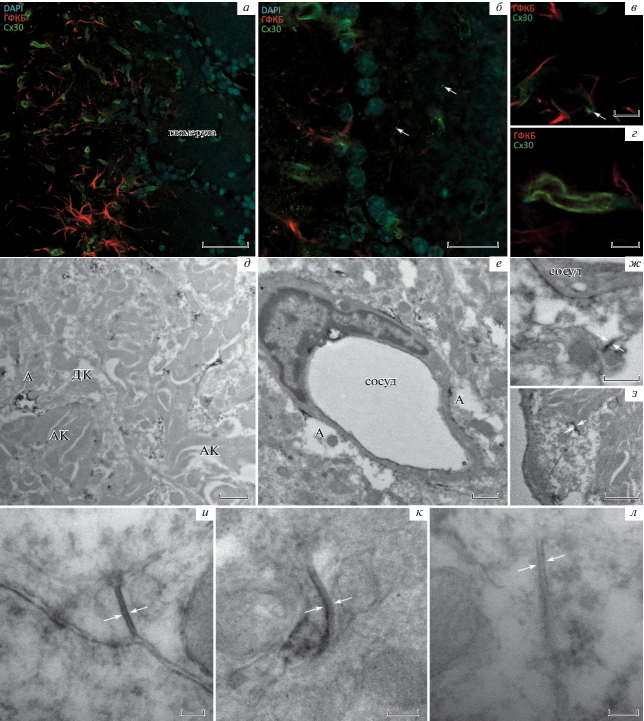
На ультраструктурном уровне общий вид локализации Сх30 в нейропиле гломерулы идентичен локализации Сх43: наблюдается отрицательная реакция в области нейритов с темной цитоплазмой – аксонов обонятельных нейронов (рис. 2д). При этом реакция на Сх30 в дендритном компартменте оказалась намного слабее, чем реакция на Сх43, как это наблюдалось и на светооптическом уровне. Кроме того, четко визуализируется периваскулярная астроцитарная муфта вокруг сосудов и образованные Сх30 щелевые контакты между отдельными астроцитарными отростками, формирующими ее (рис. 2е–з). В отличие от Сх43 продукт иммуногистохимической реакции при использовании антител к Сх30 был неравномерно распределен между контактирующими астроцитарными отростками – встречались варианты как симметричного, так и асимметричного распределения продуктов реакции пероксидазы с DAB. Кроме того, визуализировались Сх30-иммунонегативные астроцитарные ЩК при наличии продуктов реакции в других участках поля зрения (рис. 2и–л).
ОБСУЖДЕНИЕ
Проведенное нами морфологическое исследование показало, что астроцитарные отростки в гломеруле расположены гетерогенно и связаны с известной компартментализацией нейритов в данной структуре (Kasowski et al., 1999). Астроциты не проникают в зону первичного переключения обонятельного сигнала – в аксональный компартмент, но более обильны в зоне переплетающихся дендритов. Тем не менее, общая плотность астроцитарных отростков в данной зоне нейропиля меньше, чем в коре головного мозга. Соответственно, и количество, и характер контактов астроцитарных отростков и химических синапсов – так называемый трехсторонний синапс – здесь отличаются от других зон ЦНС. В гломерулах ОЛ чаще можно наблюдать контакт астроцита с дендро-дендритическими синапсами. Эти синапсы в основном образованы дендритами митральных и перигломерулярных нейронов и выполняют функцию прямого торможения, усиливая контраст восприятия обонятельных сигналов – “вытормаживание” слишком слабых сигналов (Linster, Cleland, 2009). Возбуждающие синапсы, которые образуют обонятельные нейроны на дендритах, не окружены астроцитами. Возможно, такое устройство астроцитарного компонента в гломерулах ОЛ способствует передаче возбуждения между отдельными лежащими рядом возбуждающими синапсами обонятельных нейронов благодаря повышенному уровню глутамата, внеклеточного калия или других факторов гуморальной регуляции, поглощение которых астроцитами в этой зоне затруднено. Известно, что возбуждающие синапсы обонятельных нейронов образуют микрокомпартменты, паттерн возбуждения которых в каждой отдельной гломеруле остается постоянным вне зависимости от природы одоранта и силы его воздействия на обонятельный эпителий (Wachowiak et al., 2004). Такое постоянство трудно объяснить, принимая во внимание присущую обонятельным нейронам разницу в чувствительности к одоранту, а также различные модулирующие воздействия на обонятельные нейроны со стороны локального окружения и выше лежащих отделов нервной системы. Возможно, происходит своеобразная суммация возбуждения между близко лежащими синапсами, образованными аксонами разных обонятельных нейронов. Это явление может обеспечивать постоянный сигнал в пределах обнаруженных Вачовяк с соавторами (Wachowiak et al., 2004) микрокомпартментов при различных режимах обонятельной стимуляции. Постоянный паттерн возбуждения синаптических микрокомпартментов нейропиля гломерулы, в свою очередь, позволяет этой структуре выступать в виде стабильной функциональной единицы, являющейся первичным элементом в кодировании обонятельной информации (Ressler et al., 1994). Таким образом, выявленные особенности астроцитарного компонента НГСА в гломерулах ОЛ могут обеспечивать надежность работы всего обонятельного аппарата.
Отдельного внимания заслуживает обнаруженный нами диморфизм иммуногистохимической локализации Сх43 и Сх30: если Сх43 равномерно распределялся между астроцитарными профилями как в перисинаптической области НГСА, так и в периферических отростках астроцитов, окружающих микрокапилляры, то Сх30 характеризовался более выраженной реакцией в периваскулярной астроцитарной муфте. Не подлежит сомнению, что в состав подавляющего большинства ЩК астроцитов, входят как Сх43, так и Сх30, что было подтверждено во многих исследованиях с применением двойного мечения на эти коннексины (Nagy et al., 1999; Rash et al., 2001). Известно также, что соотношение содержания Сх43 и Сх30 в составе ЩК зависит от возраста животного, подвержено регуляции со стороны множества факторов и имеет определенное функциональное значение (Nagy et al., 1999; Zeinieh et al., 2009; Mansour et al., 2013; Griemsmann et al., 2015). Так, уровень содержания Сх30 в составе ЩК может влиять на подавление подвижности перисинаптической мембраны астроцита и выступать, таким образом, отрицательным регулятором интенсивности поглощения высвобождаемого аксоном глутамата (Pannasch, 2014). С другой стороны, Сх43 отвечает за множество регуляторных взаимодействий внутри клетки, участвуя в контроле пролиферации, перестройке цитоскелета и других процессах (Leithe et al., 2018). Таким образом, большинство имеющихся данных указывает на то, что баланс основных коннексинов астроцитов как в составе каждого отдельного ЩК, так и на уровне НГСА имеет определенные последствия для функционирования последнего. Преимущественная связь Сх30 с периваскулярной астроцитарной муфтой отмечалась ранее другими авторами (Nagy et al., 1999), однако, такая выраженная гетерогенность экспрессии этого белка между клеточными компартментами астроцитов еще никем не была описана и является, вероятно, отличительной чертой ОЛ. Как эта особенность влияет на работу НГСА в составе гломерул ОЛ еще предстоит выяснить.
Другой особенностью экспрессии Сх30 в гломерулах ОЛ крысы оказалось присутствие гетеротипических контактов, образованных, с одной стороны, Сх30, а с другой – не установленным типом коннексинов. Под гетеротипическим контактом здесь понимается состыковка коннексонов двух контактирующих мембран, состоящих из разных типов коннексина при образовании ЩК.
На электронограммах такие типы контактов визуализируются в виде неравномерного распределения иммунной метки только с одной стороны ЩК, что говорит о разной антигенной природе образующих контакт белков. Ранее мы обнаруживали гетеротипические контакты в НГСА баррельной коры для ЩК, образованных Сх43 (Кириченко и др., 2018) в зоне периваскулярной астроцитарной муфты, которых в настоящем исследовании, напротив, не отмечалось. Как и ранее, мы предполагаем, что обнаруженные в данном исследовании гетеротипические контакты входят в состав ЩК между астроцитом и олигодендроцитом, так как, согласно литературным данным, астроциты не формируют между собой гетеротипические каналы, состоящие, с одной стороны, из Сх30, а с другой – из Сх43 (Orthmann-Murphy et al., 2007), однако известно о частом формировании гетеротипических каналов состава Сх30/Сх32 между астроцитами и олигодендроцитами (Kamasawa et al., 2005). В гломерулах ОЛ такие контакты еще никем не были описаны, и их возможное значение здесь остаётся неясным.
Таким образом, в гломерулах ОЛ мы наблюдаем четкие отличия в строении нейро-глио-сосудистого ансамбля от других зон нейропиля. На уровне нейритов, зона первичного переключения сигнала не содержит астроциты и их отростки, основной интерфейс нейрон-астроцит локализован в области дендро-дендритических связей вставочных и проекционных нейронов ОЛ. Также нами была обнаружена выраженная диспропорция в экспрессии основных коннексинов астроглии между разными функциональными полюсами НГСА и присутствие гетеротипических контактов с участием Сх30. Функциональное значение наблюдаемых особенностей еще предстоит выяснить.
Список литературы
Кириченко Е.Ю., Повилайтите П.Е., Логвинов А.К., Кириченко Ю.Г., Филиппова С.Ю. 2018. Щелевые контакты в составе нейро-глио-сосудистых ансамблей в колонкахбаррельной коры крыс. Цитология. Т. 60. № 6. С. 448. (Kirichenko E.Y., Logvinov A.K., Filippova S.Y., Povilaytite P.E., Kirichenko Y.G. 2018. Gap junctions in the composition of neurogliovascular ensembles in rat cortical barrel columns. Cell Tiss. Biol. (Tsitologiya). V. 12. № 6. P. 477.)
Bailey M.S., Shipley M.T. 1993. Astrocyte subtypes in the rat olfactory bulb: morphological heterogeneity and differential laminar distribution. J. Comp. Neurol. V. 328. P. 501.
Banker G.A. 1980. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. V. 209. P. 809.
Blinder P., Tsai P.S., Kaufhold J.P., Knutsen P.M., Suhl H., Kleinfeld D. 2013. The cortical angiome: An interconnected vascular network with noncolumnar patterns of blood flow. Nat. Neurosci. V. 16. P. 889.
Eilam R., Aharoni R., Arnon R., Malach R. 2016. Astrocyte morphology is confined by cortical functional boundaries in mammals ranging from mice to human. Elife. V. 5. e15915.
Griemsmann S., Höft S.P., Bedner P., Zhang J., Von Staden E., Beinhauer A., Degen J., Dublin P., Cope D.W., Richter N., Crunelli V., Jabs R., Willecke K., Theis M. et al. 2015. Characterization of panglial gap junction networks in the thalamus, neocortex, and hippocampus reveals a unique population of glial cells. Cerebral Cortex. V. 25. P. 3420.
Guerra-Gomes S., Sousa N., Pinto L., Oliveira J.F. 2017. Functional roles of astrocyte calcium elevations: From synapses to behavior. Front. Cell Neurosci. V. 11. P. 427.
Houades V., Koulakoff A., Ezan P., Seif I., Giaume C. 2008. Gap junction-mediated astrocytic networks in the mouse barrel cortex. J. Neurosci. V. 28. P. 5207.
Kamasawa N., Sik A., Morita M., Yasumura T., Davidson K.G.V., Nagy J.I., Rash J.E. 2005. Connexin-47 and connexin-32 in gap junctions of oligodendrocyte somata, myelin sheaths, paranodal loops and Schmidt-Lanterman incisures: implications for ionic homeostasis and potassium siphoning. Neuroscience. V. 136. P. 65.
Kasowski H.J., Kim H., Greer C.A. 1999. Compartmental organization of the olfactory bulb glomerulus. J. Comp. Neurol. V. 407. P. 261.
Leithe E., Mesnil M., Aasen T. 2018. The connexin 43 C-terminus: A tail of many tales. Biochim. Biophys. Acta. V. 1860. P. 48.
Linster C., Cleland T.A. 2009. Glomerular microcircuits in the olfactory bulb. Neural. Netw. V. 22. P. 1169.
Mansour H., McColm J.R., Cole L., Weible M. 2nd, Korlimbinis A., Chan-Ling T. 2013. Connexin 30 expression and frequency of connexin heterogeneity in astrocyte gap junction plaques increase with age in the rat retina. PLoS One. V. 8. e57038.
Nagayama S., Homma R., Imamura F. 2014. Neuronal organization of olfactory bulb circuits. Front. Neural. Circuits. V. 8. P. 98.
Nagy J.I., Patel D., Ochalski P.A.Y., Stelmack G.L. 1999. Connexin30 in rodent, cat and human brain: Selective expression in gray matter astrocytes, co-localization with connexin43 at gap junction and late developmental appearance. Neuroscience. V. 88. P. 447.
Nielsen M.S., Axelsen L.N., Sorgen P.L., Verma V., Delmar M., Holstein-Rathlou N.H. 2012. Gap junctions. Compr. Physiol. V. 2. P. 1981.
Orthmann-Murphy J.L., Freidin M., Fischer E., Scherer S.S., Abrams C.K. 2007. Two distinct heterotypic channels mediate gap junction coupling between astrocyte and oligodendrocyte connexins. J. Neurosci. V. 27. P. 13949.
Pannasch U. 2014. Connexin 30 sets synaptic strength by controlling astroglial synapse invasion. Nat. Neurosci. V. 17. P. 549.
Pérez-Alvarez A., Araque A. 2013. Astrocyte-neuron interaction at tripartite synapses. Curr. Drug Targets. V. 14. P. 1220.
Rash J.E., Yasumura T., Davidson K.G.V., Furman C.S., Dudek F.E., Nagy J.I. 2001. Identification of cells expressing Cx43, Cx30, Cx26, Cx32 and Cx36 in gap junctions of rat brain and spinal cord. Cell Comm. Adhesion. V. 8. P. 315.
Ressler K.J., Sullivan S.L., Buck L.B. 1994. Information coding in the olfactory system: evidence for a stereotyped and highly organized epitope map in the olfactory bulb. Cell. V. 79. P. 1245.
Roux L., Benchenane K., Rothstein J.D., Bonvento G., Giaume C. 2011. Plasticity of astroglial networks in olfactory glomeruli. Proc. Natl. Acad. Sci. USA. V. 108. P. 18 442.
Savtchouk I., Volterra A. 2018. Gliotransmission: Beyond black-and-white. J. Neurosci. V. 38. P. 14.
Wachowiak M., Denk W., Friedrich R.W. 2004. Functional organization of sensory input to the olfactory bulb glomerulus analyzed by two-photon calcium imaging. Proc. Natl. Acad. Sci. USA. V. 101. P. 9097.
Zeinieh M.P., Talhouk R.S., El-Sabban M.E., Mikati M.A. 2010. Differential expression of hippocampal connexins after acute hypoxia in the developing brain. Brain Dev. V. 32. P. 810.
Дополнительные материалы отсутствуют.


