Цитология, 2020, T. 62, № 5, стр. 333-339
Функциональные свойства клеточной поверхности гранулоцитов при моделировании активации элементов пуринергической сигнальной системы
М. Ю. Скоркина 1, *, Т. С. Шевченко 1, Е. А. Сладкова 1, Л. Р. Закирова 1
1 Белгородский государственный национальный исследовательский университет, кафедра биохимии
308015 Белгород, Россия
* E-mail: skorkina@bsu.edu.ru
Поступила в редакцию 28.01.2020
После доработки 04.02.2020
Принята к публикации 06.02.2020
Аннотация
В регуляции функциональной активности иммунных клеток непосредственное участие принимает пуринергическая сигнальная система. В работе изучены микромеханические и функциональные свойства клеточной поверхности гранулоцитов при моделировании механического стресса in vitro на крови пациентов, больных острым лимфобластным лейкозом. В условиях активации элементов пуринергической сигнальной системы установлено повышение концентрации АТФ на 26.7% (Р < 0.05), снижение модуля Юнга гранулоцитов на 6.3% (Р < 0.05), увеличение заряда поверхности на 24% (Р < 0.05) и силы адгезии в системе эритроцит–гранулоцит на 17.8% (Р < 0.05) по сравнению с контролем. Под влиянием механического стресса миграционная активность гранулоцитов увеличилась на 24.5% (Р < 0. 05) при этом клетки более активно использовали мембранный резерв в механизмах регуляции объема по сравнению с интактными пробами. Полученные данные указывают на ведущую регуляторную роль пуринергической сигнальной системы, которая модулирует микромеханические и функциональные свойства клеточной поверхности гранулоцитов при механической деформации клеток крови в условиях опухолевого процесса. Полученные результаты могут быть учтены при поиске и разработке фармакологических регуляторных мишеней, направленных на улучшение транскапиллярного обмена при развитии патофизиологических процессов у больных лейкозом.
Пуринергическая сигнальная система играет ключевую роль в регуляции функциональной активности иммунных клеток, межклеточной коммуникации и обладает спектром биологических воздействий на функции как нормальных, так и опухолевых клеток (Junger, 2011). В частности, рядом исследований продемонстрирована способность внеклеточных нуклеотидов (АТФ, АДФ, УТФ, УДФ) регулировать пролиферацию клеток, миграцию и смерть в зависимости от экспрессии подтипа пуринергического рецептора и концентрации нуклеотидов во внеклеточной середе (Di Virgilio et al., 2001; Swennen et al., 2005). Согласно современным представлениям паракринный механизм регуляции, реализуемый через пуринергические рецепторы на поверхности иммунных клеток, позволяет им распознавать АТФ, высвобожденный из других клеток организма, в результате чего гранулоциты-фагоциты мигрируют в места воспаления и способствуют клиренсу антигенов и апоптических клеток (Elliot et al., 2009).
Доказано, что в микроциркуляторном русле основными поставщиками внеклеточной АТФ являются эритроциты, которые высвобождают АТФ в ответ на механический стресс, воздействие β-адренергических агонистов, аналогов простагландинов, при снижении кислородного напряжения, ацидозе или набухании (Leal et al., 2013). Несмотря на детальное описание семейства пуринергических рецепторов на клеточной поверхности (Corriden, Insel, 2010; Burnstook, 2015) и механизмы их активации (Bao et al., 2014), мало что известно о влиянии пуринергической сигнальной системы на свойства плазмалеммы иммунных клеток, функционирующих в условиях опухолевого роста и изменяющихся в процессе межклеточного взаимодействия.
Цель настоящей работы заключалась в изучении микромеханических свойств клеточной поверхности гранулоцитов (упруго-эластических, электрических и адгезивных), а также способности клеток к миграции и регуляции своего объема в условиях активации элементов пуринергической сигнальной системы in vitro на крови пациентов больных острым лимфобластным лейкозом (ОЛЛ). Для решения поставленной задачи в качестве естественной модели опухолевого процесса был выбран ОЛЛ, при котором в системе крови циркулируют лимфобласты, не способные выполнять функции иммунологического надзора. В этих условиях гранулоциты являются единственными полноценными клетками, которые поддерживают реализацию иммунных реакций в микроциркуляторном русле и непосредственно участвуют в межклеточных коммуникациях.
МАТЕРИАЛ И МЕТОДИКА
В эксперименте использована кровь больных ОЛЛ (n = 10), поступивших в клинико-диагностическое отделение областной клинической больницы г. Белгорода. Отбор проб осуществлен после точной постановки диагноза, забор крови проводили у всех пациентов до лечения. Возраст пациентов разнился в пределах 18–45 лет, по полу пробы крови не разделяли, так как половые различия по числу и морфологии белых клеток крови отсутствуют. Венозную кровь собирали в вакуумные пробирки Vacuette K3E, содержащие сухую ЭДТА-К3 в концентрации 2.0 мг на 1 мл крови (0.006843 моль/литр). Эксперименты выполнены с соблюдением требований Хельсинской декларации после получения предварительного информированного согласия от участников в соответствии с рекомендациями Декларации по этическим принципам медицинских исследований, в которых участвуют люди (принята 52-ой Генеральной Ассамблеей Всемирной Медицинской Ассоциации, Эдинбург, Шотландия, октябрь, 2000 г.).
С целью активации элементов пуринергических сигнальных путей в работе использовали инъекционную модель механического стресса in vitro (Oonishi et al., 1997), максимально приближенную к физиологическим параметрам микроциркуляторного русла (Trautmann, 2009). Каждую пробу взятой крови делили на две части – контрольную и экспериментальную. Экспериментальные пробы подвергали стрессу, контрольные – оставляли интактными. И в тех, и других пробах измеряли концентрацию АТФ колориметрическим методом (Алейникова, Рубцова, 1998). Кровь в объеме 0.5 мл помещали на ледяную баню и добавляли 5 мл 5%-ного раствора ТХУ. Экстрагирование АТФ выполняли в течение 5 мин, перемешивая содержимое пробирки, к которой добавляли 5 мл 0.9%-ного физиологического раствора и продолжали экстракцию на холоде в течение 5 мин.
Полученный экстракт делили на 2 пробирки по 0.5 мл в каждой. В пробирку № 1 добавляли 1 М соляной кислоты, 1 мл 1 М раствора гидроксида натрия и 7.5 мл 0.9%-ного раствора хлорида натрия. В пробирку № 2 добавляли 1 мл 1 М раствора соляной кислоты и помещали ее в кипящую водяную баню для гидролиза фосфатных связей. Затем раствор охлаждали и добавляли 1 мл 1 M раствора гидроксида натрия и 7.5 мл 0.9%-ного раствора хлорида натрия. Из обеих пробирок по 5 мл жидкости переносили в пробирки № 3 (без кипячения) и № 4 (после кипячения). В каждую из них добавляли по 0.5 мл 1%-ного раствора молибдата аммония, 0.5 мл аскорбиновой кислоты и 2 мл 0.9%-ного раствора хлорида натрия. В каждой пробирке смесь перемешивали и оставляли стоять при комнатной температуре в течение 10 мин. Измеряли оптическую плотность в пробирках № 3 и № 4 на фотометре КФК-3 (Россия, 2015) при длине волны 670 нм против физиологического раствора. Концентрацию АТФ рассчитывали по разности оптических плотностей между пробирками № 4 и № 3, используя для этого калибровочный график. При построении калибровочного графика использовали раствор фосфат-ионов (ГСО 7791-2000) в концентрации от 50 до 500 мкг/мл с шагом в 50 мкг/мл. Измерение АТФ выполняли трижды для каждой пробы.
Микромеханические свойства плазмалеммы гранулоцитов изучали с использованием методов атомно-силовой микроскопии (АСМ). Упруго-эластические свойства плазмалеммы оценивали по числовым данным модуля Юнга. Из каждой пробы сканировали по 20 клеток. Для сканирования гранулоцитов были сконструированы модифицированные АСМ-зонды на основе типлесса и полимерных микросфер с радиусом закругления 5 мкм (Скоркина и др., 2012). Полученные в результате выполнения АСМ-спектроскопии силовые кривые подвода и отвода использовали для вычисления силы взаимодействия между зондом и клеточной поверхностью. Обработку силовых кривых и расчет модуля Юнга (мкРа) проводили, используя программный продукт Nova (NT-MDT, Зеленоград, Россия, 2011).
Заряд клеточной поверхности гранулоцитов оценивали, измеряя потенциал поверхности в режиме зонда Кельвина на АСМ, используя кантилеверы с токопроводящим титановым покрытием серии NSG03/TiN (Nanoworld, США). Готовили суспензию клеток для измерения потенциала поверхности, которую помещали на обезжиренную металлическую подложку. Для приготовления суспензии лейкоциты крови отмывали изотоническим раствором хлорида натрия в течение 5 мин. Фиксацию осуществляли 0.25%-ным раствором глутарового альдегида в течение 20 мин, затем суспензию гранулоцитов дважды отмывали изотоническим раствором хлорида натрия по 5 мин (Сладкова, Скоркина, 2014). Из каждой пробы сканировали по 20 клеток. Обработку полученных сканов проводили в программе Nova, используя инструмент “Point Instruments” и рассчитывая значение поверхностного потенциала в 10 участках каждой клетки.
Силу межклеточной адгезии измеряли на АСМ в режиме силовой спектроскопии во влажной камере. Для измерения конструировали биосенсорный чип, изготовленный на основе нативного эритроцита и типлесса HA_C/tipless (США), который обрабатывали 2%-ным раствором желатина. Для этого на середину обезжиренного предметного стекла наносили каплю приготовленного раствора желатина, по бокам от нее на один край наносили каплю суспензии лейкоцитов, на другой край – каплю суспензии эритроцитов. Проводили спектрометрирование на АСМ в участке препарата, где расположена капля желатина, затем изменяли область сканирования, перемещаясь на противоположный край препарата, где расположена суспензия эритроцитов. Под контролем оптической системы микроскопа выбирали участок с отдельно лежащим эритроцитом и спектрометрировали, надавливая на клетку, и в результате получали клеточный биосенсор. Силу прижатия зонда к клетке оценивали по закону Гука:
где, x – смещение конца балки кантилевера, нм; k – константа жесткости балки зонда, Н/м.Далее проводили подвод кантилевера на противоположный край стекла, где располагалась суспензия лейкоцитов, под контролем оптической системы микроскопа находили отдельно лежащие гранулоциты и проводили процедуру силовой спектроскопии, надавливая биосенсорным чипом на клетку (Скоркина и др., 2017). Силу адгезии измеряли между эритроцитом и гранулоцитом, регистрируя силовые кривые с поверхности 20 клеток. Силы адгезии рассчитывали с помощью программного продукта Nova (см. выше).
Функциональные свойства плазмалеммы гранулоцитов исследовали в тестах с гипоосмотической нагрузкой in vitro и миграционном тесте. Тесты с гипоосмотической нагрузкой выполняли с целью оценки осморегуляторных реакций гранулоцитов за счет дополнительных мембранных структур, заложенных в складчатости плазмалеммы и используемых груналоцитами в регуляции своего объема. Суспензию лейкоцитов в экспериментальных и контрольных пробах делили на 2 части: к первой добавляли равное количество аутологичной плазмы, ко второй – гипотонического раствора хлорида натрия (0.45%). Формировали суспензионные препараты из каждой пробы, в которых через каждые 30 с регистрировали изображения нативной суспензии лейкоцитов с помощью лазерного сканирующего конфокального микроскопа Nikon (TokyoByoke, Япония), используя программное обеспечение Nis-Elements Documentation (ver. 2.32, TokyoByoke, 2011). Длительность гипоосмотической нагрузки составила 5 мин. На полученных изображениях измеряли диаметр 50 гранулоцитов из каждой пробы. На основе замеров диаметров рассчитывали объем и площадь поверхности клетки. Относительный мембранный резерв, заложенный в складчатости плазмалеммы и используемый клетками в регуляции объема при гипоосмотической нагрузке, рассчитывали согласно формуле:
Интенсивность использования клеткой относительного мембранного резерва оценивали, вычисляя его как процентную долю от потенциального мембранного резерва, принимаемого за 100%.
Результаты экспериментальных исследований обрабатывали методами вариационной статистики. Достоверность различий между контрольными и эксперименталными пробами при нормальном распределении признака определяли с использованием t-критерия Стьюдента при P < 0.05. Для анализа непараметрических данных использовали U-критерий Манна–Уитни при P < 0.05. В работе приведены значения средней величины и ее статистической ошибки.
Использованные реактивы. ТХУ и аскорбиновая-L(+) кислота (Sigma, США); молибдат аммония и глутаровый альдегид (Sigma-Aldrich, США); соляная кислота и гидрооксид натрия (PanReac AppliChem, Испания); хлорид натрия (ООО Гематек, Россия); фосфат-ионы (ГСО 7791-2000) и желатин (АО ЛенРеактив, Россия).
РЕЗУЛЬТАТЫ
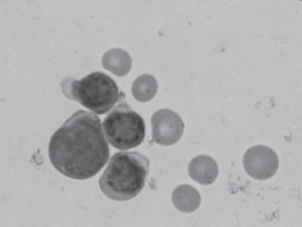
В крови больных ОЛЛ число лейкоцитов было увеличено и составляло 14.23 ± 0.15 × 109 л–1, из них 88.4 ± 1.5% – бластные формы лимфоидного ростка кроветворения (рис. 1).
Рис. 1.
Лимфобласты периферической крови больного ОЛЛ. Мазок, окраска по Романовскому-Гимзе. Об.: 100×.
Под влиянием механического стресса концентрация АТФ в крови увеличилась на 26.7% (Р < 0.05) по сравнению с контролем (рис. 2). Модуль Юнга клеточной поверхности гранулоцитов снизился на 6.3% (Р < 0.05), при этом сила адгезии в системе эритроцит–гранулоцит увеличилась на 17.8% (Р < 0.05) по сравнению с контролем (табл. 1). Клеточная поверхность гранулоцитов потеряла отрицательный заряд, в результате чего потенциал поверхности повысился на 24% (Р < 0.05) по сравнению с контролем.
Рис. 2.
Изменение концентрации АТФ в крови больных ОЛЛ под влиянием механической нагрузки (МН) in vitro. Различие с контролем (К) достоверно при *Р < 0.05 (t-критерий Стьюдента).
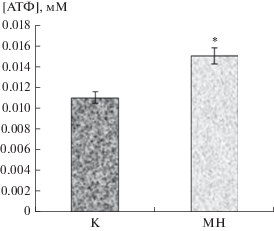
Таблица 1.
Функциональные свойства поверхности гранулоцитов больных ОЛЛ
| Параметр | Контроль | Механический стресс |
|---|---|---|
| Модуль Юнга, мкРа | 6.21 ± 0.02 | 5.84 ± 0.02* |
| Сила адгезии в системе “эритроцит−гранулоцит”, нН | 21.2 ± 0.3 | 25.8 ± 0.4** |
| Потенциал поверхности, мВ | –19.0 ± 0.8 | –10.8 ± 0.6* |
| Миграционная активность гранулоцитов, % | 25.5 ± 0.3 | 33.8 ± 0.3* |
Наряду с изменением микромеханических свойств клеточной поверхности, установлено влияние смоделированной нагрузки на клеточную подвижность и способность клеток регулировать свой объем. Так, в экспериментальных пробах миграционная активность гранулоцитов увеличилась на 24.5% (Р < 0.05) по сравнению с контролем (см. табл. 1).
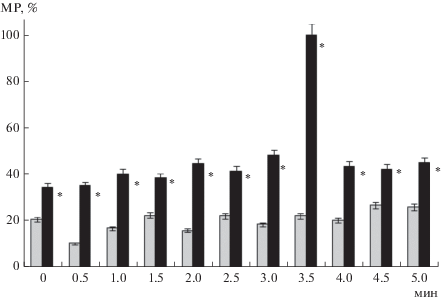
В экспериментальных пробах гранулоциты больных ОЛЛ более активно использовали мембранный резерв для регуляции объема в условиях механического стресса (рис. 3); интенсивность использования мембранного резерва гранулоцитами постепенно увеличивалась. На 0.5-й мин использование мембранного резерва клеткой возросло на 70.4% (Р < 0.05), на 2-ой мин – на 64.4% (Р < 0.05), на 3-ей мин – на 61.6% (Р < 0.05) по сравнению с контролем. На 3.5 мин инкубации гранулоциты использовали 100% мембранного резерва для регуляции своего объема, затем (с 4-ой по 5-ю мин) использование мембранного резерва составило около 45%, что превышало показатели контрольной группы примерно в 2 раза. В целом, наблюдали один период регуляторного увеличения объема в течение первых 3.5 мин инкубации. В контрольной группе проб установлено чередование коротких 30-секундных периодов регуляторного уменьшения объема, которые сменялись такими же периодами увеличения объема. Такие флуктуации объема наблюдали в течение 4 мин инкубации.
Рис. 3.
Интенсивность использования мембранного резерва (МР) гранулоцитами больных ОЛЛ в тесте с гипоосмотической нагрузкой in vitro в течение 5-минутной экспозиции. Значения всех столбиков достоверно отличаются от контроля (светлые столбцы) при Р < 0.05 (t-критерий Стьюдента). Вертикальные отрезки – доверительный интервал для среднего значения по выборке из конечной генеральной совокупности.
ОБСУЖДЕНИЕ
На модели механического стресса in vitro опосредованно установлено высвобождение АТФ из клеток крови. Полученные данные согласуются с результатами, представленными в литературе, и указывают на экскрецию в межклеточное пространство молекул АТФ клетками крови в ответ на силовое воздействие со стороны смещающихся слоев плазмы (Sprague et al., 2007; Bao et al., 2014). Известно, что при механическом стрессе АТФ может высвобождаться из нормальных или опухолевых клеток посредством экзоцитоза АТФ-содержащих везикул, либо селективного оттока через мембранные каналы или неселекивного нарушения целостности мембраны (Lazarowski, 2012). Нормальные эритроциты и полиморфно-ядерные лейкоциты высвобождают АТФ через канал паннексин-1. Однако, в эритроцитах в процесс высвобождения АТФ вовлечен путь трансдукции сигнала, требующий наличия специфической мембранно-связанной аденилатциклазы, цАМФ, протеинкиназы А и непосредственной стимуляции G-белка (Olearczyk et al., 2004; Montalbetti et al., 2010), в то время как в лейкоцитах АТФ высвобождается через канал панексин-1 на лидирующем крае клетки (Chen et al., 2010; Bao et al., 2013). При апоптозе лейкемических Т-клеток установлена центральная роль каналов паннексин-1 при выделении АТФ (Chekeni et al., 2010).
В настоящее время доказано, что клеточная поверхность иммунных клеток обладает набором пуринергических рецепторов с разной нуклеотидной селективностью, аффинностью и способностью образовывать гетеромерные каналы (Di Virgilio, Vierich, 2015). Нами установлено, что при повышении концентрации АТФ в среде микроокружения, снижается жесткость клеточной поверхности и увеличивается сила адгезии между эритроцитами и лейкоцитами. С точки зрения физиологии микроциркуляции крови, снижение жесткости клеточной поверхности лейкоцитов имеет физиологическое значение, так как позволяет этим клеткам легче деформироваться и продвигаться по мелким сосудам. Это особенно важно при циркуляции в кровотоке бластных форм, способных формировать очаги лейкостаза в мелких сосудах у больных ОЛЛ (Ali et al., 2016).
Под влиянием механического стресса в эксперименте удалось установить потерю части отрицательного заряда гранулоцитами, что способствовало увеличению силы адгезии между эритроцитом и гранулоцитом. Данный факт указывает на физиологическую роль эритроцитов в усилении адгезивной функции лейкоцитов. Согласно модели Lattica-Bolcmana в “виртуальном кровеносном сосуде” происходит “обтекание” лейкоцитов эритроцитами и формируются условия для роллинга лейкоцитов по поверхности эндотелиальной стенки в микроциркуляторном русле (Migliorini et al., 2002). Не исключено, что это явление стимулирует миграционную активность лейкоцитов. Следовательно, при механической деформации в микрососудах элементы пуринергической сигнальной системы выполняют регуляторную функцию, запуская каскад процессов, направленных на изменение функциональных свойств плазмалеммы гранулоцитов, что снижает жесткость, заряд клеточной поверхности и обеспечивает увеличение адгезивных свойств и миграционной активности гранулоцитов. Кроме того, изменение этих свойств поверхности позволяет гранулоцитам более эффективно использовать мембранный резерв для регуляции объема при прохождении через мелкие сосуды, что сохраняет целостность клетки при значительных деформациях у пациентов больных ОЛЛ.
Таким образом, установлены физиологические ответы клеточной поверхности гранулоцитов у больных ОЛЛ при моделировании механического стресса (in vitro). В ответ на увеличение концентрации АТФ в крови выявлено снижение жесткости клеточной поверхности, повышение потенциала поверхности и увеличение силы адгезии между эритроцитом и гранулоцитом. Изменение функциональных свойств плазмалеммы гранулоцитов позволяет клеткам более интенсивно испоьзовать запасы мембранного резерва для регуляции клеточного объема и миграционной активности.
Полученные данные указывают на ведущую регуляторную роль пуринергической сигнальной системы, которая модулирует функциональные свойства клеточной поверхности гранулоцитов при механической деформации клеток крови в условиях опухолевого процесса. Выявленные адаптивные ответы клеточной поверхности позволяют гранулоцитам эффективно выполнять свою иммунную функцию и сохранять оптимальные параметры циркуляции крови в мелких сосудах при развитии ОЛЛ. Полученные экспериментальные данные имеют значение при изучении механизмов межклеточных взаимодействий в микроциркуляторном русле и могут быть учтены при поиске и разработке фармакологических регуляторных мишеней, направленных на улучшение транскапиллярного обмена при развитии патофизиологических процессов у больных лейкозом.
Список литературы
Алейникова Т.Л., Рубцова Г.В. 1988. Руководство к практическим занятиям по биологической химии. М.: Вс. Шк. С. 115. (Aleinikova T.L., Rubtsova G.V. 1988. Rukovodstvo k prakticheskim zanatiam po biologicheskoi chimii. Moscow: Vs. Sh. P. 115).
Скоркина М.Ю., Федорова М.З., Муравьев А.В., Сладкова Е.А. 2012. Использование наномеханического сенсора для изучения морфофункциональных свойств лимфоцитов здоровых доноров и больных хроническим лимфобластным лейкозом. Клеточные технол. биол. мед. Т. 3. С. 172. (Skorkina M.Yu, Fedorova M.Z., Muravyov A.V., Sladkova E.A. 2012. The use of nanomechanical sensor for studies of morphofunctional properties of lymphocytes from healthy donors and patients with chronic lymphoblastic leukemia. Cell Techol. Biol. Med. V. 3. P. 163.)
Скоркина М.Ю., Шамрай Е.А., Сладкова Е.А. 2017. Измерение сил адгезии в системе “клетка–клетка” на основе технологий атомно-силовой микроскопии. Клеточные технол. биол. мед. Т. 4. С. 213. (Skorkina M.Yu., Shamray E.A., Sladkova E.A. 2018. Measuring of adhesion force in the cell-cell system based on atomic force microscopy technology. Cell Technol. Biol. Med. V. 4. P. 528.)
Сладкова Е.А., Скоркина М.Ю. 2014. Оценка поверхностного потенциала лимфоцитов больных лейкозом методом зонда Кельвина. Биофизика. Т. 59. № 2. С. 310. (Sladkova E.A., Skorkina M.Yu. 2014. Estimation of surface potential of lymphocytes from patients with leukemia using Kelvin probe mode. Biophysics. V. 59. P. 310.)
Ali A.M., Mirrakhimov A.E., Abboud C.N., Cashen A.F. 2016. Leukostasis in adult acute hyperleukocytic leukemia: a clinician’s digest. Hematolog. Oncol. V. 34. P. 69.
Bao Y., Ledderose C., Seier T., Graft A.F., Brix. B., Chang E., Junger W.C. 2014. Mitochondria regulate neutrophil activation by generating ATP for autocrine purinergic signaling. J. Biol. Chem. V. 289. P. 26794.
Bao Y., Chen Y., Ledderose C., Li L., Junger W.G. 2013. Pannexin 1 channels link chemoattractant receptor signaling to local excitation and global inhibition responses at rhe front and back of polarized neutrophils. J. Biol. Chem. V. 288. P. 22 650.
Burnstook G. 2015. Blood cells an historical account of the roles of purinergic signaling. Purin. Signal. V. 11. P. 411.
Chekeni F.B., Elliot M.R., Sanidols J.K., Walk S.F., Kinchen J.M., Lazarowski E.R., Aemstrong A.J., Penuela S., Laird D.W., Salvesen G.S., Isakson B.E., Bayliss D.A., Ravichandran K.S. 2010. Pannexin 1 channels mediate “find-me” signal release and membrane permeability during apoptosis. Nature. V. 467. P. 863.
Chen Y., Yao Y., Sumi Y., Li A., To U.K., Elkhal A., Inoe Y., Woehrle T., Zhang Q., Hauser C., Junger W.G. 2010. Purinergic signaling: A fundamental mechanism in neutrophil activation. Sci. Signal. V. 3. ra45. https://doi.org/10.1126/scisignal.2000549
Corriden R., Insel P.A. 2010. Basal release ATP: An autocrine-paracrine mechanism for cell regulation. Sci. Signal. V. 3. P. 104. re1. https://doi.org/10.1126/scisignal.3104re1
Di Virgilio F., Chiozzi P., Ferrari D., Sanz J.M., Morelli A., Torboli M., Bolognesi G., Baricordi O.R. 2001. Nucleotide receptors: an emerging family of regulatory molecules in blood cells. Blood. V. 97. P. 587.
Di Virgilio F., Vierich M. 2015. Purinergic signaling in the immune system. Atonomic Neuroscience: Basic Clinical. V. 191. P. 117.
Elliot M.R. Chekein F.B., Trampont P.C., Lazarowski E.R., Kadl A., Walk S.F., Park D., Woodson R.I., Ostankovich M., Lysiak J.J., Harden T.K., Leitinger N., Ravichandran K.S. 2009. Nucleotides released by apoptotic cells act as a find-me signal to promote phagocytic clearance. Nature. V. 461. P. 282.
Junger W.G. 2011. Immune cell regulation by autocrine purinergic signaling. Nat. Rev. Immunol. V. 11. P. 201.
Lazarowski E.R. 2012. Vesicular and conductive mechanisms of nucleotide release. Purin. Signall. V. 8. P. 359.
Leal D.M.F., Incicco J.J., Espelt M.V., Verstraeten S.V., Pignataro O.P., Lazarowski E.R., Schwarzbaum P.J. 2013. Kinetics of extracellular ATP in mastoparan 7-activated human erythrocytes. Biochem. Biophys. Acta. V. 1830. P. 4692.
Migliorini C., Qian Y., Chen H., Brown E.B., Lain R.K., Munn L.L. 2002. Red blood cells augment leukocyte rolling in a virtual blood vessel. Biophys. J. V. 83. P. 1834.
Montalbetti N., Lazarowski E., Schwarzbaum P. 2010. Human erythrocytes release ATP in cyclic AMP-regulated manner. Purin. Signall. V. 6. P. 73.
Olearczyk J.J., Stephenson A.H., Lonigro A.J., Sprague R.S. 2004. Heterotrimeric G protein Gi is involved in a signal transduction pathway for ATP release from erythrocytes. A. J. Physiol. Heart. Circ. Physiol. V. 286. P. H940.
Oonishi T., Sakashita K., Uyesaka N. 1997. Regulation of red blood cell filterability by Ca2+ influx and cAMP-mediated signaling pathways. Am. J. Physiol. Soc. Cell. Physiol. V. 273. P. C1828.
Sprague R., Stephenson A., Ellworth M. 2007. Red not dead: Signaling in and from erythrocytes. Trends Endocrin. Metabol. V. 18. P. 350.
Swennen E.L., Basta A., Dagnelie P.C. 2005. Immunoregulatory effects of adenosine 5-triphosphate on cytokine release from stimulated whole blood. Eur. J. Immunol. V. 35. P. 852.
Trautmann A. 2009. Extracellular ATP in the immune system: More than just a “damage signal”. Sci. Signal. V. 2. pe6. https://doi.org/10.1126/scisignal.256pe6
Дополнительные материалы отсутствуют.


