Цитология, 2020, T. 62, № 6, стр. 418-427
Гемопоэтические клетки костного мозга крыс после внутривенного введения модифицированных хитозаном наночастиц магнетита
И. В. Мильто 1, 2, *, Н. М. Шевцова 1, В. В. Иванова 1, О. Н. Серебрякова 1, Р. М. Тахауов 2, И. В. Суходоло 1
1 Кафедра морфологии и общей патологии Сибирского государственного медицинского университета Минздрава России
Томск, 634050 Россия
2 Северский биофизический научный центр Федерального медико-биологического агенства РФ
636013 Северск, Россия
* E-mail: milto_bio@mail.ru
Поступила в редакцию 12.02.2020
После доработки 17.02.2020
Принята к публикации 17.02.2020
Аннотация
Модифицированные хитозаном наночастицы магнетита являются перспективной основой для создания новых диагностических и терапевтических препаратов. В работе изучены клетки эритроцитарного, гранулоцитарного, моноцитарного, лимфоцитарного и тромбоцитарного дифферонов костного мозга половозрелых крыс в течение 120 сут после однократного внутривенного введения суспензии модифицированных хитозаном наночастиц магнетита (Fe3O4) в дозе 0.14 г на 1 кг массы тела. С использованием световой микроскопии описана структура гемопоэтических клеток и выполнено морфометрическое исследование мазков костного мозга, окрашенных по методу Романовского–Гимзы: определён размер клеток (мкм) и их относительное количество (%). Проведено сравнение биологических эффектов немодифицированных и модифицированных хитозаном наночастиц магнетита на гемопоэтические клетки костного мозга, показаны преимущества модификации. Модифицированные хитозаном наночастицы магнетита не влияют на структуру гемопоэтических клеток костного мозга крыс, а их введение вызывает обратимое повышение относительного количества моноцитов, палочкоядерных и сегментоядерных нейтрофилов, а также полихроматофильных и оксифильных нормобластов.
В последние десятилетия в связи с интенсивным развитием нанотехнологий, отмечается рост производства высокотехнологичных продуктов на основе наночастиц, который сопровождается увеличением их влияния на здоровье человека (Gaharwar, Paulraj, 2015). Следует отметить, что современный человек постоянно сталкивается в повседневной жизни с воздействием наночастиц, которые могут поступать в организм ингаляционно, перорально или резорбтивно (Oberdoster et al., 2005). Кроме того, использование наноматериалов в медицинских целях может сопровождаться их парентеральным введением в организм. Детальное исследование биологических свойств наноматериала является обязательным этапом изучения любого его вида для биомедицинского применения (Easo, Mohanan, 2015).
Наночастицы магнетита (НЧМ) являются перспективным материалом для целевой магнитоуправляемой доставки лекарственных препаратов, локальной гипертермии, а также разработки контрастных препаратов для магнито-резонансной терапии. Несмотря на активное изучение и использование НЧМ в биомедицинских целях, их безопасность является дискуссионной (Oberdoster et al., 2005; Wu et al., 2010; Couto et al., 2015). Использование НЧМ в диагностических и терапевтических целях требует повышения соотношения польза-риск, что обуславливает необходимость применения НЧМ только после их предварительной модификации (Couto et al., 2014).
Данные о токсичности ряда наноматериалов (золото, оксид титана, углеродные нанотрубки, оксид железа(III), магнетит), представленные в научной литературе, получены, главным образом, in vitro (Easo, Mohanan, 2015; Wu et al., 2017). Так, большинство работ по изучению влияния НЧМ на клетки костного мозга и форменные элементы крови выполнено на клеточных культурах (Ruiz et al., 2015). Однако полученные в культуральных исследованиях данные полностью не отражают возможные эффекты НЧМ при их введении в организм. В связи с этим требуется изучение биологических свойств НЧМ на организменном уровне. Сведения о биологических эффектах НЧМ на различные системы организма крайне противоречивы (Paik et al., 2015). Ввиду того, что после проникновения в организм распределение НЧМ осуществляется гематогенно, изучение их влияния на костный мозг представляется наиболее актуальной задачей.
Цель настоящей работы заключалась в описании структуры клеток основных гемопоэтических дифферонов костного мозга и динамики гемопоэза у крыс после однократного внутривенного введения суспензии модифицированных хитозаном НЧМ.
МАТЕРИАЛ И МЕТОДИКА
Приготовление суспензии немодифицированных наночастиц магнетита (НМ-НЧМ) и модифицированных наночастиц магнетита (М-НЧМ). Наночастицы FeO · Fe2O3 (Fe3O4) являются сферическими частицами, которые получены механохимическим способом в отделе структурной макрокинетики ТНЦ СО РАН (г. Томск). НЧМ представлены агломератами размером 200–300 нм, состоящими из слабо связанных друг с другом сферических частиц, средний диаметр которых составляет 7 нм. Площадь удельной поверхности НЧМ 150 м2/г.
Суспензию НМ-НЧМ готовили, растворяя навеску сухого порошка НЧМ в водно-солевом стабилизирующем растворе (pH 7.4), содержащем хлорид натрия, цитрат натрия и динатриевую соль HEPES. Полученную суспензию подвергали сонификации (22 кГц) на ультразвуковом дезинтеграторе УЗДН-2Т (Укрросприбор, Украина) в течение 10 мин для разрушения агломератов НЧМ. После дезинтеграции суспензию центрифугировали (500 g) в течение 10 мин для осаждения агломератов НЧМ. Супернатант отбирали и фильтровали через поликарбонатные фильтры с диаметром пор 100 нм под избыточным давлением аргона (15 атм), после чего использовали для исследования.
Для приготовления М-НЧМ хитозан растворяли в 0.06%-ном водном растворе лимонной кислоты. Раствор хитозана (1 г/л) и стабилизированную суспензию НМ-НЧМ (в соотношении 1 : 1) перемешивали на магнитной мешалке в течение 3-х ч при комнатной температуре. Доводили рН полученной суспензии до 7.4 водным раствором гидроксида натрия (0.1 М), после чего подвергали сонификации на ультразвуковом дезинтеграторе УЗДН-2Т (22 кГц) в течение 10 мин. Суспензию М-НЧМ фильтровали через поликарбонатные фильтры с диаметром пор 100 нм под избыточным давлением аргона, после чего использовали для исследования.
Стандартизация суспензий НМ-НЧМ и М-НЧМ. Концентрацию НЧМ в суспензиях определяли рентгено-флуоресцентным методом по концентрации атомарного железа на спектрометре Quant’X (Thermo Scientific, Швейцария).
Распределение структурных элементов суспензий по размерам устанавливали методом динамического светорассеяния на приборе Zetasizer Nano ZS (Malvern Instruments, Великобритания).
Форму и структуру частиц в суспензиях определяли с помощью трансмиссионного электронного микроскопа JEM-100 CX II (JEOL, Япония).
Дизайн эксперимента. Исследование проведено на 128 беспородных половозрелых (4 мес.) крысах-самцах, массой 150 ± 30 г, из которых было сформировано 4 группы: 1) интактная группа (24 крысы); 2) группа “Хитозан” (24 крысы), которой вводили 2.5 мл раствора хитозана (6.25 мг на 1 кг массы тела); 3) группа НМ-НЧМ (40 крыс), которой вводили 2 мл суспензии немодифицированных НЧМ (0.14 г Fe3O4 на 1 кг массы тела); 4) группа М-НЧМ (40 крыс), которой вводили 2.5 мл суспензии НЧМ, модифицированных хитозаном (Fe3O4 на 1 кг массы тела).
Работа с животными. Раствор хитозана, суспензию НМ-НЧМ и М-НЧМ вводили животным внутривенно через одну из хвостовых вен. Содержание, питание, уход и выведение крыс из эксперимента осуществляли в соответствии с Правилами проведения работ с использованием экспериментальных животных (Приказ Минздрава РФ № 755 от 12.08.1987 г.). Внутривенные инъекции крысам проводили в фиксаторе Когана. Выведение крыс из эксперимента осуществляли путём асфиксии углекислым газом через 1, 7, 14, 21, 40, 60, 90 и 120 сут после инъекции. Взятие костного мозга у животных всех 4-х групп производили в одни и те же сроки.
Приготовление гематологических препаратов. Из костного мозга грудины крыс в течение 2–3 мин после смерти животного готовили мазки, которые высушивали, фиксировали в абсолютном метаноле и окрашивали азуром II и эозином по методу Романовского−Гимзы. Из костного мозга каждого животного готовили по 3 мазка. Окрашивание мазков костного мозга проводили согласно инструкции производителя раствора азур-эозин по Романовскому (МиниМед-Р, Россия).
Исследование гематологических препаратов. Исследование окрашенных мазков костного мозга осуществляли с помощью светового микроскопа Axioscope 40 (Zeiss, Германия) с использованием объектива 100× с масляной иммерсией). На препаратах костного мозга крыс оценивали структуру гемопоэтических клеток и подсчитывали миелограмму. Для определения миелограммы считали не менее 1000 клеток мазка костного мозга по правилу меандров. Фотосъемку препаратов костного мозга выполняли с помощью цифровой камеры Canon G5 (Canon, Япония). Определение размеров клеток костного мозга проводили по фотографиям с помощью программы ImageJ 1.48 (NIH Image, США).
Статистическая обработка результатов. Использовали программу “SPSS 17.0” (IBM, США). Результаты представлены в виде медианы (Ме), а также нижнего (Q25) и верхнего (Q75) квартилей. Так как распределение не соответствовало нормальному (критерий Шапиро−Уилкса), то для выяснения достоверности различий морфометрических показателей между экспериментальными группами использовали критерий Манна−Уитни для независимых выборок (Р < 0.05). Для сравнения параметров внутри групп применяли критерий Вилкоксона для зависимых выборок (Р < 0.05).
Реактивы: азур-эозин по Романовскому (МиниМед-Р, Россия), гидроксид натрия (РЕАХИМ, Россия), динатриевая соль HEPES (AppliChem GmbH, Германия), лимонная кислота (РЕАХИМ, Россия), хитозан (Sigma Aldrich, Япония), хлорид натрия (РЕАХИМ, Россия), цитрат натрия (РЕАХИМ, Россия).
РЕЗУЛЬТАТЫ
Эритроцитарный дифферон. Нами не выявлено нарушения структуры клеток эритроцитарного дифферона крыс ни в одной из экспериментальных групп в течение 120 сут. Относительное количество клеток эритроцитарного дифферона в костном мозге крыс представлено в табл. 1. В мазках костного мозга крыс всех 4-х групп в течение всего эксперимента определяются следующие клетки эритроцитарного дифферона: эритробласты, пронормобласты, а также базофильные, полихроматофильные и оксифильные нормобласты. Средний диаметр соответствующих клеток крыс всех экспериментальных групп в исследуемые сроки не изменяется.
Таблица 1.
Динамика относительного количества клеток эритроцитарного дифферона и дифферона нейтрофила в костном мозге крыс в различные сроки после внутривенного введения немодифицированных (НМ-НЧМ) и модифицированных хитозаном (М-НЧМ) наночастиц, а также хитозана
| Группа | Экспериментальный срок, сут | |||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 7 | 14 | 21 | 40 | 60 | 90 | 120 | |
| Относительное количество клеток эритроцитарного дифферона, % | ||||||||
| Интактная | 33.2 (27.2; 40.4) |
45.6 (40.8;49.7) |
46.7 (37.4; 57.7) |
36.6 (29.6; 48.1) |
37.8 (33.0; 47.1) |
35.6 (34.3; 47.5) |
45.5 (31.3; 55.4) |
40.2 (30.5; 43.1) |
| Хитозан | 34.5 (29.1; 43.1) |
35.4 (27.0; 40.9) |
35.6 (26.3; 44.8) |
36.4 (26.3; 41.5) |
36.6 (25.9; 43.1) |
34.4 (30.6; 38.9) |
35.8 (24.6; 37.4) |
37.0 (30.9; 40.6) |
| НМ-НЧМ | 29.6 a (21.8; 40.1) |
29.5a (21.8; 35.4) |
23.0a (19.5; 53.8) |
34.6 (21.2; 38.2) |
35.0 (34.1; 44.0) |
42.0 (28.8; 46.0) |
35.6 (32.0; 49.3) |
39.4 (31.6; 46.1) |
| М-НЧМ | 34.5 (26.3; 36.8) |
32.2 (28.2; 40.2) |
36.0 (28.2; 41.8) |
29.0a (25.8; 39.5) |
28.1a (26.6; 33.2) |
28.7a (26.9; 32.3) |
31.4 (24.1; 43.1) |
32.3 (25.3; 46.8) |
| Относительное количество клеток дифферона нейтрофила, % | ||||||||
| Интактная | 34.5 (28.4; 47.4) |
36.1 (28.9; 45.8) |
36.0 (32.4; 39.0) |
36.0 (32.9; 39.8) | 34.5 (28.7; 47.8) | 36.1 (26.0; 40.4) |
37.0 (31.2; 43.4) |
35.0 (29.8; 43.6) |
| Хитозан | 38.0 (32.7; 44.0) |
34.4 (28.7; 42.4) |
38.4 (17.7; 45.3) |
48.2а (43.5; 50.7) |
39.9а (33.6;50.3) |
48.6а (42.5; 53.2) |
37.2 (34.5; 42.7) |
35.6 (32.9; 39.4) |
| НМ-НЧМ | 55.0a (41.5; 69.5) |
50.6a (39.2; 57.8) |
35.0в (30.5; 42.6) |
36.0 (33.3; 37.5) |
36.0a, б (27.0; 43.6) |
35.0 (31.2; 41.1) |
34.0 (26.7; 38.2) |
35.5 (33.4; 41.4) |
| М-НЧМ | 37.5 (33.5; 40.5) |
39.8 (35.0; 41.0) |
44.2 (27.5; 47.0) |
54.6a, б, в (49.3; 58.2) |
55.3 (51.0; 59.2) |
55.4a, б (51.4; 60.7) |
33.5в (29.3; 49.6) |
35.5 (25.6; 64.6) |
Результаты представлены в виде медианы, в скобках указаны значения нижнего и верхнего квартилей (Q25; Q75). a Отличие от соответствующего показателя крыс интактной группы; б отличие от соответствующего показателя крыс группы НМ-НЧМ; в отличие от показателя предыдущего срока этой же группы. Уровень значимости Р < 0.05.
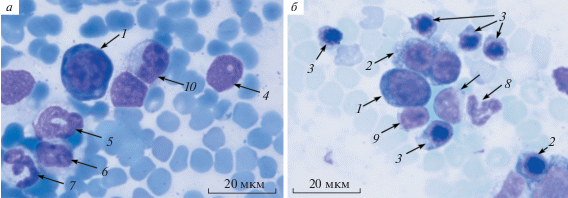
Эритробласты. Это круглые крупные клетки с диаметром в среднем 14.00 (13.33; 15.23) мкм с ультрабазофильной цитоплазмой и крупным круглым ядром, в котором преобладает эухроматин (структура хроматина сетчатая, содержится 1–2 ядрышка) (рис. 1а).
Рис. 1.
Костный мозг крысы из группы, которой вводили суспензию НЧМ, модифицированных хитозаном (М-НЧМ), через 7 (а) и (б) 40 сут. Эритробласт (1), базофильный нормобласт (2), полихроматофильный нормобласт (3), нейтрофильный миелоцит (4), нейтрофильный метамиелоцит (5), эозинофильный метамиелоцит (6), палочкоядерный нейтрофил (7), сегментоядерный нейтрофил (8), лимфоцит (9), моноцит (10). Окраска: азур II–эозин.
Пронормобласты – круглые клетки диаметром в среднем 10.70 (10.15; 11.95) мкм с базофильной цитоплазмой и крупным круглым ядром, в котором преобладает эухроматин сетчатой структуры, и ядрышки не определяются.
Базофильные нормобласты – круглые мелкие клетки диаметром в среднем 9.30 (8.40; 9.90) мкм с умеренно базофильной цитоплазмой и круглым ядром, в котором преобладает гетерохроматин (структура хроматина зернистая, ядрышки не определяются) (рис. 1б).
Полихроматофильные нормобласты – круглые мелкие клетки диаметром в среднем 7.25 (6.90; 7.80) мкм. Цитоплазма – полихромная (слабо базофильная или серо-розоваяй) ядро – круглое, в котором преобладает гетерохроматин (структура хроматина плотная, ядрышки не определяются) (рис. 1б).
Оксифильные нормобласты – круглые мелкие клетки диаметром в среднем 6.45 (5.98; 6.83) мкм с оксифильной цитоплазмой и круглым пикнотичным ядром.
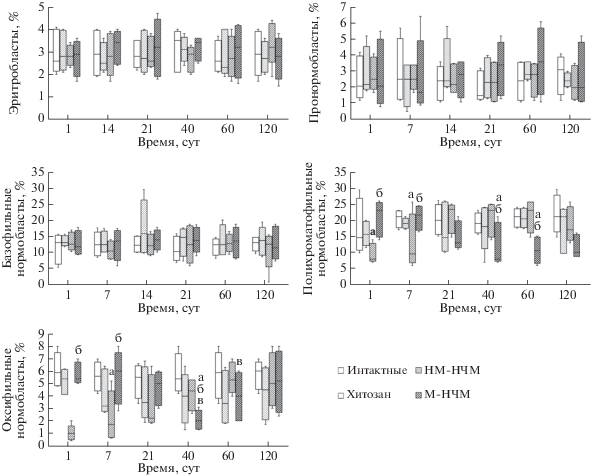
Введение НМ-НЧМ сопровождается снижением через 1 и 7 сут относительного количества полихроматофильных и оксифильных нормобластов, по сравнению с аналогичным показателем интактных крыс. Модифицированные хитозаном М-НЧМ вызывают аналогичные изменения клеток эритроцитарного дифферона (рис. 2), но на более поздних сроках (с 14 по 40 сут).
Рис. 2.
Динамика относительного количества клеток (%) эритроцитарного дифферона в костном мозге интактных крыс и крыс, которым вводили суспензию или хитозана (Хитозан), или немодифицрованных НЧМ (НМ-НЧМ), или модифицированных хитозаном НЧМ (М-НЧМ), в течение 120 сут. Здесь и на рис. 3, 4: результаты представлены в виде медианы (Me) и нижнего (Q25) и верхнего (Q75) квартилей; достоверность различий соответствующих показателей при Р < 0.05 показана буквами: от интактной группы (а), от группы НМ-НЧМ (б), от показателя предыдущего срока той же группы (в).
Гранулоцитарный дифферон. Нами не выявлено нарушения структуры клеток гранулоцитарного дифферона костного мозга крыс ни в одной из экспериментальных групп в течение 120 сут. Гранулоцитарный дифферон в костном мозге крыс представлен миелобластами, промиелоцитами (нейтрофильными, эозинофильными и базофильными), миелоцитами (нейтрофильными, эозинофильными и базофильными), метамиелоцитами (нейтрофильными, эозинофильными и базофильными), палочкоядерными и сегментоядерными гранулоцитами (нейтрофилами, эозинофилами и базофилами).
Миелобласты. Это округлые клетки диаметром в среднем 15.70 (14.30; 16.30) мкм. Цитоплазма – базофильная, в ней могут встречаться единичные азурофильные гранулы, ядро – крупное круглое, в котором преобладает эухроматин (структура хроматина сетчатая, есть 1–2 ядрышка).
Промиелоциты – крупные округлые клетки диаметром в среднем 17.30 (16.60; 18.80) мкм с крупным центрально расположенным ядром (хроматин имеет более грубую структуру, чем у миелобласта), содержащем 1–2 ядрышка. В обильной слабо базофильной цитоплазме определяется азурофильная зернистость и появляются специфическая зернистость, которая у нейтрофилов представлена мелкими (пылевидными) оксифильными гранулами (нейтрофильная зернистость), у эозинофилов – крупными оксифильными гранулами (эозинофильная зернистость), у базофилов – крупными базофильными гранулами (базофильная зернистость). Предшественники нейтрофилов и эозинофилов со стадии промиелоцита представлены двумя формами клеток: с круглыми и торовидными или кольцевидными ядрами.
Миелоциты – округлые клетки диаметром в среднем 14.60 (13.60; 15.90) мкм с бобовидным или торовидным, эксцентрично расположенным ядром (структура хроматина грубая, ядрышки не определяются). Цитоплазма – голубовато-розовая с хорошо выраженной специфической зернистостью. Азурофильная зернистость не определяется (рис. 1а, б).
Метамиелоциты – округлые клетки диаметром в среднем 12.90 (12.15; 13.80) мкм с бобовидным или кольцевидным, эксцентрично расположенным ядром (структура хроматина глыбчатая, ядрышки отсутствуют). В розовой цитоплазме хорошо определяется специфическая зернистость (рис. 1а).
Палочкоядерные нейтрофилы всех экспериментальных групп – округлые клетки диаметром в среднем 11.40 (10.20; 12.25) мкм с незамкнутым или кольцевидным несегментированным ядром (рис. 1а).
Сегментоядерные нейтрофилы крыс всех 4-х групп представляют собой округлые клетки диаметром в среднем 11.40 (10.86; 12.12) мкм с сегментированным незамкнутым гиперхромным ядром, имеющем 4–5 перетяжек (рис. 1б).
Цитоплазма нейтрофилов слабо оксифильна и заполнена большим количеством мелких оксифильных гранул. Повышение относительного количества нейтрофилов и их предшественников в костном мозге крыс после введения М-НЧМ отмечается в течение 21–40 сут (рис. 3). Относительное количество клеток дифферона нейтрофила в костном мозге крыс в течение эксперимента у животных исследованных групп представлено в табл. 1.
Рис. 3.
Динамика относительного количества клеток (%) дифферона нейтрофила в костном мозге крыс интактных и в экспериментальных группах в течение 120 сут. Все объяснения те же, что и к рис. 2.

На мазках костного мозга крыс всех экспериментальных групп определяются эозинофильные промиелоциты, эозинофильные миелоциты, эозинофильные метамиелоциты, палочкоядерные и сегментоядерные эозинофилы.
Палочкоядерные эозинофилы (9.40 (9.00; 11.65) мкм в диаметре) представлены в мазках клетками с незамкнутым или кольцевидным несегментированным ядром. Сегментоядерные эозинофилы (11.93 (11.76; 12.42) мкм в диаметре) имеют незамкнутое сегментированное гиперхромное ядро. Палочкоядерные и сегментоядерные эозинофилы содержат в цитоплазме большое количество крупных интенсивно оксифильных гранул.
Клетки дифферона базофила определяются в мазках костного мозга крыс в течение эксперимента в небольшом количестве и представлены базофильными промиелоцитами, базофильными миелоцитами, базофильными метамиелоцитами, палочкоядерными и сегментоядерными базофилами.
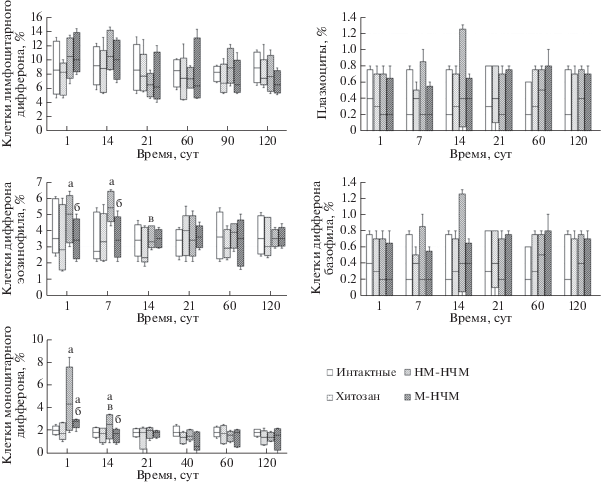
Динамика относительного количества клеток дифферона эозинофила и дифферона базофила в течение 120 сут эксперимента представлена на рис. 4.
Рис. 4.
Динамика относительного количества клеток (%) лимфоцитарного и моноцитарного дифферонов, а также дифферонов эозинофила и базофила в костном мозге крыс интактных и крыс в экспериментальных группах в течение 120 сут. Все объяснения те же, что и к рис. 2.
Моноцитарный дифферон. Клетки моноцитарного дифферона костного мозга крыс 4-х экспериментальных групп представлены монобластами, промоноцитами и моноцитами. Монобласты костного мозга крыс всех групп представлены крупными округлыми клетками (15.15 (13.5; 17.18) мкм в диаметре) с центрально расположенным ядром, имеющим хроматин нежно сетчатой структуры и 1–3 ядрышка. Цитоплазма монобласта базофильна, лишена гранул и в виде узкой каймы окружает ядро. Промоноциты – округлые клетки (13.20 (12.55; 14.20) мкм в диаметре) с одним бобовидным крупным ядром, которое смещено на периферию. В ядре определяются хроматин более грубой структуры, чем у монобласта и 1–2 ядрышка. Цитоплазма имеет серо-голубой цвет и окружает ядро в виде широкой каймы.
Моноциты костного мозга крыс всех групп являются крупными округлыми клетками (13.87 (12.24; 14.61) мкм в диаметре) с овальным или бобовидным ядром, в котором преобладает эухроматин. Слабо базофильная цитоплазма моноцитов хорошо выражена и содержит единичные азурофильные гранулы (рис. 1а). Повышение относительного количества моноцитов и их предшественников в костном мозге крыс после введения М-НЧМ отмечается в течение 40 сут. В мазках костного мозга также присутствует небольшое количество макрофагов (15.50 (14.95; 16.35) мкм в диаметре), количество которых не отличается у крыс экспериментальных групп и не изменяется в течение 120 сут.
Лимфоцитарный дифферон. Клетки лимфоцитарного дифферона в костном мозге крыс всех экспериментальных групп представлены лимфобластами, пролимфоцитами и лимфоцитами. Лимфобласты – округлые клетки (9.90 (9.38; 10.68) мкм в диаметре) с одним крупным круглым, центрально расположенным ядром (структура хроматина нежно сетчатая, определяется 1–2 ядрышка). Слабо базофильная цитоплазма лимфобласта имеет светлую перинуклеарную зону и окружает ядро в виде умеренно выраженной каймы. Пролимфоциты – округлые клетки (8.50 (7.80; 8.70) мкм в диаметре) с одним крупным круглым или овальным, центрально или периферически расположенным ядром (структура хроматина тонкопетлистая и мелкоглыбчатая, могут определяться 1–2 ядрышка). Цитоплазма пролимфоцита умеренно выражена и слабо базофильна. Лимфоциты костного мозга крыс всех экспериментальных групп представлены мелкими круглыми клетками (8.67 (8.00; 10.16) мкм в диаметре) с крупным гиперхромным округлым ядром, которое окружено узкой полоской базофильной цитоплазмы (рис. 1б). В цитоплазме лимфоцитов встречаются единичные азурофильные гранулы.
Плазматические клетки. Эти клетки также определяются в костном мозге крыс. Они представляют собой округлые клетки (11.00 (10.55; 12.80) мкм в диаметре) с мелким эксцентрично расположенным ядром и базофильной цитоплазмой. Ядро плазмоцитов часто имеет характерную структуру – гетерохроматин формирует радиальные тяжи. Мы не наблюдали изменения их относительного количества у крыс в течение эксперимента ни в одной из групп.
Относительное количество клеток моноцитарного и лимфоцитарного дифферонов в костном мозге крыс всех экспериментальных групп в течение эксперимента представлено на рис. 4.
Тромбоцитарный дифферон. На мазках костного мозга крыс тромбоцитарный дифферон характеризовали по структуре и количеству мегакариоцитов. Мегакариоциты крыс всех экспериментальных групп в течение 120 сут представлены крупными клетками (49.90 (37.75; 69.65) мкм в диаметре) неправильной формы с крупным дольчатым ядром и обильной слабо базофильной цитоплазмой, содержащей мелкие оксифильные гранулы. Относительное количество мегакариоцитов у крыс не меняется в течение эксперимента, не отличается между экспериментальными группами и не превышает 0.4%.
ОБСУЖДЕНИЕ
Активное биомедицинское исследование НЧМ определяется их многофункциональностью, малым размером частиц, низкой токсичностью (LD50 составляет приблизительно около 1 г на 1 кг массы тела), суперпарамагнитными свойствами и биосовместимостью (Couto et al., 2014; Wu et al., 2017). В водных растворах НМ-НЧМ подвергаются агрегации, что уменьшает время их циркуляции в крови, затрудняет выведение из организма и сопровождается накоплением в клетках (Chen et al., 2018). Модификация поверхности препятствует агрегации НЧМ, предотвращает интернализацию НЧМ или способствует ей, а также препятствует образованию свободных ионов железа, снижая токсичность наноматериала (Couto et al., 2015; Wu et al., 2017; Chen et al., 2018). Для модификации поверхности НЧМ часто используют биодеградируемые полимеры (декстран, крахмал, полиакриловую кислоту, полимолочнуюя кислоту и др.) (Wu et al., 2017).
Несмотря на длительное изучение биологических свойств НЧМ, многие аспекты их влияния на организм (гемосовместимость, цитотоксичность) неоднозначны и требуют индивидуального исследования. Противоречивость сведений о биологических эффектах НЧМ объясняется широким варьированием их физико-химическими свойств в зависимости от размера, формы и заряда частиц, площади удельной поверхности, способа поверхностной модификации, химических особенностей покрытия и др. (Paik et al., 2015; Chen et al., 2018). Модифицированные НЧМ должны обладать низкой реакционной способностью и токсичностью, а также высокой биосовместимостью и биоэлиминацией.
Применение в нашем исследовании НЧМ в дозе 0.14 г/кг, которая превышает планируемую для них терапевтическую дозу, связано со стремлением к выявлению негативных эффектов модифицированных хитозаном НЧМ. Следует отметить, что аналогичную дозу НЧМ мы использовали в предварительных исследованиях биологических свойств НЧМ (Мильто, Суходоло, 2012). В настоящее время модифицированные НЧМ используются в медицине в качестве препаратов для визуализации магнито-резонансной томографии (Endorem®, Resovist®, Combidex® и др.). Для сравнения: рекомендованная доза препарата Endorem (Guerbert) составляет 0.56 мг Fe3O4 на 1кг массы тела (Ruiz et al., 2015).
Одним из перспективных биодеградируемых природных соединений для поверхностной модификации наноматериалов является полисахарид хитозан. Данные литературы указывают на отсутствие у него токсического действия на клетки: так для лабораторных мышей LD50 хитозана при пероральном введении составляет 16 г/кг (Agnihotri et al., 2004).
Стабилизирующий раствор, который используется в нашем исследовании, не обладает цитотоксичностью, так как его компоненты традиционно используются при культивировании клеток (Мильто, Суходоло, 2012; Paik et al., 2015).
Костный мозг является основным органом кроветворения и центральным органом иммунной системы крыс, который обеспечивает дифференцировку эритроцитов, гранулоцитов, моноцитов, лимфоцитов, тромбоцитов, а также тучных и миелоидных дендритных клеток. В костном мозге крыс мы описывали структуру клеток эритроцитарного, гранулоцитарного, моноцитарного, лимфоцитарного и тромбоцитарного дифферонов, которые возможно идентифицировать при использовании стандартных гематологических методов окрашивания (азур II-эозин), но есть еще клетки 4-, 5- и 6-ого классов по схеме кроветворения Воробьева−Черткова. Взаимодействие НЧМ с клетками костного мозга сопровождается влиянием наночастиц на пролиферацию, метаболическую активность, секрецию цитокинов и гибель гемопоэтических клеток (Gaharwar, Paulraj, 2015).
Наблюдаемое в работе увеличение относительного количества полихроматофильных и оксифильных нормобластов свидетельствует об активации эритропоэза у крыс после введения модифицированных хитозаном НЧМ. Активация эритропоэза может являться компенсаторной реакцией на внутрисосудистый гемолиз эритроцитов. Так, показано, что инкубация эритроцитов с НЧМ приводит к повреждению плазмолеммы эритроцитов и изменению их морфометрических параметров, сдвигу эритрограммы в сторону предгемолитических форм (Плескова и др., 2017).
Другой причиной активации эритропоэза может быть увеличение содержания ионов железа в организме крыс, связанное с метаболизированием НЧМ в клетках системы мононуклеарных фагоцитов (МНФ). Показано, что макрофаги обеспечивают внутриклеточную деградацию НЧМ с переводом железа в ионную форму и депонированием его в составе ферритина (Wu et al., 2010; Wu et al., 2017; Chen et al., 2018). Стимулирование клеток эритроцитарного дифферона также можно объяснить влиянием цитокинов, выделяемых клетками системы МНФ после фагоцитоза НЧМ. Например, модифицированные алкилполиэтиленимином наночастицы оксида железа (III), индуцируют синтез и секрецию макрофагами разных интерлейкинов (ИЛ1β, ИЛ6, ИЛ8, ИЛ10) и фактора некроза опухолей (Chen et al., 2018). Более краткосрочное (1–14 сут) влияние на эритропоэз крыс после введения немодифицированных НЧМ по сравнению с модифицированными хитозаном НЧМ, объясняется меньшим временем их циркуляции в крови вследствие фагоцитоза клетками системы МНФ печени и селезeнки.
Данные о влиянии модифицированных НЧМ на гранулоцитарный дифферон противоречивы. Так, внутривенное введение модифицированных полиэтиленгликолем НЧМ сопровождается увеличением количества лейкоцитов в крови крыс (Ruiz et al., 2015). Тогда как инкубация модифицированных полиакриламидом или полиакриловой кислотой НЧМ с нейтрофилами крови человека стимулирует апоптоз нейтрофилов, повышая активность каспазы 3 (Couto et al., 2014).
В нашем исследовании после введения суспензий НЧМ наблюдается увеличение относительного количества нейтрофилов и их предшественников, что связано с их участием в элиминации НЧМ из организма. НМ-НЧМ вызывают активацию нейтрофилопоэза через 1–14 сут, при этом их эффект более выраженный и краткосрочный по сравнению с НЧМ, модифицированными хитозаном, которые повышают относительное количество клеток дифферона нейтрофила в течение 21–60 сут.
Следует отметить, что внутривенное введение раствора хитозана также сопровождается активацией нейтрофилопоэза у крыс, обусловленной участием нейтрофилов в гидролизе этого полисахарида за счeт наличия лизоцима и хитиназ (Aiba, 1992; Kzhyshkowska et al., 2007). Вследствие этого, отчасти увеличение относительного количества клеток дифферона нейтрофила после введения модифицированных хитозаном НЧМ в настоящей работе обусловлено влиянием хитозана. Внутривенное введение НЧМ не сопровождается изменением относительного количества клеток дифферонов эозинофила и базофила по сравнению с аналогичными показателями животных интактной группы в течение 120 сут. Особенностью гранулоцитарного дифферона крыс является наличие наряду с типичными предшественниками гранулоцитов клеток, имеющих кольцевидные ядра (характерно только для предшественников нейтрофилов и эозинофилов). Кроме того, нейтрофилы и их предшественники имеют оксифильную специфическую зернистость (Bolliger, 2004).
Моноциты и их предшественники (монобласты, промоноциты) представлены в костном мозге интактных крыс в небольшом количестве. Следует отметить, что предшественники моноцитов довольно трудно достоверно идентифицировать в мазках костного мозга при окраске по методу Романовского−Гимзы (Bolliger, 2004). Увеличение относительного количества клеток моноцитарного дифферона в костном мозге крыс после введения суспензий НЧМ объясняется участием этих клеток в элиминации НЧМ из организма. Более продолжительное повышение относительного количества клеток моноцитарного дифферона после введения М-НЧМ (1–40 сут) по сравнению с НМ-НЧМ (1–14 сут) объясняется влиянием хитозана, который является естественным стимулятором моноцитов и макрофагов.
Следует отметить, что покрытие хитозаном способствует увеличению времени циркуляции НЧМ в крови и их более длительному поглощению клетками системы МНФ. Помимо этого, имеет место прямое (взаимодействие с НЧМ) и опосредованное (действие цитокинов) влияние НЧМ на клетки дифферона моноцита. Так, при добавлении НЧМ, модифицированных декстраном, в культуру моноцитов, в цитоплазме последних определяются свободные НЧМ и НЧМ в составе везикул. Содержание железа внутри моноцита через 24 ч инкубации с НЧМ возрастет с 0.07 до 5 пг (Paik et al., 2015; Chen et al., 2018).
Количество лимфоцитов и их предшественников (лимфобласты, пролимфоциты) в костном мозге зависит от возраста животного: у молодых крыс относительное количество лимфоцитов больше, чем у взрослых животных. При подсчете клеток лимфоцитарного дифферона необходимо указывать возраст животного (Bolliger, 2004). Лимфобласты и пролимфоциты присутствуют в костном мозге в незначительном количестве, их достоверная идентификация при использовании рутинных методов гематологического окрашивания затруднена. Внутривенное введение НЧМ не сопровождается изменением относительного количества клеток лимфоцитарного дифферона костного мозга по сравнению с аналогичными показателями животных интактной группы, что объясняется незначительным участием этих клеток в элиминации НЧМ.
Итак, НЧМ, модифицированные хитозаном, не влияют на структуру гемопоэтических клеток костного мозга крыс, а их применение сопровождается обратимыми изменениями гемопоэза, которые связаны с увеличением относительного количества клеток, участвующих в элиминации НЧМ.
Список литературы
Мильто И.В., Суходоло И.В. 2012. Структура печени, лёгкого, почек, сердца и селезенки крыс после многократного внутривенного введения суспензии наноразмерных частиц магнетита. Вестник РАМН. Т. 67.№ 3. С. 75. (Milto I.V., Sukhodolo I.V. 2012. The structure of liver, lung, kidneys, heart and spleen of rats after repeated intravenous application of nanoparticles magnetite. Vestnik RAMN. V. 67. № 3. P. 75.)
Плескова С.Н., Горностаева Е.Е., Крюков Р.Н., Боряков А.В., Зубков С.Ю. 2017. Изменения архитектоники и морфометрических характеристик эритроцитов под воздействием наночастиц магнетита. Цитология. Т. 59. № 12. С. 874. (Pleskova S.N., Gornostaeva E.E., Kryukov R.N., Boryakov A.V., Zubkov S.Yu. 2017. Changes in the architectonics and the morphometric characteristics of erythrocytes under the influence of magnetite nanoparticles. Cell Tiss. Biol. (Tsitologiya). V.59. P. 874.)
Agnihotri S.A., Mallikarjuna N.N., Aminabhavi T.M. 2004. Recent advances on chitosan-based micro- and nanoparticles in drug delivery. J. Contr. Release. V. 100. P. 5.
Aiba S. 1992. Studies on chitosan: Lysozymic hydrolysis of partially N-acetylated chitosans. Int. J. Biol. Macromol. V. 14. P. 225.
Bolliger A.P. 2004. Cytologic evaluation of bone marrow in rats: indications, methods, and normal morphology. Vet. Clin. Pathol. V. 33. P. 58.
Chen S., Chen S., Zeng Y., Lin L., Wu C., Ke Y., Liu G. 2018. Size-dependent superparamagnetic iron oxide nanoparticles dictate interleukin-1β release from mouse bone marrow derived macrophages. J. Applied Toxicol. V. 38. P. 978.
Couto D., Freitas M., Vilas-Boas V., Dias I., Porto G., Arturo Lopez-Quintela M., Rivas J., Freitas P., Carvalho F., Fernandes E. 2014. Interaction of polyacrylic acid coated and non-coated iron oxide nanoparticles with human neutrophils. Toxicol. Letters. V. 225. P. 57.
Couto D., Sousa R., Andrade L., Leander M., Lopez-Quintela M.A., Rivas J., Freitas P., Lima M., Porto G., Porto B., Carvalho F., Fernandes E. 2015. Polyacrylic acid coated and non-coated iron oxide nanoparticles are not genotoxic to human T limphocytes. Toxicol. Letters. V. 234. P. 67.
Easo S.L., Mohanan P.V. 2015. In vitro hematological and in vivo immunotoxicity assessment of dextran stabilized iron oxide nanoparticles. Colloids and surfaces B: Biointerfaces. V. 134. P. 122.
Gaharwar U.S., Paulraj R. 2015. Iron oxide nanoparticles induced oxidative damage in peripheral blood cells of rat. J.Bbiomed. Sci. Eng. V. 8 P. 274.
Kzhyshkowska J., Gratchev A., Goerdt S. 2007. Human hitinasees and hitinase-like proteins as indicators for inflammation and cancer. Biomarker Insights. V. 2. P. 128.
Oberdoster G., Oberdoster E., Oberdoster J. 2005. Nanotoxicology: an emerging discipline evolving from studies of ultrafine particles. Envir. Health Persp. V. 113. P. 823.
Paik S.-Y.-R., Kim J.-S., Shin S.J., Ko S. 2015. Characterization, quatification, and determination of the toxicity of iron oxide nanoparticles to the bone marrow cells. Int. J. Mol. Sci. V. 16. P. 22243.
Ruiz A., Ali L.M.A., Caceres-Velez P.R., Cornudella R., Gutierrez M., Moreno J.A., Pinol R., Palacio F., Fascineli M.L., de Azevedo R.B., Morales M.P., Millan A. 2015. Hematotoxicity of magnetite nanoparticles coated with polyethylene glycol: In vitro and vivo study. Toxicol. Res. V. 4. P. 1555.
Wu Q.H., Jin R.R., Feng T., Liu L., Yang L., Tao Y.H., Anderson J.M., Ai H., Li H. 2017. Iron oxide nanoparticles and induced autophagy in human monocytes. Toxicol. Letters. V. 22. P. 57.
Wu W., Chen B., Cheng J., Wang J., Xu W., Liu L., Xia G., Wei H., Wang X., Yang M., Yang L., Zhang Y., Xu C., Li J. 2010. Biocompatibility of Fe3O4/DNR magnetic nanoparticles in the treatment of hematologic malignancies. Int. J. Nanomed. V. 5. P. 1079.
Дополнительные материалы отсутствуют.


