Цитология, 2020, T. 62, № 6, стр. 428-436
Влияние окисленной и восстановленной форм коэнзима Q10 (убихинона и убихинола) на клетки церебрального эндотелия в модели гематоэнцефалического барьера
Н. С. Шаповал 1, *, О. С. Медведев 1, 2, Н. А. Медведева 1, А. В. Моргун 2, Е. Б. Бойцова 2, Е. Д. Осипова 2, А. Б. Салмина 2
1 Московский государственный университет им. М.В. Ломоносова
119192 Москва, Россия
2 Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого Минздрава России
660022 Красноярск, Россия
* E-mail: natali31193@mail.ru
Поступила в редакцию 26.02.2020
После доработки 12.03.2020
Принята к публикации 16.03.2020
Аннотация
Способность коэнзима Q10 проникать через гематоэнцефалический барьер (ГЭБ) делает его потенциальным агентом, оказывающим влияние на метаболизм митохондрий клеток нейроваскулярной единицы головного мозга, однако механизмы проникновения и действия на клетки до конца не изучены. В данной работе проводили изучение проницаемости трехклеточной модели ГЭБ in vitro при действии различных доз и времени действия убихинола (CoQ10H2) и убихинона (CoQ10) с оценкой экспрессии полифункционального белка Rac-1. В ходе исследования влияния препаратов на величину трансэндотелиального сопротивления (ТЭС) было установлено, что CoQ10H2 способен в различных концентрациях по-разному влиять на проницаемость ГЭБ: повышать проницаемость ГЭБ в дозе 1 мкМ и снижать в дозе 10 мкМ. CoQ10 способен повышать проницаемость ГЭБ в дозе 1 мкМ. Регистрация экспрессии белка Rac-1 показала, что оба соединения способны снижать экспрессию Rac-1 в модели ГЭБ в течение 120 мин. Максимальное снижение числа Rac-1 иммунопозитивных клеток наблюдали при воздействии CoQ10H2 в дозе 10 мкМ в течение 15 мин. Учитывая действие CoQ10 и CoQ10H2 в отношении митохондрий, потенциально возможной является вовлеченность митохондриальной активности клеток церебрального эндотелия в регуляцию проницаемости ГЭБ.
Центральная нервная система (ЦНС) отделена от кровеносной и других систем организма эндотелиальными клетками, выстилающими сосуды головного мозга и образующими полупроницаемый барьер – гематоэнцефалический барьер (ГЭБ) (Abbott et al., 2010). Благодаря структурно-функциональным особенностям ГЭБ нейроваскулярная единица (НВЕ) головного мозга является весьма динамичной системой, в которой в полной мере реализуются механизмы защиты головного мозга от токсинов и метаболитов, регуляции кровоснабжения активных участков мозга, избирательного транспорта метаболитов и нейромедиаторов из ткани головного мозга в кровь, а также механизмы нейропластичности (Hawkins, Davis, 2005; Hartmann et al., 2007; Wong et al., 2013; Мельникова, Макарова, 2015). В состав нейроваскулярной единицы головного мозга входят эндотелиоциты, перициты, периваскулярные астроциты, нейроны и, по мнению ряда авторов, клетки микроглии (Hawkins, Davis, 2005; Hartmann et al., 2007). Эндотелиоциты сосудов головного мозга отличаются от эндотелиоцитов сосудов других органов тем, что имеют непрерывные плотные контакты, чем ограничивают проникновение различных веществ в ЦНС (Bradbury, 1993). Еще одной особенностью церебрального эндотелия является высокое содержание митохондрий, практически в 5–6 раз превышающее их содержание в эндотелиальных клетках других органов и тканей (Kluge et al., 2013). Митохондрии выступают главным внутриклеточным источником и мишенью активных форм кислорода (АФК), которые являются постоянными субпродуктами аэробного метаболизма в клетках человека (Yan et al., 2017). Установлено, что с возрастом дыхательная функция митохондрий снижается, а дефекты дыхательной цепи увеличивают продукцию АФК и свободных радикалов в митохондриях. В зависимости от концентрации АФК могут проявлять как анти-, так и проапоптическое воздействие на клетки. Исследования последних лет показали, что митохондрии играют ключевую роль в ранней фазе апоптоза (Sena, Chandel, 2012; Arakawa et al., 2015; Zhang et al., 2018a).
В последнее время уделяется особое внимание перспективному антиоксидантному препарату коэнзиму Q10 (CoQ10). Химически он представляет собой 2,3-диметокси-5-метил-6 декапренил бензохинон и существует в двух формах: окисленной (убихинон, CoQ10) и восстановленной (убихинол, CoQ10H2). От формы зависит, какие свойства он будет проявлять. В процессе восстановления хинона до хинола (CoQ10H2) образуется носитель протонов и электронов (Greenberg, Firishman, 1990; Kumar et al., 2009). Коэнзим Q10 играет важную роль в митохондриальном дыхании и антиоксидантной защите (Tatsuta et al., 2017). Как было показано ранее, CoQ10 способен проникать через ГЭБ (Matthews et al., 1998; Isobe et al., 2010; Tatsuta et al., 2017; Kalenikova et al., 2018). Способность коэнзима Q10 проникать через ГЭБ делает его потенциальным агентом, который может оказывать влияние на митохондриальный метаболизм клеток НВЕ головного мозга. Однако механизмы проникновения, действия и эффекты CoQ10 на клетки до конца не изучены. В связи с вышеизложенным, целью настоящей работы явилось изучение влияния CoQ10 и CoQ10H2 на проницаемость трехклеточной модели ГЭБ in vitro с оценкой экспрессии полифункционального белка Rac-1.
МАТЕРИАЛ И МЕТОДИКА
Исследование проводили на трехклеточной модели ГЭБ in vitro (Хилажева и др., 2015). В состав модели входило три вида клеток: нейроны, астроциты и эндотелиальные клетки. Источником прогениторных клеток для получения нейронов и астроцитов служили клетки головного мозга новорожденных крыс (4 сут после рождения – Р4). Прогениторные клетки головного мозга культивировали с формированием нейросфер. После образования достаточного количества нейросфер проводили их дифференцировку в нейроны и астроциты. Эндотелиальные клетки изолировали из сосудов паренхимы головного мозга крыс (Р10). Все работы проводили на льду в стерильных условиях.
Для получения нейросфер и первичной культуры нейронов и астроцитов новорожденных крыс (Р4) помещали на лед, проводили декапитацию и извлекали головной мозг. Головной мозг помещали в чашку Петри, содержащую ледяной раствор 2% глюкозы в PBS, отделяли кору головного мозга и гиппокамп в культуральной чашке с раствором 2%-ной глюкозы в PBS. Полученную ткань переносили в пробирку со свежим раствором 2%-ной глюкозы в PBS и ждали осаждения кусочков ткани (1–2 мин) с последующим удалением супернатанта, добавлением 1 мл среды NeuroCult® NS-A Proliferation (StemCell, Канада). Проводили тритурацию до получения однородной суспензии клеток и оставляли на 1 мин для осаждения крупных кусочков тканей. Через 1 мин собирали супернатант и переносили в новую стерильную пробирку для центрифугирования при 150 g в течение 5 мин при комнатной температуре. После центрифугирования проводили тритурацию в свежей культуральной среде. Определяли количество клеток с помощью гемоцитометра. Клетки засевали в культуральные флаконы (T 75 см2) в 25 мл культуральной среды. Использовали коммерческую пролиферативную среду NeuroCult® NS-A Proliferation (Stem Cell Technologies, Канада). Клетки инкубировали в условиях CO2-инкубатора (Binder, Германия) при 5% CO2 и температуре 37°C. Смену среды производили каждые 2 сут. После достижения нейросферами размеров 100–150 мкм производили направленную дифференцировку нейросфер в нейроны и астроциты согласно методике, описанной ранее (Khilazheva et al., 2015). Эндотелиальные клетки получали из микрососудов головного мозга крыс (Р10). Выделение и получение первичной культуры клеток проводили в соответствии с протоколом (Liu et al., 2013). Полученные эндотелиальные клетки головного мозга фенотипировали с помощью моноклональных антител к эндотелиальному маркеру (ZO1) по стандартному протоколу иммуногистохимического исследования с использованием первичных анти-ZO1-антител (sc-8147, Santa Cruz Biotechnology Inc., США) и вторичных антител, помеченных флюорохромом Alexa Fluor 488 (ab150117, Abcam, Великобритания).
После образования монослоев клеток (астроциты, нейроны, эндотелиоциты) формировали модель ГЭБ in vitro в культуральном 24-луночном планшете со вставками. Астроциты и нейроны помещали на дно лунки планшета, эндотелиоциты на внутреннюю поверхность культуральной вставки с добавлением культуральной среды. Культивирование продолжалось в течение 2 сут в стандартных условиях СО2-инубатора. После образования монослоев на дне лунок и на вставках помещали культуральные вставки с эндотелиоцитами в лунки планшета, в которых были астроциты и нейроны на дне лунок. Культивировали в стандартных условиях CO2-инкубатора.
Для проведения исследования были сформированы следующие экспериментальные группы: группа клеток модели ГЭБ в планшетах, во вставки которых добавляли 1%-ный раствор CoQ10H2 в дозах 1, 5 и 10 мкМ (Duran-Prado et al., 2014) и инкубировали в течение 15, 120 и 480 мин; группа клеток модели ГЭБ в планшетах, во вставки которых добавляли 1%-ный раствор CoQ10 в дозах 1, 5 и 10 мкМ и инкубировали в течение 15, 120 и 480 мин (Shapoval et al., 2018). Контрольная группа (К) была представлена клетками модели ГЭБ, к которым добавляли питательную среду DMEM в объемах, эквивалентных дозам препаратов (86, 430 и 860 мкл). Контрольная группа с плацебо (растворителем, который использовали для разведения исследуемых препаратов) – группа клеток модели ГЭБ в планшетах, во вставки которых добавляли растворитель (Р) в объемах, эквивалентных дозам препаратов (86, 430 и 860 мкл).
По истечении времени инкубации проводили оценку структурно-функциональной целостности монослоя эндотелиальных клеток во вставках планшетов, после чего клетки фиксировали для дальнейшего иммуногистохимического анализа.
Во всех экспериментальных группах оценку структурно-функциональной целостности монослоя эндотелиальных клеток проводили путем измерения трансэндотелиального сопротивления (ТЭС). Использовали вольтомметр EVOM2 (World Precision Instruments, США) с электродами STX2 с предварительной калибровкой в культуральной среде с культуральной вставкой. Величину ТЭС регистрировали в Ом ⋅ см2. Контрольной группой для результатов, полученных при измерении ТЭС, являлись измерения в лунках, которые проводили перед добавлением исследуемых растворов.
Иммуногистохимическое исследование проводили методом двойного непрямого иммунофлуоресцентного мечения. Окрашивание ядер клеток проводили красителем 4',6-диамидино-2-фенилиндол (DAPI). Для регистрации целевых молекул использовали первичные антитела Rac-1 (ab33186; Abcam, США) в разведении 1 : 50. Вторичными антителами являлись моноклональные антитела, меченные флюорохромом Alexa Fluor 488, (ab150117; Abcam, США) в разведении 1 : 100. Микроскопию клеток осуществляли на флуоресцентном микроскопе ZOE (Bio-Rad, США). Выполняли подсчет относительного количества клеток, экспрессирующих данный антиген, на 500 клеток в образце при анализе не менее 5 полей зрения. При обработке результатов учитывали относительное количество всех клеток, несущих интересующую метку, выраженное в процентах от общего количества клеток. Подсчет меток производили в программе ImageJ (версия 1.52р), статистическую обработку данных – в программе Prism 7 (GraphPad Software, США), методами непараметрической статистики. Для сравнения показателей в независимых выборках применяли критерий Краскела−Уоллиса и критерий Манна−Уитни, с последующими попарными сравнениями. Различия принимали значимыми при p ≤ 0.01. Результаты представлены в виде M ± m, где М – среднее значение, m – ошибка среднего, p – уровень значимости.
РЕЗУЛЬТАТЫ
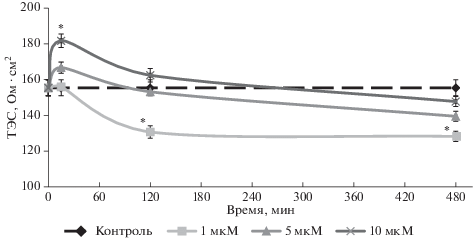
Изменение трансэндотелиального электрического сопротивления. Проницаемость ГЭБ можно оценить по изменению величины ТЭС. При высоких показателях ТЭС проницаемость ГЭБ ниже, и, наоборот, чем ниже значения ТЭС, тем выше проницаемость. В ходе исследования мы обнаружили дозозависимое изменение величины ТЭС в обеих экспериментальных группах. При добавлении в культуральную среду CoQ10H2 в дозе 1 мкМ через 120 мин мы зафиксировали снижение величины ТЭС на 15.9%, которое продолжалось до 480 мин наблюдения, когда величина ТЭС уменьшилась на 17.5%. В дозе 10 мкМ CoQ10H2 повышал ТЭС на 16.9% после 15 мин его воздействия (рис. 1).
Рис. 1.
Изменение величины ТЭС (Ом ⋅ см2) после воздействия CoQ10H2 в дозах 1, 5 и 10 мкМ на клетки модели ГЭБ. Звездочкой показаны статистически значимые отличия от контроля, p ≤ 0.01 (критерий Манна–Уитни).
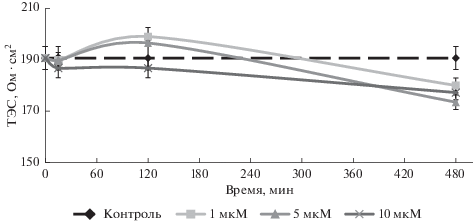
CoQ10 в дозе 1 мкМ снижал ТЭС на 13.7% после 120 мин воздействия и на 11% после 480 мин относительно исходной точки (рис. 2). При использовании других концентраций препаратов CoQ10 и CoQ10H2 не наблюдали статистически значимых изменений величины ТЭС. В группе Р (рис. 3), которая являлась контрольной группой, так как в этом случае использовали плацебо-раствор (без растворенных в нем субстанций исследуемых препаратов), статистически значимых изменений величины ТЭС не наблюдали, что исключает возможность влияния использованного растворителя на клетки модели ГЭБ.
Рис. 2.
Изменение величины ТЭС (Ом ⋅ см2) после воздействия CoQ10 в дозах 1, 5 и 10 мкМ на клетки модели ГЭБ. Звездочкой показаны статистически значимые отличия от контроля, p ≤ 0.01 (критерий Манна–Уитни).
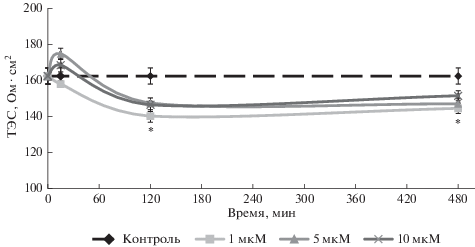
Рис. 3.
Изменение величины ТЭС (Ом ⋅ см2) в группе Р (плацебо-раствор) после воздействия растворителя на клетки модели ГЭБ.
Оценка экспрессии белка Rac-1 на трехклеточной модели ГЭБ in vitro. В нашей работе мы оценивали изменение количества Rac-1-иммунопозитивных клеток при воздействии CoQ10 и CoQ10H2 на клетки ГЭБ (рис. 4). В ходе исследования мы обнаружили, что влияние обеих форм коэнзима Q10 вызвало статистически значимое уменьшение количества эндотелиальных клеток, которые экспрессируют белок Rac-1 по сравнению с группами К и Р (рис. 5). Изменения наблюдались уже через 15 мин и не зависели от дозы. Добавление CoQ10H2 в культуральную среду в дозе 1 мкМ вызвало уменьшение количества Rac-1 иммунопозитивных эндотелиоцитов в экспериментальной группе до 3.9% по сравнению с контрольной группой (К), где составляло 31.8% (p = 0.0013) через 15 мин, и до 1.8% с 24.7% (p = 0.00109) через 120 мин. Влияние CoQ10H2 в концентрации 5 мкМ привело к уменьшению количества эндотелиальных клеток, экспрессирующих Rac-1, до 2.1% по сравнению с группой К, где составляло 31.79% (p = 0.0052), через 15 мин воздействия и до 1.2% с 24.7% (p < 0.0001) через 120 мин. При концентрации 10 мкМ – до 1% с 31.8% (p = 0.0007) и до 1.1% с 24.7% (p = 0.0002) через 15 и 120 мин соответственно.
Рис. 4.
Иммуноцитохимическое выявление белка Rac-1 в клетках модели ГЭБ. (а) – Контроль (К), (б) – после воздействия CoQ10H2, (в) – после воздействия CoQ10. Ядра клеток – синий цвет (DAPI), Rac-1-иммунопозитивные клетки – зеленый цвет. Увел. об.: 20×.
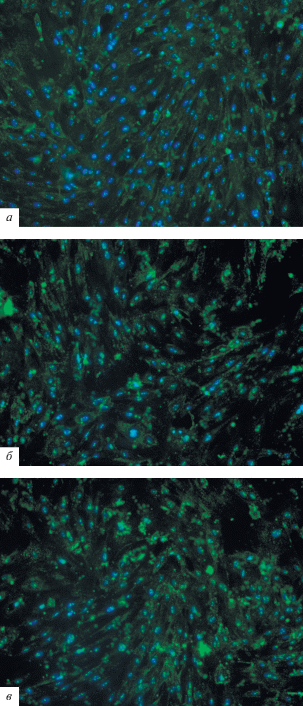
Рис. 5.
Влияние CoQ10 и CoQ10H2 в дозах 1 (а), 5 (б) и 10 мкМ (в) на экспрессию белка Rac-1 в клетках эндотелия в модели ГЭБ. Звездочкой показаны статистически значимые отличия от контроля (К) (тест Краскела–Уоллиса). Решеткой показаны статистически значимые отличия от плацебо-контроля (Р) (тест Краскела–Уоллиса).
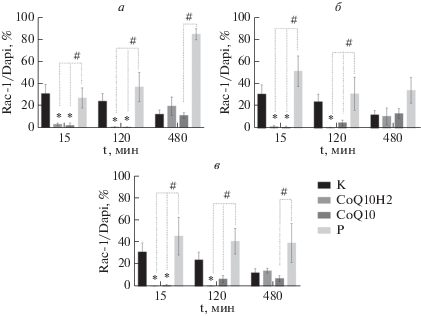
Однонаправленные изменения количества Rac-1-иммунопозитивных клеток мы обнаружили и при воздействии CoQ10. Так, через 15 мин после добавления CoQ10 в дозах 1, 5 и 10 мкМ в культуральную среду, мы обнаружили уменьшение числа клеток, экспрессирующих целевую молекулу, в экспериментальной группе до 2.6, 1.7 и 1.6% (p < 0.0001; p = 0.0009; p = = 0.0045) по сравнению с группой К (31.8%). Через 120 мин после добавления CoQ10 в дозе 1 мкМ число Rac-1-иммунопозитивных клеток уменьшалось до 1.1% (p = 0.003) по сравнению с группой К (24.7%).
Оценка экспрессии белка Rac-1 на монослое клеток эндотелия in vitro. Мы также проводили оценку экспрессии белка Rac-1 через 15, 120 и 480 мин после воздействия растворами CoQ10 и CoQ10H2 на монокультуру клеток церебрального эндотелия в дозах 1, 5 и 10 мкМ. В отличие от модели ГЭБ in vitro в этом случае отсутствовало взаимодействие эндотелиальных клеток с нейронами и астроцитами. Так как при изучении действия растворителя на клеточную модель ГЭБ in vitro (группа Р) были получены данные, статистически не отличающиеся от результатов, полученных в контрольных измерениях (группа К), поэтому результаты действия препаратов, в дальнейшем сравнивали с группой К.
Эффекты CoQ10 и CoQ10H2 на клетки церебрального эндотелия (вне модели ГЭБ) отличались от тех, которые наблюдали при влиянии веществ на клеточную модель ГЭБ in vitro (рис. 6).
Рис. 6.
Влияние CoQ10 и CoQ10H2 в дозах 1 (а), 5 (б) и 10 мкМ (в) на экспрессию белка Rac-1 в эндотелиальных клетках головного мозга. Звездочкой показаны статистически значимые отличия от контроля (группа К) (тест Краскела–Уоллиса). Решеткой показаны статистически значимые различия между группами CoQ10 и CoQ10H2 (тест Краскела–Уоллиса).
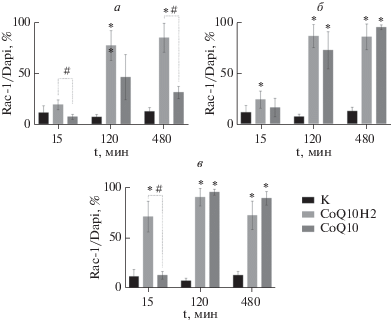
В целом, мы наблюдали более выраженные различия между действием окисленной и восстановленной форм коэнзима CoQ. CoQ10Н2 в дозах 5 и 10 мкМ увеличивал количество Rac-1-иммунопозитивных клеток в экспериментальной группе до 24.2 и 70.7% (p = 0.0026 и p = 0.0001) соответственно, по сравнению с группой К, в которой данный показатель через 15 мин от начала воздействия составлял 11.8%. Через 120 мин эффект CoQ10Н2 в дозе 1, 5 и 10 мкМ усилился, наблюдали увеличение числа Rac-1-иммунопозитивных клеток до 77.1, 86 и 89.9% (p < 0.0001; p = = 0.0004; p = 0.0053) соответственно, по сравнению с группой К, в которой этот показатель составлял 7.5%. Через 480 мин эффект сохранялся, показатели превышали контрольные (13% в группе К) и возросли до 84.7, 85.2 и 72% (p < 0.0001; p = 0.0073; p = 0.0419) при использовании CoQ10Н2 в дозе 1, 5 и 10 мкМ соответственно.
Влияние CoQ10 в дозах 5 и 10 мкМ после 120 мин воздействия проявлялось в статистически значимом увеличении числа эндотелиальных клеток, экспрессирующих Rac-1, в экспериментальной группе до 72.2 и 94.8% (p = 0.0382 и p = 0.0015) соответственно, по сравнению с группой К, в которой этот показатель составлял 7.5%. Через 480 мин действия CoQ10 в тех же дозах данный показатель в экспериментальной группе составлял 94.5 и 88.8% (p = 0.0011 и p = = 0.0001), тогда как в группе К – 13%.
ОБСУЖДЕНИЕ
По результатам исследования мы установили, что CoQ10 и CoQ10H2 оказывают влияние на величину ТЭС в модели ГЭБ in vitro. Так как ТЭС является интегральным показателем целостности ГЭБ, обусловленным наличием и функцией белков плотных контактов, этот факт может свидетельствовать об изменении проницаемости ГЭБ при воздействии использованных в нашей работе веществ (Srinivasan et al., 2015). При этом установлено, что CoQ10H2 проявляет дозозависимый эффект, то есть при его различных концентрациях изменения ТЭС оказались различными. При концентрации 1 мкМ ТЭС уменьшается, что соответствует повышению проницаемости ГЭБ, а при концентрации 10 мкМ ТЭС увеличивается, что может свидетельствовать о снижении проницаемости ГЭБ, таким образом, CoQ10H2 в разных концентрациях оказывает разное влияние на проницаемость ГЭБ.
В отношении CoQ10 можно заключить, что при концентрации 1 мкМ его влияние на величину ТЭС заключается в уменьшении этого показателя, то есть в увеличении проницаемости ГЭБ. При более высоких концентрациях отмечается тенденция к дальнейшему повышению проницаемости ГЭБ.
Белок Rac-1 (Ras-related C3 botulinum toxin substrate 1) является полифункциональным белком. Rac-1 играет большую роль в регуляции активности белков цитоскелета и в организации сигнальных путей, регулирующих сборку актинового цитоскелета, процессы адгезии эндотелиальных клеток, их парацеллюлярную и трансцеллюлярную проницаемость (Hall, 1998; Ridley, 2001). Rac1 вызывает повышенную нуклеацию и полимеризацию актина за счет связывания с двумя эффекторами – РI-4-P5K и WAVE. Активация РI-4-P5K приводит к росту внутриклеточного уровня фосфатидил-инозитидов, которые связывают кэпирующие белки и тем самым способствуют удлинению актиновых микрофиламентов (Machesky, Insall, 1998; Tolias et al., 2000).
В регуляции функциональной активности Rac-1 задействовано большое количество белков, которые могут способствовать его рекрутированию, активации, дезактивации или стабильности. Активированный Rac-1 можно обнаружить во время таких процессов, как миграция клеток, инвазия и повреждение ДНК (Payapilly, Malliri, 2018). С активацией Raс-1 в клетках связан также апоптоз (Naci, 2019). Одной из функций белка Rac-1 также является регуляция продукции АФК в митохондриях (Werner, Werb, 2002). Активированный Rac-1 (Rac-GTP) стимулирует фермент НАДФ ⋅ H-оксидазу (NOX), что приводит к усилению продукции АФК (Sundaresan et al., 1996).
Учитывая, что высокие уровни экспрессии Rac-1 клетками ГЭБ, ассоциированы с повреждением и повышением проницаемости ГЭБ, усилением апоптоза клеток и митохондриальной недостаточностью (Kahles et al., 2007), а эффекты CoQ10 и Co-Q10H2 проявляются в уменьшении количества Rac-1-иммунопозитивных клеток, можно предполагать потенциальную возможность применения этих веществ в роли терапевтических агентов. Обсуждая влияние CoQ10 и CoQ10H2 на экспрессию Rac-1, можно сделать вывод о том, что оба изучаемых вещества влияют на количество Rac-1-иммунопозитивных клеток. Снижение экспрессии при воздействии обоими препаратами на клетки ГЭБ in vitro наблюдали через 120 мин. При этом максимальный эффект характерен для CoQ10H2 в концентрации 10 мкМ, в этом случае наблюдали уменьшение количества Rac-1-иммунопозитивных эндотелиоцитов приблизительно в тридцать раз относительно контроля. Данный эффект развивался стремительно и наблюдался уже через 15 мин.
Эффект CoQ10, который наблюдали уже через 15 мин, имел место при различных концентрациях действующего вещества. Однако максимально длительным (120 мин) и сильным он был при концентрации 1 мкМ, в этом случае наблюдали уменьшение количества клеток, экспрессирующих Rac-1 в 22 раза по сравнению с контролем.
Таким образом, остается актуальным вопрос об эффективной концентрации CoQ10 и CoQ10H2, необходимой для реализации терапевтического эффекта. Так в работе Ниу с соавторами (Niu et al., 2020), посвященной изучению влияния CoQ10H2 в концентрации 0–400 мкМ на ооциты млекопитающих, авторы убедительно показали наличие максимально выраженного положительного эффекта при концентрации 100 мкМ.
В другом исследовании изучалось влияние C-oQ10H2 на организм молодых спортсменов, которые получали препарат в дозе 200 мг/сут в течение 1 мес. Оценивали физические и гематохимические показатели, содержание CoQ10/CoQ10H2 в плазме, уровень внутриклеточных АФК, состояние митохондриальной мембраны и параоксоназы (универсального фактора антиоксидантной защиты в организме человека), а также уровня окислительного повреждения ДНК. Авторы указывают, что добавки CoQ10H2 предотвращали, вызванную физическими упражнениями депривацию коэнзима и снижение активности параоксоназы, снижение цитоплазматических АФК в мононуклеарных клетках. Однако потенциал митохондриальной мембраны и окислительное повреждение ДНК не изменялись (Orlando et al., 2018).
При изучении влияния CoQ10 и CoQ10H2 в дозе 200 мг/сут в течение 2 нед. у пожилых людей оказалось, что более эффективным оказался CoQ10H2, а не CoQ10. Однако, в обеих группах, несмотря на уменьшение концентрации АФК в мононуклеарных клетках периферической крови, общие показатели оксидативного стресса по результатам анализа периферической крови не изменились (Zhang et al., 2018b). Кроме этого указывается, что CoQ10H2 способен проникать в ткани, в том числе и головной мозг через ГЭБ и оказывать свое антиоксидантное действие в концентрации более 2.78 мкМ/л–1. Однако в отмеченных выше исследованиях использовался пероральный путь введения препаратов. В целом результаты нашей работы позволяют обозначить CoQ10 и CoQ10H2, как перспективные вещества, для терапевтического применения.
Таким образом, убихинол и убихинон влияют на проницаемость эндотелиального слоя и модулируют экспрессию Rac-1 в модели ГЭБ. Учитывая действие этих веществ в отношении митохондрий, можно предполагать вовлеченность митохондриальной активности клеток церебрального эндотелия в процессы регуляции проницаемости ГЭБ.
Список литературы
Мельникова Ю.С., Макарова Т.П. 2015. Эндотелиальная дисфункция как центральное звено патогенеза хронических болезней. Казанский Мед. Журн. Т. 94. № 4. С. 659. (Melnikova Y.S., Makarova T.P. 2015. Endothelial dysfunction as a central link in the pathogenesis of chronic diseases. Kazan. Med. J. V. 94. No 4. P. 659.)
Хилажева Е.Д., Бойцова Е.Б., Пожиленкова Е.А., Солончук Ю.Р., Салмина А.Б. 2015. Получение трехклеточной модели нейроваскулярной единицы in vitro. Цитология. Т. 57. № 10. С. 710. (Khilazheva E.D., Boytsova E.B., Pozhilenkova E.A., Solonchuk Yu.R., Salmina A.B. 2015. Obtaining a three-cell model of a neurovascular unit in vitro. Cell Tiss. Biol. V. 9. № 6. P. 447.)
Abbott N.J., Patabendige A., Dolman D., Yusof S. R., Begley D.J. 2010. Structure and function of the blood–brain barrier. Neurobiol. Disease. V. 37. P. 13.
Arakawa S., Nakanomyo I., Kudo-Sakamoto Y., Akazawa H., Komuro I., Shimizu S. 2015. Identification of a novel compound that inhibits both mitochondria-mediated necrosis and apoptosis. Biochem. Biophys. Res. Commun. V. 467 P. 1006.
Bradbury M.W. 1993. The blood-brain barrier. Exp. Physiol. V. 78. P. 453.
Duran-Prado M., Frontinan J., Santiago-Mora R., Peinado J.R., Parrado-Fernadez C., Gomez-Almagro M.V., Moreno M., Lopez-Dominguez J.A., Villalba J.M., Alcaín F.J. 2014. Coenzyme Q10 protects human endothelial cells from β-amyloid uptake and oxidative stress-induced injury. PLoS One. V. 9. P. 1.
Greenberg S., Firishman W.H. 1990. Co-enzyme Q10: a new drug for cardiovascular disease. J. Clin. Pharmacol. V. 30. P. 596.
Hall A. 1998. Rho GTPases and the actin cytoskeleton. Science. V. 279. P. 509.
Hartmann C., Zozulya A., Wegener J., Galla H.J. 2007. The impact of glia-derived extracellular matrices on the barrier function of cerebral endothelial cells: An in vitro study. Exp. Cell Res. V. 313. P. 1318.
Hawkins B.T., Davis T.P. 2005. The blood-brain barrier/neurovascular unit in health and disease. Pharm. Rev. V. 57. P. 173.
Isobe C., Abe T., Terayama Y. 2010. Levels of reduced and oxidized coenzyme Q-10 and 8-hydroxy-2'-deoxyguanosine in the CSF of patients with Alzheimer’s disease demonstrate that mitochondrial oxidative damage and/or oxidative DNA damage contributes to the neurodegenerative process. J. Neurol. V. 257. P. 399.
Kahles T., Luedike P., Endres M., Galla H.J., Steinmetz H., Busse R., Neumann-Haefelin T., Brandes R. P. 2007. NADPH oxidase plays a central role in blood-brain barrier damage in experimental stroke. Stroke. V. 38. P. 3000.
Kalenikova E.I., Gorodetskaya E.A., Obolenskaya O.N., Shapoval N.S., Makarov V.G., Medvedev O.S. 2018. Tissue-level dynamics and redox state of coenzyme Q10 in rats after intravenous injection of ubiquinol. Pharm. Chem. J. V. 52. P. 690.
Kluge M.A., Fetterman J.L., Vita J.A. 2013. Mitochondria and endothelial function. Circ. Res. V. 112. P. 1171.
Kumar A., Kaur H., Devi P., Mohan V. 2009. Role of coenzyme Q10 (CoQ10) in cardiac disease, hypertension and Meniere-like syndrome. Pharmacology & Therapeutics. V. 124. P. 259.
Liu Y., Xue Q., Tang Q., Hou M., Qi H., Chen G., Chen W., Zhang J., Chen Y., Xu X. 2013. A simple method for isolating and culturing the rat brain microvascular endothelial cells, Microvasc. Res. V. 90. P. 199.
Machesky L.M., Insall R.H. 1998. Scar1 and the related Wiskott-Aldrich syndrome protein, WASP, regulate the actin cytoskeleton through the Arp2/3 complex. Curr. Biol. V. 8. P. 1347.
Matthews R.T., Yang L., Browne S., Baik M., Beal M.F. 1998. Coenzyme Q10 administration increases brain mitochondrial concentrations and exerts neuroprotective effects. Proc. Natl. Acad. Sci. USA. V. 95. P. 8892.
Naci D., Berrazouane S., Barabe F., Aoudjit F. 2019. Cell adhesion to collagen promotes leukemia resistance to doxorubicin by reducing DNA damage through the inhibition of Rac1 activation. Sci. Rep. V. 9 : 19455.
Niu Y.J., Zhou W., Nie Z.W., Zhou D., Xu Y.N., Ock S.A., Yan C.G., Cui X.S. 2020. Ubiquinol-10 delays postovulatory oocyte aging by improving mitochondrial renewal in pigs. Aging (Albany N.Y.). V. 12. P. 1256.
Orlando P., Silvestri S., Galeazzi R., Antonicelli R., Marcheggiani F., Cirilli I., Bacchetti T., Tiano L. 2018. Effect of ubiquinol supplementation on biochemical and oxidative stress indexes after intense exercise in young athletes. Redox Rep. V. 23. P. 136.
Payapilly A., Malliri A. 2018. Compartmentalisation of RAC1 signalling. Curr. Opin. Cell Biol. V. 54. P. 50.
Ridley A.J. 2001. Rho proteins, PI 3-kinases and monocyte/ macrophage motility. FEBS Lett. V. 498. P. 168.
Shapoval N., Obolenskaia O., Kalenikova E., Gorodetskaya E., Medvedev O. 2018. Tissue distribution and redox status of coenzyme Q10 after intravenous administration of ubiquinol to rat. J. Hypertension. V. 36. P. 149.
Sena L.A., Chandel N.S. 2012. Physiological roles of mitochondrial reactive oxygen species. Mol. Cell. V. 48. P. 158.
Srinivasan B., Kolli A.R., Esch M.B., Abaci H.E., Shuler M.L., Hickman J.J. 2015. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. V. 20. P. 107.
Sundaresan M., Yu Z.X., Ferrans V.J., Sulciner D.J., Gutkind S., Irani K.J., Goldschmidt-Clermont P.J., Finkel T. 1996. Regulation of reactive-oxygen-species generation in fibroblasts by Rac 1. Biochem. J. V. 318. P. 379.
Tatsuta Y., Kasai K., Maruyama C., Hamano Y., Matsuo K., Taira S. 2017. Imaging mass spectrometry analysis of ubiquinol localization in the mouse brain following short-term administration. Sci. Rep. V. 7 : 12990.
Tolias K.F., Hartwig J.H., Ishihara H., Shibasaki Y., Cantley L.C., Carpenter C. L. 2000. Type Ialpha phosphatidylinositol-4-phosphate 5-kinase mediates Rac-dependent actin assembly. Curr. Biol. V. 10. P. 153.
Werner E., Werb Z. 2002. Integrins engage mitochondrial function for signal transduction by a mechanism dependent on Rho GTPases. J. Cell Biol. V. 158. P. 357.
Wong A.D., Ye M., Levy A.F., Rothstein J.D., Bergles D.E., Searson P.C. 2013. The blood-brain barrier: an engineering perspective. Front. Neuroeng. V. 6. P. 1.
Yan X.J., Yu X., Wang X.P., Jiang J.F., Yuan Z.Y., Lu X., Lei F., Xing D.M. 2017. Mitochondria play an important role in the cell proliferation suppressing activity of berberine. Sci. Rep. V. 7 :41712).
Zhang H., Chang Z., Mehmood K., Abbas R.Z., Nabi F., Rehman M.U., Wu X., Tian X., Yuan X., Li Z., Zhou D. 2018a. Nano copper induces apoptosis in PK-15 Cells via a mitochondria-mediated pathway. Biol. Trace. Elem. Res. V. 181. P. 62.
Zhang Y., Liu J., Chen X.Q., Oliver Chen C.Y. 2018. Ubiquinol is superior to ubiquinone to enhance Coenzyme Q10 status in older men. Food Funct. V. 9. P. 5653.
Дополнительные материалы отсутствуют.


