Цитология, 2021, T. 63, № 2, стр. 193-204
Сравнительный анализ методов выделения экзосом из культуральной среды
А. Н. Горшков 1, *, Л. В. Пурвиньш 1, 2, А. В. Протасов 1, 2, П. А. Некрасов 1, А. А. Шалджян 1, А. В. Васин 1, 2
1 Научно-исследовательский институт гриппа им. А.А. Смородинцева Министерства здравоохранения
Российской Федерации
197376 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого, Институт биомедицинских систем
и биотехнологий
195251 Санкт-Петербург, Россия
* E-mail: angorsh@yahoo.com
Поступила в редакцию 15.11.2020
После доработки 10.12.2020
Принята к публикации 10.12.2020
Аннотация
Экзосомы представляют собой внеклеточные мембранные везикулы диаметром 40–100 нм и являются ключевым средством межклеточной коммуникации. С их помощью происходит перенос широкого спектра биологически активных молекул, включая липиды, белки, мРНК и микроРНК. Передача этих молекул клеткам-реципиентам регулирует их функции в норме и вносит вклад в патогенез множества заболеваний. Уникальные особенности молекулярного состава экзосом делают их потенциально важнейшим диагностическим и прогностическим маркером в медицине. К настоящему времени предложен ряд методов выделения и очистки экзосом. Тем не менее, стандартный подход, позволяющий получать чистые препараты, полностью пригодные для последующего применения высокочувствительных методов анализа, в настоящее время отсутствует. В настоящей работе мы провели сравнение эффективности выделения экзосом из культуральной клеточной среды с помощью трех методов: 1) ультрацентрифугирования, 2) концентрирования тангенциальной потоковой фильтрацией с последующей гель-фильтрацией, 3) осаждения с помощью коммерческого реагента Total exosome isolation reagent (Thermo Fisher, США). Оценка качества проб экзосом включала просвечивающую электронную микроскопию, динамическое светорассеяние и детекцию маркерного экзосомального белка аннексина А2 Вестерн-блоттингом. Результаты показали, что наибольшая чистота препарата экзосом достигается при их концентрировании тангенциальной потоковой фильтрацией с последующей гель-фильтрацией.
Экзосомы – везикулы диаметром 40–100 нм, секретируемые клетками во внеклеточное пространство (Purushothaman et al., 2016). Биогенез экзосом в клетке связан с эндосомальным компартментом. Наблюдается вторичное впячивание мембраны поздней эндосомы и образование мультивезикулярного тела с интралюминальными везикулами внутри него (Stoorvogel et al., 2002). При слиянии мультивезикулярного тела с плазматической мембраной происходит выход содержащихся в нем везикул во внеклеточное пространство – секреция экзосом из клетки (Colombo et al., 2014). Экзосомы секретируются клетками всех типов и обнаруживаются во множестве различных биологических жидкостей: моче (Conde-Vancells et al., 2010), крови (Caby et al., 2005), слюне (Michael et al., 2010), грудном молоке (Admyre et al., 2007), бронхоальвеолярной (Prado et al., 2008), амниотической (Keller et al., 2007) и других жидкостях, доставляя свое содержимое клеткам-реципиентам.
По современным представлениям, экзосомы являются компонентом внеклеточного микроокружения, обеспечивающим межклеточную коммуникацию. Благодаря специфической доставке функциональных белков и нуклеиновых кислот к клеткам-реципиентам, экзосомы выступают посредниками регуляторных сигналов между клетками (Vlassov et al., 2012). Секретируемые экзосомы могут локально влиять на функции соседних клеток, а также переноситься на значительные расстояния биологическими жидкостями. С накоплением данных о составе экзосом и способах их взаимодействия с клетками-мишенями открывается все больше физиологических процессов, регулируемых этими везикулами.
Так как экзосомы широко представлены в биологических жидкостях и содержат специфические белки, липиды и нуклеиновые кислоты, состав которых зависит от функционального состояния секретирующей клетки, они являются перспективным объектом для ранней диагностики заболевания, определения его прогрессии и эффективности лечения, в частности для диагностики онкологических заболеваний (Whiteside 2015; Palmirotta et al., 2018).
Кроме того, природная функция экзосом как средства межклеточной коммуникации, их стабильность, небольшие размеры и нетоксичность для организма делает их перспективным объектом для разработки систем направленной доставки лекарственных препаратов in vivo (Bunggulawa et al., 2018; Samanta et al., 2018). Однако реализация всего потенциала клинического использования экзосом невозможна без эффективных и воспроизводимых подходов получения чистых препаратов экзосом. Несмотря на большое разнообразие разработанных и применяемых методов, в том числе имеющихся на рынке нескольких коммерческих наборов для выделения, до сих пор не существует “золотого стандарта”, позволяющего получать однородные препараты экзосом из различных биологических жидкостей (Abramowicz et al., 2016).
Цель настоящей работы заключалась в сравнении эффективности получения чистых препаратов экзосом из культуральной среды тремя методами, которые включали ультрацентрифугирование, гель-фильтрацию и осаждение коммерческим реагентом Total exosome isolation reagent (Thermo Fisher, США). Были поставлены следующие задачи: анализ выхода экзосом и чистоты полученных препаратов с помощью просвечивающей электронной микроскопии, динамического светорассеивания и Вестерн-блот-анализа с использованием моноклональных антител к аннексину А2 – известному маркерному белку экзосом.
Полученные результаты важны для выбора оптимального протокола выделения экзосом с целью дальнейшего анализа их молекулярного состава и исследований по доставке биологически активных веществ.
МАТЕРИАЛ И МЕТОДИКА
Очистка сыворотки от экзосом. Рутинные протоколы культивирования клеток традиционно предполагают использование 5% эмбриональной бычьей сыворотки (FBS), как источника гормонов и ростовых факторов. Однако FBS сама по себе является биологической жидкостью, содержащей большое количество функционально активных экзосом (Shelke et al., 2014). Поэтому при исследованиях экзосом, секретируемых культивируемыми клетками в присутствии FBS в культуральной среде, абсолютно необходима ее предварительная очистка от FBS сывороточных экзосом.
С этой целью мы ультрацентрифугировали культуральную среду DMEM, содержащую 20% FBS, в течение 15 ч при 100 тыс. g и 4°C (центрифуга Beckman Coulter Avanti J-30I, США, ротор JA-30.50). Далее отбирали верхнюю часть среды из центрифужных пробирок, переносили в другие пробирки и повторно ультрацентрифугировали аналогичным образом. После второго раунда ультрацентрифугирования верхнюю фракцию отбирали, разбавляли средой DMEM до концентрации FBS 5% и использовали для последующего культивирования клеток.
Культивирование клеток. Для получения культуральной среды, содержащей клеточные экзосомы, использовали клетки линии А549 (карцинома легкого человека; коллекция ATCC CCL-185). Клетки рутинно культивировали в среде DMEM, содержащей GlutaMax, антибиотик-антимикотик и 5% FBS (Gibco, Life technologies, США) при 37°C в атмосфере 5% CO2. Для культивирования использовали флаконы NUNC 225 см2 EasyFlask (Thermo Fisher, США). Для одного раунда выделения экзосом культивировали 5 флаконов с клетками А549. После достижения монослоем 80% конфлюентности, клетки 3 раза промывали фосфатно-солевым раствором (PBS; Биолот, Россия) и меняли среду на аналогичную, предварительно очищенную от сывороточных экзосом по вышеописанному протоколу. Параллельно клетки после 3-кратной промывки в PBS помещали в бессывороточную среду DMEM. Для секреции экзосом клетки культивировали 48 ч. После этого культуральную среду собирали и центрифугировали 30 мин при 3000 g и 4°C для удаления клеточного детрита (центрифуга Eppendorf Centrifuge 5810R, Германия). Далее супернатант собирали и проводили дальнейшие этапы выделения экзосом.
Выделение экзосом. Для сравнительного анализа мы использовали 3 метода выделения экзосом, принципиально различающихся по своим физическим принципам.
Ультрацентрифугирование. Среду, содержащую экзосомы и полученную по вышеуказанным протоколам культивирования клеток, центрифугировали 30 мин при 10 000 g и 4°C для удаления фрагментов клеток, крупных везикул и белковых комплексов. Далее очищенный супернатант переносили в ультрацентрифужные пробирки и центрифугировали 2 ч при 100 тыс. g и 4°C (центрифуга Beckman Coulter Avanti J-30I, США, ротор JA-30.50). После ультрацентрифугирования супернатанты удаляли, осадки ресуспендировали в PBS и объединяли в одну ультрацентрифужную пробирку. Пробу повторно центрифугировали 2 ч при тех же условиях. Далее супернатант удаляли, а обогащенный экзосомами осадок ресуспендировали в 500 мкл PBS.
Гель-фильтрация. Использованный нами протокол включал в себя два препаративных этапа: концентрирование образца методом тангенциальной потоковой фильтрации и последующую гель-фильтрацию. Для тангенциальной фильтрации использовали систему Akta flux (GE Healthcare Life Sciences, США). Культуральную среду, содержащую экзосомы, пропускали через фильтр MWCO (molecular weight cut-off) с размером пор для молекул 750 кДа, благодаря чему происходило отделение везикул и белковых комплексов от низкомолекулярных компонентов, с уменьшением объема жидкости в образце. В процессе фильтрации образец несколько раз разбавляли PBS и повторно концентрировали, что способствовало более полному удалению солей и низкомолекулярных компонентов среды. Конечный объем образца уменьшался в 10 раз.
Сконцентрированный образец наносили на колонку объемом 120 мл, содержащую Sephacryl S-500HR (Sigma-Aldrich, США), и проводили гель-фильтрацию (хроматограф Akta pure, GE Healthcare Life Sciences, США). Элюцию проводили PBS (скорость элюции 1 мл/мин, фракции по 5 мл). Фракции первого пика объединяли и концентрировали с помощью центрифугирования при 3000 g через Amicon Ultra-15 30 кДа (Merck, Германия) до 500 мкл.
Осаждение с помощью коммерческого реагента. Для выделения экзосом использовали Total exosome isolation reagent (Thermo Fisher, США) согласно протоколу производителя. Культуральную среду, содержащую экзосомы, смешивали с реагентом в соотношении 1 : 0.5. Пробу инкубировали с реагентом в течение ночи при 4°C, после чего центрифугировали 1 ч при 10 тыс. g и 4°C. Супернатант удаляли, а осадок ресуспендировали в 500 мкл PBS.
Обогащенные экзосомами пробы, полученные тремя перечисленными выше методами, анализировали на чистоту образца и выход экзосом непосредственно после получения, либо хранили до исследования не более 1 нед. при –20°C в присутствии ингибиторов протеаз (Sigma-Aldrich, США).
Просвечивающая электронная микроскопия. Для электронно-микроскопического исследования образцов, содержащих экзосомы, был использован метод негативного контрастирования. Исследуемые суспензии наносили на медные сетки для электронной микроскопии (300 mesh; Sigma-Aldrich, США), покрытые коллодиевой поддерживающей пленкой. После адсорбции на пленку в течение 1–2 мин частиц, содержащихся в пробе, сетки дважды промывали дистиллированной водой в течение 10 с. Контрастирование проводили в 2%-ном растворе фосфорно-вольфрамовой кислоты (Sigma-Aldrich, США) в течение 1 мин. Далее сетки исследовали с помощью просвечивающего электронного микроскопа JEM 1011 (JEOL, Япония) при ускоряющем напряжении 80 кВ в диапазоне инструментальных увеличений 50–250 тыс. Электронные микрофотографии получали с помощью цифровой камеры Morada (Olympus, Япония).
Динамическое светорассеяние. Метод динамического рассеяния позволяет оценить однородность и фракционный состав микрочастиц в образце путем статистической обработки значений светорассеивания, происходящего за счет случайного теплового перемещения микрочастиц в растворе.
Наличие и количество фракций микрочастиц в изучаемых препаратах оценивали с помощью прибора Zetasizer Nano-ZSP (Malvern Instruments, Великобритания). В качестве эталона для оценки гидродинамического радиуса частиц в отдельных фракциях использовали стандартные частицы латекса диаметром 100 нм. Образцы объемом 60 мкл вносили в микрокюветы Starstedt при стандартном значении угла детектирования. Измерения проводили с учетом показателей преломления воды и комнатной температуры. Для каждого образца проводили по три измерения, каждое включало 20 прогонов (продолжительностью 10 с), с автоматическим подбором аттенуатора. Полученные в каждом измерении данные обрабатывали, после чего с помощью программного обеспечения Malvern Zetasizer Software 7.12 определяли наличие, стабильность и количество фракций частиц и строились кривые, характеризующие среднее распределение гидродинамического радиуса частиц в пробах. Для обсчета использовали базовую статистическую модель прибора (профиль General purpose). В процессе эксперимента оценивали светорассеяние как неразведенной пробы, так и проб, разведенных в 10 и 100 раз.
Вестерн-блот-анализ. К препаратам экзосом добавляли буфер Лэмли и инкубировали 5 мин при 95°C. Последующее электрофоретическое разделение белков выполняли в градиентном полиакриламидном геле (градиент 8–16%). Для электрофореза использовали источник PowerPac universal (Bio-Rad, США), ток 25 мА и время разделения 1 ч. В качестве стандарта молекулярной массы был добавлен Precision plus protein WesternC standarts (Bio-Rad, США).
Полусухой перенос белков на PVDV- мембрану был выполнен в течение 30 мин с помощью источника Trans-blot turbo (Bio-Rad, США). Далее мембрану инкубировали в течение ночи в растворе первичных антител (раствор антитела на PBST в разведении 1 : 2500) против хорошо известного маркерного белка экзосом аннексина А2 (MAB3928; R&D Systems, США).
После инкубации с первичными антителами мембрану отмывали в PBST и инкубировали в растворе козьих вторичных антител (в разведении 1 : 1000 на PBST) против иммуноглобулинов мыши, конъюгированных с пероксидазой хрена (Bio-Rad, США) в течение 1 ч. После отмывки добавляли субстрат Clar-ity Western ECL (Bio-Rad, США). Детектировали хемилюминисценцию с помощью системы ChemiDoc MP imaging system (Bio-Rad, США).
Трипсинолиз и масс-спектрометрия. С помощью масс-спектрометрии анализировали ультрацентрифугированный препарат клеточных экзосом после культивирования клеток в среде, содержащей 5% FBS, очищенной от экзосом. Для этого белки в пробе были разделены с помощью электрофореза в градиентном полиакриламидном геле (градиент 8–16%) в денатурирующих условиях, аналогично приведенному выше протоколу Вестерн-блотинга. Гель был окрашен красителем Coomassie Blue R250.
Фрагменты геля объемом около 2 мкл, содержащие наиболее выраженные белковые бэнды, вырезали и переносили в пробирки с отмывочным буферным раствором (150 мкл, 2 смены по 10 мин). Состав отмывочного буфера: 30 мМ NH4HCO3 и 40% ацетонитрила. После отмывки проводили инкубацию проб с ацетонитрилом (100 мкл) в течение 10 мин. После полного удаления ацетонитрила к фрагментам геля добавляли раствор трипсина (Promega, США) в 50 мМ NH4HCO3, разведенном до концентрации 20 мкг/мл. Трипсинолиз проводили в течение 4 ч при 37°C.
Для дальнейшего масс-спектрометрического анализа образцов использовали масс-спектрометрию с ионизацией лазерной десорбции в присутствии матрицы (MALDI – Matrix-assisted laser desorption ionization mass-spectrometry) с время-пролетным анализатором TOF (time of flight), реализованную в приборе ultrafleXtreme™ (Bruker, Германия). Этот прибор оснащен твердотельным лазером 337 нм.
Для получения масс-спектров образцы наносили на мишень (MTP 384 target plate ground steel TF; Bruker, Германия). Для нанесения образцов использовали матрицу HCCA (α-циано-4-гидроксикоричная кислота). Масс-спектры получали в режиме регистрации положительных ионов при помощи программы Bruker daltonics flex control (Bruker, Германия).
Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции (ионизации) образца. Спектры получали в результате суммирования трех серий спектров по 1000 импульсов лазера для каждой серии. Спектры фрагментации пептидов регистрировали с помощью метода LIFT. Обработку полученных результатов проводили с помощью программы Bruker daltonics flex analysis (Bruker, Германия). Идентификацию соединений осуществляли посредством программы Bruker daltonics BioTools (Bruker, Германия), взаимодействующей с базами данных MASCOT. Для внутренней калибровки масс в спектрах использовали ионы, соответствующие продуктам автопротеолиза трипсина (842.51 и 2211.01 Да). Погрешность измерения масс составляла не более 20 ppm.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Очистка FBS от экзосом. Классические протоколы культивирования клеток, в частности линии А549, требуют использования эмбриональных сывороток как источника ряда гормонов, ростовых факторов и других биологически активных молекул (Marcos-Vadillo, García-Sánchez, 2016). Эти соединения необходимы для нормального функционального состояния клеток, в том числе для их эффективного деления в фазе экспоненциального роста клеточной культуры. Однако при этом FBS является биологической жидкостью, содержащей огромное количество экзосом. По-видимому, именно присутствующие в FBS экзосомы и их содержимое опосредуют значительную часть физиологических эффектов FBS на клеточные культуры (Beninson, Fleshner, 2015; Zhou et al., 2020). При этом клеточные и сывороточные экзосомы имеют более 95% гомологии белкового состава, что делает невозможным их разделение и сильно затрудняет дальнейший протеомный и транскриптомный анализ клеточных экзосом (Keerthikumar et al., 2016). В этой связи был предложен протокол удаления экзосом из FBS путем ее длительного ультрацентрифугирования при 100 тыс. g, что приводит к 50%-ному уменьшению сигнала маркерного экзосомального белка CD63 при иммуноблоттинге (Abramowicz et al., 2018).
В начале нашей работы мы оценили применимость ультрацентрифугирования для удаления экзосом из FBS с учетом задач последующего использования высокопроизводительных аналитических методов. Для увеличения эффективности осаждения сывороточных экзосом мы использовали два последовательных раунда 15-часового ультрацентрифугирования среды, содержащей 20% сыворотки, после чего верхнюю фракцию отбирали и использовали для культивирования клеток.
Ультрацентрифугированный препарат клеточных экзосом, полученный после культивирования клеток в среде с 5% FBS, освобожденной от ее собственных экзосом, мы проанализировали с помощью просвечивающей электронной микроскопии (рис. 1).
Рис. 1.
Электронные микрофотографии ультрацентрифугированного препарата клеточных экзосом после культивирования клеток в среде, содержащей 5% сыворотки (FBS), очищенной от экзосом. Наряду с отдельными экзосомами (звездочки), видны многочисленные хлопьевидные агрегаты сывороточных белков, покрывающие пленку-подложку (стрелки).

Очевидно, что количество неспецифических хлопьевидных агрегатов сывороточных белков в данной пробе в десятки раз превышает количество целевых экзосом, тем самым крайне затрудняя морфологический и молекулярный анализ данных везикул. Кроме того, по недавно опубликованным данным (Lehrich et al., 2018), ультрацентрифугирование FBS в принципе не приводит к полному удалению экзосом из сыворотки. Следовательно, мы не можем быть полностью уверены в происхождении экзосом (из клеток А549 или из FBS), представленных на рис. 1.
Для уточнения данных электронной микроскопии и идентификации наиболее обильных белков в пробе, мы провели ее электрофоретическое разделение в полиакриламидном геле (рис. 2), трипсинолиз и масс-спектрометрический анализ наиболее выраженных полос в геле.
Рис. 2.
ПААГ-электрофорез ультрацентрифугированного препарата клеточных экзосом после культивирования клеток A549 в среде, содержащей 5% FBS, очищенную от собственных экзосом (левая дорожка). 1, 2, 3, 4, 5, 6, 7 – наиболее выраженные полосы геля, для которых была выполнена масс-спектрометрическая идентификация. Справа показаны маркеры мол. массы.

По данным масс-спектрометрии, основными идентифицированными в образце белками являлись внеклеточные сывороточные белки: альфа-2-макроглобулин (рис. 2, полоса 2), сывороточный альбумин (рис. 2, полоса 7), аполипопротеин А (рис. 2, полоса 9). Экзосомальные белки не были выявлены масс-спектрометрически, то есть они не образуют выраженных полос при электрофоретическом разделении и присутствуют в значительно меньших концентрациях по сравнению с вышеперечисленными сывороточными белками. Маскирующий эффект преобладающих в образце сывороточных белков делает практически невозможным детальный протеомный анализ экзосом.
Таким образом, существующий протокол очистки FBS от экзосом не приводит к удовлетворительным результатам в рамках стоящих задач протеомного анализа. Учитывая это, дальнейшие эксперименты мы выполняли, культивируя клетки в течение 48 ч в бессывороточной среде DMEM. Хотя хорошо известно, что длительное сывороточное голодание в целом может ухудшать состояние клеток, останавливать их деление и, в конечном итоге, запускать апоптотическую гибель, мы не наблюдали заметных изменений морфологии клеточного монослоя клеток А549 в течение 48 ч в условиях голодания (данные не приводятся), что позволило нам использовать эту методику.
Анализ методов выделения клеточных экзосом. Мы использовали три принципиально разных подхода к выделению экзосом из культуральной среды – ультрацентрифугирование, гель-фильтрацию и осаждение коммерческим реагентом Total exosome isolation reagent. Конечный объем полученных препаратов экзосом во всех случаях составлял 500 мкл для удобства и достоверности сравнительного анализа полученных образцов.
Серия последовательных центрифугирований с конечным этапом ультрацентрифугирования считается классическим методом выделения экзосом из разных биологических жидкостей. Показано, что с помощью высокоскоростного ультрацентрифугирования можно получить препараты с хорошим выходом экзосом. Основными недостатками такого подхода являются трудо- и времязатратность, а также со-осаждение вместе с экзосомами различных высокомолекулярных белков и белковых комплексов, загрязняющих конечный препарат.
Хроматографические методы также широко применяются для выделения экзосом, одним из наиболее эффективных является гель-фильтрация, позволяющая отделить высокомолекулярные везикулярные структуры от низкомолекулярных примесных белков. При этом экзосомы элюируются с колонки в первую очередь, тогда как более мелкие компоненты задерживаются в порах сорбента.
Менее трудоемким способом получения экзосомальных препаратов является использование коммерческих наборов и реактивов. Согласно описанию производителей, такие наборы позволяют быстро и качественно получить чистые препараты экзосом без использования сложного оборудования. Однако закрытость информации о составе веществ в наборах, осаждающих экзосомы, затрудняет понимание их истинных возможностей и ограничений. Кроме того, большинство из них рассчитаны на небольшие объемы исходных образцов, что усложняет масштабирование данного подхода.
Основные стадии используемых в настоящей работе методов выделения и анализа экзосом отражены на схеме на рис. 3.
Динамическое светорассеяние. Результаты определения фракционного состава частиц в полученных препаратах экзосом с применением метода динамического светорассеивания представлены ниже (рис. 4).
Рис. 4.
Распределение размеров частиц в препаратах экзосом, выделенных тремя разными методами: а – ультрацентрифугированием, б – гель-фильтрацией, в – с использованием коммерческого Total exosome isolation reagent. Приведены графики, полученные с прибора Zetasizer Nano-ZSP (Malvern Instruments, Великобритания) с программным обеспечением Malvern Zetasizer Software 7.12. По горизонтали – размер частиц, нм; по вертикали – интенсивность сигнала, %.

При исследовании препарата экзосом, полученного методом ультрацентрифугирования (рис. 4а), ни автоматический подбор аттенуатора, ни разведение препарата не позволило получить достоверного разделения фракций микрочастиц. С некоторой вероятностью можно предположить в препарате наличие двух перекрывающихся фракций микрочастиц с преобладанием частиц диаметром около 300 нм, однако результат также может свидетельствовать о наличии в препарате смеси частиц разнородной как по размеру, так и по форме и оптическим свойствам. Вероятнее всего, в препарате содержится значительное количество примесных частиц (белков, белковых комплексов и агрегатов).
Выделение экзосом методом гель-фильтрации способствует получению гораздо более гомогенной фракции частиц (рис. 4б). Устойчивый пик этой фракции определяется при различных разведениях, лучше всего при десятикратном. Средний размер этой фракции несколько превышает 100 нм, что, однако, не исключает соответствие пика экзосомальной фракции. Определение размера частиц в смесовых (богатых белком) препаратах является ориентировочным и определяется многими факторами. Сопоставление данных динамического светорассеяния с обнаружением экзосомальных частиц электронной микроскопией позволяет заключить, что в препарате содержится преобладающая фракция экзосом в количестве, достаточном для определения при разведениях до 1000-кратного.
Наконец, в препарате, полученном с помощью коммерческого реагента Total exosome isolation reagent, методом динамического светорассеивания стабильно определялись две фракции микрочастиц, однако ни одна из них не соответствовала предполагаемому размеру экзосом. Наблюдали два пика, соответствующих совсем маленьким частицам (до 10 нм) и крупным частицам (более 1 мкм) (рис. 4в). Можно предположить, что в третьем образце присутствует два типа частиц, не соответствующих известным размерам экзосомальной фракции (около 100 нм).
Электронно-микроскопический анализ. Морфологическую оценку чистоты, размеров и формы частиц в составе полученных препаратов проводили с помощью просвечивающей электронной микроскопии. В препаратах после ультрацентрифугирования присутствуют внеклеточные везикулы, соответствующие по размерам (50–120 нм) и форме (чашеобразной) экзосомам. Помимо экзосом, в препаратах также наблюдали заметное количество хлопьевидных белковых агрегатов, которые со-осаждаются с экзосомами при центрифугировании на высоких оборотах (рис. 5).
Рис. 5.
Электронные микрофотографии экзосом в образце, полученном методом ультрацентрифугирования (стрелки). Помимо экзосом, в пробе присутствуют также хлопьевидные белковые агрегаты (звездочки).

В препаратах после гель-фильтрации (рис. 6) наблюдаемое под электронным микроскопом количество экзосом несколько уступает таковому в пробах после ультрацентрифугирования, хотя вполне достаточно для электронно-микроскопической визуализации. При этом неспецифические агрегаты примесных белков в данных образцах не выявляются, т.е. степень очистки препарата в случае гель-фильтрации существенно выше, по сравнению с ультрацентрифугированием.
Рис. 6.
Электронные микрофотографии вариантов экзосом в образце, полученном методом гель-фильтрации (стрелки). Неспецифические хлопьевидные агрегаты примесных белков в образце не выявляются.
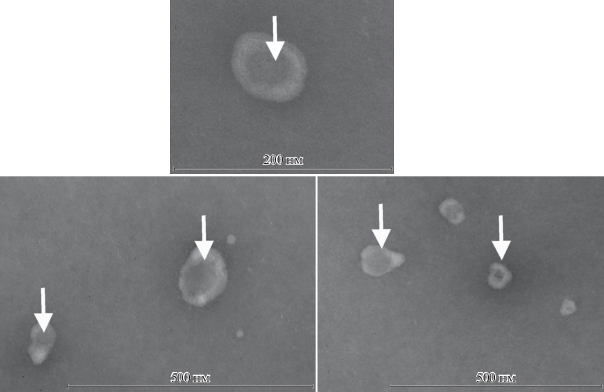
В случае препарата, полученного с помощью коммерческого реагента Total exosome isolation reagent (рис. 7) экзосом в пробе не наблюдали. Образец состоит из массы округлых электронно-плотных частиц различного диаметра, по-видимому, представляющих собой осажденный материал в составе реагента.
Рис. 7.
Электронная микрофотография препарата, полученного в результате выделения экзосом с использованием коммерческого реагента Total exosome isolation reagent. Экзосомы не наблюдаются. Видны многочисленные округлые электронно-плотные частицы различного диаметра.

Вестерн-блот-анализ. Метод был использован для иммунодетекции маркерного белка экзосом в полученных нами препаратах. При его проведении мы использовали моноклональные антитела к маркерному поверхностному белку экзосом аннексину А2. Результаты Вестерн-блотинга представлены на рис. 8.
Рис. 8.
Вестерн-блоттинг препаратов экзосом, полученных тремя различными способами. Дорожки: 1 – ультрацентрифугирование, 2 – гель-фильтрация, 3 – использование коммерческого реагента Total exosome isolation reagent. Иммунодетекция моноклональными антителами к аннексину 2.
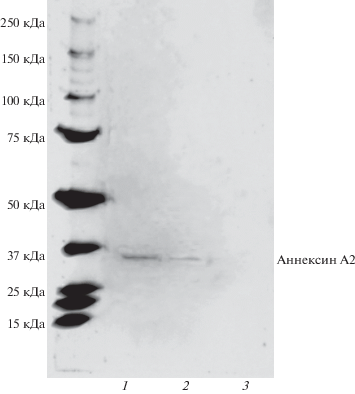
Специфические бэнды аннексина А2 (молекулярная масса около 37 кДа) обнаружены в пробах клеточных экзосом, выделенных ультрацентрифугированием и гель-фильтрацией, при этом при ультрацентрифугировании выявлен более интенсивный бэнд. Этот результат соответствует данным электронной микроскопии, согласно которым ультрацентрифугирование обеспечивает несколько более высокий выход экзосом по сравнению с гель-фильрацией. В пробе, полученной с помощью Total exosome isolation reagent, специфический бэнд аннексина А2 не обнаружен.
Таким образом, в настоящей работе мы проанализировали метод очистки эмбриональной сыворотки от экзосом (два раунда длительного ультрацентифугирования) для ее последующего использования в культивировании клеток, секретирующих экзосомы. Оказалось, что культуральная среда с такой сывороткой содержит огромное количество сывороточных белков (по результатам электронной микроскопии и масс-спектрометрической идентификации), что исключительно усложняет задачу анализа минорных экзосомальных белков клеточного происхождения. Поэтому оптимальным решением в данном случае является 48-часовое культивирование клеток, секретирующих экзосомы, в полностью бессывороточной среде.
Далее мы сравнили 3 метода выделения клеточных экзосом (ультрацентрифугирование, гель-фильтрация и использование коммерческого реагента Total exosome isolation reagent). Для анализа полученных препаратов использовали 3 подхода – электронную микроскопию, динамическое светорассеяние и Вестерн-блот-анализ с антителами к аннексину А2.
По совокупности полученных результатов, наболее высокий выход экзосом достигается путем ультрацентрифугирования. Однако данный протокол неизбежно приводит к со-осаждению вместе с экзосомами заметного количества неспецифических белков и белковых комплексов. Гель-фильтрация с предварительным концентрированием культуральной среды тангенциальной потоковой фильтрацией несколько уменьшает выход экзосом, однако обеспечивает несоизмеримо более высокую чистоту препарата (по данным электронной микроскопии и динамического светорассеяния). Применение реагента Total exosome isolation reagent не позволило детектировать экзосомы в пробе ни одним из использованных методов. Таким образом, по нашему мнению, гель-фильтрация с предварительным концентрированием культуральной среды тангенциальной потоковой фильтрацией является оптимальным методом выделения экзосом для задач последующего протеомного и транскриптомного анализа.
Список литературы
Abramowicz A., Marczak L., Wojakowska A., Zapotoczny S., Whiteside T.L., Widlak P., Pietrowska M. 2018. Harmonization of exosome isolation from culture supernatants for optimized proteomics analysis. PLoS One V. 13. P. e0205496. https://doi.org/10.1371/journal.pone.0205496
Abramowicz A., Widlak P., Pietrowska M. 2016. Proteomic analysis of exosomal cargo: The challenge of high purity vesicle isolation. Mol. Biosyst. V. 12. P. 1407. https://doi.org/10.1039/c6mb00082g
Admyre C., Johansson S.M., Rahman Qazi K., Filén J., Lahesmaa R., Norman M., Neve E.P.A., Scheynius A., Gabrielsson S. 2007. Exosomes with immune modulatory features are present in human breast milk. J. Immunol. V. 179. P. 1969. https://doi.org/10.4049/jimmunol.179.3.1969
Beninson L.A., Fleshner M. 2015. Exosomes in fetal bovine serum dampen primary macrophage IL-1β response to lipopolysaccharide (LPS) challenge. Immunol. Lett. V. 163. P. 187. https://doi.org/10.1016/j.imlet.2014.10.019
Bunggulawa E.J., Wang W., Yin T., Wang N., Durkan C., Wang Y., Wang G. 2018. Recent advancements in the use of exosomes as drug delivery systems. J. Nanobiotech. V. 16. P. 81. https://doi.org/10.1186/s12951-018-0403-9
Caby M.P., Lankar D., Vincendeau-Scherrer C., Raposo G., Bonnerot C. 2005. Exosomal-like vesicles are present in human blood plasma. Int. Immunol. V. 17. P. 879. https://doi.org/10.1093/intimm/dxh267
Colombo M., Raposo G., Théry C. 2014. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu. Rev. Cell. Dev. Biol. V. 30. P. 255. https://doi.org/10.1146/annurev-cellbio-101512-122326
Conde-Vancells J., Rodriguez-Suarez E., Gonzalez E., Berisa A., Embade N., Gil D., Matthiesen R., Valle M., Elortza F., Wagner C., Lu S.C., Mato J.M., Falcon-Perez J.M. 2010. Candidate biomarkers in exosome-like vesicles purified from rat and mouse urine samples. Proteomics Clin. Appl. V. 4. P. 416. https://doi.org/10.1002/prca.200900103
Keerthikumar S., Chisanga D., Ariyaratne D., Al Saffar H., Anand S., Zhao K., Samuel M., Pathan M., Jois M., Chilamkurti N., Gangoda L., Mathivanan S. 2016. ExoCarta: A web-based compendium of exosomal cargo. J. Mol. Biol. V. 428. P. 688. https://doi.org/10.1016/j.jmb.2015.09.019
Keller S., Rupp C., Stoeck A., Runz S., Fogel M., Lugert S., Hager H.D., Abdel-Bakky M.S., Gutwein P., Altevogt P. 2007. CD24 is a marker of exosomes secreted into urine and amniotic fluid. Kidney Int. V. 72. P.1095. https://doi.org/10.1038/sj.ki.5002486
Lehrich B.M., Liang Y., Khosrav P., Federoff H.J., Fiandac M.S. 2018. Fetal bovine serum-derived extracellular vesicles persist within vesicle-depleted culture media. Int. J. Mol. Sci. V. 19. P. 3538. https://doi.org/10.3390/ijms19113538
Marcos-Vadillo E. García-Sánchez A. 2016. Cell culture techniques: corticosteroid treatment in A549 human lung epithelial cell. Methods Mol. Biol. V. 1434. P. 169. https://doi.org/10.1007/978-1-4939-3652-6_12
Michael A., Bajracharya S.D., Yuen P.S.T., Zhou H., Star R.A., Illei G.G., Alevizos I. 2010. Exosomes from human saliva as a source of microRNA biomarkers. Oral Dis. V. 16. P. 34. https://doi.org/10.1111/j.1601-0825.2009.01604.x
Palmirotta R., Lovero D., Cafforio P., Felici C., Mannavola F., Pellè E., Quaresmini D., Tucci M., Silvestris F. 2018. Liquid biopsy of cancer: A multimodal diagnostic tool in clinical oncology. Ther. Adv. Med. Oncol. V. 10. P. 758 835 918 794 630. https://doi.org/10.1177/1758835918794630
Prado N., Marazuela E.G., Segura E., Fernández-García H., Villalba M., Théry C., Rodríguez R., Batanero E. 2008. Exosomes from bronchoalveolar fluid of tolerized mice prevent allergic reaction. J. Immunol. V. 181. P. 1519. https://doi.org/10.4049/jimmunol.181.2.1519
Purushothaman A., Bandari S.K., Liu J., Mobley J. A., Brown E.E., Sanderson R.D. 2016. Fibronectin on the surface of myeloma cell-derived exosomes mediates exosome-cell interactions. J. Biol. Chem. V. 291. P. 1652. https://doi.org/10.1074/jbc.M115.686295
Samanta S., Rajasingh S., Drosos N., Zhou Z., Dawn B., Rajasingh J. 2018. Exosomes: New molecular targets of diseases. Acta Pharmacol. Sin. V. 39. P. 501. https://doi.org/10.1038/aps.2017.162
Shelke G.V. Lässer C., Gho Y.S. Lötvall J. 2014. Importance of exosome depletion protocols to eliminate functional and RNA-containing extracellular vesicles from fetal bovine serum. J. Extracell. Ves. V. 3. P. 24783. https://doi.org/10.3402/jev.v3.24783
Stoorvogel W., Kleijmeer M.J., Geuze H.J., Raposo G. 2002. The biogenesis and functions of exosomes. Traffic. V. 3. P. 321. https://doi.org/10.1034/j.1600-0854.2002.30502.x
Vlassov A.V., Magdaleno S., Setterquist R., Conrad R. 2012. Exosomes: Current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials. Biochim. Biophys. Acta. V. 1 820. P. 940. https://doi.org/10.1016/j.bbagen.2012.03.017
Whiteside T.L. 2015. The potential of tumor-derived exosomes for noninvasive cancer monitoring. Expert Rev. Mol. Diagn. V. 15. P. 1293. https://doi.org/10.1586/14737159.2015.1071666
Zhou Q., Xie F., Zhou B., Li C., Kang Y., Wu B., Li L., Dai R. 2020. Fetal bovine serum-derived exosomes regulate the adipogenic differentiation of human bone marrow mesenchymal stromal cells in a cross-species manner. Differentiation. V. 115. P. 11. https://doi.org/10.1016/j.diff.2020.06.004
Дополнительные материалы отсутствуют.



