Цитология, 2021, T. 63, № 2, стр. 184-192
Опыт применения инкапсуляции в альгинат для исследования влияния EGF и FGF2 на пролиферацию клеток колоректального рака в условиях пониженной адгезии in vitro
С. Ю. Филиппова 1, *, А. О. Ситковская 1, Е. С. Бондаренко 1, И. А. Новикова 1, Д. А. Харагезов 1, В. В. Позднякова 1, О. В. Хохлова 1, О. И. Кит 1
1 Национальный медицинский исследовательский центр онкологии Министерства здравоохранения РФ
344037 Ростов-на-Дону, Россия
* E-mail: filsv@yandex.ru
Поступила в редакцию 22.10.2020
После доработки 30.11.2020
Принята к публикации 01.12.2020
Аннотация
Опухолевые стволовые клетки (ОСК) являются перспективными мишенями для разработки новых противораковых средств. Успехи в изучении свойств этой субпопуляции опухолевых клеток во многом зависят от подбора адекватных методов идентификации и выделения. Для оценки возможностей инкапсуляции в альгинат в контексте исследования свойств ОСК мы тестировали влияние факторов роста EGF и FGF2 на размер колоний культур колоректального рака в условиях пониженной адгезии. Исследование показало, что добавление экзогенных факторов роста приводит к замедлению роста колоний культуры НТ-29 и усилению роста Сасо-2, не оказывая существенного влияния на культуру клеток НСТ116. Таким образом, инкапсуляция в альгинат с дальнейшим измерением размера образующихся колоний может быть применена для создания теста, аналогичного классическому тесту на образование колоний в полужидком агаре, с перспективой дальнейшего расширения спектра применения метода с добавлением химических модификаций альгината, сокультивирования разных типов клеток и других дополнений.
Теория опухолевых стволовых клеток (ОСК) утверждает, что метастазирование, рост и возобновление опухоли поддерживаются небольшой субпопуляцией клеток, обладающих свойствами, присущими нормальным стволовым клеткам – способностью к самоподдержанию, устойчивостью к действию лекарственных препаратов, мощными механизмами репарации ДНК, устойчивостью к аноикису и др. (Пучинская, 2016; Battle, Clevers, 2017). Данная концепция вдохновила исследователей на разработку инновационных стратегий лечения рака, направленных не столько на уменьшение объема опухоли, сколько на прицельное уничтожение популяции ОСК (Du et al., 2019).
Успех исследований в области биологии ОСК связан с возможностью точной идентификации и выделения клеток опухоли, обладающих свойствами стволовых. Методы идентификации ОСК базируются на использовании присущих им характерных свойств, которые в общем можно разделить на три группы. К первой группе относятся методы, которые эксплуатируют способность ОСК к усиленной экскреции из клетки флуоресцентных красителей за счет увеличенной экспрессии ABC-транспортеров на их поверхности (Song et al., 2010; Pattabiraman, Weinberg, 2014). Усиленное выведение красителей применяется для идентификации и измерения побочной популяции (side population) (Shimoda et al., 2018) – субпопуляции клеток, слабо светящейся в канале используемого красителя (например, Hoechst 33 342 или Rhodamine 123), которая и принимается за ОСК в исследуемом материале. Ко второй группе методов относится идентификация специфических клеточных маркеров для определения выраженности свойств стволовости в культуре клеток или ткани опухоли. Молекулы CD44 и CD133, первоначально описанные для нормальных стволовых клеток, представляют собой два наиболее распространенных поверхностных маркера, используемых для идентификации ОСК (Глузман и др., 2020; Abbaszadegan et al., 2017). С развитием исследований в области биологии стволовых клеток, список специфических маркеров, как поверхностных, так и цитоплазматических, постоянно расширяется.
Третья группа методов основывается на устойчивости ОСК к аноикису – клеточной гибели, вызванной неправильным взаимодействием с молекулами внеклеточного матрикса. Это свойство используется для получения свободно плавающих сфер (онкосфер) при культивировании исследуемого клеточного материала в условиях низкой адгезии (Lobo et al., 2007). Количество и размер онкосфер в абсолютном или относительном выражении применяются в качестве показателей выраженности свойств стволовости в исследуемой культуре клеток или ткани опухоли (Lopez-Sánchez et al., 2014; Jang et al., 2018; Katakam et al., 2020). Технически это самый простой подход к изучению ОСК, так как не требует дорогих антител и использования специального оборудования. Необходимым условием постановки тестов на образование онкосфер является низкая плотность посадки (1–10 кл./мкл) с тем, чтобы нецелевые клетки не образовали конгломераты, которые затруднили бы подсчет истинных клонов – потомков отдельных ОСК (Coles-Takabe et al., 2008). Вместе с тем, низкая плотность посадки не всегда применима из-за биологических свойств исследуемых клеток, так как для проявления свойств стволовости могут быть необходимы паракринные сигналы от других клеток (Pastrana et al., 2011).
Для преодоления этого недостатка можно использовать заключение исследуемых клеток в гидрогель, который препятствует движению и слипанию клеток. Широко применяемое для этих целей заключение в 0.3–0.35%-ный агар (Borowicz et al., 2014; Horibata et al., 2015; Rajendran, Jain, 2018) затрудняет замену среды, что ограничивает длительность культивирования и плотность посадки клеток. Инкапсуляция клеток в отдельные бусины из агара снимает проблему замены среды и может быть использована для решения широкого круга исследовательских задач. В частности, инкапсуляцию в бусины из мягкого агара (0.8%) в оболочке из плотного агара (4.5%) использовали в экспериментах с длительным культивированием для обогащения и изучения свойств ОСК мышиной почечной карциномы (Smith et al., 2011; Gazda et al., 2013). Недостаток этого метода в том, что он требует применения минерального масла и достаточно длительного воздействия на клетки не физиологических условий. В то же самое время, заключение в близкий по химическому строению к агару полисахарид растительного происхождения – альгинат – не оказывает негативного воздействия на клетки (Lee, Mooney, 2012) и открывает дополнительные возможности по созданию моделей для изучения свойств ОСК.
Из-за гидрофильных остатков альгинат, как и агар, плохо адсорбирует на своей поверхности белки (Piras, Smith, 2020), из-за чего клетки не могут нормально прикрепиться к стенкам образующихся в альгинате пор даже в присутствии белков сыворотки. Поэтому альгинат может быть использован в качестве гидрогеля для тестирования способности клеток к колониеобразованию и является, таким образом, перспективным материалом для изучения клеток, проявляющих свойства стволовых. В качестве дополнительного преимущества можно указать на то, что химические свойства альгината могут быть модифицированы с получением широкого спектра биологически активных модификаций (Neves et al., 2020). Наконец, выращенные клетки без уменьшения жизнеспособности могут быть быстро выделены путем деполимеризаци альгината в растворе ЭДТА или цитрата натрия для дальнейшего анализа или культивирования (Dhamecha et al., 2019).
Альгинат удобен, прежде всего, тем, что быстро полимеризуется под действием двухвалентных ионов (Lee, Mooney, 2012), поэтому бусины из этого полисахарида с небольшой вариацией по объему можно получить без применения специального оборудования, а просто прокапывая с постоянной скоростью суспензию клеток в альгинате через иглу в раствор хлорида кальция при комнатной температуре (Dhamecha et al., 2019; Кит и др., 2020). Получаемые структуры устойчивы в большинстве сред культивирования, содержащих достаточное количество ионов кальция и менее хрупкие, чем бусины из агарозы, что облегчает длительное культивирование, в том числе и в экспериментах с сокультивированием. Особенное значение разработка систем сокультивирования ОСК с другими клеточными компонентами имеет для поиска новых терапевтических стратегий для лечения таких онкологических заболеваний, течение которых зависит от локального иммунного окружения опухоли и системного иммунного статуса больного, например, опухолей желудочно-кишечного тракта (Pernot et al., 2014; Колесников и др., 2016).
Для оценки возможностей инкапсуляции в альгинат в качестве платформы для изучения ОСК в настоящей работе мы тестировали влияние факторов роста на пролиферативную способность клеток, устойчивых к аноикису, в постоянных клеточных линиях колоректального рака, заключенных в альгинатные бусины.
МАТЕРИАЛ И МЕТОДИКА
Культуры клеток. Материалом для исследования служили постоянные культуры клеток колоректального рака (КРР) Сасо-2, НТ-29 и НСТ116. Клеточная линия Сасо-2 была получена из Института цитологии РАН (Санкт-Петербург, Россия). Клеточная линия НТ-29 была получена из Российского научного центра рентгенорадиологии Минздрава России (Москва, Россия). Клеточная линия НСТ116 была получена из Memorial Sloan Kettering Cancer Center (Нью-Йорк, США). Клетки всех линий культивировали в питательной среде DMEM (Gibco, США), содержащей 10% сыворотки (FBS; HyClone, США), при 37°С в атмосфере 5.5% СО2. Для исследования был подготовлен 1%-ный раствор альгината натрия (W201502; Sigma Aldrich, США) в фосфатно-солевом растворе Дульбекко (DPBS; Биолот, Россия), простерилизованном методом холодной стерилизации путем пропускания через фильтры с диаметром пор 0.22 мкм (Corning, США).
Инкапсуляция в альгинат и условия эксперимента. При достижении монослоем клеток 70%-ной конфлюентности их снимали с пластика при помощи раствора трипсин–Версена (1 : 1; Биолот, Россия). Далее часть клеток анализировали на наличие маркеров стволовости при помощи проточной цитофлуориметрии, а оставшиеся клетки ресуспендировали в растворе альгината до концентрации 105 кл./мл. Раствор альгината с клетками исследуемых культур КРР медленно капали через иглу 30G в стерильный охлажденный раствор хлорида кальция (100 мМ) с высоты 10 см. При соприкосновении с раствором хлорида кальция происходило мгновенное отверждение капель альгината и образование бусин диаметром 2.5–3 мм. Полученные бусины выдерживали для дополимеризации в растворе хлорида кальция еще 5 мин. После отверждения бусины отмывали охлажденной средой DMEM и помещали в среду культивирования, приготовленную в трех вариантах: 1) DMEM/F12 (Gibco, США), содержащая по 10 нг/мл факторов роста EGF (ПанЭко, Россия) и рекомбинантного FGF2 (СайСторЛаб, Россия); 2) DMEM/F12, содержащая 10% сыворотки FBS; 3) DMEM/F12, содержащая 10% FBS и по 10 нг/мл EGF и FGF2. Бусины с заключенными в них клетками культур КРР культивировали 14 сут с заменой среды на 3-, 7- и 10-е сут культивирования. На 14-е сут культивирования фотографировали образовавшиеся колонии. При помощи средств пакета ImageJ определяли площади колоний.
Проточная цитофлуориметрия. Анализ на наличие маркеров стволовости проводили на проточном цитофлуриметре FACSCantoII (BD, США) с использованием флуоресцентно меченых моноклональных антител к CD44 (BD, США) и CD133 (BD, США).
Статистический анализ. Статистический анализ полученных данных проводили с помощью пакета STATISTICA. Оценку статистической достоверности различий между показателями групп определяли по t-критерию Стьюдента. Данные выражали средними значениями и 0.95%-ным доверительным интервалом. В каждой клеточной линии было проведено измерение площади 300 колоний.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для того чтобы оценить количество ОСК в используемых культурах клеток КРР, мы провели тестирование на наличие маркеров стволовости перед инкапсуляцией клеток в альгинат. Согласно данным из литературы, одними из наиболее популярных маркеров ОСК клеток КРР являются CD44 и CD133 (Abbasian et al., 2019). Полученные данные свидетельствуют в пользу того, что исследуемые культуры клеток КРР разделились на две группы по содержанию этих маркеров: клетки Сасо-2 и НТ-29 характеризуются меньшим количеством маркера CD133, чем клетки НСТ116. Кроме того, культура НСТ116 демонстрировала более широкий диапазон маркера CD44 по сравнению с клетками культур Сасо-2 и НТ-29 (рис. 1).
Рис. 1.
Результаты проточно-цитометрического анализа культур колоректального рака Сасо-2, НТ-29 и НСТ116. По осям – интенсивность флуоресценции антител против CD133, меченных фикоэритрином (PE-CD133, горизонталь) и против CD44, меченных изотиоцианатом флуоресцеина (FITC-CD44, вертикаль). Квадранты Q1–Q4 условно разделяют субпопуляции клеток на положительные и отрицательные по интенсивности флуоресценции в канале выбранного флюорофора.
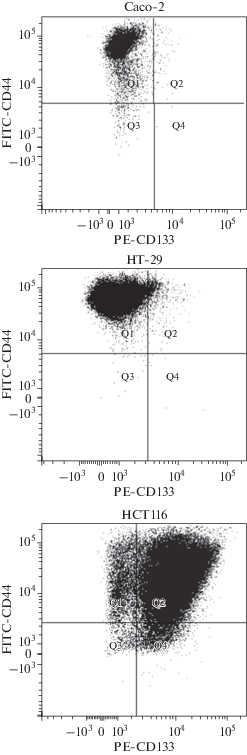
Полученные нами результаты лишь отчасти поддерживают данные других авторов. Например, количество маркера CD133 на клетках Сасо-2 было выше, чем на клетках НСТ116 в работе других авторов (Muraro et al., 2012), в то время как в нашем эксперименте наблюдается обратное. Тем не менее, данные по наличию маркера CD44 в клетках Сасо-2 и НСТ116 совпадают в обоих исследованиях. Кроме того, в отличие от наших данных, в другой работе (Sahlberg et al., 2014) содержания маркеров CD133 и CD44 в культурах клеток НСТ116 и НТ-29 были схожими. Объяснением наблюдаемых расхождений количеств маркеров ОСК в одних и тех же культурах клеток КРР могут быть непостоянные биологические свойства ОСК in vitro и in vivo, так как содержание маркеров и другие характеристики ОСК могут меняться при изменении условий оксигенации, доступности факторов роста, нутриентов и других причин (Thankamony et al., 2020). Кроме того, нельзя исключить вариацию экспериментальных методик и состояния культур клеток в момент проведения эксперимента в разных лабораториях.
Для тестирования влияния условий выращивания на клетки, которые устойчивы к аноикису, мы поставили эксперименты с тремя вариантами среды с включением факторов роста EGF и FGF2 на фоне добавления сыворотки и без сыворотки, а также только с сывороткой, но без добавления факторов роста.
Наличия только факторов роста в среде культивирования оказалось недостаточно для роста колоний даже в течение 14 сут (рис. 2а). Вероятно, в среде культивирования отсутствовали ключевые компоненты, обеспечивающие пролиферацию клеток. Традиционно среда для культивирования ОСК, в том числе клеток КРР, состоит из смеси DMEM/F12, содержащей В27, и факторов роста EGF и FGF2 (известного также как основной фактор роста фибробластов bFGF) в концентрациях 10–20 нг/мл (O’Brien et al., 2007; Kreso, O’Brien, 2008; Prasetyanti et al., 2013). Добавка В27 содержит разнообразные компоненты, обеспечивающие жизнедеятельность клеток, но не поддерживающие адгезию, и является, таким образом, заменителем сыворотки, который изначально был разработан для культивирования клеток нервной системы (Brewer et al., 1993), но позже получил широкое распространение и в работе с ОСК (Ledur et al., 2017). Использование альгината обеспечивает культивирование клеток в условиях пониженной адгезии даже при добавлении сыворотки, так как на поверхности альгинатных пор не происходит адсорбции белков, способствующих прикреплению клеток к субстрату. При этом сыворотка является источником необходимых нутриентов и гормонов, поддерживающих рост клеток, устойчивых к аноикису. Поэтому добавление сыворотки привело к росту многочисленных колоний во всех культурах, как с наличием факторов роста EGF и FGF2, так и без них (рис. 2а). Наряду с колониями в альгинате также наблюдали и отдельные клетки.
Рис. 2.
Влияние факторов роста на размер колоний, образуемых инкапсулированными в альгинат клетками культур колоректального рака Сасо-2, НТ-29 и НСТ116. Клетки культивировали 14 сут в среде DMEM/F12, содержащей 3 варианта добавок: только факторы роста (ФР) EGF и FGF2 по 10 нг/мл; только 10% сыворотки FBS; 10% FBS и ФР. а – Внешний вид образующихся колоний клеток культур КРР в трех вариантах эксперимента; увел. об.: 5×. б–г – Распределение значений площади колоний клеток культур КРР при культивировании в среде, содержащей ФР и в среде без ФР в присутствии сыворотки. д – Среднее значение площади колоний клеток при культивировании в среде в присутствии ФР и без ФР в присутствии сыворотки; вертикальные отрезки соответствуют 0.95%-ному доверительному интервалу.

Таким образом, исследуемые культуры клеток КРР продемонстрировали рост колоний в условии низкой адгезии. Предположительно, эти колонии являются клонами ОСК в исследуемых клеточных линиях и могут выступать в качестве объектов для изучения биологических особенностей этой клеточной популяции.
В качестве параметра интенсивности роста ОСК был использован размер колоний. Измерения показали, что добавление факторов роста в среду культивирования, содержащую сыворотку, вызвало разнонаправленную реакцию со стороны исследуемых культур клеток КРР (рис. 2б–г). Клетки Сасо-2 отреагировали на добавление факторов усилением пролиферации, а именно увеличилась частота появления колоний большего размера (3500–7500 мкм2) и сократилось число маленьких колоний (0–1500 мкм2). Характер распределения размеров колоний клеточной линии НСТ116 мало изменился при добавлении факторов роста в среду культивирования. В культуре клеток НТ-29 наблюдали замедление роста колоний, о чем можно судить по смещению модального класса размеров колоний с 3500–4000 к 2000–2500 мкм2 при добавлении факторов роста.
Сравнение среднего значения площади колоний культуры клеток Сасо-2 при наличии и отсутствии факторов роста показало его значительное увеличение при добавлении факторов роста: 1755.16 ± 195.87 мкм2 в отсутствие и 3270.57 ± 274.91 мкм2 в присутствии факторов (P < 0.05). Измерение площади колоний НСТ116 показало незначительную тенденцию к увеличению размеров колоний: 2844.89 ± 461.57 и 3530.31 ± 503.85 мкм2 без факторов роста и в их присутствии соответственно. Площадь колоний НТ-29 уменьшилась в среде с добавлением факторов роста: 4605.10 ± 324.02 мкм2 в среде без факторов и 3167.85 ± 249.07 мкм2 в присутствии факторов (P < < 0.05) (рис. 2д). Таким образом, несмотря на то, что культуры клеток Сасо-2 и НТ-29 имели одинаковую характеристику по наличию маркеров стволовости, их реакция на введение факторов роста оказалась противоположной.
Факторы роста, такие как EGF и FGF2 являются наиболее часто применяемыми компонентами среды культивирования ОСК (Ledur et al., 2017). Эти факторы участвуют в ряде сигнальных каскадов, усиливающих клеточную пролиферацию и выживаемость и играющих важную роль в канцерогенезе (Sigismund et al., 2018). Ожидается, что добавление факторов роста в среду культивирования должно простимулировать рост клеток и, в первую очередь, клеток со свойствами ОСК, так как в условиях низкой адгезии они получают пролиферативное преимущество, что и было продемонстрировано для Сасо-2. При этом для НСТ116 эффект добавления оказался слабо выраженным, а для НТ-29 – противоположным.
Наблюдаемые эффекты можно объяснить рядом причин. С одной стороны, Сасо-2 демонстрируют увеличенную экспрессию гена рецептора EGF (EG-FR) по сравнению с двумя другими культурами клеток, используемыми в нашей работе (Berg et al., 2017), что может способствовать усиленному ответу на стимуляцию фактора EGF. С другой стороны, торможение роста клеточных колоний культуры клеток НТ-29 может быть связано с сигнальным каскадом EGFR−PTEN, обладающим антимитогенной активностью, которая была описана на культуре клеток рака легкого (Ryu et al., 2017). Авторы этой работы обнаружили, что торможение роста культуры клеток рака легкого связано с усилением продукции активных форм кислорода под длительным действием EGF. Увеличение продукции активных форм кислорода, в свою очередь, через ряд сигнальных событий вызывает рост экспрессии онкосупрессора PTEN, мишенью которого является путь PI3K−Akt, отвечающий за пролиферацию опухолевых клеток (Hoxhaj, Manning, 2020).
Известно, что экспрессия генов, участвующих в сигнальном каскаде PI3K−Akt, повышена, в том числе в клетках НТ-29 и НСТ116 (Berg et al., 2017), которые негативно или слабо отреагировали на воздействие факторов роста в нашем исследовании. Кроме того, в этой же работе сказано, что уровень малой ГТФазы Rac1, участвующей в образовании активных форм кислорода под действием EGF (Dröge, 2002; Hordijk, 2006), в НТ-29 почти в два раза выше, чем в Сасо-2, а в НСТ116 наблюдается его промежуточное значение (Berg et al., 2017). Возможно, повышение содержания Rac1 способствует увеличению продукции активных форм кислорода в ответ на продолжительную стимуляцию EGF в культуре клеток НТ-29 и, в меньшей степени, в культуре клеток НСТ116, что также может быть объяснением наблюдаемого в нашей работе антимитогенного влияния факторов роста на эти две клеточные линии.
Для установления точных причин наблюдаемого парадоксального влияния факторов EGF и FGF2 на рост клеток КРР, заключенных в альгинат, требуются дальнейшие исследования. Однако полученные нами данные уже позволяют сделать вывод о том, что широкое применение традиционных сред для выделения ОСК с добавлением высоких концентраций факторов роста может быть под вопросом.
Таким образом, заключение в альгинат клеточных линий с определением размера образуемых колоний является адекватным методом изучения свойств ОСК, так как при этом сохраняются условия низкой адгезии и обеспечивается независимость роста отдельных клонов. При этом инкапсуляция в альгинат позволяет расширить возможности теста на колониеобразование и, например, создать на его основе экспериментальные модели с включением сокультивирования с суспензионными и адгезионными культурами.
Список литературы
Глузман Д.Ф., Фильченков А.А., Ивановская Т.С. 2020. Молекулярные маркеры поверхностных мембран для идентификации популяций стволовых клеток опухолей (Систематический обзор). Вопросы онкологии. Т. 66. № 4. С. 336. (Gluzman D.F., Philchenkov A.A., Ivanovskaya T.S. 2020. Cell surface molecular markers for identification of cancer stem cell populations (Systematic review). Voprosy Onkologii. V. 66. № 4. P. 336.)
Кит О.И., Филиппова С.Ю., Ситковская А.О., Позднякова В.В., Хохлова О.В. 2020. Влияние способа стерилизации на пролиферацию и жизнеспособность инкапсулированных в альгинатный гель клеток культуры MOLT-4. Российский биотерапевтический журн. Т. 19. № 3. С. 46. (Kit O.I., Filippova S.Yu., .Sitkovskaya A.O., Pozdnyakova V.V., Khokhlova O.V. 2020. Influence of the sterilization method on the proliferation and viability of molt-4 cells encapsulated in alginate gel. Russ. J. Biotherapy. V. 19. № 3. P. 46.)
Колесников В.Е., Кит О.И., Златник Е.Ю., Новикова И.А., Гранкина А.О., Геворкян Ю.А., Максимов А.Ю. 2016. Анализ иммунного статуса больных колоректальным раком после различных вариантов оперативного вмешательства. Современные проблемы науки и образования. 6. http://www.science-education.ru/ru/article/view?id=25733 (Kolesnikov V.E., Kit O.I., Zlatnik E.Yu., Novikova I.A., Grankina A.O., Gevorkyan Yu.A., Maksimov A.Yu. 2016. Analysis of immune status of patients with colorectal cancer after different options of surgical intervention. Sovremennye Problemy Nauki i Obrazovanija. 6. http://www.science-education.ru/ru/article/view?id=25733)
Пучинская М.В. 2016. Раковые стволовые клетки как возможный источник возникновения и прогрессирования опухолей. Вопросы онкологии. Т. 62. № 1. С. 14. (Puchinskaya M.V. 2016. Cancer stem cells as a possible source of tumor initiation and progression. Voprosy Onkologii. V. 62. № 1. P. 14.)
Abbasian M., Mousavi E., Arab-Bafrani Z., Sahebkar A. 2019. The most reliable surface marker for the identification of colorectal cancer stem-like cells: A systematic review and meta-analysis. J. Cell. Physiol. V. 234. P. 8192.
Abbaszadegan M.R., Bagheri V., Razavi M.S., Momtazi A.A., Sahebkar A., Gholamin M. 2017. Isolation, identification, and characterization of cancer stem cells: A review. J. Cell. Physiol. V. 232. P. 2008. https://doi.org/10.1002/jcp.25759
Batlle E., Clevers H. 2017. Cancer stem cells revisited. Nat. Med. V. 23. P. 1124. https://doi.org/10.1038/nm.4409
Berg K.C.G., Eide P.W., Eilertsen I.A., Johannessen B., Bruun J., Danielsen S.A., Bjørnslett M., Meza-Zepeda L.A., Eknæs M., Lind G.E., Myklebost O., Skotheim R.I., Sveen A., Lothe RA. 2017. Multi-omics of 34 colorectal cancer cell lines – a resource for biomedical studies. Mol. Cancer. V. 16. P. 116. https://doi.org/10.1186/s12943-017-0691-y
Borowicz S., Van Scoyk M., Avasarala S., Karuppusamy Rathinam M.K., Tauler J., Bikkavilli R.K., Winn R.A. 2014. The soft agar colony formation assay. J. Vis. Exp. V. 92. P. e51998. https://doi.org/10.3791/51998
Brewer G.J., Torricelli J.R., Evege E.K., Price P.J. 1993. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J. Neurosci. Res. V. 35 P. 567. https://doi.org/10.1002/jnr.490350513
Coles-Takabe B.L., Brain I., Purpura K.A., Karpowicz P., Zandstra P.W., Morshead C.M., van der Kooy D. 2008. Don’t look: growing clonal versus nonclonal neural stem cell colonies. Stem Cells. V. 26. P. 2938. https://doi.org/10.1634/stemcells.2008-0558
Dhamecha D., Movsas R., Sano U., Menon J.U. 2019. Applications of alginate microspheres in therapeutics delivery and cell culture: Past, present and future. Int. J. Pharm. V. 569. P. 118627. https://doi.org/10.1016/j.ijpharm.2019.118627
Dröge W. 2002. Free radicals in the physiological control of cell function. Physiol. Rev. V. 82. P.47. https://doi.org/10.1152/physrev.00018.2001
Du F.Y., Zhou Q.F., Sun W.J., Chen G.L. 2019. Targeting cancer stem cells in drug discovery: Current state and future perspectives. World J. Stem Cells. V. 11. P. 398. https://doi.org/10.4252/wjsc.v11.i7.398
Gazda L.S., Martis P.C., Laramore M.A., Bautista M.A., Dudley A., Vinerean H.V., Smith B.H. 2013. Treatment of agarose-agarose RENCA macrobeads with docetaxel selects for OCT4(+) cells with tumor-initiating capability. Cancer Biol. Ther. V. 14. P. 1147. https://doi.org/10.4161/cbt.26455
Hordijk P.L. 2006. Regulation of NADPH oxidases: The role of Rac proteins. Circ. Res. V. 98. P. 453. https://doi.org/10.1161/01.RES.0000204727.46710.5e
Horibata S., Vo T.V., Subramanian V., Thompson P.R., Coonrod S.A. 2015. Utilization of the soft agar colony formation assay to identify inhibitors of tumorigenicity in breast cancer cells. J. Vis. Exp. (99) : e52727. https://doi.org/10.3791/52727
Hoxhaj G., Manning B.D. 2020. The PI3K-AKT network at the interface of oncogenic signalling and cancer metabolism. Nat. Rev. Cancer. V. 20. P. 74. https://doi.org/10.1038/s41568-019-0216-7
Jang H.J., Bak Y., Pham T.H., Kwon S.B., Kim B.Y., Hong J., Yoon D.Y. 2018. STK899704 inhibits stemness of cancer stem cells and migration via the FAK-MEK-ERK pathway in HT29 cells. BMB Rep. V. 51. P. 596. https://doi.org/10.5483/BMBRep.2018.51.11.180
Katakam S.K., Pelucchi P., Cocola C., Reinbold R., Vlodavsky I., Greve B., Götte M. 2020. Syndecan-1-dependent regulation of heparanase affects invasiveness, stem cell properties, and therapeutic resistance of Caco2 colon cancer cells. Front. Oncol. 10 : 774. https://doi.org/10.3389/fonc.2020.00774
Kreso A., O’Brien C.A. 2008. Colon cancer stem cells. Curr. Protoc. Stem. Cell Biol. V. 7. P. 3.1.1. https://doi.org/10.1002/9780470151808.sc0301s7
Lee K.Y., Mooney D.J. 2012. Alginate: Properties and biomedical applications. Prog. Polym. Sci. V. 37. P. 106. https://doi.org/10.1016/j.progpolymsci.2011.06.003
Ledur P.F., Onzi G.R., Zong H., Lenz G. 2017. Culture conditions defining glioblastoma cells behavior: What is the impact for novel discoveries? Oncotarget. V. 8. P. 69185. https://doi.org/10.18632/oncotarget.20193
Lobo N.A., Shimono Y., Qian D., Clarke M. F. 2007. The biology of cancer stem cells. Annu. Rev. Cell Dev. Biol. № 23. P. 675. https://doi.org/10.1146/annurev.cellbio.22.010305.104154
Lopez-Sánchez L.M., Jimenez C., Valverde A., Hernandez V., Peñarando J., Martinez A., Lopez-Pedrera C., Muñoz-Castañeda J.R., De la Haba-Rodríguez J.R., Aranda E., Rodriguez-Ariza A. 2014. CoCl2, a mimic of hypoxia, induces formation of polyploid giant cells with stem characteristics in colon cancer. PLoS One. V. 9. P. e99143. https://doi.org/10.1371/journal.pone.0099143
Muraro M.G., Mele V., Däster S., Han J., Heberer M., Cesare Spagnoli G., Iezzi G. 2012. CD133+, CD166+CD44+, and CD24+CD44+ phenotypes fail to reliably identify cell populations with cancer stem cell functional features in established human colorectal cancer cell lines. Stem Cells Transl. Med. V. 1. P. 592. https://doi.org/10.5966/sctm.2012-0003
Neves M.I., Moroni L., Barrias C.C. 2020. Modulating alginate hydrogels for improved biological performance as cellular 3D microenvironments. Front. Bioeng. Biotechnol. V. P. 665. https://doi.org/10.3389/fbioe.2020.00665
O’Brien C.A., Pollett A., Gallinger S., Dick J.E. 2007. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice. Nature. V. 445. P. 106. https://doi.org/10.1038/nature05372
Pastrana E., Silva-Vargas V., Doetsch F. 2011. Eyes wide open: A critical review of sphere-formation as an assay for stem cells. Cell Stem Cell. V. 8. P. 486. https://doi.org/10.1016/j.stem.2011.04.007
Pattabiraman D. R., Weinberg R. A. 2014. Tackling the cancer stem cells – what challenges do they pose? Nat. Rev. Drug Discov. V. 13. P. 497. https://doi.org/10.1038/nrd4253
Pernot S., Terme M., Voron T., Colussi O., Marcheteau E., Tartour E., Taieb J. 2014. Colorectal cancer and immunity: What we know and perspectives. World J. Gastroenterol. V. 20. P. 3738. https://doi.org/10.3748/wjg.v20.i14.3738
Piras C.C., Smith D.K. 2020. Multicomponent polysaccharide alginate-based bioinks. J. Mater. Chem. B. V. 8. P. 8171. https://doi.org/10.1039/d0tb01005g
Prasetyanti P.R., Zimberlin C., De Sousa E., Melo F., Medema J.P. 2013. Isolation and propagation of colon cancer stem cells. Methods Mol. Biol. № 1035. P. 247. https://doi.org/10.1007/978-1-62703-508-8_21
Rajendran V., Jain M.V. 2018. In Vitro tumorigenic assay: Colony forming assay for cancer stem cells. Methods Mol. Biol. № 1692. P. 89. https://doi.org/10.1007/978-1-4939-7401-6_8
Ryu J.W., Choe S.S., Ryu S.H., Park E.Y., Lee B.W., Kim T.K., Ha C.H., Lee S.W. 2017. Paradoxical induction of growth arrest and apoptosis by EGF via the up-regulation of PTEN by activating Redox factor-1/Egr-1 in human lung cancer cells. Oncotarget. V. 8. P. 4181.
Sahlberg S.H., Spiegelberg D., Glimelius B., Stenerlöw B., Nestor M. 2014. Evaluation of cancer stem cell markers CD133, CD44, CD24: Association with AKT isoforms and radiation resistance in colon cancer cells. PLoS One. V. 9. P. e94621. https://doi.org/10.1371/journal.pone.0094621
Shimoda M., Ota M., Okada Y. 2018. Isolation of cancer stem cells by side population method. Methods Mol. Biol. № 1692. P. 49. https://doi.org/10.1007/978-1-4939-7401-6_5
Sigismund S., Avanzato D., Lanzetti L. 2018. Emerging functions of the EGFR in cancer. Mol. Oncol. V. 12. P. 3. https://doi.org/10.1002/1878-0261.12155
Smith B.H., Gazda L.S., Conn B.L., Jain K., Asina S., Levine D.M., Parker T.S., Laramore M.A., Martis P.C., Vinerean H.V., David E.M., Qiu S., Cordon-Cardo C., Hall R.D., Gordon B.R. et al. 2011. Three-dimensional culture of mouse renal carcinoma cells in agarose macrobeads selects for a subpopulation of cells with cancer stem cell or cancer progenitor properties. Cancer Res. V. 71. P. 716. https://doi.org/10.1158/0008-5472.CAN-10-2254
Song J., Chang I., Chen Z., Kang M., Wang C.-Y. 2010. Characterization of side populations in HNSCC: Highly invasive, chemoresistant and abnormal Wnt signaling. PLoS One. V. 5. P. e11456. https://doi.org/10.1371/journal.pone.0011456
Thankamony A.P., Saxena K., Murali R., Jolly M.K., Nair R. 2020. Cancer stem cell plasticity – a deadly deal. Front. Mol. Biosci. V. 7. P. 79. https://doi.org/10.3389/fmolb.2020.00079
Дополнительные материалы отсутствуют.


