Цитология, 2021, T. 63, № 2, стр. 105-115
Содержание нуклеиновых кислот в адгезирующих Т-лимфобластах линии Jurkat и их подвижность in vitro
Л. С. Литвинова 1, *, В. В. Шуплецова 1, К. А. Юрова 1, О. Г. Хазиахматова 1, Н. Д. Газатова 1, Н. М. Тодосенко 1, М. Ю. Хлусова 2, В. В. Малащенко 1, Е. О. Шунькин 1, Е. Д. Порохова 2, И. А. Хлусов 3, 4
1 Центр иммунологии и клеточных биотехнологий Балтийского федерального университета им. И. Канта
236041 Калининград, Россия
2 Кафедра патофизиологии Сибирского государственного медицинского университета
634034 Томск, Россия
3 Кафедра морфологии и общей патологии Сибирского государственного медицинского университета
634050 Томск, Россия
4 Исследовательская школа химических и биомедицинских технологий Национального исследовательского
Томского политехнического университета
634034 Томск, Россия
* E-mail: larisalitvinova@yandex.ru
Поступила в редакцию 30.10.2020
После доработки 17.11.2020
Принята к публикации 17.11.2020
Аннотация
Т-лимфобластоподобные лейкозные клетки человека линии Jurkat (Jurkat-T-клетки) образуют в суспензионной культуре полиплоидные формы с повышенным содержанием ДНК. Это способствует, вследствие выраженной генетической нестабильности, дальнейшей трансформации и развитию клонального разнообразия (поликлоновости) клеточной линии. Об адгезирующей субпопуляции Jurkat-T-клеток сведения немногочисленны. В настоящей работе анализировали содержание нуклеиновых кислот в суспензионной (ДНК) и адгезионной (ДНК, РНК) субпопуляциях Jurkat-T-клеток с использованием проточной цитометрии и красителя иодида пропидия, а также конфокальной лазерной микроскопии и красителя акридинового оранжевого. Морфологию и подвижность крупных (с диаметром более 15 мкм) прикрепившихся к пластику Jurkat-T-клеток изучали с использованием Cell-IQ фазово-контрастной микроскопии в реальном времени. По интенсивности флюоресценции в условно зеленом диапазоне длин волн (300–530 нм: от УФ до зеленого) и в условно красном (565–800 нм: от красного до дальнего красного) выделили 3 субпопуляции адгезирующих Jurkat-Т-клеток: с высоким, средним, и низким содержанием нуклеиновых кислот. Таким образом, Jurkat Т-клетки, адгезирующие к пластиковой поверхности планшетов, сохраняют выраженную гетерогенность в содержании ДНК, характерную для суспензионной фракции, что предполагает различие морфофункциональных свойств (поликлоновость) данной субпопуляции клеточной культуры. При резком нарастании общей клеточной массы доля крупных (гигантских; 15–50 и более мкм) клеток, прикрепившихся к пластику, на протяжении 21 сут культивирования оставалась постоянной и составляла 1% адгезирующей фракции. Установлено, что крупные Jurkat-Т-клетки (медианное значение диаметра 31 мкм) передвигались по пластику с линейной (по медиане) скоростью 38 мкм/ч. Морфологически идентифицируется полинуклеарность Jurkat-Т-клеток на пластике; выявлен линейный рост подвижности адгезирующих клеток с увеличением их диаметра (коэффициент регресcии r = 0.33; p < 0.02; n = 52). Обсуждаются возможные клеточно-молекулярные механизмы повышенного числа копий ДНК в части адгезирующих Jurkat-Т-клеток. Предполагается, что обнаруженное новое свойство (двигательная активность) может обеспечивать полиплоидным (многоядерным) адгезирующим Jurkat-T-клеткам существенное преимущество направленной миграции (хемотаксиса) в растущей клеточной популяции в условиях недостатка нутриентов, обусловленного сменой питательной среды через 3–4 сут культивирования.
Т-лимфобластоподобные лейкозные клетки человека линии Jurkat (Jurkat-T-клетки) c 80-х годов XX века являются наиболее известной и популярной моделью для изучения внутриклеточного сигналинга и Т-клеточной активации (Abraham, Weiss, 2004), исследования экспрессии генов, иммунных и цитотоксических реакций на различные раздражители (Tuomela et al., 2013; Khlusov et al., 2018). Многие аспекты жизнедеятельности штаммов Jurkat-T-клеток актуальны и в настоящее время (Fabre et al., 2008; Yang et al., 2019).
Высокая генетическая нестабильность культуры Jurkat-T-клеток, обусловленная вариациями числа и структуры хромосом, генными мутациями (Мамаева, 2002; Gioia et al., 2018), приводит к гетерогенности генома, которая в суспензионной части клеточной культуры возрастает со временем культивирования (Snow, Judd, 1987). Часть мутаций имеет место в генах, вовлекаемых в сигнальные пути Т-клеточного рецептора (Gioia et al., 2018), определяющего, в том числе, перестройки цитоскелета в этих клетках (Abraham, Weiss, 2004). Тем не менее, при общем количестве ссылок в базе Pubmed порядка 700–900 в год за период 2000–2015 гг., касающихся всех проблем изучения клеточной линии Jurkat (Gioia et al., 2018), статьи, описывающие свойства ее адгезирующей субпопуляции, немногочисленны. Например, Jurkat-T-клетки адгезируют к различным субстратам (Cárcamo et al., 2006), что может провоцировать процессы дефектного цитокинеза и эндомитоза, приводящего к усилению мутагенеза, образованию анеу- и полиплоидных, а также многоядерных клеток, способствующих появлению новых клонов клеточной линии (Huang et al., 2005). Однако авторы отмечают, что описанные клеточно-молекулярные процессы менее характерны для Jurkat-T-клеток в сравнении с другими лейкозными линиями. Кроме того, при общем интересе к подвижности Т-лимфоцитов (Arkhipov, Maly, 2015) большинство публикаций в отношении Jurkat-T-клеток посвящено инвазии (хемотаксису) их суспензионной фракции через полупроницаемые мембраны в камере Бойдена (Edmond et al., 2015). Таким образом, существует явный дефицит сведений о морфофункциональных свойствах адгезирующей субпопуляции лейкозных Т-лимфобластов линии Jurkat и возможном биологическом значении ее формирования.
В связи с этим, цель исследования заключалась в определении содержания нуклеиновых кислот и подвижности in vitro Jurkat-T-клеток, прикрепляющихся к пластику, с использованием конфокальной сканирующей лазерной микроскопии и Cell-IQ фазово-контрастной микроскопии.
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток. Использовали иммортализированную линию Jurkat лейкозных Т-лимфобластоподобных клеток человека из Российской коллекции клеточных культур позвоночных Института цитологии РАН, Санкт-Петербург), стандартизированную до 5.25 × 104 клеток в 1 мл полной питательной среды (ППС) при 95%-ной жизнеспособности. Клетки культивировали в 12-луночных планшетах (Orange Scientific, Бельгия) в ППС, содержащей RPMI 1640 с L-глютамином (Gibco Life Technologies, Великобритания), 10% инактивированной (при 56°С в течение 30 мин) сыворотки крови эмбрионов коров (Gibco, Германия), 0.5 мкмоль/л β-меркаптоэтанола (AcrosOrganics, США), 100 мкг/мл пенициллин и 100 Ед./мл стрептомицина (Gibco Life Technologies, США). Клетки культивировали в течение 7 сут при 37°С во влажной атмосфере, содержащей 5% СO2 с однократной сменой среды на 3 сут. При 21-суточном культивировании исходное число Jurkat-Т-клеток при посеве составило 1.05 × 106 клеток (при 95% жизнеспособности) в 1 мл той же ППС. Замену среды проводили каждые 3–4 сут.
Проточная цитометрия. Через 7 сут культивирования клеток собирали надосадочную жидкость с фракцией суспензионных клеток, которые далее анализировали методом проточной цитометрии, используя цитофлюориметр MACS Quant (Miltenyi Biotec, Германия). Долю (%) жизнеспособных клеток и клеток, погибших путем апоптоза или некроза, определяли при помощи набора реагентов ViaCount® (Merck, США) (рис. 1) в соответствии с инструкцией фирмы-производителя. Для детекции содержания нуклеиновых кислот клетки фиксировали в холодном 70%-ном этаноле (30 мин при 4°C) c последующей двукратной отмывкой в фосфатно-солевом буфере (PBS) с помощью центрифугирования (1500 об./мин в течение 15 мин), обрабатывали РНКазой A (Sigma-Aldrich, США) и окрашивали йодидом пропидия (PI) в соответствии с инструкцией производителя (Thermo Fisher Scientific, США). Цитофлуорометрические результаты обрабатывали с помощью программы KALUZA Analysis Software (Beckman Coulter, США).
Рис. 1.
Гистограмма распределения суспензионных Jurkat-Т-клеток по жизнеспособности до начала культивирования (а) и через 7 сут культивирования (б). Проточная цитометрия с использованием набора реактивов для определения жизнеспособности Guava ViaCount® (Merck, США); PI – йодистый пропидий.

Световая микроскопия. Адгезирующие к пластику Jurkat-T-клетки через 21 сут культивирования сушили на воздухе, фиксировали и окрашивали 2%-ным раствором ализаринового красного S (Sigma-Aldrich, США). Цитологические препараты микроскопировали в проходящем свете на микроскопе AxioScope 40 (Carl Zeiss, Jena, Германия) при увеличении объектива (4–20)×, фотографировали с помощью фотоаппарата Canon Power Shot G10 (Canon Inc., Япония) с разрешением 14.7 мегапикселей и аппаратно-программного комплекса AxioVision 4.6 (Carl Zeiss, Jena, Германия).
Конфокальная лазерная микроскопия. В 7-суточной культуре прикрепившиеся к пластику клетки окрашивали флюорохроматическим красителем акридиновым оранжевым (Sigma-Aldrich, США), который связывается с нуклеиновыми кислотами (Plemel, 2016). Акридиновый оранжевый существовует в растворе как в мономерной, так и димерной форме. Мономеры красителя образуют комплексы с двухспиральной нуклеиновой кислотой (ДНК, двуспиральной РНК некоторых вирусов), в то время как димеры – с односпиральными нуклеиновыми кислотами (РНК, односпиральными ДНК некоторых вирусов и бактериофагов, деполимеризованной ДНК). При воздействии на клетку ультрафиолетового (405 нм) и голубого (488 нм) излучения комплексы акридинового оранжевого с РНК флуоресцируют в красном диапазоне (650 нм), с двунитевой ДНК – в зеленом спектре длин (527 нм).
Раздельная съемка условно зеленого (300–530 нм; от УФ до зеленого спектра) и красного (565–800 нм; от красного до дальнего красного спектра) каналов флюоресценции с использованием конфокальной сканирующей лазерной микроскопии (микроскоп LSM-700; Carl Zeiss, Германия) позволила провести оценку интенсивности окрашивания ДНК и РНК. Для каждой из 3-х лунок планшета с клетками выбирали 10 областей визуализации. Цитоморфометрическое исследование площади и числа клеток проводили с использованием инструментов компьютерной программы Adobe Photoshop CS6 (Adobe Inc., США), как описано ранее (Шахов и др., 2004), в соответствии с принципами компьютерной морфометрии цифровых изображений (Автандилов, 2006). Интенсивность флуоресценции 433 клеток после окраски определяли в каждой из 3-х лунок в 10 областях визуализации (всего 30 областей).
Фазово-контрастная микроскопия. Морфологию и подвижность прикрепившихся к пластику Jurkat-T-клеток изучали в течение 7 сут с использованием интегрированной платформы для непрерывной фазово-контрастной визуализации живых клеток в реальном времени Cell-IQ® v2 MLF (CM Technologies, Финляндия) как описано ранее для мультипотентных мезенхимных стромальных клеток жировой ткани (Litvinova et al., 2017). При ручной обработке цифровых видеофильмов определяли линейную скорость свободного движения клеток до их вступления в межклеточные контакты. В связи с вариабельностью формы и различными размерами мигрирующих Jurkat-T-клеток расстояние, пройденное клеткой, оценивали по перемещению ядра.
Статистический анализ. При анализе полученных данных использовали возможности стандартного пакета STATISTICA for Windows версия 13.3. Нормальность распределения в выборке проверяли с помощью критерия Колмогорова-Смирнова. Рассчитывали параметры распределений: медиану (Ме), 25%-ный (Q1) и 75%-ный (Q3) квартили, определяли корреляционные (rS – по Спирмену) и регрессионные (r) зависимости показателей. Различия считали статистически значимыми согласно критерию Манна−Уитни при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ
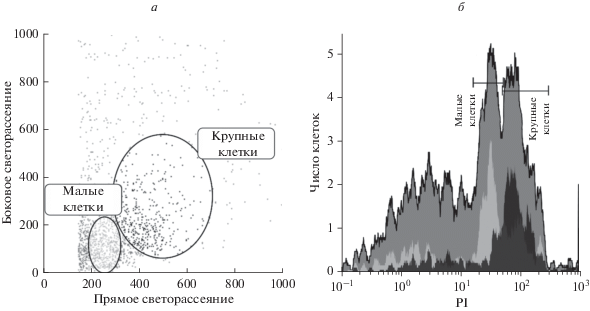
В суспензионной культуре Jurkat Т-клеток после 7-суточного культивирования доля жизнеспособных клеток (рис. 1) составила в среднем 91% при 9% клеток, погибших путем апоптоза (5%) или некроза (4%) при исходных (до культивирования) значениях 95, 4 и 1% соответственно. Проточная цитометрия (рис. 2) показала присутствие нескольких субпопуляций в суспензии Jurkat-T-клеток, статистически значимо (р < 0.05) различающихся по интенсивности флуоресценции (ИФ) нуклеиновых кислот при окраске PI (табл. 1). Так, обнаружены слабо окрашенные клетки (медиана ИФ 3.59 усл. ед), предположительно апоптотические тельца, содержащие фрагментированную ДНК, а также гаплоидные формы, доля которых в геноме клеток линии Jurkat может достигать нескольких процентов согласно данным из литературы (Gioia et al., 2018). Выявлена и неоднородная фракция клеток по медиане ИФ (в диапазоне 21.29–117.05–232.61) (рис. 2) и размерам (рис. 3). В сумме их относительное количество в популяции достигает 82.46% по медианам. Вероятно, это клетки с 2−4 копиями ДНК, доля которых является основной в геноме линии Jurkat, поскольку составляет не менее 79% (Gioia et al., 2018). Малая фракция клеток (3.93%)
Рис. 2.
Распределение суспензионных Jurkat-Т-клеток по интенсивности флюоресценции после окраски йодидом пропидия (PI) через 7 сут культивирования. Проточная цитометрия, показаны данные трех экспериментов (а, б, в). Выделены фракции: слабо окрашенных клеток (1), гетерогенной по размерам и интенсивности флюоресценции (2, 3, 4) и клеток с максимальной интенсивностью флюоресценции (5).

Таблица 1.
Доля суспензионных Jurkat-T-клеток c различным содержанием нуклеиновых кислот и интенсивность их флуоресценции (ИФ) после 7-суточного культивирования. Проточная цитометрия, окраска фиксированных клеток йодидом пропидия
| Доля клеток в суспензии, % | 14.68 (9.61–15.73) |
25.04 (24.76–27.52) |
25.46 (24.19–26.06) |
31.96 (25.50–36.04) |
3.93 (2.47–7.26) |
|---|---|---|---|---|---|
| ИФ, усл. ед. | 3.59 (3.02–4.02) |
21.29 (20.74–23.29) |
117.05 (102.17–135.98) |
232.61 (221.54–285.15) |
618.97 (459.31–664.15) |
Примечание. В табл. 1–3 результаты представлены как Me (Q1–Q3), выборки включали клетки из 3 лунок планшета (n). Различия между ИФ всех субпопуляций статистически значимы (р < 0.05).
Рис. 3.
Гетерогенность суспензионных Jurkat-Т-клеток по размерам и интенсивности флюоресценции при гейтировании по прямому и боковому светорассеянию (а) и окраске йодидом пропидия (PI, б) через 7 сут культивирования согласно данным проточной цитометрии.
По данным из литературы, Jurkat-Т-клетки являются, преимущественно, тетраплоидами (более 65% генома) с анеуплоидными вариациями и частотой полиплоидии до 8% (Мамаева, 2002; Marie et al., 2013; Gioia et al., 2018). Наши данные по окраске нуклеиновых кислот в целом соответствуют сведениям о гетерогенности суспензионной культуры этих клеток, полученным при кариологическом анализе и секвенировании генома (Snow, Judd, 1987; Мамаева, 2002; Marie et al., 2013; Gioia et al., 2018). В связи с этим методический подход, основанный на флуоресцентной окраске нуклеиновых кислот, использовали для изучения адгезирующей фракции Jurkat-Т-клеток.
При культивировании на протяжении 7 сут часть Jurkat-T-клеток адгезировала к пластиковой поверхности культуральных планшетов (рис. 4) и не смывалась при удалении суспензионной части клеточной культуры. При этом выявлена субпопуляция крупных клеток с диаметром до 50 мкм и более, способных прикрепляться к пластиковой поверхности культуральных планшетов и принимающих неправильную, иногда фибробластоподобную, форму (рис. 4).
Рис. 4.
Варианты морфологии крупных Jurkat-Т-клеток, адгезированных на пластике через 21 сут культивирования. а, в, г – окраска ализариновым красным; б – 7-суточная культура, неокрашенные клетки в фазовом контрасте. Показаны многоядерные клетки (а, б), делящаяся клетка (в) и фибробластоподобная клетка (г).

С использованием Cell-IQ фазово-контрастной микроскопии нами измерена подвижность Jurkat-T-клеток, прикрепившихся к пластику. Время начала движения клеток варьировало в интервале 10–60 ч культивирования. В последующие сроки резкое увеличение клеточной массы (рис. 5) не позволяло визуализировать отдельные клетки на пластиковой поверхности планшетов.
Рис. 5.
Динамика изменения числа Jurkat-Т-клеток в течение 7 сут культивирования. Наблюдение с помощью Cell-IQ фазово-контрастной микроскопии.

Корреляционная зависимость скорости движения клеток от времени начала их движения не выявлена, что позволило объединить данные в одну выборку (табл. 2). Диаметр изученных клеток варьировал от 16 до 42 мкм, поскольку при микроскопии мелкие клетки сливались с общей массой, а клетки с диаметром 50 мкм (рис. 2) встречались редко. Крупные клетки (медианный диаметр 31 мкм) передвигались по неправильной траектории с короткими (2-часовыми) линейными участками движения с медианной скоростью 38 мкм/ч (табл. 2), что сопоставимо с таковой для мезенхимных стволовых клеток жировой ткани человека (Литвинова и др., 2017). Линейная связь скорости миграции Jurkat-Т-клеток с их диаметром (коэффициент регресcии r = 0.33; p < 0.02; n = 52; y = = –5.3 + 1.92x) свидетельствует в пользу жизнеспособности части субпопуляции крупных Т-лимфобластов.
Таблица 2.
Подвижность крупных Jurkat-T-клеток в 7-суточной культуре
| Диаметр клеток, мкм |
Измеренное время линейного движения клеток, ч | Пройденное расстояние, мкм | Линейная скорость свободного движения клеток, мкм/час |
|---|---|---|---|
| 30.6 (25.0–33.3) | 2.0 (1.5–3.0) | 102.8 (44.4–151.3) | 38.4 (24.0–72.9) |
Согласно данным конфокальной микроскопии площадь и диаметр прилипающих к пластику Jurkat-Т-клеток тесно коррелировали (rS = 0.98; p < 0.0001; n = 433), поэтому в дальнейшем использовали линейный размер клеток. Основная часть (95%) прикрепившихся к пластику лейкозных клеток имела диаметр в пределах 8–18 мкм с медианой 15 мкм. Единичные клетки (12 кл.) обладали крупным размером – более 20 мкм (рис. 6а). По интенсивности флуоресценции нуклеиновых кислот в зеленой части спектра (рис. 6а) были выделены 3 следующие субпопуляции прилипающих Jurkat Т-клеток.
Рис. 6.
Распределение интенсивности флуоресценции акридинового оранжевого в Jurkat-T-клетках, адгезированных на пла-стике, в зеленой (527 нм, а) и красной (650 нм, б) частях спектра. В зеленом цвете флуоресцирует двунитевая ДНК, в красном – РНК.
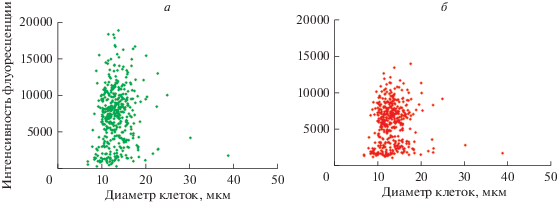
1) Клетки с интенсивностью флуоресценции двунитевой ДНК менее 5000 усл. ед. (24.5%; вероятно, это диплоидные, анеуплоидные и мертвые клетки). Возможно, в этой фракции находятся гаплоидные формы вследствие редуктивного митоза тетраплоидов (Storchova, Pellman, 2004), составляющих более половины всей клеточной популяции (табл. 1).
2) Клетки с интенсивностью флуоресценции 5000–14000 усл. ед. (70.5%; предположительно, это тетраплоидные и анеуплоидные клетки).
3) Клетки с интенсивностью флуоресценции более 14000 усл. ед. (5%; по-видимому, это полиплоидные и анеуплоидные клетки).
Jurkat Т-клетки склонны к анеуплоидии, которая усиливается при их адгезии к субстрату (Huang et al., 2005). Этот факт учитывали при интерпретации полученных данных. При этом результаты, полученные на адгезионной и суспензионной субпопуляциях клеток при окраске различными флюорохромными красителями (PI и акридиновым оранжевым), во многом совпадают (табл. 1, рис. 6а), прежде всего, по доле полиплоидных форм.
Из рис. 6а следует, что в общей популяции лейкозных клеток с увеличением линейных размеров клетки интенсивность зеленого свечения ДНК снижалась, достигая 2000 усл. ед. при диаметре 40 мкм. Однако статистически значимая линейная регрессия не выявлена (r = 0.05; p > 0.49; n = 433). Из общей популяции клеток была изучена выборка крупных прикрепляющихся Jurkat Т-клеток с диаметром выше медианного (>15 мкм; 95 клеток) и высокими значениями интенсивности флуоресценции (14 000 усл. ед. и выше) при предположении, что это соответствует полиплоидному набору хромосом. Подобных клеток оказалось всего 6 из 95, и достоверная линейная связь полиплоидии и клеточного диаметра также не установлена (r = 0.24; p > 0.64; n = 6).
Одним из очевидных объяснений отсутствия корреляции содержания ДНК и размеров ядра может быть повышенная гибель части Jurkat-Т-клеток с увеличением их диаметра, снижающая интенсивность окраски двунитевой ДНК вследствие ее деградации. В какой-то мере это действительно имеет место, поскольку часть крупных клеток и их ядер прокрашивалась ализариновым красным (рис. 4а), что нехарактерно для данного красителя и свидетельствует, по-видимому, о пермеабилизации клеточных мембран. Повышенную тенденцию к клеточной гибели можно предполагать при диаметре адгезирующих Jurkat-Т-клеток более 24 мкм, когда отчетливо снижается интенсивность флюоресценции не только ДНК (рис. 6а), но и молекул РНК (рис. 6б). В остальных случаях при окраске акридиновым оранжевым адгезирующих Jurkat-Т-клеток с диаметром до 20 мкм интенсивность флуоресценции их РНК в красной части спектра (рис. 6б) так же, как и ДНК (рис. 6а), разделялась на 3 кластера: менее 4000, 4000–10 000 и более 10 000 усл. ед. Тесная корреляционная связь флюоресценции ДНК и РНК (rS = 0.91; p < 0.001; n = 95) в крупных (>15 мкм) адгезирующих к пластику Jurkat-Т-клетках характеризует, по-видимому, их сбалансированную синтетическую активность (Plemel et al., 2017), говорящую о метаболической активности клеток.
В пользу жизнеспособности части (r2 = 0.332 = = 0.11) субпопуляции крупных Т-лимфобластов, прикрепившихся к пластику, свидетельствует также их подвижность, описанная выше и растущая с увеличением линейных размеров клеток, приводящая к появлению фибробластоподобных форм (рис. 4г). Эти клетки делились, но достаточно редко и, как правило, асимметрично с неравномерным расхождением генетического материала (рис. 4в). Действительно, полиплоидные опухолевые клетки делятся мало вследствие G0/G1-блока фаз клеточного цикла (Coward, Harding, 2014). Согласно Cell-IQ-фазово-контрастной микроскопии, общая клеточность в культуре Jurkat-Т-клеток росла (рис. 5); в адгезирующей фракции (табл. 3) скорость прироста при периоде наблюдений 165 ч (7 сут) составила 8.56 (4.09–9.55) кл./ч.
Таблица 3.
Количество крупных (диаметр >15 мкм) адгезированных Jurkat-T-клеток при культивировании в течение 7 и 21 сут
| 7 сут (n = 3) | 21 сут (n = 6) | ||
|---|---|---|---|
| крупные клетки, % | число всех клеток в поле зрения | крупные клетки, % | число всех клеток в лунке |
| 0.70 (0.53–1.69) n1 = 18 |
1413 (675–1575) n1 = 18 |
1.11 (0.66–1.84) | 10 093 (3443–32968) |
При этом данный показатель положительно коррелировал (rS = 0.75; p < 0.001; n = 18) со скоростью миграции крупных клеточных форм (0.087 (0.073–0.125 кл./ч)). Однако доля крупных адгезирующих Т-клеток, независимо от времени наблюдения (7 или 21 сут) и исходного числа клеток в культуре, оставалась постоянной и варьировала в пределах 1% (табл. 3). По-видимому, часть активно растущей субпопуляции адгезирующих мононуклеарных клеток трансформируется в консервативные полиплоидные (многоядерные) формы.
ОБСУЖДЕНИЕ
Вопрос интерпретации полученных in vitro данных достаточно сложен. Известно, что Jurkat-T-клетки адгезируют на других клетках (Kurita-Ochiai et al., 2004), а также на поверхностях, обработанных поли-L/D-лизином (Huang et al., 2005), галектином-8 (Cárcamo et al., 2006), фибронектином (Kim et al., 1999) и, по-видимому, другими молекулами внеклеточного матрикса, взаимодействующими с антигеном CD44 на клеточной мембране (Kurita-Ochiai et al., 2004) и способствующими хемотаксису. Способность крупных Jurkat T-клеток адгезировать не только к пластику, но и к рельефным металлическим поверхностям (Khlusov et al., 2018), в совокупности с обнаруженной двигательной активностью (табл. 2) свидетельствуют об интересных свойствах, нехарактерных для пролиферирующих лимфобластов.
Существенный прирост линейных размеров клетки с увеличением плоидности ядра и (или) многоядерностью является общеизвестным фактом. Например, прикрепление к пластику ослабляет цитокинез клеток L1210 лимфомы мыши, что в период 2–4 сут культивирования приводит к эндомитозу, нарастанию плоидности и количества многоядерных клеточных форм с резким увеличением клеточного объема (Huang et al., 2005). Однако в субпопуляции крупных (гигантских: 15–50 мкм и более) Jurkat-Т-клеток, адгезирующих к пластику при 7-суточном культивировании, тесная связь содержания ДНК и клеточного диаметра нами не обнаружена. Тем не менее, полинуклеарность крупных Jurkat-Т-клеток идентифицируется морфологически (рис. 4).
Полиплоиды (поликарионы) образуются за счет трех механизмов: эндорепликации (эндомитоза), абортивного клеточного цикла (приводит к тетраплоидии) или клеточного слияния, в том числе, в ответ на механический стресс (Storchova, Pellman, 2004), связанный, в частности, с адгезией к искусственной пластиковой поверхности. По-видимому, медленный темп делений обусловливает постоянность клеточной популяции крупных адгезирующих клеток (табл. 3) и способствует росту их размеров согласно данным обзорной статьи (Storchova, Pellman, 2004).
Значительные вариации содержания ДНК, обнаруженные в ядре крупных адгезирующих клеток (рис. 6а), предполагают сосуществование форм с 2–10 и более копиями ДНК, как это описано для суспензионной культуры Jurkat-Т-клеток (Gioia et al., 2018). Как показано ранее другими авторами (Huang et al., 2005), механизм эндомитоза нехарактерен для формирования полиплоидии (многоядерности) Jurkat- Т-клеток. Мы предполагаем, что активность этого механизма снижается при клеточном диаметре более 18–20 мкм, поскольку наблюдается тенденция к снижению содержания ДНК (рис. 6а). В результате возникает гипотеза, что при диаметре Jurkat-Т-клеток более 15 мкм снижается их митотическая активность, которая может сопровождаться повышенным слиянием клеток в многоядерные формы (третий механизм полиплоидии). Гаплоидные формы, образующиеся в результате редуктивного митоза тетраплоидных клеток (Storchova, Pellman, 2004), могут, по-видимому, тоже сливаться в немногочисленные многоядерные формы с низким (менее 3000–4000 усл. ед.) содержанием нуклеиновых кислот (рис. 6), предположительно, с целью избегания апоптоза, характерного для гаплоидных клеток (Storchova, Pellman, 2004).
При этом часть гигантских полиплоидных (многоядерных) клеток сохраняет жизнеспособность и способна, вероятно, менять свою физиологию, приобретая, например, экспрессию генов инвазивного роста (Storchova, Pellman, 2004), а также генов oct4 и nanog, регулирующих самоподдержание опухолевых стволовых клеток (Salmina et al., 2010). Кроме того, возрастает устойчивость полиплоидных форм к химиотерапии (Coward, Harding, 2014). После воздействия ксенобиотиков свою жизнеспособность сохраняет небольшая часть таких клеток; однако они могут быстро генерировать “вторичные” ядра и, в последующем, новые мутантные клетки (Storchova, Pellman, 2004; Coward, Harding, 2014). Как следствие, полиплоидия (многоядерность) рассматривается как один из механизмов “эволюции опухолей” in vivo (Storchova, Pellman, 2004; Coward, Harding, 2014), в том числе посредством формирования клонального разнообразия лейкозных клеток, отражающего, в свою очередь, историю инициации гемобластоза и его потенциал к опухолевой прогрессии (Huang et al., 2005; Morita et al., 2020).
Данные, полученные нами in vitro, показали, что субпопуляция Jurkat-Т-клеток, адгезирующих к пластиковой поверхности планшетов, сохраняет выраженную гетерогенность в содержании нуклеиновых кислот (рис. 6), характерную для суспензионной фракции, что предполагает различие морфофункциональных свойств (поликлоновость) клеточной культуры. Часть крупных адгезирующих Т-клеток приобретает новое свойство – двигательную активность (табл. 2), увеличивающуюся с ростом их размерности. Это может давать существенное преимущество направленной миграции клеток в условиях недостатка нутриентов, обусловленного сменой ППС через 3–4 сут культивирования.
В случае реализации подобного сценария в тканях после метастазирования, адгезирующие, подвижные, полиплоидные (многоядерные) лейкозные лимфобласты могут обеспечить клональную эволюцию (опухолевую прогрессию) in vivo за счет положительного (негативного) хемотаксиса по градиенту концентраций кислорода и химиотерапевтических препаратов.
Список литературы
Автандилов Г.Г. 2006. Диагностическая медицинская плоидометрия. М.: Медицина. (Avtandilov G.G. 2006. Diagnostic medical ploidometry, M.: Medicine.).
Литвинова Л.С., Шуплецова В.В., Юрова К.А., Хазиахматова О.Г., Тодосенко Н.М., Хлусова М.Ю., Шаркеев Ю.П., Комарова Е.Г., Седельникова М.Б., Малащенко В.В., Мелащенко Е.С., Хлусов И.А. 2017. Cell-IQ-визуализация подвижности, клеточной массы и остеогенной дифференцировки мультипотентных мезенхимальных стромальных клеток при культивировании с рельефным кальцийфосфатным покрытием. ДАН. Т. 476. № 4. С. 470. (Litvinova L.S., Shupletsova V.V., Yurova K.A., Khaziakhmatova O.G., Todosenko N.M., Khlu-sova M.Yu., Slepchenko G.B., Cherempey E.G., Sharkeev Yu.P., Komarova E.G., Sedelnikova M.B., Malashchenko V.V., Melashchenko E.S., Khlusov I.A. 2017. Cell-IQ visualization of motility, cell mass, and osteogenic differentiation of multipotent mesenchymal stromal cells cultured with relief calcium phosphate coating. Dokl. Biochem. Biophys. V. 476. P. 310. https://doi.org/10.1134/S1607672917050076).https://doi.org/10.7868/S0869565217280258
Мамаева С.Е. 2002. Атлас хромосом постоянных клеточных линий человека и животных. М.: Науч. Мир. (Mamaeva S.E. 2002. Atlas of chromosomes of permanent cell lines of humans and animals. M.: Nauchnii Mir.)
Шахов В.П., Хлусов И.А., Дамбаев Г.Ц., Зайцев К.В., Егорова А.Б., Шахова С.С., Загребин Л.В., Волгушев С.А. 2004. Введение в методы культуры клеток, биоинженерии органов и тканей. Томск: STT. (Shahov V.P., Hlusov I.A., Dambaev G.C., Zajcev K.V., Egorova A.B., SHahova S.S., Zagrebin L.V., Volgushev S.A. 2004. Introduction to methods of cell culture, bioengineering of organs and tissues. Tomsk: STT.).
Abraham R.T., Weiss A. 2004. Jurkat T cells and development of the T-cell receptor signalling paradigm. Nat. Rev. Immunol. V. 4. P. 301. https://doi.org/10.1038/nri1330
Arkhipov S.N., Maly I.V. 2015. Microtubule appendages mediating T-cell motility and polarity. Integr. Biol. (Camb). V. 7. P. 1143. https://doi.org/10.1039/c4ib00300d
Cárcamo C., Pardo E., Oyanadel C., Bravo-Zehnder M., Bull P., Cáceres M., Martínez J., Massardo L., Jacobelli S., González A., Soza A. 2006. Galectin-8 binds specific beta1 integrins and induces polarized spreading highlighted by asymmetric lamellipodia in Jurkat T cells. Exp. Cell Res. V. 312. P. 374. https://doi.org/10.1016/j.yexcr.2005.10.025
Coward J., Harding A. 2014. Size does matter: why polyploid tumor cells are critical drug targets in the war on cancer. Front. Oncol. V. 4. P. 123. https://doi.org/10.3389/fonc.2014.00123
Edmond V., Dufour F., Poiroux G., Shoji K., Malleter M., Fouqué A., Tauzin S., Rimokh R., Sergent O., Penna A., Dupuy A., Levade T., Theret N., Micheau O., Ségui B., Legembre P. 2015. Downregulation of ceramide synthase-6 during epithelial-to-mesenchymal transition reduces plasma membrane fluidity and cancer cell motility. Oncogene. V. 34. P. 996. https://doi.org/10.1038/onc.2014.55
Fabre S., Carrette F., Chen J., Lang V., Semichon M., Denoyelle C., Lazar V., Cagnard N., Dubart-Kupperschmitt A., Mangeney M., Fruman D.A., Bismuth G. 2008. FOXO1 regulates L-selectin and a network of human T cell homing molecules downstream of phosphatidylinositol 3-kinase. J. Immunol. V. 181. P. 2980. https://doi.org/10.4049/jimmunol.181.5.2980
Gioia L., Siddique A., Head S.R., Salomon D.R., Su A.I. 2018. A genome-wide survey of mutations in the Jurkat cell line. BMC Genomics. V. 19. P. 334. https://doi.org/10.1186/s12864-018-4718-6
Huang X., Dai W., Darzynkiewicz Z. 2005. Enforced adhesion of hematopoietic cells to culture dish induces endomitosis and polyploidy. Cell Cycle. V. 4. P. 801. https://doi.org/10.4161/cc.4.6.1695
Khlusov I., Litvinova L., Shupletsova V., Khaziakhmatova O., Melashchenko E., Yurova K., Leitsin V., Khlusova M., Pichugin V., Sharkeev Y. 2018. Rough titanium oxide coating prepared by micro-arc oxidation causes down-regulation of hTERT expression, molecular presentation, and cytokine secretion in tumor Jurkat T Cells. Materials. V. 11. P. 360. https://doi.org/10.3390/ma11030360
Kim Y.J., Mantel P.L., June C.H., Kim S.H., Kwon B.S. 1999. 4-1BB Costimulation promotes human T Cell adhesion to fibronectin. Cell Immunol. V. 192. P. 13. https://doi.org/10.1006/cimm.1998.1435
Kurita-Ochiai T., Seto S., Ochiai K. 2004. Role of cell-cell communication in inhibiting butyric acid-induced T-Cell apoptosis. Infect. Immun. V. 72. P. 5947. https://doi.org/10.1128/IAI.72.10.5947-5954.2004
Marie R., Pedersen J.N., Bauer D.L., Rasmussen K.H., Yusuf M., Volpi E., Flyvbjerg H., Kristensen A., Mir K.U. 2013. Integrated view of genome structure and sequence of a single dna molecule in a nanofluidic device. Proc. Natl. Acad. Sci. V. 110. P. 4893. https://doi.org/10.1073/pnas.1214570110
Morita K., Wang F., Jahn K., Hu T., Tanaka T., Sasaki Y., Kuipers J., Loghavi S., Wang S.A., Yan Y., Furudate K., Matthews J., Little L., Gumbs C., Zhang J. et al. 2020. Clonal evolution of acute myeloid leukemia revealed by high-throughput single-cell genomics. Nat. Commun. V. 11. P. 5327. https://doi.org/10.1038/s41467-020-19119-8
Plemel J.R., Caprariello A.V., Keough M.B., Henry T.J., Tsutsui S., Chu T.H., Schenk G.J., Klaver R., Yong V.W., Stys P.K. 2017. Unique spectral signatures of the nucleic acid dye acridine orange can distinguish cell death by apoptosis and necroptosis. J. Cell Biol. V. 216. P. 1163. https://doi.org/10.1083/jcb.201602028
Salmina K., Jankevics E., Huna A., Perminov D., Radovica I., Klymenko T., Ivanov A., Jascenko E., Scherthan H., Cragg M., Erenpreisa J. 2010. Up-regulation of the embryonic self-renewal network through reversible polyploidy in irradiated p53-mutant tumour cells. Exp. Cell Res. V. 316. P. 2099. https://doi.org/10.1016/j.yexcr.2010.04.030
Snow K., Judd W. 1987. Heterogeneity of a human T-lymphoblastoid cell line. Exp. Cell Res. V. 171. P. 389. https://doi.org/ (87) 90171-6https://doi.org/10.1016/0014-4827
Storchova Z., Pellman D. 2004. From polyploidy to aneuploidy, genome instability and cancer. Nat. Rev. Mol. Cell Biol. V. 5. P. 45. https://doi.org/10,1038/nrm1276
Tuomela S., Autio R., Buerki-Thurnherr T., Arslan O., Kunzmann A., Andersson-Willman B., Wick P., Mathur S., Scheynius A., Krug H.F., Fadeel B., Lahesmaa R. 2013. Gene expression profiling of immune-competent human cells exposed to engineered zinc oxide or titanium dioxide nanoparticles. PLoS One. V. 8. P. e68415. https://doi.org/10.1371/journal.pone.0068415
Yang T., Peng J., Shu Z., Sekar P.K., Li S., Gao D. 2019. Determination of the membrane transport properties of Jurkat cells with a microfluidic device. Micromachines (Basel). V. 10. P. 832. https://doi.org/10.3390/mi10120832
Дополнительные материалы отсутствуют.
Инструменты
Цитология


