Цитология, 2021, T. 63, № 2, стр. 116-126
Содержание железа и пролиферация клеток в тимусе и селезенке мышей при росте гепатомы 22А
Е. А. Зеленский 1, К. В. Рутто 1, *, И. В. Кудрявцев 1, А. В. Соколов 1, Е. П. Киселева 1, 2
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
2 Северо-Западный государственный медицинский университет им. И.И. Мечникова
195067 Санкт-Петербург, Россия
* E-mail: krispins-90@mail.ru
Поступила в редакцию 10.12.2020
После доработки 18.12.2020
Принята к публикации 18.12.2020
Аннотация
Известно, что опухолевый рост подавляет Т-клеточный иммунитет, но также вызывает значительные нарушения метаболизма железа. Мы предположили, что дефицит железа может быть одной из причин иммунодепрессии при опухолевом росте. В работе впервые были сопоставлены показатели пролиферативной активности двух органов иммунной системы – тимуса и селезенки с содержанием в них негемового железа в динамике роста перевиваемой гепатомы 22а. Из общих показателей исследовали концентрацию железа в сыворотке крови и печени. Начиная с третьей недели опухолевого роста у мышей отмечали прогрессирующее снижение массы и клеточности тимуса, а также увеличение массы и клеточности селезенки. У этих животных выявлено снижение пролиферативной активности клеток только в тимусе, но не в селезенке. Однако при этом содержание негемового железа в тимусе было повышено, а в селезенке – снижено. Следовательно, можно предположить, что железа и в селезенке, и в тимусе достаточно для обеспечения потребностей клеточной пролиферации в этих органах. Также в тимусе не выявлено снижения экспрессии трансферринового рецептора (CD71) на тимоцитах и активности каталазы, что подтверждает отсутствие дефицита железа в этом органе. Показатели метаболизма железа в тимусе были исследованы при росте перевиваемой опухоли впервые. Таким образом, причиной иммунологических нарушений в организме мышей с гепатомой 22а, таких как инволюция тимуса и снижение пролиферативной активности тимоцитов, не является дефицит железа, а механизмы, лежащие в основе этих процессов, не связаны напрямую с содержанием железа в этом органе. Настоящая работа проливает свет на один из аспектов метаболического влияния опухоли на иммунитет, связанного с обменом железа.
Железо является микроэлементом, необходимым для всех живых клеток и играет важную роль в регуляции клеточной пролиферации, поскольку служит кофактором рибонуклеотид редуктазы – ключевого фермента для биосинтеза дезоксинуклеотидов (Zohora et al., 2018). Железо особенно важно для функционирования пролиферирующих клеток, таких как тимоциты и активированные Т-лимфоциты. Установлено, что удаление железа из культуральной среды приводит к подавлению пролиферации клеток, а добавление железа – к восстановлению этого процесса (Pourcelot et al., 2015).
У животных, содержащихся на диете со сниженным содержанием железа, наблюдаются признаки иммунодефицита: атрофия тимуса с уменьшением общего числа тимоцитов и подавлением их пролиферативной активности (Soyano et al., 1982; Kuvibidila et al., 1990), а также снижение пролиферативного ответа Т-лимфоцитов селезенки на митогены (Kuvibidila et al., 1983, 2012; Omara, Blakley, 1994; Klecha et al., 2005).
Известно, что рост многих опухолей также сопровождается и гипоферремией (Kim et al., 2014; Skrajnowska et al., 2015; Chen, Chen, 2018) и иммунологическими нарушениями – инволюцией тимуса, подавлением пролиферации тимоцитов (Киселева, Малыгин, 1998; Shanker et al., 2000; Song et al., 2013) и периферических Т-клеток (Kikuchi, 1982; Rashid et al., 2005). Однако никто не сопоставлял иммунологические характеристики с показателями содержания железа, и они были получены на разных экспериментальных моделях.
Между тем, еще в середине прошлого века были высказаны предположения о том, что описанные изменения могут быть взаимосвязаны и зависеть от веществ, продуцируемых малигнизированными тканями. Накахара и Фукуока (Nakahara, Fukuoka, 1958) выделили из опухоли полипептид, названный ими “токсогормоном”, который при введении интактным животным вызывал, с одной стороны, инволюцию тимуса, а с другой – изменения, связанные с обменом железа, а именно, уменьшение концентрации железа и гемоглобина в крови, а также снижение активности каталазы в печени. К сожалению, несмотря на многочисленные исследования, активное вещество “токсогормона” так и не было идентифицировано (Kampschmidt, 1965). Однако эти работы позволили нам сделать предположение о том, что одной из многих причин нарушения центрального и периферического Т-клеточного иммунитета при опухолевом росте может быть, в том числе, и дефицит железа.
Для проверки этого предположения мы провели сопоставление пролиферативной активности тимоцитов и спленоцитов с содержанием негемового железа в этих органах в динамике роста перевиваемой опухоли – гепатомы 22а у мышей. Для выявления дефицита железа мы также исследовали экспрессию трансферринового рецептора CD71 на поверхности клеток, активность железосодержащего фермента каталазы в органах и уровень содержания железа в сыворотке крови и печени.
МАТЕРИАЛ И МЕТОДИКА
Животные. Работу проводили на мышах-самцах C3HA весом 16–18 г, полученных из питомника “Рапполово”, Санкт-Петербург. Животные находились на стандартной диете, содержащей 18 мг железа/кг. Мыши имели свободный доступ к еде и питьевой воде (централизованное водоснабжение) ad libitum. Световой режим день/ночь был установлен по 12 ч, температура в помещении – 22°C. Эксперименты проводили с соблюдением этических принципов в работе с лабораторными животными, исследование было одобрено локальным этическим комитетом при ФГБНУ “ИЭМ” (протокол № 2/15 от 26.02.2015).
Клеточные культуры. Культура клеток гепатомы 22а (MH-22a/МГ-22а), была получена из коллекции клеточных культур Института цитологии РАН. Клетки культивировали в среде DMEM (Биолот, Россия) с добавлением 10% эмбриональной телячьей сыворотки (HyClone, Великобритания), 0.1 мг/мл гентамицина (Биолот, Россия) и 0.6 мг/мл глутамина (Биолот, Россия) при 5% CO2 и 37°С.
Опухолевая модель. Для получения солидных опухолей животным подкожно инокулировали в область спины 2 × 105 живых клеток гепатомы 22а в 0.2 мл забуференного физиологического раствора (PBS). Контрольные животные получали инъекцию только PBS. Животных убивали методом цервикальной дислокации на 7, 14, 21, 28 и 35 сут после инокуляции опухоли, тимус и селезенку взвешивали и определяли содержание негемового железа. Других мышей обескровливали для получения сыворотки крови и определения содержания негемового железа и гемоглобина.
Определение содержания негемового железа в сыворотке крови и тканях. Концентрацию железа определяли колориметрическим методом (Rebouche et al., 2004) с использованием хромогенного агента феррозина. Тканевые гомогенаты приготавливали в деионизированной воде 1 : 10 (масса/объем) и смешивали с равным объемом раствора, преципитирующего белки (1 M HCl и 10% трихлоруксусной кислоты), а к 50 мкл сыворотки добавляли 150 мкл преципитирующего раствора. Пробы нагревали при 95°C в течение 1 ч, затем охлаждали до комнатной температуры и центрифугировали при 8200 g 10 мин. После чего 30 мкл супернатанта смешивали с 30 мкл хромогенного субстрата, состоящего из 0.508 мМ феррозина, 1.5 M ацетата натрия и 1.5% тиогликолевой кислоты; в контрольные пробы феррозин не добавляли. Через 30 мин оптическую плотность раствора измеряли на микропланшетном спектрофотометре (ClarioStar, BMG Labtech, Германия) при длине волны 562 нм. Построение калибровочных кривых проводили в день эксперимента с использованием 0–20 мкг/мл железа (в виде раствора NH4Fe(SO4)2 · 12H2O в 0.4 M натрий-ацетатном буфере, pH 5.5) в качестве стандарта.
Определение содержания гемоглобина в крови. Уровень общего гемоглобина определяли спектрофотометрическим методом путем добавления 1 мл 0.04% водного раствора аммиака к 10 мкл крови. Оптическую плотность раствора измеряли в 96-луночных планшетах при длине волны 415 нм и выражали в процентах по отношению к контрольному уровню.
Определение активности каталазы. Активность каталазы в гомогенатах тимуса и селезенки проводили по описанному ранее методу (Hadwan, Ali, 2018), адаптированному для микропланшетов. 50 мкл тканевого гомогената, разведенного в 2, 4 и 8 раз 50 мМ натрий-фосфатным буфером (pH 7.0) смешивали со 100 мкл 10 мМ H2O2. После инкубации в течение 2 мин на термошейкере при 270 оборотах в минуту и 37°C реакцию останавливали путем добавления 50 мкл хромогенного раствора, содержащего 10 мМ NH4VO3 в 0.5 M H2SO4. Оптическую плотность раствора измеряли на микропланшетном спектрофотометре при длине волны 452 нм. Для построения калибровочной кривой 100 мкл последовательных двукратных разведений 10 мМ H2O2 смешивали с 50 мкл 50 мМ натриево-фосфатного буфера, pH 7.0 (вместо тканевого гомогената) и через 2 мин добавляли 50 мкл 10 мМ NH4VO3 в 0.5 M H2SO4. После определения белка по Бредфорду специфическую активность каталазы в пробах выражали в микромолях поглощенной H2O2 в течение 1 мин на 1 мг общего белка.
Определение пролиферативной активности лимфоцитов. Тимусы и селезенки выделяли в стерильных условиях и приготавливали клеточную суспензию в среде RPMI-1640 (GIBCO, США) с добавлением 10%-ной фетальной телячьей сыворотки (Sigma-Aldrich, USA), 50 мкМ 2-меркаптоэтанола и 80 мкг/мл гентамицина. Клетки в количестве 2 × 105/200 мкл помещали в 96-луночные планшеты в трех повторностях и инкубировали при 37°C с 5% СО2 в течение 1 ч (для тимоцитов) и 72 ч (для спленоцитов). В качестве Т-клеточного митогена использовали конканавалин А в концентрации 2.5 мкг/мл (Sigma-Aldrich, США). Пролиферативный ответ оценивали путем добавления 1 мкКи 3H-тимидина на пробу (удельная активность 23 Ки/мМ). Клетки собирали на фильтры, промывали, высушивали и помещали в сцинтилляционную жидкость для измерения радиоактивности на счетчике (Beckman, США).
Проточная цитофлуориметрия. Фенотипирование тимоцитов проводили с использованием моноклональных антител против CD4 мыши, меченных PE-Cy7 (BD Pharmingen, США), и против CD8, меченных PE-Cy5 (BD Pharmingen, США); рецептор трансферрина выявляли с помощью моноклональных антител к CD71 мыши, меченных фикоэритрином (BD Pharmingen, США), а также соответствующих изотипических контролей на проточном цитофлуориметре Navios (Beckman Coulter, США). Для каждого образца анализировали не менее 15 000 одиночных клеток. Данные обрабатывали с помощью программы Kaluza™ версия 1.3 (Beckman Coulter, США).
Статистическая обработка. Данные обрабатывали статистически с помощью t-теста (критерий Стьюдента).
РЕЗУЛЬТАТЫ
Общие показатели содержания железа. Для оценки общих показателей исследовали концентрацию железа в сыворотке крови и гемоглобина в крови. Концентрация железа в сыворотке мышей с гепатомой 22а начинала уменьшаться на третьей неделе опухолевого роста и затем прогрессивно снижалась, составляя на поздних сроках исследования около половины контрольного уровня (рис. 1а). Концентрация гемоглобина в крови была более стабильна и снижалась только на терминальной фазе опухолевого роста (рис. 1б). Начиная с 28 сут опухолевого роста снижалось также и содержание негемового железа в печени (рис. 1в).
Рис. 1.
Общие показатели содержания железа в организме контрольных животных (кривая 1) и мышей с гепатомой 22а (кривая 2). По оси ординат: a – концентрация железа в сыворотке крови, мкг/дл (n = 10–15); б – относительное содержание гемоглобина в крови, % (n = 10); в – содержание негемового железа в печени, мкг на 1 г сырой ткани (n = 15–20). Здесь и далее данные представлены в виде средней величины и ошибки среднего (M ± m), звездочками обозначены достоверные различия между опухолевой и контрольной группами животных: *Р < 0.05, **P < 0.01, ***P < 0.001.

Исследование тимуса. Рост гепатомы 22а вызывал прогрессирующее снижение массы тимуса, начиная с третьей недели опухолевого роста (рис. 2а), которое сопровождалось снижением числа клеток в органе (рис. 2б). Параллельно со снижением массы и клеточности тимуса была подавлена также и пролиферативная активность тимоцитов (рис. 2в). Задачей нашего исследования было сопоставить динамику этих показателей с содержанием железа в тимусе. Поскольку содержание железа в сыворотке крови у животных с гепатомой 22а было снижено, мы предполагали наличие возможного дефицита этого микроэлемента и в тимусе.
Рис. 2.
Показатели состояния тимуса у контрольных мышей (кривая 1) и животных с гепатомой 22а (кривая 2). По оси ординат: a – масса тимуса, мг (n = 15–20); б – число клеток в тимусе, млн; в – пролиферация тимоцитов, включение 3H-тимидина, импульсы/мин (n = 6); г – содержание негемового железа в тимусе, мкг/г сырой ткани (n = 15–20).

Для решения этого вопроса исследовали три показателя: содержание негемового железа в тимусе, активность железосодержащего фермента – каталазы и экспрессию трансферринового рецептора (CD71). Насколько нам известно, эти показатели в тимусе при опухолевом росте ранее никто не исследовал.
Неожиданным оказалось повышение содержания негемового железа в тимусе, которое наблюдали, начиная с третьей недели опухолевого роста (рис. 2г). При исследовании специфической активности каталазы в тимусе было также обнаружено ее повышение в гомогенатах тимуса мышей на 21 сут роста гепатомы 22а по сравнению с этим же показателем у контрольных животных (рис. 3). Кроме того, была также оценена специфическая активность этого фермента в селезенке и показано, что она не отличается от контроля у животных на 21 сут роста гепатомы 22а.
Рис. 3.
Специфическая активность каталазы в тимусе и селезенке контрольных мышей (белые столбцы) и животных с гепатомой 22а на 21 сут опухолевого роста (серые столбцы), мкмоль H2O2, поглощенной за 1 мин на 1 мг общего белка (n = 10).

Считается, что трансферрин и его рецептор необходимы для нормальной дифференцировки тимоцитов in vivo (Macedo et al., 2003). Трансферриновый рецептор отвечает за поступление железа в клетку и в случае железодефицита его мембранная экспрессия повышается (Saldanha-Araujo et al., 2009).
Сначала было исследовано относительное содержание CD71-положительных клеток среди всех тимоцитов и было показано, что в тимусе животных на 21 сут опухолевого роста этот показатель не отличался от контроля и был довольно низким в обеих группах: 1.51 ± 0.08% – у животных с опухолями и 1.27 ± ± 0.08% – в контроле. Поэтому в дальнейшем оценивали число CD71-позитивных клеток среди четырех основных популяций тимоцитов, а именно, среди CD4+CD8+, CD4–CD8–, CD4+CD8– и CD4–CD8+ клеток. Имеются данные о том, что у взрослых мышей появление CD71 характерно для ранних фаз дифференцировки тимоцитов и данный маркер выявляется в основном на большинстве незрелых делящихся бластных клеток (Breckelmans et al., 1994).
Известно, что инволюция тимуса на поздних сроках роста экспериментальных опухолей приводит не только к резкому сокращению всех клеток, но и к выраженному перераспределению тимоцитов по основным популяциям за счет гораздо большей убыли основной популяции CD4+CD8+ клеток по сравнению с остальными (Fu et al., 1989; Shanker et al., 2000). В связи с этим необходимо было выяснить, не меняется ли распределение тимоцитов по четырем основным популяциям к 21 сут опухолевого роста. Действительно, как показано на рис. 4а, на этом сроке роста гепатомы 22а показатели распределения тимоцитов еще не отличались от тех же показателей у контрольных животных.
Рис. 4.
Основные популяции тимоцитов (а) и относительное содержание CD71+ тимоцитов (б) на 21-е сут роста гепатомы 22а по данным проточной цитометрии. Представлены результаты одного из трех репрезентативных экспериментов: а – распределение тимоцитов по экспрессии CD4/CD8 антигенов у контрольных животных (слева) и животных с опухолями (справа); б – относительное содержание CD71+-клеток среди CD4–CD8– (DN), CD4+CD8+ (DP), CD4–CD8+ (Sp8) и CD4+CD8– (Sp4) тимоцитов у контрольных мышей (верхний ряд) и мышей с опухолями (нижний ряд). Число CD71+-клеток указано в верхней области диаграммы.

Выявление CD71 совместно с маркерами CD4/CD8 не выявило разницы частоты встречаемости CD71-позитивных клеток среди основных популяций по сравнению с контролем (рис. 4б) и составило соответственно: 0.24 ± 0.05% против 0.17 ± 0.06% для CD4+CD8+ (DP) клеток; 3.64 ± 1.24% против 3.81 ± 1.11% для CD4–CD8– (DN) клеток; 12.66 ± 0.91% против 11.06 ± 0.45% для CD4+CD8– (Sp4) клеток и 13.11 ± 2.43% против 11.73 ± 2.07% для CD4–CD8+ (Sp8) клеток. Аналогичные результаты были также получены при анализе относительного содержания CD71+ клеток на 7 и 14 сут эксперимента (данные не приводятся). Одинаковая экспрессия CD71 на поверхности тимоцитов у животных с опухолями и контрольных животных косвенно указывает на отсутствие дефицита железа в тимусе мышей с гепатомой 22а.
Таким образом, в тимусе мышей с гепатомой 22а нами не было обнаружено признаков железодефицита, которые могли бы рассматриваться в качестве причины резкого снижения массы тимуса и пролиферации тимоцитов у этих животных.
Исследование селезенки. При исследовании другого органа иммунной системы – селезенки, начиная с третьей недели опухолевого роста наблюдали увеличение массы (рис. 5a), которое также сопровождалось увеличением числа клеток в этом органе (рис. 5б).
Рис. 5.
Показатели состояния селезенки у контрольных мышей (кривая 1) и животных с гепатомой 22а (кривая 2). По оси абсцисс: время после инокуляции опухолевых клеток, сут. По оси ординат: a – масса селезенки, мг (n = 15–20); б – число клеток в селезенке, млн; в – пролиферация спленоцитов в присутствии 2.5 мкг/мл конканавалина А (1, 2) и без него (3, 4) у контрольных животных (1, 3) и животных с опухолями (2, 4), включение 3H-тимидина, импульсы/мин (n = 8); г – содержание негемового железа в селезенке, мкг/г сырой ткани (n = 15–20).

Содержание негемового железа в селезенке мышей с опухолями было снижено на всех сроках исследования, кроме 14 сут (рис. 5г). На поздних сроках роста гепатомы 22а этот показатель был приблизительно в 2 раза ниже, чем у контрольных животных.
При сопоставлении этих данных с пролиферативной активностью спленоцитов оказалось, что спонтанная пролиферация спленоцитов повышена у животных, начиная с третьей недели опухолевого роста, по сравнению с контрольным уровнем (рис. 5в). Известно, что селезенка мышей является не только лимфоидным, но и кроветворным органом. Поскольку ранее было показано, что увеличение объема селезенки при росте гепатомы 22а связано в основном с разрастанием красной, а не белой пульпы (Киселева, Малыгин, 1984), можно рассматривать повышение показателей включения радиоактивной метки в спленоциты без добавления митогена как отражение активации нелимфоидных клеток этого органа, что также характерно и для роста других опухолей (Kikuchi et al., 1982; Radoja et al., 2000).
Для более прицельного анализа ответа Т-лимфоцитов было проведено исследование пролиферации спленоцитов в присутствии Т-клеточного митогена конканавалина А. В этом случае также не было обнаружено признаков снижения пролиферации по сравнению с контролем, более того, было отмечено повышение показателя на 21 сут опухолевого роста (рис. 5в).
Полученные данные указывают, что несмотря на снижение содержания негемового железа в селезенке, рассчитанного на единицу массы ткани, этого микроэлемента в органе достаточно для обеспечения пролиферации спленоцитов.
ОБСУЖДЕНИЕ
Известно, что опухолевый рост оказывает подавляющее влияние на Т-клеточный иммунитет, которое в настоящее время связывают с многими причинами, такими как ингибиторные рецепторы, активация Т-регуляторных и миелоидных супрессорных клеток, синтез иммуносупрессорных цитокинов и метаболитов (Xia et al., 2019), но не с нарушениями обмена железа. Между тем известно, что опухолевый рост вызывает в организме значительные нарушения метаболизма и появление дефицита железа (Zohora et al., 2018), которые также могут сказываться на функционировании клеток иммунной системы.
Обращает на себя внимание большое сходство системных явлений, которые можно наблюдать в организме животных с опухолями и животных, находящихся на железодефицитной диете (табл. 1). В обоих случаях наблюдаются изменения, связанные с обменом железа – гипоферремия, снижение содержания железа и активности каталазы в печени, а также иммунологические нарушения, такие как инволюция тимуса и спленомегалия, которые могут сопровождаться снижением пролиферативной активности тимоцитов и Т-лимфоцитов селезенки. Несмотря на большую разницу процессов, можно предположить, что в организме животных с опухолями и животных с пищевым недостатком железа, действуют общие системные механизмы регуляции нарушенного тканевого гомеостаза. Однако конкретные механизмы происходящих сдвигов в иммунной системе ни в том, ни в другом случае недостаточно ясны (Kuvibidila et al., 2012; Carrio, Lopez, 2013).
Таблица 1.
Сравнительный анализ процессов, происходящих в организме животных с опухолями и животных, содержащихся на железодефицитной диете
| Характеристика | Работы, в которых описаны соответствующие изменения у животных | |
|---|---|---|
| с опухолями | на железодефицитной диете | |
| Инволюция тимуса | Fu et al., 1989; Киселева и др., 1998; Carrio, Lopez, 2013 | Kuvibidila et al., 2012 |
| Снижение пролиферации тимоцитов | Киселева и др., 1998; Shanker et al., 2000; Song et al., 2013 | Kuvibidila et al., 1990; Soyano et al., 1982 |
| Спленомегалия | Fu et al., 1989; Киселева и др., 1984; Radoja et al., 2000 | Kuvibidila et al., 1990, 2012 |
| Снижение ответа спленоцитов на Т-митогены | Kikuchi, 1982; Rashid et al., 2005 | Kuvibidila et al., 1983, 2012; Omara, Blakley, 1994; Klecha et al., 2005 |
| Гипоферремия | Kim et al., 2014; Skrajnowska et al., 2015; Chen et al., 2018 | Kuvibidila et al., 1983; Soyano, 1982 |
| Снижение содержания железа в печени на единицу массы ткани | Kim et al., 2014; Skrajnowska et al., 2015 |
Kuvibidila et al., 1990, 2012; Klecha et al., 2005; Omara, Blakley, 1994 |
| Снижение активности каталазы печени | Kampschmidt, 1965 | Vieyra-Reyes et al., 2017 |
При этом даже у животных, находящихся на железодефицитной диете, у которых снижение пролиферативной активности тимоцитов и Т-лимфоцитов селезенки непосредственно связывают с недостатком железа, прямого сопоставления функциональной активности клеток с содержанием железа в этих органах не проводили; исследователи лишь регистрировали факт наличия дефицита железа по его уровню содержания в крови и печени (Soyano, 1982; Kuvibidila et al., 1983; Omara, Blakley, 1994; Klecha et al., 2005). Также никто не проводил подобных сопоставлений при опухолевом росте.
В настоящей работе впервые было проведено сопоставление показателей пролиферативной активности тимоцитов и спленоцитов с содержанием негемового железа в тимусе и селезенке в динамике роста перевиваемой опухоли гепатомы 22а. Cуммарные результаты исследования представлены на схеме (рис. 6).
Рис. 6.
Суммарная схема влияния роста гепатомы 22а в организме животных на показатели метаболизма железа и состояние лимфоидных органов. Обозначения: ↑ повышение, ↓ подавление, = нет эффекта.
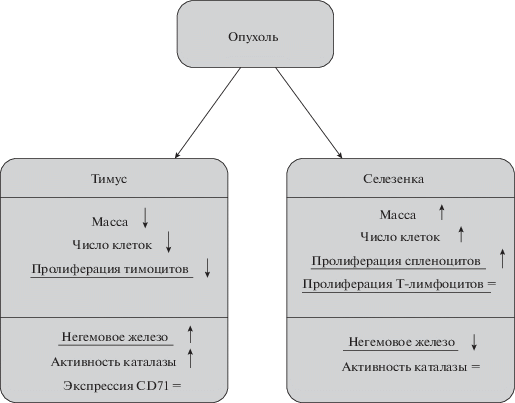
У животных с опухолями начиная с третьей недели морфологические изменения в двух органах иммунной системы имели противоположный характер: инволюция тимуса и спленомегалия. Пролиферативная активность клеток этих органов также была различной: снижена у тимоцитов, не изменена у спленоцитов в ответ на Т-клеточный митоген и повышена у спленоцитов без индуктора.
Полученные результаты были сопоставлены с содержанием негемового железа в тимусе и селезенке. При этом оценивали удельное содержание железа на единицу массы ткани, а не на весь орган, поскольку нас интересовало содержание железа в микроокружении клеток.
Наша гипотеза заключалась в том, что подавление пролиферативной активности клеток лимфоидных органов может быть связано с дефицитом железа. Поскольку снижение пролиферации клеток было выявлено только в тимусе, то следовало ожидать, что в этом органе содержание железа будет снижено, а в селезенке – нет. Однако содержание негемового железа в тимусе было не только не снижено, но даже повышено. Отсутствие дефицита железа в вилочковой железе было подтверждено также и нормальным уровнем экспрессии CD71 на мембране тимоцитов.
При этом в селезенке содержание негемового железа изменялось противоположным образом – было снижено. Эти изменения совпадали во времени с изменениями массы органов – уменьшения массы тимуса и увеличения массы селезенки.
Данные литературы о содержании железа при росте экспериментальных опухолей весьма противоречивы. Гипоферремия является наиболее частым признаком дефицита железа у животных с опухолями (Kim et al., 2014; Skrajnowska et al., 2015; Chen, Chen, 2018). Однако другие исследователи ее не наблюдали (Youn et al., 2009). Содержание железа в печени и селезенке может также значительно варьировать при росте различных опухолей и быть как сниженным (Kim et al., 2014; Skrajnowska et al., 2015), так и повышенным (Kim et al., 2014), или же оставаться на нормальном уровне (Eagon et al., 1999).
Из общих показателей метаболизма железа в организме животных с гепатомой 22а оценивали концентрацию железа в сыворотке крови и содержание железа в печени. Оба показателя были снижены также, как и содержание железа в селезенке. Однако при пересчете содержания негемового железа в органах с учетом изменениях их массы оказалось, что эти показатели для тимуса, селезенки и печени не отличаются у животных с опухолями от контрольных показателей (табл. 2). Данные приводятся на 35 сут опухолевого роста, когда изменения всех показателей были наиболее выраженными.
Таблица 2.
Содержание негемового железа в органах мышей на 35 сут роста гепатомы 22а
| Органы | Содержание железа, мкг/орган | |
|---|---|---|
| контроль | мыши с опухолями | |
| Тимус | 0.61 ± 0.1 (n = 14) | 0.53 ± 0.1 (n = 9) Р > 0.05 |
| Селезенка | 6.6 ± 0.7 (n = 18) | 8.0 ± 1.4 (n = 11) Р > 0.05 |
| Печень | 91.0 ± 9.5 (n = 18) | 80.5 ± 13.9 (n = 12) Р > 0.05 |
Таким образом, несмотря на снижение концентрации железа в сыворотке крови, содержание негемового железа в тимусе, селезенке и печени при расчете на весь орган оставалось стабильным и достаточным для обеспечения полноценного функционирования клеток (о чем можно судить по отсутствию подавления пролиферации клеток селезенки). При этом изменения показателей железа, рассчитанные на единицу массы органов, по-видимому, являются следствием достаточно выраженных сдвигов массы и клеточности органов, но не их причиной.
Тем не менее, нами были зарегистрированы снижение концентрации железа в крови и противоположные изменения удельного содержания негемового железа в тимусе и селезенке при расчете на единицу массы. Известно, что недостаток железа может оказывать не только прямой антипролиферативный эффект в отношении лимфоцитов, но также и существенным образом модифицировать клеточное микроокружение, например, вызывать окислительный стресс вследствие недостаточной продукции железосодержащих белков антиоксидантной системы, таких как каталаза и др. (Vieyra-Reyes et al., 2017).
Для того чтобы оценить возможные тканевые эффекты противоположных изменений содержания железа в тимусе и селезенке, провели измерение специфической активности гемосодержащего фермента – каталазы. Ее активность в селезенке мышей с опухолями не отличалась от контрольного уровня, в то время как в тимусе мышей с гепатомой 22а была выше, чем у контрольных животных. Отсутствие снижения активности каталазы в обоих органах является еще одним аргументом в пользу того, что в них нет дефицита железа.
Полученные нами результаты по отсутствию изменений активности каталазы в селезенке согласуются с данными других авторов, полученными при росте канцероген-индуцированной опухоли желудка у мышей (Gagandeep et al., 2005). Оценка активности каталазы в тимусе при росте экспериментальных опухолей не проводилась.
Таким образом, впервые было определено содержание железа в тимусе животных с перевиваемой опухолью. У этих животных также впервые проанализировали экспрессию CD71 на мембране тимоцитов и активность каталазы в тимусе. Полученные результаты свидетельствуют об отсутствии дефицита железа в этом органе и, следовательно, дефицит железа не может быть причиной развития инволюции тимуса и снижения пролиферативной активности тимоцитов при росте гепатомы 22а. Тем самым, наше изначальное предположение не было подтверждено. В основе этих процессов, по-видимому, могут лежать механизмы, не связанные напрямую с содержанием железа.
Еще многое предстоит узнать о механизмах опухоль-индуцированной инволюции тимуса и других системных проявлениях опухолевого роста. Существует мнение, что раковая ткань может исполнять роль “системного метаболического диктатора”, перестраивая обмен веществ в организме для покрытия своих потребностей (Lee et al., 2016). Клетки иммунной системы, так же как и любые другие клетки организма, должны испытывать на себе воздействие этой перестройки, что, однако, изучено недостаточно. Настоящая работа проливает свет на один из аспектов этого влияния, связанный с обменом железа.
Список литературы
Киселева Е.П., Малыгин А.М. 1984. Функциональная активность спленоцитов мышей при росте сингенной перевиваемой гепатомы 22а. Цитология. Т. 26. № 12. С. 1409. (Kiseleva E.P., Malygin A.M. 1984. Splenocyte functional activity in mice growing the syngeneic transplantable hepatoma 22a. Tsitologiya. V. 26. № 12. P. 1409.)
Киселева Е.П., Суворов А.Н., Огурцов Р.П. 1998. Роль апоптоза в процессе инволюции тимуса при росте сингенной перевиваемой опухоли у мышей. Изв. АН Сер. Биология. № 2. С. 172. (Kiseleva E.P., Suvorov A.N., Ogurtsov R.P. 1998. The role of apoptosis in the thymic involution during growth of the syngeneic transplanted tumor in mice. Izv. Akad. Nauk. Ser. Biol. № 2. P. 172.)
Breckelmans P., van Soest P., Leenen P.J., van Ewijk W. 1994. Inhibition of proliferation and differentiation during early T cell development by anti-transferrin receptor antibody. Eur. J. Immunol. V. 24. P. 2896.
Carrio R., Lopez D.M. 2013. Insights into thymic involution in tumor-bearing mice. Immunol. Res. V. 57. P. 106.
Chen R., Chen G. 2018. Tumor-induced disorder of iron metabolism in major organs: a new insight from chemical speciation of iron. J. Int. Med. Res. V. 46. P. 70.
Eagon P.K., Teepe A.G., Elm M.S., Tadic S.D., Epley M.J., Beiler B.E., Shinozuka H., Rao K.N. 1999. Hepatic hyperplasia and cancer in rats: alterations in copper metabolism. Carcinogenesis. V. 20. P. 1091.
Fu Y., Paul R.D., Wang Y., Lopez D.M. 1989. Thymic involution and thymocyte phenotypic alterations induced by murine mammary adenocarcinomas. J. Immunol. V. 143. P. 4300.
Gagandeep, Rao A.R., Kale R.K. 2005. Oxidative stress in tumour-bearing fore-stomach and distant normal organs of Swiss albino mice. Ind. J. Biochem. Biophys. V. 42. P. 216.
Hadwan M.H., Ali S.K. 2018. New spectrophotometric assay for assessments of catalase activity in biological samples. Anal. Biochem. V. 542. P. 29.
Kampschmidt R.F. 1965. Mechanism of liver catalase depression in tumor-bearing animals: a review. Cancer Res. V. 25. P. 34.
Kikuchi Y., Hiramoto R.N., Ghanta V. 1982. Mitogen response of peripheral blood and splenic lymphocytes and effect of 2-mercaptoethanol in tumor-bearing mice. Cancer Immunol. Immunother. V. 12. P. 225.
Kim A., Rivera S., Shprung D., Limbrick D., Gabayan V., Nemeth E., Ganz T. 2014. Mouse models of anemia of cancer. PLoS One. V. 9. e93283.
Klecha A.J., Salgueiro J., Wald M., Boccio J., Zubillaga M., Leonardi N.M., Gorelik G., Cremaschi G.A. 2005. In vivo iron and zinc deficiency diminished T- and B-selective mitogen stimulation of murine lymphoid cells through protein kinase C-mediated mechanism. Biol. Trace Elem. Res. V. 104. P. 173.
Kuvibidila S.R., Dardenne M., Savino W., Lepault F. 1990. Influence of iron-deficiency anemia on selected thymus functions in mice: thymulin biological activity, T-cell subsets, and thymocyte proliferation. Am. J. Clin. Nutr. V. 51. P. 228.
Kuvibidila S.R., Gardner R., Velez M., Yu L. 2012. Iron deficiency, but not underfeeding reduces the secretion of interferon-gamma by mitogen-activated murine spleen cells. Cytokine. V. 52. P. 230.
Kuvibidila S.R., Nauss K.M., Baliga S.B., Suskind R.M. 1983. Impairment of blastogenic response of splenic lymphocytes from iron-deficient mice. In vitro repletion by hemin, transferrin, and ferric chloride. Am. J. Clin. Nutr. V. 37. P. 557.
Lee Y.-M., Chang W.-C., Ma W.-L. 2016. Hypothesis: solid tumours behave as systemic metabolic dictators. J. Cell. Mol. Med. V. 20. P. 1076.
Macedo M.F., de Sousa M., Ned R.M., Mascarenhas C., Andrews N.C., Correia-Neves M. 2004. Transferrin is required for early T-cell differentiation. Immunology. V. 112. P. 543.
Nakahara W., Fukuoka F. 1958. The newer concept of cancer toxin. Adv. Cancer Res. V. 5. P. 157.
Omara F.O., Blakley B.R. 1994. The effects of iron deficiency and iron overload on cell-mediated immunity in the mouse. Br. J. Nutr. V. 72. P. 899.
Pourcelot E., Lénonn M., Mobilia N., Cahn J.-Y., Arnaud J., Fanchon E., Moulis J.-M., Mossuz P. 2015. Iron for proliferation of cell lines and hematopoietic progenitors: nailing down the intracellular functional iron concentration. Biochim. Biophys. Acta. V. 1853. P. 1596.
Radoja S., Rao T.D., Hillman D., Frey A.B. 2000. Mice bearing late-stage tumors have normal functional systemic T cell responses in vitro and in vivo. J. Immunol. V. 164. P. 2619.
Rashid R.M., Achille N.J., Lee J.M., Lathers D.M., Young M.R. 2005. Decreased T-cell proliferation and skewed immune responses in LLC-bearing mice. J. Environ. Pathol. Toxicol. Oncol. V. 24. P. 175.
Rebouche C.J., Wilcox C.L., Widness J.A. 2004. Microanalysis of non-heme iron in animal tissues. J. Biochem. Biophys. Methods. V. 58. P. 239.
Saldanha-Araujo F., Souza A.M. 2009. Early effects on T lymphocyte response to iron deficiency in mice, Short communication. Biol. Trace Elem. Res. V. 127. P. 95.
Shanker A., Singh S.M., Sodhi A. 2000. Impairment of T-cell functions with the progressive ascitic growth of a transplantable T-cell lymphoma of spontaneous origin. FEMS Immunol. Med. Microbiol. V. 27. P. 247.
Skrajnowska D., Korczak B.B., Tokarz A., Kazimierczuk A., Klepacz M., Makowska J., Gadzinski B. 2015. The effect of zinc and phytoestrogen supplementation on the changes in mineral content of the femur of rats with chemically induced mammary carcinogenesis. J. Trace Elem. Med. Biol. V. 32. P. 79.
Song Y., Yu R., Wang C., Chi F., Guo Z., Zhu X. 2013. Disruption of the thymic microenvironment is associated with thymic involution of transitional cell cancer. Urol. Int. V. 92. P. 104.
Soyano A., Candellel D., Layrisse M. 1982. Effect of iron deficiency on the mitogen-induced proliferative response of rat lymphocytes. Int. Archs Allergy Appl. Immun. V. 69. P. 353.
Vieyra-Reyes P., Millán-Aldaco D., Palomero-Rivero M., Jiménez-Garcés C., Hernández-González M., Caballero-Villarraso J. 2017. An iron-deficient diet during development induces oxidative stress in relation to age and gender in Wistar rats. J. Physiol. Biochem. V. 73. P. 99.
Xia A., Zhang Y., Xu J., Yin T., Lu X.-J. 2019. T Cell dysfunction in cancer immunity and immunotherapy. Front. Immunol. V. 10. https://doi.org/10.3389/fimmu.2019.01719
Youn P., Kim S., Ahn J.H., Kim Y., Park J.D., Ryu D.Y. 2009. Regulation of iron metabolism-related genes in diethylnitrosamine-induced mouse liver tumors. Toxicol. Lett. V. 184. P. 151.
Zohora F., Bidad K., Pourpak Z., Moin M. 2018. Biological and immunological aspects of iron deficiency anemia in cancer development: a narrative review. Nutr. Cancer. V. 70. P. 546.
Дополнительные материалы отсутствуют.


