Цитология, 2021, T. 63, № 2, стр. 156-162
Тучные клетки и контроль трансэндотелиального транспорта. Роль гистамина
П. Г. Назаров 1, 2, О. Н. Мальцева 1, Д. А. Танянский 1, 3, *, Е. В. Агеева 1, С. С. Лутфуллоева 1, А. Д. Денисенко 1, 3, П. В. Пигаревский 1
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
197022 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: dmitry.athero@gmail.com
Поступила в редакцию 17.03.2020
После доработки 22.12.2020
Принята к публикации 26.12.2020
Аннотация
Исследовали влияние тучных клеток (ТК) человека (линия MHC-1) на трансэндотелиальный транспорт (ТЭТ) альбумина и липопротеинов низкой плотности (ЛПНП), используя двухкамерную систему с порами диаметром 1 мкм. Эндотелиальные клетки (ЭК) человека (линия EA.hy926) помещали в верхнюю камеру на подложке из коллагена I типа и выращивали 2–3 сут до формирования визуального монослоя. После этого в верхнюю камеру добавляли 200 мкг/мл ЛПНП и 200 мкг/мл альбумина, а в нижнюю – ТК интактные или активированные агрегированным IgG человека, либо соединением 48/80. ТЭТ белков (прохождение из верхней камеры в нижнюю через монослой ЭК) оценивали через 5 и 24 ч. Оказалось, что присутствие в нижних камерах ТК (интактных, либо активированных) вызывало замедление ТЭТ ЛПНП и альбумина через 24 ч, но не через 5 ч. Транспорт ЛПНП оказался более чувствителен к ингибирующему влиянию ТК, чем транспорт альбумина. Супрессивное действие ТК зависело в основном от гистамина и отменялось блокатором гистаминовых рецепторов Н1 (но не Н2).
В последнее время все большее внимание исследователей привлекает роль ТК как источника регуляторных влияний на кровеносные и лимфатические сосуды. В тканях ТК располагаются вокруг кровеносных и лимфатических сосудов и способны вступать в непосредственный контакт с ЭК (Guidolin et al., 2017). Подобно эндотелию, ТК содержат NO-синтазу и продуцируют окись азота (Kritas et al., 2013) и, как предполагается, могут влиять на тонус сосудов и активность эндотелия. Несмотря на близость анатомического расположения сосудов и ТК, функциональные последствия их контактов для обоих типов клеток изучены недостаточно (Kunder et al., 2011; Zhang et al., 2011).
ТК являются одним из основных источников гистамина в организме, выделяя его при активации иммунными комплексами, содержащими иммуноглобулин E, либо G (IgG), и многими другими факторами. Известно, что гистамин повышает проницаемость сосудов (Tessier et al., 2007; Kumar et al., 2009). Предполагается, что в сосудах с мышечным слоем механизм сосудорасширяющего действия гистамина реализуется через гладкомышечный слой благодаря расслаблению гладкомышечных волокон и “раздвиганию” клеток эндотелия (Чернух, 1976). Влияние гистамина на эндотелий изучено меньше. Между тем, вопрос о роли тучных клеток и гистамина в регуляции эндотелиальной проницаемости важен для понимания физиологии сосудов в норме и при воспалении. Хорошо известно, что индукция IgG-содержащими иммунными комплексами (в результате взаимодействия с Fcγ-рецепторами) дегрануляции ТК приводит к освобождению большого числа биологически активных веществ, которые являются важнейшими участниками воспалительного процесса. Следовательно, необходимо учитывать потенциал этих клеток врожденного иммунитета в инициации иммунопатологических механизмов, запускаемых таким, почти бытовым, фактором, как иммунные комплексы, сопровождающие любое инфекционное заболевание, любой иммунный ответ.
Учитывая неодинаковое строение разных анатомических сегментов сосудистой сети (артерий и артериол, вен и венул, лимфатических сосудов), центральным может оказаться вопрос о влиянии ТК и гистамина на проницаемость общего для сосудистой сети эндотелия.
Вопрос о влиянии гистамина на эндотелий неясен. Наряду с многочисленными данными о стимулирующем действии гистамина на проницаемость эндотелия (Tessier et al., 2007; Kumar et al., 2009), есть данные и о его угнетающем действии (Takeda et al., 1992; Lua et al., 2010). Так, у мышей с эндотелий-специфичной сверхэкспрессией гена гистаминового рецептора Н1 наблюдали не повышение, а снижение проницаемости гематоэнцефалического барьера при индукции экспериментального аллергического энцефаломиелита (Lua et al., 2010).
Цель настоящей работы – изучить взаимодействие ТК и ЭК in vitro, используя модель, в которой клетки находятся в двухкамерном культуральном сосуде: монослой ЭК – в верхней камере на ее пористом дне, ТК – в нижней камере. Исследовали влияние ТК на трансэндотелиальный транспорт (ТЭТ) компонентов плазмы (ЛПНП и альбумина) из верхней камеры в нижнюю.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Использовали эндотелиоциты человека линии EA.hy926 и ТК человека перевиваемой линии HMC-1. Клетки линии EA.hy926 с подтвержденным эндотелиальным фенотипом (наличием основного маркера эндотелия фактора фон Виллебранда) получены от д-ра Cora-Jean S. Edgell (Университет Северной Каролины, США), ТК линии HMC-1 – от д-ра Joseph H. Butterfield (Mayo Clinics, США).
Двухкамерная система. Исследование проводили в 2-камерной системе, верхние камеры которой представляют собой пористые вставки (трансвеллы) с диаметром пор 1 мкм (353 104; Costar, США), а нижние – лунки 24-луночного планшета (Sarstedt, Германия), в которых расположены указанные вставки. Вставки предварительно обрабатывали раствором коллагена I типа (Биолот, Россия) (70 мкг/мл в 20 мМ уксусной кислоте) в течение 1 ч при комнатной температуре, далее их промывали фосфатно-солевым буферным раствором (PBS) (Биолот, Россия) и выдерживали в среде DMEM (D6546; Sigma, США), содержащей 10% фетальной телячьей сыворотки (FCS) (HyClone, США), в течение 3 ч в СО2-инкубаторе (37°С, 5% СО2).
Ход экспериментов. Вставки засевали клетками линии EA.hy926, по 105 клеток на вставку. Клетки растили в среде DMEM c 10% FCS при 37°С и 5% СО2 в течение 2–3 сут до формирования визуального монослоя. Далее монослой ЭК переводили в бессывороточную среду. Для этого клетки предварительно выдерживали в среде DMEM, содержащей 0.5% бычьего сывороточного альбумина (Sigma, США), в течение 1 сут. Затем во вставки добавляли по 200 мкл среды DMEM, содержащей 200 мкг/мл выделенных ЛПНП человека и 200 мкг/мл очищенного альбумина человека (Sigma, США). ЛПНП (1.024–1.055 г/мл) были выделены из донорской плазмы методом последовательного ультрацентрифугирования (Havel et al., 1955) в роторе 70Ti на ультрацентрифуге Beckman Optima L90-K (США). Выделенные ЛПНП диализовали против PBS. Содержание белка в препаратах ЛПНП определяли BCA-реактивом (Pierce, США).
В нижние камеры вносили по 106 ТК линии HMC-1 на 700 мкл среды. Клетки культивировали на среде IMDM (Iscove’s Modified Dulbecco’s Medium; Биолот, Россия), содержащей 10% FCS и 1.2 мМ монотиоглицерола, в СО2-инкубаторе (37°С, 5% СО2). Перед добавлением в нижние камеры ТК предварительно выдерживали в культуральной среде в течение 1 ч в присутствии раствора термоагрегированного (при 63°С, 10 мин) нормального IgG человека (Имтек, Россия), либо c либератором гистамина соединением 48/80 (полимер, произведенный с помощью конденсации из N-метил-р-метоксифенилэтиламина с формальдегидом; Sigma-Aldrich, США) в заранее подобранных оптимальных концентрациях (300 мкг/мл и 20 мкг/мл соответственно). Во избежание преждевременной дегрануляции клеток, нагрузку мембранных рецепторов IgG и веществом 48/80 проводили при 4°С. Контролем служили клетки MHC-1, к которым вместо активаторов добавляли PBS. Затем клетки дважды отмывали холодным PBS и вносили в нижние камеры 2-камерной системы (с монослоем ЭК в верхних) и далее помещали в СО2-инкубатор.
В ряде экспериментов в верхние камеры добавляли гистамин. Гистамин (Sigma-Aldrich, США) использовали в финальной концентрации 10−6 М, подобранной предварительно как минимальнoй и достаточной для получения эффекта. Блокаторы гистаминовых рецепторов Н1 и Н2 (супрастин (Эгис, Венгрия) и квамател (Гедеон Рихтер, Венгрия) соответственно) использовали в концентрации 6.7 мкг/мл, принятой в клинической практике.
Через 5 и 24 ч от начала совместного культивирования ЭК и ТК отбирали по 50 мкл аликвот из нижних камер для определения концентраций аполипопротеина В (апоВ), основного аполипопротеина ЛПНП, и альбумина человека.
Иммуноферментный анализ (ИФА). Концентрацию апоВ в культуральных средах определяли при помощи “сэндвич”-варианта ИФА с использованием нижних поликлональных антител кролика к апоВ человека (ИМТЕК, Россия) в разведении 1 : 500 и конъюгатов антител к апоВ с пероксидазой хрена (Sigma, США), приготовленных по описанному методу (Кэтти, Райкундалия, 1991), в разведении 1 : 50. Концентрацию альбумина определяли при помощи прямого варианта ИФА с использованием поликлональных антител кролика к альбумину человека (ИМТЕК, Россия) в разведении 1 : 100 000 и конъюгатов козьих антител к кроличьим Ig с пероксидазой хрена (Abcam, США) в разведении 1 : 20 000.
Показатель ТЭТ. Показатель ТЭТ макромолекул рассчитывали как отношение количества апоВ или альбумина (нг) в нижней камере к количеству соответствующего белка (нг), добавленного в верхнюю камеру, и выражали в процентах.
Статистическая обработка результатов. Использовали пакет Microsoft Excel. Результаты основаны на данных 4–5 экспериментов, причем на каждое условие эксперимента использовали по 3–4 вставки, т.е. общее число повторов составило 12–16 на 1 точку. Данные представлены в виде средних значений и их ошибок. Достоверность различий оценивали по непарному t-критерию Стьюдента. Различия считали достоверными при P < 0.05.
РЕЗУЛЬТАТЫ
Как видно из рис. 1, Iа–г, в течение первых 5 ч культивирования присутствие в нижней камере как не активированных, так и активированных ТК не оказывало заметного влияния на ТЭТ альбумина. Количество альбумина, проникшего через монослой ЭК из верхней камеры в нижнюю, было практически одинаковым как в присутствии ТК, так и без них, независимо от того, были ли ТК активированы и чем именно, или нет. Однако через 24 ч совместного культивирования клеток влияние ТК на ТЭТ альбумина становилось вполне очевидным и, как видно на рис. 1, Iд–з, практически не зависело от того, активированы ТК или нет. Так, присутствие в системе неактивированных ТК приводило к практически двукратному снижению ТЭТ альбумина по сравнению с культивированием в отсутствие ТК (рис. 1, Iе; Р < 0.05). ТК, активированные агрегированным IgG, либо соединением 48/80, также подавляли ТЭТ альбумина (рис. 1, Iж, з; Р < 0.05).
Рис. 1.
Влияние тучных клеток (ТК) на трансэндотелиальный транспорт (ТЭТ) альбумина (I) и ЛПНП (II) и его зависимость от гистамина и гистаминовых рецепторов Н1 и Н2. ТЭТ оценивали через 5 (а–г) и 24 (д–з) ч культивирования в отсутствие (а, д) или в присутствии не активированных ТК (б, е), либо ТК, активированных агрегированным иммуноглобулином G (Ig; в, ж) или соединением 48/80 (г, з). Супрастин (С) и квамател (К) использовали в качестве блокаторов Н1- и Н2-рецепторов соответственно. Здесь и на рис. 2, 3 представлены средние значения и их ошибки (вертикальные отрезки); достоверность различий при P < 0.05 показана звездочкой.

Факт влияния ТК из нижней камеры системы на эндотелиальный монослой в верхней камере указывает на действие гуморальных посредников. Наиболее вероятным действующим агентом является гистамин – известный продукт ТК, к которому у ЭК клеток линии EA.hy926 есть рецепторы H1 и H2 (Esposito et al., 2011). Для проверки роли гистамина как действующего фактора ТК, ответственного за ингибирование ТЭТ альбумина, мы использовали блокаторы гистаминовых рецепторов Н1 и Н2 – супрастин и квамател соответственно.
Как видно на рис. 1, Iе–з, супрастин во всех случаях снижал ингибирующее действие ТК, как интактных, так и стимулированных агрегированным IgG или соединением 48/80, на ТЭТ альбумина, тогда как блокатор Н2-рецепторов квамател не оказывал влияния на этот процесс. Полученные данные, во-первых, свидетельствуют о том, что секретируемый ТК гистамин является, как минимум, основным агентом, если не единственным, посредством которого эти клетки оказывают влияние на ТЭТ альбумина. Кроме того, свое действие на ЭК гистамин осуществляет через Н1-рецептор.
Мы также выяснили, каково влияние ТК на ТЭТ ЛПНП. Как следует из рис. 1, II, ТК оказывают более сильное влияние на прохождение через эндотелий ЛПНП, чем альбумина. Если в течение 5 ч ТЭТ альбумина был устойчив не только к интактным, но и к активированным ТК, то транспорт ЛПНП на этом раннем сроке уже демонстрировал высокую чувствительность к влиянию ТК, хотя только активированных IgG или соединением 48/80 (рис. 1, IIв, г).
Через 24 ч совместного культивирования отчетливое подавление ТЭТ ЛПНП вызывали уже не только активированные, но и интактные ТК (рис. 1 IIе–з). Снижение транспорта ЛПНП (Р < 0.05) частично отменялось блокатором гистаминовых рецепторов Н1 супрастином, но не блокатором Н2-рецепторов квамателом (рис. 1, IIе–з). Это однозначно указывает на участие Н1-рецепторов в обеспечении чувствительности механизмов ТЭТ альбумина и ЛПНП к гистамину тучных клеток.
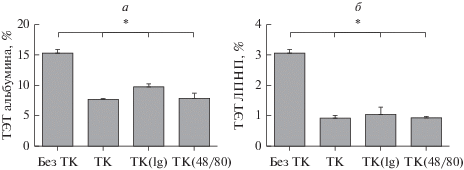
Сводные сравнительные данные по ТЭТ альбумина и ЛПНП через 24 ч культивирования представлены на рис. 2. Видно, что скорость ТЭТ альбумина значительно выше, чем ЛПНП: количество проникшего в нижнюю камеру альбумина в пять раз больше (приблизительно 15%), чем ЛПНП (около 3%). В присутствии ТК транспорт и альбумина, и ЛПНП снижается. Влияние ТК на транспорт апоВ-содержащих ЛПНП значительно сильнее, чем на транспорт альбумина (Р < 0.05) (рис. 2).
Рис. 2.
Влияние тучных клеток (ТК), не активированных, либо активированных агрегированным иммуноглобулином G (Ig) или соединением 48/80, на трансэндотелиальный транспорт (ТЭТ) альбумина (а) и ЛПНП (б). ТЭТ оценивали через 24 ч культивирования.
Для дополнительной идентификации гистамина как молекулы, обеспечивающей супрессивные эффекты ТК на ТЭТ макромолекул, исследовали влияние гистамина на ТЭТ ЛПНП в той же двухкамерной системе, где в верхней камере по-прежнему находился монослой клеток EA.hy926, а в нижней – только среда. Гистамин в разных концентрациях вносили в среду верхней камеры с эндотелием (рис. 3). Как следует из рис. 3, действие гистамина проявляется через 24 ч (Р < 0.05) и выражается подавлением ТЭТ апоВ-содержащих ЛПНП (через 1 ч эффект не замечен). Это совпадает с описанной выше супрастин-чувствительной супрессией транспорта ЛПНП, вызываемой ТК. Как и в экспериментах с ТК, супрессивный эффект гистамина отменялся блокатором рецепторов Н1, но не Н2.
ОБСУЖДЕНИЕ
Известно, что эндотелиальная дисфункция играет существенную роль в патогенезе атеросклероза и характеризуется дисбалансом между факторами релаксации и сокращения, прокоагулянтными и антикоагулянтными субстанциями, а также между провоспалительными и антивоспалительными медиаторами (Poredos, 2001). Основными факторами эндотелиальной дисфункции, способствующей атерогенезу, считают чрезмерную продукцию супероксидных анионов, экспрессию эндотелиальными клетками молекул адгезии и увеличение адгезии моноцитов и макрофагов, а также повышение проницаемости эндотелиального слоя. Ранее нами показано, что факторы воспаления, связанные с развитием атеросклероза, такие как провоспалительный цитокин TNFα и C-реактивный белок, стимулируют прохождение ЛПНП через эндотелиальный монослой (Назаров и др., 2015).
ТК располагаются вокруг небольших сосудов и, как показывают наблюдения, способны вступать в непосредственный контакт с ЭК как in vitro, так и in vivo (Ohtsuka, 2000; Brill et al., 2004; Kunder et al., 2011). На возможность таких контактов указывают данные о том, что при дегрануляции ТК участки их мембран, несущие, в частности, их маркерный антиген CD63, акцептируются мембранами ЭК и могут быть обнаружены с помощью проточной цитофлуориметрии (Schaefer et al., 2012).
Способность ТК влиять на состояние эндотелия не вызывает сомнения. Большой набор биологически активных веществ, освобождающихся при дегрануляции ТК, включает в себя такие вазоактивные соединения, как гистамин, оксид азота, липидные медиаторы, протеазы и т.д. Так, например, ТК синтезируют и выбрасывают при дегрануляции ренин – фермент, запускающий цепь реакций, ведущих к образованию ангиотензина II. Плейотропный биологически активный пептид ангиотензин II вызывает множественные эффекты, считающиеся проатерогенными: индуцирует генерацию супероксид-анионного радикала, появление на клетках эндотелия адгезионных молекул VCAM-1 и ICAM-1, синтез хемокина MCP-1 (Toba et al., 2006). На проницаемость эндотелия могут влиять и другие вещества, также являющиеся продуктами ТК – катепсин G, триптаза (Sendo et al., 2003). Содержание в крови еще одного вещества, продуцируемого ТК (фермента химазы), коррелирует с числом и величиной атеросклеротических бляшек у людей (Doggrell et al., 2004), что также может быть связано с влиянием этого фермента, прямо или опосредовано, на проникновение ЛПНП в интиму артерий.
Результаты настоящего исследования позволяют заключить, что ТК действительно участвуют в регуляции физиологического состояния сосудов, влияя непосредственно на эндотелий. Причем в наших экспериментах ТК уменьшали ТЭТ альбумина и ЛПНП. Одним из медиаторов, по-видимому основным, влияния ТК на ЭК является гистамин. И действительно, роль гистамина в этом процессе подтверждена нейтрализацией (смягчением) его эффекта с помощью блокатора гистаминовых рецепторов Н1. Судя по полученным данным, рецепторы гистамина Н2 не участвуют в регуляции проницаемости эндотелия.
Действие гистамина на проницаемость сосудов хорошо известно. Гистамин действует на сосуды через гистаминовые рецепторы H1 и H2 (Ash, Schild, 1966; Ohtsuka, 2000; Brill et al., 2004; McLeod et al., 2005; Esposito et al., 2011). Гистамин, взаимодействуя с рецептором H1, повышает проницаемость венозного эндотелия, как считается, за счет увеличения промежутков между клетками. Через этот рецептор антигистаминные препараты гасят основные сосудистые эффекты гистамина. Хотя действие гистамина кратковременно (около 20 мин), оно может быть пролонгировано в условиях хронического воспаления при непрекращающейся активации пула ТК циркулирующими иммунными комплексами (любыми комплексами, содержащими IgG-антитела и соответствующие антигены).
Несмотря на многолетнюю историю изучения влияния гистамина на состояние эндотелия, к настоящему времени мало что известно о возможности избирательного влияния ТК и их основного медиатора гистамина на проникновение конкретных молекул через монослой ЭК. Особый интерес вызывает изучение влияния гистамина на поступление в сосудистую стенку ЛПНП, накопление которых в интиме артерий является одним из самых ранних событий в атерогенезе. Имеются сведения, что гистамин, действуя через Н1-рецепторы способствует развитию экспериментального атеросклероза у мышей с дефицитом аполипопротеина Е (Rozenberg et al., 2010), по-видимому, повышая поступление ЛПНП в интиму аорты. Вместе с тем, имеются весьма убедительные данные, что трансцитоз ЛПНП через ЭК является рецептор-опосредованным и не может осуществляться по межклеточным пространствам (см. обзор: Jang et al., 2020). Это позволяет предполагать, что действие гистамина на эндотелий не ограничивается только увеличением межклеточных промежутков.
Среди многих работ, повторяющих и подтверждающих тезис о повышении проницаемости сосудов (и эндотелия) гистамином, имеется только несколько публикаций, в которых показано снижение проницаемости под влиянием гистамина (Takeda et al., 1992; Lua et al., 2010). Кажущееся противоречие между известными данными о гистамине как веществе, повышающем проницаемость сосудов, и результатами настоящего исследования, как нам кажется, убедительно показавшими “эндотелий-уплотняющий” эффект гистамина, скорее всего, объясняется следующими обстоятельствами.
Реакция на гистамин многослойной сосудистой стенки не есть реакция только ее эндотелия, а есть совокупная реакция всех слоев. И если в составе сосуда присутствует гладкомышечный слой, то, скорее всего, именно его мощная реакция будет доминирующей и перекроет реакции других слоев. Наши данные позволяют заключить, что самостоятельная реакция эндотелия на гистамин является реакцией “сжатия”, реакцией “закрытия сосуда”, что при наличии мышечного слоя может составлять компенсаторное противодействие паретической реакции гладкомышечных волокон. Кроме того, весьма вероятно, что характер влияния гистамина на ТЭТ макромолекул может в существенной степени зависеть от физико-химических свойств изучаемых молекул.
Список литературы
Кэтти Д., Райкундалия И. 1991. Иммуноферментный анализ. В кн.: Антитела: Методы. М.: Мир. Т. 2. 384 с. (Katie D., Raikundalia I. 1991. Enzyme-linked Immunosorbent assay. In: Antibodies: Methods. M.: Mir. V. 2. 384 p.)
Назаров П.Г., Мальцева О.Н., Танянский Д.А., Агеева Е.В., Бородина Д.В., Денисенко А.Д. 2015. Влияние факторов воспаления на трансэндотелиальный транспорт липопротеинов сыворотки крови in vitro. Цитокины воспаления. Т. 14. № 4. С. 59. (Nazarov P.G., Maltseva O.N., Tanyanskiy D.A., Ageeva E.V., Borodina D.V., Denisenko A.D. 2015. Influence of inflammation factors on transendothelial transport of blood serum lipoproteins in vitro. Cytokines and Inflammation (Russ.). V. 14. № 4. P. 59.)
Чернух А.М., Александров П.Н., Алексеев О.В. 1975. Микроциркуляция. М.: Медицина. 456 с. (Chernukh A.M., Aleksandrov P.N., Alekseev O.V. 1975. Microcirculation. M.: Meditsina. 456 p.)
Ash A.S., Schild H.O. 1966. Receptors mediating some actions of histamine. Br. J. Pharmacol. Chemother. V. 27. P. 427. https://doi.org/10.1111/j.1476-5381.1966.tb01674.x
Brill A., Baram D., Sela U., Salamon P., Mekori Y.A., Hershkoviz R. 2004. Induction of mast cell interactions with blood vessel wall components by direct contact with intact T cells or T cell membranes in vitro. Clin. Exp. Allergy. V. 4. P. 1725. https://doi.org/10.1111/j.1365-2222.2004.02093.x
Doggrell S.A., Wanstall J.C. 2004. Vascular chymase: pathophysiological role and therapeutic potential of inhibition. Cardiovasc. Res. V. 61. P. 653. https://doi.org/10.1016/j.cardiores.2003.11.029
Esposito B., Gambara G., Lewis A.M., Palombi F., D’Alessio A., Taylor L.X., Genazzani A.A., Ziparo E., Galione A., Churchill G.C., Filippini A. 2011. NAADP links histamine H1 receptors to secretion of von Willebrand factor in human endothelial cells. Blood. V. 117. P. 4968. https://doi.org/10.1182/blood-2010-02-266338
Guidolin D., Ruggieri S., Annese T., Tortorella C., Marzullo A., Ribatti D. 2017. Spatial distribution of mast cells around vessels and glands in human gastric carcinoma. Clin. Exp. Med. V. 17. P. 531. https://doi.org/10.1007/s10238-017-0452-7
Havel R.J., Eder H.A., Bragdon J.H. 1955. The distribution and chemical composition of ultracentrifugally separated lipoproteins in human serum. J. Clin. Invest. V. 34. P. 345. https://doi.org/10.1172/JCI103182
Jang E., Robert J., Rohrer L., von Eckardstein A., Lee W.L. 2020. Transendothelial transport of lipoproteins. Atherosclerosis. V. 315. P. 111. https://doi.org/10.1016/j.atherosclerosis.2020.09.020
Kritas S.K., Saggini A., Varvara G., Murmura G., Caraffa A., Antinolfi P., Toniato E., Pantalone A., Neri G., Frydas S., Rosati M., Tei M., Speziali A., Saggini R., Pandolfi F., Cerulli G., Theoharides T.C., Conti P. 2013. Impact of mast cells on the skin. Int. J. Immunopathol. Pharmacol. V. 26. P. 855. https://doi.org/10.1177/039463201302600403
Kumar P., Shen Q., Pivetti C.D., Lee E.S., Wu M.H., Yuan S.Y. 2009. Molecular mechanisms of endothelial hyperpermeability: Implications in inflammation. Expert Rev. Mol. Med. V. 11. e19. https://doi.org/10.1017/S1462399409001112
Kunder C.A., St. John A.L., Abraham S.N. 2011. Mast cell modulation of the vascular and lymphatic endothelium. Blood. V. 118. P. 5383. https://doi.org/10.1182/blood-2011-07-358432
Lua C., Diehla S.A., Noubadea R., Ledouxb J., Nelsonb M.T., Spacha K., Zacharyc J.F., Blankenhornd E.P., Teuschera C. 2010. Endothelial histamine H1 receptor signaling reduces blood–brain barrier permeability and susceptibility to autoimmune encephalomyelitis. PNAS. V. 107. P. 18967. https://doi.org/10.1073/pnas.1008816107
McLeod R.L., Mingo G.G., Kreutner W., Hey J.A. 2005. Effect of combined histamine H1 and H3 receptor blockade on cutaneous microvascular permeability elicited by compound 48/80. Life Sci. V. 76. P. 1787. https://doi.org/10.1016/j.lfs.2004.08.033
Ohtsuka T. 2000. Different interaction of mast cells with human endothelial cells and fibroblasts. Eur. J. Dermatol. V. 10. P. 115.
Poredos P. 2001. Endothelial dysfunction in the pathogenesis of atherosclerosis. Clin. Appl. Thromb. Hemost. V. 7. P. 276. https://doi.org/10.1177/107602960100700404
Rozenberg I., Sluka S.H., Rohrer L., Hofmann J., Becher B., Akhmedov A., Soliz J., Mocharla P., Borén J., Johansen P., Steffel J., Watanabe T., Lüscher T.F., Tanner F.C. 2010. Histamine H1 receptor promotes atherosclerotic lesion formation by increasing vascular permeability for low density lipoproteins. Arterioscler. Thromb. Vasc. Biol. V. 30. P. 923. https://doi.org/10.1161/ATVBAHA.109.201079
Schaefer T., Zajonz A., Lorentz P., Bohnacker T., Wymann M.P., Schweighoffer T. 2012. Luminal decoration of blood vessels by activated perivasal mast cells in allergic rhinitis. Allergy. V. 67. P. 510. https://doi.org/10.1111/j.1398-9995.2012.02790.x
Sendo T., Sumimura T., Itoh Y., Goromaru T., Aki K., Yano T., Oike M., Ito Y., Mori S., Nishibori M., Oishi R. 2003. Involvement of proteinase-activated receptor-2 in mast cell tryptase-induced barrier dysfunction in bovine aortic endothelial cells. Cell Signal. V. 15. P. 773. https://doi.org/10.1016/s0898-6568(03)00014-7
Takeda T., Yamashita Y., Syuji S., Youji M. 1992. Histamine decreases the permeability of an endothelial cell monolayer by stimulating cyclic AMP production through the H2-receptor. J. Cell Sci. V. 101. P. 745.
Tessier J., Green C., Padgett D., Zhao W., Schwartz L., Hughes M., Hewlett E. 2007. Contributions of histamine, prostanoids, and neurokinins to edema elicited by edema toxin from bacillus anthracis. Infect. Immun. V. 75. P. 1895. https://doi.org/10.1128/IAI.01632-06
Toba H., Gomyo E., Miki S., Shimizu T., Yoshimura A., Inoue R., Sawai N., Tsukamoto R., Asayama J., Kobara M., Nakata T. 2006. Hyperinsulinaemia increases the gene expression of endothelial nitric oxide synthase and the phosphatidylinositol 3-kinase/Akt pathway in rat aorta. Clin. Exp. Pharmacol. Physiol. V. 33. P. 40. https://doi.org/10.1111/j.1440-1681.2006.04385.x
Zhang J., Alcaide P., Liu L., Sun J., He A. 2011. Regulation of endothelial cell adhesion molecule expression by mast cells, macrophages, and neutrophils. PLoS One. 6. e14525. https://doi.org/10.1371/journal.pone.0014525
Дополнительные материалы отсутствуют.



