Цитология, 2021, T. 63, № 2, стр. 127-138
Становление клеточной линии HindIIIG-1, полученной после облучения устойчивых к апоптозу клеток HindIIIG, характеризуется нестабильностью генома, нарушением системы репарации ДНК и активацией аутофагии
Ж. В. Шитикова 2, *, Н. М. Ярцева 1, Т. В. Быкова 1, С. Г. Зубова 1, Е. Ю. Кочеткова 1, В. А. Поспелов 1, Т. В. Поспелова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Женевский университет
1205 Женева, Швейцария
* E-mail: zhanna.chitikova@gmail.com
Поступила в редакцию 23.10.2020
После доработки 20.11.2020
Принята к публикации 21.11.2020
Аннотация
Генетическая нестабильность и гетерогенность популяции относятся к ключевым характеристикам опухолевых клеток, позволяющим им выживать в неблагоприятных условиях. Глобальная перестройка генома в результате явления, известного как хромотрипсис, приводит к возникновению множества мутаций за одно катастрофическое событие, что способствует прогрессии опухоли и приобретению устойчивости к терапии. Сложные хромосомные перестройки, возникающие при хромотрипсисе, обусловлены случайной сшивкой множества хромосомных фрагментов в результате ненадежной репарации путем негомологичного соединения концов. В настоящей работе изучена активация ответа на повреждение ДНК и репарации путем негомологичного соединения концов в качестве маркеров генетической нестабильности клеток HindIIIG-1, возникших после деполиплоидизации облученных клеток HindIIIG, устойчивых к апоптозу. Кроме того, исследовано возможное участие хромотрипсиса и аутофагии в формировании клеточной линии HindIIIG-1. Наши результаты показывают, что клетки HindIIIG-1 характеризуются высокой нестабильностью генома, активацией ответа на повреждение ДНК и репарации путем негомологичного соединения концов. Фрагментация хромосом в облученных клетках HindIIIG и необлученных клетках HindIIIG-1, а также активация репарации путем негомологичного соединения концов предполагают участие подобного хромотрипсису процесса в образовании линии HindIIIG-1. Показано, что в отличие от исходной линии HindIIIG, клетки HindIIIG-1 приобрели способность к инвазии и пролиферации независимо от прикрепления к субстрату, указывающую на возможность развития метастатического потенциала. Деградация поврежденной ДНК, ядер и микроядер в клетках HindIIIG-1 путем аутофагии говорит о ее вовлечении в процессы регуляции выживания и гибели, и, тем самым, об участии в становлении новой клеточной линии.
Нестабильность генома является одной из ключевых характеристик опухолевых клеток, которая позволяет им выживать и пролиферировать в неблагоприятных условиях. Хромосомная нестабильность является одним из видов генетической нестабильности. Она проявляется в численных и структурных перестройках хромосом, включая транслокации, делеции, вставки, инверсии участков хромосом и слияние теломер. Эти перестройки влекут за собой изменения экспрессии генов, в частности, онкогенов и опухолевых супрессоров (Negrini et al., 2010).
На стабильность генома влияют как внешние факторы, так и внутриклеточные процессы. ДНК-повреждающие агенты, окислительный стресс и ионизирующее излучение приводят к двуцепочечным разрывам ДНК, и тем самым вносят вклад в хромосомную нестабильность. Двуцепочечные разрывы являются наиболее опасными повреждениями ДНК. Нарушение их репарации лежит в основе генетической нестабильности. При обнаружении разрывов клетки активируют ответ на повреждение ДНК и репарацию. В местах разрывов ДНК происходит фосфорилирование гистона H2AX, активация белка 53BP и формирование фокусов, содержащих различные факторы ответа на повреждение ДНК и репарации (Rogakou et al., 1998; Rappold et al., 2001).
Главными механизмами репарации двуцепочечных разрывов ДНК являются гомологичная рекомбинация и негомологичное соединение концов ДНК. Гомологичная рекомбинация активируется в S и G2 фазах клеточного цикла и требует наличия гомологичной последовательности для аккуратной репарации ДНК (Mao et al., 2008). Негомологичное соединение концов не требует наличия гомологичной последовательности и является менее надежным механизмом репарации, который активируется в течение всего клеточного цикла (Mao et al., 2008). Нарушения репликации ДНК или вступление клетки в фазу митоза при незавершенной репликации также приводят к разрывам ДНК, которые влекут за собой фрагментацию хромосом. Хаотическая сборка фрагментов хромосом в ходе катастрофического события, известного как хромотрипсис, приводит к возникновению большого числа мутаций (Stephens et al, 2011; Zhang et al., 2015). Повреждение ДНК, фрагментация хромосом, образование микроядер и полиплоидизация способствуют хромотрипсису (Stephens et al., 2011; Crasta et al., 2012; Hatch, Hetzer, 2015; Cortés-Ciriano et al., 2020). При хромотрипсисе процессу фрагментации могут подвергаться одна или несколько хромосом (Cortés-Ciriano et al., 2020). Одним из характерных признаков хромотрипсиса является лигация фрагментов хромосом путем негомологичного соединения концов, приводящая к многочисленным структурным перестройкам (Jones, Jallepalli, 2012). Хромотрипсис, наряду с хромоанасинтезом и хромоплексией, различающихся по механизмам, количеству точек разрывов и перестроенных хромосом, относится к такому явлению как хромоанагенез (Zhang et al., 2013).
Аутофагия представляет собой катаболический процесс, который способствует деградации поврежденных компонентов клетки, тем самым поддерживает клеточный гомеостаз. Она необходима для выживания и гибели клеток, развития, репрограммирования и поддержания фенотипа стволовых клеток (Levine, Yuan, 2005; Mizushima, Levine, 2010; Menendez et al., 2011). Показано, что аутофагия участвует в ответе клетки на повреждение ДНК и репарации, способствуя таким образом поддержанию целостности генома (Mathew et al., 2007; Guan et al., 2013; Vanzo et al., 2020).
Ранее мы показали, что трансформированные районом HindIIIG аденовируса 5-ого типа эмбриональные фибробласты крысы, характеризующиеся устойчивостью к апоптозу, преодолевают индуцированное облучением старение (Chitikova et al., 2014). Обратимое старение ассоциировалось с формированием гигантских полиплоидных клеток, задержкой активации ответа на повреждение ДНК и ее репарации, а также персистенцией разрывов ДНК. Восстановление популяции происходило за счет SA-β-Gal-негативных клеток с околодиплоидным содержанием ДНК, образовавшихся, по-видимому, в результате деполиплоидизации гигантских клеток (Chitikova et al., 2014). Наши дальнейшие исследования показа-ли, что в процессе становления линии HindIIIG-1 в облученных клетках HindIIIG и необлученных Hi-ndIIIG-1 наблюдаются клональные и неклональные хромосомные перестройки, отмечается гетерогенность популяции (Ярцева и др., 2020).
В настоящей работе мы исследовали функционирование системы репарации ДНК, аутофагии и процесса, подобного хромотрипсису, в становлении клеточной линии HindIIIG-1. Кроме того, проанализированы фенотипические изменения клеток HindIIIG-1, являющиеся характерными признаками развития метастатического потенциала. Мы обнаружили, что новая линия HindIIIG-1, полученная после облучения клеток HindIIIG, характеризуется многочисленными хромосомными аберрациями и длительной активацией системы репарации ДНК. Наши результаты указывают на возможное участие механизма подобного хромотрипсису, а также аутофагии в формировании и поддержании клеточной линии HindIIIG-1. Клетки линии HindIIIG-1 характеризуются способностью к пролиферации независимо от прикрепления к субстрату и миграции через поры мембраны, покрытой Матригелем, что может указывать на приобретение метастатического потенциала. Полученные данные показывают, что подобные хромотрипсису явления и аутофагия играют роль в восстановлении популяции опухолевых клеток после действия ионизирующего излучения, а также в приобретении устойчивости к облучению.
МАТЕРИАЛ И МЕТОДИКА
Клеточные линии. Клетки HindIIIG были получены из эмбриональных фибробластов крысы в результате котрансфекции регионом HindIIIG аденовируса Ad5 человека и плазмидой pSV-2neo. Линия HindIIIG-1 получена в результате однократного воздействия рентгеновского излучения на клетки Hi-ndIIIG в дозе 6 Гр и последующего культивирования облученных клеток в течение 27 сут до достижения монослоя, после чего клетки пересевали на новые культуральные чашки и начинали отсчет пассажей линии HindIIIG-1. Клетки культивировали в среде Игла в модификации Дальбекко (Биолот, Россия), содержащей 10% сыворотки крупного рогатого скота (HyClone, США), 1% пенициллина и стрептомицина в условиях 5% CO2 и 37°C.
Иммунофлуоресценция и конфокальная микроскопия. Анализировали активацию ответа на повреждение ДНК, процессы репарации ДНК путем негомологичного соединения концов и аутофагию. Клетки высевали на покровные стекла, через 24 ч их фиксировали и окрашивали как описано ранее (Chitikova et al., 2014). Препараты анализировали с помощью конфокального микроскопа Leica TCS SP5 (Leica Microsystems, Германия).
Активацию ответа на повреждение ДНК оценивали по формированию фокусов, содержащих гистон H2AX, фосфорилированный по серину в положении 139 (γH2AX), и p53-связывающий белок (53BP1). Активацию репарации ДНК путем негомологичного соединения концов оценивали по фосфорилированию каталитической субъединицы ДНК-зависимой протеинкиназы по серину в положении 2056 (pDNA-PKcsSer2056). Количество фокусов γH2AX и 53BP1, а также наличие pDNA-PKcsSer2056 оценивали при подсчете 100 ядер. Аутофагию оценивали по колокализации белков LAMP1 и LC3, указывающую на формирование аутолизосом.
В работе использованы первичные антитела против белков 53BP1 и LAMP1 (Cell Signaling Technology, США), γH2AX и pDNA-PKcsSer2056 (Abcam, США), LC3 (MBL, США) и вторичные антитела, конъюгированные с флуоресцентными красителями A-lexa-fluor 488 и Alexa-fluor 568 (Invitrogen, США).
Выявление хромосомных аберраций, фрагментации хромосом и активных ядрышковых организаторов. Клетки культивировали в присутствии 0.6 мкг/мл колхицина в течение 90 мин при 37°C и 5% CO2. Затем клетки трипсинизировали, собирали в конические пробирки объемом 15 мл и центрифугировали при 200 g в течение 5 мин. Далее клетки ресуспензировали в 6 мл 0.075M раствора KCl, нагретого до 37°C, и инкубировали 12 мин при 37°C. Затем клетки центрифугировали и фиксировали в смеси метанола и ледяной уксусной кислоты в соотношении 3 : 1 в течение 15 мин при 20°C. Процедуру центрифугирования и фиксации повторяли дважды. Суспензию клеток в смеси метанола и ледяной уксусной кислоты наносили на предметные стекла над водяной баней при температуре 53°C. После этого препараты оставляли до полного высыхания. Хромосомы окрашивали раствором Гимза, как описано в литературе (Ozkinay et al., 1979). Ядрышковые организаторы выявляли с помощью окрашивания препаратов хромосом 50%-ным раствором нитрата серебра (Sigma, CША), как описано ранее (Howell, Black, 1980). Анализ проводили при помощи светового микроскопа с использованием объективов с увеличением 10× и 100×. Число хромосом определяли при анализе 100 клеток, количество клеток с фрагментацией хромосом определяли при анализе 1000 метафазных пластинок.
Анализ инвазивной способности клеток. Анализ выполнялся по описанной ранее методике (Pospelova et al., 2013). Для оценки инвазивной способности клеток были использованы камеры с мембраной, покрытой Матригелем, с размером пор 8 мкм (BD Biosystems).
РЕЗУЛЬТАТЫ
Клетки линии HindIIIG-1 характеризуются высокой генетической нестабильностью. Ранее мы показали, что в связи с нарушением процессов репарации в облученных клетках HindIIIG длительное время сохраняются повреждения ДНК, а также формируются микроядра (Chitikova et al., 2014). Мы проанализировали нарушения хромосом в клетках HindIIIG через 1 и 4 сут после облучения, а в клетках HindIIIG-1 – на 22–34-ом пассажах. При анализе облученных клеток HindIIIG и необлученных клеток HindIIIG-1 были обнаружены метафазы с фрагментацией хромосом, выявлены дицентрические и кольцевые хромосомы, а также двойные микрохромосомы (рис. 1а), тогда как в контрольных необлученных клетках Hin-dIIIG данные нарушения не выявлены (рис. 1б). Кроме того, в многоядерных клетках HindIIIG-1, но не в контрольных клетках HindIIIG, была выявлена асинхронная конденсация хромосом (рис. 1б). Фрагментации подвергалось различное число хромосом. Мы обнаружили клетки с фрагментами множества хромосом, образовавшихся, вероятно, в результате фрагментации целого ядра, а также клетки с одной фрагментированной хромосомой (рис. 1в).
Рис. 1.
Хромосомные аберрации, нарушение конденсации и фрагментация хромосом в клетках HindIIIG после действия рентгеновского излучения в дозе 6 Гр и в необлученных клетках HindIIIG-1 . а – Фрагменты хромосом (фх), дицентрические (дх) и кольцевые (кх) хромосомы. б – Асинхронная конденсация хромосом в многоядерных клетках HindIIIG-1. в – Фрагментация хромосом в клетках HindIIIG-1. Стрелками указана фрагментация одной хромосомы, наблюдаемая в клетках Hi-ndIIIG после облучения и в клетках HindIIIG-1. Показаны изображения, полученные через 1 и 4 сут после облучения клеток HindIIIG, а также клеток HindIIIG-1 на пассажах 1, 22 и 34 (1п, 22п, 34п).

Фрагментация хромосом была обнаружена в 0.8% необлученных клеток HindIIIG и в 0.7% клеток через 1 сут после облучения. Количество клеток Hi-ndIIIG с фрагментированными хромосомами возросло до 9.3% на четвертые сутки после облучения, а через 13 сут снизилось до 1.6%. При дальнейшем культивировании доля клеток с фрагментацией хромосом продолжала снижаться. Так, в необлученных клетках HindIIIG-1 мы обнаружили 0.6% и 0.8% клеток с фрагментацией хромосом на 4- и 22-ом пассажах соответственно.
Полученные данные указывают на высокую хромосомную нестабильность и наличие фрагментации хромосом в облученных клетках HindIIIG и клетках HindIIIG-1, не подвергнутых действию рентгеновского излучения.
В популяции клеток HindIIIG-1 долговременно активированы ответ на повреждение ДНК и репарация путем негомологичного соединения концов. Наши предыдущие данные показывают, что в облученных клетках HindIIIG нарушены ответ на повреждение ДНК и репарация, отмечается их длительная активация, а также наблюдается персистенция повреждений ДНК (Chitikova et al., 2014). Mы решили исследовать, связана ли фрагментация хромосом в клетках HindIIIG-1 с активацией ответа на повреждение ДНК и с репарацией путем негомологичного соединения концов.
Активацию ответа на повреждение ДНК определяли по формированию и колокализации фокусов γH2AX и 53BP1 в ядрах исследуемых клеток. Так как незначительное количество фокусов γH2AX и 53BP1 обнаруживается в клетках в норме, при подсчете доли ядер с фокусами мы учитывали ядра, содержащие более трех фокусов. В необлученных клетках HindIIIG-1 формирование и колокализацию фокусов γH2AX и p53BP1 наблюдали на 10- и 22-ом пассажах, тогда как в необлученных клетках HindIIIG фокусы γH2AX и p53BP1 не колокализовались (рис. 2а). Кроме того, γH2AX был выявлен в микроядрах клеток Hi-ndIIIG-1 (рис. 2б). На 10-ом пассаже клеток Hin-dIIIG-1 более трех фокусов ответа на повреждение ДНК было выявлено в 91.2 ± 2.3% ядер, при этом среднее число фокусов γH2AX в одном ядре составило 12.9 ± 7.8, а фокусов 53BP1 – 11.3 ± 6.9. На 22-ом пассаже более трех фокусов было выявлено в 87.2 ± 4.2% ядер, а среднее число фокусов на ядро составило 13.5 ± 7.7 для γH2AX и 11.9 ± 5.4 для 53BP1. В отличие от клеток HindIIIG-1, в необлученных клетках Hi-ndIIIG среднее число фокусов γH2AX и 53BP1 в ядре составило 2.8 ± 1.4 и 1.7 ± 1.2 соответственно, при этом 4.7 ± 2.3% ядер содержало фокусы γH2AX и 3.5 ± 2.1% ядер – фокусы 53BP1.
Рис. 2.
Активация ответа на повреждение ДНК и нарушение механизмов репарации в необлученных клетках HindIIIG-1 согласно формированию, колокализации и персистенции фокусов γH2AX и 53BP1. а – Маркированные соответствующими антителами к γH2AX и 53BP1 фокусы ответа на повреждение ДНК и их колокализация (merge) в ядрах клеток. б – Формирование микроядер, содержащих γH2AX. Показаны результаты иммуноцитохимического окрашивания клеток на 10- и 22-ом пассажах (10п и 22п). Ядра окрашены DAPI. Изображения получены с помощью конфокального микроскопа.
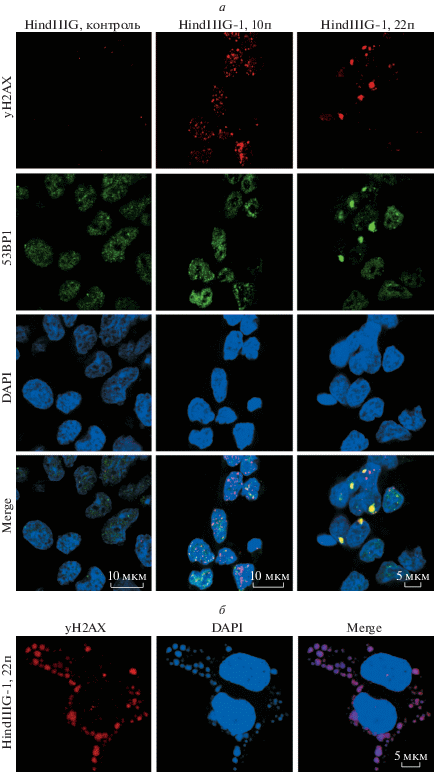
В связи с тем, что репарация путем негомологичного соединения концов принимает участие в опосредованных хромотрипсисом хромосомных перестройках (Stephens et al., 2011), мы проанализировали ее активацию в необлученных клетках HindIIIG-1. Действительно, мы обнаружили фосфорилирование каталитической субъединицы ДНК-зависимой протеинкиназы (DNA-PKcs) по серину в положении 2056 (pDNA-PKcsSer2056) в клетках HindIIIG-1 (рис. 3), что говорит об активации репарации ДНК путем негомологичного соединения концов. Кроме того, pDNA-PKcsSer2056 колокализовалась с фокусами γH2AX на пассажах 10 и 22 (рис. 3) Так, 27.1 ± 3.4% клеток HindIIIG-1 на 10-ом пассаже содержали pDNA-PKcsSer2056 и 54.4 ± 6.4% клеток – на 22-ом пассаже. Среднее количество фокусов pDNA-PKcsSer2056 в ядре составило 27.1 ± 8.2% и 54.4 ± 5.5% на пассажах 10 и 22 соответственно. В отличие от HindIIIG-1, только 6.9 ± 4.8% необлученных клеток HindIIIG содержали pDNA-PKcsSer2056, а среднее количество фокусов в ядре составило 1.8 ± 1.4.
Рис. 3.
Активация репарации ДНК путем негомологичного соединения концов в необлученных клетках HindIIIG-1 согласно фосфорилированию каталитической субъединицы ДНК-зависимой протеинкиназы (pDNA-PKcsSer2056) и ее колокализация (merge) с фокусами γH2AX. Показаны результаты иммуноцитохимического окрашивания с использованием соответствующих антител на 10- и 22-ом пассажах (10п и 22п). Ядра окрашены DAPI. Изображения получены с помощью конфокального микроскопа.

Таким образом, наши результаты говорят о возрастании генетической нестабильности в клетках HindIIIG-1 по сравнению с исходной линией Hi-ndIIIG.
В облученных клетках HindIIIG и необлученных клетках HindIIIG-1 поврежденная ДНК, ядра и микроядра подвергаются аутофагической деградации.
Поврежденная ДНК, хромосомы и фрагменты хромосом изолируются в микроядрах, а затем элиминируются из клетки или подвергаются деградации с помощью аутофагии (Rello-Varona et al., 2012). Кроме того, ядра могут быть деградированы посредством нуклеофагии, представляющей собой особую форму аутофагии (Mijaljica, Devenish, 2013). Ранее мы показали, что в облученных клетках HindIIIG отмечается активация аутофагии одновременно со снижением активности киназы mTOR (Chitikova et al., 2014).
Мы проанализировали активацию аутофагии и ее участие в деградации генетического материала в клетках HindIIIG через 4 сут после облучения и в необлученных клетках HindIIIG-1 на 22-ом пассаже согласно колокализации маркера аутофагосом белка LC3 и лизосом-связанного мембранного белка LAMP1 с ДНК. Согласно полученным данным, в отличие от контрольных клеток HindIIIG, в исследованных клетках маркеры LC3 и LAMP1 колокализуются с отдельными ядрами многоядерных клеток, микроядрами и диспергированным ДНК-содержащим материалом, являющимся, по-видимому, фрагментами хромосом (рис. 4). В связи с этим мы предполагаем, что аутофагия может служить механизмом селекции генетического материала и деградации поврежденной ДНК в облученных клетках HindIIIG и необлученных клетках HindIIIG-1.
Рис. 4.
Активация аутофагии в клетках HindIIIG после облучения в дозе 6 Гр и в необлученных клетках HindIIIG-1 (а). Стрелками указаны микроядра, содержащие маркеры аутофагии LAMP-1 и LC3. Увеличенные изображения внизу показывают колокализацию LAMP-1 и LC3 с ДНК, окрашенной DAPI в фрагментах хромосом (б) и в микроядрах, указанных стрелками (в). Активацию аутофагии анализировали на 4-е сут после облучения клеток HindIIIG (*), и на 22-ом пассаже (**) (22п) клеток HindII-IG-1. ДНК и ядра окрашены DAPI. Визуализация с помощью соответствующих антител, конфокальная микроскопия.

Клетки HindIIIG-1 характеризуются способностью к инвазии и пролиферации независимо от прикрепления к субстрату. Ранее мы показали, что облучение клеток HindIIIG приводило к активации обратимой программы старения, экспрессии маркеров стволовых клеток и формированию новой околодиплоидной популяции (Chitikova et al., 2014) HindIIIG-1. В этом исследовании мы обнаружили, что в процессе культивирования линия HindIIIG-1 разделилась на две субпопуляции. Тогда как прикрепленные клетки представляли собой большую часть популяции, часть клеток была способна пролиферировать независимо от прикрепления к субстрату. Так как подобное свойство может указывать на приобретение клетками способности к метастазированию, мы проанализировали способность обеих субпопуляций к инвазии. В отличие от исходных необлученных клеток HindIIIG обе субпопуляции клеток HindIIIG-1 продемонстрировали способность к миграции через поры мембраны, покрытой Матригелем. При этом инвазивная способность клеток, не прикрепленных к субстрату, оказалась в два раза выше, чем адгезированных. Так, 49.6% клеток из плавающей фракции и 26.4% клеток из адгезированной субпопуляции мигрировали через поры мембраны покрытой Матригелем, тогда как контрольные необлученные клетки HindIIIG не были способны проходить через поры мембраны.
Предположив, что формирование двух субпопуляций может быть связано с перестройками хромосом, возникающими в результате облучения, мы проанализировали кариотип обеих субпопуляций на 17-ом пассаже. Обе эти популяции были гетерогенны и характеризовались сходными структурными перестройками, показанными нами ранее (Ярцева и др., 2020). Окрашивание нитратом серебра выявило, что 30% прикрепленных к субстрату и 23% суспензионных клеток c числом хромосом 41 были представлены клоном с активными ядрышковыми организаторами на коротком плече хромосомы 3, описанным нами ранее (Ярцева и др., 2020).
Так как субпопуляции клеток HindIIIG-1 не имеют значительных различий на хромосомном уровне, мы предполагаем, что их фенотип определяется другими механизмами регуляции экспрессии генов. Принимая во внимание увеличение числа клеток с активными ядрышковыми организаторами в популяции, растущей независимо от прикрепления к субстрату, можно предположить, что одним из таких механизмов может быть регуляция трансляции.
ОБСУЖДЕНИЕ
Наше предыдущее исследование показало, что активация обратимого старения после облучения устойчивых к апоптозу клеток HindIIIG сопровождается образованием гигантских полиплоидных клеток, способных реплицировать ДНК и характеризующихся нарушениями ответа на повреждение ДНК и ее репарации, а также персистенцией повреждений ДНК (Chitikova et al., 2014). В частности, транслокация 53BP1 и Rad51 к местам повреждений ДНК происходила с задержкой. Кроме того, ферменты репарации ДНК Rad51 и pDNA-PKcsSer2056 длительное время оставались активированными и колокализовались с фокусами повреждений ДНК до конца эксперимента (20-е сут после облучения), тогда как в нормальных фибробластах крысы репарация завершалась через 1 сут после воздействия ионизирующего излучения (Chitikova et al., 2014).
В настоящей работе мы показали, что в клетках HindIIIG-1, полученных из околодиплоидных клеток, образовавшихся после облучения клеток Hin-dIIIG, наблюдается персистенция фокусов γH2AX и 53BP1, а также активация репарации ДНК путем негомологичного соединения концов. Нужно отметить, что количество клеток с фокусами γH2AX и 53BP1, а также количество фокусов на клетку на пассажах 10 и 22 практически не отличалось. В то же время количество клеток с pDNA-PKcsSer2056 на 22-ом пассаже увеличилось вдвое по сравнению с пассажем 10, что может говорить об усилении репарации путем негомологичного соединения концов. Количество клеток HindIIIG-1 с фрагментацией хромосом также уменьшалось со временем. Интересно, что количество клеток HindIIIG-1, содержащих фокусы ответа на повреждение ДНК, было выше, чем у клеток HindIIIG на 20-е сут после облучения, описанное нами ранее (Chitikova et al., 2014). В то же время количество фокусов γH2AX в клетках HindIIIG-1 на пассаже 10 было ниже, чем обнаруженное нами ранее содержание фокусов в клетках HindIIIG на 20-е сут после облучения (Chitikova et al., 2014), а количество фокусов 53BP1 осталось прежним.
Известно, что белок 53BP1 играет ключевую роль в выборе пути репарации ДНК и способствует негомологичному соединению концов, противодействуя гомологичной рекомбинации (Panier, Boulton, 2014). Таким образом, сохранение количества фокусов 53BP1 и длительная активация репарации путем негомологичного соединения концов в исследованных клетках могут быть взаимосвязаны. Наши данные говорят о возросшей генетической нестабильности в клетках HindIIIG-1 по сравнению с клетками Hi-ndIIIG, а также о достижении равновесия между возникновением повреждений ДНК и их репарацией и стабилизации генома в клетках HindIIIG-1 в процессе культивирования.
Персистенция повреждений ДНК может быть связана не только с нарушением репарации двуцепочечных разрывов, вызванных действием ионизирующего облучения, но также и с возникновением новых разрывов ДНК вследствие остановки вилок репликации (Mehta, Haber, 2014). Тогда как в облученных клетках HindIIIG могут сохраняться индуцированные облучением двойные разрывы ДНК, повреждения ДНК, возникшие из-за нарушения репликации, могут наблюдаться в клетках HindIIIG и HindIIIG-1 независимо от того, были ли они подвергнуты облучению.
Исследованные клетки экспрессируют аденовирусный белок E1A, способный связываться с Rb и тем самым способствовать E2F1-зависимой транскрипции и прогрессии клетки по клеточному циклу (Chellapan et al., 1991; Hiebert et al., 1992), что может вызывать репликативный стресс как в облученных, так и необлученных клетках. Нарушения репликации ДНК могут приводить к асинхронной конденсации хромосом, нарушению их сегрегации, а также фрагментации ДНК. Клетки элиминируют отстающие хромосомы, фрагменты ДНК и поврежденные хромосомы путем заключения их в микроядра (Thompson et al., 2011; Crasta et al., 2012), которые затем должны быть секретированы из клеток или деградированы с помощью аутофагии.
Известно, что при вхождении в митоз в клетке, содержащей микроядра, может происходить фрагментация хромосом (Crasta et al., 2012; Hatch, Hetzer 2015; Zhang et al., 2015). В настоящее время считается, что опосредованная микроядрами фрагментация хромосом является одним из основных механизмов хромотрипсиса (Zhang et al., 2015; Kneissig et al., 2019). Формирование микроядер, содержащих поврежденную ДНК, на что указывает наличие в них γH2AX, наблюдалось как в облученных клетках Hi-ndIIIG (Chitikova et al., 2014), так и в клетках Hin-dIIIG-1. Кроме того в этих клетках была обнаружена фрагментация хромосом. Несмотря на то, что нам не удалось секвенировать ДНК для подтверждения хромотрипсиса, мы, принимая во внимание фрагментацию хромосом, образование микроядер и активацию репарации ДНК путем негомологичного соединения концов, предполагаем, что подобный хромотрипсису механизм может играть роль в перестройках генома исследованных нами клеток, а также в выживании облученных клеток HindIIIG и формировании новой линии HindIIIG-1.
Ранее мы показали, что в облученных клетках HindIIIG наблюдается активация маркеров стволовых клеток (Chitikova et al., 2014). Факторы ответа на повреждение ДНК и репарации имеют важное значение в репрограммировании и получении индуцированных стволовых клеток (González et al., 2013). Кроме того, большое число делеций, транслокаций и инверсий, возникающих вследствие хромотрипсиса, может приводить к нарушению экспрессии генов, в том числе онкогенов, опухолевых супрессоров и факторов репрограммирования. Как и в опухолевых клетках, подобный хромотрипсису механизм в клетках HindIIIG и HindIIIG-1 может способствовать гетерогенности популяции, дающей возможность быстрой адаптации к стрессу и выживанию. Кроме того, устойчивость к апоптозу, обеспечиваемая экспрессией аденовирусного белка E1B с мол. массой 19 кДа, позволяет клеткам HindIIIG и H-indIIIG-1 выживать и осуществлять репарацию ДНК, несмотря на персистенцию повреждений ДНК и значительную фрагментацию хромосом.
Хромотрипсис наблюдается в различных типах опухолей (Stephens et al., 2011; Cortés-Ciriano et al., 2020). Он способствует прогрессии опухоли, приобретению устойчивости к терапии, а также метастазированию. Мы обнаружили, что в отличие от клеток HindIIIG, клетки HindIIIG-1 могли пролиферировать независимо от прикрепления к субстрату и мигрировать в поры мембраны покрытой Матригелем, что указывает на их способность к инвазии и может говорить о развитии метастатического потенциала. Кроме того, в клетках HindIIIG-1 отмечалась активация ядрышковых организаторов. Такое явление часто наблюдается в опухолевых клетках и коррелирует с повышенным биогенезом рибосом, необходимым для быстрого роста и развития опухоли (Pelletier et al., 2018).
В облученных клетках HindIIIG (Chitikova et al., 2014) и клетках HindIIIG-1 наблюдается активация аутофагии. Кроме киназы mTOR, к ключевым регуляторам аутофагии относятся такие факторы, как транскрипционный фактор p53 и киназа ATM (Feng et al., 2005; Alexander et al., 2010; Triparthi et al., 2013), участвующие в ответе на повреждение и ДНК репарации. Кроме того, транскрипционный фактор E2F1 может контролировать аутофагию на уровне транскрипции белков семейства Atg и LC3 (Polager et al., 2008). Аутофагия играет важную роль в ответе на повреждение ДНК и репарации, тем самым способствуя поддержанию целостности генома. Она участвует в деградации микроядер, селекции ДНК и деполиплоидизации клеток (Erenpreisa et al., 2011, 2012). Тогда как элиминация поврежденной ДНК и фрагментов хромосом способствует выживанию клетки, аутофагическая деградация всего ядра приводит к клеточной гибели. Аутофагия может способствовать селекции ДНК в одно- и многоядерных клетках или служить механизмом гибели в устойчивых к апоптозу клетках HindIIIG и HindIIIG-1, таким образом способствуя становлению линии HindIIIG-1.
Наши результаты показали, что линия HindIIIG-1, полученная в результате облучения и последующего длительного культивирования устойчивых к апоптозу клеток HindIIIG, характеризуется высокой нестабильностью генома и длительной активацией механизмов ответа на повреждение и репарации ДНК. Мы предполагаем участие подобного хромотрипсису механизма в становлении линии HindIIIG-1 основываясь на наблюдениях значительной фрагментации ДНК и долгосрочной активации репарации ДНК путем негомологичного соединения концов в облученных клетках HindIIIG (Chitikova et al., 2014) и в клетках HindIIIG-1. Клетки HindIIIG-1 приобрели такие свойства, как способность к пролиферации независимо от прикрепления к субстрату и инвазии, что может указывать на развитие метастатического потенциала. Аутофагия участвует в деградации поврежденной ДНК, фрагментов хромосом, микроядер и ядер клеток HindIIIG и HindIIIG-1. Она может служить механизмом селекции генетического материала и выживания клеток, тем самым способствуя становлению новой линии.
Список литературы
Ярцева Н.М., Шитикова Ж.В., Быкова Т.В., Зубова С.Г., Кочеткова Е.Ю., Поспелов В.А., Поспелова Т.В. 2020. Изменения кариотипа устойчивых к апоптозу клеток крысы линии HindIIIG при длительном культивировании после действия ионизирующего облучения. Цитология. Т. 62. № 12. С. 880. (Yartseva N.M., Chitikova Z.V., Bykova T.V., Zubova S.G., Kochetkova E.U, Pospelov V.A., Pospelova T.V. 2020. Alterations of Karyotype in Irradiated Apoptosis-Resistant HindIIIG Cells after Prolonged Cultivation. Tsitologya. V. 62. № 12. P. 880.)
Alexander A., Cai S.L., Kim J., Nanez A., Sahin M., MacLean K.H., Inoki K., Guan K.L., Shen J., Person M.D., Kusewitt D., Mills G.B., Kastan M.B., Walker C.L. 2010. ATM signals to TSC2 in the cytoplasm to regulate mTORC1 in response to ROS. Proc. Natl. Acad. Sci. USA. V. 107. P. 4153. https://doi.org/10.1073/pnas.0913860107
Chellappan S.P., Hiebert S., Mudryj M., Horowitz J.M., Nevins J.R. 1991. The E2F transcription factor is a cellular target for the RB protein. Cell. V. 65. P. 1053. https://doi.org/10.1016/0092-8674(91)90557-F
Chitikova Z.V., Gordeev S.A., Bykova T.V., Zubova S.G., Pospelov V.A., Pospelova T.V. 2014. Sustained activation of DNA damage response in irradiated apoptosis-resistant cells induces reversible senescence associated with mTOR downregulation and expression of stem cell markers. Cell Cycle. V. 13. P. 1424. https://doi.org/10.4161/cc.28402
Cortés-Ciriano I., Lee J.J., Xi R., Jain D., Jung Y., Yang L., Gordenin D., Klimczak L.J., Zhang C.-Z., Pellman D., PCWAG Structural Variation Working Group, Park P.J., and PCWAG Consortium. 2020. Comprehensive analysis of chromothripsis in 2.658 human cancers using whole-genome sequencing. Nat. Genet. V. 52. P. 331. https://doi.org/10.1038/s41588-019-0576-7
Crasta K., Ganem N.J., Dagher R., Lantermann A.B., Ivanova E.V., Pan Y., Nezi L., Protopopov A., Chowdhury D., Pellman D. 2012. DNA breaks and chromosome pulverization from errors in mitosis. Nature. V. 482. P. 53. https://doi.org/10.1038/nature10802
Erenpreisa J., Huna A., Salmina K., Jackson T.R.,Cragg M.S. 2012. Macroautophagy-aided elimination of chromatin: sorting of waste, sorting of fate? Autophagy. V. 8. P. 1877. https://doi.org/10.4161/auto.21610
Erenpreisa J., Salmina K., Huna A., Kosmacek E.A., Cragg M.S., Ianzini F., Anisimov A.P. 2011. Polyploid tumour cells elicit paradiploid progeny through depolyploidizing divisions and regulated autophagic degradation. Cell. Biol. Int. V. 35. P. 687. https://doi.org/10.1042/CBI20100762
Feng Z., Zhang H., Levine A.J., Jin S. 2005. The coordinate regulation of the p53 and mTOR pathways in cells. Proc. Natl. Acad. Sci. USA. V. 102. P. 8204. https://doi.org/. 0502857102https://doi.org/10.1073/pnas
González F., Georgieva D., Vanoli F., Shi Z.D., Stadtfeld M., Ludwig T., Jasin M., Huangfu D. 2013. Homologous recombination DNA repair genes play a critical role in reprogramming to a pluripotent state. Cell Rep. V. 3. P. 651. https://doi.org/10.1016/j.celrep.2013.02.005
Guan J.-L., Simon A.K., Prescott M., Menendez J.A., Liu F., Wang C., Wolvetang E., Vazquez-Martin A., Zhang J. 2013. Autophagy in stem cells. Autophagy. V. 9. P. 830. https://doi.org/10.4161/auto.24132
Hatch E.M., Hetzer M.W. 2015. Linking micronuclei to chromosome fragmentation. Cell. V. 161. P. 1502. https://doi.org/10.1016/j.cell.2015.06.005
Hiebert S.W., Chellappan S.P., Horowitz J.M., Nevins J.R. 1992. The interaction of RB with E2F coincides with an inhibition of the transcriptional activity of E2F. Genes Dev. V. 6. P. 177. https://doi.org/10.1101/gad.6.2.177
Howell W., Black D. A. 1980. Controller silver staining of nucleolus organizer regions with protective colloidal developer: a one-step method. Experientia. V. 36. P. 1014. https://doi.org/10.1007/BF01953855
Jones M.J.K., Jallepalli P.V. 2012. Chromothripsis: chromosomes in crisis. Dev. Cell. V. 23. P. 908. https://doi.org/10.1016/j.devcel.2012.10.010
Kneissig M., Keuper K., de Pagter M.S., van Roosmalen M.J., Martin J., Otto H, Passerini V., Campos Sparr A., Renkens I., Kropveld F., Vasudevan A., Sheltzer J.M., Kloosterman W.P., Storchova Z. 2019. Micronuclei-based model system reveals functional consequences of chromothripsis in human cells. eLife. 8: e50292. https://doi.org/10.7554/eLife.50292
Levine B., Yuan J. 2005. Autophagy in cell death: an innocent convict? J. Clin. Invest. V. 115. P. 2679. https://doi.org/10.1172/JCI26390
Mao Z., Bozzella M., Seluanov A., Gorbunova V. 2008. DNA repair by nonhomologous end joining and homologous recombination during cell cycle in human cells. Cell Cycle. V. 7. P. 2902. https://doi.org/10.4161/cc.7.18.6679
Mathew R., Kongara S., Beaudoin B., Karp C.M., Bray K., Degenhardt K., Chen G., Jin S., White E. 2007. Autophagy suppresses tumor progression by limiting chromosomal instability. Genes Dev. V. 21. P. 1367. http://www.genesdev.org/cgi/doi/ 10.1101/gad.1545107
Mehta A., Haber J.E. 2014. Sources of DNA double-strand breaks and models of recombinational DNA repair. Cold Spring Harb. Perspect. Biol. V. 6. P. a016428. https://doi.org/10.1101/cshperspect.a016428
Menendez J.A., Vellon L., Oliveras-Ferraros C., Cufí S, Vazquez-Martin A. 2011. mTOR-regulated senescence and autophagy during reprogramming of somatic cells to pluripotency: a roadmap from energy metabolism to stem cell renewal and aging. Cell Cycle. V. 10. P. 3658. https://doi.org/10.4161/cc.10.21.18128
Mijaljica D., Devenish R.J. 2013. Nucleophagy at a glance. J. Cell Sci. V. 126. P. 4325. https://doi.org/10.1242/jcs.133090
Mizushima N., Levine B. 2010. Autophagy in mammalian development and differentiation. Nat. Cell Biol. V. 12. P. 823. https://doi.org/10.1038/ncb0910-823
Negrini S., Gorgoulis V.G., Halazonetis T.D. 2010. Genomic instability – an evolving hallmark of cancer. Nat. Rev. Mol. Cell Biol. V. 11. P. 220. https://doi.org/10.1038/nrm2858
Ozkinay C., Mitelman F. 1979. A simple trypsin-Giemsa technique producing simultaneous G- and C-banding in human chromosomes. Hereditas. V. 90. P. 1. https://doi.org/10.1111/j.1601-5223.1979.tb01287.x
Panier S., Boulton S.J. 2014. Double-strand break repair: 53BP1 comes into focus. Nat. Rev. Mol. Cell Biol. V. 15. P. 7. https://doi.org/10.1038/nrm3719
Pelletier J., George Thomas G., Volarević S. 2018. Ribosome biogenesis in cancer: new players and therapeutic avenues. Nat. Rev. Cancer. V. 18. P. 51. https://doi.org/10.1038/nrc.2017.104
Polager S., Ofir M., Ginsberg D. 2008. E2F1 regulates autophagy and the transcription of autophagy genes. Oncogene. V. 27. P. 4860. https://doi.org/10.1038/onc.2008.117
Pospelova T.V., Chitikova Z.V., Pospelov V.A. 2013. An integrated approach for monitoring cell senescence. Methods Mol. Biol. V. 965. P. 383. https://doi.org/10.1007/978-1-62703-239-1_26
Rappold I., Iwabuchi K., Date T., Chen J. 2001. Tumor suppressor p53 binding protein 1 (53BP1) is involved in DNA damage-signaling pathways. J. Cell Biol. V. 153. P. 613. https://doi.org/10.1083/jcb.153.3.613
Rello-Varona S., Lissa D., Shen S., Niso-Santano M., Senovilla L., Mariño G., Vitale I., Jemaá M., Harper F., Pierron G., Castedo M., Kroemer G. 2012. Autophagic removal of micronuclei. Cell Cycle. V. 11. P. 170. https://doi.org/10.4161/cc.11.1.18564
Rogakou E.P., Pilch D.R., Orr A.H., Ivanova V.S., Bonner W.M. 1998. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J. Biol. Chem. V. 273. P. 5858. https://doi.org/10.1074/jbc.273.10.5858
Stephens P.J., Greenman C.D., Fu B., Yang F., Bignell G.R., Mudie L.J., Pleasance E.D., Lau K.W., Beare D., Stebbings L.A., McLaren S., Lin M.-L., McBride D.J., Varela I., Nik-Zainal S., Leroy C. et al. 2011. Massive genomic rearrangement acquired in a single catastrophic event during cancer development. Cell. V. 144. P. 24. https://doi.org/10.1016/j.cell.2010.11.055
Thompson S.L., Duane A. Compton D.A. 2011. Chromosome missegregation in human cells arises through specific types of kinetochore–microtubule attachment errors. Proc. Natl. Acad. Sci. USA. V. 108. P. 17974. https://doi.org/10.1073/pnas.1109720108
Tripathi D.N., Chowdhury R., Trudel L.J., Tee A.R., Slack R.S., Walker C.L., Wogan G.N. 2013. Reactive nitrogen species regulate autophagy through ATM-AMPK-TSC2-mediated suppression of mTORC1. Proc. Natl. Acad. Sci. USA. V. 110. P. E2950. https://doi.org/. 1307736110https://doi.org/10.1073/pnas
Vanzo R., Bartkova J., Merchut-Maya J.M., Hall A., Bouchal J., Dyrskjøt L., Frankel L.B., Gorgoulis V., Maya-Mendoza A., Jäättelä M., Bartek J. 2020. Autophagy role(s) in response to oncogenes and DNA replication stress. Cell Death Differ. V. 27. P. 1134. https://doi.org/10.1038/s41418-019-0403-9
Zhang C.-Z., Leibowitz M.L., Pellman D. 2013. Chromothripsis and beyond: rapid genome evolution from complex chromosomal rearrangements. Genes Dev. V. 27. P. 2513. https://doi.org/10.1101/gad.229559.113
Zhang C.-Z., Spektor A., Cornils H., Francis J.M., Jackson E.K., Liu S., Meyerson M., Pellman D. 2015. Chromothripsis from DNA damage in micronuclei. Nature. 522, 179–184. https://doi.org/10.1038/nature14493
Дополнительные материалы отсутствуют.


