Цитология, 2021, T. 63, № 3, стр. 300-306
Состояние эритроцитов в посттравматический период черепно-мозговой травмы у крыс при действии цитофлавина. Оценка методом лазерной интерференционной микроскопии
А. В. Дерюгина 1, А. В. Полозова 1, 2, *, М. Н. Иващенко 1, П. С. Игнатьев 3, В. Б. Метелин 4, 5
1 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
2 Приволжский исследовательский медицинский университет Минздрава РФ
603005 Нижний Новгород, Россия
3 Производственное объединение Уральский оптико-механический завод им. Э.С. Яламова
620100 Екатеринбург, Россия
4 Российский государственный университет им. А.Н. Косыгина
117997 Москва, Россия
5 Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
129110 Москва, Россия
* E-mail: shumilowanastya@gmail.com
Поступила в редакцию 02.02.2021
После доработки 06.03.2021
Принята к публикации 06.03.2021
Аннотация
В работе проведена комплексная фазовая микроморфометрия эритроцитов крыс при черепно-мозговой травме (ЧМТ) и действии цитофлавина (ЦФ) в посттравматическом периоде. У животных моделировали закрытую ЧМТ путем свободного падения груза на теменно-затылочную область черепа. Через 1 ч после нанесения травмы и затем в течение 10 сут крысам ежедневно внутрибрюшинно вводили ЦФ в дозе 0.2 мл/кг. Контрольным животным вводили изотонический раствор хлорида натрия в том же объеме. Анализ крови проводили через 1, 3, 7 и 12 сут после нанесения травмы. ЧМТ вызывала увеличение фазовой высоты и фазового диаметра, объема, площади и среднего диаметра эритроцитов на 1–7 сут относительно значений интактной группы, что сочеталось с эхиноцитарной и сфероэхиноцитарной трансформацией эритроцитов, а также смещением спектра длин волн фазовых портретов в сторону 650 нм. Влияние ЦФ на морфометрические показатели эритроцитов в посттравматическом периоде проявлялось в восстановлении фазовой высоты, фазового диаметра, площади, объема и периметра эритроцитов. Начиная с 3–7-х сут действия ЦФ наблюдали уменьшение количества эхиноцитов, сферичности клеток, длины волны фазовых портретов до 600 нм. Оценены возможности лазерной интерференционной микроскопии при неинвазивном исследовании эритроцитов при ЧМТ и действии ЦФ в посттравматическом периоде. Анализ интерференционных изображений эритроцитов свидетельствует о снижении окислительных процессов в клетках, восстановлении состояния гемоглобина, улучшении метаболизма эритроцитов при действии ЦФ в посттравматический период.
При черепно-мозговой травме (ЧМТ) повреждение головного мозга определяется степенью выключения тканевого кровотока в момент ишемии и длительностью самого ишемического периода (Царёв, 2018). Доставку кислорода тканям затрудняют нарушения микрореологических свойств крови. Ключевая роль в формировании микрореологического поведения крови принадлежит эритроцитам, нарушение формы и структуры мембран которых может приводить к снижению их деформируемости, нарушению газотранспортной функции, ухудшению реологических свойств крови (Ciccoli et.al., 2012). При этом использование препаратов, обладающих антигипоксическим действием, предполагает исследование их влияния на морфометрические показатели эритроцитов. Комбинированным антигипоксантом является цитофлавин (ЦФ) – комплексный цитопротектор, состоящий из двух метаболитов (янтарной кислоты и рибоксина) и двух коферментов витаминов (рибофлавинмононуклеотида (витамин В2) и никотинамида (витамин РР)). Установлено, что ЦФ улучшает окислительный метаболизм в условиях ишемии, препятствуя резкому снижению уровня АТФ в клетках любого типа (Джумагазиев и др., 2015).
Для оценки состояния живых клеток целесообразно использование неинвазивных методик, вносящих наименьшее количество повреждений и уменьшающих таким образом погрешность метода измерений. В качестве такого метода используется метод лазерной интерференционной микроскопии, способный создавать высококонтрастные изображения живых объектов без их модификации красителями (Василенко и др., 2018). Проведение комплексной фазовой микроморфометрии позволяет визуализировать модификацию клеток в режиме реального времени и исследовать динамику процессов, протекающих на мембране и примембранной областях клеток.
Цель настоящей работы заключалась в изучении влияние ЦФ на морфометрические показатели эритроцитов в посттравматическом периоде с использованием лазерной интерференционной микроскопии.
МАТЕРИАЛ И МЕТОДИКА
Животные. Работу проводили на 30 белых нелинейных красах-самках массой 180 ± 20 г в возрасте 14 нед. (из питомника г. Крюково). Животных содержали в индивидуальных боксах с естественной 12-часовой сменой света и темноты, при влажности воздуха 60% и температуре 22 ± 2°С, со свободным доступом к воде и пище. Содержание животных и проводимые с ними манипуляции осуществляли в соответствии с нормативными документами, представленными в руководстве “Guide for care and use of laboratory animals” и требованиями приказа Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н “Об утверждении Правил надлежащей лабораторной практики”.
Моделирование закрытой ЧМТ. Животным наносили ЧМТ путем свободного падения груза массой 100 г с высоты 80 см на теменно-затылочную область черепа. Падение груза направлялось при помощи цилиндрической трубы с внутренним диаметром 20 мм, которая была жестко закреплена на штативе двумя держателями и центрирована над головой крысы. Голова животного при этом была не зафиксирована. Травму наносили без анестезии на неповрежденный череп без предварительных манипуляций. Приложение такой механической энергии обеспечивает моделирование сотрясения головного мозга, очаговые повреждения, в том числе ушиб мозга, который сопровождается формированием эпидуральных и субдуральных гематом (Цымбалюк, Кочин, 2008). После нанесения травмы животных переносили в специальную пластиковую клетку и вели за ними наблюдение вплоть до восстановления нормальных поведенческих реакций. Летальность при падении груза составила 0–10%, а время рефлекторного выпрямления 2–4 мин. Это указывает на развитие легкой ЧМТ. Сразу после травмы у крыс наблюдали асфиксию, судороги, кровотечения и пр. Через 30–40 мин отмечали восстановление и возврат к нормальному режиму жизни и питания.
Через 1 ч после нанесения ЧМТ, а затем в течение 10 сут крысам ежедневно вводили внутрибрюшинно либо ЦФ (ООО “НТФФ "ПОЛИСАН”, Санкт-Петербург) в дозе 0.2 мл/кг (группа ЧМТ + ЦФ, n = 10), либо изотонический раствор хлористого натрия в том же объеме (группа ЧМТ, n = 10) для контроля действия ЦФ в посттравматическом периоде. Уровень физиологической нормы исследуемых показателей определяли у интактых (контрольных) животных (n = 10). Образцы крови брали из подъязычной вены в 1, 3, 7 и 12 сут после нанесения травмы.
Лазерная модуляционная интерференционная микроскопия. Для комплексной фазометрии эритроцитов использовали микроскоп МИМ-340 (Уральский оптико-механический завод им. Э.С. Яламова, Рос-сия), лазер с длиной волны 650 нм и объектив с увеличением 30× (NA = 0.65), разрешение по поверхности – до 15 нм, разрешение по вертикали – 0.1 нм, возможность контроля изделий с глубиной рельефа – до 600 нм. Для захвата изображений применяли CCD-видеокамеру VS-415U (НПК “Видеоскан”, Россия) с разрешением 782 × 582 пикселей. Регистрация морфологии нативных клеток без предварительной фиксации позволяла визуализировать модификацию клеток в режиме реального времени, изучать их морфологию и динамику внутриклеточных процессов.
В ходе работы биологические объекты размещали на зеркальной подложке, от которой отражается проходящий через клетку свет. В результате фиксируется двойной сдвиг фазы луча когерентного источника света в каждой точке объекта, а с помощью дополнительной волны от того же источника формируется интерференционное изображение клетки. Для исследования получали изображения 10 участков с монослойным расположением клеток в интерференционном канале и отраженном свете в каждой пробе. Состояние эритроцитов человека оценивали, регистрируя среднюю величину оптической разности хода и площадь фазового изображения эритроцита. Для получения достоверного результата показатели рассчитывали, используя не менее 100 клеток от каждого образца.
Полученные данные были обработаны с помощью пакетов прикладных программ BIOSTAT (Analystsoft, США) и Microsoft Excel (Microsoft, США) с использованием методов одномерной статистики. Результаты представлены в виде средних арифметических значений и их стандартной ошибки. Достоверность различий средних определяли по t-критерию Стьюдента. Различия считали достоверными при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По данным анализа фазово-интерференционной микроскопии у животных после ЧМТ на 1–7 сут статистически значимо были увеличены значения фазовой высоты и фазового диаметра, объема, площади и периметра эритроцитов относительно значений этих же показателей у интактной группы животных (табл. 1). Наиболее выраженные изменения значений фазовой высоты и площади эритроцитов в группе ЧМТ регистрировали в 1-е сут посттравматического периода, которые составили 14 и 13% от значений интактной группы соответственно. На 3-и сут максимально увеличивались фазовый диаметр (на 10%), объем (на 34%) и периметр клеток (на 8%) в группе ЧМТ относительно значений интактной группы.
Таблица 1.
Влияние цитофлавина (ЦФ, 0.2 мл/кг ежесуточно, внутрибрюшинно) на морфометрические показатели эритроцитов при моделировании ЧМТ у крыс
| Показатель | Интактные | Группа | Время после ЧМТ, сут | |||
|---|---|---|---|---|---|---|
| 1 | 3 | 7 | 12 | |||
| Фазовый диаметр, мкм |
6.28 ± 0.07 | ЧМТ | 6.65 ± 0.05а | 6.92 ± 0.07а | 6.52 ± 0.08а | 6.31 ± 0.08 |
| ЧМТ + ЦФ | 6.69 ± 0.06а | 6.54 ± 0.07а | 6.24 ± 0.08 | 6.02 ± 0.08а | ||
| Площадь, мкм2 | 2.88 ± 0.06 | ЧМТ | 3.26 ± 0.08а | 3.16 ± 0.12а | 3.14 ± 0.10а | 2.93 ± 0.10 |
| ЧМТ + ЦФ | 3.29 ± 0.03 а | 3.19 ± 0.09а | 3.39 ± 0.13а.б | 2.92 ± 0.09 | ||
| Объем, мкм3 | 4.03 ± 0.11 | ЧМТ | 4.92 ± 0.12а | 5.41 ± 0.11а | 4.66 ± 0.12а | 4.22 ± 0.14 |
| ЧМТ + ЦФ | 4.62 ± 0.14а. б | 4.34 ± 0.18 | 4.23 ± 0.21 | 3.92 ± 0.17 | ||
| Периметр, мкм | 21.97 ± 0.31 | ЧМТ | 21.56 ± 0.36 | 23.82 ± 0.39а | 21.84 ± 0.53 | 20.98 ± 0.49а |
| ЧМТ + ЦФ | 22.64 ± 0.32 | 21.36 ± 0.4б | 22.32 ± 0.51 | 20.07 ± 0.45а. б | ||
| Фазовая высота, мкм | 8.83 ± 0.16 | ЧМТ | 10.13 ± 0.1а | 9.56 ± 0.02а | 9.63 ± 1.19а | 9.43 ± 0.12а |
| ЧМТ + ЦФ | 9.68 ± 0.13а. б | 9.28 ± 0.15а | 8.87 ± 0.14б | 9.62 ± 0.16б | ||
При действии ЦФ в постравматический период у крыс (в группе ЧМТ + ЦФ) фазовый объем и периметр эритроцитов уменьшились соответственно на 20 и 10.3% по сравнению с показателями в группе ЧМТ на 3-и сут. При этом фазовый диаметр эритроцитов через 3 сут уменьшался на 5.7% относительно группы ЧМТ, а через 7 сут восстановился до показателей интактной группы. Начиная с 7-х сут, в группе ЧМТ + ЦФ регистрировали снижение фазовой высоты и объема клеток соответственно на 6 и 8.65% и увеличение фазовой площади на 4% по сравнению с этими параметрами в 1-е сут после травмы.
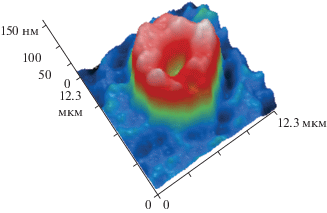
При сравнении фазового портрета эритроцитов в группах ЧМТ и ЧМТ + ЦФ были выявлены изменения топографии и рельефа поверхности мембраны эритроцитов по сравнению с интактной (контрольной) группой. Фазовый портрет интактного эритроцита показан на рис. 1. У крыс с ЧМТ (в отсутствие ЦФ) диаметр клеток и толщина в области краев уменьшались, а размер центральной зоны увеличивался, имелась неравномерность распределения уровня гемоглобина в примембранных слоях. К 1 сут преобладали сфероэхиноцитарные формы (рис. 2а), тогда как через 3 и 7 сут на поверхности клеток отмечали появление большого количества шипов и спикул (рис. 2б, в соответственно), которые сохранялись у клеток к 12-м сут посттравматического периода (рис. 2г). Наблюдали значительное количество эхиноцитов и сфероэхиноцитов. Регистрировали смещение спектра длин волн фазовых портретов в сторону 650 нм.
Рис. 2.
Фазовые портреты нефиксированных эритроцитов крыс после черепно-мозговой травмы (ЧМТ) на 1-е, 3-и, 7-е и 12‑е сут посттравматического периода.
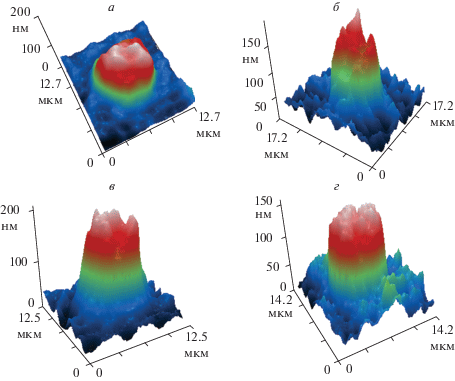
Фазовые портреты эритроцитов при действии ЦФ в посттравматический период на начальном этапе характеризовались появлением значительного количества эхиноцитов (рис. 3а). Начиная с 3–7 сут, наблюдали восстановление формы эритроцитов, уменьшение количества эхиноцитов и сферичности клеток в экспериментальной группе ЧМТ + ЦФ (рис. 3б, в). При этом дискоциты имели различную степень двояковогнутости с сохранением шипов (рис. 3в). Длины волн фазовых портретов находились в области 600 нм. К 12-м сут посттравматического периода в группе ЧМТ + ЦФ фазовые портреты эритроцитов (рис. 3г) были сопоставимы с группой интактных (контрольных) животных (рис. 1).
Рис. 3.
Фазовые портреты нефиксированных эритроцитов крыс после ЧМТ на 1-е, 3-и, 7-е и 12-е сут посттравматического периода в присутствии цитофлавина (группа ЧМТ + ЦФ).

Полученные результаты свидетельствуют о том, что при ЧМТ увеличиваются морфометрические показатели клеток, что сочетается с увеличением сфероэхиноцитов. Показано, что чем интенсивнее развивается патологический процесс, тем сильнее проявляется стресс, что обусловливает рост патологически измененных эритроцитов с сфероэхиноцитарной трансформацией (Дерюгина и др., 2019). Очевидно, что выявленные эффекты при ЧМТ определяются изменением их метаболических показателей. Смещение спектра длин волн фазовых портретов свидетельствует об усилении окислительного метаболизма и снижении энергетических показателей клеток (Дерюгина и др., 2018). Интенсификация процессов перекисного окисления липидов сопряжена с увеличением количества гемина и опосредует образование спикул и формирование эхиноцитов (Сергунова и др., 2016; Дерюгина и др., 2021). При этом увеличение фазовой высоты может быть обусловлено уменьшением в клетках воды (Загубиженко и др., 2011), что оказывает негативное воздействие на протекание биохимических процессов в эритроцитах. Кроме того, показано, что в ответ на снижение оксигенации компенсаторно увеличивается объем эритроцитов. Однако отдача кислорода в ткани при этом замедляется (Mohanty et al., 2014). Следует отметить, что при ухудшении морфологических показателей эритроцитов не только снижается скорость доставки кислорода к тканям в системе эритроцит–капилляр, но и уменьшается количество функционирующих капилляров (Hogan et al., 2019). Эритроциты с измененной структурой и морфологией способствуют закупорке сосудов (Kviatkovsky et al., 2017).
Внутрибрюшинное введение ЦФ способствовало восстановлению фазовых портретов эритроцитов, что, исходя из вышесказанного, свидетельствует о снижении окислительных процессов, восстановлении состояния гемоглобина, улучшении метаболизма эритроцитов. Обсуждая выявленные эффекты сукцинатсодержащего препарата ЦФ, следует отметить, что антигипоксическое действие сукцината пролонгируется его влиянием на стабильность и активность чувствительного к гипоксии фактора HIF-1α. Этот фактор является кислород-чувствительным протеиновым комплексом и запускает экспрессию целого ряда пептидов, в том числе эритропоэтина (EPO), белков-транспортeров глюкозы (GLUT 1, 3), ферментов гликолиза (Liu et al., 2020). Кроме того, выявлено наличие сукцинатных рецепторов на эритроидных клетках-предшественниках, действие которых сопряжено с G-белками и определяет повышение концентрации внутриклеточного Са2+ (Grimolizzi, 2018). По всей видимости, введение ЦФ у крыс в послеоперационном периоде стимулирует эритропоэз и метаболизм клеток, что отражается на динамике фазово-интерференционных показателей эритроцитов.
Таким образом, полученные интерференционные изображения эритроцитов с детализацией морфологических параметров позволяют использовать их для качественной оценки морфофункциональной активности клеток и свидетельствуют, что при использовании ЦФ происходит восстановление состояния гемоглобина, энергетического и окислительного метаболизма эритроцитов. На основании проведенной работы можно сделать следующие выводы.
1) Применение лазерной интерференционной микроскопии позволяет выявить существенные изменения фазовых изображений эритроцитов при ЧМТ.
2) Влияние ЦФ на морфометрические показатели эритроцитов в посттравматическом периоде проявляется в восстановлении фазовой высоты, фазового диаметра, площади, объема, периметра эритроцитов, начиная с 3–7 сут после травмы, что сочетается с уменьшением количества эхиноцитов и длин волн фазовых портретов клеток.
3) Анализ интерференционных изображений эритроцитов позволяет провести качественную оценку функциональной активности клеток, свидетельствуя о ее снижении при ЧМТ и восстановлении при действии ЦФ.
Список литературы
Василенко И.А., Метелин В.Б., Игнатьев П.С., Кардашова З.З., Лифенко Р.А. 2018. Диалог с клеткой: диагностическая real-time технология на основе лазерной интерферометрии. Альманах клинической медицины Т. 46. № 8. С. 748. (Vasilenko I.A., Metelin V.B., Ignat’ev P.S., Kardashova Z.Z., Lifenko R.A. 2018. A dialogue with the cell: diagnostic real-time technology based on laser interferometry. Almanac Clinical Med. V. 46. № 8. P. 748.)
Дерюгина А.В., Иващенко М.Н., Игнатьев П.С., Белов А.А., Петров В.А. 2021. Диагностические возможности анализа эритроцитов методом лазерной интерференционной микроскопии. Клиническая лабораторная диагностика. Т. 66. № 1. С. 22. (Deryugina A.V., Ivashchenko M.N., Ignatiev P.S., Belov A.A., Petrov V.A. 2021. Diagnostics possibilities of erythrocytes analysis by the method of laser interference microscopy. Russ. Clinical Laboratory Diagnostics. V. 66. № 1. P. 22.)
Дерюгина А.В., Иващенко М.Н., Игнатьев П.С., Лодяной М.С., Самоделкин А.Г. 2019. Изменение фазового портрета и электрофоретической подвижности эритроцитов при различных видах заболеваний. Современные технологии в медицине. Т. 11. № 2. С. 63. (Deryugina A.V., Ivashchenko M.N., Ignatiev P.S., Lodyanoy M.S., Samodelkin A.G. 2019. Alterations in the phase portrait and electrophoretic mobility of erythrocytes in various diseases. Modern Technol. Med. V. 11. № 2. P. 63.)
Дерюгина А.В., Иващенко М.Н., Игнатьев П.С., Таламанова М.Н., Самоделкин А.Г. 2018. Возможности интерференционной микроскопии в изучении прижизненного состояния эритроцитов при воздействии на них низкоинтенсивным лазером для коррекции стресса. Современные технологии в медицине. Т. 10. № 4. С. 78. (Deryugina A.V., Ivashchenko M.N., Ignatiev P.S., Talamanova M.N., Samodelkin A.G. 2018. The capabilities of interference microscopy in studying the in vitro state of erythrocytes exposed to low-intensity laser radiation for stress correction. Modern Technol. Med. V. 10. № 4. P. 78.)
Джумагазиев А.А., Рахимова Л.Р. 2015. Применение метаболических препаратов для реабилитации новорожденных с церебральной ишемией. Доктор. Ру. Т. 106–107. № 5–6. С. 63. (Dzhumagaziev A.A., Rakhimova L.R. 2015. Use of Metabolic Agents in Rehabilitation of Newborns with Cerebral Ischemia. Doctor. Ru. V. 106–107. № 5–6. P. 63.)
Загубиженко М.В., Юсипович А.И., Пирутин С. К., Минаев В.Л., Кудряшов Ю.Б. 2011. Использование метода лазерной интерференционной микроскопии для исследования состояния перитонеальных макрофагов мыши, облученных ультрафиолетовым светом. Радиационная биология. Радиоэкология. Т. 51. № 6. С. 715. (Zagubizhenko M.V., Yusipovich A.I., Pirutin S.K., Minaev V.L., Kudryashov Yu.B. 2011. Using the method of laser interference microscopy to study the state of mouse peritoneal macrophages irradiated with ultraviolet light. Radiat. Biol. Radioecol. V. 51. № 6. P. 715.)
Сергунова В.А., Черняев А.П., Козлов А.П., Близнюк У.А., Борщеговская П.Ю., Козлова Е.К., Черныш А.М. 2016. Наноструктура мембран эритроцитов при интоксикации крови. Исследование с помощью атомной силовой микроскопии. Альманах клинической медицины. Т. 44. № 2. С. 234. (Sergunova V.A., Chernyaev A.P., Kozlov A.P., Bliznyuk U.A., Borshchegovskaya P.Yu., Kozlova E.K., Chernysh A.M. 2016. The nanostructure of erythrocyte membranes under blood intoxication: an atomic force microscopy study. Almanac Clinical Med. V. 44. № 2. P. 234.)
Царёв А.В. 2018. Cостояние гемодинамики при проведении терапевтической гипотермии в комплексе интенсивной терапии тяжелой черепно-мозговой травмы. Вестник проблем биологии и медицины. Т. 142. № 1. С. 213. (Tsarev A.V. 2018. The state of hemodynamics in the carrying out therapeutic hypothermia in the of intensive care of severy trauma brain injury. Bulletin of Problems, Boil. Med. V. 142. P. 213.)
Цымбалюк В.И., Кочин О.В. 2008. Экспериментальное моделирование черепно-мозговой травмы. Украинский нейрохирургический журн. № 2. С. 10–12. (Tsymbalyuk V.I., Kochin O.V. 2008. Eksperimental’noe modelirovanie cherepno-mozgovoj travmy. Ukrainskij Nejrokhirurgicheskij J. № 2. P. 10.)
Ciccoli L., De Felice C., Paccagnini E. 2012. Morphological changes and oxidative damage in Rett Syndrome erythrocytes. Biochim. Biophys. Acta V. 1820. P. 511.
Grimolizzi F., Arranz L. 2018. Multiple faces of succinate beyond metabolism in blood. Haematologica. V. 103. P. 1586.
Hogan B., Shen Z., Zhang H, Misbah Ch., Barakat Al. 2019. Shear stress in the microvasculature: influence of red blood cell morphology and endothelial wall undulation. Biomech. Model Mechanobiol. V. 18. P. 1095.
Kviatkovsky I., Zeidan A, Yeheskely-Hayon D., Shabad E.L., Dann E.J., Yelin D. 2017. Measuring sickle cell morphology during blood flow. Biomed. Opt. Express. V. 8. P. 1996.
Liu Z., Wu Z., Fan Y., Fang Y. 2020. An overview of biological research on hypoxia-inducible factors (HIFs). Endokrynol. Pol. V. 71. P. 432.
Mohanty J.G., Nagababu E., Rifkind J.M. 2014. Red blood cell oxidative stress impairs oxygen delivery and induces red blood cell aging. Front. Physiol. V. 84. https://doi.org/10.3389/fphys.2014.00084
Дополнительные материалы отсутствуют.