Цитология, 2021, T. 63, № 3, стр. 292-299
Локальный механозависимый вход кальция контролирует активность кальций-зависимых калиевых каналов высокой и низкой проводимости в клетках лимфомы человека
В. Ю. Васильева 1, В. И. Чубинский-Надеждин 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: vchubinskiy@gmail.com
Поступила в редакцию 20.02.2021
После доработки 03.03.2021
Принята к публикации 05.03.2021
Аннотация
Лимфома Беркитта является агрессивной и быстрорастущей формой не-Ходжкинской лимфомы, характеризующейся самым высоким инвазивным потенциалом среди всех известных типов лимфом. Ионы кальция являются одними из основных внутриклеточных сигнальных мессенджеров, контролирующих процесс диссеминации раковых клеток в организме. Лимфома Беркитта является распространенной клеточной моделью для исследований, направленных на понимание патофизиологических особенностей и механизмов лечения лимфом, однако практически ничего неизвестно о физиологических путях, обеспечивающих поступление кальция из внеклеточной среды в цитоплазму этих клеток. В настоящей работе впервые были проведены электрофизиологические исследования нативных кальций-проницаемых ионных каналов, участвующих в клеточном ответе на механическую стимуляцию клеток лимфомы Беркитта линии Raji. Регистрация ионных токов в конфигурации cell-attached позволила обнаружить механочувствительные кальций-проницаемые каналы (SAC-каналы), активирующиеся в ответ на растяжение участка клеточной мембраны. При анализе записей токов через одиночные каналы выявлено потенциальное участие SAC-каналов в транспорте ионов кальция в клетках Raji. Мы показали, что локальный вход ионов кальция через каналы SAC контролирует активность кальций-зависимых калиевых каналов двух типов – ВК и SK, не обладающих собственной механочувствительностью. Полученные результаты впервые демонстрируют участие механоуправляемых каналов SAC в формировании физиологически значимых путей транспорта кальция, регулирующих активность кальций-зависимых молекул в клетках лимфомы Беркитта.
Лимфома Беркитта (Burkitt’s Lymphoma) – это агрессивная и быстрорастущая не-Ходжкинская B-клеточная лимфома. Встречаемость лимфомы Беркитта составляет примерно 1–5% от всех неходжкинских лимфом, но при этом диагностируется примерно в 30% случаев детских лимфом в США (Allen et al., 2015). Для лимфомы Беркитта характерен повышенный уровень пролиферативной активности и самый высокий инвазивный потенциал среди всех лимфом (Xiong et al., 2012). Известно, что ионы кальция являются одними из основных внутриклеточных сигнальных мессенджеров, которые контролируют инвазию, миграцию и метастазирование раковых клеток (Iamshanova et al., 2017). В то же время физиологические пути, которые могут обеспечивать регулируемое поступление кальция в цитоплазму клеток лимфомы, в настоящее время практически не изучены, несмотря на очевидную важность данной проблемы для понимания особенностей малигнизации лимфоидных клеток.
Поступление кальция в цитоплазму из внеклеточной среды опосредуется катионными кальций-проницаемыми каналами плазматической мембраны, как высокоселективными по отношению к кальцию (например, семейством ионных каналов STIM/Orai и кальциевыми потенциал-зависимыми каналами Cav), так и неселективными (ионными каналами семейства TRP, Piezo).
В наших работах было выявлено, что механочувствительные кальций-проницаемые ионные каналы, которые активируются при растяжении мембраны (stretch-activated channels или каналы SAC), обеспечивают эффективный путь для высоколокализованного поступления ионов кальция в цитоплазму клеток различного происхождения, включая мезенхимные стволовые клетки человека (Chubinskiy-Nadezhdin et al., 2017), нормальные и трансформированные фибробласты мыши (Chubinskiy-Nadezhdin et al., 2014, 2018, 2020) и клетки миелоидной лейкемии человека (Chubinskiy-Nadezhdin et al., 2019a).
Задача настоящей работы заключалась в электрофизиологическом исследовании ионных каналов, участвующих в клеточном ответе на механическую стимуляцию клеток лимфомы Беркитта линии Raji. Мы применили апробированный ранее подход для проверки предположений о присутствии механоуправляемых SAC-каналов и определения их потенциального участия в транспорте ионов кальция в клетках лимфомы Беркитта. В этой работе нами впервые показана и проанализирована механозависимая активация ионных токов в мембране культивируемых клеток лимфомы Беркитта линии Raji.
Результаты демонстрируют, что SAC-опосредованное высоколокализованное поступление кальция стимулирует активность различных типов кальций-зависимых калиевых каналов (КСа; высокой и низкой проводимости, BK и SK).
МАТЕРИАЛ И МЕТОДИКА
Клетки. Культивируемая клеточная линия лимфомы Беркитта Raji была получена из Российской коллекции клеточных культур Института цитологии РАН (Санкт-Петербург). Клетки культивировали на среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки для суспензионных клеточных культур (Sus-Biol, Биолот, Россия) и 80 мкг/мл гентамицина при 37°С и 5% CO2. Клетки пересевали 3 раза в неделю в соотношении 1 : 3. За 1 ч до экспериментов клетки высевали на покровные стекла (4 × 4 мм), предварительно покрытые поли-DL-лизином (Sigma-Aldrich, США).
Метод локальной фиксации потенциала. Установка для регистрации ионных токов состоит из операционного усилителя Axon 200B (Molecular Devices, США) c регистрирующей головкой Axon CV203BU (Molecular Devices, США), аналогово-цифрового преобразователя Digidata 1550A (Molecular Devices, США) и персонального компьютера под управлением ОС Windows 7 (Microsoft, США). Управление экспериментом, регистрацию и запись данных осуществляли с помощью специализированного пакета программного обеспечения pClamp 10.7 (Molecular Devices, США). При регистрации ионных токов частота дискретизации сигнала составляла 10 кГц, фильтр нижних частот – 0.3 кГц. Стекла с клетками помещали в экспериментальную камеру, заполненную стандартным наружным раствором (состав см. ниже). Оптические наблюдения осуществляли с помощью инвертированного микроскопа с дифференциальным контрастом по Номарскому (объектив PlanApochromat 16×/0.25, Carl Zeiss, Германия, окуляр 16×).
Стеклянные микропипетки изготавливали из боросиликатных заготовок со стандартной толщиной капилляра (внешний/внутренний диаметр капилляра 1.5/0.86 мм, кат. № BF-150-86-10, Molecular Devices, США) на горизонтальной автоматизированной микрокузнице Флеминга−Брауна (Flaming/Brown Puller, модель P-97, Sutter Instruments, США) и заполняли стандартным наружным раствором (состав см. ниже), контактирующим с внеклеточной стороной участка мембраны. Электрическое сопротивление пипеток составляло 5–8 МОм. Стеклянную микропипетку подводили к клетке с помощью микроманипулятора, касание микропипеткой клеточной поверхности наблюдали в микроскоп. Для формирования сверхплотного гигаомного контакта с плазматической мембраной (Giga-seal) через стеклянную микропипетку подавали и запасали в системе “отрицательное” давление (suction, около 70–80 мм. рт. ст.). При подаче отрицательного давления наблюдали быстрое увеличение электрического сопротивления (R) контакта между микропипеткой и плазматической мембраной клетки. При достижении значений R > 200 МОм давление в системе сбрасывали, что приводило к дальнейшему повышению R до значений 3–5 ГОм и стабилизации гигаомного контакта, после чего приступали к регистрации ионных токов. Все эксперименты проводили при комнатной температуре (22–23°С).
Растворы. В электрофизиологических экспериментах стандартный наружный раствор в регистрирующей микропипетке содержал (в мМ): 145 NaCl, 2 СаCl2, 1 MgCl2, 10 HEPES/TrisOH. В режиме отведения токов cell-attached раствор в камере был аналогичен стандартному наружному раствору с эквивалентной заменой ионов Na+ на K+ для установления потенциала покоя мембраны клетки близким к нулю. Величину pH всех растворов поддерживали на уровне 7.2–7.3.
Регистрация ионных токов и анализ данных. После образования гигаомного контакта в условиях отведения токов от участка плазматической мембраны неповрежденной клетки (вариант cell-attached, «калиевый» наружный раствор) в начале эксперимента в течение 1–2 мин регистрировали фоновую активность ионных каналов в контрольных условиях при различных уровнях поддерживаемого трансмембранного потенциала в диапазоне от –70 до 30 мВ (непрерывная регистрация с ручной установкой значения потенциала, протокол gap-free). Далее эксперименты проводили по стандартному протоколу, состоящему из следующих последовательных этапов:
1) установка трансмембранного потенциала (Е) на заданный уровень;
2) регистрация фоновой активности каналов при заданном значении Е;
3) подача механического стимула (отрицательного давления) и регистрация ответа;
4) снятие давления, регистрация активности после прекращения стимуляции;
5) повторение этапов 1, 2 и др.
Использовали широко распространeнный способ механической стимуляции участка плазматической мембраны нативных клеток, который состоял в натяжении (деформации) мембраны посредством снижения гидростатического давления Р (ΔP < 0, suction) или его повышения (ΔP > 0, pressure) в регистрирующей пипетке. Упрощенная схема активации механозависимых ионных токов в ответ на растяжение плазматической мембраны представлена в наших ранних публикациях (например: Chubinskiy-Nadezhdin et al., 2018). Контроль и регистрацию уровня стимула, необходимого для активации каналов, осуществляли по манометру.
Обработку и анализ записей токов проводили в программном обеспечении Clampfit 10.7. Для фильтрации записей использовали фильтр Гаусса нижних частот с частотой среза 170 Гц (–3 dB cut off frequency); кроме того, записи дополнительно фильтровали от электрических помех с опорной частотой 50 Гц (частота переменного тока в электрической сети). Из записей токов при различных уровнях мембранного потенциала получали характеристики одиночных каналов и идентифицировали их по проводимости и селективности. Амплитуды токов рассчитывали из амплитудных гистограмм, описанных функцией Гаусса, или измеряли вручную с помощью программы Clampfit 10.7. Для проверки корректности значений определяемых амплитуд в некоторых случаях использовали опцию “Single-channel search”, встроенную в программное обеспечение.
РЕЗУЛЬТАТЫ
Механочувствительные ионные каналы в клетках лимфомы Беркитта линии Raji. В наших предыдущих исследованиях была описана активность механочувствительных SAC-каналов в различных клеточных типах, включая трансформированные клетки крови. Нами были разработаны и апробированы протоколы для регистрации и анализа одиночных механозависимых ионных токов, которые мы и использовали в настоящей работе для проверки предположений о функциональной активности SAC-каналов в клетках лимфомы Беркитта линии Raji. Действительно, подача механического стимула (отрицательного или положительного давления) приводила к активации механочувствительных каналов в 30 экспериментах (из 49 стабильных патчей, что составляет около 60%) при отведении от участка плазматической мембраны нативных клеток (конфигурация cell-attached). При этом в остальных 19 экспериментах мы не наблюдали активации механозависимых токов, и фоновая активность каких-либо других ионных каналов была крайне незначительна или совсем отсутствовала.
На рис. 1а представлена запись тока, демонстрирующая активность SAC-каналов в плазматической мембране клеток лимфомы при различных уровнях поддерживаемого потенциала. Амплитудные гистограммы, соответствующие представленным записям токов, приведены на рис. 1б. Вольтамперная характеристика зарегистрированных SAC-каналов, полученная на основании измеренных значений амплитуд в диапазоне от –20 до –70 мВ, аппроксимирована линейной зависимостью; унитарная проводимость составляет 23.7 пСм (рис. 1в). Потенциал реверсии близок к нулю, что означает отсутствие натрий-калиевой избирательности и является характерной особенностью SAC-каналов в клетках млекопитающих. Активация SAC-каналов развивалась без видимой задержки, и после снятия стимула уровень активности каналов возвращался к фоновому значению, близкому к нулю (рис. 1а). На рис. 1 приведен эксперимент, в котором регистрировали активность одного SAC-канала в участке мембраны нативной клетки. В большинстве случаев наблюдали несколько кратных уровней тока, отражающих одновременные открывания пор нескольких независимых канальных молекул (см. рис. 2, 3).
Рис. 1.
Активация механочувствительных SAC-каналов в плазматической мембране клеток лимфомы Беркитта линии Raji. а – Репрезентативные записи токов I (конфигурация cell-attached), демонстрирующие активацию SAC-каналов в ответ на приложение механического стимула (отрицательного давления, ΔP < 0, около 40 мм рт. ст.). Значения поддерживаемого мембранного потенциала указаны над записями токов. б – Амплитудные гистограммы, построенные по представленным записям токов; расстояние между пиками соответствует амплитуде одиночного открывания канала при соответствующем мембранном потенциале. в – Вольтамперная характеристика SAC-каналов, соответствует унитарной проводимости 23.7 пСм. Здесь и на рис. 2, 3: з – закрытое состояние каналов (уровень нулевого тока); открывание SAC-каналов (входящие токи) отмечено нижней штриховой линией.
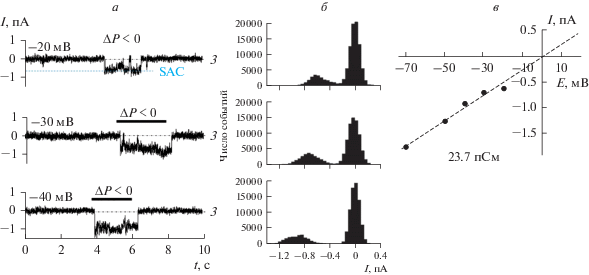
Рис. 2.
Активация кальций-зависимых калиевых каналов (КСа) различной проводимости, вызванная высоколокализованным входом ионов Са2+ через SAC-каналы. Показаны результаты двух независимых репрезентативных экспериментов. Поддерживаемый мембранный потенциал –20 мВ. а – Функциональное сопряжение кальций-проницаемых SAC-каналов и каналов КСа большой проводимости (ВК). б – Сопряженная активация кальций-проницаемых каналов SAC и КСа малой проводимости (SK). Здесь и на рис 3. открывания BK- и SK-каналов обозначены красной и зеленой штриховыми линиями соответственно. Предполагаемые модели сопряжения между SAC- и KCa-каналами представлены справа от записей токов. [Ca2+]i – внутриклеточная концентрация Ca2+.

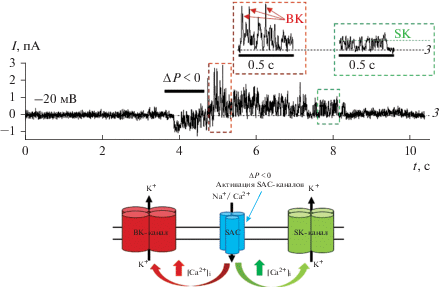
Рис. 3.
Сопряженная активация кальций-проводящих SAC-каналов c калиевыми каналами BK и SK в одном мембранном патче. Поддерживаемый потенциал –20 мВ. Активность BK- и SK-каналов показана в расширенном масштабе времени на врезках вверху. Схема регуляции активности каналов ВК и SК локальным входом ионов кальция через механоуправляемые SAC-каналы показана под записью токов.
Сопряженная механозависимая активация каналов SAC и KCa в клетках лимфомы Беркитта линии Raji. Ранее нами был продемонстрирован феномен кальций-зависимого функционального сопряжения между каналами SAC и KCa в различных типах клеток (см. вводную часть). Возник вопрос о том, может ли присутствовать феномен сопряженной активации каналов SAC и KCa в клетках лимфомы Беркитта линии Raji. Это предположение опирается, прежде всего, на данные мРНК-скрининга на микрочипах, представленного в транскриптомной базе данных: так, в клетках Raji наблюдаются высокие уровни экспрессии мРНК некоторых типов KCa-каналов (например, KCa2.3, ген KCNN3; Wu et al., 2016).
Результаты наших электрофизиологических экспериментов по регистрации одиночных ионных токов позволили документировать феномен сопряженной активации в клетках лимфомы Беркитта линии Raji (рис. 2 и 3). В результате проведенного анализа механозависимых токов в 18 экспериментах (из 30 стабильных патчей с SAC-каналами) была выявлена сопряженная активация колокализованных Са2+-транспортирующих SAC-каналов и Са2+-управляемых KCa-каналов. Важно отметить, что в клетках Raji мы наблюдали сопряженную активацию SAC-каналов и KCa-каналов различных типов, значительно различающихся по значениям амплитуд открываний одиночных каналов и, соответственно, по унитарной проводимости. Так, на основании амплитуд мы можем четко разделить наблюдаемые KCa-каналы на два типа: калиевые каналы высокой проводимости (BK, рис. 2а) и калиевые каналы низкой проводимости (SK, рис. 2б). Близкие значения амплитуд и проводимости для BK-каналов мы регистрировали ранее в стволовых клетках эндометрия человека (Chubinskiy-Nadezhdin et al., 2017, 2019b), а каналы SK, имеющие сходные характеристики, были описаны нами в клетках миелоидной лейкемии человека линии К562 (Chubinskiy-Nadezhdin et al., 2019a) и фибробластах мыши (клеточные линии BALB/3Т3 и 3T3B-SV40; Chubinskiy-Nadezhdin et al., 2014, 2018).
Сопряженную активацию каналов SAC и SK наблюдали в 7 экспериментах, а сопряжение между SAC- и BK-каналами наблюдали в 6 экспериментах из 18. На рис. 2 показаны типичные записи ионных токов, представляющих последовательное развитие активности SAC-каналов и функционально солокализованных с ними каналов BK (рис. 2а) или SK (рис. 2б). Механическая стимуляция вызывала стретч-активацию токов входящего направления через Са2+-проводящие SAC-каналы в клетках Raji (см. также рис. 1: активация токов через SAC-каналы). Далее, в том же патче наблюдали развитие токов выходящего направления, отражающих опосредованную активацию KCa-каналов, не имеющих собственной механочувствительности. Имеющиеся данные (рис. 2) согласуются c результатами наших предшествующих работ и позволяют заключить, что активация KCa-каналов в клетках лимфомы человека, наблюдаемая через 1–2 с после подачи стимула, и активации Са2+-проницаемых SAC-каналов, обусловлена кратковременным локальным повышением уровня Са2+ в околомембранной зоне кластеризации SAC- и KCa-каналов.
В 5 из 18 экспериментов на клетках Raji активация SAC-каналов сопровождалась развитием активности как BK-, так и SK-каналов в одном фрагменте клеточной мембраны (рис. 3). Важно отметить (рис. 3), что снятие механического стимула, приводящее к инактивации SAC-каналов (а, следовательно, прекращению локального входа кальция), приводила к постепенному исчезновению активности сначала BK-, а затем и SK-каналов. Это хорошо коррелирует с различной степенью кальциевой чувствительности каналов BK (активация при уровне внутриклеточного свободного ионизированного кальция >1 мкМ) и SK (активация при концентрациях >0.1 мкМ: Fakler, Adelman, 2008). Соответственно SK-каналы, активирующиеся при более низких значениях уровня внутриклеточного кальция, работают дольше и инактивируются позже каналов BK в условиях прекращения локального входа кальция через SAC-каналы.
ОБСУЖДЕНИЕ
В клетках лимфомы Беркитта впервые выявлены механоуправляемые катионные каналы, активирующиеся при растяжении участка плазматической мембраны (стретч-активация, SAC-каналы). В ионных условиях, близких к физиологическим, было продемонстрировано функциональное сопряжение между SAC-каналами и КСа-каналами различных типов: высоколокализованный вход кальция через SAC-каналы стимулирует активность калиевых каналов SK и BK в плазматической мембране. Таким образом, SAC-каналы, по-видимому, формируют один из физиологически значимых путей для эффективного входа ионов кальция в клетках Raji.
Учитывая высокие пролиферативную и инвазивную способности лимфомы Беркитта (Xiong et al., 2012), в которых очевидна важная роль кальций-зависимых сигнальных путей и молекул, SAC‑каналы могут являться определяющими регуляторами поведения клеток лимфомы. Следует отдельно отметить, что ионные механизмы транспорта кальция в клетках различных лимфом практически не изучены. Теперь, после выявленного нами присутствия и активности кальций-проницаемых SAC-каналов, важным вопросом является идентификация их потенциальных молекулярных коррелятов в клетках данного типа. По значению унитарной проводимости (около 25 пСм), которая является важной биофизической характеристикой одиночного канала, SAC-каналы в клетках Raji близки к каналам, идентифицированным нами ранее в стволовых клетках эндометрия человека (Chubinskiy-Nadezhdin et al., 2017) и трансформированных фибробластах мыши линии 3T3B-SV40 (Chubinskiy-Nadezhdin et al., 2014, 2018, 2019с). В клетках 3T3B-SV40 мы показали, что наиболее вероятным коррелятом SAC-каналов являются белки Piezo1: мы обнаружили соответствие биофизических характеристик каналов, активируемых в ответ на растяжение мембраны и в присутствии селективного активатора каналов Piezo1 низкомолекулярного гетероциклического соединения Yoda1 (Chubinskiy-Nadezhdin et al., 2019с). Анализ баз данных транскриптом (Wu et al., 2019) позволил обнаружить крайне высокий уровень экспрессии мРНК PIEZO1 в клетках Raji: он находится на втором месте среди более 80 образцов различных клеток и тканей, использованных в тесте (oligonucleotide array). Таким образом, весьма вероятно, что белки Piezo1 формируют кальций-проницаемые SAC-каналы в клетках лимфомы Беркитта. Это предположение может быть использовано для формирования отдельного направления исследований.
Ранее детально были изучены SAC-каналы в клетках другого рака (крови) – клетках миелоидной лейкемии человека линии К562 (Staruschenko, Vedernikova, 2002; Staruschenko et al., 2005, 2006), показана их проницаемость для ионов кальция, исследованы некоторые механизмы регуляции их активности мембранными липидами и актиновым цитоскелетом (Morachevskaya et al., 2007; Chubinskiy-Nadezhdin et al., 2011). С помощью анализа записей одиночных ионных токов в участке клеточной мембраны нативных клеток К562 нами было показано, что кальциевый вход через SAC-каналы в клетках К562 вызывает активацию кальций-зависимых калиевых каналов SK. Напротив, в мезенхимных стволовых клетках эндометрия человека SAC-каналы стимулируют активность калиевых каналов BK, но не SK, которые, несмотря на их присутствие в том же мембранном фрагменте, не активируются SAC-опосредованным локальным входом кальция (Chubinskiy-Nadezhdin et al., 2017).
В представленной работе на клетках лимфомы Беркитта мы обнаружили, что активация SAC-каналов может стимулировать активность как каналов BK или SK по отдельности, так и одновременно двух типов KCa-каналов в одном мембранном фрагменте. Феномен SAC-зависимой стимуляции активности одновременно каналов SK и BK может быть интерпретирован двумя предположениями.
Первая гипотеза – в мембране присутствуют два независимых типа канальных кластеров – SAC/SK и SAC/BK, и их случайное попадание в один фрагмент плазматической мембраны в эксперименте приводит к наблюдениям сопряжения SAC-каналов одновременно с двумя типами KCa-каналов. В таком случае, активация разных SAC-каналов внутри независимых кластеров управляет активностью своих, со-локализованных с ними, SK- или BK-каналов.
Альтернативная гипотеза – присутствие канальных кластеров, состоящих из функционально солокализованных каналов трех типов – SAC + BK + SK. Наши результаты свидетельствуют в пользу альтернативной гипотезы – совместной локализации 3-х типов каналов в плазматической мембране клеток Raji. Этот вывод может быть сделан нами на основании записей токов с активностью трех типов ионных каналов: во всех 5 экспериментах после снятия механического стимула (и постепенного снижения активности SAC-каналов) вначале мы наблюдали инактивацию каналов BK, а только затем – каналов SK. Учитывая известную разницу в чувствительности каналов BK и SK к уровню внутриклеточного кальция (см. раздел Результаты и Fakler, Adelman, 2008), при прекращении локального входа кальция через каналы SAC каналы BK должны инактивироваться раньше, чем SK. В случае первой гипотезы (присутствия независимых кластеров каналов SAC/BK и SAC/SK) феномен последовательного снижения активности KCa каналов не наблюдали, а временные рамки процессов инактивации BK- и SK-каналов имели бы случайный характер. В совокупности, наши данные в очередной раз демонстрируют уникальность метода патч-кламп для анализа и оценки взаимодействий одиночных канальных белков в плазматической мембране живых клеток, в частности анализа механизмов передачи локального кальциевого сигнала.
Связь функций калий-селективных ионных каналов с различными патофизиологическими процессами и реакциями в трансформированных клетках различного происхождения являются актуальным и перспективным направлением исследований. Калиевые каналы предлагаются как терапевтическая мишень в персонифицированной онкотерапии (Huang, Jan, 2014). Мы впервые идентифицировали функциональную активность КСа-каналов BK и SK в клетках лимфомы Беркитта линии Raji. С учетом наличия высокоселективных ингибиторов для данных каналов, в дальнейших исследованиях может быть оценена перспектива использования BK- и SK-каналов как молекулярных мишеней для снижения агрессивных патофизиологических свойств лимфом.
Список литературы
Allen C.E., Kelly K.M., Bollard C.M. 2015. Pediatric lymphomas and histiocytic disorders of childhood. Pediatr. Clin. North. Am. V. 62. P. 139.
Chubinskiy-Nadezhdin V.I., Efremova T.N., Negulyaev Y.A., Morachevskaya E.A. 2018. Coupled activation of mechanosensitive and calcium-dependent potassium channels in 3T3 and 3T3-SV40 cells. Cell Tiss. Biol. V. 12. P. 231.
Chubinskiy-Nadezhdin V.I, Negulyaev Y.A., Morachevskaya E.A. 2011. Cholesterol depletion-induced inhibition of stretch-activated channels is mediated via actin rearrangement. Biochem.Biophys. Res. Commun. V. 412. P. 80.
Chubinskiy-Nadezhdin V.I., Negulyaev Y.A., Morachevskaya E.A. 2014. Functional coupling of ion channels in cellular mechanotransduction. Biochem. Biophys. Res. Commun. V. 451. P. 421.
Chubinskiy-Nadezhdin V.I., Negulyaev Y.A., Morachevskaya E.A. 2019a. Functional coupling of ion channels in the process of mechano-dependent activation in the membrane of K562 Cells. Cell Tiss. Biol. V. 13. P. 470.
Chubinskiy-Nadezhdin V.I., Sudarikova A.V., Shilina M.A., Vasileva V.Y., Grinchuk T.M., Lyublinskaya O.G., Nikolsky N.N., Negulyaev Y.A. 2019b. Cell cycle-dependent expression of BK channels in human mesenchymal endometrial stem cells. Sci. Rep. V. 9. P. 4595.
Chubinskiy-Nadezhdin V.I., Vasileva V.Y., Negulyaev Y.A., Morachevskaya E.A. 2020. Functional clustering and coupling of ion channels in cellular mechanosensing is independent on lipid raft integrity in plasma membrane. Biochim. Biophys. Acta Mol. Cell. Res. V. 1867. P. 118764.
Chubinskiy-Nadezhdin V.I., Vasileva V.Y., Pugovkina N.A., Vassilieva I.O., Morachevskaya E.A., Nikolsky N.N., Negulyaev Y.A. 2017. Local calcium signalling is mediated by mechanosensitive ion channels in mesenchymal stem cells. Biochem. Biophys. Res. Commun. V. 482. P. 563.
Chubinskiy-Nadezhdin V.I., Vasileva V.Y., Vassilieva I.O., Sudarikova A.V., Morachevskaya E.A., Negulyaev Y.A. 2019c. Agonist-induced Piezo1 activation suppresses migration of transformed fibroblasts. Biochem. Biophys. Res. Commun. V. 514. P. 173.
Fakler B., Adelman J.P. 2008. Control of K(Ca) channels by calcium nano/microdomains. Neuron. V. 59 P. 873.
Huang X., Jan L.Y. 2014. Targeting potassium channels in cancer. J. Cell. Biol. V. 206. P. 151.
Iamshanova O., Fiorio Pla A., Prevarskaya N. 2017. Molecular mechanisms of tumour invasion: Regulation by calcium signals. J. Physiol. V. 595. P. 3063.
Morachevskaya E., Sudarikova A., Negulyaev Y. 2007. Mechanosensitive channel activity and F-actin organization in cholesterol-depleted human leukaemia cells. Cell. Biol. Int. V. 31. P. 374.
Staruschenko A.V., Negulyaev Y.A., Morachevskaya E.A. 2005. Actin cytoskeleton disassembly affects conductive properties of stretch-activated cation channels in leukaemia cells. Biochim. Biophys. Acta. V. 1669. P. 53.
Staruschenko A.V., Sudarikova A.V., Negulyaev Y.A., Morachevskaya E.A. 2006. Magnesium permeation through mechanosensitive channels: single-current measurements. Cell Res. V. 16. P. 723.
Staruschenko A.V., Vedernikova E.A. 2002. Mechanosensitive cation channels in human leukaemia cells: calcium permeation and blocking effect. J. Physiol. V. 541. P. 81.
Wu C., Jin X., Tsueng G., Afrasiabi C., Su A.I. 2016. BioGPS: Building your own mash-up of gene annotations and expression profiles. Nucleic Acids Res. V. 44. P. 313.
Xiong J., Qin J., Zheng Y., Peng X., Luo Y., Meng X. 2012. PEG10 promotes the migration of human Burkitt’s lymphoma cells by up-regulating the expression of matrix metalloproteinase-2 and -9. Clin. Invest. Med. V. 35. P. 117.
Дополнительные материалы отсутствуют.


