Цитология, 2021, T. 63, № 3, стр. 237-243
Экспрессия генов в опухоли и ее микроокружении при фолликулярной лимфоме
А. В. Горбунова 1, *, Ю. А. Криволапов 1, Е. С. Божокина 2, И. В. Евсюков 3, М. М. Фирулева 3, П. В. Харченко 4
1 Северо-Западный государственный медицинский университет им. И.И. Мечникова
191015 Санкт-Петербург, Россия
2 Институт Цитологии РАН
194064 Санкт-Петербург, Россия
3 Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики
197101 Санкт-Петербург, Россия
4 Кафедра биомедицинской информатики Гарвардской медицинской школы
02115 Бостон, Массачусетс, США
* E-mail: anna.gorbunova@szgmu.ru
Поступила в редакцию 22.12.2020
После доработки 19.01.2021
Принята к публикации 19.01.2021
Аннотация
По частоте встречаемости фолликулярная лимфома (ФЛ) занимает второе место среди неходжкинских лимфом. В настоящей работе проведен сравнительный анализ транскриптомов образцов опухолевой ткани пациентов с ФЛ в сравнении с контрольными образцами лимфоузлов с реактивной фолликулярной гиперплазией с целью поиска внутриклеточных сигнальных путей иммунного ответа, функционирование которых изменено в опухоли и ее микроокружении. Было обнаружено 997 генов, экспрессия которых различается в опухолевых и контрольных образцах. Из них 430 генов имеют повышенную экспрессию при ФЛ, а 567 генов демонстрируют пониженную экспрессию. Активированы сигнальные пути регуляции клеточного цикла, ответа клетки на стресс и повреждение ДНК, организации хромосом и процессинга РНК. Среди генов с пониженной экспрессией преобладают гены, ассоциированные с сигнальными путями, контролирующими иммунный ответ. Один из наиболее подавленных при ФЛ сигнальных путей контролирует активацию Т-лимфоцитов. Из 29 генов, участвующих в активации Т-клеток, экспрессия которых подавлена при ФЛ, три гена (CD28, LAT, ZAP70) вовлечены в передачу сигнала при анти-PD-1 терапии. Таким образом, уровень экспрессии этих генов у пациента потенциально может быть одним из биомаркеров, имеющим прогностическое значение при анти-PD-1 терапии при ФЛ.
Постулируемым неопухолевым аналогом клеток фолликулярной лимфомы (ФЛ) считаются В-лимфоциты центров размножения лимфоидных фолликулов. На первых этапах терапии ФЛ хорошо отвечает (как правило) на лечение, но в дальнейшем опухоль прогессирует и теряет чувствительности к терапии. Для лечения В-клеточных лимфом применяется химиотерапия и таргетная терапия моноклональными антителами, обладающими специфичностью к CD20 антигену, обнаруживаемому на поверхности нормальных и малигнизированных В-лимфоцитов. Тем не менее, актуальна потребность в разработке методов лечения резистентных к терапии ФЛ.
Наиболееперспективным подходом считается применение ингибиторов иммунных контрольных точек, а именно антител против рецептора программируемой клеточной гибели (анти-PD-1), таких как ниволумаб и пембролизумаб, и антител против цитотоксических Т-лимфоцит-ассоциированных антигенов (анти-CTLA-4), таких как ипилимумаб. Механизм работы этих антител состоит в ингибировании молекул, блокирующих противоопухолевое действие иммунной системы организма (Pardoll, 2012). Клинические испытания ингибитора контрольных иммунных точек ниволумаба продемонстрировали низкую эффективность анти-PD-1 терапии у пациентов с ФЛ по сравнению с классической лимфомой Ходжкина. Общий показатель объективного ответа в случаях ФЛ был почти в два раза ниже, чем при классической лимфоме Ходжкина (40% против 87%). Было выдвинуто предположение о том, что устойчивость опухоли к ингибиторам контрольных иммунных точек и химиотерапии может быть связана с сигнальными путями, ассоциированными с клетками микроокружения опухоли (Klemm, Joyce, 2015).
Таким образом, для разработки новых методов терапии ФЛ перспективным является изучение механизмов подавления противоопухолевого иммунного ответа. Для этого необходимо найти и исследовать сигнальные пути, связанные с иммунным ответом, функционирование которых изменено в опухоли и ее микроокружении, а также выявить потенциальные биомаркеры эффективности терапии ингибиторами иммунных контрольных точек при ФЛ.
Для решения этой задачи в настоящей работе проведен сравнительный полнотранскриптомный анализ образцов опухолевой ткани пациентов с ФЛ контрольных образцов лимфоузлов с неопухолевой реактивной фолликулярной гиперплазией.
МАТЕРИАЛ И МЕТОДИКА
Материал. В работу включено 39 биопсийных образцов лимфатических узлов с ФЛ (цитологических подтипов 1−2 и 3а) и 9 контрольных биопсийных образцов лимфоузлов с реактивной фолликулярной гиперплазией. От всех пациентов было получено информированное согласие на хранение образцов и использование их для молекулярно-биологических исследований. Для установления морфологического диагноза использовали стандартные гистологические и иммуногистохимические исследовании согласно классификации опухолей кроветворной и лимфоидной тканей (ВОЗ, 2017). Образцы опухолевой ткани криоконсервировали в жидком азоте не позднее, чем через 2 ч после проведения биопсии.
Получение суспензии одиночных клеток. Предварительно измельченные ткани помещали в среду DMEM (Gibco, США), содержащую 10% FBS (Hyclone, США), 2 мг/ мл коллагеназы (Sigma, США) и 50 мкг/мл ДНКазы I (Roche, Германия) при 37°С на 30 мин. Суспензию клеток пропускали через фильтр с размером пор 70 мкм (BD Falcon, США), центрифугировали при 300 g 15 мин и осадок растворяли в буферном растворе PBS без ионов Ca2+ и Mg2+ (PBS–/–; Sigma, США). Жизнеспособность клеток проверяли визуально под микроскопом по окрашиванию трипановым синим (BioRad, США).
Подготовка библиотек РНК и секвенирование. Для полнотранскриптомного анализа РНК выделяли из криоконсервированных образцов лимфоузлов реактивом TRIZOLTM (Invitrogen, США). Библиотеки готовили согласно рекомендациям производителя с помощью набора TruSeq Stranded mRNA Library Prep Kit for Illumina (with Ribo-Zero Human/Mouse/Rat) (Illumina, США). Секвенирование проводили на секвенаторе HiSeq 2500 (Illumina, США). Подготовку библиотек и секвенирование проводили в ресурсном центре “Центр Биобанк”, СПбГУ.
Контроль качества прочтений и выравнивание. Контроль качества полученных данных осуществляли с помощью программы FastQC. Прочтения низкого качества отфильтровывали и удаляли инструментом Trimmomatic (Bolger et al., 2014). Прошедшие контроль качества прочтения выравнивали на референсный геном человека (версия GRCh38.p12) с использованием программы STAR (Spliced Transcripts Alignment to a Reference) (Dobin et al., 2013).
Анализ экспрессии генов. Количественный анализ данных на файлах формата BAM, полученных в результате выравнивания для каждого образца, проводили программой HTSeq-count. Для статистического анализа использовали пакет edgeR (Robinson et al., 2010), при помощи функции glmFit строили итоговую модель и выбрали для дальнейшего анализа данных гены с FDR < 0.05. Анализ представленности функциональных групп генов проводили на базе программы gprofiler (Raudvere et al., 2019).
Приготовление библиотек и секвенирование одиночных клеток. Подготовка библиотек и секвенирование одиночных клеток проводили с использования оборудования 10x Genomics согласно инструкциям производителя (10x Genomics, Inc., США).
Анализ данных секвенирования одиночных клеток. Данные, полученные при секвенировании библиотек, демультиплексировали с использованием программного обеспечения 10x CellRanger и выравнивали на референсный геном человека (версия hg38). Для последующего анализа использовали клетки, содержащие не менее 1000 молекул. Клетки низкого качества дополнительно отфильтровывали с помощью функции gene.vs.molecule.cell.filter из пакета pagoda2 (https://github.com/kharchenkolab/pagoda2). Затем образцы визуализоровали с использованием алгоритма машинного обучения, клеточные субпопуляции были определены с использованием алгоритма Лейдена (r = 1.8). Аннотации проводили вручную с помощью браузера pagoda2 на основе дифференциально экспрессируемых генов и известных литературных маркеров.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
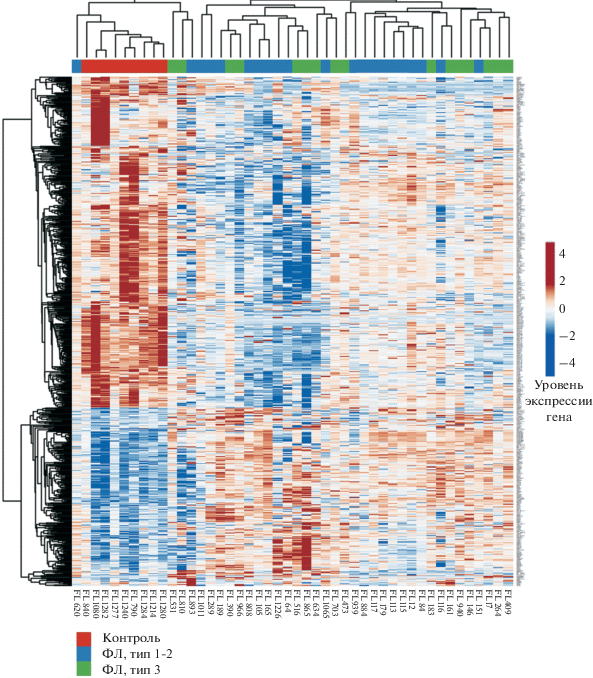
Полнотранскриптомный анализ позволяет количественно оценить уровень экспрессии каждого из более чем 20000 генов. Для исследования профиля экспрессии генов в экспериментальной (ФЛ) и контрольной группах анализировали дифференциальную экспрессию генов. Было обнаружено 997 генов, экспрессия которых статистически достоверно (FDR < 0.05) различается в опухолевых и контрольных образцах (рис. 1). Из них 430 генов имеют повышенную экспрессию при ФЛ (в том числе известные ранее гены BCL2, BCL6, BCL7A, BLK, BTK, CD79A, CD79B, PAX5) и 567 генов демонстрируют пониженную экспрессию.
Рис. 1.
Экспрессия генов в образцах фолликулярной лимфомы (ФЛ, синие и зеленые столбцы) и неопухолевых образцах (контроль, красные столбцы). Цитологический тип ФЛ: 1−2 (синие столбцы) и 3 (зеленые столбцы). Степень их близости по профилю экспрессии отображена в виде дендрограммы. Уровень экспрессии каждого из генов (строки) обозначен цветом: красный – высокая, синий – низкая.
Анализ обогащенности функциональных групп генов, представленных в каталоге GeneOntology, показал, что при ФЛ активированы такие группы генов, молекулярные функции которых относятся к регуляции клеточного цикла, ответу клетки на стресс и повреждение ДНК, организации хромосом и процессинга РНК. Активация этих процессов и связанных с ними сигнальных путей и функциональных групп генов характерна для всех типов злокачественных опухолей, включая В-клеточные лимфомы. В ФЛ по сравнению с солидными опухолями закономерно активирован сигнальный путь В-клеточного рецептора.
Среди генов с пониженной экспрессией преобладали гены, ассоциированные с сигнальными путями, контролирующими иммунный ответ. Один из наиболее подавленных при ФЛ сигнальных путей контролирует активацию Т-лимфоцитов.
Экспрессия 29 генов из этой функциональной группы понижена при ФЛ (табл. 1). Некоторые из них (LAT и BCL11B) ассоциированы с синдромом приобретенного иммунодефицита. Из 29 генов, участвующих в активации Т-клеток, экспрессия которых подавлена при ФЛ, три гена (CD28, LAT, ZAP70) вовлечены в передачу сигнала при анти-PD-1 терапии. Уровень экспрессии этих генов в опухоли потенциально может быть биомаркером, имеющим предиктивное значение для анти-PD-1 терапии ФЛ.
Таблица 1.
Список генов, относящихся к функциональной группе активации Т-лимфоцитов, уровень экспрессии которых статистически значимо (FDR < 0.05) понижен при фолликулярной лимфоме
| Обозначение гена | Полное название гена |
|---|---|
| BCL11B | BAF chromatin remodeling complex subunit BCL11B |
| CAMK4 | Calcium/calmodulin dependent protein kinase IV |
| CCR2 | C-C motif chemokine receptor 2 |
| CCR7 | C-C motif chemokine receptor 7 |
| CD28 | CD28 molecule |
| CLEC7A | C-type lectin domain containing 7A |
| DPP4 | Dipeptidyl peptidase 4 |
| FCER1G | Fc fragment of IgE receptor Ig |
| GATA3 | GATA binding protein 3 |
| GRAP2 | GRB2 related adaptor protein 2 |
| IDO1 | Indoleamine 2,3-dioxygenase 1 |
| IL15 | Interleukin 15 |
| IL23R | Interleukin 23 receptor |
| IL6R | Interleukin 6 receptor |
| IL7R | Interleukin 7 receptor |
| IRF1 | Interferon regulatory factor 1 |
| ITK | IL2 inducible T cell kinase |
| LAT | Linker for activation of T cells |
| LEF1 | Lymphoid enhancer binding factor 1 |
| PRKCQ | protein kinase C theta |
| RUNX2 | Runt related transcription factor 2 |
| SPN | Sialophorin |
| TCF7 | Transcription factor 7 |
| THEMIS | Thymocyte selection associated |
| TMIGD2 | Transmembrane and immunoglobulin domain containing 2 |
| TNFSF13B | TNF superfamily member 13b |
| VSIR | V-set immunoregulatory receptor |
| XBP1 | X-box binding protein 1 |
| ZAP70 | Zeta chain of T cell receptor associated protein kinase 70 |
Маркерный белок CD28 играет ключевую роль в активации наивных Т-клеток, которая возможна только при костимуляции за счет связывания Т-клеточного рецептора (TCR) с главным комплексом гистосовместимости (MHC) на поверхности антигенпрезентирующей клетки и одновременного связывания рецептора CD28 с его лигандом B7. Ассоциация Т-клеточного рецептора наивной Т‑клетки с комплексом MHC без костимуляции взаимодействием CD28 и B7 приводит к анергии Т‑лимфоцита. Показана (Hui et al., 2017) ключевая роль CD28 в эффективности анти-PD-1 терапии, поскольку CD28 непосредственно участвует в сигнальном пути PD-1. Белок CD28 необходим при анти-PD-1 терапии для обеспечения эффективной элиминации опухолевых клеток (Kamphorst et al., 2017). Было обнаружено прогностическое значение уровня экспрессии CD28 при аденокарциноме легкого (Zheng et al., 2018) и диффузной крупноклеточной В-клеточной лимфоме (Wang et al., 2019).
Ген LAT (Linker for Activation of T-cells) кодирует трансмембранный белок, необходимый для внутриклеточной передачи сигнала с Т-клеточного рецептора (TCR) в Т-лимфоцитах на всех стадиях их развития. Белок LAT служит субстратом для белка ZAP70 и необходим для активации Т-клеток (Zhang et al., 1998). Известно, что мутации в этом гене, приводящие к потере функции белка и утрате Т-клетками способности к нормальному функционированию, сопровождаются развитием тяжелого иммунодефицита (Keller et al., 2016).
Белок ZAP70 (zeta chain of T Cell receptor associated protein kinase 70) является частью Т-клеточного рецептора и выполняет критическую роль в передаче сигналов Т-клеток. Анализ экспрессии генов в одиночных клетках опухолевой ткани показал неоднородность уровня экспрессии генов, контролирующих активацию Т-клеток, в различных субпопуляциях лимфоцитов (рис. 2).
Рис. 2.
Экспрессия генов в популяциях клеток опухоли и микроокружения по данным анализа одиночных клеток методом главных компонент. Каждая точка представляет собой отдельную клетку. Клетки объединены в кластеры на основе сходства профиля экспрессии генов. Красным цветом обозначен высокий уровень экспрессии гена, синим – низкий. Кластер клеток, маркированный высокой экспрессией гена CD20, объединяет опухолевые клетки. Кластер клеток с высокой экспрессией гена CD3 – T-лимфоциты микроокружения опухоли.
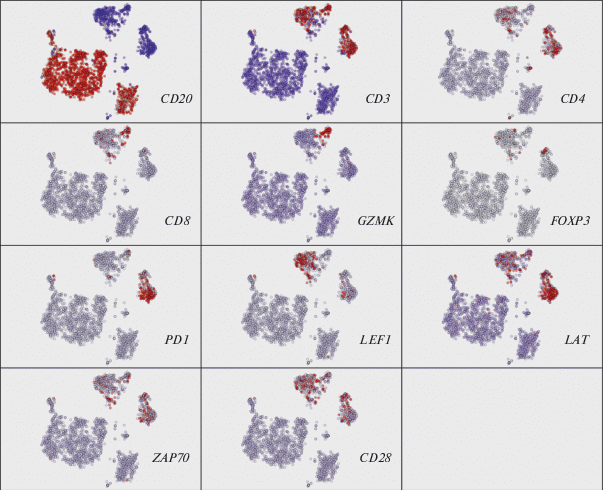
Экспрессия гена CD20 (рис. 2: красный – высокий уровень экспрессии, синий – низкий) маркирует В-клетки, присутствующие в образце. В-клетки образуют единый кластер, состоящий из опухолевых клеток, которые относительно однородны по характеру экспрессии генов.
Все остальные клеточные субпопуляции представляют собой микроокружение опухоли, состоящее из неопухолевых клеток. Как можно отметить на рис. 2, большая часть микроокружения образована Т-лимфоцитами (эти клетки маркирует экспрессия гена CD3). Помимо Т-лимфоцитов можно отметить еще два хорошо заметных (хотя и немногоклеточных) кластера NK-клеток и макрофагов. Количество макрофагов в данных секвенирования одиночных клеток очень невелико по сравнению с их количеством в соответствующем гистологическом препарате, что, вероятно, объясняется большими размерами этих клеток, так как крупные клетки гораздо легче разрушаются при замораживании тканей и в процессе приготовления библиотек для секвенирования. Количество NK-клеток также невелико по сравнению с популяциями Т-клеток.
Т-лимфоциты, присутствующие в микроокружении ФЛ, представляют собой неоднородную группу, состоящую из отдельных субпопуляционных кластеров. Несколько таких кластеров маркированы экспрессией гена CD4, в то время как другие кластеры экспрессируют ген CD8.
Один из кластеров CD4+ представляет собой популяцию Т-регуляторных лимфоцитов FOXP3+, которые способны регулировать иммунный ответ путем подавления активности цитотоксических CD8+-клеток. Второй CD4+-кластер характеризуется очень высокой экспрессией гена PD-1, которая отмечается во всех популяциях Т-клеток, однако на значительно более низком уровне. Экспрессия гена LEF1 (lymphoid enhancer binding factor 1) маркирует кластеры наивных Т-лимфоцитов, не имевших контакта с антигеном.
Наиболее важная с точки зрения противоопухолевого ответа популяция цитотоксических Т-лимфоцитов CD8+ маркирована экспрессией гена GZMK, который кодирует основной компонент цитотоксических гранул. Видно, что количество цитотоксических клеток в микроокружении сопоставимо с количеством клеток самой опухоли. Эти клетки экспрессируют костимулирующие молекулы CD28 и ZAP70 на том же уровне, что и другие субпопуляции Т-клеток. В то же время, гены LAT и LEF1, также участвующие в активации Т-лимфоцитов, экспрессируются в цитотоксических Т-клетках на заметно более низком уровне, чем в других субпопуляциях.
ЗАКЛЮЧЕНИЕ
Таким образом, полученные данные позволяют предположить, что вероятной причиной низкой эффективности применения ингибиторов контрольных точек иммунитета при ФЛ является низкий уровень экспрессии генов, участвующих в передаче сигнала при анти-PD-1 терапии, прежде всего, CD28. Уровень экспрессии этих ключевых генов потенциально может быть одним из биомаркеров, имеющих предиктивное значение в отношении эффективности терапии ингибиторами иммунных контрольных точек.
Список литературы
Bolger A.M., Lohse M., Usadel B. 2014. Trimmomatic: A flexible trimmer for Illumina Sequence Data. Bioinformatics, V. 30. P. 2114. https://doi.org/10.1093/bioinformatics/btu170
Dobin A., Davis C., Schlesinger F., Drenkow J., Zaleski C., Jha S., Batut P., Chaisson M., Gingeras T. 2013. STAR: ultrafast universal RNA-seq aligner. Bioinformatics. V. 29. P. 15. https://doi.org/10.1093/bioinformatics/bts635
Hui E., Cheung J., Zhu J., Su X., Taylor M., Wallweber H., Sasmal D., Huang J., Kim J., Mellman I., Vale R. 2017. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition. Science. V. 355. P. 1428. https://doi.org/10.112/science.aaf1292
Kamphorst A.O., Wieland A., Nasti T., Yang S., Zhang R., Barber D., Konieczny B.T., Daugherty C.Z., Koenig L., Yu K., Sica G.L., Sharpe A.H., Freeman G.J., Blazar B.R., Turka L.A. et al. 2017. Rescue of exhausted CD8 T cells by PD-1-targeted therapies is CD28-dependent. Science. V. 355. P. 1423. https://doi.org/10.1126/science.aaf0683
Keller B., Zaidman I., Yousefi O.S., Hershkovitz D., Stein J., Unger S., Schachtrup K., Sigvardsson M., Kuperman A.A., Shaag A., Schamel W.W., Elpeleg O., Warnatz K., Stepensky P. 2016. Early onset combined immunodeficiency and autoimmunity in patients with loss-of-function mutation in LAT. J. Exp. Med. V. 213. P. 1185. https://doi.org/10.1084/jem.20151110
Klemm F., Joyce J.A. 2015. Microenvironmental regulation of therapeutic response in cancer. Trends Cell Biol. V. 25. P.198. https://doi.org/10.1016/j.tcb.2014.11.006
Pardoll D.M. 2012. The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer. V.12. P. 252. https://doi.org/10.1038/ncr3239
Raudvere U., Kolberg L., Kuzmin I., Arak T., Adler P., Peterson H., Vilo J. 2019. g:Profiler: a web server for functional enrichment analysis and conversions of gene lists (2019 update). Nucleic Acids Res. V. 47. P. 191. https://doi.org/10.1093/nar/gkz369
Robinson M.D., McCarthy D.J., Smyth G.K. 2010. edgeR: A Bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics. V. 26. P. 139. https://doi.org/10.1093/bioinformatics/btp616
Wang G., Fu X., Chang Y., Xin Li, Wu X., Li L., Zhang L., Sun Z., Zhang X., Zhang M. 2019. B7-CD28 gene family expression is associated with prognostic and immunological characteristics of diffuse large B-cell lymphoma. Aging (Albany NY). V. 11. P. 3939. http//doi.org/https://doi.org/10.18632/aging.10202
Zhang W., Sloan-Lancaster J., Kitchen J., Trible R.P., Samelson L.E. 1998. LAT: the ZAP-70 tyrosine kinase substrate that links T cell receptor to cellular activation. Cell. V. 92. P. 83. https://doi.org/10.1016/s0092-8674(00)80901-0
Zheng S., Luo X., Dong C., Zheng D., Xie J., Zhuge L., Sun Y., Chen H. 2018. A B7-CD28 family based signature demonstrates significantly different prognoses and tumor immune landscapes in lung adenocarcinoma. Int. J. Cancer. V. 143. P. 2592. https://doi.org/10.1002/ijc.31764
Дополнительные материалы отсутствуют.


