Цитология, 2021, T. 63, № 3, стр. 260-271
Использование коллагена высокой концентрации в тканевой инженерии хряща методом трехмерной биопечати
Е. В. Исаева 1, *, Е. Е. Бекетов 1, В. В. Южаков 1, Н. В. Аргучинская 1, А. А. Кисель 1, Е. П. Малахов 1, Т. С. Лагода 1, Н. Д. Яковлева 1, П. В. Шегай 2, С. А. Иванов 1, А. Д. Каприн 2
1 Медицинский радиологический научный центр им. А.Ф. Цыба – филиал Национального медицинского исследовательского центра радиологии Министерства здравоохранения РФ
249036 Обнинск, Россия
2 Национальный медицинский исследовательский центр радиологии Министерства здравоохранения РФ
249036 Обнинск, Россия
* E-mail: e1esa@yandex.ru
Поступила в редакцию 26.10.2020
После доработки 24.11.2020
Принята к публикации 30.11.2020
Аннотация
3D-биопечать – перспективная технология создания тканеинженерных конструкций для замещения поврежденных тканей и органов. Коллаген обладает такими преимуществами, как биодеградируемость, биосовместимость и низкая иммуногенность, поэтому он широко используется в 3D-биопечати в тканевой инженерии. Однако при использовании коллагена в традиционной низкой концентрации процесс биопечати затруднен и не обеспечивает высокую точность. Цель настоящего исследования – оценка пригодности коллагена высокой концентрации для создания скаффолдов с инкорпорированными хондроцитами методом 3D-биопечати для формирования хрящевой ткани in vitro и in vivo. Результаты исследования показали, что собственной пористости 4%-ного коллагенового геля было недостаточно для сохранения жизнеспособности клеток в течение длительного времени в условиях in vitro. Сразу после начала культивирования скаффолдов наблюдали массовую миграцию клеток к свободным поверхностям и за их пределы. Клетки, оставшиеся в коллагене, большей частью погибли в течение 4 нед. В эксперименте на животных через 2 нед. после имплантации скаффолдов наблюдали картину слабовыраженного гранулематозного воспаления. Через 6 нед. в зоне имплантата под эпидермисом сформировалась соединительная ткань, в которой рядом с кровеносными сосудами обнаруживали макрофаги и группы мелких клеток с округлыми ядрами, по морфологическим критериям соответствующие молодым хондроцитам, однако количества этих клеток было недостаточно для начала формирования хрящевой ткани.
Все большее распространение в регенеративной медицине и тканевой инженерии приобретает 3D-биопечать. Она позволяет получать тканеинженерные конструкции (скаффолды) строго заданной формы, распределять клетки и поддерживающие биоматериалы определенными способами, чтобы имитировать микроархитектуру различных тканей человека. Ожидается, что технология трехмерной биопечати в будущем радикально изменит регенеративную медицину (Nguyen et al., 2017). В основе 3D-биопечати лежит использование “биочернил” – биосовместимых материалов, дополняемых живыми клетками (стволовыми или дифференцированными). В последнее время как сами биочернила, так и технологии изготовления тканеинженерных конструкций на их основе являются предметом интенсивных исследований. На основании уже имеющихся данных сформулированы основные требования, предъявляемые к биочернилам (Murphy, Atala, 2014; Kesti et al., 2015; Бекетов и др., 2019; Zhang et al., 2019):
1) они должны быть совместимыми с определенными типами клеток и организмов, не вызывать гибель клеток или иммунный ответ и оказывать положительное влияние на прикрепление, пролиферацию, миграцию и функцию как эндогенных, так и экзогенных клеток;
2) биочернила должны быть пригодны для печати, обеспечивать стабильный выход материала, наноситься как на культуральную посуду, так и на другие поверхности, например, вспомогательный гидрогель (sacrificial hydrogel), обеспечивать своевременную полимеризацию;
3) биоматериалы должны иметь контролируемую кинетику деградации и нетоксичные продукты распада, поскольку встроенные клетки секретируют протеазы и продуцируют белки внеклеточного матрикса, которые определяют новую ткань;
4) структуры на основе биоматериалов должны обладать хорошими механическими свойствами, которые необходимы для продолжения функционирования конструкции.
В настоящее время исследования с использованием 3D-биопечати для восстановления хрящевой и костной тканей, а также кожи доведены до стадии клинического применения (Murphy et al., 2020). Хрящевая ткань характеризуется относительно простым строением с низкой плотностью клеток, не содержит кровеносных сосудов и нервов, что упрощает изготовление тканеинженерных конструкций (Grogan et al., 2003; Murphy et al., 2020). В случае хрящевой ткани для экструзионной 3D-биопечати используют такие материалы, как желатинметакриламид (Schuurman et al., 2013; Levato et al., 2017), коллаген (Ren et al., 2016), полиэтиленгликольдиметакрилат (Cui et al., 2012), наноцеллюлоза с добавкой альгината (Nguyen et al., 2017), децеллюляризованный хрящевой матрикс с полисахаридами гелланом и альгинатом (Kesti et al., 2015).
Коллаген – это природный белковый полимер, молекула которого представляет собой правозакрученную спираль из трех α-цепей. Эти белковые цепи содержат сайты клеточной адгезии на основе трипептида аргинин–глицин–аспарагиновая кислота (RGD) (Chaisri et al., 2015). Молекулярные структура и масса, а также температурные условия влияют на физико-химические характеристики коллагена и определяют вязкость и образование гидрогелей на его основе (Zhang et al., 2019). Коллаген входит в состав внеклеточного матрикса и в основном содержится в соединительной ткани животных и человека. В настоящее время описано 29 типов коллагена, которые кодируются более чем 40 генами (Chaisri et al., 2015), однако более 90% всего коллагена высших организмов приходится на I, II, III и IV типы (Abraham et al., 2008). Коллаген I типа участвует в многочисленных физиологически важных взаимодействиях, модулируя клеточную пролиферацию, миграцию, дифференцировку и специфическую экспрессию генов (Liu et al., 2008). Коллаген характеризуется биодеградируемостью, биосовместимостью и низкой иммуногенностью, поэтому он широко используется в 3D-биопечати в тканевой инженерии (Liu et al., 2008; Osidak et al., 2019; Zhang et al., 2019).
Традиционно для биопечати применяют биочернила на основе коллагена низкой концентрации – до 1% (Drobnik et al., 2019; Okubo et al., 2019), что объясняется необходимостью доступа питательных веществ и газов к инкорпорированным в скаффолд клеткам. Однако дальнейшее развитие метода 3D-биопечати направлено на повышение точности печати и лучшее сохранение геометрических параметров сформированных конструкций, что требует применения более вязких гидрогелей (Skardal et al., 2015). Один из вариантов – применение биочернил на основе коллагена высокой концентрации (Osidak et al., 2019). Цель настоящего исследования – оценка пригодности коллагена высокой концентрации для создания скаффолдов с инкорпорированными хондроцитами методом 3D-биопечати для формирования хрящевой ткани in vitro и in vivo.
МАТЕРИАЛ И МЕТОДИКА
Получение клеток. В эксперименте использовали клетки, полученные из мечевидных хрящей двух беспородных белых крыс-самцов (масса 300 г, возраст 4 мес.). Хрящ отделяли от грудины, удаляли все мягкие ткани, измельчали ножницами на кусочки толщиной 3–4 мм, дважды промывали стерильным фосфатным буфером и помещали в стакан с 0.15%-ным раствором коллагеназы в среде DMEM. Фрагменты ткани инкубировали при 37°C и 5% CO2 в течение ~20 ч (MCO-5AC, Sanyo, Япония). После инкубации для окончательного разделения клеток раствор перемешивали 30 мин на магнитной мешалке (Biosan, Латвия), затем клетки осаждали в течение 5 мин при 400 g (центрифуга ELMI CM-6M, Латвия). Для отмывания от фермента клеточный осадок ресуспендировали в среде, дополненной 10% эмбриональной телячьей сыворотки (Biosera, Франция) и центрифугировали в том же режиме. Процедуру повторяли дважды. После этого клетки ресуспендировали в среде с сывороткой, отбирали 200 мкл суспензии, окрашивали 0.4%-ным раствором трипанового синего в фосфатном буфере и подсчитывали количество живых клеток.
Культивирование клеток. Клеточную суспензию (~450 000 мл–1) переносили в культуральный флакон с площадью поверхности 25 см2 (Corning, США), добавляли среду с 10% сыворотки, пенициллином-стрептомицином (по 50 ЕД/мкг/мл), глютамином (649 мкг/мл), помещали в СО2-инкубатор для прикрепления. Через 48 ч производили замену среды на свежую. Культивировали до образования монослоя (примерно 7 сут), после чего переносили в новые флаконы. Для эксперимента использовали клетки 2-го пассажа.
Подготовка биочернил. Биочернила готовили на основе стерильного ателоколлагена свиньи I типа в соответствии с описанной методикой (Osidak et al., 2019). В день эксперимента клетки снимали с пластика раствором трипсина−ЭДТА, после окрашивания трипановым синим подсчитывали в камере Горяева (Минимед, Россия) количество живых клеток, центрифугировали (400 g, 5 мин) и ресуспендировали в 0.25 мл среды без сыворотки. Клеточную суспензию в объеме 0.25 мл смешивали с 0.25 мл буферного раствора для коллагена и охлаждали при 4°С в течение 10 мин. Этот раствор смешивали с 0.5 мл раствора коллагена, получив таким образом биочернила с концентрацией коллагена 4%. До печати биочернила держали при 4°C. Конечная концентрация клеток составляла 20 млн мл–1.
Параметры печати. Для создания скаффолдов был использован 3D-биопринтер Rokit Invivo (Южная Корея) с ПО версии 1.68. Слайсинг модели проводили в программе NewCreatorK версии 1.57.63. Гидрогель находился в шприце с внутренним диаметром 8.24 мм. Подача материала осуществлялась через иглу 21G (внутренний диаметр 514 мкм) длиной 0.5 дюймов типа “Luer-Lock”. Печать осуществляли в стерильные чашки Петри диаметром 60 мм (Corning, США). Высота слоя составляла 386 мкм – 75% от диаметра сопла (Аргучинская и др., 2019). Для получения стабильного филамента печать проводили с увеличенным в 1.5 раза выходом материала с пропорционально (до уровня 66%) сниженной плотностью заполнения и концентрическим алгоритмом печати. Выход материала на первом слое увеличивался на 30% для учета погрешности определения нулевого уровня. Скорость печати составляла 5 мм/с. Температура диспенсера была установлена на уровне 4°C, температура печатного столика соответствовала комнатной. Перед печатью проводили стерилизацию внутреннего пространства принтера с помощью встроенной УФ-лампы с длиной волны 254 нм. В каждой чашке размещали по три печатных конструкции размером 4 × 4 × 4 мм.
Инкубирование после печати. После окончания печати чашки заливали теплой питательной средой в количестве, полностью покрывающем печатные конструкции. Состав среды: DMEM с содержанием глюкозы 4.5 г/л, 10% эмбриональной телячьей сыворотки, 50 ЕД/мкг/мл пенициллина-стрептомицина, 649 мкг/мл глютамина, 100 нг/мл фактора роста фибробластов, 100 нг/мл инсулиноподобного фактора роста I типа, 10 нг/мл трансформирующего фактора роста β1. Каркасы инкубировали в стандартных для культур клеток условиях. Среду меняли два раза в неделю.
Эксперименты на животных. Через 1 ч после печати два скаффолда были имплантированы двум беспородным белым крысам-самцам. Все операции с животными осуществляли с применением ингаляционного эфирного наркоза. Животным выстригали шерсть в области холки, операционное поле обрабатывали 70%-ным раствором этанола. Делали разрез ножницами и с помощью скальпеля формировали под кожей карман, в который помещали имплантат. При зашивании раны края кармана стягивали, место вживления имплантата помечали цветной нитью шовного материала. Шов обрабатывали 3%-ным раствором перекиси водорода. Второй шов накладывали на кожу, повторно обрабатывали перекисью водорода. Для лучшей фиксации сверху наносили медицинский клей. Для обезболивания вокруг операционного поля в холку в трех местах вводили по 0.1 мл 0.5%-ного раствора новокаина. В течение эксперимента крыс содержали изолированно друг от друга в одиночных клетках со свободным доступом к воде и пище. Место операции визуально осматривали ежедневно. Животных подвергли эвтаназии через 2 и 6 нед. после имплантации, отбирали материал для гистологического исследования.
Гистологические и иммуногистохимические исследования. Гистологическому исследованию подвергали напечатанные конструкции через 1 ч, 2 и 4 нед. после печати. Материал, полученный в экспериментах с животными, исследовали через 2 и 6 нед. после имплантации. Коллагеновые каркасы и фрагменты тканей фиксировали 24 ч в кислой жидкости Буэна. После отмывки в 70%-ном этаноле выполняли стандартную гистологическую проводку образцов с их последующим заключением в парафиновую среду. Парафиновые срезы толщиной 5 мкм, полученные на микротоме (Leica RM2235, Германия), помещали на силанизированные стекла (S3003, Dako, Дания). Для гистологических исследований депарафинированные срезы окрашивали гематоксилином и эозином и альциановым синим по Моури. После обезвоживания в спиртах и просветления в ксилоле препараты заключали в канадский бальзам.
Иммуногистохимические исследования на серийных срезах проводили с использованием поликлональных кроличьих антител к ядерному антигену пролиферирующих клеток – PCNA (1 : 100) и моноклональных кроличьих антител к маркеру эндотелия – адгезионной молекулы тромбоцитов/эндотелиальных клеток-1 – PECAM-1 (1 : 250). Для иммуновизуализации кроличьих антител применяли козьи антитела к кроличьим IgG, конъюгированные с пероксидазой хрена (1 : 1000). Растворы для иммуногистохимии готовили на фосфатно-солевом буфере.
Выявление антигенов на гистологических срезах выполнено согласно основным требованиям для иммунопероксидазных методов. Предварительно все антитела и наборы были протестированы на позитивном контроле экспериментального материала. Оптимальные условия иммуноокрашивания определяли по соотношению интенсивности иммуноположительной реакции к “фону”. Согласно протоколу иммуногистохимических исследований, до нанесения первичных антител к PCNA и CD31 депарафинированные срезы, погруженные в цитратный буфер (рН 6.0), прогревали в микроволновой печи (5 мин, 720 Вт). Эндогенную пероксидазу блокировали в 3%-ном растворе перекиси водорода. В блокирующий буфер добавляли 2% нормальной сыворотки животных-доноров вторых антител, 1% бычьего сывороточного альбумина и 0.1% Тритона Х-100. В растворе первичных антител препараты инкубировали в течение ночи во влажной камере при 4°С. После отмывки препаратов в фосфатно-солевом буфере на срезы наносили вторичные антитела на 1 час при комнатной температуре. Субстратную пероксидазу выявляли с использованием диаминобензидина (Liquid DAB+, DAKO, К3468). Ядра клеток докрашивали гематоксилином Майера.
Гистологические препараты изучали в микроскопе Leica DM 1000 (Германия) с камерой Leica ICC50 HD (Германия).
Использованные реактивы. Альциановый синий (8GX), инсулиноподобный фактор роста I типа (IGF-1), сыворотка козья, трансформирующий фактор роста β1, тринитрофенол (для приготовления жидкости Буэна, 1.3%), тритон X-100 (Sigma-Aldrich, США); ацетон, ксилол (орто) (ЧДА), перекись водорода (3%), хлороформ (ХЧ) (Россия); бычий сывороточный альбумин (Santa Cruz, США); гематоксилин Майера, парафиновая среда (Гистомикс), формалин (для приготовления жидкости Буэна, 40%), эозин (1%-ный спиртовой раствор) (БиоВитрум, Россия); глютамин, коллагеназа II типа (Clostridium histolyticum, 315 ед/мг), пенициллин-стрептомицин, среда DMEM (содержание глюкозы 4.5 г/л), раствор трипсина–ЭДТА, трипановый синий, фактор роста фибробластов (ООО НПП “ПанЭко”, Россия); диаминобензидин (Dako, Дания); канадский бальзам (Merck, Германия); козьи антитела, конъюгированные с пероксидазой хрена (ab205718), моноклональные кроличьи антитела к CD31/PECAM-1 (ab182981) (Abcam, Великобритания); комплект ателоколлагена свиньи I типа с буферным раствором (80 мг/мл, ИМТЕК, Россия); медицинский клей БФ-6 (МПЗ, Россия); новокаин (ОАО “Дальхимфарм”, Россия); поликлональные кроличьи антитела к PCNA (PA5-27214, Invitrogen, США); фосфатно-солевой буфер (рН 7.4, ЭКОсервис, Россия); шовный материал (Monocryl poliglecaprone 25, Ethicon, США−Бельгия); эмбриональная телячья сыворотка (Biosera, Франция); этанол медицинский (95%, ЗАО “РФК”, Россия); эфир для наркоза (Химмед, Россия).
РЕЗУЛЬТАТЫ
Результаты исследований in vitro. При первичной изоляции клеток из хрящевой ткани животных с помощью фермента коллагеназы общее их количество было невелико (~775 тыс.), что, вероятно, объясняется возрастом доноров. Выход живых клеток при описанном способе изоляции составил 86.4%. Клетки нулевого пассажа имели характерную для хондроцитов кубическую форму и зернистую цитоплазму, образовывали плотный монослой на 7 сут культивирования. Жизнеспособность клеток 2-го пассажа, которые использовали в эксперименте, до смешивания с коллагеном составляла 99.9%.
Состояние клеток в составе коллагеновой конструкции через 1 ч после печати, в течение которого она находилась в питательной среде в СО2-инкубаторе, представлено на рис. 1: коллаген окрашен в розовый цвет, клетки имеют базофильную окраску. Распределение клеток по объему скаффолда неравномерно. Клетки концентрировались большей частью у воздушных пузырей внутри конструкции и вблизи свободных поверхностей скаффолда. Через 1 сут нахождения в инкубаторе и в следующие несколько дней наблюдали массовую миграцию клеток из коллагеновых каркасов и прикрепление их ко дну чашек (рис. 2). В дальнейшем ее темпы снижались. Для того, чтобы предотвратить истощение питательной среды клетками, мигрировавшими из коллагеновых конструкций, скаффолды были перенесены в новые чашки Петри.
Рис. 1.
Распределение хондроцитов в коллагеновых конструкциях через 1 ч после печати. Окрашивание гематоксилином и эозином. Увел. об.: 2.5×.
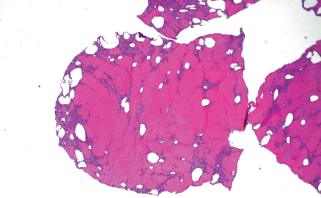
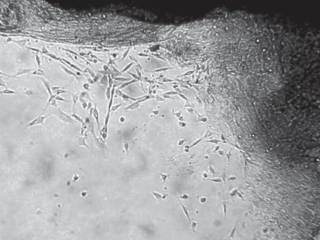
Рис. 2.
Миграция хондроцитов из коллагеновых каркасов на дно чашек Петри через 1 сут после печати. Фазовый контраст. Увел. об.: 10×.
Со второй недели наблюдали уменьшение размеров, деформацию и, в некоторых случаях, частичное разрушение скаффолдов. На рис. 3а представлена микрофотография срезов разных каркасов через 14 сут после печати. Здесь видна неравномерная окраска коллагена, присутствуют более светлые (рыхлые) и темные (плотные) участки. Вероятно, плотность коллагена изменилась вследствие разрушения, а также действия клеточных протеолитических ферментов. В более плотных участках воздушные пузыри отсутствовали. Клетки сосредоточены в более рыхлых участках (рис. 3б). Много клеток располагалось на поверхности конструкций (рис. 3в). PCNA-положительная реакция ядер наблюдалась только в отдельных клетках (рис. 3г), что, на наш взгляд, свидетельствует о том, что основная часть клеток находилась в состоянии покоя. В следующие 14 сут большая часть клеток, заключенных в коллаген, погибла.
Рис. 3.
Хондроциты в составе тканеинженерных коллагеновых конструкций через 14 сут после печати. а–в – Окрашивание гематоксилином и эозином, г – иммуноокрашивание на PCNA. Увел. об.: а – 2.5×, б – 20×, в – 10×, г – 40×.
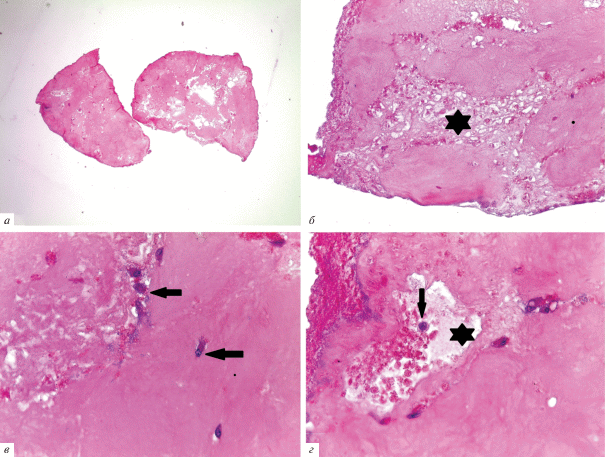
На срезах, сделанных через 28 сут после печати, можно видеть, что конструкции уменьшились в размерах и деформировались (рис. 4а), присутствовал клеточный детрит (рис. 4б). На микрофотографиях отчетливо видно, что через 4 нед. в коллагене сохранились только отдельные живые клетки (рис. 4в, г).
Рис. 4.
Коллагеновые конструкции через 28 сут после печати. Окрашивание гематоксилином и эозином. Стрелками показаны живые клетки; звездочки – клеточный детрит. Увел. об.: а – 2.5×, б – 10×, в, г – 40×.
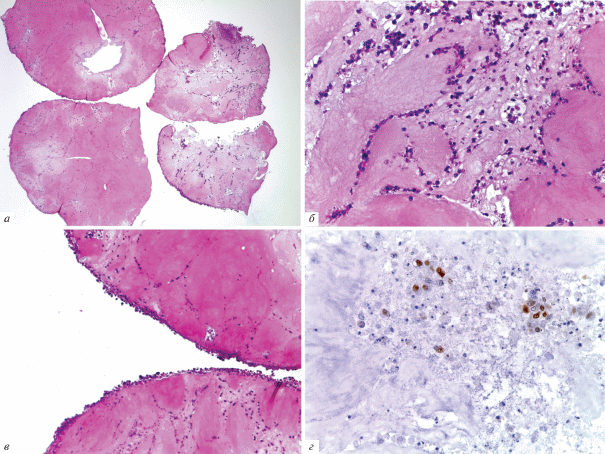
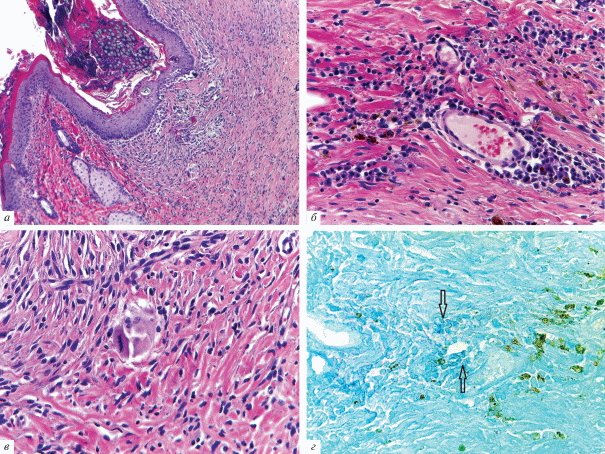
Результаты исследований in vivo. Гистологическое исследование показало, что через 2 нед. в отдельных участках зоны введения имплантата животным присутствовал клеточный детрит, состоявший из фрагментов каркаса, погибших полиморфноядерных лейкоцитов и некротизированных подкожных мышечных волокон (рис. 5а, б). Вокруг скаффолда формировалась капсула из соединительной ткани, которая прорастала в коллаген, разделяя его на отдельные фрагменты (рис. 6). Вокруг кровеносных сосудов располагались макрофаги, по-видимому, вовлеченные в процесс рассасывания органического каркаса, и гранулемы инородных тел (рис. 7). Гранулематозные узелки, окруженные кровеносными сосудами, содержали большое количество клеточных элементов, концентрически располагавшихся вокруг фрагментов деградирующего матрикса. При иммуногистохимическом окрашивании на CD-31 в зонах рассасывания скаффолда выявлялись многочисленные формирующиеся мелкие кровеносные сосуды (рис. 8). Положительная реакция ядер на PCNA наблюдалась в клетках соединительной ткани, эндотелии сосудов и в клеточных элементах гранулем (рис. 9). В окружающей соединительной ткани отмечалось присутствие клеточных элементов с округлыми ядрами и узким ободком цитоплазмы (возможно, хондроцитов). Таким образом, результаты патоморфологического исследования свидетельствуют о том, что через 2 нед. после имплантации скаффолда под кожу крыс наблюдается гранулематозное воспаление с разрушением органического матрикса макрофагами и гигантскими клетками.
Рис. 5.
Место введения скаффолда через 2 нед. после его имплантации под кожу холки крысы. Звездочками показаны области с признаками воспалительной реакции в зоне имплантации. Окрашивание гематоксилином и эозином. Увел. об.: а – 2.5, б – 5×.
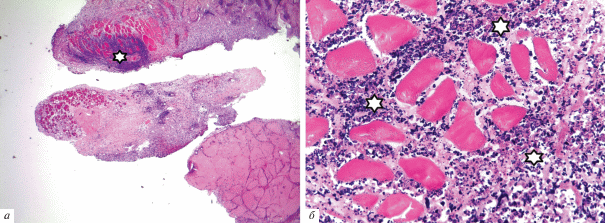
Рис. 6.
Формирование соединительнотканной капсулы на границе с подкожной жировой клетчаткой (отмечено стрелками). Окрашивание гематоксилином и эозином. Увел. об.: 2.5×.
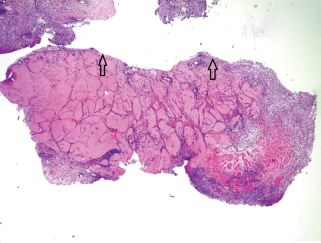
Рис. 7.
Зона рассасывания скаффолда. а – Макрофаги и гранулемы инородных тел в зоне элиминации имплантата; б – фрагмент а при большем увеличении. СК – Скаффолд, ГИТ – гранулема инородных тел, стрелками показаны макрофаги. Окрашивание гематоксилином и эозином. Увел. об.: а – 20×, б – 40×.
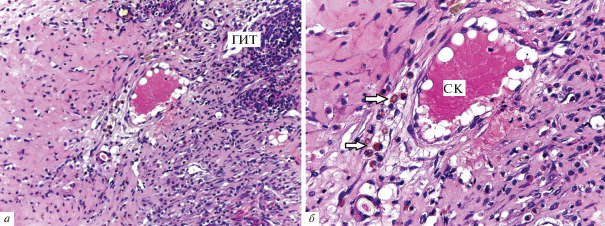
Рис. 8.
Васкуляризация зоны рассасывания скаффолда. а – Ангиогенез на границе скаффолда, б – ангиогенез в области формирования гранулем инородных тел (ГИТ) с многоядерными клетками рассасывания. Стрелками показана иммуногистохимическая реакция эндотелия сосудов с антителами к CD31. Увел. об.: 20×.
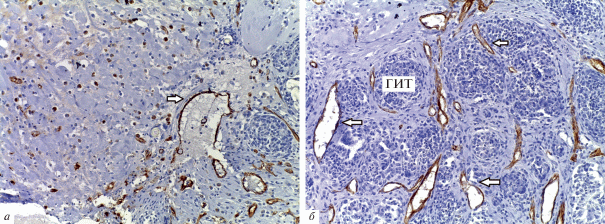
Рис. 9.
Иммуногистохимическая реакция ядер клеток с антителами к PCNA в зоне рассасывания скаффолда. Увел. об.: 20×.
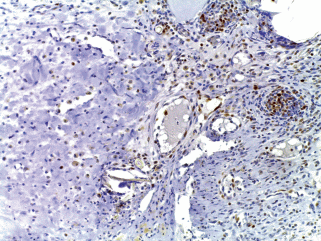
Через 6 нед. в зоне введения имплантата под эпидермисом сформировалась соединительная ткань (рис. 10а), в которой, рядом с кровеносными сосудами, обнаруживались макрофаги и группы мелких клеток с округлыми ядрами, по морфологическим критериям соответствующие молодым хондроцитам (рис. 10б, в). Цитоплазма этих клеток дала положительную реакцию на гликозаминогликаны при окрашивании альциановым синим (рис. 10г). В то же время данные свидетельства формирования хрящевой ткани можно считать косвенными и требующими дальнейшего подтверждения.
Рис. 10.
Зона имплантации скаффолда под кожу холки крысы через 6 недель. а – В верхнем левом углу виден фрагмент шовной нити в месте имплантации; б, в – в окружающих тканях видны группы мелких клеток с округлыми ядрами, по морфологическим критериям соответствующие молодым хондроцитам, г – группа клеток с положительной реакцией на гликозаминогликаны в подкожной соединительной ткани крысы (показаны стрелками) в зоне рассасывания органического матрикса. а–в – Окрашивание гематоксилином и эозином, г – окрашивание альциановым синим. Увел. об.: а – 10×, б–г – 40×.
ОБСУЖДЕНИЕ
Трехмерная (3D) культура хондроцитов считается предпочтительной для регенерации хрящевой ткани (Okubo et al., 2019). Сочетание 3D условий культивирования с добавлением факторов роста позволяет сохранить специфический фенотип хондроцитов (Nguyen et al., 2017; Okubo et al., 2019), обеспечивая синтез и накопление молекул внеклеточного матрикса – протеогликанов и коллагенов, которые могут быть потеряны в условиях in vitro (Grogan et al., 2003; Бекетов и др., 2019). Трехмерные условия культивирования создаются, в основном, с помощью каркасов из различных материалов, которые служат для прикрепления, жизнедеятельности и пролиферации клеточных элементов. Жизнеспособность клеток в искусственных тканях зависит от того, насколько эффективно они снабжаются кислородом и питательными веществами. Ограниченный поток метаболитов в тканевых конструкциях – одна из проблем всей тканевой инженерии (Brown et al., 2007). В статических условиях культивирования основным способом переноса веществ в гидрогелях является диффузия. Предполагается, что кислород постоянно поступает в периферические зоны тканеинженерной конструкции: он растворяется в питательной среде, при этом его концентрация пропорциональна парциальному давлению газа и коэффициенту растворимости (Brown et al., 2007). Поскольку в искусственных тканях диффузия кислорода часто происходит медленнее, чем его потребление, кислород является лимитирующим фактором в выживании клеток в конструкциях толще 100–200 мкм (Malda et al., 2004). На доступность кислорода кроме длины пути диффузии влияет плотность клеточной массы, так как способность кислорода диффундировать через клетки значительно меньше, чем через воду (Radisic et al., 2005; Brown et al., 2007). В каркасах с достаточно большой объемной долей клеток затрудненная диффузия метаболитов будет дополняться их повышенным потреблением. Поэтому в статических клеточных конструкциях, где питательные вещества распространяются только путем диффузии, неизбежно возникают области, в которых преобладает пролиферация клеток, – это наружная поверхность скаффолда (Lewis et al., 2005).
Результаты, полученные в нашем исследовании, являются хорошей иллюстрацией всему вышесказанному. Уже через 1 ч нахождения тканеинженерных конструкций в статических условиях инкубатора произошло перемещение клеток к наружным поверхностям скаффолда и воздушным пузырям. В течение следующих нескольких дней наблюдали массовый выход клеток за пределы коллагеновой конструкции и прикрепление их ко дну культуральной посуды. О гетерогенном распределении клеток внутри тканеинженерных каркасов сообщают и другие авторы. Так, Левис с соавторами (Lewis et al., 2005) наблюдали увеличение плотности бычьих хондроцитов в периферических слоях пористого каркаса из терефталата/полибутилентерефталата в течение первых 14 сут. культивирования. В литературе также сообщается (Radisic et al., 2005), что концентрация кислорода и жизнеспособность сердечных миоцитов крыс снижались линейно и плотность живых клеток уменьшалась экспоненциально с ростом расстояния от поверхности конструкции (коллагеновая губка диаметром 6 мм и толщиной 1.5 мм).
Хрящ – аваскулярная ткань и относительно медленная диффузия веществ в глубину конструкции не считается преобладающей проблемой в инженерии хряща (Grogan et al., 2003). Однако в искусственных каркасах используется высокая плотность клеток для получения более “функциональной” ткани, так как она имеет решающее значение для установления межклеточных контактов и осуществления тканевых функций (Radisic et al., 2005; Brown et al., 2007; Cigan et al., 2016). При биопечати высокая плотность клеток необходима также для достижения хорошей выживаемости после печати (Nguyen et al., 2017). Таким образом, в диффузно-ограниченных конструкциях возникает противоречие между высокой плотностью клеток и достаточным содержанием кислорода. Это становится особенно важным в свете выводов, сделанных Окубо с соавторами (Okubo et al., 2019). По их мнению, эффективность хондрогенеза напрямую зависела от плотности клеток в скаффолдах (чем выше, тем лучше) и фактор высокой жизнеспособности клеток являлся более важным с точки зрения формирования ткани, чем попытки стимулировать хондрогенез.
В соответствии с представленными данными при культивировании скаффолда в течение 4 нед. произошло его частичное разрушение и сжатие. Одной из причин, вызвавшей разрушение коллагена, могло быть выделение клетками протеолитических ферментов (Zhang et al., 2019). Деформация и сжатие конструкций из натуральных материалов, например, внеклеточного матрикса хряща или коллагена вследствие жизнедеятельности клеток также описаны в литературе (Liu et al., 2008; Rowland et al., 2013). Клеточно-опосредованное сжатие пористого материала может уменьшить диффузию кислорода и питательных веществ к центру, и, как следствие, объем, доступный для клеточной пролиферации (Rowland et al., 2013), что также не способствует формированию полноценной ткани. Дробник с соавторами (Drobnik et al., 2019) исследовали долговечность трехмерных губчатых пористых каркасов на основе коллагена I типа с нервными эмбриональными крысиными клетками или без клеток после имплантации в головной мозг крысам. Было показано, что имплантаты оставались структурно не поврежденными в течение 4 нед., но индуцировали гранулематозное воспаление, включающее накопление многоядерных макрофагов, мононуклеарных воспалительных клеток и образование кровеносных сосудов. Авторы предположили, что иммунные реакции, включая воспаление, окислительный стресс и низкий уровень трофических факторов могут вызывать гибель клеток внутри инженерных конструкций после имплантации. Мы наблюдали сходную картину воспаления после подкожной имплантации коллагеновых каркасов крысам. Но в нашем исследовании каркасы полностью рассосались в течение 4–6 нед., вероятно, по причине того, что состояли из немодифицированного коллагена. Обнаружение кровеносных сосудов, прорастающих в каркас, является положительным фактором, так как васкуляризация считается критически важным событием в тканевой инженерии (Murphy et al., 2020). Несмотря на то, что жизнеспособные клетки, по морфологическим критериям соответствующие молодым хондроцитам, сохранились, полноценного формирования хрящевой ткани не произошло. Вероятно, это также связано как с быстрым рассасыванием коллагенового скаффолда, так и небольшим количеством выживших клеток. Оставшиеся клетки не успели сформировать собственный матрикс, характерный для хрящевой ткани.
Для клинического применения трансплантаты должны быть объемными (не плоскими) и содержать физиологическую плотность метаболически активных дифференцированных клеток (Radisic et al., 2005). В тканеинженерных конструкциях, толщина которых составляет несколько мм, снабжение клеток питательными веществами и особенно кислородом является критической проблемой. Ограничение диффузии питательных веществ приводит к пространственно неоднородным свойствам искусственной ткани (Bian et al., 2009). Как показывает анализ литературы, более высокая жизнеспособность клеток достигается в менее плотных гелях, в которых лучше осуществляется диффузия (Nguyen et al., 2017; Okubo et al., 2019). Однако в трехмерной биопечати плотность материала должна обеспечивать возможность получения стабильной конструкции заданной формы, иначе все преимущества технологии будут сведены к нулю. Это противоречие может быть разрешено с помощью включения дополнительных каналов и пор, например, из вспомогательных материалов (sacrificial hydrogel), которые удаляются из готовых изделий (Levato et al., 2017), или с использованием динамических систем культивирования – биореакторов. В то же время существует мнение, что перфузионные системы могут не подходить для получения хрящевой ткани, так как способны удалять специфические метаболиты (коллаген) и приводить к апоптозу клеток (Grogan et al., 2003). Результаты нашего исследования показали, что собственной пористости использованного 4%-ного коллагенового геля было недостаточно для снабжения инкорпорированных клеток кислородом и питательными веществами и сохранения их жизнеспособности в течение длительного времени в условиях in vitro. Вторым недостатком материала была его быстрая (в течение месяца) деградация в организме животных. Это в свою очередь не позволило необходимое время поддерживать условия для формирования хрящевой ткани в месте имплантации. Таким образом, в дальнейших исследованиях целесообразно использовать модифицированные варианты коллагена или другие полимеры, в том числе синтетические, характеризующиеся более длительным сроком деградации.
Список литературы
Аргучинская Н.В., Бекетов Е.Е., Осидак Е.О., Северюков Ф.Е., Шегай П.В., Каприн А.Д. 2019. Создание скаффолда щитовидного хряща человека методом 3D-биопринтинга. Гены и клетки. Т. 14. № S. С. 26. (Arguchinskaya N.V., Beketov E.E., Osidak E.O., Severyukov F.E., Shegai P.V., Kaprin A.D. 2019. Human thyroid cartilage scaffold fabrication using 3D-bioprinting. Genes and Cells. V. 14. № S. P. 26.)
Бекетов Е.Е. Исаева Е.В., Шегай П.В., Иванов С.А., Каприн А.Д. 2019. Современное состояние тканевой инженерии для восстановления хрящевой ткани. Гены и клетки. Т. 14. № 2. С. 12. (Beketov E.E. Isaeva E.V., Shegai P.V., Ivanov S.A., Kaprin A.D. 2019. Current state of tissue engineering for cartilage regeneration. Genes and Cells. V. 14. № 2. P. 12. )https://doi.org/10.23868/201906013
Abraham L.C., Zuena E., Perez-Ramirez B., Kaplan D.L. 2008. Guide to collagen characterization for biomaterial studies. J. Biomed. Mater. Res. B Appl. Biomater. V. 87. P. 264. https://doi.org/10.1002/jbm.b.31078
Bian L., Angione S.L., Ng K.W., Lima E.G., Williams D.Y., Mao D.Q., Ateshian G. A., Hung C.T. 2009. Influence of decreasing nutrient path length on the development of engineered cartilage. Osteoarthritis Cartilage. V. 17. P. 677. https://doi.org/0.1016/j.joca.2008.10.003
Brown D.A., MacLellan W.R., Laks H., Dunn J.C.Y., Wu B.M., Beygui R.E. 2007. Analysis of oxygen transport in a diffusion-limited model of engineered heart tissue. Biotechnol. Bioeng. V. 97. P. 962. https://doi.org/10.1002/bit.21295
Chaisri P., Chingsungnoen A., Siri S. 2015. Repetitive gly-leu-lys-gly-glu-asn-arg-gly-asp peptide derived from collagen and fibronectin for improving cell-scaffold interaction. Appl. Biochem. Biotechnol. V. 175. P. 2489. https://doi.org/10.1007/s12010-014-1388-y
Cigan A.D., Durney K.M., Nims R.J., Vunjak-Novakovic G., Hung C.T., Ateshian G.A. 2016. Nutrient channels aid the growth of articular surface-sized engineered cartilage constructs. Tissue Eng. Part A. V. 22. P. 1063. https://doi.org/10.1089/ten.TEA.2016.0179
Cui X., Breitenkamp K., Finn M.G., Lotz M., D’Lima D.D. 2012. Direct human cartilage repair using three-dimensional bioprinting technology. Tissue Eng. Part A. V. 18. P. 1304. https://doi.org/10.1089/ten.TEA.2011.0543
Drobnik J., Pietrucha K., Janczar K., Polis L., Polis B., Safandowska M., Szymański J. 2019. Intra-cerebral implantation of a variety of collagenous scaffolds with nervous embryonic cells. Exp. Ther. Med. V. 18. P. 4758. https://doi.org/10.3892/etm.2019.8116
Grogan S.P., Rieser F., Winkelmann V., Berardi S., Mainil-Varlet P. 2003. A static, closed and scaffold-free bioreactor system that permits chondrogenesis in vitro. Osteoarthritis and Cartilage. V. 11. P. 403. https://doi.org/10.1016/s1063-4584(03)00053-0
Kesti M., Eberhardt C., Pagliccia G., Kenkel D., Grande D., Boss A., Zenobi-Wong M. 2015. Bioprinting complex cartilaginous structures with clinically compliant biomaterials. Adv. Funct. Mater. V. 25. P. 7406. https://doi.org/10.1002/adfm.201503423
Levato R., Webb W.R., Otto I.A., Mensinga A., Zhang Y., van Rijen M., van Weeren R., Khan I.M., Malda J. 2017. The bio in the ink: cartilage regeneration with bioprintable hydrogels and articular cartilage-derived progenitor cells. Acta Biomater. V. 1. P. 41. https://doi.org/10.1016/j.actbio.2017.08.005
Lewis M.C., Macarthur B.D., Malda J., Pettet G., Please C.P. 2005. Heterogeneous proliferation within engineered cartilaginous tissue: the role of oxygen tension. Biotechnol. Bioeng. V. 91. P.607. https://doi.org/10.1002/bit.20508
Liu C.Z., Xia Z.D., Han Z.W., Hulley P.A., Triffitt J.T., Czernuszka J.T. 2008. Novel 3d collagen scaffolds fabricated by indirect printing technique for tissue engineering. J. Biomed. Mater. Res. B Appl. Biomater. V. 85. P. 519. https://doi.org/10.1002/jbm.b.30975
Malda J., Woodfield T.B., Vloodt F.V., Kooy F.K., Martens D.E., Tramper J., Blitterswijk C.A, Riesle J.U. 2004. The effect of PEGT/PBT scaffold architecture on oxygen gradients in tissue engineered cartilaginous constructs. Biomaterials. V. 25. P. 5773. https://doi.org/10.1016/j.biomaterials.2004.01.028
Murphy S.V., Atala A. 2014. 3D bioprinting of tissues and organs. Nat. Biotechnol. V. 32. P. 773. https://doi.org/10.1038/nbt.2958
Murphy S.V., De Coppi P., Atala A. 2020. Opportunities and challenges of translational 3d bioprinting. Nat. Biomed. Eng. V. 4. P. 370. https://doi.org/10.1038/s41551-019-0471-7
Nguyen D., Hägg D.A, Forsman A., Ekholm J., Nimkingratana P, Brantsing C., Kalogeropoulos T., Zaunz S., Concaro S., Brittberg M., Lindahl A., Gatenholm P., Enejder A., Simonsson S. 2017. Cartilage tissue engineering by the 3d bioprinting of ips cells in a nanocellulose/alginate bioink. Sci. Rep. V. 7. P. 658. https://doi.org/10.1038/s41598-017-00690-y
Okubo R., Asawa Y., Watanabe M., Nagata S., Nio M., Takato T., Hikita A., Hoshi K. 2019. Proliferation medium in three-dimensional culture of auricular chondrocytes promotes effective cartilage regeneration in vivo. Regen. Ther. V. 15. P. 306. https://doi.org/10.1016/j.reth.2019.10.002
Osidak E.O., Karalkin P.A., Osidak M.S., Parfenov V.A., Sivogrivov D.E., Pereira A.S., Gryadunova A.A., Koudan E.V., Khesuani Y.D., Kasyanov V.A., Belousov S.I., Krasheninnikov S.V., Grigoriev T.E., Chvalun S.N., Bulanova E.A. et al. 2019. Viscoll collagen solution as a novel bioink for direct 3d bioprinting. J. Mater. Sci. Mate. Med. V. 30. P. 31. https://doi.org/10.1007/s10856-019-6233-y
Radisic M., Malda J., Epping E., Geng W., Langer R., Vunjak-Novakovic G. 2005. Oxygen gradients correlate with cell density and cell viability in engineered cardiac tissue. Biotechnol.Bioeng. V. 93. P. 332. https://doi.org/10.1002/bit.20722
Ren X., Wang F., Chen C., Gong X., Yin L., Yang L. 2016. Engineering zonal cartilage through bioprinting collagen type ii hydrogel constructs with biomimetic chondrocyte density gradient. BMC Musculoskelet Disord. V. 20. P. 301. https://doi.org/10.1186/s12891-016-1130-8
Rowland C.R., Lennon D.P., Caplan A.I., Guilak F. 2013. The effects of crosslinking of scaffolds engineered from cartilage ECM on the chondrogenic differentiation of MSCs. Biomaterials. V. 34. P. 5802. https://doi.org/10.1016/j.biomaterials.2013.04.027
Schuurman W., Levett P.A., Pot M.W., Weeren P., Dhert W.J.A., Hutmacher D.W., Melchels F.P.W., Klein T.J., Malda J. 2013. Gelatin-methacrylamide hydrogels as potential biomaterials for fabrication of tissue-engineered cartilage constructs. Macromol. Biosci. V. 13. P. 551. https://doi.org/10.1002/mabi.201200471
Skardal A., Devarasetty M., Kang H.W., Mead I., Bishop C., Shupe T., Lee S.J., Jackson J., Yoo J., Soker S., Atala A. 2015. A Hydrogel bioink toolkit for mimicking native tissue biochemical and mechanical properties in bioprinted tissue constructs. Acta Biomater. V. 25. P. 24. https://doi.org/10.1016/j.actbio.2015.07.030
Zhang Y., Zhou D., Chen J., Zhang X., Li X., Zhao W., Xu T. 2019. Biomaterials based on marine resources for 3d bioprinting applications. Mar. Drugs. V. 17. P. 555. https://doi.org/10.3390/md17100555
Дополнительные материалы отсутствуют.


