Цитология, 2021, T. 63, № 3, стр. 256-259
Морфология поверхности хондросфер после обработки цитохалазином Д
А. А. Грядунова 1, 2, *, Е. А. Буланова 1, Е. В. Кудан 1, В. А. Касьянов 3, Ю. Д. Хесуани 1, В. А. Миронов 1, 2
1 Лаборатория биотехнологических исследований “3Д Биопринтинг Солюшенс”
115409 Москва, Россия
2 Институт регенеративной медицины Первого Московского медицинского университета
им. И.М. Сеченова Минздрава России
119991 Москва, Россия
3 Лаборатория биомеханики Рижского университета им. П. Страдиньша
LV-1007 Рига, Латвия
* E-mail: zharnitskaya_anna@mail.ru
Поступила в редакцию 19.02.2021
После доработки 26.02.2021
Принята к публикации 06.03.2021
Аннотация
Целью данной работы является изучение морфологии поверхности хондросфер после обработки цитохалазином Д. Хондросферы c концентрацией клеток 8000 на 1 сфероид получали из первичных хондроцитов барана. Подсчитывали диаметры хондросфер, количества микроворсинок и округленных клеток (%) на поверхности. Для оценки диаметра хондросфер использовали фотографии, полученные с помощью инвертированного светового микроскопа, оснащенного цифровой фотокамерой. Для оценки количества округленных клеток и микроворсинок использовали фотографии, полученные в ходе сканирующей электронной микроскопии. Морфометрический анализ показал, что после действия цитохалазина Д диаметр хондросфер увеличивается, хондроциты округляются, подавляющее большинство хондроцитов сохраняет на своей поверхности плотно расположенные микроворсинки. При этом в незначительной части клеток наблюдается ранее не описанный феномен прогрессирующей депопуляции микроворсинок. Таким образом, цитохалазин Д оказывает существенное влияние на размеры и морфологию поверхности хондросфер.
Тканевые сфероиды представляют собой плотно упакованные шарообразные агрегаты живых клеток, использующиеся в качестве “строительных блоков” в тканевой инженерии (Mironov et al., 2009). Некоторые виды тканевых сфероидов находят применение в клинической практике. Так, сфероиды, состоящие из первичных хондроцитов, или хондросферы, уже более десяти лет успешно применяются в качестве одной из форм клеточной терапии для лечения повреждений хряща (Schubert et al., 2009). Таким образом, изучение хондросфер является перспективным направлением в современной регенеративной медицине.
Для ускоренного созревания хрящевой ткани рекомендуется применять химическую стимуляцию (Huang et al., 2018). В качестве одного из важных компонентов химического хондрогенного коктейля для такой стимуляции впервые было предложено использовать цитохалазин Д (Huang et al., 2018). Цитохалазин Д является метаболитом некоторых видов плесневых грибов и широко используется в клеточной биологии как классический ингибитор полимеризации актина (Brown, Spudich, 1979). Показано, что цитохалазин Д вызывает деполимеризацию актиновых микрофиламентов в хондроцитах при культивировании в монослое, приводящую к округлению клеток и усилению синтеза компонентов внеклеточного матрикса хряща, в основном гликозоаминогликанов (Newman, Watt, 1988). Включение цитохалазина Д в состав химического хондрогенного коктейля, по-видимому, обусловлено именно этим фактом. Следовательно, в настоящее время цитохалазин Д можно рассматривать в качестве хондрогенного агента. Несмотря на большое количество работ, посвященных изучению свойств цитохалазина Д, мы не нашли в литературе данных о его влиянии на хондроциты в условиях 3D-культивирования – в составе хондросфер.
Цель настоящей работы заключалась в изучении влияния цитохалазина Д на морфологию поверхности хондросфер с помощью метода сканирующей электронной микроскопии.
МАТЕРИАЛЫ И МЕТОДИКА
Культура клеток. Первичные хондроциты барана были любезно предоставлены Н.П. Омельяненко (Национальный медицинский исследовательский центр травматологии и ортопедии им. Н.Н. Приорова, Москва, Россия). Клетки выращивали в культуральной среде DMEM (Gibco, США), содержащей 10% фетальной бычьей сыворотки (Gibco, США), 1% антибиотика/антимикотика (Gibco, США) и 2 мM L-глутамина (ПанЭко, Россия). Клетки инкубировали при температуре 37°С во влажной атмосфере при 5% CO2 до достижения 85–95% конфлюэнтности. Отсутствие микоплазменного заражения подтверждали по протоколу окрашивания Hoechst 33 258 (Sigma, США).
Получение хондросфер. Для фабрикации хондросфер использовали хондроциты 3 пассажа. Хондросферы получали с использованием планшетов с низкоадгезивным покрытием Corning Spheroid Microplates (Corning, США) по протоколу производителя. После достижения 85–95% конфлюэнтности клетки промывали раствором Версена (ПанЭко, Россия), добавляли 0.25%-ный раствор трипсина с 0.53 мМ ЭДТА (Gibco, США) и суспендировали в культуральной среде DMEM. Для получения хондросфер использовали клеточную суспензию с концентрацией клеток 80000 кл./мл. В каждую ячейку 96-луночного планшета Corning Spheroid Microplate помещали 100 мкл готовой суспензии. Таким образом, концентрация клеток в одном сфероиде составила 8000.
Обработка цитохалазином Д. Через 3 сут хондросферы, находившиеся в ячейках 96-луночного планшета Corning Spheroid Microplate, обрабатывали раствором цитохалазина Д (Sigma, США) в концентрации 10 мкM в культуральной среде DMEM и оставляли на 24 ч. По истечении 24 ч хондросферы фиксировали в 2.5%-ном растворе глутаральдегида (Sigma, США) для дальнейшего сканирующего электронно-микроскопического исследования.
Сканирующая электронная микроскопия. Образцы клеток фиксировали в 1%-ном растворе OsO4 в фосфатном буфере в течение 1–2 ч и дегидратировали в серии спиртов возрастающей концентрации. Дегидратированные образцы высушивали методом перехода критической точки на установке HCP-2 (Hitachi Koki Co. Ltd., Япония) и подвергали напылению золотом с помощью установки ионного напыления IB-3 (EIKO, Япония). Затем образцы исследовали на сканирующем электронном микроскопе JSM-6510 LV (JEOL, Япония).
Морфометрический анализ. Для оценки диаметров хондросфер использовали фотографии, полученные на инвертированном световом микроскопе Nikon Eclipse Ti-E (Nikon, Япония), оснащенном цифровой фотокамерой. Для оценки количества округленных клеток и микроворсинок использовали фотографии, полученные в ходе сканирующей электронной микроскопии. Подсчет диаметров хондросфер, а также количества округленных хондроцитов и микроворсинок на их поверхности проводили с использованием программного обеспечения ImageJ 1.51 (NIH, Bethesda, США). При подсчете диаметров использовали 96 фотографий хондросфер в каждой группе. При подсчете микроворсинок анализировали 10 фотографий поверхности хондросфер, в каждой из которых подсчитывали количество микроворсинок в 3-х произвольных областях площадью 10 × 10 мкм2.
Статистический анализ. Статистическую обработку проводили с использованием однофакторного дисперсионного анализа ANOVA в программном обеспечении GraphPad Prism 6.01 (GraphPad Software, Inc., La Jolla, CA, США). Эксперимент повторяли 3 раза. Результаты измерений представлены средними значениями и их ошибкой, различия между группами считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ
Морфометрический анализ с использованием световой микроскопии показал существенное увеличение диаметров хондросфер, обработанных цитохалазином Д (365.31 ± 2.40 мкм), по сравнению с контрольной группой (287.28 ±1.55 мкм). Следовательно, диаметр увеличился более чем на 20% (рис. 1а–в). При действии цитохалазина Д также наблюдали округление практически всех хондроцитов на поверхности хондросфер (97.44 ± 1.95%), тогда как в контрольной группе количество округленных клеток составляло 10.10 ± 3.39% (рис. 1г–е).
Рис. 1.
Влияние цитохалазина Д на размеры и морфологию поверхности хондросфер: фазово-контрастные микрофотографии контрольного сфероида (а) и сфероида после обработки 10 мкM цитохалазина Д (б); изменение диаметра хондросфер в процессе эксперимента (в); микрофотографии поверхности контрольного сфероида (г) и сфероида после обработки цитохалазином Д (д); изменение количества округленных клеток в процессе эксперимента (е); варианты поверхности клеток в составе контрольного сфероида (ж) и сфероида после обработки цитохалазином Д (з, и). Размерные шкалы: 100 мкм (а, б, г, д), 2 мкм (ж–и). Различия между группами достоверны при p ≤ 0.0001 (звездочки).
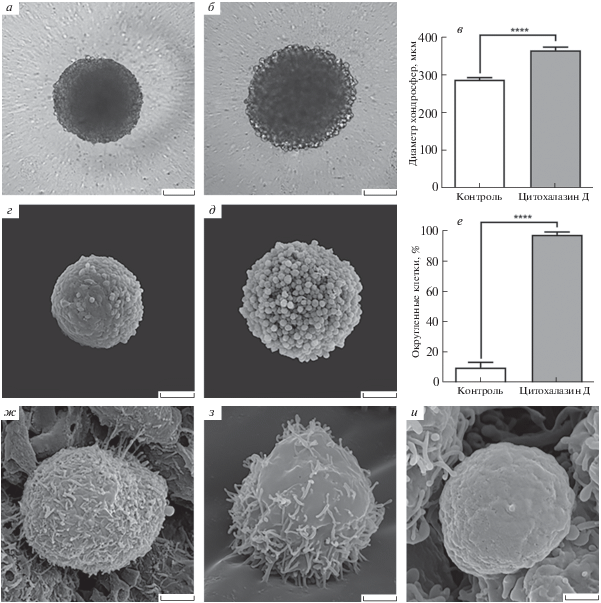
По данным сканирующей электронной микроскопии подавляющее большинство хондроцитов сохранило на своей поверхности плотно расположенные микроворсинки после обработки цитохалазином Д. Тем не менее, в незначительной части клеток наблюдали ранее не описанный феномен прогрессирующей депопуляции микроворсинок (рис. 1з). Редко можно было заметить хондроциты, практически полностью лишенные микроворсинок (рис. 1и). Таким образом, диаметр хондросфер, плотность упаковки клеток в их составе, а также форма самих клеток претерпевают существенные изменения после обработки цитохалазином Д.
ОБСУЖДЕНИЕ
Проведенное исследование показало существенное влияние цитохалазина Д на морфологию хондросфер, которое проявилось прежде всего в увеличении их диаметра. Такое увеличение, по нашим данным, не связано с пролиферацией хондроцитов в составе сфероидов, но может быть сопряжено с синтезом внеклеточного матрикса, хотя обычно для его накопления требуется более продолжительное время культивирования (Newman, Watt, 1988; Omelyanenko et al., 2020). Декомпактизация хондросфер, наиболее вероятно, связана с округлением хондроцитов в их составе, что является следствием деполимеризации актиновых микрофиламентов под воздействием цитохалазина Д. Примечательным является феномен депопуляции микроворсинок, наблюдаемый в некоторых хондроцитах на поверхности хондросфер. В качестве продолжения анализа этого феномена необходимо проведение дополнительных исследований, затрагивающих влияние цитохалазина Д на кинетику слияния хондросфер между собой и на кинетику распластывания хондросфер на различных субстратах, включая поверхность поврежденного хряща. Еще одним важным аспектом является изучение синтеза и накопления внеклеточного матрикса хряща в присутствии цитохалазина Д. Наконец, имеет значение включение в состав хондросфер микро- или наночастиц, содержащих цитохалазин Д как отдельно, так и в комбинации с другими хондрогенным факторами (Dang et al., 2016).
Известно, что обработка хондроцитов цитохалазином Д способствует восстановлению их хондрогенного фенотипа (Newman, Watt, 1988). Перестройка актиновых микрофиламентов по данным из литературы приводит к увеличению экспрессии коллагена II типа и к повышению содержания протеогликанов в матриксе хондроцитов (Nofal, Knudson, 2002). В свою очередь, накопление компонентов внеклеточного матрикса вызывает увеличение модуля упругости хондросфер, характеризующего их биомеханические свойства (Omelyanenko et al., 2020). Усиление упругости хондросфер позволит им выдерживать высокое давление при встраивании в место дефекта и распределять возникающие сжимающие напряжения по подлежащей субхондральной кости.
Таким образом, использование цитохалазина Д при культивировании хондросфер может помочь повысить их эффективность при замещении дефектов хрящевой ткани.
Список литературы
Brown S S., Spudich J.A. 1979. Cytochalasin inhibits the rate of elongation of actin filament fragments. J. Cell Biol. V. 83. P. 657.
Dang P.N., Dwivedi N., Phillips L.M., Yu X., HerbergS., Bowerman C., Solorio L.D., Murphy W.L., Alsberg E. 2016. Controlled Dual Growth Factor Delivery From Microparticles Incorporated Within Human Bone Marrow-Derived Mesenchymal Stem Cell Aggregates for Enhanced Bone Tissue Engineering via Endochondral Ossification. Stem Cells Transl. Med. V. 5. P. 206.
Huang B.J., Brown W.E., Keown T., Hu J.C., Athanasiou K.A. 2018. Overcoming Challenges in Engineering Large, Scaffold-Free Neocartilage with Functional Properties. Tissue Eng. Part A. V. 24. P. 1652.
Mironov V., Visconti R.P., Kasyanov V., Forgacs G., Drake C.J., Markwald R.R. 2009. Organ printing: tissue spheroids as building blocks. Biomaterials. V. 30. P. 2164.
Newman P., Watt F.M. 1988. Influence of cytochalasin D-induced changes in cell shape on proteoglycan synthesis by cultured articular chondrocytes. Exp. Cell Res. V. 178. P. 199.
Nofal G.A., Knudson C.B. 2002 Latrunculin and cytochalasin decrease chondrocyte matrix retention. J. Histochem. Cytochem. V. 50. P. 1313.
Omelyanenko N.P., Karalkin P.A., Bulanova E.A., Koudan E.V., Parfenov V.A., Rodionov S.A., Knyazeva A.D., Kasyanov V.A., Babichenko I.I., Chkadua T.Z., Khesuani Y.D., Gryadunova A.A., Mironov V.A. 2020. Extracellular Matrix Determines Biomechanical Properties of Chondrospheres during Their Maturation In Vitro. Cartilage. V. 11. P. 521.
Schubert T., Anders S., Neumann E., Schölmerich J., Hofstädter F., Grifka J., Müller-Ladner U., Libera J., Schedel J. 2009. Long-term effects of chondrospheres on cartilage lesions in an autologous chondrocyte implantation model as investigated in the SCID mouse model. Int. J. Mol. Med. V. 23. P. 455.
Дополнительные материалы отсутствуют.


