Цитология, 2021, T. 63, № 3, стр. 281-291
Реконструкция сосудов малого диаметра с использованием тканеинженерной клеточной конструкции на основе поликапролактона
Н. М. Юдинцева 1, *, Ю. А. Нащекина 1, М. А. Шевцов 1, 2, В. Б. Карпович 2, Г. И. Попов 2, И. А. Самусенко 3, Н. А. Михайлова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
197022 Санкт-Петербург, Россия
3 Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова МЧС России
197082 Санкт-Петербург, Россия
* E-mail: yudintceva@mail.ru
Поступила в редакцию 21.01.2021
После доработки 04.02.2021
Принята к публикации 05.02.2021
Аннотация
Поликапролактон (ПКЛ) широко применяется для конструирования сосудистых трансплантатов малого диаметра благодаря своим биомеханическим свойствам, медленной скорости деградации, а также хорошей биосовместимости. В настоящей работе тестировали тканеинженерную конструкцию (ТИК) на основе трубчатой матрицы, заселенной гладкомышечными (ГМ) клетками аорты, на модели замещения брюшной аорты крысы. Полиэфирные трубчатые матрицы получали методом термического разделения фаз и заселяли ГМ-клетками. Чтобы проследить дальнейшую судьбу ГМ-клеток, использовали суперпарамагнитные наночастицы оксида железа, которые являются эффективным маркером имплантированных клеток для их долгосрочной визуализации. Гистологическую оценку миграции аутологичных эндотелиальных клеток и образования эндотелиальной оболочки проводили через 4, 8 и 12 нед. после введения трансплантата. Миграция эндотелия в просвет имплантированной конструкции с последующим образованием клеточного монослоя была выявлена через 4 нед. Помеченные наночастицами ГМ-клетки были обнаружены на всем протяжении ТИК, что свидетельствовало о роле этих клеток в эндотелизации ТИК. В конце 12-недельного периода наблюдения архитектура неоинтимы и неоадвентиции имела большое сходство с таковыми у нативного сосуда. Сравнение с бесклеточной конструкцией показало лучшую проходимость клеточной ТИК без возникновения каких-либо осложнений и хорошие биоинтегративные свойства.
Шунтирование является основным подходом к лечению сердечно-сосудистых заболеваний, связанных с облитерацией кровеносных сосудов. Однако недостаток аутологичных сосудов пациентов (вен или артерий) из-за повторных операций или сопутствующей патологии (атеросклероза) приводит к необходимости развития тканеинженерных сосудистых трансплантатов. Создание клинически применимых сосудов малого диаметра (менее 6 мм) в качестве альтернативы аутологичным венозным или артериальным сосудистым заменителям в настоящее время является предметом интенсивных исследований в области трансляционной медицины (Li et al., 2014; Xu et al., 2017). Несмотря на большое количество исследований, до сих пор нет выводов о клинической пригодности сосудистых тканеинженерных конструкций (ТИК). Для обеспечения структурной целостности и долгосрочной проходимости идеальный сосудистый трансплантат должен обладать антитромботической поверхностью, устойчивостью к образованию аневризмы и иметь низкий риск осложнений, таких как гиперплазия интимы или кальцификация.
За последние десятилетия были разработаны различные биологические сосудистые трансплантаты на основе децеллюлированных тканей (Hibino et al., 2015; Negishi et al., 2017), фиброина шелка (Catto et al., 2015), гидрогелей (Aussel et al., 2017), внеклеточного матрикса, синтезированного клетками (Rosellini et al., 2010). Различная степень успеха у применяемых конструкций частично определяется химическими и механическими свойствами материала (Pashneh-Tala et al., 2015). В настоящее время для приготовления сосудистых ТИК широко используют биодеградируемые синтетические полимеры (de Valence et al., 2012; Aussel et al., 2017). Полимеры играют решающую роль в технологии тканевой инженерии, поскольку представляют собой наиболее подходящий материал для применения в сердечно-сосудистой хирургии, главным образом, благодаря их свойствам и практическим преимуществам (простота изготовления, удобство имплантации, хранения и т.д.). Кроме того, скорость деградации полимера можно регулировать путем изменения множества факторов, включая молекулярную массу, отношение площади поверхности к объему и др. По сравнению с биологическими материалами синтетические полимеры демонстрируют улучшенные биомеханические свойства, которые делают их хорошими кандидатами на размещение трансплантата в сосудах с высоким артериальным давлением.
Поликапролактон (ПКЛ) является одним из наиболее перспективных кандидатов при разработке сосудистых ТИК благодаря таким свойствам как биосовместимость, медленная скорость деградации и превосходные биомеханические свойства (Fukunishi et al., 2016). Важную роль при разработке ТИК играют технологии изготовления трубчатых матриц. Наиболее часто используемые методы включают электроспиннинг, выщелачивание порогенов или биопринтинг (Hoch et al., 2014). К сожалению, применение синтетических материалов в сосудистой хирургии часто приводит к возникновению различных осложнений, включая тромбоз, гиперплазию интимы и кальцификацию трансплантата (Mel et al., 2008; Mehta et al., 2011).
Одной из стратегий, позволяющих избежать возникновения подобных осложнений, является заселение биодеградируемых синтетических материалов клетками сосудов двух основных типов: эндотелиальными клетками и (или) гладкомышечными (ГМ). Эндотелий обладает плейотропным эффектом и играет важную роль в регуляции гомеостаза и проходимости кровеносных сосудов (Dharmashankar et al., 2010; Wilson et al., 2014). Неполная эндотелизация ТИК, особенно в случае регенерации кровеносных сосудов малого диаметра, приводит к тромбозу, протеканию швов, псевдоаневризмам и т.д. (Stowell, Wang, 2018; Zhao et al., 2018). Известно, что на образование эндотелиальной оболочки значительное влияние оказывает рельеф матриц. Для того, чтобы модулировать образование эндотелиального монослоя, предпринимались многочисленные попытки образования гребней и канавок на поверхностях матриц (Wang et al., 2019) или изменения жесткости волокон (Stekelenburg et al., 2008; Bingcheng et al., 2020). Однако эффективного и быстрого решения проблемы эндотелизации ТИК пока не достигнуто.
Другими клетками, играющими важную роль в регуляции тонуса сосуда и диаметра просвета, являются ГМ-клетки. Показано, что низкая способность ГМ-клеток заселять трансплантат, а также снижение эффективности синтеза коллагена и эластина, приводят к образованию нарушений в стенке сосуда, ухудшению параметров вазомоторности и эластичности, а также к длительным осложнениям, связанным с трансплантатом (de Valence et al., 2012). Сосудистые ТИК, заселенные аутологичными эндотелиальными клетками, безусловно являются предпочтительными, так как не вызывают иммунных реакций хозяина. Однако получение и культивирование аутологичных эндотелиальных клеток имеет ряд ограничений, включая болезненность забора биопсии, длительный период масштабирования клеток, а также снижение их жизнеспособности, что в значительной степени связано с возрастом пациента и сопутствующими заболеваниями. Для заселения трансплантата можно использовать аллогенные эндотелиальные клетки, однако это связано с повышенным риском их отторжения (Radke, et al., 2018).
В настоящей работе реконструировали брюшную аорту крысы, используя трубчатую матрицу на основе ПКЛ, заселенную аллогенными ГМ-клетками аорты крысы. Мы предположили, что после внесения ТИК, заселенной ГМ-клетками, клетки эндотелия хозяина будут активно мигрировать из прилежащей части нативной аорты и образовывать клеточный монослой во внутреннем просвете каркаса, что позволит улучшить биосовместимость трансплантата. Для отслеживания последующей судьбы ГМ-клеток в условиях in vivo их метили суперпарамагнитными наночастицами оксида железа. В течение 12-недельного периода наблюдения с помощью методов гистологии оценивали характер реконструкции сосудов и наличие осложнений. Было показано, что внутренний просвет сосудистых ТИК полностью покрывался эндотелиальными клетками, а помеченные наночастицами ГМ-клетки присутствовали на всем протяжении формируемого нео-сосуда.
МАТЕРИАЛ И МЕТОДИКА
Животные. В работе использовали самцов крыс Вистар, полученных из питомника Рапполово РАМН (Санкт-Петербург, Россия). Исследования проводили согласно ГОСТ 33216-2014 “Правила работы с лабораторными грызунами и кроликами” и Протокола № 1-208 от 21 марта 2018 этического комитета Первого государственного медицинского университета им. И.П. Павлова (Санкт-Петербург, Россия). Всех животных лечили в соответствии с руководящими принципами Федерации европейской лабораторной научной ассоциации.
Выделение ГМ-клеток аорты крысы. Клетки выделяли из брюшной аорты крыс (n = 6), используя метод ферментативной обработки (Song et al., 2009). ГМ-клетки культивировали в среде DMEM (Биолот, Россия), содержащей 10% эмбриональной сыворотки и 50 мкг/мл гентамицина (Capricorn, Германия). Смену питательной среды выполняли два раза в неделю. После достижения клетками 80–90% конфлуентности выполняли пересев посредством обработки культуры 0.25%-ным раствором трипсин−ЭДТА (Gibco, США). В экспериментах использовали клетки 4–6 пассажей.
Интернализация наночастиц ГМ-клетками. Суперпарамагнитные наночастицы оксида железа (Fe3O4) c размерами менее 50 нм были покрыты декстраном для повышения биосовместимости и снижения агрегации. Клетки, достигшие состояния монослоя, культивировали в среде ДМЕМ, содержащей 10% фетальной сыворотки и гентамицин, в присутствии суперпарамагнитных наночастиц (150 мкг/мл) в течение 24 ч в условиях СО2-инкубатора. После инкубации среду меняли на свежую. Клетки трижды отмывали от неинтернализованных наночастиц раствором PBS и оценивали жизнеспособность с помощью окраски трипановым синим (0.4%; Биолот, Россия). Дополнительно с помощью МТТ-теста анализировали цитотоксичность наночастиц, используя набор Vybrant® MTT в соответствии с протоколом производителя (Life Technologies, США).
Приготовление и модификация трубчатой матрицы на основе поликапролактона (ПКЛ). На первой стадии готовили матрицу из расплавленного сахара. Матрица имела форму стержня диаметром 1.1 мм и длиной 60 мм. Сахарный стержень последовательно покрывали тремя слоями раствора полимера ПКЛ (мол. масса 80 000; Sigma-Aldrich, США), растворенного в хлороформе в концентрации 2%. После полного выпаривания растворителя воздействием воздуха в течение 24 ч трубчатую матрицу промывали дистиллированной водой для удаления кристаллов сахара, а затем стерилизовали с помощью газообразного озона в режиме 200 ppm в течение 120 мин при относительной влажности 80%. Для усиления прикрепления клеток матрицу выдерживали в растворе фибриногена (Sigma-Aldrich, США) в концентрации 0.1 мг/мл при 4°С в течение ночи. Для анализа параметров и архитектуры образцы матрицы использовали сканирующую электронную микроскопию (СЭМ) (FE-SEM; JEOL, Япония). Механические свойства образцов определяли с помощью универсальной испытательной машины (Instron, США).
Заселение ГМ-клетками трубчатой матрицы на основе ПКЛ. Суспензию клеток (20 мкл) в концентрации 106 кл./мл вводили микропипеткой в просвет трубчатой матрицы. Заселенную клетками матрицу вращали каждые 30 мин в течение 4 ч для равномерного распределения клеток по всей внутренней поверхности. Затем добавляли среду DMEM, содержащую 10% фетальной сыворотки и гентамицин, до полного погружения матрицы и культивировали при температуре 37°С и 5% CO2. Питательную среду меняли два раза в неделю. Характер распределения клеток оценивали с помощью конфокальной микроскопии (Olympus FV3000, Япония) через 3 сут и 3 нед. культивирования образцов.
Иммунофлуоресцентный анализ. ГМ-клетки в слайд-флаконах (IBIDI, Германия), а также образцы трубчатых матриц, заселенные ГМ-клетками, трижды промывали раствором PBS и фиксировали раствором 10%-ного нейтрального формалина (Sigma-Aldrich, США) в течение 15 мин. Затем образцы трубчатых матриц, заселенных ГМ-клетками, помещали в реактив Tissue-Tek (Sakura, Япония) и хранили при −80°C. В дальнейшем с помощью криотома из них готовили срезы толщиной 10–15 мкм. Для пермеабилизации клеточной мембраны вносили 0.1%-ный раствор Тритона Х100 (Sigma-Aldrich, США) на 15 мин. Затем трижды отмывали и инкубировали в растворе 0.2%-ного бычьего сывороточного альбумин в течение 1 ч для блокировки сайтов неспецифического связывания.
В качестве первичных антител использовали антитела против альфа-ГМ-актина (anti-alpha smooth muscle actin (α-SMA); Abcam, Великобритания) в разведении 1 : 250. Инкубацию клеток и криосрезов с антителами проводили в течение ночи при температуре 4°С. В качестве вторичных антител использовали Rabbit Anti-Mouse IgG FITC-labeled (Sigma-Aldrich, США) в разведении 1 : 500. Инкубирование выполняли в течение 45 мин при комнатной температуре в темноте. После трехкратной отмывки препаратов раствором PBS для окраски ядер на 10 мин вносили краситель DAPI (4′,6-diamidino-2-phenylindole) (Thermo Fisher Scientific, США), затем отмывали раствором PBS и заключали в среду Mounting medium (Thermo Fisher Scientific, США). В качестве отрицательного контроля использовали клетки, окрашенные только вторичными антителами. Для выявления иммунофлуоресценции и детекции ядер использовали диодный лазера с длиной волны соответственно 488 и 405 нм. Для анализа внутриклеточной локализации магнитных наночастиц применяли сканирование отраженным лазером (504 нм). В работе был использован конфокальный микроскоп (Olympus FV3000, Япония) с использованием конфокальной системы Olympus IX83 microscope (Olympus Corporation, Япония).
Операция по реконструкции брюшной аорты. Животных делили на две группы (n = 6): экспериментальная группа получала ТИК, заселенную ГМ-клетками; контрольная группа – бесклеточную ТИК. При операционных манипуляциях применяли ингаляционную анестезию, состоящую из 3%-ного изофлурана (Laboratorios Karizoo, Испания). Проводили Y-образную лапаротомию и мобилизацию инфраренальной части брюшной аорты (рис. 1а). Для реконструкции использовали ТИК длиной 6 мм (рис. 1б). После мобилизации брюшной аорты от левой почечной вены и сперматической артерии бесклеточную ТИК или ТИК, заселенную ГМ-клетками, вшивали 12-узловыми швами, используя шовный материал (нейлон 9/0) (рис. 1в, г). Проходимость ТИК оценивали по классической методике сразу и через 30 мин после имплантации (Acland, 1972). Антикоагулянты в послеоперационном периоде не применяли. Животные получали свободный доступ к воде и стандартную диету. Кроме того, все животные получали послеоперационную профилактику антибиотиками (энрофлоксацин, 5 мг/кг; Laboratorios Karizoo, Испания) в течение 7 сут.
Рис. 1.
Модель замещения брюшной аорты крысы. а – Мобилизация инфернальной части брюшной аорты крысы (аорта показана черными стрелками); б – ТИК (белые стрелки) длиной 6 мм; в – замена аорты с использованием ТИК; г – ТИК, заполненная кровью.

Гистологический анализ. На сроках 4, 8 и 12 нед. животных выводили из эксперимента и фиксировали реконструированные сосуды в 10%-ном формалине в течение 24 ч. Далее материал проходил стандартную обработку в изопропиловом спирте и парафине для приготовления гистологических и гистохимических препаратов с толщиной серийных парафиновых срезов 3–5 мкм. Для микроскопического исследования срезы окрашивали гематоксилином и эозином. Все образцы проанализировали на инфильтрацию лимфоцитами, гистиоцитами, эпителиоидными и гигантскими многоядерными клетками. Кроме того, срезы окрашивали антителами против α-SMA (Diagnostic BioSystems, США). После инкубации при комнатной температуре в течение 30 мин с последующим несколькими промывками PBS проводили окрашивание ядер с использованием гематоксилина Майера. Затем для визуализации α-SMA применяли систему детекции мышь/кролик UnoVue™ HRP/DAB (Diagnostic BioSystems, США) в соответствии с протоколом производителя. Морфологическое исследование гистологических препаратов и препаратов, окрашенных гистохимическим методом, проводили при помощи светооптического микроскопа (Leica DM LS, Германия). Микрофотографирование проводили при помощи цифровой фотокамеры (Leica DC320, Германия). В качестве контроля использовали нативную аорту интактных животных.
Приготовление криосрезов. Для обнаружения клеток, помеченных наночастицами, образцы реконструированных сосудов помещали в Tissue-Tek (Sakura, Япония) и хранили при –80°C. Срезы (толщиной 5–7 мкм), полученные из этих блоков, помещали на предметные стекла Superfrost Plus (Thermo Fisher Scientific, США) и анализировали с помощью конфокальной микроскопии. Дополнительно срезы окрашивали, используя первичные антитела, специфические для ГМ-клеток (против α-SMA; Abcam, США) в разведении 1 : 100. В качестве вторичных антител использовали Rabbit Anti-Mouse FITC-labeled antibody (Sigma-Aldrich, США) в разведении 1 : 500. Срезы дополнительно окрашивали DAPI и монтировали в среде Mounting medium. Флуоресцентные изображения получали с использованием конфокальной системы (Olympus FV3000, Япония). Иммунофлуоресценцию и ядра, а также локализацию магнитных наночастиц детектировали так же, как и при иммунофлуоресцентном анализе (см. выше).
Статистический анализ. Данные по оценке механических свойств трубчатых матриц, а также полученные гистологические показатели обрабатывали статистически методами вариационной статистики при помощи программы Microsoft Exel с определением показателей среднего значения (М), ошибки среднего (m), достоверности различий между группами сравнения с вычислением критерия Стьюдента (t), уровня значимости (α), доверительного интервала (р). Различия считали достоверными при р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выделенные из аорты крысы ГМ-клетки представляли собой однородную популяцию с биполярной веретенообразной морфологий (рис. 2а) и окрашивались антителами против α-SMA (рис. 2б). Используемые суперпарамагнитные наночастицы оксида железа в соответствии с данными ТЭМ имели размеры менее 50 нм (рис. 2в). Культивирование ГМ-клеток с наночастицами в течение 24 ч приводило к высокому уровню их интернализации. Поглощенные наночастицы располагались в цитоплазме клеток, окружая ядро, но не проникая в него (рис. 2г). Цитотоксического влияния наночастиц на ГМ-клетки после совместного культивирования в течение 24 ч не отмечено (данные не приводятся). Отсутствие цитотоксического действия на клетки наночастиц в используемом режиме подтверждено и в нашей более ранней работе, в которой суперпарамагнитные наночастицы оксида железа применяли как в качестве метки, введенной в стволовые клетки (Yudintceva et al., 2018), так и для диагностических целей (Shevtsov et al., 2015). При оценке характера распределения ГМ-клеток, заселенных в трубчатые матрицы, было показано, что через 3 сут культивирования ГМ-клетки, помеченные наночастицами, образовывали монослой на внутренней поверхности (рис. 2д), а через 3 нед. распределялись по всей толще и на всем протяжении матрицы (рис. 2е).
Рис. 2.
ГМ-клетки аорты. а – Морфологическая картина ГМ-клеток аорты в монослое, световая микроскопия. б – Иммунофлуоресценция клеток (зеленый цвет), окрашенных на α-SMA с использованием специфических антител; ядра окрашены DAPI (синий цвет). в – Наночастицы (ТЭМ). г – Интернализация наночастиц клетками (красный цвет). д, е – ГМ-клетки (окрашенные на α-SMA и DAPI), заселенные в трубчатые матрицы, через 3 сут и 3 нед. соответственно. б, г, д, е – Конфокальная микроскопия. Масштабная линейка: 200 (а, б), 100 (в–е) мкм.
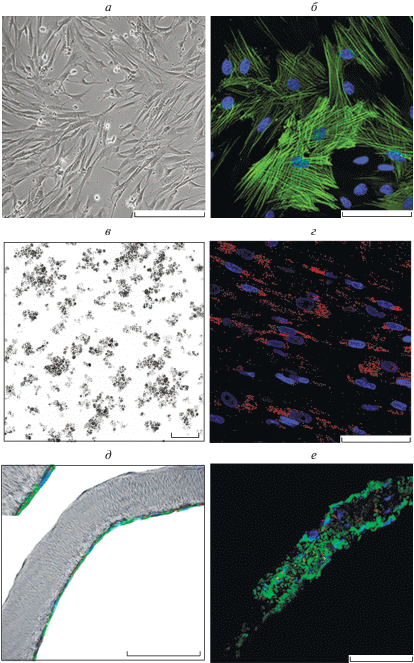
Согласно данным СЭМ, внутренний диаметр трубчатой матрицы из ПКЛ (рис. 3а) составлял 1.1 мм (рис. 3б), а толщина стенки – 100 мкм (рис. 3в). ГМ-клетки, заселенные вовнутрь трубчатой матрицы, имели нормальную морфологию (рис. 3г).
Рис. 3.
Трубчатая матрица на основе ПКЛ. а – Внешний вид и параметры матрицы. б, в – Поперечный и продольный срезы матрицы соответственно. г – ГМ-клетки на внутренней поверхности матрицы. СЭМ. Масштабная линейка: 10 мкм.

Для бесклеточных трубчатых матриц на основе ПКЛ и нативных образцов аорты крыс определяли модуль упругости (модуль Юнга), предел прочности и деформацию при растяжении. Значения механических свойств у матрицы из ПКЛ (прочность на разрыв, растяжение и модуль Юнга) были существенно выше, чем у нативной аорты, несмотря на меньшую толщину ее стенки (табл. 1).
Таблица 1.
Механические свойства трубчатой матрицы на основе ПКЛ
| Образец | Толщина стенки, мкм | Прочность на разрыв, МПа | Модуль Юнга, МПа | Растяжение, % |
|---|---|---|---|---|
| ПКЛ матрица | 100 | 23 ± 2.36а | 226 ± 8.1а | 800 ± 66а |
| Нативная аорта | 150 | 2.27 ± 0.56 | 17.3 ± 5.1 | 139 ± 32 |
Гистологический анализ реконструированных сосудов выявил наличие в контрольной группе (применение бесклеточной ТИК) раннего (≤24 ч) тромбоза ТИК у пяти из шести животных. Одно из животных в этой группе выжило до конца периода наблюдения, однако последующая оценка (после 12 нед.) подтвердила поздний тромбоз ТИК с реканализованным тромбом, припаянным к стенке в просвете аорты (рис. 4). В экспериментальной группе, получавшей ТИК, заселенные ГМ-клетками, никаких осложнений не обнаружено. На всех сроках наблюдения сосудистые ТИК, заселенные клетками, оставались проходимыми, патологического влияния (воспаления, кровоизлияния) на окружающие ткани выявлено не было. Неоинтима аорты была представлена в виде волокнистой соединительной ткани с внутренней эластичной мембраной, покрытой эндотелием. Признаков гиперплазии неоинтимы также не выявлено (рис. 4). В качестве дополнительного контроля использовали аорту интактного животного (рис. 4).
Рис. 4.
Гистологическое (ГЛ), иммуногистохимическое (ИГХ) и иммунофлуоресцентное (ИФ) детектирование сосудов, реконструированных с помощью ТИК, через 4, 8 и 12 нед. после введения трансплантата. Интактная брюшная аорта крысы служила контролем. Черные стрелки на ГЛ-препаратах, окрашенных гематоксилин-эозином (H&E), указывают на материал ПКЛ матрицы. Красные стрелки (ИГХ) указывают на ГМ-клетки, положительно окрашенные на α-SMA (коричневый цвет). ИФ: меченные наночастицами ГМ-клетки (красный цвет) и окрашенные на α-SMA с помощью специфических антител (зеленый цвет) в реконструированной стенке сосуда; вставки – фотоувеличение (10×) части изображения. Область тромбоза сосуда с использованием бесклеточной ТИК выделена эллипсом (ГЛ).
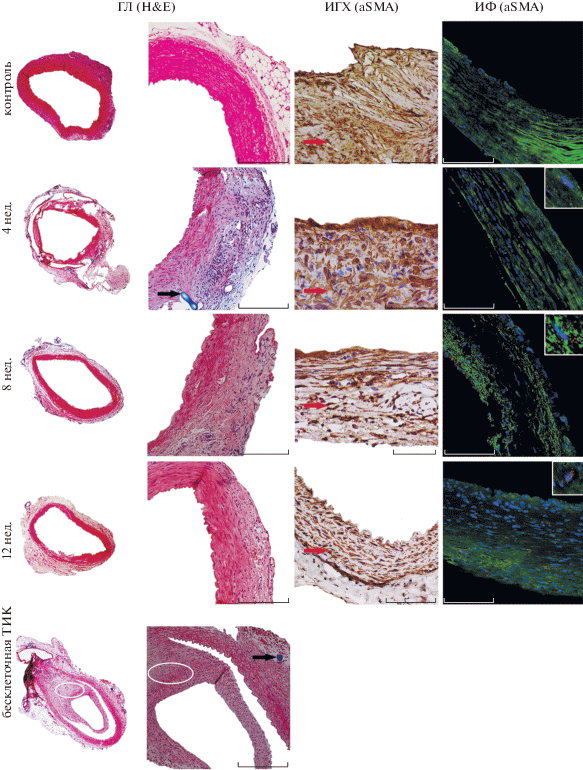
С помощью иммуногистохимического анализа была показана тенденция к постепенному упорядочиванию гладкомышечных волокон в стенке реконструированных сосудов от раннего (4 нед.) к позднему (12 нед.) сроку имплантации ТИК по сравнению с контрольным бесклеточным нео-сосудом (рис. 4). Наличие материала ТИК в адвентиции со слабой воспалительной инфильтрацией одиночными гистиоцитами, эпителиоидными клетками и гигантскими многоядерными клетками подтверждалось визуально. Последующий анализ с помощью конфокальной микроскопии продемонстрировал, что после 12-недельного периода присутствие клеток, помеченных наночастицами и дополнительно окрашенных на α-SMA, выявляется в толще и на всем протяжении ТИК (рис. 4).
Полиэстер является широко используемым синтетическим материалом для реконструкции сосудов малого калибра благодаря его превосходной биосовместимости и подходящей механической прочности (Gao, 2016; Bouchet et al., 2019). Известно, что максимальный модуль упругости составляет приблизительно 130 МПа для вен и 17 МПа для артерий человека (Donovan et al., 1990; Porter et al., 1993), а прочность на разрыв у вен составляет около 6.5 МПа, у артерий это значение несколько ниже (Stegemann et al., 2007). Значения прочности и устойчивости к деформации приготовленной трубчатой матрицы на основе ПКЛ были значительно выше, чем у нативных кровеносных сосудов, что указывает на возможность ее применения в качестве биорезорбируемого сосудистого трансплантата (табл. 1). Однако у разработанных in vitro сосудистых трансплантатов малого диаметра на основе биодеградируемых полимеров после имплантации часто возникают различные осложнения (стеноз, гиперплазия интимы, кальцификации трансплантата и т.д.).
Долгосрочная проходимость ТИК малого диаметра продолжает оставаться одной из главных проблем в области исследований сердечно-сосудистый ткани из-за возникновения тромбоза. Один из подходов к снижению тромбогенности синтетических материалов, хотя и с ограниченным успехом, основан на покрытии просветной поверхности каркаса антикоагулянтами (Devine et al., 2001; Ren et al., 2015). Другой стратегией повышения биосовместимости трансплантата и снижения риска осложнений является заселение трансплантата клетками сосуда (Cui et al., 2019; Generali et al., 2019). Многообещающим источником клеток, благодаря простоте выделения, культивирования, а также их способности индуцировать эндотелиолизацию (Arias et al., 2018; Hassan et al., 2018) являются ГМ-клетки сосудов.
Представленное исследование продемонстрировало возможность применения аллогенных ГМ-клеток, заселенных в трубчатую матрицу на основе ПКЛ, индуцировать миграцию аутологичного эндотелия в условиях in vivo. Данные гистологического анализа подтвердили, что просвет ТИК, заселенной ГМ-клетками, был полностью покрыт монослоем эндотелия уже через 4 нед. после операции, а также биоинтеграцию и хорошую проходимость по сравнению с бесклеточной (рис. 4). Можно предполагать, что миграция аутологичных клеток эндотелия в раннем послеоперационном периоде предотвращает образование тромбоза в ТИК (рис. 4). Ранее в нескольких исследованиях сообщалось об антикоагулянтных свойствах эндотелиальных клеток, которые способствуют регуляции гемостаза (van Hinsbergh et al., 2012; Yau et al., 2015).
Полученные биомеханические свойства заселенной клетками ПКЛ-матрицы можно сравнить с результатами, полученными в исследованиях, в которых ГМ-клетки использовали для заселения децеллюляризированного (Neff et al., 2011) или синтетического (Cheng et al., 2008) скаффолда. Скорость резорбции ПКЛ-матрицы не превышала скорости пролиферации клеток внутри нее в течение периода наблюдения, что позволяет предположить возможное использование этой матрицы для генерации нео-сосудов с хорошей долгосрочной проходимостью. Интересно, что помеченные наночастицами ГМ-клетки обнаруживали на протяжении всей ТИК в течение анализируемого периода длительностью 12 нед. (рис. 4), что может указывать на участие этих клеток в формировании стенок нео-сосудов, а также в индуцировании миграции эндотелия по внутреннему просвету трансплантата.
Полученные данные свидетельствуют о возможности использовать аллогенные ГМ-клетки сосуда для конструирования сосудистых ТИК и демонстрируют успешное использование клеточной ТИК, приготовленной на основе биодеградируемого полиэфирного полимера ПКЛ.
Список литературы
Acland R. 1972. Signs of patency in small vessel anastomosis. Surgery. V. 72. P. 744.
Arias S.L., Shetty A., Devorkin J., Allain J.P. 2018. Magnetic targeting of smooth muscle cells in vitro using a magnetic bacterial cellulose to improve cell retention in tissue-engineering vascular grafts. Acta Biomater. V. 77. P. 172.
Aussel N.B., Thebaud X., Berard V., Brizzi V., Delmond S., Bareille R., Siadous R., James C., Ripoche J., Durand M., Montembault A., Burdin B., Letourneur D., Heureux N.L., David L., Bordenave L. 2017. Chitosan-based hydrogels for developing a small-diameter vascular graft: in vitro and in vivo evaluation. Biomed. Mater. V. 12. https://doi.org/10.1088/1748-605X/aa78d0
Bingcheng Y., Yanbing S., Tang H., Wang X., Zhang Y. 2020. Stiffness of the aligned fibers affects structural and functional integrity of the oriented endothelial cells. Acta Biomater. https://doi.org/10.1016/j.actbio.2020.03.022
Bouchet M., Gauthier M., Maire M., Ajji A., Lerouge S. 2019. Towards compliant small-diameter vascular grafts: predictive analytical model and experiments. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 100. P. 715.
Catto V., Fare S., Cattaneo I., Figliuzzi M., Alessandrino A., Freddi G., Remuzzi A., Tanzi, M.C. 2015. Small diameter electrospun silk fibroin vascular grafts: Mechanical properties, in vitro biodegradability, and in vivo biocompatibility. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 54. P. 101.
Cheng S.T., Chen Z.F., Chen G.Q. 2008. The expression of cross-linked elastin by rabbit blood vessel smooth muscle cells cultured in polyhydroxyalkanoate scaffolds. Biomaterials. V. 29(31). P. 4187–4194.
Cui H., Zhu W., Huang Y., Liu C., Yu Z., Nowick, M., Miao S., Cheng Y., Zhou X., Lee S., Zhou Y., Wang S., Mohiuddin M., Horvath K., Zhang L.G. 2019. In vitro and in vivo evaluation of 3D bioprinted small-diameter vasculature with smooth muscle and endothelium. Biofabrication. V. 12. https://dx.doi.org/10.1088%2F1758-5090%2Fab402c
De Valence S., Tille J.-Ch., Mugnai D., Mrowczynski W., Gurny R., Moller M., Walpoth B.H. 2012. Long term performance of polycaprolactone vascular grafts in a rat abdominal aorta replacement model. Biomaterials. V. 33. P. 38.
Devine C., Hons B., McCollum C. 2001. Heparin-bonded dacron or polytetrafluoroethylene for femoropopliteal bypass grafting: A multicenter trial. J. Vasc. Surg. V. 33. P. 533.
Dharmashankar K., Widlansky M.E. 2010. Vascular endothelial function and hypertension: Insights and directions. Cur. Hypertens. Rep. V. 12. P. 448.
Donovan D.L., Schmidt S.P., Townshend S.P., Njus G.O., Sharp W.V. 1990. Material and structural characterization of human saphenous vein. J. Vas. Surg. V. 12. P. 531.
Fukunishi T., Best C.A., Sugiura T., Shoji T., Yi T., Udelsman B., Hibino N. 2016. Tissue-engineered small diameter arterial vascular grafts from cell-free nanofiber pcl/chitosan scaffolds in a sheep model. PLoS One. V. 11. P. e0158555. https://doi.org/10.1371/journal.pone.0158555
Gao C. 2016. Polymeric biomaterials for tissue regeneration. From surface/interface design 3D constructs. https://www.springer.com/gp/book/9789811022920
Generali M., Casanova E.A., Kehl D., Wanner D., Hoerstrup S.P., Cinelli P., Weber B. 2019. Autologous endothelialized small-caliber vascular grafts engineered from blood-derived induced pluripotent stem cells. Acta Biomater. V. 97. P. 333.
Hassan G.S., Jacques D., D’Orleans-Juste P., Magder S., Bkaily G. 2018. Physical contact between human vascular endothelial and smooth muscle cells modulates cytosolic and nuclear calcium homeostasis. Can. J. Physiol. Pharmacol. V. 96. P. 655.
Hibino N., McConnell P., Shinoka T., Malik M., Galantowicz M. 2015. Preliminary experience in the use of an extracellular matrix (CorMatrix) as a tube graft: Word of caution. Semin. Thorac. Cardiovasc. Surg. V. 27. P. 288.
Hoch E., Tovar G.E., Borchers K. 2014. Bioprinting of artificial blood vessels: Current approaches towards a demanding goal. Eur. J. Cardiothorac. Surg. V. 46. P. 767.
Li S., Sengupta D., Chien S. 2014. Vascular tissue engineering: from in vitro to in situ. Wiley Interdiscip. Rev. Syst. Biol. Med. V. 6. P. 61.
Mehta R.I., Mukherjee A.K., Patterson T.D., Fishbein M.C. 2011. Pathology of explanted polytetrafluoroethylene vascular grafts. Cardiovasc. Pathol. V. 20. P. 213.
Mel A., Jell G., Stevens M.M., Seifalian A.M. 2008. Biofunctionalization of biomaterials for accelerated in situ endothelialization: A review. Biomacromolecules. V. 9. P. 2969.
Neff L.P., Tillman B.W., Yazdani S.K., Machingal M.A., Yoo J.J., Soker S., Christ G.J. 2011. Vascular smooth muscle enhances functionality of tissue-engineered blood vessels in vivo. J. Vasc. Surg. V. 53. P. 426.
Negishi J., Hashimoto Y., Yamashita A., Zhang Y., Kimura T., Kishida A., Funamoto S. 2017. Evaluation of small-diameter vascular grafts reconstructed from decellularized aorta sheets. J. Biomed. Mater. Res. A. V. 105. P. 1293.
Pashneh-Tala S., MacNeil S., Claeyssens F. 2015. The tissue-engineered vascular graft-past, present, and future. Tissue Eng. Part B. Rev. V. 22.P. 68.
Porter T.R., Taylor D.O., Fields J., Cycan A., Akosah K., Mohanty P.K., Pandian N.G. 1993. Direct in vivo evaluation of pulmonary arterial pathology in chronic congestive heart failure with catheter-based intravascular ultrasound imaging. Am. J. Cardiol. V. 71. P. 754.
Radke D., Jia W., Sharma D., Fena K., Wang G., Goldman J., Zhao F. 2018. Tissue engineering at the blood-contacting surface: a review of challenges and strategies in vascular graft development. Adv. Healthcare Mater. https://doi.org/10.1002/adhm.201701461
Ren X., Feng Y., Guo J., Wang H., Li Q., Yang J., Li W. 2015. Correction: Surface modification and endothelialization of biomaterials as potential scaffolds for vascular tissue engineering applications. Chem. Soc. Rev. V. 44. P. 5745.
Rosellini E., Vozzi G., Barbani N., Giusti P., Cristallini C. 2010. Three-dimensional microfabricated scaffolds with cardiac extracellular matrix-like architecture Int. J. Artif. Organs. V. 33. P. 885.
Shevtsov M.A., Nikolaev B.P., Ryzhov V.A., Yakovleva L.Y., Dobrodumov A.V., Marchenko Y.Y., Guzhova I.V. 2015. Brain tumor magnetic targeting and biodistribution of superparamagnetic iron oxide nanoparticles linked with 70-kDa heat shock protein study by nonlinear longitudinal response. J. Magn. Magn. Mater. V. 388. P. 123.
Song H.J., Xue W.J., Li Y., Tian X.H., Song Y., Ding X.M., Li Z.L. 2009. Improved islet survival and function with rat endothelial cells in vitro co-culture. Transpl. P. V. 41. P. 4302.
Stegemann J.P., Kaszuba S.N., Rowe S.L. 2007. Review: Advances in vascular tissue engineering using protein-based biomaterials. Tissue Eng. V. 13. P. 2601.
Stekelenburg M., Rutten MC, Snoeckx H.E.H., Baaijens F.P. 2008. Dynamic straining combined with fibrin gel cell seeding improves strength of tissue-engineered small-diameter vascular grafts. Tissue Eng. Part A. V. 15. P. 1081.
Stowell C.E.T., Wang Y. 2018. Quickening: Translational design of resorbable synthetic vascular grafts. Biomaterials. V. 173. P. 71.
Van Hinsbergh V.W. 2012. Endothelium-role in regulation of coagulation and inflammation. Semin. Immunopathol. V. 34. P. 93.
Wang W., Xu X., Li Z., Kratz K., Ma N., Lendlein A. 2019. Modulating human mesenchymal stem cells using poly(n-butyl acrylate) networks in vitro with elasticity matching human arteries. Clin. Hemorheol. Microcirc. V. 71. P. 277.
Wilson H.K., Canfield S.G., Shusta E.V., Palecek S.P. 2014. Concise review: Tissue-specific microvascular endothelial cells derived from human pluripotent stem cells. Stem Cells. V. 32. P. 3037.
Xu S., Lu F., Cheng L., Li C., Zhou X., Wu Y., Qi Z. 2017. Preparation and characterization of small-diameter decellularized scaffolds for vascular tissue engineering in an animal model. Biomed. Eng. Online. V. 16. https://doi.org/10.1186/s12938-017-0344-9
Yau J.W., Teoh H., Verma S. 2015. Endothelial cell control of thrombosis. BMC Cardiovasc. Disord. V. 15. P. 130.
Yudintceva N.M., Bogolubova I.O., Muraviov A.N., Sheykhov M.G., Vinogradova T.I., Sokolovich E.G., Shevtsov M.A. 2018. Application of the allogenic mesenchymal stem cells in the therapy of the bladder tuberculosis. J. Tiss. Eng. Regen. Med. V. 12. P. e1580. .https://doi.org/10.1002/term.2583
Zhao Q., Cui H., Wang J., Chen H., Wang Y., Zhanget L., Wang M. 2018. Regulation effects of biomimetic hybrid scaffolds on vascular endothelium remodeling of biomimetic hybrid scaffolds on vascular endothelium Remodeling. ACS Appl. Mater. Interfaces. V. 10. P. 23583.
Дополнительные материалы отсутствуют.


