Цитология, 2021, T. 63, № 4, стр. 309-321
Перспективные технологии 3D биопечати
Д. В. Леонов 1, *, Ю. А. Спирина 1, А. А. Яценко 1, В. А. Кушнарев 2, Е. М. Устинов 1, С. В. Баранников 1
1 Амурская государственная медицинская академия Министерства здравоохранения Российской Федерации
675006 Благовещенск, Россия
2 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова Министерства здравоохранения Российской Федерации
191124 Санкт-Петербург, Песочный, Россия
* E-mail: d.leonov1998@gmail.com
Поступила в редакцию 13.03.2021
После доработки 12.04.2021
Принята к публикации 13.04.2021
Аннотация
В обзоре рассмотрены семь наиболее перспективных для тканевой инженерии технологий трехмерной печати: струйная, экструзионная, лазерная, стереолитографическая, 4D-печать, томографическая печать, цифровая световая печать (digital light processing). Проанализированы возможности и недостатки методик, механизмы их работы. Приведены примеры успешных тканеинженерных разработок, выполненных этими методами биопечати.
В настоящее время во всем мире существует острая проблема нехватки органов для трансплантологии. По данным Федерального научного центра трансплантологии и искусственных органов им. академика В.И. Шумакова (Москва) в 2019 г. было выполнено 1473 пересадки почек, 584 пересадки печени, 25 трансплантаций легких, 337 пересадок сердца. При этом в листе ожидания в настоящее время находятся 9500 пациентов (https://vademec.ru/news/2020/03/19/ kolichestvo-transplantatsiy-organov-v-2019-vyroslo-na-11/).
По данным Министерства здравоохранения и социальных служб США (MoHSS) за 2019 г. было проведено около 11900 трансплантаций. Этот показатель является одним из самых высоких по числу трансплантаций во всем мире, однако потребность составляет около 113000 трансплантаций (https:// optn.transplant.hrsa.gov/news/organ-donation-again-sets-record-in-2019/). Для операции по трансплантации характерна проблема совместимости, например, необходимо учитывать гистосовместимость тканей, а для непарных органов трудно найти донора. Одним из решений этих проблем является 3D-биопечать.
Биопечать – технология аддитивного производства, которая позволяет создавать сложные трехмерные тканеинженерные конструкции, используя биоматериалы в качестве микросреды для живых клеток, за короткое время. Одним из наиболее важных составляющих биопечати являются биочернила. Биочернила – это комбинация из биополимерных гелей (жидкой фазы) и живых клеток, используемая для печати трехмерных тканевых структур. Они содержат как малодифференцированные мультипотентные мезенхимные стромальные клетки (ММСК), так и дифференцированные, например, фибробласты, кератиноциты, гепатоциты и т.д. (Ong et al., 2018; Hong et al., 2018). В качестве жидкой фазы используют биополимеры, такие как желатин, коллаген, агароза и др. (Xia et al., 2018). Выбор метода печати базируется не только на скорости и выживаемости клеток, а также на разрешающей способности. Разрешающая способность представляет собой размер самой маленькой детали, которую может напечатать принтер в одном слое.
В настоящее время существуют различные технологии биопечати. Самая простая из них – экструзионная печать (Lee, Yeong, 2016), при которой создание объекта происходит послойно снизу-вверх с помощью одной печатающей головки.
К более сложным технологиям относятся томографическая печать (Kelly et al., 2017), когда объект печатается с помощью луча света определенной длины волны, который полимеризует фотополимер; при этом объект воссоздается без разделения на слои, что позволяет создавать более сложные и в тоже время более прочные трехмерные конструкции (Bernal et al., 2019). Эта биотехнология имеет большие перспективы в фармацевтической промышленности, поскольку является одним из наиболее быстрых сегодня способов создания клеточного продукта (Hong et al., 2018), на котором можно исследовать лекарственные препараты (Lawrence et al., 2015). Помимо этого, биопечать позволяет создавать трехмерные опухолевые тканеинженерные конструкции (Knowlton et al., 2015). Такие тканевые аналоги позволят более точно подбирать и корректировать тактику противоопухолевой терапии (Lv et al., 2017).
В настоящее время существует большое количество технологий 3D-биопечати и их модификаций, но не все они показали себя одинаково эффективно. Среди множества статей сложно выделить ключевую информацию об эффективности того или иного вида биопечати. Поэтому мы решили осветить важные аспекты современных методик биопечати в представленной обзорной работе, в которой рассматриваются семь наиболее перспективных технологий трехмерной печати для создания сложных тканеинженерных структур.
К основным технологиям относятся струйная, экструзионная, лазерная, стереолитографическая и 4D-печать, а также их модификации: томографическая печать и цифровая световая печать (digital light processing), преимущества, недостатки и другие характеристики которых описаны в табл. 1.
Таблица 1.
Сравнительный анализ технологий биопечати
| Технология 3D-печати | Преимущество | Недостатки | Разрешение, мкм | Скорость печати |
Выживаемость клеток, % | Источ-ника |
|---|---|---|---|---|---|---|
| Струйная | Низкая стоимость, простота в эксплуатации | Ограниченность в выборе биочернил, низкая выживаемость клеток | 5–50 | 150 кап/мин | 85 | [1 ] |
| Экструзионная | Высокая выживаемость клеток, простота в эксплуата-ции, низкая стоимость | Низкая скорость печати | 5–100 | 10–50 мкм/с | >95 | [2 ] |
| Лазерная | Высокая скорость печати, возможность печати высоковязкими биочернилами | Фото-механическое повреждение клеток при печати, высокая стоимость | >50 | 200–1600 мм/с | 85–95 | [3 ] |
| Стереолитографическая | Высокая скорость печати, возможность создания сложных трехмерных структур | Канцерогенное влияние на клетки при печати, ограниченность в выборе материалов | 20 | 100 мкм/с– 1000 мм/с | 90 | [4, 5 ] |
| Цифровая световая (digital light processing) | Очень высокая скорость | Высокая цена, ограниченность в выборе материалов | 10–100 | 30–100 см/ч по оси Z |
90–95 | [6, 7 ] |
| Томографическая | Очень высокая скорость, бесшовная печать | Высокая стоимость и сложность в эксплуатации | 16–33 | 1–2 мм2/с | 80–90 | [8,9, 10 ] |
| 4D-биопечать | Возможность создания сложных трехмерных конструкций, | Ограниченность в выборе материалов, высокая цена | — | — | — | [11 ] |
СТРУЙНАЯ БИОПЕЧАТЬ
Первый биопринтер был разработан на основе модифицированного коммерческого струйного принтера, однако у него имелись технические ограничения, которые заключались в небольшом размере сопла и низкой выживаемости клеток. Вскоре после этого был создан полноценный 3D-биопринтер (Bishop et al., 2017).
Существуют две технологии печати: термическая и пьезоэлектрическая. Принцип работы данных технологий можно увидеть на рис. 1. В первом случае в экструдере располагается нагревательный элемент, при работе которого происходит быстрое локальное повышение температуры до 300°C в течение нескольких микросекунд. Вследствие этого появляются пузырьки газа, которые вытесняют капли из сопла. Во второй технологии используется пьезоэлектрические кристаллы, которые расширяются и сжимаются под действием переменного тока. Благодаря этому создается повышенное давление (Li et al., 2016), печать происходит капельно, послойно снизу вверх (Ma et al., 2018).
Рис. 1.
Схема работы струйной печати. а – Термическая модель; давление создается нагревающимися пластинами. б – Пьезоэлектрическая модель; давление создается благодаря кристаллам, которые расширяются под действием тока (адаптировано из: Derakhshanfar et al., 2018).
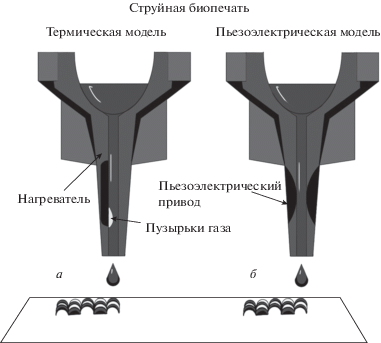
Эта технология позволяет производить печать несколькими печатающими головками с разными типами клеток, что делает возможным создание многокомпонентных тканей с достаточно высокой скоростью (1–10 000 капель/с) (Hong at al., 2018). Выживаемость клеток составляет 85% (Angelopoulos et al., 2019). Разрешающая способность составляет 5–50 мкм (Hong et al., 2018). Еще одним преимуществом является низкая цена по сравнению с конкурентами (Cui et al., 2012).
Небольшие размеры сопла не позволяют использовать биочернила с высокой вязкостью (>15 Па с), а также с высокой плотностью клеток (>1 × 106 кл./мл) (Guillotin et al., 2010; Pepper et al., 2011). Все это приводит к недостаточной механической прочности и накладывает ограничение на создание сложных трехмерных тканеподобных структур (Angelopoulos et al., 2019).
Несмотря на это, существуют примеры создания многокомпонентных систем с помощью данной технологии. Например, были созданы искусственная ткань сердца, способная сокращаться в ответ на электрические импульсы (Xu et al., 2009), нервная (Li et al., 2018) и костная (Gao et al., 2014) ткани. Патаки и его команда (Pataky et al., 2012) смогли создать разветвленную сосудистую сеть. Они использовали альгинат натрия в качестве биочернил, который печатался на подложку из пропитанного кальцием желатина, после их взаимодействия альгинат полимеризовался и приобретал форму капли. Это позволило преодолеть естественную склонность гидрогелей распространяться и объединяться. С помощью этой технологии смогли создать модель пигментированной кожи полной толщины (Min et al., 2017). Для этого авторы напечатали дермальный слой в виде нескольких слоев гидрогеля с фибробластами, после чего послойно наносили меланоциты и кератиноциты. Спустя 4 сут на границе разделения фаз воздух−жидкость появился пигмент.
ЭКСТРУЗИОННАЯ ПЕЧАТЬ
Экструзионная печать может выполнять широкий спектр задач, поскольку позволяет применять гидрогели различной вязкости (6—30 × 107 Па с) (Derakhshanfar et al., 2018). Для печати могут быть использованы как органические естественные материалы – коллаген (Wu et al., 2016), желатин (Jia et al., 2016), хитозан (Gu et al., 2017), альгинат (Tabriz et al., 2015), так и материалы, имеющие синтетическую природу – полиэтиленгликоль (Ashammakhi et al., 2019), метакрилат (Chen et al., 2012), полилактат (Brigham et al., 2009).
В экструзионной печати существуют 3 основных подхода. Наглядно данные подходы изображены в виде схем на рис. 2. На рис. 2а изображен пневматический метод, в котором сжатый воздух нагнетается с помощью специального насоса. Из-за того, что система нагнетает воздух из окружающей среды, он должен проходить через ряд фильтров для обеспечения стерильности. Также такой подход наиболее хорош при работе с гидрогелем низкой вязкости (Ozbolat et al., 2016).
Рис. 2.
Схема подходов экструзионной печати. а – Пневматический, давление обеспечивается за счет сжатого воздуха. б, в – Поршневой и винтовой соответственно, выталкивание биочернила происходит под действием механического давления (адаптировано из: Derakhshanfar et al., 2018).
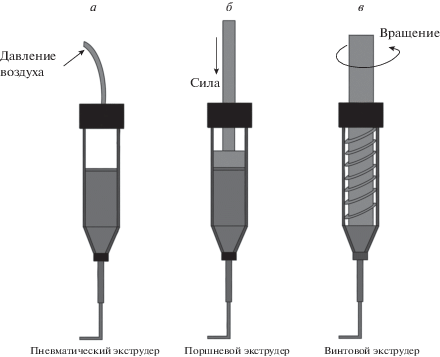
Поршневой и винтовой способ (рис. 2б, в) основаны на давлении на гидрогель вертикальной и вращательной механической силой соответственно. Оба способа обеспечивают высокую разрешающую способность печати и возможность использования более вязких гидрогелей. Принтеры, использующие одновременно эти два метода, имеют большую стоимость, а также сложны в обслуживании и стерилизации.
Благодаря непрерывности печати обеспечивается наличие большого числа клеток в скаффолде и выживаемость клеток составляет более 95%. Из недостатков этой технологии можно выделить низкую скорость печати, которая находится в диапазоне от 10 до 50 мкм/с (Murphy, Atala, 2014; Zhu et al., 2016). В среднем разрешающая способность 100 мкм (Miri et al., 2019), но существуют данные о разрешающей способности до 5 мкм (Ozbolat et al., 2016). Благодаря своим преимуществам технология экструзионной печати показывает хорошие результаты при создании тканей с простой микроструктурой по типу хрящей и костей (Tao et al., 2017).
Существует несколько успешных модификаций данной технологии. Так, разработан 3D-принтер (Liu et al., 2017), печатающий семью биочернилами одновременно. Экструдер состоит из нескольких капилляров, подсоединенных к резервуарам с биочернилами. Переключение между резервуарами происходит быстро и плавно, что позволяет программно комбинировать потоки биочернил. С помощью данного подхода удалось напечатать многокомпонентную сердечную органоподобную структуру.
Другие авторы (Rocca et al., 2018) напечатали сердце, почку и другие сложные трехмерные объекты в микромасштабе благодаря печатающей головке, которая имеет несколько сопел. Точное дозирование альгината удалось достичь программно. Помимо этого, во время печати используется ванна, наполненная Pluronic F127 (PF-127), который обладает обратимыми свойствами фазового перехода золь–гель при различных температурах благодаря образованию мицелл. При температуре 37°С гидрогель затвердевал и выступал в качестве поддержки для печатаемого объекта. Когда орган был напечатан, гидрогель охлаждали до 4°С для его сжижения и извлечения объекта.
ЛАЗЕРНАЯ ПЕЧАТЬ
Лазерная биопечать основана на двух технологиях: прямая лазерная запись (laser direct-write) (Mandrycky et al., 2016) и лазерно-индуцированный перенос (laser-induced transfer) (Duocastella et al., 2007). Оба метода позволяют печатать в жидкой и твердой фазе.
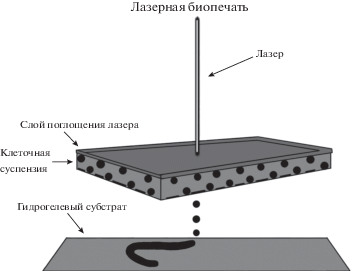
Лазерный принтер состоит из следующих частей: лазерная установка, абсорбирующая пластинка и подложка, на которую попадают осажденные капли (Ma et al., 2018). Абсорбирующая пластинка имеет две части: энергопоглощающую пластинку из титана (Ali et al., 2014) или золота (Barron et al., 2004) и биочернила.
На рис. 3 представлен принцип работы лазерного 3D биопринтера. Во время печати луч с длиной волны 325 нм действует на верхний слой пластины – слой поглощения лазера. Это приводит к локальному наносекундному нагреву его поверхности с образованием на внутренней стороне энергопоглощающего слоя пузырька воздуха. Благодаря этому происходит локальное повышение давления, вследствие чего биочернила с клеточной суспензией переносятся с пластинки на подложку – гидрогелевый субстрат (Arcaute et al., 2011).
Рис. 3.
Схема лазерной печати, нагревание абсорбирующей пластинки лазером (адаптировано из: Tasoglu et al., 2013).
Отличительной особенностью этого способа является отсутствие механического контакта между биочернилами и лучом. Это ведет к высокой выживаемости клеток (85–95%) (Mandrycky et al., 2016) и скорости печати (200–1600 мм/с) (Hong et al., 2018). Вдобавок эта технология позволяет печатать высоковязкими биочернилами (1–300 Па с) (Guillemot et al., 2010). Разрешающая способность составляет более 50 мкм (Guillotin et al., 2010).
Недостатком метода является малое количество исследований о воздействии энергии лазерного излучения на клетки. Существуют статьи, указывающие на то, что быстрое локальное нагревание, вызванное лучом света, является основным поражающим фактором для них (Barron et al., 2005; Lin et al., 2010). Для решения этой проблемы были использованы фемтосекундные лазеры с целью сокращения негативного влияния. Однако дальнейшие исследования показали, что это решение только увеличило летальность клеток, что связано с более интенсивным фотомеханическим воздействием (Hopp et al., 2012).
В настоящее время существует малое количество принтеров с лазерной печатью, что обусловлено сложностью производства этих устройств, а также их стоимостью. Исходя из этого, исследователи больше сконцентрированы не на создании новых принтеров, а на исследовании корреляции между параметрами лазера, такими как длина волны, интенсивность и время импульса с качеством конечных образцов (Duan et al., 2013; Duarte Campos et al., 2013).
Используя мезенхимные стволовые клетки для создания трансплантата с последующей дифференцировкой в адипоциты, удалось показать, что лазерная печать не влияет на пролиферативную и дифференциальную активность мезенхимных стволовых клеток (Gruene et al., 2011). Другие авторы смогли создать разветвленную сосудистую сеть при помощи комбинации эндотелиальных и мезенхимных стволовых клеток (Kérourédan et al., 2019) В этом случае клетки печатали на коллаген первого типа, после чего на них помещали еще один слой коллагена вместе со стволовыми клетками апикального сосочка.
СТЕРЕОЛИТОГРАФИЧЕСКАЯ ПЕЧАТЬ
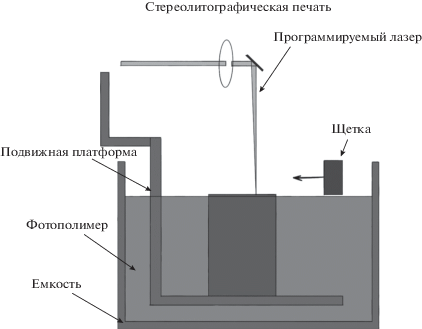
Эта печать является модификацией фотолитографии. На рис. 4 представлены основные компоненты стереолитографического 3D биопринтера. Биопечать осуществляется с использованием фотополимеризующихся гидрогелей, которые находятся в емкости на движущейся платформе, внутри емкости находится столик на подвижной платформе. С помощью программируемого лазера подается свет определенного спектра, что инициирует сшивание фотополимера (Vijayavenkataraman et al., 2018). Для печати объекта используются трехмерные модели, которые загружаются в компьютер. После полимеризации первого слоя щетка удаляет лишний фотополимер с верхней поверхности напечатанного объекта, затем платформа вместе с емкостью опускается на одну ступень ниже. Так послойно формируется трехмерный объект (Wang et al., 2018). Высота ступеней может быть 5–20 мкм. Кроме того, существуют модели принтеров с инвертированным столиком и излучателем света (Tamay et al., 2019).
Рис. 4.
Схема стереолитографической печати. Скаффолд создается в результате взаимодействия света определенной длины волны и фотополимера (адаптировано из: Tamay et al., 2019).
В стереолитографической печати скорость и жесткость сшивки гидрогеля зависит от концентрации фотоинициаторов: чем выше концентрация, тем прочнее и быстрее сшивка (Knowlton et al., 2017). Но в то же время высокая концентрация фотоинициаторов обладает выраженным цитотоксичным действием (Sabnis et al., 2009). Существует два основных фотоинициатора: иргакур (Irgacure) 2959 для ультрафиолетовой сшивки и эозин Y для видимого света (Mondschein et al., 2017). Более цитотоксическим является иргакур 2959 (Mondschein et al., 2017). Ультрафиолетовое излучение во время печати оказывает повреждающее действие на ДНК (Ikehata, Ono, 2011). Исходя из этого, большинство исследователей предпочитают использовать луч света с видимым спектром излучения.
Основным преимуществом стереолитографической печати является ее скорость (100 мкм/с– 1000 мм/с), поскольку печать всего слоя происходит одновременно. Разрешающая способность в среднем составляет 20 мкм (Pirlo et al., 2012). Выживаемость – более 90% (Catros et al., 2011). Благодаря инвертированному столику и печати сверху вниз становится возможным создавать сложную трехмерную архитектонику. Основным недостатком является ограничение в выборе гидрогелей, сложность и дороговизна 3D-биопринтеров.
Стереолитографию применяют для изготовления сложных и нестандартных по форме каркасов для лицевой хирургии на основе снимков компьютерной томографии. В качестве материала для каркаса авторы используют бета-трикальцийфосфатколлаген, что позволяет делать каркасы прочными при низкой цене производства (Scalera et al., 2014).
С помощью стереолитографического принтера и собственной разработки смогли напечатать гидрогелевые скелетные мышцы, которые являются частью мини-роботов bio-bots (Cvetkovic et al., 2014). Bio-bots могли совершать движения с максимальной скоростью ~156 мкм/с, что превышает 1.5 длины тела за 1 мин. Ученые исследовали влияние белков внеклеточного матрикса, коллагена I типа, фибрина и инсулиноподобного фактора роста на силу сокращения напечатанных скелетных мышц. Им удалось достичь улучшения способности генерировать силу и функциональные характеристики этой сконструированной ткани, дифференцируя мышечные полоски в оптимизированной среде ECM на основе фибрина с добавлением фактора роста IGF-1.
ЦИФРОВАЯ СВЕТОВАЯ ПЕЧАТЬ
Эта печать (digital light processing) является одной из разновидностей стереолитографической печати. Компьютерная программа управляет интенсивностью света с помощью цифрового микрозеркального устройства − DMD-чипа (DMD – digital micro-mirror device) (Hribar et al., 2014). На рис. 5 представлена схема работы цифрового светового 3D биопринтера, где ключевую роль играет DMD-чип. Он состоит из двух миллионов микрозеркал, способных менять свое положение независимо друг от друга (Zhu et al., 2016). Печать происходит послойно снизу-вверх с помощью двух тысяч световых точек.
Рис. 5.
Схема цифровой световой печати (digital light processing). Печать осуществляется с помощью двух тысяч световых точек, под действием которых биочернила полимеризуются (адаптировано из: Ma et al., 2018).
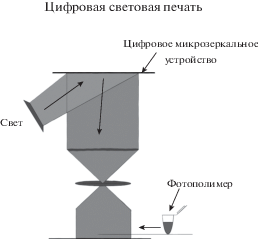
Наиболее часто используют свет видимого спектра для уменьшения цитотоксичности (Lim et al., 2018). В качестве биочернил могут быть использованы различные фотополимеры с диапазоном вязкости 1–2000 Па ⋅ с, к ним относятся полиэтиленгликольдиакрилат (PEGDA), глицидилметакрилат-гиалуроновая кислота (GMHA) (Cui et al., 2018) и желатин-метакрилат (GelMA). Последний обладает низкой цитотоксичностью и способен полимеризоваться от видимого спектра, ввиду чего его выбор в качестве биочернил является предпочтительным (Lim et al., 2018).
Скорость печати при этой технологии выражается в см/ч по оси Z, так как объект полимеризуется по всей площади. Скорость печати с высоким разрешением менее 100 мкм составляет 30 см/ч по оси Z, при более низкой разрешающей способности достигается скорость в 100 см/ч по оси Z. Разрешающая способность составляет 10–100 мкм. Выживаемость клеток – 90–95%. В силу отсутствия сопел исключается возможность их засорения. Образец получается бесшовным, что увеличивает его прочность и позволяет создавать более сложную архитектонику (Tamay et al., 2019).
Недостатками является сложное устройство принтера, из-за чего увеличивается его стоимость, а также трудность обслуживания. Цитотоксическое влияние фотополимеров и фотомеханическое действие света отрицательно сказываются на выживаемости клеток (Tamay et al., 2019).
Несколько лет назад удалось создать органоподобную ткань печени (Ma et al., 2016). Модель представляла собой группу печеночных долек, состоящих из гепатоцитов, которые были получены из индуцированных стволовых клеток, эндотелиальных клеток, а также мезенхимных клеток. Исследователи использовали два гидрогеля: желатин метакрилат (GelMA) и глицидную метакрилат-гиалуроновую кислоту (GMHA) в соотношении 1 : 1. Размер долек был приближен к физиологичным. Печать происходила в два этапа: вначале наносились гепатоциты с 5%-ной GMHA, затем – эндотелиальные и мезенхимные клетки с 2.5%-ной и 1%-ной GMHA соответственно.
ТОМОГРАФИЧЕСКАЯ 3D-ПЕЧАТЬ
За основу взят принцип компьютерной томографии. Для начала создается модель на компьютере, после чего объект разделяют на множество проекций (вокселизация). Затем набор проекций от 0° до 360° рассчитывается с использованием алгоритма Радона для достижения кумулятивного эффекта при печати. Схематично процесс создания объекта во время томографической 3D биопечати представлен на рис. 6а. Точное вычисление набора проекций с применением фильтра Рам-Лака позволяет рассчитать оптимальное распределение излучения. Фильтр также позволяет компенсировать эффект размытия, свойственный проекциям (Brett et al., 2019).
Рис. 6.
Схемы процесса томографической 3D-печати (а) и устройства томографического 3D-биопринтера (б). Создание объекта происходит с помощью комплекса линз, преломляющих свет, для печати в разных проекциях. б – адаптировано из: Brett et al., 2019.
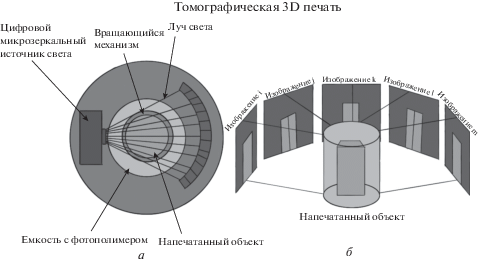
Механизм печати происходит следующим образом. Оптическая установка состоит из шести лазерных диодов с длиной волны 405 нм. Диоды объединены в один луч с помощью линзы. Луч выходит из волокна, проходит через асферическую линзу и проецируются на цифровое микрозеркальное устройство. Затем луч проходит через цилиндрическую стеклянную емкость, содержащую фотополимер. Вогнутая цилиндрическая линза, расположенная в непосредственной близости от флакона, исправляет искажение, вызванное цилиндрической поверхностью раздела флакона (Bernal et al., 2019). Общий план строения томографического 3D биопринтера представлен на рис. 6б.
Когда все пиксели на цифровом микрозеркальном устройстве находятся в состоянии “Вкл”, мощность светового луча, направляемого во флакон, составляет приблизительно 1.6 Вт (Bernal et al., 2019).
Скорость печати зависит от вязкости фотополимера. В среднем объект в несколько квадратных сантиметров печатается менее 30 с с максимальной скоростью ~1–2 мм2/с. Выживаемость клеток составляет 80–90%. Разрешающая способность – 16–33 мкм (Bernal et al., 2019). Модель печатается полностью одновременно, что позволяет создавать трехмерные конструкции со сложной архитектоникой и большим количеством полостей.
Эта технология имеет большинство стандартных недостатков для принтеров, основанных на фотолитографии. Основным недостатком является сложность компьютерных программ для принтера и сложность его устройства (Loterie et al., 2018).
4D-БИОПЕЧАТЬ
Основная задача этого подхода – решить проблемы, с которыми не справляется стандартная 3D-биопечать. К ним относится создание сложных полых конструкций по типу разветвленной сосудистой сети с мелкими капиллярами. Помимо этого, печать стандартными методами не может обеспечить рост и пролиферацию клеток в центре сложных трехмерных структур (Gao et al., 2016).
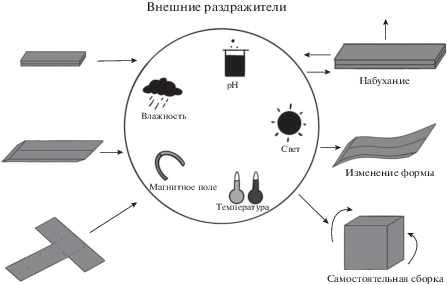
4D-биопечать позволяет создавать конструкции, которые меняют свою форму или функции со временем или под действием внешней стимуляции, такой как тепло, влажность, свет, магнитное поле или величина pH. Для печати используют умные материалы (smart materials) (Gao et al., 2016), которые могут собираться (Kirillova et al., 2017), раскладываться (Ionov, 2018) и имеют хотя бы один из таких свойств, как память формы, самопроизвольное срабатывание и др. (Kokkinis et al., 2015). Основные типы стимулов и ответов на них умных материалов представлены на рис. 7.
Рис. 7.
Типы стимулов и ответов, наблюдаемых в умных материалах (адаптировано из: Tamay et al., 2019).
В качестве примера 4D-биопечати приведем мультисомы, которые в основном представляют собой водные капли, заключенные в масло (1,2-дифитаноил-sn-глицеро-3-фосфохолин). Печать таких мультисом в воде заставляет водные капли прилипать друг к другу, образуя бислои, в которых заключенные в каплю компоненты высвобождаются при изменении величины рН или температуры (Villar et al., 2011). В будущем продукты печати могут использовать в малоинвазивных операциях, с возможностью самостоятельной сборки до необходимой формы внутри организма человека.
Из графена и гидрогеля был изготовлен гибридный электроактивный скаффолд (Servant et al., 2014). Авторы этой работы сначала создали пластинки из графена путем его молекулярного взаимодействия с меламином. Затем был создан гибридный гидрогель из метакриловой кислоты и N,N'-метиленбисакриламида, а также инициатора пероксодисульфата калия. После чего в гидрогель были добавлены графеновые пластины (0.2 мг/мл), размером от 100 нм до 1 мкм. Эти электроактивные скаффолды демонстрируют пульсирующее высвобождение лекарственного средства при напряжении электрического поля постоянного тока 10 В (Servant et al., 2014).
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
На основе проанализированной литературы по технологиям 3D-биопринтинга мы можем сделать вывод, что данные технологии будут играть важную роль в области ортопедии, регенеративной медицины и тканевой инженерии. В будущем биопринтинг будет использоваться для создания многофункциональных объектов и устройств, включая имплантаты, которые будут имитировать биологические функции, а также реагировать на меняющиеся внешние раздражители.
Уже сегодня существуют проекты, которым удалось создать модели костной, эпителиальной, мышечной ткани in vitro (Mandrycky et al., 2016). Данные модели схожи с тканями организма, благодаря чему они позволяют проводить доклинические исследования лекарственных молекул. Несмотря на это имеется ряд нерешенных проблем, таких как создание разветвленных сосудистых сетей и сложных многокомпонентных тканей. По этой причине пока невозможно создание полноценных органов для трансплантации (Huang et al., 2017). Кроме того, сейчас отсутствует возможность печати клеточного продукта непосредственно на месте раны.
Из представленного краткого обзора можно сделать вывод о том, что для различных потребностей необходимы различные технологии изготовления. Поэтому большинство современных разработок сосредоточены на объединении технологий для оптимизации процесса создания тканеподобных структур и ликвидации существующих у недостатков у каждой из них.
Список литературы
Ali M., Pages E., Ducom A., Fontaine A., Guillemot F. 2014. Controlling laser-induced jet formation for bioprinting mesenchymal stem cells with high viability and high resolution. Biofabrication. V. 6. P. 045001. https://doi.org/10.1088/1758-5082/6/4/045001
Angelopoulos I., Allenby M.C., Lim M., Zamorano M. 2019. Engineering inkjet bioprinting processes toward translational therapies. Biotechnol. Bioeng. V. 117. P. 272. https://doi.org/10.1002/bit.27176
Arcaute K., Mann B.K., Wicker R.B. 2011. Fabrication of off-the-shelf multilumen poly (ethylene glycol) nerve guidance conduits using stereolithography. Tiss. Eng. Part C Methods. V. 17. P. 27. https://doi.org/10.1089/ten.TEC.2010.0011
Ashammakhi N., Ahadian S., Xu C., Montazerian H., Ko H., Nasiri R., Barros N., Khademhosseini A. 2019. Bioinks and bioprinting technologies to make heterogeneous and biomimetic tissue constructs. Mater. Today Bio. V. 1. P. 100 008. https://doi.org/10.1016/j.mtbio.2019.100008
Au A.K., Lee W., Folch A. 2014. Mail-order microfluidics: evaluation of stereolithography for the production of microfluidic devices. Lab. Chip. V. 14. P. 1294. https://doi.org/10.1039/c3lc51360b
Barron J.A., Krizman D.B., Ringeisen B.R. 2005. Laser printing of single cells: Statistical analysis, cell viability, and stress. Ann. Biomed. Eng. V. 33. P. 121. https://doi.org/10.1007/s10439-005-8971-x
Barron J.A., Rosen R., Jones-Meehan J., Spargo B.J., Belkin S., Ringeisen B.R. 2004. Biological laser printing of genetically modified Escherichia coli for biosensor applications. Biosens. Bioelectron. V. 20. P. 246. https://doi.org/10.1016/j.bios.2004.01.011
Bernal P. N., Delrot P., Loterie D., Li Y., Malda J., Moser C., Levato R. 2019. Volumetric bioprinting of complex living-tissue constructs within seconds. Adv. Mater. V. 31. P. 1 904 209. https://doi.org/10.1002/adma.201904209
Bishop E.S., Mostafa S., Pakvasa M., Luu H.H., Lee M.J., Wolf J.M., Ameer G.A., He T.C., Reid R.R. 2017. 3D bioprinting technologies in tissue engineering and regenerative medicine: Current and future trends. Genes Dis. V. 4. P.185. https://doi.org/10.1016/j.gendis.2017.10.002
Brett K., Indrasen B., Hossein H., Maxim S., Christopher S., Hayden T. 2019. Volumetric additive manufacturing via tomographic reconstruction. Science. 363. V. 363. P. 1075. https://doi.org/10.1126/science.aau7114
Brigham M.D., Bick A., Lo E., Bendali A., Burdick J.A., Khademhosseini A. 2009. Mechanically robust and bioadhesive collagen and photocrosslinkable hyaluronic acid semi-interpenetrating networks. Tiss. Eng. A. V. 15. P. 1645. https://doi.org/10.1089/ten.tea.2008.0441
Catros S., Fricain J. C., Guillotin B., Pippenger B., Bareille R., Remy M., Lebraud E., Desbat B., Amédée J., Guillemot F. 2011. Laser-assisted bioprinting for creating on-demand patterns of human osteoprogenitor cells and nano-hydroxyapatite. Biofabrication. V. 3. P. 025001. https://doi.org/10.1088/1758-5082/3/2/025001
Chen Y.C., Lin R.Z., Qi H., Yang Y., Bae H., Melero-Martin J.M., Khademhosseini A. 2012. Functional human vascular network generated in photocrosslinkable gelatin methacrylate hydrogels. Adv. Funct. Mater. V. 22. P. 2027. https://doi.org/10.1002/adfm.201101662
Cui H., Miao S., Esworthy T., Zhou X., Lee S. J., Liu C., Yu Z.X., Fisher J. P., Mohiuddin M., Zhang L. G. 2018. 3D bioprinting for cardiovascular regeneration and pharmacology. Adv. Drug Deliv. Rev. V. 132 P. 252. https://doi.org/10.1016/j.addr.2018.07.014
Cui X., Breitenkamp K., Finn M.G., Lotz M., D’Lima D.D. 2012. Direct human cartilage repair using three-dimensional bioprinting technology. Tiss. Eng. A. V. 18. P. 1304. https://doi.org/10.1089/ten.TEA.2011.0543
Cvetkovic C., Raman R., Chan V., Williams B.J., Tolish M., Bajaj P., Sakar M.S., Asada H.H., Saif M.T.A., Bashir R. 2014. Three-dimensionally printed biological machines powered by skeletal muscle. Proc. Natl. Acad. Sci. US V. 111. P. 10 125. https://doi.org/10.1073/pnas.1401577111
Derakhshanfar S., Mbeleck R., Xu K., Zhang X., Zhong W., Xing M. 2018. 3D bioprinting for biomedical devices and tissue engineering: A review of recent trends and advances. Bioact. Mater. V. 3. P. 144. https://doi.org/10.1016/j.bioactmat.2017.11.008
Duan B., Hockaday L. A., Kang K. H., Butcher J. T. 2013. 3D bioprinting of heterogeneous aortic valve conduits with alginate/gelatin hydrogels. J. Biomed. Mater. Res. A. V. 101. P. 1255. https://doi.org/10.1002/jbm.a.34420
Duarte Campos D. F., Blaeser A., Weber M., Jäkel J., Neuss S., Jahnen-Dechent W., Fischer, H. 2013. Three-dimensional printing of stem cell-laden hydrogels submerged in a hydrophobic high-density fluid. Biofabrication. V. 5. P. 015 003. https://doi.org/10.1088/1758-5082/5/1/015003
Duocastella M., Colina M., Fernández-Pradas J.M., Serra P., Morenza J.L. 2007. Study of the laser-induced forward transfer of liquids for laser bioprinting. Appl. Surf. Sci. V. 253. P. 7855. https://doi.org/10.1016/j.apsusc.2007.02.097
Gao B., Yang Q., Zhao X., Jin G., Ma Y., Xu F. 2016. 4D Bioprinting for biomedical applications. Trends Biotechnol. V. 34. P. 746. https://doi.org/10.1016/j.tibtech.2016.03.004
Gao G., Schilling A.F., Yonezawa T., Wang J., Dai G., Cui X. 2014. Bioactive nanoparticles stimulate bone tissue formation in bioprinted three-dimensional scaffold and human mesenchymal stem cells. Biotechnol. J. V. 9. P. 1304. https://doi.org/10.1002/biot.201400305
Gruene M., Pflaum M., Deiwick A., Koch L., Schlie S., Unger C., Wilhelmi M., Haverich A., Chichkov B. N. 2011. Adipogenic differentiation of laser-printed 3D tissue grafts consisting of human adipose-derived stem cells. Biofabrication. V. 3. P. 015 005. https://doi.org/10.1088/1758-5082/3/1/015005
Gu Q., Tomaskovic-Crook E., Wallace G.G., Crook J.M. 2017. 3D Bioprinting human induced pluripotent stem cell constructs for in situ cell proliferation and successive multilineage differentiation. Adv. Healthc. Mater. V. 6. P. 10.1002. https://doi.org/10.1002/adhm.201700175
Guillemot F., Souquet A., Catros S., Guillotin B., Lopez J., Faucon M., Pippenger B., Bareille R., Rémy M., Bellance S., Chabassier P., Fricain J.C., Amédée J. 2010. High-throughput laser printing of cells and biomaterials for tissue engineering. Acta Biomater. V. 6. P. 2494. https://doi.org/10.1016/j.actbio.2009.09.029
Guillotin B., Souquet A., Catros S., Duocastella M., Pippenger B., Bellance S., Bareille R., Rémy M., Bordenave L., Amédée J., Guillemot F. 2010. Laser assisted bioprinting of engineered tissue with high cell density and microscale organization. Biomaterials. V. 31. P. 7250. https://doi.org/10.1016/j.biomaterials.2010.05.055
Hong N., Yang G.H., Lee J., Kim G. 2018. 3D bioprinting and its in vivo applications. Biomed. Mater. Res. B Appl. Biomater. V. 106. P. 444. https://doi.org/10.1002/jbm.b.33826
Hopp B., Smausz T., Szabó G., Kolozsvari L., Nogradi A., Kafetzopoulos D., Fotakis C. 2012. Femtosecond laser printing of living cells using absorbing film-assisted laser-induced forward transfer. Optical Engineering. V. 51. P. 014 302. https://doi.org/10.1117/1.OE.51.1.014302
Hribar K. C., Soman P., Warner J., Chung P., Chen S. 2014. Light-assisted direct-write of 3D functional biomaterials. Lab. Chip. V. 14. P. 268. https://doi.org/10.1039/c3lc50634g
Huang Y., Zhang X.F., Gao G., Yonezawa T., Cui X. 2017. 3D bioprinting and the current applications in tissue engineering. Biotechnol. J. V. 12. P. 1 600 734. https://doi.org/10.1002/biot.201600734
Ikehata H., Ono T. 2011. The mechanisms of UV mutagenesis. J. Radiat. Res. V. 52. P. 115. https://doi.org/10.1269/jrr.10175
Ionov L. 2018. 4D biofabrication: Materials, methods, and applications. Adv. Healthc Mater. V. 7. P. 1800412. https://doi.org/10.1002/adhm.201800412
Jia W., Gungor-Ozkerim P.S., Zhang Y.S., Yue K., Zhu K., Liu W., Pi Q., Byambaa B., Dokmeci M.R., Shin S.R., Khademhosseini A. 2016. Direct 3D bioprinting of perfusable vascular constructs using a blend bioink. Biomaterials. V. 106. P. 58. https://doi.org/10.1016/j.biomaterials.2016.07.038
Kelly B., Bhattacharya I., Heidari H., Shusteff M., Spadaccini C., Taylor H. 2019. Volumetric additive manufacturing via tomographic reconstruction. Science. V. 363. https://doi.org/10.1126/science.aau7114
Kelly B., Bhattacharya I., Shusteff M., Taylor H., Spadaccini C. 2017. “Computed axial lithography (CAL) for rapid volumetric 3D additive manufacturing” in solid freeform fabrication. Proc. 28th Annual Int.Solid Freeform Fabrication Symposium (University of Texas at Austin), P. 938.
Kérourédan O., Bourget J. M., Rémy M., Crauste-Manciet S., Kalisky J., Catros S., Thébaud N. B., Devillard R. 2019. Micropatterning of endothelial cells to create a capillary-like network with defined architecture by laser-assisted bioprinting. J. Mater. Sci. Mater. Med. V. 30. P. 28. https://doi.org/10.1007/s10856-019-6230-1
Kirillova A., Maxson R., Stoychev G., Gomillion C.T., Ionov L. 2017. 4D biofabrication using shape-morphing hydrogels. Adv. Mater. V. 29. P. 1 703 443. https://doi.org/10.1002/adma.201703443
Knowlton S., Onal S., Yu C.H., Zhao J.J., Tasoglu S. 2015. Bioprinting for cancer research. Trends Biotechnol. V. 33. P. 504. https://doi.org/10.1016/j.tibtech.2015.06.007
Knowlton S., Yenilmez B., Anand S., Tasoglu S. 2017. Photocrosslinking-based bioprinting: examining crosslinking schemes. Bioprinting. V. 5. P. 10.https://doi.org/10.1016/j.bprint.2017.03.001
Kokkinis D., Schaffner M., Studart A.R. 2015. Multimaterial magnetically assisted 3D printing of composite materials. Na.t Commun. V. 6. P. 8643. https://doi.org/10.1038/ncomms9643
Kolesky D.B., Homan K.A., Skylar-Scott M.A., Lewis J.A. 2016. Three-dimensional bioprinting of thick vascularized tissues. Proc. Natl. Acad. Sci. USA. V. 113. P. 3179. https://doi.org/10.1073/pnas.1521342113
Lawrence J., Cameron D., Argyle D. 2015. Species differences in tumour responses to cancer chemotherapy. Philos. Trans. R. Soc. Lond. B Biol. Sci. V. 370. P. 1673. https://doi.org/10.1098/rstb.2014.0233
Lee J.M., Yeong W.Y. 2016. Design and printing strategies in 3D bioprinting of cell-hydrogels: A review. Adv. Healthc. Mater. V. 5. P. 2856. https://doi.org/10.1002/adhm.201600435
Li J., Chen M., Fan X., Zhou H. 2016. Recent advances in bioprinting techniques: approaches, applications and future prospects. J. Transl. Med. V. 14. P. 271. https://doi.org/10.1186/s12967-016-1028-0
Li X., Chen J., Liu B., Wang X., Ren D., Xu T. 2018. Inkjet printing for biofabrication. In: Ovsianikov A., Yoo J., Mironov V. (Eds.). 3D Printing and Biofabrication. Ref. Series Biomed. Eng. https://doi.org/10.1007/978-3-319-45444-3_26
Ligon S.C., Liska R., Stampfl J., Gurr M., Mülhaupt R. 2017. Polymers for 3D printing and customized additive manufacturing. Chem. Rev. V. 117. P.10212. https://doi.org/10.1021/acs.chemrev.7b00074
Lim K.S., Levato R., Costa P.F., Castilho M.D., Alcala-Orozco C.R., van Dorenmalen K., Melchels F., Gawlitta D., Hooper G.J., Malda J., Woodfield T. 2018. Bio-resin for high resolution lithography-based biofabrication of complex cell-laden constructs. Biofabrication. V. 10. P. 034101. https://doi.org/10.1088/1758-5090/aac00c
Lin Y., Huang G., Huang Y., Tzeng T., Chrisey D. 2010. Effect of laser fluence in laser-assisted direct writing of human colon cell. Rapid Prototyping J. V. 16. P. 202. https://doi.org/10.1108/13552541011034870
Liu W., Zhang Y.S., Heinrich M.A., De Ferrari F., Jang H.L., Bakht S.M., Alvarez M.M., Yang J., Li Y.C., Trujillo-de Santiago G., Miri A.K., Zhu K., Khoshakhlagh P., Prakash G., Cheng H., Guan X., Zhong Z. et al. 2017. Rapid continuous multimaterial extrusion bioprinting. Adv. Mater. V. 29. P. 10.1002. https://doi.org/10.1002/adma.201604630
Loterie D., Delrot P., Moser C. 2018. Volumetric 3D printing of elastomers by tomographic back-projections. Preprint. https://doi.org/10.13140/RG.2.2.20027.46889
Lv D., Hu Z., Lu L., Lu H., Xu X. 2017. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncol. Lett. V. 14. P. 6999. https://doi.org/10.3892/ol.2017.7134
Ma X., Liu J., Zhu W., Tang M., Lawrence N., Yu C., Gou M., Chen S. 2018. 3D bioprinting of functional tissue models for personalized drug screening and in vitro disease modeling. Adv. Drug Deliv. Rev. V. 132. P. 235. https://doi.org/10.1016/j.addr.2018.06.011
Ma X., Qu X., Zhu W., Li Y. S., Yuan S., Zhang H., Liu J., Wang P., Lai C. S., Zanella F., Feng G. S., Sheikh F., Chien S., Chen S. 2016. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting. Proc. Natl. Acad. Sci. USA. V. 113. P. 2206. https://doi.org/10.1073/pnas.1524510113
Mandrycky C., Wang Z., Kim K., Kim D.H. 2016. 3D bioprinting for engineering complex tissues. Biotechnol. Adv. V. 34. P. 422. https://doi.org/10.1016/j.biotechadv.2015.12.011
Rocca M., Fragasso A., Liu W., Heinrich M.A., Zhang Y.S. 2018. Embedded multimaterial extrusion bioprinting. SLAS Technol. V. 23. P. 154. https://doi.org/10.1177/2472630317742071
Matsusaki M., Sakaue K., Kadowaki K., Akashi M. 2013. Three-dimensional human tissue chips fabricated by rapid and automatic inkjet cell printing. Adv. Healthc. Mater. V. 2. P. 534. https://doi.org/10.1002/adhm.201200299
Min D., Lee W., Bae I.H., Lee T.R., Croce P., Yoo S.S. 2017. Bioprinting of biomimetic skin containing melanocytes. Exper. Dermatol. V. 27. P. 453. https://doi.org/10.1111/exd.13376
Miri A.K, Mostafavi E., Khorsandi D., Hu S.K., Malpica M., Khademhosseini A. 2019. Bioprinters for organs-on-chips. Biofabrication. V. 11. P. 042002. https://doi.org/10.1088/1758-5090/ab2798
Mondschein R.J., Kanitkar A., Williams C.B., Verbridge S.S., Long T.E. 2017. Polymer structure-property requirements for stereolithographic 3D printing of soft tissue engineering scaffolds. Biomaterials. V. 140. P. 170. https://doi.org/10.1016/j.biomaterials.2017.06.005
Murphy S.V., Atala A. 2014. 3D bioprinting of tissues and organs. Nat. Biotechnol. V. 32. P. 773. https://doi.org/10.1038/nbt.2958
Ong C.S., Yesantharao P., Huang C.Y., Mattson G., Boktor J., Fukunishi T., Zhang H., Hibino N. 2018. 3D bioprinting using stem cells. Pediatr. Res. V. 83. P. 223. https://doi.org/10.1038/pr.2017.252
Ozbolat I.T., Hospodiuk M. 2016. Current advances and future perspectives in extrusion-based bioprinting. Biomaterials. V. 76. P. 321. https://doi.org/10.1016/j.biomaterials.2015.10.076
Pataky K., Braschler T., Negro A., Renaud P., Lutolf M.P., Brugger J. 2012. Microdrop printing of hydrogel bioinks into 3D tissue-like geometries. Adv. Mater. V. 24. P. 391. https://doi.org/10.1002/adma.201102800
Pepper M.E., Seshadri V., Burg T., Booth B.W., Burg K.J., Groff R.E. 2011. Cell settling effects on a thermal inkjet bioprinter. Annu. Int. Conf. IEEE Eng. Med. Biol. Soc. V. 2011. P. 3609. https://doi.org/10.1109/IEMBS.2011.6090605
Pirlo R. K., Wu P., Liu J., Ringeisen B. 2012. PLGA/hydrogel biopapers as a stackable substrate for printing HUVEC networks via BioLP. Biotechnol. Bioeng. V. 109. P. 262. https://doi.org/10.1002/bit.23295
Sabnis A., Rahimi M., Chapman C., Nguyen K. T. 2009. Cytocompatibility studies of an in situ photopolymerized thermoresponsive hydrogel nanoparticle system using human aortic smooth muscle cells. J. Biomed. Mater. Res. A. V. 91. P. 52. https://doi.org/10.1002/jbm.a.32194
Scalera F., Corcione C. E., Montagna F., Sannino A., Maffezzoli A. 2014. Development and characterization of UV curable epoxy/hydroxyapatite suspensions for stereolithography applied to bone tissue engineering. Ceram. Int. V. 40. P. 15 455. https://doi.org/10.1016/j.ceramint.2014.06.117
Servant A., Leon V., Jasim D., Methven L., Limousin P., Fernandez-Pacheco E.V., Prato M., Kostarelos K. 2014. Graphene-based electroresponsive scaffolds as polymeric implants for on-demand drug delivery. Adv. Healthc. Mater. V. 3. P. 1334. https://doi.org/10.1002/adhm.201400016
Tabriz A.G., Hermida M.A., Leslie N.R., Shu W. 2015. Three-dimensional bioprinting of complex cell laden alginate hydrogel structures. Biofabrication. V. 7. P. 045012. https://doi.org/10.1088/1758-5090/7/4/045012
Tamay D. G., Dursun Usal T., Alagoz A. S., Yucel D., Hasirci N., Hasirci V. 2019. 3D and 4D printing of polymers for tissue engineering applications. Front. Bioeng. Biotechnol. V. 7. P. 164. https://doi.org/10.3389/fbioe.2019.00164
Tao J., Hu Y., Wang S., Zhang J., Liu X., Gou Z., Cheng H., Liu Q., Zhang Q., You S., Gou M. 2017. A 3D-engineered porous conduit for peripheral nerve repair. Sci. Rep. V. 7. P. 46 038. https://doi.org/10.1038/srep46038
Tasoglu S., Gurkan U. A., Wang S., Demirci U. 2013. Manipulating biological agents and cells in micro-scale volumes for applications in medicine. Chem. Soc. Rev. V. 42. P. 5788. https://doi.org/10.1039/c3cs60042d
Vijayavenkataraman S., Yan W. C., Lu W. F., Wang C. H., Fuh J. 2018. 3D bioprinting of tissues and organs for regenerative medicine. Adv. Drug Deliv. Rev. V. 132. P. 296. https://doi.org/10.1016/j.addr.2018.07.004
Villar G., Heron A.J., Bayley H. 2011. Formation of droplet networks that function in aqueous environments. Nat. Nanotechnol. V. 6. P. 803. https://doi.org/10.1038/nnano.2011.183
Wang Z., Kumar H., Tian Z., Jin X., Holzman J. F., Menard F., Kim K. 2018. Visible light photoinitiation of cell-adhesive gelatin methacryloyl hydrogels for stereolithography 3D bioprinting. ACS Appl. Mater. Interfaces. V. 10. P. 26 859. https://doi.org/10.1021/acsami.8b06607
Wu Z., Su X., Xu Y., Kong B., Sun W., Mi S. 2016. Bioprinting three-dimensional cell-laden tissue constructs with controllable degradation. Sci. Rep. V. 6. P. 24 474. https://doi.org/10.1038/srep24474
Xia Z., Jin, S., Ye K. 2018. Tissue and organ 3D bioprinting. SLAS Technol.: Translating Life Sci. Innov. V. 23. P 301. https://doi.org/10.1177/2472630318760515
Xu T., Baicu C., Aho M., Zile M., Boland T. 2009. Fabrication and characterization of bio-engineered cardiac pseudo tissues. Biofabrication. V. 1. P. 035001 https://doi.org/10.1088/1758-5082/1/3/035001
Zhu W., Ma X., Gou M., Mei D., Zhang K., Chen S. 2016. 3D printing of functional biomaterials for tissue engineering. Curr. Opin. Biotechnol. V. 40. P. 103. https://doi.org/10.1016/j.copbio.2016.03.014
Дополнительные материалы отсутствуют.
Инструменты
Цитология


