Цитология, 2021, T. 63, № 4, стр. 398-402
Повреждения средней кишки медоносной пчелы ноземой
Е. К. Еськов 1, *, М. Д. Еськова 1, А. С. Роженков 1, Е. В. Шестакова 1
1 Аналитическая лаборатория экологического мониторинга Российского государственного
аграрного заочного университета
143900 Балашиха, Московской обл, Россия
* E-mail: ekeskov@yandex.ru
Поступила в редакцию 21.04.2021
После доработки 30.05.2021
Принята к публикации 08.06.2021
Аннотация
К тенденции массовой гибели пчелиных семей, наметившейся в последние годы, имеет отношение заражение пчел микроспоридиями Nosema apis Zander (1909). Эти одноклеточные организмы, проникнув в желудочно-кишечный тракт, разрушают слизистую оболочку средней кишки, что проявляется в деградации эпителиальных клеток. За счет выраженного внутриклеточного отека эпителиоциты слизистой оболочки увеличиваются в объеме, приобретая округло-овальную форму, а в цитоплазме появляется характерная базофильная зернистость. При этом исчезают пищеварительные вакуоли, ядра клеток становятся гипер-хромными и отчасти пикнотическими. Камбиальные клетки в желудке больных пчел визуально не выявляются, а перитрофическая мембрана утрачивается. Отмечается неравномерность длины пищеварительных желез, что обуславливается десквамацией и преждевременной гибелью секреторных клеток. Деструкция эпителиальных клеток средней кишки и утрата перитрофической оболочки приводит к значительному снижению эффективности или полной утрате трофической функции, что приводит к гибели пчел от голода.
В последние годы во всем мире отмечается массовая гибель пчелиных семей (“коллапс пчел”). Причины их гибели не имеют убедительного объяснения (Currie et al., 2010; Dainat et al., 2012; Ильясов и др., 2017). В качестве наиболее вероятных причин рассматривается техногенное загрязнение, включающее электромагнитные излучения и токсичные химические вещества (Еськов, Еськова, 2019), а также патогенное воздействие экзо- и эндогенных паразитов (Сотников, Гробов, 2003).
Возрастающую угрозу для медоносной пчелы Apis mellifera L. (1758) представляет нозематоз. Его вызывают одноклеточные организмы (протисты), родственные грибам (Eckert et al., 2008), – микроспоридии вида Nosema apis Zander (1909) и Nozema ceranae, паразитирующие в эпителиальных клетках средней кишки взрослых рабочих пчел, маток и трутней. Заражение насекомых происходит спорами паразита. Споры N. apis поступают в пищеварительный тракт с кормом и, оказавшись в средней кишке, проникают в клетки, где и проходит полный цикл развития паразита. N. apis, разрушая клетки желудка пчел, приводит к понижению жизнеспособности и (или) гибели всей пчелиной семьи (Гробов, Лихотин, 2003; Fries, 1993). Помимо пчел, микроспоридии, обладая широким видовым разнообразием, паразитируют на животных многих других видов, относящихся к разным таксономическим группам (Соколова, 2009).
В задачу настоящего исследования входило изучение гистологических изменений стенки средней кишки медоносных пчел, зараженных N. apis, поскольку именно нарушения функций пищеварительной системы влияют на жизнеспособность пчелиных семей.
МАТЕРИАЛ И МЕТОДИКА
Исследования выполняли в конце весны–начале лета 2020 г. на двух генетически сходных группах пчел, каждая из которых содержала по пять семей. В одной группе находились здоровые семьи, в другой больные нозематозом. Косвенным признаком, указывавшим на то, что семьи второй группы больны нозематозом, являлось наличие множества пятен экскрементов на стенках ульев и сотах.
Поскольку диарея могла быть связана с потреблением некачественного корма, для уточнения причины диареи и выявления спор ноземы, от каждой семьи отбирали по 30 пчел. У каждой пчелы извлекали пищеварительный тракт, отделяли среднюю кишку и растирали ее с небольшим количество воды в чашке Петри. Полученную каплю суспензии наносили на предметное стекло, накрывали покровным стеклом и проводили микроскопический анализ при 400-кратном увеличении в слегка затененном поле (Макаров, 2010). Признаком заражения пчелы N. apis являлось наличие в гомогенате средней кишки спор овальной формы.
Для гистологического исследования средней кишки (желудка) у здоровых пчел и пчел, пораженных N. apis, извлекали желудочно-кишечный тракт и вычленяли из него среднюю кишку (желудок). Материал помещали в кассеты для гистологической проводки, раздельно фиксировали в 10%-ном нейтральном формалине в течение 24 ч, а затем 2 ч промывали в дистиллированной воде. Зафиксированный и промытый от формалина материал при комнатной температуре дегидратировали в водных растворах этилового спирта возрастающей концентрации, обеспечивая постоянное перемешивание растворов в автоматизированной системе гистологической проводки Chandon Citadel 2000. Затем препараты пропитывали парафином в том же автоматическом гистологическом процессоре.
Пропитанные парафином части средней кишки помещали в металлические формы для изготовления парафиновых блоков, заливали жидким парафином и прижимали кассетой, после чего материал охлаждался до комнатной температуры. Из полученных таким способом парафиновых блоков с помощью ручного роторного микротома Accu-Cut Srm получали гистологические срезы толщиной 4 мкм. Депарафинирование, окраску гематоксилин-эозином и ламинирование защитной пленкой гистологических препаратов проводили в модульной автоматической системе Tissue-Tek Film.
Готовые гистологические препараты исследовали с помощью оптического микроскопа Leica DM 4000 B с объективами 20× и 40×, и окуляром 10×. Микросъемку проводили с помощью компьютерного приложения Leica Application Suite.
РЕЗУЛЬТАТЫ
В норме средняя кишка медоносной пчелы представляет собой полый складчатый орган, в стенке которого при гистологическом исследовании выделяются три структурно-функциональных отдела (рис. 1а): наружный мышечный слой, слизистая оболочка и перитрофическая мембрана (оболочка). Наружный слой образован поперечно-полосатой мышечной тканью (рис. 1а, 1), представленной клетками вытянутой формы с заметной поперечной исчерченностью. Клетки содержат по одному овальному ядру. Мышечные клетки, расположены слоями в кольцевом, косом и продольном направлениях.
Рис. 1.
Гистологическая организация стенки средней кишки пчел в норме и при поражении нозематозом. а – Гистологический препарат средней кишки здоровой пчелы. Обозначения: 1 – клетки мышечного слоя, 2 – пищеварительные вакуоли эпителиальных клеток, 3 – эпителиальные клетки слизистой оболочки, 4 – перитрофическая мембрана, 5 – мальпигиев сосуд. Ув. об.: 20×. б – Гистологический препарат средней кишки пчелы, пораженной нозематозом. Обозначения: 1 – набухшие эпителиальные клетки, со светлой цитоплазмой, содержащие споры Nozema apis, 2 – отсутствие перитрофической мембраны, 3 – поперечнополосатая мышечная клетка, 4 – гиперхромные и пикнотичные ядра эпителиальных клеток, 5 – увеличенный в объеме эпителиоцит слизистой оболочки со светлой зернистой цитоплазмой. Увел. об. 40×.
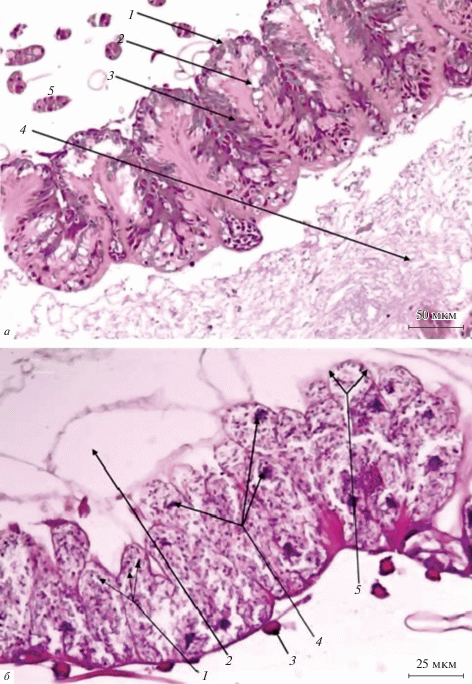
С внутренней стороны к мышечному слою прилегает неоднородная по клеточному составу слизистая оболочка (рис. 1а, 3), сужающаяся от передней к задней части кишки. Слизистая оболочка отделяется от мышечного слоя тонкой базальной мембраной, выполняющей опорную, трофическую, барьерную и другие функции.
Структурно-функциональной единицей слизистой оболочки является простая трубчатая железа, образованная одним слоем специализированного столбчатого (цилиндрического) эпителия. Большая его часть представлена секреторными светлыми вытянутыми клетками с нечеткими контурами, содержащими пищеварительные вакуоли (рис. 1а, 2). Более темные, базофильные, мелкие эпителиоциты, расположенные в базальных отделах железистых крипт, являются, вероятно, камбиальными клеточными элементами, способными к делению и дифференцировке в секреторные клетки.
Пищеварительная секреция осуществляется путем увеличения в размерах внутрицитоплазматических вакуолей, которые в дальнейшем сливаются между собой, образуя один или два крупных пузырька. Впоследствии, клеточная мембрана разрушается и секреторное содержимое, вместе с разрушенными частями клеток, попадает в просвет средней кишки.
Трофический субстрат, находящийся в желудке, обволакивает и отделяет от слизистой оболочки перитрофическая мембрана (рис. 1а, 4), предохраняющая эпителиоциты слизистой оболочки от разрушения. Она представляет собой слой слизи, включающей фрагменты разрушенных клеточных элементов, образовавшихся в результате голокриновой секреции. Через перитрофическую мембрану проникает пищеварительный секрет, а питательные вещества поступают к эпителиальному слою.
У пчел, пораженных N. apis, выраженные изменения происходят в пределах слизистой оболочки средней кишки и не затрагивают другие отделы пищеварительного тракта. На малых увеличениях наблюдается некоторое сглаживание складок кишечной стенки (рис. 1б), что возможно связано с выраженным внутриклеточным отеком и увеличением в объеме эпителиоцитов слизистой оболочки. Повышенная десквамация секреторных клеток, связанная с их ускоренной гибелью, приводит к возникновению неравномерности толщины слизистой оболочки. В некоторых участках отмечается отсутствие железистых крипт, вплоть до базальной мембраны. На больших увеличениях прослеживается изменение размеров секреторных клеток. Они увеличиваются в поперечном сечении (с 8–15 мкм в норме до 16–26 мкм при поражении ноземой). При этом в светлой, слабо эозинофильной цитоплазме обнаруживаются многочисленные округлые и овальные базофильные зерна размером от 1 до 5 мкм. Ядра эпителиоцитов выглядят гиперхромными, местами пикнотичными (рис. 1б, 4). Секреторных вакуолей в пораженных клетках не обнаруживается. Камбиальные клетки в слизистой оболочке желудков пчел, пораженных N. apis, визуально не определяются. В желудках таких пчел полностью утрачивается перитрофическая мембрана.
ОБСУЖДЕНИЕ
Споры ноземы, оказавшиеся в средней кишке пчелы, проникают в клетки путем прокола их оболочек и вступают во внутриклеточную фазу развития (Исси, Токарев,2002; Исси и др., 2005). Размножение N. apis в пораженных эпителиоцитах слизистой оболочки приводит к увеличению численности паразитов в цитоплазме, что порождает дегенеративно-дистрофические изменения в клетках и развитие внутриклеточного отека. Секреторные клетки увеличиваются в объеме, а цитоплазма на гистологических препаратах приобретает светлую, слабо эозинофильную окраску с наличием базофильных зерен округлой и овальной формы. На нарушение секреторной функции эпителоцитов указывает отсутствие пищеварительных вакуолей и перитрофической мембраны. В норме формирование перитрофической мембраны связано с секреторной функцией эпителиоцитов и последующей голокриновой секрецией. В клетках слизистой оболочки желудка пчелы, пораженной N. apis, секреторные процессы прекращаются. По этой причине перитрофическая мембрана не может формироваться и не обнаруживается на гистологических препаратах.
Деструкция перитрофической оболочки, выполняющей функцию фильтра, пропускающего к стенкам желудка продукты полного расщепления пищевых веществ – аминокислот, моносахаридов и др. (Peters, 1968; Тыщенко, 1976), нарушает трофическую функцию. Пчелы лишаются возможности потребления цветочной пыльцы – важного компонента, обеспечивающего их протеинами и липидами. Без этого пчелы не могут продуцировать маточное молочко, необходимое для выкармливания расплода (Асафова и др., 2001). Поэтому численность рабочих особей в семье, пораженной микроспоридиями N. apis, неуклонно уменьшается.
Продолжительность развития в организме пчелы одной генерации N. apis при благоприятной для них температуре (20–30°С) происходит за 3–4 сут (Buhlmann, 1998), а голодные пчелы выживают в течение 5–6 сут (Еськов, 1995), поэтому генерация паразитов успевает завершить развитие в живой пчеле. Образующиеся споры выделяются в окружающую среду с экскрементами. Интенсификации их выделения и распространения способствует диарея, стимулируемая N. apis.
Широкое распространение нозематоза, наряду с другими заболеваниями и загрязнением кормовых участков пчел токсическими элементами вносит свой вклад в отмечаемую в последние десятилетия массовую гибель пчелиных семей (Currie et al., 2010; Dainat et al., 2012; Ильясов и др., 2017). Уменьшение продолжительности жизни трутней и маток происходит отчасти под непосредственным воздействием N. apis и опосредованно – под влиянием заражения и снижение жизнеспособности рабочих пчел. У них нарушение пищеварения лишает возможности секреции маточного молочка, необходимого для выкармливания расплода всех трех каст медоносной пчелы. Связанное с этим недоразвитие маток и трутней отражается на снижении их жизнеспособности и воспроизводительной функции (Rhodes, 2011; Гулов и др., 2015). По причине физиологического недоразвития маток, выращенных в семьях больных нозематозам, их замена происходит в первые месяцы жизни (Anderson, 2004). Подобное явление отмечается, если матки на стадии куколки развиваются при пониженной температуре (Еськов, Торопцев, 1979).
На основании проведенных гистологических исследований установлено, что основная причина гибели пчел, зараженных N. apis, обуславливается деструкцией эпителиальных клеток средней кишки и утратой ею перитрофической оболочки, что приводит к нарушению пищеварения. Поэтому предлагаемые при нозематозе белково-углеводные подкормки пчелиных семей (Гробов, Лихотин, 2003) не могут иметь ни лечебного, ни профилактического значения. В отсутствии же эффективных лечебных препаратов пчеловодам остается лишь строго соблюдать профилактические меры – изолировать здоровые семьи от больных, заменять в них кормовые и расплодные соты на обеззараженные, дезинфицировать ульи и пчеловодный инвентарь. Вероятно, в некоторых критических ситуациях биологически целесообразно уничтожать семьи, сильно ослабленные прогрессирующей экспансией паразита.
Список литературы
Асафова Н.Н., Орлов Б.Н., Козин Р.Б. 2001. Физиологически активные продукты пчелиной семьи. Нижний Новгород: изд. Ю.А. Николаев. (Asafova N.N., Orlov B.N., Kozin R.B. 2001. Physiologically active products of the bee family. Nizhny Novgorod: ed. Yu.A. Nikolaev).
Гробов О.Ф., Лихотин А.К. 2003. Болезни и вредители пчел. М.: Мир. Колос. (Grobov O.F., Likhotin A.K. 2003. Diseases and pests of bees. M.: Mir. Kolos).
Гулов А.Н., Бородачев А.В., Березин А.С. 2015. Возраст трутней и качество спермы. Пчеловодство. № 9. С. 24. (Gulov A.N., Borodachev A.V., Berezin A.S. 2015. Drone age and sperm quality. Beekeeping. № 9. P. 24.)
Еськов Е.К. 1995. Экология медоносной пчелы. Рязань: Русское слово. (Eskov E.K. 1995. Ecology of the Honey Bee. Ryazan: Russian word).
Еськов Е.К. Еськова М.Д. 2019. Критические уровни накопления свинца и кадмия в теле пчел (Apis mellifera L.), модифицирующие их поведение. Успехи совр. биол. № 2. С. 178. (Eskov E.K. Eskova M.D. 2019. Critical levels of accumulation of lead and cadmium in the body of bees (Apis mellifera L.), modifying their behavior. Advances in Modern Boil. № 2. P. 178.)
Еськов Е.К., Торопцев А.И. 1978. Микроклимат пчелиного гнезда как фактор, влияющий на развитие маток. Журн. общ. биологии. Т. 39. № 2. С. 262. (Eskov E.K., Toroptsev A.I. 1978. Microclimate of a bee’s nest as a factor affecting the development of queens. Zhurn. Gen. Biology. Т. 39. № 2. P. 262.)
Ильясов Р.А., Поскряков А.В., Николенко А.Г. 2017. Семь причин смертности семей пчелы Apis mellifera в России. Пчеловодство. № 9. С. 10. (Ilyasov R.A., Poskryakov A.V., Nikolenko A.G. 2017. Seven causes of mortality of families of Apis mellifera bees in Russia. Beekeeping. № 9. P. 10.)
Исси, И.В., Токарев Ю.С. 2002. Влияние микроспоридий на гормональный баланс насекомых. Паразитология. Т. 36. С. 405. (Issi I.V., Tokarev Yu.S. 2002. Influence of microsporidia on the hormonal balance of insects. Parasitology. V. 36. Р. 405.)
Исси И.В, Долгих В.В., Соколова Ю.Я., Токарев Ю.С. 2005. Факторы патогенности микроспоридий – внутриклеточных паразитов насекомых. Вестн. сельскохозяйственной науки. № 3. С. 17 (Issi I.V., Dolgikh V.V., Sokolova Yu.Ya., Tokarev Yu.S. 2005. Factors of pathogenicity of microsporidia – intracellular parasites of insects. Bul. Agricult. Sci. № 3. P. 17.)
Макаров С.Г. 2010. Пораженность пчел варроатозом и нозематозом в Республике Марий Эл. Пчеловодство. № 8. С. 2. (Makarov S.G. 2010. Infestation of bees with varroatosis and nosematosis in the Republic of Mari El. Beekeeping. № 8. P. 2.)
Сотников А.Н., Гробов О.Ф. 2003. Причины гибели пчел. Пчеловодство. № 7. С. 30. (Sotnikov A.N., Grobov O.F. 2003. Causes of death of bees. Beekeeping. № 7. P. 30.)
Соколова Ю.Я. 2009. Происхождение микроспоридий и их положение в системе эукариот. Микол. и фитопатология. № 3. С. 177. (Sokolova Yu.Ya. 2009. The origin of microsporidia and their position in the eukaryotic system. Mycol. and Phytopathology. № 3. P. 177.)
Тыщенко В.П. 1976. Основы физиологии насекомых. Изд-во Ленинградского ун-та.
Anderson D.L. 2004. Improving queen bee production. Publication. No. 04/153, Rural Industries Research and Development Corporation. Canberra, Australia. 16 p.
Buhlmann G. 1998. Nosema. Schweiz. Bienen-Ztg. № 4. P. 177.
Currie R.W., Pernal S.F., Guzman-Novoa E. 2010. Honey bee colony losses in Canada. J. Apicult. Res. V. 49. P. 104.
Dainat B., Vanengelsdorp D., Neumann P. 2012. Colony collapse disorder in Europe. Env. Microbiol. Rep. V. 4. P. 123.
Eckert J., Friedhoff K.T., Zahner H., Deplazes P. 2008. Lehrbuch der parasitologie für die tiermedizin (German). 2nd Ed., Georg Thieme. 140 p.
Fries I. 1993. Nosema apis – a parasite in the honey bee colony. Bee World. V. 74. P. 5.
Peters W. 1968. Vorkommen, zusammensetzung und feinstruktur peritrophischen membranen in tierreich. Zeit. Morphol. Oecol. Tiere. V. 62. P. 9.
Rhodes J., Harden S., Spooner-Hart R., Anderson D., Wheen G. 2011. Effects of age, season and genetics on semen and sperm production in Apis mellifera drones. Apidologie. V. 42. P. 29.
Дополнительные материалы отсутствуют.


