Цитология, 2021, T. 63, № 4, стр. 390-397
Сравнительный анализ цитотоксического действия флавоноидсодержащих растительных экстрактов на клеточную линию СНО
М. Н. Курчатова 1, *, А. С. Фомин 2, А. А. Широков 1, 2, Н. А. Дурнова 1
1 Кафедра общей биологии, фармакогнозии и ботаники Саратовского государственного медицинского университета
им. В.И. Разумовского Минздрава России
410012 Саратов, Россия
2 Институт биохимии и физиологии растений и микроорганизмов РАН
410049 Саратов, Россия
* E-mail: kurchatova.marya@yandex.ru
Поступила в редакцию 06.04.2021
После доработки 27.04.2021
Принята к публикации 30.04.2021
Аннотация
С использованием МТТ-теста установлены изменения жизнеспособности и метаболической активности монослойной клеточной линии CHO при воздействии экстрактов бессмертника песчаного, кукурузы антоциановой формы и аврана лекарственного. Использование всех изученных экстрактов в концентрации от 50 до 250 мкг/мл приводило к увеличению количества жизнеспособных клеток (до 86.0 ± 8.2%) и стимулировало их метаболическую активность (до 196.1 ± 8.8%). Применение экстрактов в концентрации от 500 до 2000 мкг/мл приводило к уменьшению количества жизнеспособных клеток (до полной гибели клеток) и угнетению метаболической активности (до 13.4 ± 11.3%). Изученные растительные экстракты бессмертника песчаного, антоциановой формы кукурузы обыкновенной и аврана лекарственного проявляли различное воздействие на здоровые клетки в зависимости от применяемой концентрации.
Культуры клеток широко применяются в различных областях биологических и медицинских наук. Они являются моделью для исследования воздействия различных факторов среды: поллютантов, лекарственных препаратов и т.д. (Davis et al., 2001; Manayi et al., 2018; Rosen et al., 2018; Upadhyay, Palmberg, 2018; Yong et al., 2020). Клеточные культуры играют важную роль при тестировании биологически активных веществ, позволяя не только изучить происходящие под их влиянием изменения на клеточном уровне, но и предположить общеорганизменную реакцию (Прилепский и др., 2019). Определение токсичности и цитотоксичности лекарственных препаратов, их отдельных компонентов или иных соединений, обладающих возможной биологической активностью, являeтся неотъемлемой частью доклинических исследований (Романова, Додонова, 2016). Клеточная линия СНО (клетки яичника китайского хомячка) является наиболее изученным и стандартным объектом в фармакологии и токсикологии. Областью применения линии является генетика соматических клеток, клеточная биология, вирусология (Александрова и др., 2015; Стефанова и др., 2015). Для определения цитотоксичности лекарственных препаратов существуют различные методы: во-первых, основанные на прямом подсчете клеток и колоний, во-вторых, связанные с оценкой целостности плазматической мембраны, в-третьих, основанные на оценке синтеза ДНК, а также методы, представляющие собой определение метаболической активности клеток, включая МТТ-тест (Аникина и др., 2014; Иксанова и др., 2016). МТТ-тест является стандартным методом определения цитотоксичности веществ в скрининговых исследованиях новых соединений, фармакологических препаратов, обладает хорошей воспроизводимостью, достаточно быстрый и относительно дешевый. Метод основан на измерении оптической плотности: о цитотоксическом действии вещества на клетки говорит уменьшение оптической плотности экспериментальных проб по сравнению с контрольными пробами (Яковлев и др., 2020). Таким образом, МТТ-тест является подходящим методом для исследования цитотоксичности самых разнообразных веществ.
В настоящее время перспективно изучение биологических эффектов флавоноидов, как веществ, обладающих широким спектром действия, низкой токсичностью, небольшим количеством побочных эффектов (Куркин, 2007). Несмотря на эти преимущества, препараты, содержащие флавоноиды, до сих пор используются недостаточно широко (Андреева, Калинкина, 2000; Ефимов и др., 2004; Анисимова и др., 2010). Бессмертник песчаный, авран лекарственный и антоциановая форма кукурузы содержат флавоноиды различных классов и обладают установленной антимикробной, противовоспалительной, противотуберкулезной и др. активностью (Купчак и др., 1995; Машурчак и др., 2009; Navolokin et al., 2012; Наволокин и др., 2013; Полуконова и др., 2013). Следует отметить, что среди использованного для получения экстрактов сырья, в официальной медицине применяются только цветки бессмертника песчаного. Антоциановая форма кукурузы создана для получения природного красителя, пригодного в пищевой промышленности. Трава аврана лекарственного ядовита за счет содержания гликозидов и алкалоидов, поэтому использовалась только в народной медицине. Из трех видов лекарственных растений наиболее изучен и включен в Государственную фармакопею РФ (XIV издание) бессмертник, относительно двух других видов в настоящее время идет накопление данных о биологической активности. В этой связи необходимо отметить данные о цитотоксической и цитостатической активности экстракта аврана лекарственного в отношении линии опухолевых клеток и линии SPEV, которую чаще используют в вирусологических исследованиях (Polukonova et al., 2018). В указанном исследовании в тесте “живые–мертвые” была выявлена нелинейная зависимость между средним количеством клеток линии SPEV и значением концентрации экстракта аврана лекарственного. Для установления степени безопасности и возможного избирательного действия экстрактов бессмертника песчаного, антоциановой формы кукурузы и аврана лекарственного является целесообразным исследование их цитотоксичности на линии высокочувствительных клеток.
Цель работы: выявление и сравнительный анализ метаболической активности и выживаемости монослойной клеточной линии CHO при воздействии экстрактов бессмертника песчаного, кукурузы антоциановой формы и аврана лекарственного с помощью МТТ-теста и с помощью окрашивания Hoechst 33342 и пропидий йодидом.
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток. В работе использованы клетки яичников китайского хомячка Cricetulus griseus (CHO-K1), предоставленные сотрудниками лаборатории нанобиотехнологии Института биохимии и физиологии растений и микроорганизмов РАН (ИБФРМ РАН). Оценку цитотоксичности растительных экстрактов проводили на базе Центра коллективного пользования “СИМБИОЗ” ИБФРМ РАН. Клетки CHO-K1 (7 пассаж) культивировали при 37°С, 5% СО2 в питательной среде ДМЕМ, содержащей 2 мМ L-глутамина (Capricorn Scientific, Германия), с добавлением 10%-ной эмбриональной телячьей сыворотки (Capricorn Scientific, Германия), 1000 ед/мл пенициллина и 100 мкг/мл стрептомицина (Capricorn Scientific, Германия).
Использованные экстракты. Для приготовления экстрактов использовали цветки бессмертника песчаного (АО “Красногорсклексредства”), траву аврана лекарственного (собрана в Саратовской обл.), оберточные листья початков антоциановой формы кукурузы обыкновенной (предоставлено сотрудниками кафедры генетики ФГБОУ ВО “Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского”). Флавоноидсодержащие водные растворы сухих спиртовых экстрактов приготовлены согласно методике, описанной в Патенте на изобретение № 2 482 863: “Способ получения сухого экстракта из растительного сырья, обладающего биологической активностью” (Полуконова и др., 2012). Способ включает измельчение сырья, экстракцию 96%-ным спиртом на водяной бане, выпаривание экстракта, добавление хлороформа, удаление хлороформа, отделение водной фазы и высушивания при определенных условиях. Экстракт бессмертника песчаного содержит следующие флавоноиды: нарингин и его растворимый агрегат, прунин, кверцетин, апигенин и нарингенин, а также 5-О-глюкозид апигенина и изосалипурпозид (Гринёв и др., 2015). Экстракт кукурузы антоциановой формы, полученный предлагаемым способом, содержит большое количество веществ полифенольной природы, включая кверцетин (Kanevskii et al., 2020). Экстракт аврана лекарственного содержит различные фенольные соединения, моносахариды, органические кислоты и один из флавоноидов – кверцетин (Полуконова и др., 2013). Исследуемые экстракты содержат флавоноиды, но различаются по составу. В исследовании сравнивали действие всей биологически активной композиции на клеточную линию СНО, так как нередко комплекс веществ оказывает большее воздействие, чем отдельное вещество. Все экстракты перед использованием стандартизировали по сумме флавоноидов.
Для оценки влияния на метаболическую активность клеток экстракты использовали в концентрациях, полученных методом двухкратных разведений, в диапазоне от 15.6 до 2000 мкг/мл. Всего было исследовано восемь концентраций каждого из изучаемых экстрактов. В экспериментах по оценке влияния на жизнеспособность клеток экстракты использовали в трех концентрациях, которые были выбраны по результатам МТТ-теста (7.81, 31.3 и 500 мкг/мл для экстрактов бессмертника и аврана и 1.95, 62.5, 1000 мкг/мл для экстракта кукурузы).
МТТ-тест. Оценку метаболической активности клеток определяли в МТТ-тесте по способности восстанавливать нитротетразолевый синий ([3-(4.5-dimethylthiazol-2yl)]-2.5 diphenyltetrazoliumbromide) до формазана по общепринятому методу (Bernas, Dobrucki, 2000). Клетки CHO-K1 культивировали в стандартных 96-луночных планшетах, по достижении клеточного монослоя 70–90% удаляли старую питательную среду и вносили новую, содержащую исследуемые экстракты. Через 24 ч удаляли старую питательную среду и вносили раствор нитротетразолиевого синего (Thermo Scientific, США) (0.5 мг на 100 мл 0.01 М забуференного физиологического раствора, pH 7.4 (БиолоТ, Россия)), культивировали 1 ч. Содержимое лунок удаляли и вносили ДМСО (Thermo Scientific, США). Далее измеряли оптическую плотность лунок на планшетном спектрофотометре Spark 10M (Tecan Group Ltd., Швейцария) при длине волны 540 нм, с вычетом результатов измерения при 630 нм.
Идентификацию живых и мертвых клеток проводили с помощью окрашивания бисбензимидом (Hoechst 33342) и пропидий йодидом, сочетание этих красителей позволяет визуализировать живые и мертвые клетки (Böhmer, 1978; Loken at al., 1978). В лунки 6-луночного планшета вносили клетки CHO-K1, по достижении клеточного монослоя 70–90% удаляли старую питательную среду и вносили новую, содержащую исследуемые препараты. Через 24 ч удаляли старую питательную среду и вносили свежую, содержащую 1 мкг/мл Hoechst 33342 (Thermo Scientific, США) и 30 мкM пропидий йодида (Thermo Scientific, США). Через 20 мин промывали в питательной среде ДМЕМ и проводили флуоресцентную микроскопию на инвертированном флуоресцентном микроскопе Leica DMI 3000B (Leica, Германия) при увеличении объектива ×20. Проводили подсчет общего количества клеток и количества мертвых клеток в 10 полях зрения в каждой лунке (не менее 2000 клеток). Ядра всех клеток, окрашенные бисбензимидом, флуоресцировали синим цветом, ядра мертвых клеток флуоресцировали красным цветом.
Каждый эксперимент повторяли три раза, подсчет клеток для каждой экспериментальной группы проводили в 10 лунках планшета для культивирования.
Статистическую обработку результатов проводили с помощью MS Excel 2010. Данные представлены в форме среднеарифметических значений измеренных величин и их доверительных интервалов при уровне значимости 95%. Оценку достоверности различий между группами проводили с помощью t-критерия Стьюдента (p < 0.05).
РЕЗУЛЬТАТЫ
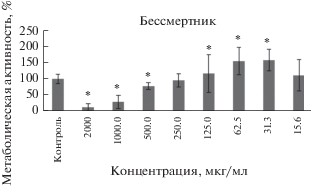
В результате исследования определена метаболическая активность клеток в контроле и при действии экстрактов в разных концентрациях. Согласно результатам МТТ-теста, экстракт бессмертника песчаного в концентрации 31.3 мкг/мл активирует метаболическую активность до 157.7 ± 33.4% (p = 0.02) относительно контрольной группы. Угнетение метаболической активности отмечается при использовании концентрации 500 мкг/мл и более (рис. 1).
Рис. 1.
Изменение метаболической активности клеток CHO при действии экстракта бессмертника. * отмечены достоверные изменения показателя по сравнению с контролем (p < 0.05).
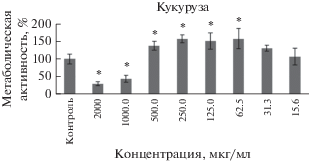
Экстракт антоциановой формы кукурузы обыкновенной в концентрации 62.5 мкг/мл активирует метаболическую активность до 158.1 ± 28.8% (p = = 0.001) относительно контрольной группы. Угнетение метаболической активности отмечается только при использовании концентрации 1000 мкг/мл и более (рис. 2).
Рис. 2.
Изменение метаболической активности клеток CHO при действии экстракта кукурузы. * отмечены достоверные изменения показателя по сравнению с контролем (p < 0.05).
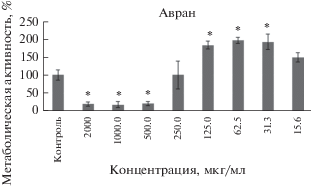
Экстракт аврана лекарственного в концентрации 31.3 мкг/мл активирует метаболическую активность до 196.1 ± 8.8% (p = 0.001) относительно контрольной группы. Угнетение метаболической активности отмечается при использовании концентрации 500 мкг/мл и более (рис. 3).
Рис. 3.
Изменение метаболической активности клеток CHO при действии экстракта аврана. * – Достоверные изменения показателя по сравнению с контролем (p < 0.05).
В результате оценки количества живых и мертвых клеток установлено, что все изученные экстракты в высоких концентрациях оказывают угнетающее действие на клеточную культуру. Экстракты бессмертника песчаного и аврана лекарственного в концентрации 500 мкг/мл снижали количество живых клеток относительно контрольной группы, а экстракт антоциановой формы кукурузы имел аналогичный эффект в концентрации 1000 мкг/мл. Все исследованные экстракты в концентрации 2000 мкг/мл вызывали гибель 100% клеток и живые клетки в культуре не обнаруживали. Сохраняющуюся при этом метаболическую активность клеток (по результатам МТТ-теста) можно объяснить сохранением активности клеточных ферментов в гибнущих клетках в течение некоторого времени после нарушения целостности их плазматической мембраны. При использовании в меньших концентрациях экстракты не оказывали достоверного влияния на количество живых клеток (табл. 1).
Таблица 1.
Количество живых клеток в культуре при действии экстрактов в разных концентрациях
| Экстракт | Концентрация, мкг/мл | Количество живых клеток, % |
|---|---|---|
| Контроль | 0 | 81.4 ± 9.1 |
| 0 | 81.4 ± 4.3 | |
| 0 | 81.4 ± 8.5 | |
| Бессмертник песчаный | 7.81 | 84.3 ± 9.8 |
| 31.3 | 83.2 ± 5.1 | |
| 500 | 61.9 ± 8.1 | |
| Антоциановая форма кукурузы | 1.95 | 86 ± 8.2 |
| 62.5 | 85.9 ± 6.2 | |
| 1000 | 66.4 ± 7.1 | |
| Авран лекарственный | 7.81 | 81.9 ± 8.5 |
| 31.3 | 75.8 ±5.8 | |
| 500 | 58.9 ± 5.9 |
Полученные данные наглядно демонстрируют дозозависимое воздействие всех исследованных экстрактов. При этом наблюдаются различия в действии экстрактов в зависимости от используемого сырья. Экстракты аврана и бессмертника в концентрации 31.3 мкг/мл увеличивают метаболическую активность клеток, в то время как экстракт кукурузы имеет такой эффект, начиная с концентрации 62.5 мкг/мл. Угнетение метаболической активности клеток под действием экстракта бессмертника и аврана происходит при применении их в концентрации 500 мкг/мл и более, а кукурузы –1000 мкг/мл и более.
Несмотря на эти различия можно говорить об общей тенденции действия на клетки всех изученных экстрактов: усиление метаболической активности клеток начинает выявляться при использовании средних концентраций (31.3 и 62.5 мкг/мл). Этот эффект постепенно возрастает по мере возрастания концентрации экстракта, а затем при достижении высоких концентраций (от 500 до 2000 мкг/мл) сменяется угнетением метаболической активности клеток.
Аналогичные результаты получены при идентификации живых и мертвых клеток. Все изученные экстракты в высоких концентрациях (от 500 мкг/мл до 1000 мкг/мл) снижали количество живых клеток. Интересно, что при использовании экстракта аврана лекарственного в концентрации 31.3 мкг/мл отмечалась тенденция к снижению доли живых клеток, несмотря на одновременное значительное увеличение их метаболической активности. Также можно отметить резкое снижение метаболической активности клеток (не только по сравнению с контролем, но и с другими использованными экстрактами) при действии экстракта аврана в высокой концентрации (500 мкг/мл).
ОБСУЖДЕНИЕ
Растения издавна служат источниками биологически активных веществ: флавоноидов, полисахаридов, кумаринов и многих других. Многие растения используют в официальной медицине для изготовления лекарственных препаратов. Но среди применяемых человеком растений есть и ядовитые (Куркин, и др., 2007). Так, используемая в нашем эксперименте трава аврана лекарственного содержит алкалоиды, в связи с чем был применен новый метод экстракции для удаления ядовитых компонентов и получения обогащенной флавоноидами фитокомпозиции с низкой токсичностью (Полуконова и др., 2012).
К настоящему времени показана цитотоксическая активность экстракта аврана лекарственного по отношению к клеткам карциномы почки человека А498 и клеткам рака шейки матки HeLa (Полуконова, 2019). Цитотоксичность по отношению к опухолевым клеткам характерна и для экстрактов, получаемых из растений других видов. Определена цитотоксическая активность экстрактов, полученных из растений ашваганды и астрагала в условиях in vitro по отношению к клеткам HeLa (Калашникова и др., 2019). Показано угнетающее действие по отношению к культуре клеток аденокарциномы легких человека А549 экстрактов ряда лекарственных растений семейства Agavaceae (Asparagaceae) (Камалова и др., 2019). Фитопрепарат на основе Vitex agnus-castus оказывал цитотоксическое действие в отношении клеток рака молочной железы, карциномы желудка (КАТО-III), рака ободочной кишки (COLO 201), рака легкого (Lu-134-AH), промиелолейкоза HL-60, клеток гиперплазии предстательной железы и рака простаты (BPH-1, LNCaP, PC-3) (Торшин, 2015). Таким образом, растительные извлечения могут стать потенциальными ингибиторами деления клеток опухолей.
Одновременно при выборе перспективных для применения биологически активных соединений необходимо использовать вещества, наименее токсичные для здоровых клеток. Клеточная линия СНО является модельным объектом нормальной ткани организма. Еще в 1999 г. с использованием этой клеточной линии установлена цитотоксичность водного экстракта Phyllanthus orbicularis, используемого в традиционной кубинской медицине (Sànchez-Lamar, 1999). Определено цитотоксическое действие экстрактов Juniperus sabina, Zataria multiflora, Taxus baccata как на клеточную линию СНО, так и на опухолевые клетки (Shokrzadeh, 2010).
Помимо оценки безопасности исследуемых веществ актуально изучение их потенциальных защитных свойств. Так, с помощью МТТ-теста было установлено, что экстракт цветков Ixora coccinea вызывает снижение цитотоксичности мышьяка в эксперименте с клеточной линией СНО (Salmataj et al., 2018).
Сравнивая результаты, полученные нами с помощью МТТ-теста и при оценке доли живых и мертвых клеток, можно сделать следующие выводы. Во-первых, клеточная культура СНО проявляет различную чувствительность к изученным экстрактам бессмертника песчаного, кукурузы антоциановой формы и аврана лекарственного. Во-вторых, только для экстракта бессмертника песчаного была обнаружена линейная зависимость между используемой концентрацией и метаболической активностью клеток, а также количеством живых клеток в культуре. В связи с этим использование двух других экстрактов требует более тщательного подбора безопасных концентраций. Можно предположить, что разница в полученных результатах связана с различным качественным и количественным содержанием веществ в экстрактах: получаемые запатентованным методом биологически активные композиции обладают многокомпонентным составом и содержат не только флавоноиды, но и другие соединения.
Согласно полученным нами результатам, экстракты бессмертника песчаного, антоциановой формы кукурузы и аврана лекарственного в относительно низких концентрациях (от 30 до 500 мкг/мл) не являются цитотоксичными. Следовательно, в дальнейших исследованиях различных аспектов их биологической активности на клеточном уровне можно рекомендовать использование экстрактов в указанном диапазоне концентраций.
Список литературы
Александрова О.И., Околов И.Н., Тахтаев Ю.В., Хорольская Ю.И., Хинтуба Т.С., Блинова М.И. 2015. Сравнительная оценка цитотоксичности антимикробных глазных капель. Офтальмол. ведомости. № 1. С. 89. (Aleksandrova O.I., Okolov I.N. Takhtaev Y.V., Khorolskaya J.I., Hintuba T.S. Blinova M.I. 2015. A comparative evaluation of antimicrobial eye drops cytotoxicity. Ophthalmology J. № 1. Р. 89.)
Андреева В.Ю., Калинкина Г.И. 2000. Разработка методики количественного определения флавоноидов в манжетке обыкновенной Alchemilla vulgaris L.S.L. Химия растительного сырья. № 1. С. 85. (Andreeva Y.V., Kalinkina G.I. 2000. Development methods of quantitative determination of flavonoids in the common cuff Alchemilla vulgaris L.S.L. Chemistry of Vegetable Raw Materials. № 1. P. 85.)
Аникина Л.В., Пухов С.А., Дубровская Е.С., Афанасьева С.В., Клочков С.Г. 2014. Сравнительное определение жизнеспособности клеток с помощью МТТ и ресазурин. Фундаментальные исследования. № 12 (часть 7). С. 1423. (Anikina L.V., Pukhov S.A., Dubrovskaya E.S., Afanasiev S.V., Klochkov S.G. 2014. Comparative determination of cell viability using MTT and resazurin. Fundamental Research. № 12 (part 7). P. 1423.)
Анисимова М.М., Куркин В.А., Ежков В.Н. 2010. Качественный и количественный анализ флавоноидов травы гречихи посевной. Известия Самарского научного центра Российской академии наук. Т. 12. № 1(8). С. 2011. (Anisimova M.M., Kurkin V.A., Ezhkov V.N. 2010. Qualitative and quantitative analysis of flavonoids of buckwheat grass. Proceedings of the Samara Scientific Center of the Russian Academy of Sciences. V. 12. № 1(8). Р. 2011.)
Гринёв В.С., Широков А.А., Наволокин Н.А., Полуконова Н.В., Курчатова М.Н., Дурнова Н.А., Бучарская А.Б., Маслякова Г.Н. 2015. Полифенольные соединения новой биологически активной композиции из цветков бессмертника песчаного (Helichrysum arenarium (L.) Moench). Химия растительного сырья. № 2. С. 177. (Grinyov V.S., Shirokov A.A., Navolokin N.A., Polukonova N.V., Kurchatova M.N., Durnova N.A., Bucharskaya A.B., Maslyakova G.N. 2015. Polifenol’nye soedineniya novoj biologicheski aktivnoj kompozicii iz cvetkov bessmertnika peschanogo. Himiya Rastitel’nogo Syr’ya. № 2. Р. 177.)
Ефимов С.Н., Дмитрук С.И., Ильинских Н.Н. 2004. Антимутагенная активность лекарственных растений Сибирского региона. Бюллетень сибирской медицины. № 3. С. 17. (Efimov S.N., Dmitruk S.I., Ilyinskikh N.N. 2004. Antimutagenic activity of medicinal plants of the Siberian region. Bulletin of Siberian Medicine. № 3. P. 17.)
Иксанова А.Г., Бондарь О.В., Балакин К.В. 2016. Методы исследования цитотоксичности при скрининге лекарственных препаратов. Казань: Казанский университет. 40 с. (Iksanova A.G., Bondar O.V., Balakin K.V. 2016. Methods of cytotoxicity research in drug screening. Kazan: Kazan University. 40 p.)
Калашникова Е.А., Киракосян Р.Н., Зайцева С.М. 2019. Цитотоксичность и фунгицидная активность экстрактов, полученных из растений ашваганды и астрагала в условиях in vitro. Актуальные вопросы ветеринарной биологии. № 2(42). С. 57. (Kalashnikova E.A., Zaytseva S.M., Kirakosyan R.N. Topical Issues of Veterinary Biology. № 2(42). Р. 57.)
Камалова Я.Н., Карамова Н.С., Зеленихин П.В., Абдул-Хафиз И., Ильинская О.Н. 2019. Растительное сырье как потенциальный источник противоопухолевых агентов. Учен. зап. Казан. ун-та. Сер. Естеств. науки. № 3. (Kamalova Ya.N., Karamova N.S., Zelenikhin P.V., Abdul-Hafeez E.Y., Ilinskaya O.N. 2019. Plant materials as a potential source of antitumor agents. Uchenye Zapiski Kazanskogo Universiteta. Seriya Estestvennye Nauki. V. 161. № 3. P. 385.)
Купчак Т.В., Николаева Л.О., Шимолина Л.Л. 1995. Выделение и идентификация антоцианов из гибридной кукурузы. Фармацевтический журн. № 6. С. 62. (Kupchak T.V., Nikolaeva L.O., Shimolina L.L. 1995. Isolation and identification of anthocyanins from hybrid Maize. Pharmacy. J. V. 6. P. 62.)
Куркин В.А. 2007. Фармакогнозия: учебник для фармацевтических вузов (факультетов). Самара: ООО “Офорт” СамГМУ. 1239 с. (Kurkin B.A. 2007. Pharmacognosy: a textbook for pharmaceutical universities (faculties). Samara: LLC “Etching” Samara State Medical Univ. 1239 p.)
Машурчак Н.В., Кашин А.С., Игнатов В.В. 2009. Зависимость состава флавоноидного комплекса Helichrysum arenarium (L.) Moench от условий произрастания в Саратовской области. Поволжский экологический журнал. № 1. С. 54. (Mashurchak N.V., Kashin A.S., Ignatov V.V. 2009. Dependence of the composition of the flavonoid complex Helichrysum arenarium (L). Moench on the vegetation conditions in the Saratov region. Povolzhskiy J. Ecol. V. 1. P. 54.)
Наволокин Н.А., Полуконова Н.В., Маслякова Г.Н., Бучарская А.Б., Дурнова Н.А. 2013. Морфология внутренних органов и опухоли лабораторных крыс с перевитым раком печени РС-1 при пероральном введении флавоноидсодержащих экстрактов аврана лекарственного (Gratiola officinalis L.) и кукурузы антоциановой (Zea mays L.). Саратовский научно-медицинский журн. Т. 9. № 2. С. 213. (Navolokin N.A., Polukonova N.V., Maslyakova G.N., Bucharskaya A.B., Durnova N.A. 2013. Internal organs morphology and tumors in laboratory rats with transplanted liver cancer PC-1 by oral introduction containing extract of gratiola (Gratiola officinalis L.) and anthocyan maize (Zea mays L.). Saratov Journal of Medical Scientific Research. V. 9. № 2. Р. 213.)
Полуконова Н.В., Дурнова Н.А., Курчатова М.Н., Наволокин Н.А, Голиков А.Г. 2013. Химический анализ и способ получения новой билогически активной композиции из травы аврана лекарственного (Gratiola officinalis L.). Химия растительного сырья. № 4. С. 165. (Polukonova N.V., Durnova N.A., Kurchatova M.N., Navolokin N.A., Golikov A.G. 2013. Chemical analysis of the new biological active composition from medicative herb hedge-hissop (Gratiola officinalis L.). Chemistry of Plant Raw Materials. № 4. P. 165.)
Полуконова Н.В., Наволокин Н.А., Дурнова Н.А., Маслякова Г.Н., Бучарская А.Б. 2012. Способ получения сухого экстракта из растительного сырья, обладающего биологической активностью. Патент на изобретение № 2 482 863. (Polukonova N.V., Navolokin N.A., Durnova N.A., Maslyakova G.N., Bucharskaya A.B. 2012. A method of obtaining a dry extract from vegetable raw materials with biological activity. Patent for invention № 2 482 863.)
Полуконова Н.В., Наволокин Н.А., Мудрак Д. А., Полуконова А.В., Бучарская А.Б., Маслякова Г.Н. 2019 Средство, обладающее избирательным действием на опухолевые клетки, активирующее их апоптоз и препятствующее формированию их резистентности. Патент № 2 694 547 РФ. (Polukonova N.V., Navolokin N.A., Mudrak D.A., Polukonova A.V., Bucharskaya A.B., Maslyakova G.N. 2019 A drug that has a selective effect on tumor cells, activates their apoptosis and prevents the formation of their resistance. Patent № 2694547 of the Russian Federation.)
Полуконова Н.В., Наволокин Н.А., Райкова С.В., Маслякова Г.Н., Бучарская А.Б., Дурнова Н.А., Шуб Г.М. 2015. Противовоспалительная, жаропонижающая и антимикробная активность флавоноидсодержащего экстракта аврана лекарственного (Gratiola officinalis L.). Экспериментальная и клиническая фармакология. Т. 78. № 1. С. 34. (Polukonova N.V., Navolokin N.A., Raikova S.V., Maslyakova G.N., Bucharskaya A.B., Durnovan N.A., Shub G.M. 2015. Anti-inflammatory, antipyretic and antimicrobial activity of flavonoid-containing extract of Gratiola officinalis L. Russian Journal of Experimental and Clinical Pharmacology. V. 78. № 1. Р. 34.)
Прилепский А.Ю., Дроздов А.С., Богатырев В.А., Староверов С.А. 2019. Методы работы с клеточными культурами и определение токсичности наноматериалов. СПб: Университет ИТМО, 43 с. (Prilepsky A.Yu., Drozdov A.S., Bogatyrev V.A., Staroverov S.A. 2019. Methods of working with cell cultures and determining the toxicity of nanomaterials. St-Petersburg: ITMO. 43 р.)
Романова М.А., Додонова А.Ш. 2016. Изучение цитотоксичности биологически активных соединений на культуре клеток. Молодой ученый. № 18(122). С. 110. (Romanova M.A., Dodonova A.Sh. 2016. Study of cytotoxicity of biologically active compounds in cell culture. A Young Scientist. № 18(122). P. 110.)
Стефанова В.Н., Ярцева Н.М., Петров А.В. 2015. Cравнительный цитогенетический анализ монослойной и суспензионной линий клеток яичника китайского хомячка CHODHFR–. Цитология. Т. 57. № 7. С. 491. (Stefanova V.N., Yartseva N.M., Petrov A.V. 2015. Comparative cytogenetic analysis of monolayer and suspension chinese hamster ovary cell lines CHODHFR–. Tsitologiya. V. 57. № 7. P. 491.)
Торшин И.Ю., Громова О. А., Лиманова О.А. 2015. Систематический анализ состава и механизмов молекулярного воздействия стандартизированных экстрактов Vitex agnus-castus. Трудный пациент. Т. 13. № 1–2. С. 19. (Torshin I.Yu., Gromova O.A., Limanova O.A. 2015. Systematic analysis of composition and molecular mechanisms of action of the Vitex agnus-castus standardized extracts. Difficult Patient. V. 13. № 1–2. P. 19.)
Яковлев Д.С., Султанова К.Т., Золотова Е.А., Гасайниева А.Г., Спасов А.А. 2020. Оптимизация МТТ-теста для определения цитотоксичности новых химических соединений на клеточной линии MCF-7. Волгоградский научно-медицинский журнал. № 1. С. 58. (Yakovlev D.S., Sultanova K.T., Zolotova E.A., Gasainieva A.G., Spasov A.A. Optimization of MTT assay for evaluation of cytotoxicity of new chemical compounds on MCF-7 cell line. Volgograd J. Medical Research. № 1. Р. 58.)
Bernas T., Dobrucki J.W. 2000. The role of plasma membrane in bioreduction of two tetrazolium salts, MTT, and CTC. Arch. Biochem. Biophys. V. 380. P. 108.
Böhmer R.M. 1979. Flow cytometric cell-cycle analysis using the quenching of 33258 Hoescht fluorescence by bromodeoxyuridine incorporation. Cell Tissue Kinet., V. 12. P. 101.
Davis P.K., Ho A., Dowdy S.F. 2001. Biological methods for cell-cycle synchronization of mammalian cells. Biotechniques. V. 30. P. 1322, 1328, 1330-1. https://doi.org/10.2144/01306rv01
Kanevskii M.V., Grinev V.S., Shirokov A.A., Belyachenko Y.A., Polukonova N.V., Navolokin N.A., Bucharskaya A.B., Durnova N.A., Maslyakova G.N. 2020. Comparative spectroscopic and hplc analyses of phenolic compounds in extracts of anthocyanin maize purple Saratov variety grown under various wetting conditions. Pharmac.l Chem. J. V. 54. P. 279.
Loken M.R., Shah V.O., Dattilio K.L., Civin C.I. 1987. Flow cytometric analysis of human bone marrow: I-normal erythroid development. Blood. V. 69. P. 255.
Manayi A., Nabavi S.M., Setzer W.N., Jafari S. 2018. Piperine as a potential anti-cancer agent: A review on preclinical studies. Curr. Med. Chem. V. 25. P. 4918. https://doi.org/10.2174/0929867324666170523120656
avolokin N.A.,Polukonova N.V.,Maslyakova G.N.,Bucharskaya A.B., Durnova N.A. 2012. Effect of extracts of Gratiola officinalis and Zea mays on the tumor and the morphology of the internal organs of rats with trasplanted liver cancer. Russian Open Medical J. V. 1. P. 0203
Polukonova N.V., Navolokin N.A., Bucharskaya A.B., Mudrak D.A., Baryshnikova M.A., Stepanova E.V., Solomko E.S., Polukonova A.V., Maslyakova G.N. 2018. The apoptotic activity of flavonoid-containing Gratiola officinalis extract in cell cultures of human kidney cancer. Russian Open Medical J. V. 7. P. e0402.
Rosen B.H., Chanson M., Gawenis L.R., Liu J., Sofoluwe A., Zoso A., Engelhardt J.F. 2018 Animal and model systems for studying cystic fibrosis. J. Cyst. Fibros. V. 17. P. S28. https://doi.org/10.1016/j.jcf.2017.09.001
Salmataj S.A., Kamath S.U., Murty V.R., Pai S.R. 2018. Amelioration of arsenic-induced oxidative stress in CHO cells by Ixora coccinea flower extract. Biotech. V. 8. P. 446. https://doi.org/10.1007/s13205-018-1446-1
Sànchez-Lamar A., Fiore M., Cundari E., Ricordy R., Cozzi R., DeSalvia R. 1999. Phyllanthus orbicularis aqueous extract: cytotoxic, genotoxic, and antimutagenic effects in the CHO cell line. Toxicol. Appl. Pharmacol. V. 161. P. 231. https://doi.org/10.1006/taap.1999.8814
Shokrzadeh M., Azadbakht M., Ahangar N., Naderi H., SaeediSaravi S.S. 2010. Comparison of the cytotoxic effects of Juniperus sabina and Zataria multiflora extracts with Taxus baccata extract and Cisplatin on normal and cancer cell lines. Pharmacogn. Mag. V. 6. P. 102. https://doi.org/10.4103/0973-1296.62894
Upadhyay S., Palmberg L. 2018. Air-liquid interface: Relevant in vitro models for investigating air pollutant-induced pulmonary toxicity. Toxicol. Sci. V. 164. P. 21. https://doi.org/10.1093/toxsci/kfy053
Yong C.Q.Y., Valiyaveetill S., Tang B.L. 2020. Toxicity of microplastics and nanoplastics in mammalian systems. Int. J. Environ. Res. Public Health. V. 17. P. 1509. https://doi.org/10.3390/ijerph17051509
Дополнительные материалы отсутствуют.


