Цитология, 2022, T. 64, № 1, стр. 36-46
Иммунолокализация BDNF, GDNF и NT-3 в теменной коре крысы при постоянной окклюзии средней мозговой артерии
С. Г. Калиниченко 1, *, А. В. Коробцов 1, Н. Ю. Матвеева 1
1 Кафедра гистологии, эмбриологии и цитологии Тихоокеанского государственного медицинского университета Министерства здравоохранения РФ
690002 Владивосток, Россия
* E-mail: sgkalinichenko@gmail.com
Поступила в редакцию 17.10.2021
После доработки 05.11.2021
Принята к публикации 08.11.2021
- EDN: SUMABT
- DOI: 10.31857/S0041377122010047
Аннотация
Исследовали иммунолокализацию нейротрофического фактора мозга (BDNF), нейротрофина-3 (NT-3) и глиального нейротрофического фактора (GDNF) в теменной коре крыс на модели фокального инсульта, вызванного постоянной окклюзией средней мозговой артерии. Пространственная плотность маркированных клеток постоянно варьирует по слоям коры и на разных сроках ишемического процесса, демонстрируя в ядре инсульта и пенумбре противоположные топографические тренды. Для всех исследованных нейротрофинов характерна значительная редукция иммунореактивных клеток в IV–VI слоях коры в первые и третьи сутки ишемии. В супрагранулярных слоях их количество остается относительно стабильным, либо слегка снижается по сравнению с контролем. На 8-е сут ишемии в ядре инсульта нейротрофины в нейронах почти не выявляются, а в пенумбре возникает индукция иммунореактивности. В пенумбре NT-3-имунореактивные нейроны превалируют в слоях II–III, BDNF выявляется в нейронах слоев II–III и V, а основную популяцию GDNF-иммунореактивных клеток составляют астроциты. Топография нейротрофинов в контралатеральном полушарии повторяет паттерн их локализации в области пенумбры. Неоднородная стратификация нейротрофинов и их избирательная реакция на ишемическое повреждение определяются их различным участием в поддержании цитопротективных и нейродеструктивных эффектов.
Характер и темпы ишемического повреждения в значительной степени лимитируются уровнем трофического обеспечения нейронов, а естественной защитной реакцией мозга в первые минуты ишемии является изменение экспрессии нейротрофинов (НТ), нейроростовых факторов и их рецепторов (Beker et al., 2020). Сумма влияний НТ обеспечивает выживание, пролиферацию и дифференцировку клеток, регулирует синаптическую трансмиссию и экзоцитоз медиаторов, выработку белков постсинаптических уплотнений и ключевых энзимов медиаторного обмена, а также напрямую управляют активностью ионных каналов (Miranda et al., 2019).
В спектр нейропротективных влияний при остром инсульте включаются глиальный нейротрофический фактор (GDNF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NT-3) (Митрошина и др., 2019; Pöyhönen et al., 2019; Liu et al., 2020). Их эффекты связаны с активацией сигнального механизма, сцепленного с определенным типом Trk-рецептора. Молекулы NT-3 имеют сродство к рецепторам TrkC, рецептор TrkB связывается с BDNF, а GDNF реагирует с рецептором GFRα1 экстраклеточного домена тирозинкиназы (Попова и др., 2017; Sasi et al., 2017; Ibanez, Andressoo, 2017). Избирательное действие НТ на нейроны различной медиаторной организации реализуется комплексом вторичных мессенджеров, один из которых опосредуется фосфолипазой С-γ (PLC-γ), другой – митоген-активируемой протеинкиназой (MAPK), а третий – через экспрессию фосфоинозитид 3-киназы/протеинкиназы B (PI3K/Akt) (Bothwell, 2014; Bronfman et al., 2014).
При экспериментальной ишемии экзогенное подведение НТ сокращает размер инфарктной зоны на 35–50% (Boyce, Mendell, 2014; Liu, Chopp, 2016; Jiang et al., 2017), снижает глутаматергическую эксайтотоксичность, оказывая про- или антиапоптотическое действие (Калиниченко и др., 2020). Хотя повышение экспрессии НТ коррелирует с регрессом неврологического дефицита, их протективные эффекты неоднородны, зависят от типологии и нейрохимического профиля поврежденных клеток (Sims et al., 2020). Для нейронов новой коры эти исследования не находят однозначного решения и на различных патогенетических моделях инсульта дают разноречивые результаты. Неизвестна также стратификация НТ в фокусе инсульта и ишемической пенумбре, что затрудняет интерпретацию данных о мишенях их избирательной активности.
Цель настоящей работы состояла в исследовании топографического и количественного представительства нейронов, экспрессирующих BDNF, NT-3 и GDNF в неокортексе крыс при фокальном ишемическом инсульте, вызванном постоянной окклюзией средней мозговой артерии.
МАТЕРИАЛ И МЕТОДИКА
Экспериментальные животные и моделирование инсульта. Работа выполнена на материале от 27 беспородных крыс-самцов весом 200–250 г. Условия содержания животных, а также экспериментальные условия соответствовали директиве 2010/63/EU Европейского союза 2010 г., определяющей правила научных экспериментов с животными. Все экспериментальные процедуры были одобрены междисциплинарным комитетом по этике ФГБОУ ТГМУ Минздрава России (протокол № 4 от 6 марта 2013 г.).
Операция проводилась в асептических условиях под ингаляционным наркозом севофлураном. Фокальный ишемический инсульт моделировали с помощью метода постоянной филаментной окклюзии средней мозговой артерии (Koizumi et al., 1986; Sommer, 2017). По достижении глубокого наркоза, крысу фиксировали на манипуляционном столике с подогревом в положении на спине. После обработки операционного поля антисептиком на передней стороне шеи по средней линии производили разрез кожи длиной 1.5 см, выделяли левую общую сонную артерию (ОСА) и ее бифуркацию на внутреннюю (ВСА) и наружную (НСА) сонные артерии. Затем выполняли перевязку ОСА и НСА. Крылонебную артерию, как коллатераль ВСА, и коллатерали НСА – затылочную и верхнюю щитовидную артерии – коагулировали. Через прокол ОСА в ее просвет вводили окклюдер (полиамидную нить (филамент)), который надежно заполнял весь поперечник сосуда. Окклюдер проводили интравазально в собственно ВСА на глубину около 1.5–2.0 см. Нить оставляли в просвете артерии и фиксировали перевязкой ВСА. После чего рану ушивали. Время операции составляло 40–60 мин. Описанные манипуляции полностью исключают ретроградный и коллатеральный кровоток в ВСА, дают возможность контролировать зону распространения инсульта в бассейне средней мозговой артерии (Коробцов, Калиниченко, 2017). Животных выводили из эксперимента через 1, 3, 8, и 21 сут после операции. На каждом сроке исследовали по 6 крыс. Контролем служили интактные животные (n = 3). Для анестезии использовали внутрибрюшинное введение 3%-ного раствора тиопентала натрия, после чего животных декапитировали.
Анатомические координаты области инфаркта мозга в первые сутки после моделируемого инсульта определяли с помощью окрашивания в растворе 2,3,5-трифенилтетразолия хлорида (TTХ). Мозг оперированного животного помещали в холодный физиологический раствор на 10 мин при 4°С, затем разрезали фронтально на сегменты толщиной 1–2 мм. Затем материал погружали в 2%-ный раствор TTC и выдерживали 30 мин в темноте при 37°С. После установления фокуса инсульта на окрашенных ТТХ фрагментах остальную ткань мозга обрабатывали для иммуногистохимии.
Иммуногистохимия. Материал фиксировали в 4%-ном параформальдегиде на фосфатном буфере в течение 4 ч, после чего промывали 0.1 М Na-фосфатным буфером (рН 7.2) с многократной сменой раствора, заливали в парафин по общепринятой методике. Затем срезы толщиной 15 мкм монтировали на предметные стекла, депарафинировали и инкубировали с первичными антителами. Для этой цели использовали следующие антитела (Abcam, Великобритания): мышиные моноклональные против BD-NF (ab205067) в разведении 5 мкг/мл, кроличьи поликлональные против GDNF (ab18956) в разведении 5 мкг/мл, кроличьи поликлональные против NT-3 (ab216491) в разведении 1 : 200. Первичные антитела разводили в 10 мл фосфатного буфера, содержащего 10% Тритона Х-100 и 200 мг бычьего сывороточного альбумина, и инкубировали в течение ночи при температуре 4°С. Промывали 0.1 М Na-фосфатным буфером, затем в течение 1 ч инкубировали в растворе биотинилированных вторичных антител против иммуноглобулина мыши и кролика соответственно первичным антителам (Biotinylated Goat anti-Mouse IgG (ab64255, Abcam, UK,) и Goat anti-Rabbit IgG Secondary Antibody, Biotin, (№ 31820; Invitrogen, США)) в разведении согласно протоколу фирмы производителя, а затем в растворе авидин-пероксидазного комплекса (Abcam, Великобритания). После этого срезы выдерживали 4 мин в растворе диаминобензидина (DAB Substrate Kit; Abcam, Великобритания), затем трижды промывали фосфатным буфером, обезвоживали и заключали в бальзам. В качестве контроля из среды исключали первичные антитела, окрашивание клеток отсутствовало. Часть срезов окрашивали толуидиновым синим по методу Ниссля.
Препараты изучали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия) и фотографировали при помощи цифровой камеры AxioCam ICc3. Морфометрическую обработку полученных фотографий проводили при помощи пакета программ AxioVision 4.8.1. Относительную плотность иммунноокрашенных клеток вычисляли на участках коры площадью 0.5 мм2. При подсчете учитывали только сохранные клетки, содержащие ядро, с учетом поправки на толщину среза и диаметр ядра по Аберкромби. Включение этой поправки в расчеты позволяет исключить повторный подсчет на серийных срезах одной и той же клетки в результате ее фрагментации. Достоверность межгрупповых различий определяли методом рангового дисперсионного анализа с попарными двусторонними post hoc тестами Манна−Уитни. Достоверными признавали различия при P ≤ 0.05 с поправкой Бонферрони на множественную проверку нулевых гипотез.
В отдельных случаях определяли долю позитивно окрашенных нейронов. Для этого с помощью окуляр-морфометрической сетки подсчитывали абсолютное количество иммунореактивных клеток на участках коры площадью 0.29 мм2 в 20–25 полях зрения и высчитывали их долю от среднего числа клеток, окрашенных в сходных областях по методу Ниссля. Данные обрабатывали методом вариационной статистики с определением t-критерия достоверности по Стьюденту (P < 0.05).
РЕЗУЛЬТАТЫ
Метод филаментной окклюзии позволяет при сравнительно малой инвазивности блокировать кровоток на значительном протяжении сосуда. При обработке мозга с помощью TTХ зона ишемического инсульта проявляется в левом полушарии со стороны окклюзии как неокрашенный участок фронто-париетальной коры (3.5–4 мм кпереди от брегмы) и внутренней капсулы величиной 0.3 × 0.5 × 0.8 см (рис. 1). На 8-е и 14-е сут отмечается значительная вариабельность конфигурации и размеров зоны инсульта. В этом периоде ишемическое ядро всегда локализуется в неокортексе, а структуры внутренней капсулы могут не показывать существенных изменений. На 21-е сут участок ишемического повреждения, как правило, не имеет четких границ, распространяется на часть височной доли и полностью охватывает внутреннюю капсулу с признаками спонгиоза белого вещества. Окружающая его ткань мозга деформируется за счет набухания и отека, внутри ядра инсульта и около него формируются множественные кисты.
Рис. 1.
Топографические границы фокуса ишемического инсульта (стрелки) в левом полушарии мозга крысы через 1 сут после окклюзии средней мозговой артерии. Коронарные срезы головного мозга, окрашенные ТТХ (раствор 2,3,5-трифенилтетразолия хлорида).

Ядро ишемии вначале формируется в слоях II–VI, а затем распространяется на всю корковую пластинку от пиальной поверхности до подкоркового белого вещества. Фокус инсульта по периферии окружает пенумбра – зона жизнеспособных клеток шириной до 800 мкм. При иммуногистохимическом окрашивании на BDNF, GDNF и NT-3 выявляются пирамидные и непирамидные нейроны и глиальные клетки. Локализация нейротрофинов дифференцирована по слоям коры, зависит от экспозиции ишемии и удаленности от ядра инсульта (рис. 2).
Рис. 2.
Распределение BDNF-, GDNF- и NT-3-иммунореактивных клеток в теменной коре крыс в фокусе инсульта (выделен штриховой линией) и ишемической пенумбре. Масштабная линейка: 250 мкм.

У контрольных животных BDNF-иммунореактивные нейроны обнаруживаются во всех слоях коры, имеют интенсивно окрашенный перикарион и первичные сегменты дендритов (рис. 2). Экспрессия BDNF преобладает в пирамидных клетках, количество которых в контроле составляет 81.3 ± 1.1%. В слое I с большим постоянством выявляются веретеновидные нейроны, имеющие морфологию типичных клеток Кахаля–Ретциуса. В глубоких слоях коры субпопуляция BDNF-позитивных интернейронов включает полиморфные и биполярные клетки. Динамика плотности BDNF-реактивных клеток у экспериментальных крыс в разных слоях коры значительно отличается от контрольной группы (рис. 3а). В 1‑е сут ишемии в ядре инсульта маркируются пирамидные и непирамидные клетки слоев II и V с высокой степенью иммунореактивности и небольшие скопления бледно окрашенных нейронов в слоях I и VI. Здесь также выявляются редкие диффузно расположенные астроцитоподобные клетки.
Рис. 3.
Топография BDNF в теменной коре большого мозга крысы при постоянной окклюзии средней мозговой артерии. а – Изменение пространственной плотности (по оси ординат – кл./0.5 мм2) BDNF-иммунореактивных нейронов по слоям коры в контроле (К) и на разных сроках ишемического инсульта; по оси абсцисс – время после ишемии, сут; показаны средние значения и их ошибки (M±SEM), P < 0.05. б – BDNF-иммунореактивные нейроны в слоях V–VI области пенумбры на 8-е сут ишемии; масштабная линейка: 150 мкм.
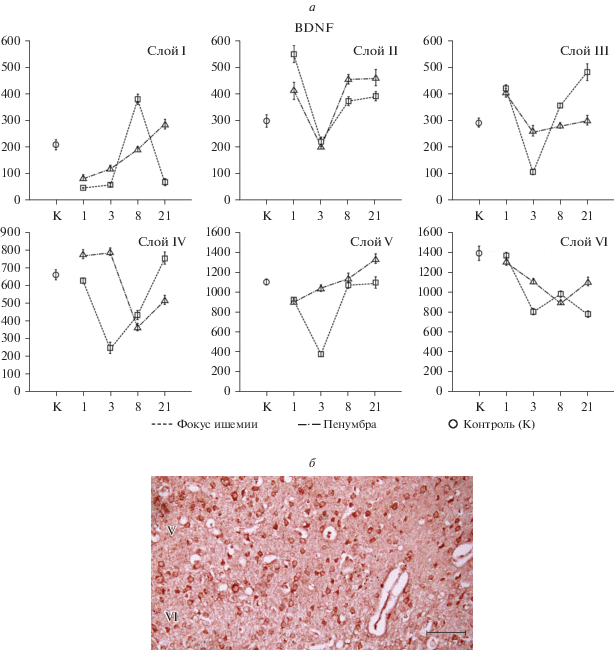
На 3-и сут ишемии ядро инсульта становится полностью организованным. Большинство клеток здесь дистрофически изменено, они увеличены в размерах, перикарионы без четких контуров. В нейропиле наблюдаются признаки перивазального и перинейронального отека. Границы слоев стерты, четко определяются только слои I и II, в которых на BDNF окрашивается лишь 9.8 ± 2.1% клеток от их общего количества в контроле. В остальных слоях встречаются редкие пирамидные клетки и астроциты с умеренной и слабой иммунореактивностью. На 8-е сут после операции в слое V выявляются единичные BDNF-позитивные клетки, а на 21-е сут в ядре ишемии нейроны и глиальные клетки не маркируются.
В зоне пенумбры BDNF-иммунореактивные клетки превалируют в слоях II, III и V. Их количество редуцируется в 1-е и 3-и сут ишемии, а, начиная с 8-х сут, постепенно увеличивается (рис. 3б). Количество таких клеток возрастает примерно на 3.2 ± 1.1% на каждые 100–150 мкм латерально от границы ядра инсульта. При сравнении плотности маркированных клеток во II слое коры в ядре и пенумбре ни в одном из исследованных периодов ишемии достоверных различий не обнаружено. Однако в слоях V и VI на 3-и и 21-е сут после окклюзии плотность BDNF-иммунореактивных клеток в пенумбре достоверно превышает их количество в фокусе ишемии (рис. 3а).
Высокую степень неоднородности демонстрирует топография иммунореактивного GDNF (рис. 4). У контрольных животных маркер локализуется в нейронах всех слоев коры, составляющих 52 ± 4.5% от общего количества клеток. Относительное количество окрашенных нейронов в ядре инсульта неизменно снижается. В первые сутки после окклюзии СМА их выявляется 29 ± 2.1%, на 8-е – 13.8 ± 0.6%, а на 21-е – 3.1 ± 0.2%. При этом в первые 3 сут плотность клеток в ядре ишемии значимо возрастает в слоях I и II и снижается в глубоких слоях коры (рис. 4а, б). Основную порцию GDNF-иммунореактивности в ядре и пенумбре на 8-е и 21-е сут эксперимента формируют глиальные клетки (рис. 4в). Сравнительная оценка плотности маркированных клеток в одинаковые сроки “ишемического” периода показывает различные значения по слоям коры в ядре инсульта и пенумбре (рис. 4а). Отметим, что в I слое выборочная дисперсия плотности клеток в контроле и экспериментальных группах значительно превосходит подобные значения в других слоях коры всех исследованных групп животных.
Рис. 4.
Иммунолокализация GDNF в теменной коре крысы в условиях фокального ишемического инсульта. а – Пространственная плотность (по оси ординат – кл./0.5 мм2) GDNF-иммунореактивных нейронов по слоям коры в контроле (К) и на разных сроках ишемического инсульта; по оси абсцисс – время после ишемии, сут; показаны средние значения и их ошибки (M ± SEM), P < 0.05. б – GDNF-иммунореактивные нейроны в III слое пенумбры, 1 сут ишемии. в – Гиперэкспрессия GDNF в астроцитах слоя I области пенумбры на 8-е сут ишемии; масштабная линейка: 100 мкм.

При иммуногистохимическом выявлении NT-3 в неокортексе контрольных крыс обнаруживаются преимущественно пирамидные клетки, составляющие 78.3 ± 2.4% от общего числа нейронов. В 1-е сут после индукции инсульта в ядре ишемии наблюдается снижение иммунореактивности по всему поперечнику коры с максимальной концентрацией реактивных клеток в слое II, в то время как в слоях III–IV и VI их окрашивается относительно меньше (рис. 5). В пенумбре в этот период, напротив, отмечается нарастание пространственной плотности NT-3-иммунореактивных клеток с превалированием последних в слоях V и VI и достоверным снижением этих показателей в поверхностных слоях коры (рис. 5а). Отметим, что в I и VI слоях коры ни в одной из контрольных точек экспериментальной ишемии не отмечено достоверных различий между плотностью клеток в зоне фокуса и пенумбры, в то время как в остальных слоях такие различия становятся ярко выраженными (рис. 5а).
Рис. 5.
Распределение иммунореактивного NT-3 в теменной коре крысы при фокальном ишемическом инсульте. а – Изменение пространственной плотности (по оси ординат – клеток/0.5 мм2) NT-3-иммунореактивных нейронов по слоям коры в контроле (К) и на разных сроках ишемического инсульта; по оси абсцисс – время после ишемии, сут; показаны средние значения и их ошибки (M ± SEM), P < 0.05. б – NT-3-иммунореактивные нейроны слоев II и III области пенумбры на 8-е сут ишемии; масштабная линейка: 150 мкм.

На 3-и и 8-е сут эксперимента в ядре ишемии почти не встречаются NT-3-позитивные нейроны. Нейропиль здесь контрастирует за счет диффузного окрашивания, в котором можно идентифицировать астроциты, сопровождающие сосуды. Часто глиоциты группируются в обширные кластеры, простирающиеся на соседние слои. В пенумбре в этот период NT-3 экспрессируют в основном нейроны слоев II–III, в остальных слоях встречаются редкие диффузно рассеянные клетки (рис. 5б). В астроцитах иммунореактивность заметно снижается, а их скопления располагаются в непосредственной близости к ядру ишемии.
На 21-е сут в ядре инсульта между стенками кистоподобных лакун наблюдаются диффузно рассеянные мелкие NT-3-позитивные клетки с округлым или полигональным перикарионом. В этот удаленный период ишемии в пенумбре выявляется топографический паттерн иммунореактивности, соответствующий распределению NT-3 в контроле, хотя и при значительно меньшем количестве окрашенных клеток. Локализация исследованных нейротрофинов в одноименных участках коры контралатерального полушария сохраняет основной топографический паттерн их распределения в пенумбре на всех сроках ишемического повреждения.
ОБСУЖДЕНИЕ
В настоящей работе установлено гетерогенное распределение BDNF, GDNF и NT-3 в неокортексе крыс, которое дополняется их различной стратификацией в ядре инсульта и пенумбре на каждом сроке ишемии. Эти данные позволяют картировать цитопротективные эффекты НТ на основе топографии и типологической характеристики маркированных нейронов.
Очаг тотального некроза, ядро инсульта, окружается пенумброй – зоной обратимого ишемического повреждения, в которой наблюдается избирательная и отсроченная гибель клеток. В механизме этой избирательности участвует фактор, индуцируемый гипоксией α1, который запускает экспрессию апоптотических молекул и НТ (Barteczek et al., 2017; Sarkar et al., 2019). На моделях временной редукции церебрального кровотока показано, что в ядре ишемии в первую очередь погибают пирамидные нейроны средних и нижних корковых слоев, а в пенумбре – клетки слоев I–II и поверхностного уровня слоя III (Witte et al., 2000). Причины этого явления связывают с дифференцированной локализацией субъединицы GluR2 AMPA-рецепторов, имеющей ограниченную проницаемость для ионов Ca2+. При инсульте GluR2 сдерживает распространение глутаматной гипервозбудимости, что наряду с апоптозом ГАМК-ергических нейронов вызывает неоднородную гибель клеток по слоям коры (Sommer, Kiessling, 2002). Иммунолокализация исследованных нами НТ согласуется с описанным порядком ишемического повреждения только в первые сутки инсульта, когда в ядре и пенумбре плотность окрашенных нейронов демонстрирует противоположные тренды. Первоначальной реакцией на окислительный стресс является тотальная редукция маркированных клеток на стороне повреждения. В отсроченный период эти показатели увеличиваются, однако существенно варьируют для каждого типа НТ.
Достоверное снижение количества маркированных клеток в соответствующих слоях ядра и пенумбры может быть связано с аноксической гибелью части нейронов. Остальная их популяция характеризуется селективной устойчивостью и высоким уровнем экспрессии НТ. К ним относятся пирамидные нейроны супра- и инфрагранулярных слоев, и в меньшей степени – интернейроны слоев I и VI. Данные настоящей работы отвечают быстрой и активной экспрессии генов НТ и их рецепторов с максимумом через 72 ч после окклюзии средней мозговой артерии (Дмитриева и др., 2016). Нарастание синтеза НТ при увеличении экспозиции фокальной ишемии способно успешно компенсировать ишемию мозга (Митрошина и др., 2019). При этом нейроны слоя IV в ядре инсульта не выявляются, а в пенумбре их количество значительно редуцировано. Слой IV отличается значительной концентрацией возбуждающих глутаматергических связей, которые формируют таламокортикальные афференты и шипиковые звездчатые клетки (Andjelic et al., 2009). Можно полагать, что эти нейроны лишаются нейротрофиновой поддержки в период ишемической гипервозбудимости и поражаются в первую очередь. Относительно небольшая популяция BDNF- и NT-3-позитивных клеток обнаружена нами в ядре инсульта на 8-ой и 21-ый день после операции. Вероятно, эта иммунореактивность связана с наличием НТ в некоторой порции глиальных клеток и, в частности, микроглии, количество которых в этот период значительно возрастает (Kalinichenko et al., 2020).
Однако не всегда индукция НТ воспроизводит заметный протективный эффект. Молекулы BDNF и NT-3 секретируются в виде смеси предшественников и их зрелых форм, имеющих разные рецепторные мишени и функциональную активность. Например, proBDNF специфически активирует сцепленный с сортилином рецептор смерти p75NTR и запускает апоптоз, а зрелая форма BDNF регулирует TrkB и репаративные процессы (Sasi et al., 2017). На модели фототромбоза кортикальных сосудов установлено, что proBDNF экспрессируется уже через 6 ч от начала инсульта, а его созревание завершается к концу первых суток. При этом пиковые значения экспрессии p75NTR отмечаются в течение 3 сут ишемии (Rahman et al., 2018). Баланс этих влияний остается критическим в оценке протективных свойств НТ. Поскольку в нейропиле присутствуют обе их фракции, обнаруженная нами валовая индукция иммунореактивного BDNF может не коррелировать с общим количеством жизнеспособных клеток.
Если границы ядра инсульта, как правило, определяются четко, то ареал распространения пенумбры при микроскопии коры не всегда столь очевиден. Своеобразным маркером границ пенумбры могут служить скопления активированных астроцитов с индуцибельной экспрессией GFAP и GDNF (Kalinichenko et al., 2020). Локализация BDNF- и NT-3-позитивных клеток в разные периоды корковой ишемии закономерно смещается в латеральном и вертикальном направлениях от ядра инсульта. Этот факт указывает на динамические изменения границ нейропротективной зоны и согласуется с гипотезой, рассматривающей пенумбру как мозаику из множественных микролокусов переживающих инсульт нейронов (del Zoppo et al., 2011). Эта особенность касается и контралатерального полушария, где при экспериментальном инсульте наблюдается индукция экспрессии NT-3, TrkA и TrkC (Дмитриева и др., 2016), а по нашим данным формируется сходный с пенумброй паттерн иммунолокализации НТ.
Данные настоящего исследования указывают на тесные метаболические отношения астроцитов и нейронов, адаптирующие их к условиям ишемии. Установленное нами постепенное смещение GD-NF-иммунореактивности из нейронального в глиальный компартмент пенумбры следует рассматривать как проявление протективных свойств нейротрофина. Способность астроцитов аккумулировать высокие уровни GDNF показана на различных моделях ишемического инсульта (Mitroshina et al., 2019). Механизмы подобных взаимосвязей остаются неясны. Однако известно, что индукцию GDNF в астроцитах опосредуют аденозиновые А2А-рецепторы (Ke et al., 2012). Можно полагать, что аноксия быстро истощает нейронный пул АТФ, вызывает нарастание уровня аденозина в нейропиле и вторичное накопление GDNF в астроцитарной глии. Если это действительно так, то GDNF здесь противостоит вазоконстрикторному действию АТФ, которое при нарушении кровотока может усиливать ишемический процесс (McConnell et al., 2017).
Таким образом, избирательная локализация BD-NF, NT-3 и GDNF выступает значимым индикатором защитных и нейродеструктивных процессов при ишемическом повреждении. Эти данные представляют особый интерес для выяснения механизмов нейрохимической адаптации и разработки прецизионных средств фармакологической коррекции состояния нейронов в условиях острого инсульта.
ЗАКЛЮЧЕНИЕ
Постоянная окклюзия средней мозговой артерии вызывает закономерную альтерацию экспрессии НТ в нейронах теменной коры крыс. Иммунолокализация BDNF, NT-3 и GDNF характеризуется топографической гетерогенностью в ядре инсульта и ишемической пенумбре и динамично варьирует по слоям коры в разные периоды ишемии.
Пространственная плотность клеток, экспрессирующих НТ, заметно меняется в первые трое суток инсульта, демонстрируя в ишемическом ядре и пенумбре противоположные топографические тренды. В ядре инсульта они концентрируются в слоях I–II. На 8-е сут ишемии НТ экспрессируется, главным образом, в клетках пенумбры. При этом иммунореактивный BDNF локализуется в нейронах слоев II–III и V, NT-3 – в слоях II–III, GDNF – в астроцитах. В пенумбре основная порция иммунореактивных клеток сосредоточена в поверхностных слоях коры. Данные исследования впервые демонстрируют избирательную локализацию НТ в разных типах нейронов. Различная стратификация НТ в коре и динамика их изменений определяет смещение границ ишемической пенумбры в разные периоды инсульта.
Список литературы
Дмитриева В.Г., Ставчанский В.В., Поварова О.В., Скворцова В.И., Лимборская С.А., Дергунова Л.В. 2016. Влияние ишемии на экспрессию генов нейротрофинов и их рецепторов в структурах мозга крыс вне очага повреждения, включая противоположное полушарие. Мол. биология. Т. 50. № 5. С. 775. (Dmitrieva V.G., Stavchansky V.V., Povarova O.V., Skvortsova V.I., Limborska S.A., Dergunova L.V. 2016. Effects of ischemia on the expression of neurotrophins and their receptors in rat brain structures outside the lesion site, including on the opposite hemisphere. Mol. Biol. (Mosk.) V. 50. № 5. P. 775.)
Калиниченко С.Г., Матвеева Н.Ю., Коробцов А.В. 2020. Нейротрофический фактор мозга (BDNF) как регулятор апоптоза в условиях фокального экспериментального инсульта. Бюлл. эксп. биол. и мед. Т. 169. № 5. С. 634. (Kalinichenko S.G., Matveeva N.Y., Korobtsov A.V. 2020. Brain-derived neurotrophic factor (BDNF) as a regulator of apoptosis under conditions of focal experimental stroke. Bull. Exp. Biol. Med. V. 169. № 5. P. 701.)
Коробцов А.В., Калиниченко С.Г. 2017. Экспериментальные стратегии исследования ишемического инсульта. Журн. неврологии и психиатрии им. С.С. Корсакова. Т. 117. № 12-2. С. 38. (Korobtsov A.V., Kalinichenko S.G. 2017. The experimental strategies in the study of ischemic stroke. Zh. Nevrol. Psikhiatr. im S.S. Korsakova. V. 117. № 12-2. P. 38.)
Митрошина Е.В., Мищенко Т.А., Шишкина Т.В., Ведунова М.В. 2019. Роль нейротрофических факторов BDNF и GDNF в адаптации нервной системы к действию факторов ишемии. Клеточные технологии в биологии и медицине. Т. 2. С. 121. (Mitroshina E.V., Mishchenko T.A., Shishkina T.V., Vedunova M.V. 2019. Role of neurotrophic factors BDNF and GDNF in nervous system adaptation to the Influence of ischemic factors. Bull. Exp. Biol. Med. V. 167. P. 574.)
Попова Н.К., Ильчибаева Т.В., Науменко В.С. 2017. Нейротрофические факторы (BDNF, GDNF) и серотонинергическая система мозга. Биохимия. Т. 82. № 3. С. 449. (Popova N.K., Ilchibaeva T.V., Naumenko V.S. 2017. Neurotrophic factors (BDNF and GDNF) and the serotonergic system of the brain. Biochemistry (Mosc.) V. 82. № 3. P. 308.)
Andjelic S., Gallopin T., Cauli B., Hill E.L., Roux L., Badr S., Hu E., Tamás G., Lambolez B. 2009. Glutamatergic nonpyramidal neurons from neocortical layer VI and their comparison with pyramidal and spiny stellate neurons. J. Neurophysiol. V. 101. P. 641.
Barteczek P., Li L., Ernst A.S., Böhler L.I., Marti H.H., Kunze R. 2017. Neuronal HIF-1α and HIF-2α deficiency improves neuronal survival and sensorimotor function in the early acute phase after ischemic stroke. J. Cereb. Blood Flow Metab. V. 37. P. 291.
Beker M., Caglayan A.B., Beker M.C., Altunay S., Karacay R., Dalay A., Altintas M.O., Kose G.T., Hermann D.M., Kilic E. 2020. Lentivirally administered glial cell line-derived neurotrophic factor promotes post-ischemic neurological recovery, brain remodeling and contralesional pyramidal tract plasticity by regulating axonal growth inhibitors and guidance proteins. Exp. Neurol. V. 331. P. 113364. https://doi.org/10.1016/j.expneurol.2020.113364
Bothwell M. 2014. NGF, BDNF, NT3, and NT4. Handb. Exp. Pharmacol. V. 220. P. 3.
Boyce V.S., Mendell L.M. 2014. Neurotrophic factors in spinal cord injury. Handb. Exp. Pharmacol. V. 220. P. 443.
Bronfman F.C., Lazo O.M., Flores C., Escudero C.A. 2014. Spatiotemporal intracellular dynamics of neurotrophin and its receptors. Implications for neurotrophin signaling and neuronal function. Handb. Exp. Pharmacol. V. 220. P. 33.
del Zoppo G.J., Sharp F.R., Heiss W.D., Albers G.W. 2011. Heterogeneity in the penumbra. J. Cereb. Blood Flow Metab. V. 31. P. 1836.
Ibáñez C.F., Andressoo J.O. 2017. Biology of GDNF and its receptors − Relevance for disorders of the central nervous system. Neurobiol. Dis. V. 97 (Pt B). P. 80.
Jiang M.Q., Zhao Y.Y., Cao W., Wei Z.Z., Gu X., Wei L., Yu S.P. 2017. Long-term survival and regeneration of neuronal and vasculature cells inside the core region after ischemic stroke in adult mice. Brain Pathol. V. 27. P. 480.
Kalinichenko S.G., Korobtsov A.V., Matveeva N.Y., Pushchin I.I. 2020. Structural and chemical changes in glial cells in the rat neocortex induced by constant occlusion of the middle cerebral artery. Acta Histochem. V. 122. P. 151573. https://doi.org/10.1016/j.acthis.2020.151573
Ke R.H., Xiong J., Liu Y. 2012. Adenosine A2a receptor induces GDNF expression by the Stat3 signal in vitro. Neuroreport. V. 23. P. 958.
Koizumi J., Yoshida Y., Nakazawa T., Ooneda G. 1986. Experimental studies of ischemic brain edema: 1. A new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemic area. Jpn. J. Stroke. V. 8. P. 1.
Liu Z., Chopp M. 2016. Astrocytes, therapeutic targets for neuroprotection and neurorestoration in ischemic stroke. Prog. Neurobiol. V. 144. P. 103.
Liu W., Wang X., O’Connor M., Wang G., Han F. 2020. Brain-derived neurotrophic factor and its potential therapeutic role in stroke comorbidities. Neural Plast. 2020. P. 1 969 482. https://doi.org/10.1155/2020/1969482
McConnell H.L., Kersch C.N., Woltjer R.L., Neuwelt E.A. 2017. The translational significance of the neurovascular unit. J. Biol. Chem. V. 292. P. 762.
Miranda M., Morici J.F., Zanoni M.B., Bekinschtein P. 2019. Brain-derived neurotrophic factor: a key molecule for memory in the healthy and the pathological brain. Front. Cell Neurosci. V. 13. P. 363. https://doi.org/10.3389/fncel.2019.00363
Mitroshina E.V., Mishchenko T.A., Shirokova O.M., Astrakhanova T.A., Loginova M.M., Epifanova E.A., Babaev A.A., Tarabykin V.S., Vedunova M.V. 2019. Intracellular neuroprotective mechanisms in neuron-glial networks mediated by glial cell line-derived neurotrophic factor. Oxid Med. Cell Longev. 2019. P. 1036907. https://doi.org/10.1155/2019/1036907
Pöyhönen S., Er S., Domanskyi A., Airavaara M. 2019. Effects of neurotrophic factors in glial cells in the central nervous system: expression and properties in neurodegeneration and injury. Front. Physiol. V. 10. P. 486. https://doi.org/10.3389/fphys.2019.00486
Rahman M., Luo H., Sims N.R., Bobrovskaya L., Zhou X.F. 2018. Investigation of mature BDNF and proBDNF signaling in a rat photothrombotic ischemic model. Neurochem. Res. V. 43. P. 637.
Sarkar S., Chakraborty D., Bhowmik A., Ghosh M.K. 2019. Cerebral ischemic stroke: cellular fate and therapeutic opportunities. Front. Biosci. V. 24. P. 435.
Sasi M., Vignoli B., Canossa M., Blum R. 2017. Neurobiology of local and intercellular BDNF signaling. Pflugers Arch. V. 469. P. 593.
Sims S.K., Rizzo A., Howard K., Farrand A., Boger H., Adkins D.L. 2020. Comparative enhancement of motor function and BDNF expression following different brain stimulation approaches in an animal model of ischemic stroke. Neurorehabil. Neural Repair. V. 34. P. 925.
Sommer C.J. 2017. Ischemic stroke: experimental models and reality. Acta Neuropathol. V. 133. P. 245.
Sommer C., Kiessling M. 2002. Ischemia and ischemic tolerance induction differentially regulate protein expression of GluR1, GluR2, and AMPA receptor binding protein in the gerbil hippocampus: GluR2 (GluR-B) reduction does not predict neuronal death. Stroke. V. 33. P. 1093.
Witte O.W., Bidmon H.J., Schiene K., Redecker C., Hagemann G. 2000. Functional differentiation of multiple perilesional zones after focal cerebral ischemia. J. Cereb. Blood Flow Metab. V. 20. P. 1149.
Дополнительные материалы отсутствуют.


