Цитология, 2022, T. 64, № 1, стр. 26-35
Изменение профиля микроРНК в клетках меланомы, резистентных к действию дакарбазина
И. С. Зинченко 1, Н. В. Палкина 1, Т. Г. Рукша 1, *
1 Кафедра патологической физиологии им. профессора В.В. Иванова Красноярского государственного медицинского университета им. профессора В.Ф. Войно-Ясенецкого Министерства здравоохранения РФ
660022 Красноярск, Россия
* E-mail: tatyana_ruksha@mail.ru
Поступила в редакцию 25.09.2021
После доработки 22.10.2021
Принята к публикации 01.11.2021
- EDN: YWCCPD
- DOI: 10.31857/S0041377122010114
Аннотация
Одним из компонентов опухолевой прогрессии меланомы кожи является формирование лекарственной устойчивости. Химиотерапевтические средства способны влиять на клеточный цикл, репарацию ДНК, в том числе посредством реализации эпигенетических механизмов с участием микроРНК, представляющих собой малые некодирующие молекулы РНК длиной 18–25 нуклеотидов. Они способны осуществлять регуляцию возникновения и развития опухоли, изменяя экспрессию генов различных сигнальных каскадов. В этой связи, цель нашего исследования заключалась в определении профиля микроРНК и распределения клеток меланомы по фазам клеточного цикла при воздействии химиотерапевтическим агентом дакарбазином с последующим биоинформатическим анализом профиля микроРНК, опосредующих развитие химиорезистентности. Для решения этой задачи использовали клеточную линию BRO, в которой после воздействия дакарбазином оценивали профиль микроРНК при помощи микрочипирования и определяли распределение клеток по фазам клеточного цикла на основе проточной цитометрии. Статистическую значимость данных анализа профиля микроРНК рассчитывали методом дисперсионного анализа (ANOVA), а для коррекции уровней значимости различий использовали метод множественного сравнения Бенджамини−Хохберга с использованием коэффициента ложного обнаружения FDR, остальные эксперименты оценивали по U-критерию Манна−Уитни. Результаты показали, что под воздействием дакарбазина увеличивается доля жизнеспособных опухолевых клеток линии BRO в фазе митоза, а также изменяется экспрессия ряда микроРНК. Согласно проведенному биоинформатическому анализу, эти микроРНК принимают участие в механизмах передачи сигнала, относящихся исключительно к канцерогенезу и имеют ключевое значение в патогенезе меланомы.
Развитие злокачественных новообразований включает многочисленные генетические и эпигенетические изменения, принципы организации которых остаются до сих пор малопонятными (Powers et al., 2016), а изменение уровней и активности различных молекул микроРНК является одним из характерных эпигенетических явлений этого процесса (Fabbri et al., 2013). МикроРНК относятся к классу малых некодирующих РНК, каноническая функция которых заключается в регуляции экспрессии генов посредством связывания с целевой мРНК, приводя к последующей деградации последней и ингибированию трансляции. Синтез микроРНК начинается в ядре клетки, где образуется первичный транскрипт, прай-микроРНК, из которого впоследствии под воздействием нуклеазы-РНКaзы III типа формируются шпилеподобные структуры размером 60–70 нуклеотидов, связывающиея с белком экспортином и транслоцирующиеся в цитоплазму. Фермент Dicer образует ассимметричный дуплекс микроРНК: микроРНК, который взаимодействует с РНК-индуцированным комплексом выключения гена (комплексом RISC), в результате чего одна часть дуплекса становится зрелой, функционально активной микроРНК.
Один вид микроРНК может регулировать экспрессию нескольких сотен генов. МикроРНК характеризуются высокой стабильностью, а также специфичностью профиля экспрессии в отдельных типах тканей и клеток (Ha et al., 2014). Эти молекулы выполняют как онкогенную, так и онкосупрессорную функцию в канцерогенезе (Zhang et al., 2007). Одной из микроРНК, изменение уровня которой показано при меланоме, является miR-204-5p (Galasso et al., 2018). Ранее нами было установлено, что данная микроРНК функционирует в клетках меланомы как онкосупрессор, регулируя интенсивность пролиферации и миграции клеток. В частности, снижение уровня miR-204-5p в клетках меланомы приводит к снижению уровня пролиферации и усилению миграции клеток меланомы (Palkina et al., 2018). Помимо этого, показано, что изменение уровня этой микроРНК посредством введения как имитатора (синтетического специфического аналога), так и ингибитора, вызывает увеличение доли клеток меланомы, находящихся в фазе G1 клеточного цикла и снижает долю клеток, находящихся в фазах S и G2. Эти данные согласуются с другими исследованиями в отношении функционирования miR-204-5p в опухолевых клетках.
Например, было установлено, что эктопическая экспрессия микроРНК miR-204-5p вызывает снижение миграции и инвазии клеток рака молочной железы (Toda et al., 2018). Экспрессия miR-204-5p негативно коррелировала с объемом опухоли, развитием метастазирования при немелкоклеточном раке легкого (Xia et al., 2014). А при плоскоклеточном раке кожи наблюдается значительное снижение miR-204-5p по сравнению с актиническим кератозом – хроническим предраковым заболеванием кожи, возникающем под воздействием ультрафиолетового излучения (Toll et al., 2016). Показано участие miR-204-5p, а также miR-211, относящейся к этому же семейству, в реализации резистентности клеток меланомы к селективному ингибитору BRAFV600E вемурафенибу посредством воздействия на компоненты сигнального каскада ERK, изменении синтеза меланина и функционировании меланосом. Меланин обладает фотопротекторными свойствами, но в меланосомах, помимо его синтеза, происходит секвестрация противоопухолевых агентов с последующей элиминацией их опухолевыми клетками, что вносит вклад в развитие лекарственной резистентности (Башмакова и др., 2015; Vitiello et al., 2017).
Было предположено несколько механизмов, посредством которых возможна реализация эффектов микроРНК miR-204-5p в опухолевых клетках. В частности, было показано, что miR-204-5p комплементарно связывается с белком HMGB1 (амфотерином), который, в свою очередь, обладает способностью взаимодействовать с ДНК и транскрипционными факторами, регулируя структуру и функцию хромосом. При этом функционирование HMGB1 в качестве мишени miR-204-5p было подтверждено люциферазным тестом, а модуляция уровня этой микроРНК вызывала HMGB1-опосредованное изменение пролиферации и миграции клеток рака щитовидной железы (Lin et al., 2020). Кроме этого, ранее нами было установлено, что одним из генов-мишеней miR-204-5p является транскрипционный фактор FOXC1, который входит в семейство транскрипционных факторов “Forkhead box” (FOX) и который способен менять динамику клеточного цикла, участвуя во внутриклеточном сигнальном пути PI3K/AKT и регулируя при этом экспрессию белков-циклинов. С помощью репортерного люциферазного анализа установлено, что воздействие имитатора miR-204-5p вызывает репрессию люциферазной активности в клетках с этой конструкцией, что указывает на прямое регуляторное воздействие miR-204-5p на мРНК гена FOXC1 посредством взаимодействия с ее 3'-нетранслируемой областью (Дубовцева и др., 2021).
Одним из механизмов прогрессии злокачественных новообразований является развитие лекарственной устойчивости клеток к противоопухолевым средствам – невосприимчивости к лекарственным препаратам разного химического строения и механизма действия, в основе которой могут лежать эпигенетические модификации (Housman et al., 2014). В свою очередь, известно, что посредством реализации эпигенетических механизмов противоопухолевые средства могут влиять на прогрессию клеточного цикла (Yang et al., 2021).
В этой связи, цель настоящего исследования заключалась в определении изменений профиля микроРНК в клетках меланомы, резистентных к действию дакарбазина.
МАТЕРИАЛ И МЕТОДИКА
Клеточная линия BRO и культивирование. Клетки меланомы линии BRO были предоставлены Научно-исследовательским институтом фундаментальной и клинической иммунологии (Новосибирск, Россия); клетки были получены из беспигментной меланомы лица мужского пола 34 лет в 1985 г. Клетки культивировали в питательной среде RPMI-1640 с L-глутамином, содержащей 10% фетальной бычьей сыворотки (FBS) и противомикробный комплекс антибиотик-антимикотик в условиях CO2-инкубатора MSO-5AC (Sanyo Electric Co. Ltd., Япония) при температуре 37°C и концентрации углекислого газа 5%. Эксперименты на клетках проводили после предварительного культивирования в течение трех-пяти пассажей. Исследование было выполнено после согласования с Локальным этическим комитетом Красноярского государственного медицинского университета (протокол № 92/2019 от 25 октября 2019 г.).
Определение IC50 для дакарбазина. Концентрацию, при которой погибает 50% клеток (IC50), проводили колориметрическим методом на основе определения оптической плотности формазана, являющегося продуктом метаболизма 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ) как было описано ранее (Komina et al., 2019). Оптическую плотность определяли на спектрофотометре Anthos 2010 ELISA (Biochrom Ltd, Англия) с использованием фильтров 495 и 620 нм с нормированием по чистому раствору DMSO (растворителя формазана). Значение определяемой оптической плотности считали соответствующим значению жизнеспособности клеток (усл. ед.). Полумаксимальную ингибирующую концентрацию дакарбазина рассчитывали с помощью программы Microsoft Excel (Microsoft Corporation, США). В дальнейшем клетки линии BRO высевали в 6-луночные планшеты или культуральные флаконы объемом 25 см2, по достижении плотности клеток 80–90% вносили стоковый раствор дакарбазина в DMSO в концентрации, соответствующей 1 × IC50. В контроли вместо раствора дакарбазина добавляли DMSO в конечной концентрации 1%. Клетки культивировали 72 ч при 37°C в CO2-инкубаторе, после чего культуральную среду заменяли на свежую и культивировали еще 48 ч, а затем клетки трансфицировали имитатором микроРНК miR-204-5p – hsa-miR-204-5p-mimic (последовательность зрелой микроРНК: UUCCCUUUGUCAUCCUAUGCCU). Трансфекцию имитатора микроРНК осуществляли по протоколу, описанному нами ранее (Palkina et al., 2018). Эксперименты выполняли в трех технологических повторах.
Проточная цитометрия и распределение клеток по фазам клеточного цикла. Для определения доли клеток меланомы, находящихся в G0-фазе клеточного цикла, использовали метод проточной цитометрии. С этой целью клетки линии BRO открепляли от поверхности культуральной емкости при помощи 0.25%-ного раствора Трипсин-ЭДТА, промывали фосфатным буфером и фиксировали 10%-ным раствором формальдегида в течение 30 мин при комнатной температуре. Далее при помощи 0.1% -ного раствора Тритона X-100 пермеабилизовали клеточные мембраны для проникновения красителей в ядро и другие внутриклеточные структуры, после чего клетки несколько раз промывали фосфатным буфером, а затем инкубировали с антителами к маркеру пролиферации Ki-67, конъюгированными с флуоресцеиновой меткой (FITC) в разведении 1 : 100 в присутствии 10% FBS в течение 4 ч при комнатной температуре. После инкубации клетки снова промывали фосфатным буфером и окрашивали иодидом пропидия (PI) в концентрации 100 мкг/мл в течение 20 мин. Суспензии окрашенных клеток анализировали на проточном цитометре Navios (Beckman Coulter, Inc., США) с использованием лазерного модуля, излучающего в синем спектре (488 нм). Полученные цитометрические результаты обрабатывали с помощью программных продуктов Navios Software v. 1.2 и Kaluza v. 2.1.1 (Beckman Coulter, Inc., США). Гейтинг клеток на разных стадиях клеточного цикла проводили в логарифмическом режиме. Клетки в G0-фазе определяли как Ki-67-отрицательные и имеющие низкие уровни флуоресценции по PI (в интервале 0.7–1.3 отн. ед.). Эксперимент выполняли в трех технологических повторах.
ПЦР в реальном времени. Выделение РНК из клеток проводили с помощью набора реагентов, предназначенных для выделения тотальной РНК из культур клеток diaGene (ДиаЭм, Москва, РФ). Для определения уровней экспрессии микроРНК проводили реакцию обратной транскрипции с использованием набора MMLV RT. Для этого каждый образец, состоящий из 3 мкл раствора РНК, содержащего 1.5 мкл 5× праймеров из соответствующего набора микроРНК для исследования экспрессии микроРНК miR-204-5p и miR-4286, а также 1.5 мкл случайных праймеров, входящих в набор MMLV RT, нагревали в термостате при 70°C в течение 2 мин и охлаждали на льду. Затем к образцу добавляли 5.5 мкл реакционной смеси, состоящей из 1 мкл смеси dNTP, 1 мкл DTT (1.4-дитиотреитола), 2 мкл 5‑кратного стандартного буфера, 0.5 мкл обратной транскриптазы MMLV и 1 мкл воды без нуклеаз, инкубировали в термостате при 37°C в течение 50 мин, а затем реакцию останавливали, нагревая образцы в течение 10 мин при 70°C. Амплификацию полученной кДНК в количестве 2 мкл на каждый образец выполняли на основе ПЦР с детекцией в режиме реального времени с использованием амплификатора StepOneTM (Applied Biosystems, Сингапур) с протоколом термоциклирования: 50°C – 2 мин, 95°C – 10 мин, затем 40 циклов 95°C – 15 с, 60°C – 1 мин. Реакционная смесь для каждой реакции по определению экспрессии микроРНК в общем объеме 18 мкл состояла из 1 мкл 20× праймеров TaqMan™ Gene Expression Assay и TaqMan™ MicroRNA & Non-coding RNA Assays, 8 мкл 2.5-кратной реакционной смеси для ПЦР в присутствии ROX и 9 мкл безнуклеазной воды. В качестве эндогенного нормализующего контроля использовали U6 snRNA и RNU6B snRNA (№ 001973 и 001093 соответственно; Applied Biosystems, США). Данные анализировали с использованием метода ∆∆Ct (Livak, Schmittgen, 2001). Исследование было проведено в трех технологических повторениях.
Микрочипирование с целью определения профиля микроРНК. Анализ профиля микроРНК выполняли с использованием системы GeneAtlas Microarray System (Affymetrix, Санта-Клара, США). Выделение тотальной РНК с целью изучения транскриптома осуществляли с использованием набора Affymetrix Flash TagTM Biotin HSR в соответствии с инструкциями производителя. Концентрацию полученной РНК и степень чистоты образцов определяли на приборе Qubit® 2.0 (Invitrogen, Thermo Fisher Scientific, Сингапур). Для анализа каждого образца использовали 100 нг общей РНК. Гибридизацию на чипе Affymetrix miRNA 4.1 Array Strip (Thermo Fisher Scientific, Сингапур) проводили с использованием набора реагентов Gene Chip Gene Atlas Hybridization, Wash and Stain Module (Affymetrix, Санта-Клара, США) при 48°C в течение 20 ч, затем чипы промывали и регистрировали флуоресцентные сигналы на станциях Gene Atlas Fluidic Station и Gene Atlas Imaging Station (Affymetrix, Санта-Клара, США). Обработку результатов проводили с помощью программы Transcriptome Analysis Console 4.0.1 (Thermo Fisher Scientific, США). Отбор дифференциально-экспрессируемых микроРНК, которые далее были сгруппированы в соответствии с категориями функций, выполняемых в клетках, проводили на основе значений уровня статистической значимости p < 0.05 с использованием коэффициента ложного обнаружения FDR (Storey, Tibshirani, 2003), а также значения кратности различий, равного значению 2 и более.
Статистический анализ. Использовали программный пакет статистического анализа Statistica 7.0 (StatSoft, Россия). Статистическую значимость данных анализа профиля микроРНК рассчитывали методом дисперсионного анализа (ANOVA), а для коррекции уровней значимости различий использовали метод множественного сравнения Бенджамини–Хохберга с использованием коэффициента ложного обнаружения FDR, остальные эксперименты рассчитывали по U-критерию Манна–Уитни, результаты считали значимыми при p < 0.05. В биоинфоматическом анализе пороговые значения определяли с использованием точного критерия Фишера при уровне значимости p ≤ 0.05. Данные представлены как средние и стандартные ошибки среднего (M ± m).
Использованные реактивы. RPMI-1640 с L-глутамином (ПанЭко, Россия); FBS, антибиотик-антимикотик, hsa-miR-204-5p-mimic (№ 4 464 066, MC11116), Трипсин-ЭДТА (Gibco, ThermoFisher Scientific, США); дакарбазин (Sigma, США); фосфатный буфер (VWR International, LL AMRESCO, США); Triton X-100 (GERBU Biotechnik GmbH, Германия); антитела к Ki-67, конъюгированные с флуоресцеином (eBioscience, Invitrogen, США); иодид пропидия (Invitrogen, Thermo Fisher Scientific, Inc., Нидерланды); diaGene (Диа-М, Россия); MMLV RT (Евроген, Россия); наборы для исследования экспрессии микроРНК miR-204-5p, miR-4286 (№ 4 427 975, Applied Biosystems, США); U6 snRNA и RNU6B snRNA (№ 001 973 и 001 093 Applied Biosystems, США); реакционная смесь для ПЦР в присутствии ROX (Syntol, Россия); Affymetrix Flash TagTM Biotin HSR (№ 901 911, Thermo Fisher Scientific, США).
РЕЗУЛЬТАТЫ
Анализ клеточного цикла в клетках BRO после воздействия дакарбазином, трансфекции имитатора miR-204-5p. В клеточной линии BRO после воздействия дакарбазином показано снижение доли клеток в фазе G0 клеточного цикла в сравнении с контролем в 2.7 раза, а также увеличение доли клеток в фазе М в 2.9 раза, тогда как процентное содержание клеток, находящихся в фазах G1, S, G2 оставалось без изменений. Клетки в М-фазе клеточного цикла дифференцировали от клеток, находящихся в фазах G1, S, G2 на основе интенсивности флуоресценции: в клетках, находящихся в фазе М, интенсивность флуоресценции Ki-67 возрастала в 10–15 раз, хотя, безусловно, для точной дифференцировки циклов эффективнее использовать анализ уровня нескольких белков. При трансфекции в клетки имитатора микроРНК miR-204-5p наблюдали увеличение доли клеток, находящихся в фазе G1 клеточного цикла на 14 и 16% по сравнению с клетками BRO, подвергнутыми только воздействию дакарбазина и по сравнению с контролем соответственно (табл. 1).
Таблица 1.
Распределение клеток меланомы BRO по фазам клеточного цикла после действия дакарбазина и трансфекции hsa-miR-204-5p-mimic (имитатора miR-204-5p)
| Фаза клеточного цикла | Доля клеток после воздействия, % | ||
|---|---|---|---|
| нет (контроль) | дакарбазина | дакарбазина и трансфекция | |
| G0 | 17.4 ± 3.8 | 6.5 ± 1.1а | 4.6 ± 2.5 |
| G1 | 42.3 ± 7.6 | 42.0 ± 6.3 | 56.5 ± 8.6б |
| S | 21.3 ± 1.4 | 24.3 ± 3.2 | 18.8 ± 1.8 |
| G2 | 14.9 ± 5.8 | 14.1 ± 8.3 | 10.3 ± 2.2 |
| M | 4.5 ± 1.2 | 13.1 ± 3.9а | 9.2 ± 4.5 |
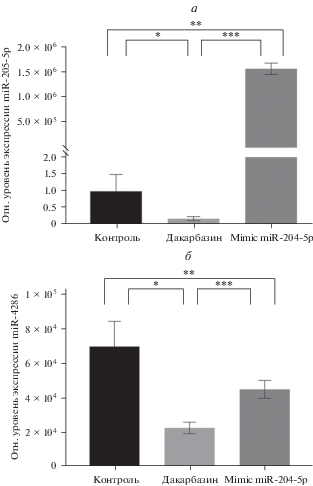
Профилирование микроРНК в клетках BRO после воздействия дакарбазином, трансфекции имитатора miR-204-5p. Валидация результатов посредством ПЦР в реальном времени. При анализе результатов микрочипирования (MicroArray) выявлено 202 вида микроРНК, профиль экспрессии которых изменился после воздействия дакарбазином, а также при трансфекции имитатора микроРНК miR-204-5p. Иерархическая кластеризация продемонстрировала четкое разделение на кластеры, соответствующие трем исследованным группам (рис. 1). Результаты микрочипирования были переподтверждены посредством определения уровней двух микроРНК – miR-204-5p и miR-4286 во всех группах с помощью ПЦР в реальном времени (рис. 2, 3). Эти микроРНК были выбраны для валидации результатов микрочипирования, исходя из наличия различий в процентном содержании GC и количестве нуклеотидов в miR-204-5p и miR-4286: 45.5% и 22 нуклеотида, 64.7% и 17 нуклеотидов соответственно.
Рис. 1.
Тепловая карта с отображением иерархической кластеризации микроРНК. a – В клетках меланомы BRO, б – после воздействия дакарбазина, в – после воздействия дакарбазинам с последующей трансфекцией имитатора miR-204-5p (Mimic miR-204-5p).

Рис. 2.
Характер экспрессии микроРНК miR-204-5p (вверху) и miR-4286 (внизу) в клетках меланомы BRO после воздействия только дакарбазина и дакарбазина с последующей трансфекцией имитатора miR-204-5p (согласно методу MicroArray).

Рис. 3.
Уровни экспрессии miR-204-5p (а) и miR-4286 (б) в клетках меланомы BRO после воздействия дакарбазинoм и имитатора miR-204-5p, определяемые с помощью ПЦР в реальном времени. Обозначения те же, что и на рис. 1. Данные представлены как средние и их стандартные ошибки, различия достоверны при (*, **, ***) p ≤ 0.05.
По результатам микрочипирования образцов, полученных после воздействия дакарбазина на клетки линии BRO, было зафиксировано изменение уровня 37 видов микроРНК по сравнению с контролем, среди которых имели повышенную экспрессию 8 видов, а пониженную – 29. К числу высокоэкспрессируемых микроРНК относились miR-320a, miR-30c-2-3p, miR-6871-5p. Среди микроРНК со сниженной экспрессией определялись miR-146a-5p, miR-21-5p, miR-301a-3p, уровни которых была понижены в 6.4, 5.2 и 4.7 раза соответственно. К микроРНК, имеющим наибольшую величину показателя кратности различий, можно отнести miR-320a, miR-30c-2-3p и miR-6871-5p, для которых выявили снижение экспрессии в 2.8, 2.7 и 2.7 раз соответственно. Все микроРНК с измененной экспрессией после воздействия дакарбазина на клетки линии BRO являлись зрелыми.
После воздействия дакарбазина на клетки линии BRO с последующей трансфекцией в них имитатора miR-204-5p определялось изменение экспрессии более чем в 2 раза у 152 видов микроРНК по отношению к контрольной группе, и 142 видов микроРНК по сравнению с профилем клеток, подвергнутых только влиянию дакарбазина. Уровни 54-х микроРНК были выше, чем в контрольной группе, и 82‑х – выше в группе после воздействия дакарбазином. К высокоэкспрессируемым микроРНК по сравнению с контролем относились miR-204-5p, miR-483-5p и miR-1973, уровни которых были повышены в 98.6, 19.2 и 13.0 раз соответственно. К наиболее высокоэкспрессируемым микроРНК в клетках, подвергнутых воздействию дакарбазина с последующей трансфекцией имитатора miR-204-5p, по отношению к клеткам, подвергнутым только воздействию дакарбазина, относились miR-204-5p, miR-483-5p, miR-6723-5p, у которых регистрировали изменение экспрессии в 127.5, 21.0 и 13.6 раз соответственно. Из повышенных 54 видов микроРНК 5 микроРНК были незрелыми – это mir-3689b, mir-3689b, mir-4419a, mir-4539, mir-682, из 82 – 6 незрелых микроРНК – это mir-3689b, mir-3689b, mir-4539, mir-6791, mir-6800, mir-6827.
После воздействия дакарбазином и имитатором miR-204-5p в профиле микроРНК выявляли снижение экспрессии 99 микроРНК по отношению к контрольной группе, 60 – по сравнению с клетками, подвергнутыми только воздействию дакарбазина. Минимальная экспрессия регистрировалась у микроРНК miR-7975, miR-18a-5p, miR-15a-5p. Снижение экспрессии по отношению к контролю составило 21.9, 21.6 и 15.4 раза соответственно. Наиболее низкая экспрессия в клетках после воздействия дакарбазина и трансфекции имитатора miR-204-5p по отношению к профилю клеток, подвергнутых только воздействию дакарбазина, отмечалась у микроРНК miR-7975, miR-6765-3p, miR-7977 со снижением в 17.1, 13.1 и 12.6 раз соответственно. Из 99 измененных микроРНК 7 микроРНК были незрелыми – mir-3150a, mir-3158-2, mir-3714, mir-4758, mir-4785, mir-6724 и mir-6819, из 60 микроРНК – 3: mir-3150a, mir-3714, mir-933.
Биоинформатический анализ результатов профилирования микроРНК. По результатам биоинформатического анализа на основе Киотской энциклопедии генов и геномов определено, что часть сигнальных путей, в которых регуляцию генов осуществляют молекулы микроРНК с измененными профилями экспрессии, была однотипной во всех трех сравниваемых группах. К таким внутриклеточным сигнальным каскадам можно отнести PI3K/Akt, MAPK, “Сигнальные пути при раке” и Ras-путь. Напротив, в клетках меланомы после действия дакарбазина изменялась экспрессия совокупности микроРНК, участвующих в регуляции сигнальных каскадов “Нарушение транскрипции при раке” и “Протеогликаны при раке”, а после воздействия дакарбазина с последующей трансфекцией имитатора miR-204-5p – Rap1-путь и “Сигнальные пути, регулирующие плюрипотентность стволовых клеток” (табл. 2).
Таблица 2.
Сигнальные пути, регулируемые микроРНК, уровни которых изменялись в клетках меланомы BRO после действия дакарбазина и трансфекции hsa-miR-204-5p-mimic (имитатора miR-204-5p)
| № | Сигнальный путь (signaling pathway), регулируемый микроРНК, уровень которой изменялся после воздействия дакарбазина | Число микроРНК с измененной экспрессией | Число генов, регулируемых измененными микроРНК | p |
|---|---|---|---|---|
| 1 | Сигнальные пути при раке (Pathways in cancer) | 28 | 184 | 1.7680e-07 |
| 2 | PI3K–Akt | 28 | 153 | 6.3451e-05 |
| 3 | MAPK | 28 | 123 | 9.7119e-06 |
| 4 | Ras | 27 | 106 | 2.4041e-05 |
| 5 | cAMP | 26 | 89 | 0.0091 |
| 6 | Эндоцитоз (Endocytosis) | 25 | 103 | 2.2518e-05 |
| 7 | Нарушение транскрипции при раке (Transcriptional misregulation in cancer) | 25 | 80 | 0.0038 |
| 8 | Дофаминергический синапс (Dopaminergic synapse) | 25 | 61 | 0.0131 |
| 9 | Протеогликаны при раке (Proteoglycans in cancer) | 24 | 93 | 4.1801e-07 |
| 10 | Вирусный канцерогенез (Viral carcinogenesis) | 24 | 77 | 0.0053 |
| Сигнальные пути, регулируемые микроРНК, уровни которых изменялись в клетках меланомы BRO после воздействия имитатором miR-204-5p | ||||
| 1 | PI3K–Akt | 80 | 245 | 0.0014 |
| 2 | Ras | 80 | 172 | 0.0001 |
| 3 | MAPK | 79 | 186 | 0.0015 |
| 4 | Сигнальные пути при раке | 78 | 296 | 3.5794e-06 |
| 5 | cAMP | 78 | 148 | 0.0028 |
| 6 | Neurotrophin | 78 | 96 | 0.0006 |
| 7 | cGMP–PKG | 77 | 121 | 0.0172 |
| 8 | Эндоцитоз | 76 | 163 | 3.8380e-06 |
| 9 | Фокальная адгезия (Focal adhesion) | 76 | 162 | 2.3611e-05 |
| 10 | Rap1 | 76 | 165 | 2.3611e-05 |
| Сигнальные пути, регулируемые микроРНК, уровни которых изменялись в клетках меланомы BRO после воздействия дакарбазином и трансфекции имитатора miR-204-5p | ||||
| 1 | Ras | 81 | 179 | 1.5860e-06 |
| 2 | Сигнальные пути при раке | 80 | 298 | 0.0001 |
| 3 | PI3K–Akt | 80 | 252 | 0.0004 |
| 4 | Эндоцитоз | 80 | 163 | 1.0054e-05 |
| 5 | MAPK | 79 | 191 | 0,0004 |
| 6 | Rap1 | 78 | 172 | 4.3567e-07 |
| 7 | Фокальная адгезия | 78 | 166 | 5.4193e-06 |
| 8 | cAMP | 78 | 151 | 0.0015 |
| 9 | Метаболизм холина при раке (Choline metabolism in cancer) | 78 | 81 | 0.0023 |
| 10 | Сигнальные пути, регулирующие плюрипотентность стволовых клеток (Signaling pathways regulating pluripotency of stem cells) | 77 | 115 | 9.8532e-06 |
ОБСУЖДЕНИЕ
Изменение клеточного цикла и профиля микроРНК в клеточной линии BRO после воздействия дакарбазина. Эпигенетические изменения в опухолевых клетках наблюдаются на всех этапах канцерогенеза в равной степени, как и изменения микроРНК. В данной работе показано, что под воздействием дакарбазина в клеточной линии BRO увеличивается доля жизнеспособных опухолевых клеток, находящихся в фазе М клеточного цикла, снижается доля G0-положительных клеток. Согласно биоинформатическому анализу, увеличение доли клеток в фазе митоза сопряжено с увеличением уровня микроРНК, регулирующих механизмы внутриклеточной сигнализации и имеющие ключевое значение в патогенезе меланомы – “Сигнальные пути при раке”, путь путь PI3K–Akt, MAPK, Ras-сигнальный путь, а также “Нарушение транскрипции при раке”. Необходимо отметить, что при воздействии на клетки линии BRO дакарбазина, уменьшались уровни miR-146a-5p и miR-21-5p.
Ранее нами было показано, что miR-146a-5p относится к наиболее высокоэкспрессируемым микроРНК в клетках меланомы по сравнению с клетками непораженной кожи (Aksenenko et al., 2019). Повышение данной микроРНК описано при различных злокачественных новообразованиях – трижды негативном раке молочной железы (Liang et al., 2019), раке желудка (Xiao et al., 2012) и раке щитовидной железы (Czajka et al., 2016). В клетках меланомы высокая экспрессия miR-146a-5p сопряжена с резистентностью к BRAF- и MEK-ингибиторам, а также связана с активацией провоспалительного внутриклеточного механизма передачи сигнала NF-kB (Vergani et al., 2020). Вместе с тем, в клетках гепатоцеллюлярной карциномы комбинированное применение ингибитора поли(АДФ-рибоза)-полимеразы и блокатора рецепторов андрогена вызывало снижение miR-146a-5p, нарушение BRCA1-опосредованной репарации ДНК с последующим повышением уровня апоптоза (Zhao et al., 2020). Таким образом, изменение уровня miR-146a-5p может быть ассоциировано с развитием химорезистентности. Наряду с miR-146a-5, miR-21-5p также регулируется транскрипционным фактором NF-kB и имеет высокое число генов-мишеней, являющихся компонентами одноименного внутриклеточного сигнального каскада, незначительно экспрессируется в нормальных клетках, но экспрессируется повышенно в опухолевых клетках (Olivieri et al., 2021).
Изменения профиля микроРНК в клеточной линии BRO после воздействия дакарбазином и последующей трансфекции имитатора микроРНК miR-204-5p. Интересно, что при трансфекции имитатора miR-204-5p в клетки линии BRO после воздействия дакарбазина, наблюдали повышение miR-483-5p по сравнению как с клетками контрольной группы, так и клетками, подвергнутыми воздействию дакарбазина. Функциональная активность miR-483-5p является менее изученной по сравнению с вышеуказанными молекулами. Вместе с тем, известно, что высокая экспрессия этой микроРНК ассоциируется с развитием химиорезистентности при эпителиальном раке яичников (Castro-Vega et al., 2020), а также с высокими уровнями миграции и инвазии клеток рака надпочечников (Agosta et al., 2018). Это может, по меньшей мере, свидетельствовать о роли этой микроРНК в канцерогенезе. Стоит также подчеркнуть, что трансфекция имитатора miR-204-5p вызывала изменение в профиле микроРНК незрелых форм данных молекул.
Необходимо отметить, что недавние исследования указывают на возможную регуляторную роль незрелых форм микроРНК, которые в контексте канцерогенеза также могут иметь проонкогенную, антионкогенную роль или быть амбивалентны по своей функции. Пре-микроРНК могут превращаться в две зрелые микроРНК, а последние могут выполнять функцию, противоположную своему предшественнику (Chen et al., 2020). Точная роль незрелых микроРНК при этом требует разъяснения на основе механистических исследований в такой же мере, как и зрелых микроРНК.
Внутриклеточные сигнальные механизмы, компоненты которых регулируются микроРНК с измененной экспрессией, относятся исключительно к канцерогенезу и к изменениям, характерным для меланомы. В частности, внутриклеточный сигнальный каскад PI3K–Akt в норме регулирует процессы пролиферации, дифференцировки, апоптоза структурных элементов кожи, препятствует развитию апоптоза в меланоцитах, индуцированного окислительным стрессом (Teng et al., 2021). Активация PI3K–Akt достоверно связана с развитием меланомы посредством ряда механизмов, в том числе изменения динамики клеточного цикла (Broussard et al., 2018), что регистрировалось и в настоящей работе с помощью проточной цитометрии.
Стоит отметить, что после трансфекции имитатора микроРНК miR-204-5p в клетки, подвергнутые воздействию дакарбазина, отмечали изменение уровня микроРНК, регулирующих компоненты сигнального каскада Rap1. Rap1 (Ras-ассоциированный белок 1) относится с ГТФазам белкового семейства Ras и является регулятором и медиатором многочисленных функций белка. Кроме того, сообщается, что Rap1 регулирует процессы адгезии и считается одним из ключевых регуляторов подвижности, миграции клеток, что согласуется с выявленным нами ранее регуляторным влиянием miR-204-5p в клетках меланомы на эти процессы (Palkina et al., 2018; Shah et al., 2019). Помимо этого, в данной группе клеток отмечали изменение профиля микроРНК, регулирующих внутриклеточный путь “Сигнальные пути, регулирующие плюрипотентность стволовых клеток”. Предполагается, что наиболее резистентными к химиотерапии являются опухолевые клетки, которые в той или иной мере обладают характеристиками нормальных стволовых клеток (Phi et al., 2018).
МикроРНК miR-204-5p, согласно ряду исследований, определялась как онкосупрессор, поэтому в настоящей работе трансфекция ее имитатора была осуществлена в клетки линии BRO, резистентные к воздействию противоопухолевым препаратом. Выявленные изменения свидетельствуют, что действительно, в данном случае профиль микроРНК подвергается изменениям, соотносящимися с развитием химиорезистентности. Целенаправленное исследование профиля микроРНК резистентных опухолевых клеток с определением молекул-мишеней для изменения их фенотипа может рассматриваться как перспективный подход в экспериментальной онкологии для установления маркеров химиорезистентности и молекул-мишеней для таргетного воздействия на них.
Список литературы
Башмакова Е.Е., Красицкая В.В., Бондарь А.А., Козлова А.В., Рукша Т.Г., Франк Л.А. 2015. Выявление однонуклеотидных полиморфизмов (R160W, R151C, D294H) в гене рецептора меланокортина-1 (MC1R) биолюминесцентным анализом. Мол. биология. Т. 49. № 6. С. 953. (Bashmakova E.E., Krasitskaya V.V., Bondar A.A., Kozlova A.V., Ruksha T.G., Frank L.A. 2015. A bioluminescent assay for detecting melanocortin-1 receptor (MC1R) gene polymorphisms R160W, R151C, and D294H. Mol. Biol. V. 49. P. 852.)
Дубовцева И.Ю., Аксененко М.Б., Николаева Е.Д., Аверчук А.С., Мошев А.В., Савченко А.А., Маркова С.В., Рукша Т.Г. 2021. FOXC1-опосредованное влияние микроРНК miR-204-5p на пролиферацию клеток меланомы. Мол. биология. Т. 55. № 4. С. 667. (Dubovtseva I.Y., Aksenenko M.B., Nikolaeva E.D., Averchuk A.S., Moshev A.V., Savchenko A.A., Markova S.V., Ruksha T.G. 2021. FOXC1-mediated effects of miR-204-5p on melanoma cell proliferation. Mol. Biol. V. 55. P. 667.)
Agosta C., Laugier J., Guyon L., Denis J., Bertherat J., Libé R., Boisson B., Sturm N., Feige J.J., Chabre O., Cherradi N. 2018. MiR-483-5p and miR-139-5p promote aggressiveness by targeting N-myc downstream-regulated gene family members in adrenocortical cancer. Int. J. Cancer. V. 143. P. 944.
Aksenenko M., Palkina N., Komina A., Tashireva L., Ruksha T. 2019. Differences in microRNA expression between melanoma and healthy adjacent skin. BMC Dermatol. V. 19. P. 1. https://doi.org/10.1186/s12895-018-0081-1
Broussard L., Howland A., Ryu S., Song K., Norris D., Armstrong C.A., Song P.I. 2018. Melanoma Cell Death Mechanisms. Chonnam. Med. J. V. 54. P. 135.
Castro-Vega L.J., Calsina B., Burnichon N., Drossart T., Martínez-Montes Á.M., Verkarre V., Amar L., Bertherat J., Rodríguez-Antona C., Favier J., Robledo M., Gimenez-Roqueplo A.P. 2020. Overexpression of miR-483-5p is confined to metastases and linked to high circulating levels in patients with metastatic pheochromocytoma/paraganglioma. Clin. Transl. Med. V. 10. P. e260. https://doi.org/10.1002/ctm2.260
Chen L., Huang K., Yi K., Huang Y., Tian X., Kang C. 2020. Premature MicroRNA-Based Therapeutic: A “One-Two Punch” against Cancers. Cancers (Basel). V. 12. P. 3831. https://doi.org/10.3390/cancers12123831
Czajka A.A., Wójcicka A., Kubiak A., Kotlarek M., Bakuła-Zalewska E., Koperski Ł., Wiechno W., Jażdżewski K. 2016. Family of microRNA-146 regulates RARβ in papillary thyroid carcinoma. PLoS One. V. 11. P. e0151968. https://doi.org/10.1371/journal.pone.0151968
Fabbri M., Calore F., Paone A., Galli R., Calin G.A. 2013. Epigenetic regulation of miRNAs in cancer. Adv. Exp. Med. Biol. V. 754. P. 137.
Galasso M., Morrison C., Minotti L., Corrà F., Zerbinati C., Agnoletto C., Baldassari F., Fassan M., Bartolazzi A., Vecchione A., Nuovo G.J., Di Leva G., D’Atri S., Alvino E. et al. 2018. Loss of miR-204 expression is a key event in melanoma. Mol. Cancer. V. 17. P. 71. https://doi.org/10.1186/s12943-018-0819-8
Ha M., Kin V.N. 2014. Regulation of microRNA biogenesis. Nat. Rev. Mol. Cell Biol. V. 15. P. 24. https://doi.org/10.1038/nrm3838
Housman G., Byler S., Heerboth S., Lapinska K., Longacre M., Snyder N., Sarkar S. 2014. Drug resistance in cancer: An overview. Cancers (Basel). V. 6. P. 1769.
Komina A.V., Palkina N.V., Aksenenko M.B., Lavrentev S.N., Moshev A.V., Savchenko A.A., Averchuk A.S., Rybnikov Y.A., Ruksha T.G. 2019. Semaphorin-5A downregulation is associated with enhanced migration and invasion of BRAF-positive melanoma cells under vemurafenib treatment in melanomas with heterogeneous BRAF status. Melanoma Res. V. 29. P. 544.
Liang H., Huang W., Wang Y., Ding L., Zeng L. 2019. Overexpression of MiR-146a-5p Upregulates lncRNA HOTAIR in triple-negative breast cancer cells and predicts poor prognosis. Technol. Cancer Res. Treat. V. 18. P. 1 533 033 819 882 949. https://doi.org/10.1177/1533033819882949
Lin Y., Jiang J. 2020. Long non-coding RNA LINC00704 promotes cell proliferation, migration, and invasion in papillary thyroid carcinoma via miR-204-5p/HMGB1 axis. Open Life Sci. V. 15. P. 561.
Livak K.J., Schmittgen T.D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. V. 25. P. 402.
Olivieri F., Prattichizzo F., Giuliani A., Matacchione G., Rippo M.R., Sabbatinelli J., Bonafè M. 2021. miR-21 and miR-146a: The microRNAs of inflammaging and age-related diseases. Ageing Res. Rev. V. 70. P. 101374. https://doi.org/10.1016/j.arr.2021.101374
Palkina N., Komina A., Aksenenko M., Moshev A., Savchenko A., Ruksha T. 2018. miR-204-5p and miR-3065-5p exert antitumor effects on melanoma cells. Oncol Lett. V. 15. P. 8269.
Phi L.T.H., Sari I.N., Yang Y.G., Lee S.H., Jun N., Kim K.S., Lee Y.K., Kwon H.Y. 2018. Cancer stem cells (CSCs) in drug resistance and their therapeutic implications in cancer treatment. Stem Cells Int. V. 2018. P. 5416923. https://doi.org/10.1155/2018/5416923
Powers J.T., Tsanov K.M., Pearson D.S., Roels F., Spina C.S., Ebright R., Seligson M., de Soysa Y., Cahan P., Theißen J., Tu H.C., Han A., Kurek K.C., LaPier G.S., Osborne J.K. et al. 2016. Multiple mechanisms disrupt the let-7 microRNA family in neuroblastoma. Nature. V. 535. P. 246.
Shah S., Brock E.J., Ji K., Mattingly R.R. 2019. Ras and Rap1: A tale of two GTPases. Semin. Cancer Biol. V. 54. P. 29.
Storey J. D., Tibshirani R. 2003. Statistical significance for genomewide studies. Proc. Natl. Acad. Sci. USA. V. 100. P. 9440.
Teng Y., Fan Y., Ma J., Lu W., Liu N., Chen Y., Pan W., Tao X. 2021. The PI3K/Akt pathway: Emerging roles in skin homeostasis and a group of non-malignant skin disorders. Cells. V. 10. P. 1219. https://doi.org/10.3390/cells10051219
Toda H., Kurozumi S., Kijima Y., Idichi T., Shinden Y., Yamada Y., Arai T., Maemura K., Fujii T., Horiguchi J., Natsugoe S., Seki N. 2018. Molecular pathogenesis of triple-negative breast cancer based on microRNA expression signatures: Antitumor miR-204-5p targets AP1S3. J. Hum. Genet. V. 63. P. 1197.
Toll A., Salgado R., Espinet B., Díaz-Lagares A., Hernández-Ruiz E., Andrades E., Sandoval J., Esteller M., Pujol R.M., Hernández-Muñoz I. 2016. MiR-204 silencing in intraepithelial to invasive cutaneous squamous cell carcinoma progression. Mol. Cancer. V. 15. P. 53. https://doi.org/10.1186/s12943-016-0537-z
Vergani E., Dugo M., Cossa M., Frigerio S., Di Guardo L., Gallino G., Mattavelli I., Vergani B., Lalli L., Tamborini E., Valeri B., Gargiuli C., Shahaj E., Ferrarini M., Ferrero E. et al. 2020. miR-146a-5p impairs melanoma resistance to kinase inhibitors by targeting COX2 and regulating NFkB-mediated inflammatory mediators. Cell Commun. Signal. V. 18. P. 156. https://doi.org/10.1186/s12964-020-00601-1
Vitiello M., Tuccoli A., D’Aurizio R., Sarti S., Giannecchini L., Lubrano S., Marranci A., Evangelista M., Peppicelli S., Ippolito C., Barravecchia I., Guzzolino E., Montagnani V., Gowen M., Mercoledi E. et al. 2017. Context-dependent miR-204 and miR-211 affect the biological properties of amelanotic and melanotic melanoma cells. Oncotarget. V. 8. P. 25395. https://doi https://doi.org/10.18632/oncotarget.15915
Xia Y., Zhu Y., Ma T., Pan C., Wang J., He Z., Li Z., Qi X., Chen Y. 2014. miR-204 functions as a tumor suppressor by regulating SIX1 in NSCLC. FEBS Lett. V. 588. P. 3703.
Xiao B., Zhu E.D., Li N., Lu D.S., Li W., Li B.S., Zhao Y.L., Mao X.H., Guo G., Yu P.W., Zou Q.M. 2012. Increased miR-146a in gastric cancer directly targets SMAD4 and is involved in modulating cell proliferation and apoptosis. Oncol. Rep. V. 27. P. 559.
Yang C., Tian C., Hoffman T.E., Jacobsen N.K., Spencer S.L. 2021. Melanoma subpopulations that rapidly escape MAPK pathway inhibition incur DNA damage and rely on stress signalling. Nat. Commun. V. 12. P. 1747. https://doi.org/10.1038/s41467-021-21549-x
Zhang B., Pan X., Cobb G.P., Anderson T.A. 2007. microRNAs as oncogenes and tumor suppressors. Dev. Biol. V. 302. P. 1.
Zhao J., Sun Y., Lin H., Chou F., Xiao Y., Jin R., Cai X., Chang C. 2020. Olaparib and enzalutamide synergistically suppress HCC progression via the AR-mediated miR-146a-5p/BRCA1 signaling. FASEB J. V. 34. P. 5877.
Дополнительные материалы отсутствуют.


