Цитология, 2022, T. 64, № 1, стр. 77-85
Использование сфероидов из PANC-1 для тестирования противоопухолевых препаратов in vitro и создания опухолевой модели in vivo
С. Ш. Каршиева 1, 2, С. П. Кудан 3, Ю. Д. Хесуани 1, В. С. Покровский 2, В. А. Миронов 1, 4, Е. В. Кудан 1, *
1 Лаборатория биотехнологических исследований “3Д Биопринтинг Солюшенс”
115409 Москва, Россия
2 ФГБУ НМИЦ Онкологии им. Н.Н. Блохина Минздрава России
115478 Москва, Россия
3 Школа № 1568 им. Пабло Неруды
127221 Москва, Россия
4 Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
(Сеченовский университет)
119991 Москва, Россия
* E-mail: koudan1980@gmail.com
Поступила в редакцию 10.08.2021
После доработки 31.08.2021
Принята к публикации 01.09.2021
- EDN: GEQBPH
- DOI: 10.31857/S0041377122010059
Аннотация
В последнее время сфероиды привлекают широкое внимание исследователей в качестве 3D моделей для тестирования лекарственных препаратов. Одной из ключевых особенностей сфероидов является то, что они могут состоять как из одного, так и из нескольких типов клеток. Существует гипотеза, что использование гетеросфероидов из нескольких типов клеток при тестировании противоопухолевых препаратов может позволить лучше воспроизвести структуру опухоли и, как следствие, повысить предиктивность исследования. Для проверки этой гипотезы в настоящей работе проведено тестирование активности восьми противоопухолевых препаратов на гомосфероидах, состоящих из клеток рака поджелудочной железы PANC-1, и гетеросфероидах из трех типов клеток: клеток рака поджелудочной железы PANC-1, первичных фибробластов человека и клеток эндотелия пупочной вены человека HUVEC. Установлено, что использование гетеросфероидов из нескольких типов клеток более точно отражающих микроокружение опухоли, не приводит к заметному изменению активности препаратов. Также проведена подкожная трансплантация сфероидов из PANC-1 иммунодефицитным мышам и показано, что полученная модель рака поджелудочной железы более эффективно воспроизводит агрессивный фенотип опухоли по сравнению с трансплантацией клеток в суспензии.
Несмотря на стремительный прогресс в методах диагностики и улучшение показателей выживаемости многих видов рака, заболеваемость и смертность от рака поджелудочной железы продолжает расти во всем мире. Рак поджелудочной железы по-прежнему характеризуется высокой летальностью, низкой пятилетней выживаемостью, агрессивным течением заболевания и трудностями раннего выявления. По глобальным прогнозам, заболеваемость раком поджелудочной железы увеличится до 18.6% на 100000 человек в 2050 г. при среднегодовом приросте на 1.1% (Hu et al., 2021). В связи с этим использование моделей, релевантных клинической ситуации, для тестирования противоопухолевых препаратов имеет большое значение для эффективного лечения рака.
Монослойная 2D культура клеток широко используется в исследовательских лабораториях и фармкомпаниях для тестирования лекарственных препаратов. Это объясняется простотой работы с клетками в монослое, низкой стоимостью анализов и наличием отработанных протоколов. Однако в последнее время все большее распространение получают работы, в которых для тестирования лекарственных средств используют 3D культуры клеток, в частности сфероиды (Brajša et al., 2016a; Fang, Eglen, 2017). 3D модели лучше отражают архитектуру тканей и органов, обеспечивают все виды клеточных взаимодействий и взаимодействий клеток с внеклеточным матриксом (Akasov et al., 2016; Тригуб и др., 2019).
В большинстве работ наблюдается повышенная устойчивость сфероидов к химиотерапевтическим препаратам по сравнению с монослоем клеток (Балалаева и др., 2017; Uematsu et al., 2018). Это может объясняться многими факторами, связанными с их внутренней организацией, такими как гипоксия, изменение клеточного метаболизма, кислая микросреда, клеточная гетерогенность, межклеточные взаимодействия и взаимодействия с внеклеточным матриксом (Weigelt et al., 2010; Liao et al., 2014; Hoffmann et al., 2015). Хотя большинство исследований продемонстрировали, что клетки в сфероидах более устойчивы к химиотерапии, чем клетки в 2D-монослоях, в некоторых исследованиях сфероиды оказались сравнимо или даже более чувствительны к противоопухолевым агентам, чем их двухмерные монослойные аналоги (Frankel et al., 2000; Brajša et al., 2016b).
Еще одним фактором, который может влиять на результаты тестирования, является диаметр используемых сфероидов. Известно, что кислород и питательные вещества могут проникать на расстояние, не превышающее 100–150 мкм (Kinney et al., 2014). Это означает, что для эффективного проникновения противоопухолевых препаратов в сфероид, его диаметр не должен превышать 250–300 мкм.
На сегодняшний день среди исследователей нет единого мнения относительно того, могут ли сфероиды состоять только из опухолевых клеток или необходимо добавление и других типов клеток.
Для применения в высокопроизводительном скрининге in vitro модель должна быть максимально простой и воспроизводимой. С этой точки зрения использование сфероидов, состоящих из одного типа клеток, значительно упрощает и ускоряет процесс тестирования. С другой стороны, создание смешанных сфероидов из нескольких типов клеток с целью воспроизведения микроокружения опухоли может улучшить предиктивность исследования.
Для тестирования противоопухолевых препаратов in vivo широко используются модели перевиваемых опухолей человека и животных. В настоящее время при подкожной трансплантации ксенографтов опухолей человека иммунодефицитным мышам используют суспензию опухолевых клеток. Однако не все опухолевые клетки человека обладают достаточной туморогенностью и способны формировать опухоли у животных. В ряде случаев происходит рассасывание трансплантированной клеточной суспензии. Такие же трудности возникают при адаптации к росту in vivo фрагментов опухолевых тканей, полученных от пациентов. Использование для трансплантации сфероидов, представляющих собой трехмерные структуры с активно делящимися клетками и микросредой, характерной для опухолевого окружения, может позволить избежать рассасывания трансплантата.
В настоящей работе проведен сравнительный анализ активности восьми противоопухолевых препаратов на гомосфероидах, состоящих только из опухолевых клеток, и гетеросфероидах, состоящих из опухолевых клеток, фибробластов и эндотелия. Также протестирована возможность создания опухолевой модели in vivo путем подкожного введения сфероидов иммунодефицитным мышам.
МАТЕРИАЛ И МЕТОДИКА
Формирование сфероидов из клеточной линии рака поджелудочной железы PANC-1 и смешанных сфероидов из PANC-1, первичных фибробластов человека HF и клеток эндотелия пупочной вены человека HUVEC. В работе использовали клетки рака поджелудочной железы PANC-1 (ATCC), первичные фибробласты человека HF (LONZA) и клетки эндотелия пупочной вены человека HUVEC (PromoCell). PANC-1 и HF культивировали в среде DMEM (Gibco, США), содержащей 2 мМ L-глутамин (Панэко, Россия) и 1‑кратный раствор антибиотика-антимикотика (Gibco, США), с добавлением 10% (v/v) фетальной бычьей сыворотки (Gibco, США) при 37°C и 5% CO2. HUVEC культивировали в среде М200 (Gibco, США), содержащей 1-кратный раствор добавки для роста (LSGS; low serum growth supplement; Gibco, США) и 1-кратный раствор антибиотика-антимикотика (Gibco, США) при 37°C и 5% CO2. Для снятия клеток с подложки использовали раствор Версена (Панэко, Россия) и 0.25%-ный раствор трипсина-ЭДТА (Gibco, США).
Сфероиды получали с помощью 96-луночных планшетов с низкоадгезивным покрытием фирмы Corning (США). Для получения сфероидов из PANC-1 готовили суспензию клеток в культуральной среде с концентрацией 2500 клеток на миллилитр. В каждую ячейку планшетов вносили по 100 мкл суспензии. Для получения смешанных сфероидов из PANC-1, HF и HUVEC, готовили суспензии клеток в соответствующих культуральных средах с концентрацией 2500 клеток на миллилитр, после чего смешивали суспензии в отношении PANC-1 : HF : HUVEC = = 1 : 9 : 4 и в каждую ячейку планшетов вносили по 100 мкл полученной смешанной суспензии. Для получения смешанных сфероидов из HF и HUVEC, готовили суспензии клеток в соответствующих культуральных средах с концентрацией 2500 клеток на миллилитр, после чего смешивали суспензии в отношении HF : HUVEC = 9 : 4 и в каждую ячейку планшетов вносили по 100 мкл полученной смешанной суспензии. Для формирования сфероидов планшеты инкубировали при 37°C и 5% CO2 в течение 72 ч.
Оценка жизнеспособности сфероидов, обработанных противоопухолевыми препаратами. В исследовании использовали восемь противоопухолевых препаратов: доксорубицин, фторурацил, винкристин (Тева, Нидерланды); цисплатин, этопозид (Эбеве Фарма, Австрия); оксалиплатин (Санофи, Франция); циклофосфамид (Бакстер, Германия); гемцитабин (Лилли, Франция). С помощью 96-луночных планшетов с низкоадгезивным покрытием сформировали сфероиды с первоначальной концентрацией 250 клеток на сфероид. Через 72 ч к сфероидам добавили препараты в тестируемых концентрациях (10–3–10–8 М для доксорубицина, цисплатина, этопозида и оксалиплатина; 10–2–10–7 М для фторурацила и циклофосфамида; 10–5–10–10 М для винкристина и гемцитабина, шаг разбавления 3.16) и инкубировали в течение 72 ч. Через 72 ч в каждую лунку планшетов добавили тест-систему на живые клетки CellTiter-Glo 3D (Promega, США) в соотношении 1 : 1 по объему и инкубировали на протяжении 60 мин. Интенсивность люминесценции измеряли с помощью мультифункционального ридера Victor X3 (Perkin Elmer, США), далее абсолютные значения люминесценции нормализовали следующим образом: cигнал люминесценции сфероидов, необработанных противоопухолевыми препаратами, принимали за 100% жизнеспособности. Жизнеспособность рассчитывали как процентное отношение сигналов люминесценции обработанных и необработанных препаратами сфероидов. Для каждого препарата рассчитывали IC50 – концентрацию, при которой жизнеспособность равна 50%.
Эксперименты на животных. В опытах были использованы 8-недельные иммунодефицитные мыши-самки линии Balb/c nude весом 20–22 г (n = 8) из разведения НМИЦ онкологии им. Н.Н. Блохина Минздрава России. Животных содержали в стерильном боксовом помещении с естественным освещением в клетках индивидуального содержания животных со свободным доступом к брикетированному корму и воде. В помещении поддерживали 26 ± 2°С температуры и 55 ± 15% влажности окружающего воздуха. Трансплантацию PANC-1 в виде клеточной суспензии проводили под кожу правого бока по 3.0 × × 106 клеток в 500 мкл натрий-фосфатного буфера на мышь. С помощью агарозных форм были сформированы сфероиды из PANC-1, с концентрацией 2000 клеток на сфероид, согласно методике, описанной ранее (Кудан и др., 2021). 1-дневные сфероиды вводили с использованием иглы диаметром 18G по 1500 сфероидов на мышь. Измерение опухолевого узла проводили после введения опухолевых клеток 2 раза в неделю в течение 40 дней. Объем опухолевого узла определяли по формуле:
V = $\frac{\pi }{6}$LWH, где L, W, H – линейные размеры опухоли.
Индекс прироста опухоли (I) вычисляли по формуле:
${{I}_{i}} = {{{{V}_{i}}} \mathord{\left/ {\vphantom {{{{V}_{i}}} {{{V}_{{\text{o}}}}}}} \right. \kern-0em} {{{V}_{{\text{o}}}}}},$ где, I – индекс прироста опухоли, i – сутки эксперимента, ${{V}_{{\text{o}}}}$ – объем опухоли в день начала лечения.
После последнего измерения на 40-е сут после трансплантации опухоли проводили эвтаназию животных путем цервикальной дислокации шейных позвонков. Все манипуляции с лабораторными животными были выполнены в соответствии с Международными рекомендациями по проведению медико-биологических исследований с использованием животных (Большаков и др., 2002).
Анализ данных. Обработку экспериментальных данных и статистический анализ проводили в программе GraphPad Prism 5 (GraphPad Software). Все исследуемые концентрации препаратов тестировали в квадруплетах. Расчет IC50 проводили методом нелинейной регрессии с использованием трехпараметрической модели доза–эффект. Все эксперименты были проведены в четырех независимых повторах. В качестве описательных статистик в работе приведены среднее арифметическое, стандартная ошибка среднего (SEM) и стандартное отклонение (SD). Для сравнения количественных признаков в группах применяли одновариантный дисперсионный анализ ANOVA с post hoc тестом Тьюки и критерий Манна–Уитни. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ
Формирование сфероидов. Для оценки суммарной антипролиферативной и цитотоксической активности противоопухолевых препаратов доксорубицина, цисплатина, фторурацила, этопозида, оксалиплатина, циклофосфамида, винкристина и гемцитабина было сформировано два вида сфероидов: сфероиды, состоящие только из клеток рака поджелудочной железы PANC-1, и сфероиды, состоящие из PANC-1, первичных фибробластов человека HF и клеток эндотелия пупочной вены человека HUVEC. Добавление к опухолевым клеткам двух других типов клеток позволило более точно воспроизвести состав опухоли и оценить, влияет ли более сложный состав сфероидов на полученные значения активности препаратов.
Для оценки цитотоксической активности тестируемых препаратов были использованы смешанные сфероиды, состоящие из HF и HUVEC. Оба типа клеток не пролиферируют в составе сфероидов, поэтому снижение количества метаболически активных клеток в сфероидах, обработанных препаратами, было результатом гибели клеток, а не торможения их пролиферации.
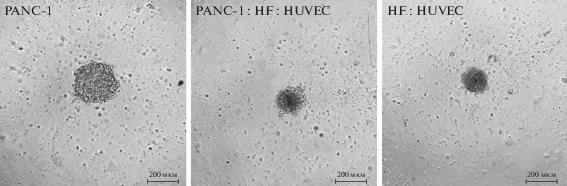
Как уже было упомянуто ранее, для полного проникновения тестируемых препаратов в центр сфероидов диаметр последних не должен превышать 250–300 мкм. Для исследования нами были сформированы сфероиды трех типов, состоящие из 250 клеток суммарно. Диаметры 3-дневных сфероидов из PANC-1, PANC-1 : HF : HUVEC и HF : HUVEC составляли 278 ± 26, 196 ± 21 и 193 ± 19 мкм соответственно (рис. 1).
Рис. 1.
Внешний вид 3-дневных сфероидов из PANC-1, PANC-1 : HF : HUVEC и HF : HUVEC. Фазово-контрастная микроскопия.
Влияние противоопухолевых препаратов на пролиферацию и жизнеспособность клеток в сфероидах. Тестируемые препараты были добавлены к 3-дневным сфероидам в различных концентрациях и через 72 ч проведен анализ количества живых метаболически активных клеток с помощью тест-системы CellTiter-Glo 3D. Кривые зависимости жизнеспособности клеток от концентрации тестируемых препаратов приведены на рис. 2. Значения полуингибиторных концентраций (IC50), рассчитанных на основании кривых, указаны в табл. 1.
Рис. 2.
Кривые зависимости жизнеспособности сфероидов из PANC-1, PANC-1 : HF : HUVEC и HF : HUVEC от концентрации противоопухолевых препаратов. Штриховая кривая (кружки) – сфероиды из PANC-1, сплошная кривая (треугольники) – сфероиды из PANC-1 : HF : HUVEC, штриховая кривая (ромбы) – сфероиды из HF : HUVEC. Показаны средние значения ±SEM, n = 4.

Таблица 1.
Оценка активности противоопухолевых препаратов на сфероидах из PANC-1, PANC-1 : HF : HUVEC и HF : HUVEC
| Соединение | IC50 ± SD, мкМ | р-значение* | ||||
|---|---|---|---|---|---|---|
| PANC-1 | PANC-1 : HF : : HUVEC | HF : HUVEC | PANC-1 vs PANC-1 : HF : : HUVEC |
PANC-1 vs HF : HUVEC |
PANC-1 : HF : : HUVEC vs HF : : HUVEC | |
| Доксорубицин | 0.15 ± 0.01 | 0.071 ± 0.001 | 0.61 ± 0.28 | ns | <0.001 | <0.001 |
| Цисплатин | 369 ± 126 | 229 ± 110 | 2458 ± 1016 | ns | <0.001 | <0.001 |
| Фторурацил | 12.1 ± 1.7 | 10.5 ± 1.7 | 519 ± 123 | ns | <0.0001 | <0.0001 |
| Этопозид | 3.6 ± 1.6 | 1.3 ± 0.8 | 104 ± 12 | ns | <0.0001 | <0.0001 |
| Оксалиплатин | 1.5 ± 0.2 | 0.96 ± 0.15 | 112 ± 15 | ns | <0.0001 | <0.0001 |
| Циклофосфамид | 866 ± 118 | 120 ± 10 | 3427 ± 1130 | ns | <0.0001 | <0.0001 |
| Винкристин | 0.0023 ± 0.0003 | 0.0016 ± 0.0002 | >10 | <0.001 | <0.0001 | <0.0001 |
| Гемцитабин | 0.0082 ± 0.0016 | 0.0071 ± 0.0010 | 5.6 ± 1.2 | ns | <0.0001 | <0.0001 |
Как видно из рис. 2 и табл. 1, наибольшая активность препаратов проявляется на сфероидах, сформированных из трех типов клеток. Однако статистический анализ показывает, что разница между значениями IC50 для сфероидов из PANC-1 и сфероидов из PANC-1 : HF : HUVEC статистически не значима для всех препаратов, кроме винкристина. Но и в случае винкристина полученные значения IC50 очень близки и составляют 2.3 и 1.6 нМ.
Значения IC50 для сфероидов из HF : HUVEC значительно выше, чем для двух других типов сфероидов, поскольку они отражают только цитотоксическую активность исследуемых препаратов. Наибольший разрыв в значениях IC50 между сфероидами, содержащими и не содержащими опухолевые клетки, наблюдается для оксалиплатина, винкристина и гемцитабина.
Сравнительный анализ динамики роста опухолей при трансплантации клеток и сфероидов из PANC-1 иммунодефицитным мышам. Для создания перевиваемых опухолевых моделей эквивалентные количества PANC-1, находящихся в виде клеточной суспензии и в составе 1-дневных сфероидов, были подкожно трансплантированы мышам Balb/c nude, после чего была изучена динамика роста опухолей. На 8 сут после трансплантации материала опухолевые узлы пальпировались у всех животных в группе со сфероидами, и только у 50% животных в группе с клетками. В группе мышей с клетками наблюдали более длительную латентную фазу роста, составляющую 25 сут, по сравнению с группой со сфероидами, в которой латентная фаза была равна 18 сут (рис. 3). Индекс прироста опухоли (ИПО) на 18 сут для клеток составил 9.7, а для сфероидов – 92.7 (рис. 4). К концу наблюдения ИПО для сфероидов был в 2 раза выше по сравнению с ИПО для клеток, составляя 1095 против 564 соответственно. Таким образом, динамика роста опухоли при подкожной трансплантации сфероидов из PANC-1 отличается более короткой латентной фазой и высокой скоростью в экспоненциальной фазе по сравнению с трансплантацией клеток в виде суспензии.
Рис. 3.
Динамика роста объемов (V) подкожных ксенографтов из клеток и сфероидов из PANC-1 у мышей-самок Balb/c nude. Штриховая кривая (кружки) – клетки, сплошная (ромбы) – сфероиды. Показаны средние значения ±SEM, n = 4. Для точек 18, 21, 25, 28 и 32 сут различия между объемами опухолей для клеток и сфероидов достоверны (р < 0.05, критерий Манна–Уитни).

Рис. 4.
Зависимость индекса прироста опухоли (ИПО) от времени для клеток и сфероидов из PANC-1 при подкожной трансплантации мышам-самкам Balb/c nude. Серые столбцы – клетки, белые столбцы– сфероиды. Показаны средние значения ±SEM, n = 4. Для точек 18, 21, 25, 28 и 32 сут различия между ИПО для клеток и сфероидов достоверны (р < 0.05, критерий Манна–Уитни).

ОБСУЖДЕНИЕ
Сфероиды находят все более широкое применение в качестве in vitro моделей для тестирования противоопухолевых препаратов. Создание гетеросфероидов из нескольких типов клеток открывает возможности для гораздо более точного воссоздания структуры опухоли, чем в случае гомосфероидов. Существует большое количество работ, подчеркивающих важность использования именно таких гетеросфероидов для исследований. Однако работы, в которых бы проводилось сравнение активности препаратов на сфероидах, состоящих только из опухолевых клеток и из опухолевых клеток в смеси с другими типами клеток, практически отсутствуют (Lazzari et al., 2018).
В настоящей работе проведено сравнение активности восьми противоопухолевых препаратов на сфероидах из клеток рака поджелудочной железы PANC-1 и смешанных сфероидах из PANC-1 : HF : HUVEC. Исходное суммарное количество клеток в сфероидах было равно 250 клеток и подобрано таким образом, чтобы на момент добавления препаратов диаметр всех сфероидов не превышал 300 мкм и допускал полное проникновение препаратов внутрь сфероидов.
Полученные результаты продемонстрировали, что активность препаратов на двух типах сфероидов практически не различалась. Наблюдали незначительное и статистически недостоверное увеличение активности на сфероидах, состоящих из PANC-1 : HF : HUVEC, по сравнению со сфероидами из PANC-1. Такое увеличение активности скорее связано с разницей в диаметрах гомо- и гетеросфероидов, нежели с их разным составом. В конце инкубации с противоопухолевыми препаратами диаметр контрольных сфероидов составлял 455 ± 27 и 274 ± ± 17 мкм для PANC-1 и PANC-1 : HF : HUVEC соответственно.
Для оценки цитотоксической активности препаратов было проведено их тестирование на гетеросфероидах из HF : HUVEC. Было установлено, что наибольший разрыв между суммарной (антипролиферативной и цитотоксической) и чистой цитотоксической активностью препаратов наблюдался для оксалиплатина, гемцитабина и винкристина. Важно отметить, что именно оксалиплатин и гемцитабин являются классическими препаратами для лечения рака поджелудочной железы. Наиболее интересный результат был получен для винкристина. Данный препарат проявил самую высокую суммарную активность, при этом он не демонстрировал цитотоксической активности в концентрации 10 мкМ и ниже. Наши данные по суммарной активности оксалиплатина, гемцитабина и винкристина на сфероидах из PANC-1 хорошо согласуются с результатами работ других авторов (Melisi et al., 2011; Bhagwandin et al., 2016), в которых оценивали активность тех же препаратов на монослое клеток.
Сравнительный анализ динамики роста подкожных ксенографтов из клеток и сфероидов из PANC-1 показал, что сфероиды, трансплантированные подкожно, обладают более стабильным и быстрым темпом роста по сравнению с суспензией клеток. Высокая скорость роста сфероидов из PANC-1, вероятно, связана с более сложной структурой и микроокружением, что позволяет им быстро адаптироваться и расти в условиях in vivo. Ранее было показано, что более тесное взаимодействие клеток в сфероидах из PANC-1 по сравнению с 2D-культурой способствует более активному экзосомному межклеточному транспорту веществ, в том числе белка глипикана-1 и ряда микроРНК, являющихся маркерами более агрессивного роста рака поджелудочной железы (Tu et al., 2021).
Таким образом, в настоящей работе проведено тестирование восьми противоопухолевых препаратов на гомосфероидах из PANC-1 и гетеросфероидах из PANC-1, HF и HUVEC. Согласно полученным данным, препараты проявляли одинаковую активность на гомо- и гетеросфероидах, свидетельствующую о том, что добавление дополнительных типов клеток к опухолевым клеткам не является необходимым требованием при тестировании и не оказывает значительного влияния на результаты исследования. Важно подчеркнуть, что для получения интерпретируемых результатов необходимо использовать сфероиды маленького диаметра, допускающего полное проникновение тестируемых препаратов внутрь сфероида. Также показано, что подкожная трансплантация опухолевых сфероидов из PANC-1 иммунодефицитным мышам приводит к более раннему и быстрому росту опухоли по сравнению с трансплантацией клеток в суспензии. Можно предположить, что описанный метод создания перевиваемой in vivo модели путем подкожной трансплантации сфероидов позволит получать опухоли у иммунодефицитных мышей в тех случаях, когда трансплантация клеточной суспензии не является эффективной.
Список литературы
Балалаева И.В., Соколова Е.А., Пужихина А.Д., Брилкина А.А., Деев С.М. 2017. Сфероиды HER2-положительной аденокарциномы молочной железы человека как модель для тестирования противоопухолевых иммунотоксинов. Acta Naturae. Т. 9. № 1. С. 38. (Balalaeva I.V., Sokolova E.A., Puzhikhina A.D., Brilkina A.A., Deyev S.M. 2017. Spheroids of HER2-positive breast adenocarcinoma for studying anticancer immunotoxins in vitro. Acta Naturae. V. 9. № 1. P. 38.)
Большаков О.П., Незнанов Н.Г., Бабаханян Р.В. 2002. Дидактические и этические аспекты проведения исследований на биомоделях и на лабораторных животных. Качественная клиническая практика. Т. 1. С. 58. (Bolshakov O.P., Neznanov N.G., Babakhanyan R.V. 2002. Didactic and ethical aspects of research on biomodels and laboratory animals. Kachestvennaya klinicheskaya praktika. V. 1. P. 58.)
Кудан Е.В., Кудан С.П., Каршиева С.Ш., Хесуани Ю.Д., Миронов В.А., Буланова Е.А. 2021. Определение активности цитостатиков в 3D условиях культивирования в сравнении с монослойной культурой. Цитология. Т. 63. № 3. С. 244. (Koudan E.V., Kudan S.P., Karshieva S.Sh., Khesuani Yu.D., Mironov V.A., Bulanova E.A. 2021. The determination of cytostatic activity on a 3D spheroids-based model in comparison with conventional monolayer culture. Tsitologiya. V. 63. № 3. P. 244.)
Тригуб М.М., Филатова Н.В., Арешидзе Д.А., Сень В.Д., Терентьев А.А. 2019. Сравнение действия комплексов платины(IV) на сфероиды и монослойную культуру клеток HeLa. Клеточные технол. биол. мед. № 4. С. 273. (Trigub М.М., Filatova N.V., Areshidze D.А., Sen'1 V.D., Terentiev А.А. 2019. Comparison of the effect of platinum(IV) complexes on spheroids and monolayer culture of HeLa cells. Bull. Exp. Biol. Med. № 4. P. 273.)
Akasov R., Zaytseva-Zotova D., Burov S., Leko M., Dontenwill M., Chiper M., Vandamme T., Markvicheva E. 2016. Formation of multicellular tumor spheroids induced by cyclic RGD-peptides and use for anticancer drug testing in vitro. Int. J. Pharm. V. 506. P. 148.
Bhagwandin V.J., Bishop J.M., Wright W.E., Shay J.W. 2016. The metastatic potential and chemoresistance of human pancreatic cancer Stem cells. PLoS One. V. 11. P. e0148807.
Brajša K., Trzun M., Zlatar I., Jelić D. 2016a. Three-dimensional cell cultures as a new tool in drug discovery. Period. Boil. V. 118. P. 59.
Brajša K., Vujasinović I., Jelić D., Trzun M., Zlatar I., Karminski-Zamola G., Hranjec M. 2016b. Antitumor activity of amidino-substituted benzimidazole and benzimidazo[1,2-a]quinoline derivatives tested in 2D and 3D cell culture systems. J. Enzyme Inhib. Med. Chem. V. 31. P. 1139.
Fang Y., Eglen R.M. 2017. Three-dimensional cell cultures in drug discovery and development. SLAS Discovery. V. 22. P. 456.
Frankel A., Man S., Elliott P., Adams J., Kerbel R.S. 2000. Lack of multicellular drug resistance observed in human ovarian and prostate carcinoma treated with the proteasome inhibitor PS-341. Clin. Cancer Res. V. 6. P. 3719.
Hoffmann O.I., Ilmberger C., Magosch S., Joka M., Jauch K.W., Mayer B. 2015. Impact of the spheroid model complexity on drug response. J. Biotechnol. V. 205. P. 14.
Hu J.X., Zhao C.F., Chen W.B., Liu Q.C., Li Q.W., Lin Y.Y., Gao F. 2021. Pancreatic cancer: A review of epidemiology, trend, and risk factors. World J. Gastroenterol. V. 27. P. 4298.
Kinney M.A., Hookway T.A., Wang Y., McDevitt T.C. 2014. Engineering three-dimensional stem cell morphogenesis for the development of tissue models and scalable regenerative therapeutics. Ann. Biomed. Eng. V. 42. P. 352.
Lazzari G., Nicolas V., Matsusaki M., Akashi M., Couvreur P., Mura S. 2018. Multicellular spheroid based on a triple co-culture: A novel 3D model to mimic pancreatic tumor complexity. Acta Biomater. V. 78. P. 296.
Liao J., Qian F., Tchabo N., Mhawech-Fauceglia P., Beck A., Qian Z., Wang X., Huss W.J., Lele S.B., Morrison C.D., Odunsi K. 2014. Ovarian cancer spheroid cells with stem cell-like properties contribute to tumor generation, metastasis and chemotherapy resistance through hypoxia-resistant metabolism. PLoS One. V. 9. P. e84941.
Melisi D., Xia Q., Paradiso G., Ling J., Moccia T., Carbone C., Budillon A., Abbruzzese J.L., Chiao P.J. 2011. Modulation of pancreatic cancer chemoresistance by inhibition of TAK1. J. Natl. Cancer Inst. V. 103. P. 1190.
Tu J., Luo X., Liu H., Zhang J., He M. 2021. Cancer spheroids derived exosomes reveal more molecular features relevant to progressed cancer. Biochem. Biophys. Rep. V. 26. P. 101 026.
Uematsu N., Zhao Y., Kiyomi A., Yuan B.O., Onda K., Tanaka S., Sugiyama K., Sugiura M., Takagi N., Hayakawa A., Hirano T. 2018. Chemo-sensitivity of two-dimensional monolayer and three-dimensional spheroid of breast cancer MCF-7 cells to daunorubicin, docetaxel, and arsenic disulfide. Anticancer Res. V. 38. P. 2101.
Weigelt B., Lo AT, Park C.C., Gray J.W., Bissell M.J. 2010. HER2 signaling pathway activation and response of breast cancer cells to HER2-targeting agents is dependent strongly on the 3D microenvironment. Breast Cancer Res. Treat. V. 122. P. 35.
Дополнительные материалы отсутствуют.


