Цитология, 2022, T. 64, № 1, стр. 86-95
Структурный полиморфизм амилоидных фибрилл на основе лизоцима
Н. М. Мельникова 1, М. И. Сулацкий 1, И. М. Кузнецова 1, К. К. Туроверов 1, *, А. И. Сулацкая 1, **
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: kkt@incras.ru
** E-mail: ansul@mail.ru
Поступила в редакцию 30.07.2021
После доработки 26.08.2021
Принята к публикации 26.08.2021
- EDN: QBXISR
- DOI: 10.31857/S0041377122010060
Аннотация
Согласно современным представлениям, полиморфизм амилоидных фибрилл может быть причиной различий в их цитотоксичности, а также вариабельности амилоидозов. Целью данной работы стало изучение структуры и свойств амилоидных фибрилл на основе модельного амилоидогенного белка лизоцима, полученных при различных условиях фибриллогенеза (при различной концентрации денатурирующего агента гуанидингидрохлорида) с применением широкого спектра физико-химических методов, в том числе специально разработанных. В результате проведенных исследований были показаны различия по следующим параметрам: 1) склонность фибриллярных волокон к взаимодействию друг с другом и размер формирующихся кластеров; 2) вторичная структура и микроокружение триптофановых остатков амилоид-формирующих белков; 3) характеристики взаимодействия фибрилл с тиофлавином Т (ThT) – амилоид-специфическим флуоресцентным зондом; 4) устойчивость амилоидов к воздействию ионного детергента додецилсульфата натрия и кипячению. Полученные результаты свидетельствуют о полиморфизме исследуемых белковых агрегатов. Результаты работы позволили сделать заключение о том, что полученные амилоидные фибриллы являются перспективным объектом для проведения дальнейших исследований, направленных на выявление связи структуры амилоидов с их цитотоксичностью.
Долгое время агрегацию белков в процессе фолдинга считали артефактом (Jahn, Radford, 2008). Ситуация заметно изменилась, когда было показано, что нарушения на пути сворачивания белка или изменение их нативной структуры в результате каких-либо внешних воздействий могут быть причиной патологической агрегации белков, которая приводит к развитию амилоидозов (например, системного лизоцимового, инсулинового, гемодиализного амилоидозов) и сопутствует ряду нейродегенеративных заболеваний, таких как, болезнь Альцгеймера, прионные болезни, болезнь Гентингтона и др. (Prusiner et al., 1983; Vassar et al., 1999; Chartier-Harlin et al., 2004; Valentine et al., 2005; Warby et al., 2009). К настоящему времени известно более пятидесяти белков (пептидов), накапливающихся в агрегированной форме при различных заболеваниях (Westermark et al., 2005; Chiti, Dobson, 2006; Eisenberg, Jucker, 2012). Причиной аномальной агрегации белков считается переход белка из нативной конформации в патологическую, в которой молекулы могут взаимодействовать друг с другом и формировать упорядоченные белковые агрегаты – амилоидные фибриллы (Nelson et al., 2005; Jahn, Radford, 2008). Увеличение концентрации этих белковых агрегатов и их накопление в тканях и органах может происходить бесконтрольно и приводить к существенному ухудшению качества жизни пациентов или к летальному исходу.
Термин амилоид долгое время ассоциировался только с патологическими процессами. Однако результаты недавних исследований свидетельствуют о том, что белки в фибриллярной форме также могут выполнять важнейшие физиологические функции (защитную, строительную, запасающую, сигнальную, транспортную и многие др.), которые необходимы для нормального функционирования клеток и тканей бактерий, грибов, растений, насекомых и млекопитающих (Collinson et al., 1991; Costerton et al., 1999; Barnhart, Chapman, 2006; Fowler et al., 2007; Pham et al., 2014; Avni et al., 2019; Otzen, Riek, 2019). В связи с многообразием функций и уникальными механическими свойствами (высокой растяжимостью и прочностью) амилоидов (Cherny, Gazit, 2008), а также их широкой распространенностью в природе, изучение этих белковых агрегатов в настоящее время является весьма актуальной задачей.
Несмотря на различие структуры амилоидогенных белков, все амилоиды имеют схожую морфологию: они представляют собой длинные, неразветвленные образования, богатые β-складчатой структурой, в которой β-листы ориентированы перпендикулярно оси фибриллы (Sunde et al., 1997; Ivanova et al., 2006; Nelson, Eisenberg, 2006 ). В связи с этим долгое время предполагали, что структура амилоидов на основе различных белков полностью идентична. Однако позднее были показаны различия в структурной организации как амилоидов на основе различных белков, так и фибрилл, сформированных при разных условиях на основе одного и того же белка (Fandrich et al., 2009; Sneideris et al., 2015; Sulatskaya et al., 2015; Iadanza et al., 2018). При этом недавние исследования показали, что структура амилоидов может влиять на их цитотоксичность (Stefani, 2010; Tycko, 2015), в связи с чем выявление внешних факторов, способных приводить к полиморфизму амилоидов, стало важнейшей прикладной задачей.
Цель настоящей работы заключалась в изучении полиморфизма амилоидных фибрилл на основе модельного амилоидогенного белка лизоцима, полученных в присутствии денатурирующего агента гуанидингидрохлорида (GdnHCl) в различных концентрациях, с использованием различных физико-химических методов.
МАТЕРИАЛ И МЕТОДИКА
Материалы. В работе использовали тиофлавин Т (ThT) (UltraPure Grade; AnaSpec, США), лизоцим, KH2PO4, NaOH и GdnHCl (Sigma, США). ThT и компоненты буфера растворяли в деионизированной воде.
Получение амилоидных фибрилл. Для получения амилоидных фибрилл на основе лизоцима использовали буферный раствор – 50 мМ KH2PO4/NaOH (рН 6.3), не содержащий денатурирующего агента GdnHCl и содержащий его в концентрации 0.05 и 3 М (Vernaglia et al., 2004; Sulatskaya et al., 2017). Белок в концентрации 2 мг/мл инкубировали в буферном растворе в термостате при температуре 57°С и интенсивном перемешивании на магнитной мешалке в течение 2 сут. Далее сформированные белковые агрегаты переводили в дистиллированную воду с помощью диализа. Подготовленные образцы визуализировaли с использованием просвечивающей электронной микроскопии.
Равновесный микродиализ. Равновесный микродиализ (Kuznetsova et al., 2012c) проводили с использованием приспособления фирмы Harvard Apparatus/Amika (США), которое состоит из двух камер равного объема (500 мкл), разделенных мембраной, непроницаемой для частиц массой больше 12 000 Да.
Абсорбционная спектроскопия. Спектры поглощения образцов регистрировали с использованием спектрофотометра U-3900H (Hitachi, Япония). Для определения концентрации свободного ThT и лизоцима использовали коэффициент молярной экстинкции 31589 (М−1 см−1) при длине волны 412 нм и 37752 (М−1 см−1) при длине волны 280 нм соответственно. Мутность образцов, содержащих фибриллы, контролировали путем измерения оптической плотности при 350 нм. При обработке зарегистрированных спектров поглощения ThT в присутствии амилоидных фибрилл из измеренных спектров был исключен вклад светорассеяния амилоидных фибрилл с использованием стандартного протокола (Vladimirov, Litvin, 1964).
Спектры кругового дихроизма (КД). Спектры КД в дальней ультрафиолетовой области регистрировали с использованием спектрополяриметра J-810 (Jasco, Япония).
Флуоресцентная спектроскопия. Спектры флуоресценции регистрировали с использованием спектрофлуориметра Cary Eclipse (Varian, Австралия). Коррекцию зарегистрированных спектров флуоресценции на эффект первичного внутреннего фильтра проводили с использованием специально разработанной методики (Fonin et al., 2014). Для определения рэлеевского светорассеяния (RLS) флуоресценцию в образцах с фибриллами возбуждали и регистрировали при длине волны 530 нм.
Для оценки времени жизни возбужденного состояния ThT, встроенного в амилоидные фибриллы, измеряли кривые затухания флуоресценции красителя с использованием спектрометра Fluo Time 300 (PicoQuant GmbH, Германия) при длине волны возбуждения 440 нм.
Электронная микроскопия. Для получения электронных микрофотографий использовали метод негативного контрастирования 1%-ным водным раствором уранилацетата. Суспензию фибрилл наносили на медные сетки, покрытые формвар-карбоновой пленкой.
Конфокальная флуоресцентная микроскопия. Для визуализации амилоидных фибрилл в присутствии флуоресцентного зонда ThT использовали конфокальный лазерный сканирующий микроскоп Olympus FV 3000 (Olympus, Япония). Была выбрана фиксированная длина волны возбуждения лазера (405 нм), регистрацию флуоресцентного света проводили в диапазоне 420–520 нм. Использовали иммерсионный объектив с увеличением 60× и числовой апертурой NA 0.6.
SDS-электрофорез в полиакриламидном геле (SDS-PAGE). Для оценки стабильности амилоидных фибрилл на основе лизоцима образцы инкубировали в буфере Лэммли, содержащем 2% ионного детергента додецилсульфата натрия (SDS), и кипятили в течение 5 мин. Образцы исследовали с помощью SDS-электрофореза в 17% полиакриламидном геле.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфология агрегатов на основе лизоцима, сформированных в отсутствие и в присутствии GdnHCl. Согласно данным, полученным с использованием просвечивающей электронной микроскопии, в образце, инкубировавшемся в отсутствие GdnHCl, наряду с фибриллярными структурами (рис. 1б) были обнаружены неупорядоченные белковые агрегаты (рис. 1а). При этом образцы, полученные в присутствии 0.05 и 0.3 GdnHCl (рис. 1в–г) оказались гомогенны и содержали только упорядоченные амилоидные фибриллы. Оказалось, что амилоиды, сформировавшиеся в отсутствие, а также в присутствии GdnHCl в различной концентрации, имеют схожую морфологию: они представляют собой длинные тонкие неразветвленные волокна, склонные к взаимодействию друг с другом и образованию кластеров (рис. 1б–г).
Рис. 1.
Визуализация аморфных агрегатов и амилоидных фибрилл на основе лизоцима, полученных в отсутствие (а, б) и в присутствии GdnHCl в концентрации 0.05 М (в) и 3 М (г). Просвечивающая электронная микроскопия; масштабная линейка: 1 мкм. На вставках – фрагменты изображений в увеличенном масштабе; масштабная линейка: 200 нм.

Полученные образцы были исследованы с использованием конфокальной лазерной сканирующей микроскопии (рис. 2а–в). Согласно данным конфокальной флуоресцентной микроскопии образцов в присутствии амилоид-специфического флуоресцентного зонда тиофлавина Т (ThT), степень кластеризации фибрилл различается: фибриллы, полученные в отсутствие GdnHCl (рис. 2а) и в присутствии 0.05 М GdnHCl (рис. 2б), образуют более крупные и плотные сгустки, чем амилоиды, полученные в присутствии 3 М GdnHCl (рис. 2в).
Рис. 2.
Визуализация кластеров амилоидных фибрилл на основе лизоцима, полученных в отсутствие (а) и в присутствии G-dnHCl в концентрации 0.05 М (б) и 3 М (в). Конфокальная флуоресцентная микроскопия в присутствии тиофлавина T (ThT). Масштабная линейка: 15 мкм.

Таким образом, оказалось, что молекула лизоцима в отсутствие GdnHCl может формировать два альтернативных типа агрегатов: амилоидные фибриллы и аморфные агрегаты. Присутствие GdnHCl, по-видимому, смещает равновесие в сторону образования амилоидных фибрилл, причем их волокнистая морфология не зависит, а склонность к кластеризации, напротив, зависит от концентрации денатурирующего агента.
Спектральные и фотофизические характеристики амилоидных фибрилл на основе лизоцима. Для подтверждения сделанного предположения о различной степени кластеризации исследуемых белковых агрегатов мы проанализировали мутность и RLS образцов (рис. 3а, б). Было показано, что значения RLS, которые характеризуют размер и количество агрегатов в образце, для фибрилл, полученных при различных условиях фибриллогенеза, заметно различаются. Оказалось, что наиболее низкое значение RLS имеет образец, полученный в присутствии 3 М Gd-nHCl (рис. 3а), что согласуется с наименьшим размером фибриллярных кластеров в этом образце, согласно данными конфокальной микроскопии (рис. 2в). Аналогичные результаты были получены при анализе мутности исследуемых образцов: наиболее низкое значение мутности было показано для образца, полученного в 3 М GdnHCl (рис. 3б). Таким образом, результаты проведенных исследований подтверждают различие линейных размеров фибриллярных агломератов лизоцима в образцах, полученных при различных условиях фибриллогенеза.
Рис. 3.
Спектральные и фотофизические свойства мономерного нативного лизоцима (К) и амилоидных фибрилл на его основе, полученных в отсутствие GdnHCl (0 М) и в его присутствии в концентрации 0.05 и 3 М. а – RLS, б – мутность; в – интегральная интенсивность флуоресценции (ИФ) (ИФинтегр – площадь под кривой спектра флуоресценции), г – спектры флуоресценции, на вставке – нормированные спектры флуоресценции триптофана в амилоидных фибриллах, полученных при различных концентрациях GdnHCl; д – спектры кругового дихроизма, на вставке – спектры кругового дихроизма фибрилл, полученных в отсутствие (0 М) и в присутствии 0.5 М GdnHCl, в увеличенном масштабе.
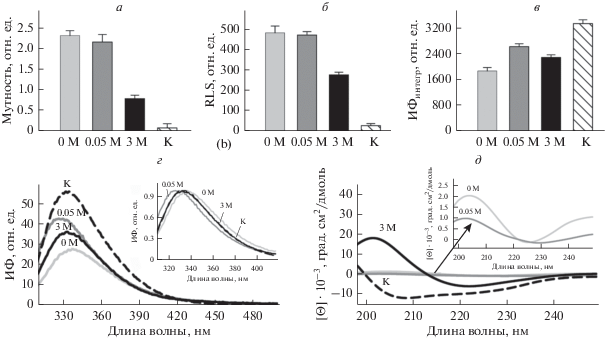
Далее мы зарегистрировали и проанализировали собственную флуоресценцию исследуемых амилоидных фибрилл (рис. 3в, г). Показано заметное различие интегральной интенсивности флуоресценции (рис. 3в) и положения спектров флуоресценции (рис. 3г, вставка) лизоцима в мономерной и фибриллярных формах. Оказалось, что максимум спектра флуоресценции образца, полученного в присутствии 0.05 М GdnHCl, сдвигается в коротковолновую область, а максимум спектра флуоресценции образца, полученного в отсутствие GdnHCl, сдвигается в длинноволновую область по сравнению со спектром мономерного лизоцима. При этом максимум спектра флуоресценции образца, полученного в присутствии 3 М GdnHCl, практически совпадает с максимумом спектра мономерного белка. Обнаруженные различия спектров флуоресценции амилоидных фибрилл, полученных при разных условиях, вероятно, обусловлены различным микроокружением и подвижностью аминокислотных остатков триптофана в исследуемых образцах, что может свидетельствовать о различии их вторичной структуры.
Для того, чтобы подтвердить сделанное предположение о различии вторичной структуры исследуемых амилоидных фибрилл, были зарегистрированы спектры КД образцов в дальней ультрафиолетовой области (рис. 3д). Оказалось, что минимум спектров КД амилоидных фибрилл на основе лизоцима, полученных в отсутствие и в присутствии 0.05 М GdnHCl (рис. 3д, вставка), существенно менее выражен по сравнению с минимумом спектров мономерного белка и амилоидов, полученных в присутствии 3 М GdnHCl (рис. 3д). Вероятно, это обусловлено чрезвычайно высоким светорассеянием этих фибрилл (рис. 3а, б). При этом форма и положение (минимум около 220–230 нм) этих спектров, как и спектра фибрилл, полученных при максимальной концентрации GdnHCl, характерны для амилоидных фибрилл на основе различных амилоидогенных белков (Greenfield, 2006).
С использованием различных базисных наборов белков и специального программного обеспечения CDPro (Provencher, Glockner, 1981; Sreerama, Woody, 2000) было определено содержание элементов вторичной структуры (α-спиралей, β-листов, β-поворотов и неупорядоченной структуры) в исследуемых образцах (табл. 1). Анализ вторичной структуры мономерного лизоцима и амилоидных фибрилл на его основе показал, что в процессе фибриллогенеза мономерный лизоцим, имеющий высокую долю α-спиралей, переходит в состояние, богатое β-складчатой структурой, что хорошо согласуется с данными из литературы, полученными для других амилоидогенных белков (Sunde et al., 1997; Juarez et al., 2009; Harada, Kuroda, 2011). При этом содержание β-листов и β-поворотов в амилоидных фибриллах, полученных в отсутствие и в присутствии 0.05 М G-dnHCl, заметно отличается от содержания β‑структуры в фибриллах, полученных в присутствии 3 М GdnHCl, что свидетельствует о различной структуре фибриллярного остова агрегатов, сформированных при различных условиях. Интересно, что именно для амилоидов, сформировавшихся в присутствии максимальной концентрации денатурирующего агента и имеющих наименьшее содержание неупорядоченной структуры (табл. 1), мы обнаружили наименьшую склонность к формированию кластеров. Возможно, элементы неупорядоченной вторичной структуры, не входящей в остов фибриллы, играют роль во взаимодействии амилоидных волокон друг с другом.
Таблица 1.
Анализ вторичной структуры нативного мономерного лизоцима и амилоидных фибрилл на его основе, полученных при различных концентрациях GdnHCl
| Фибриллы, полученные при концентрации GdnHCl, М | α-Спирали, % | β-Листы, % | β-Повороты, % | Неупорядоченная структура, % |
|---|---|---|---|---|
| 0 | 2.7 ± 0.4 | 44.4 ± 0.4 | 19.0 ± 0.3 | 33.9 ± 0.3 |
| 0.05 | 3.3 ± 0.3 | 43.7 ± 0.3 | 20.1 ± 0.4 | 33.0 ± 0.4 |
| 3.0 | 3.3 ± 0.2 | 54.4 ± 0.7 | 16.5 ± 0.3 | 25.9 ± 0.3 |
| Нативный белок | 33.3 ± 0.5 | 17.8 ± 0.3 | 21.6 ± 0.3 | 27.3 ± 0.5 |
Таким образом, в результате анализа спектральных и фотофизических характеристик амилоидов на основе лизоцима было показано, что условия фибриллогенеза оказывают влияние не только на склонность фибрилл взаимодействовать друг с другом, но и на вторичную структуру белка (как участков, формирующих остов фибриллы, так и фрагментов вне упорядоченного волокна).
Взаимодействие амилоидных фибрилл на основе лизоцима со специфическим флуоресцентным зондом ThT. Для подтверждения предположений о различии структуры фибриллярного остова амилоидов на основе лизоцима, полученных при различных условиях, мы исследовали их взаимодействие с бензтиазольным красителем ThT. Существенной особенностью этого флуоресцентного зонда является то, что его взаимодействие с фибриллами высоко специфично, так как ThT не взаимодействует с белками в нативном (за исключением ацетилхолинэстеразы (De Ferrari et al., 2001) и сывороточных альбуминов (Sen et al., 2009; Rovnyagina et al., 2018)), развернутом или частично-свернутом состояниях, а также с олигомерами и аморфными агрегатами белков. В свободном состоянии в водном растворе ThT имеет чрезвычайно низкий квантовый выход флуоресценции (0.0001), который при взаимодействии красителя с амилоидными фибриллами может увеличиваться в несколько тысяч раз (Sulatskaya et al., 2010).
Благодаря этим уникальным свойствам, ТhT уже долгое время используется в качестве удобного и эффективного инструмента для диагностики возникновения амилоидов in vivo и in vitro (Biancalana et al., 2009; Wu et al., 2009; Biancalana, Koide, 2010; Sulatsky et al., 2020). Кроме того, за последнее десятилетие накопились данные о том, что ТhT может быть использован не только для диагностики образования амилоидных фибрилл, но и для изучения структуры этих белковых агрегатов (Sulatskaya et al., 2015, 2017), что обусловлено взаимодействием красителя непосредственно с фибриллярным остовом амилоида (Krebs et al., 2005). Согласно современным представлениям, краситель встраивается в бороздки, образованные боковыми цепями аминокислот, вдоль длинной оси волокна фибриллы перпендикулярно β-листам (Krebs et al., 2005). Таким образом, анализ спектральных характеристик красителя, связанного с фибриллами, может позволить сделать заключение об их структурном полиморфизме.
Сложность в исследовании взаимодействия ThT с амилоидными фибриллами состоит в том, что образец всегда представляет собой равновесную систему свободного и связанного с амилоидами красителя. При этом фотофизические характеристики этих фракций красителя существенно различаются. Для того, чтобы определить фотофизические характеристики каждой из фракций красителя, присутствующих в образце, мы использовали специально разработанный подход, основанный на подготовке тестируемых образцов методом равновесного микродиализа (Kuznetsova et al., 2012a, 2012b, 2012c). Равновесный микродиализ был выполнен с помощью специального приспособления, которое состоит из двух камер равного объема (объем каждой составляет 500 мкл), разделенных мембраной, проницаемой для ThT и непроницаемой для амилоидных фибрилл. ThT помещали в одну из камер (камера 2), а образец с амилоидными фибриллами в том же растворителе помещали в другую камеру (камера 1). После достижения равновесия спектр поглощения раствора в камере 2 представлял собой спектр поглощения свободного красителя (рис. 4а–в, кривая 1). Спектр поглощения в камере 1 (рис. 4а–в, кривая 2) представлял собой суммарный спектр поглощения свободного и связанного с амилоидными фибриллами красителя (рис. 4а–в, кривая 4) на фоне “кажущегося поглощения”, обусловленного светорассеянием фибрилл (рис. 4а–в, кривая 3).
Рис. 4.
Характеристики взаимодействия флуоресцентного зонда тиофлавина T (ThT) с амилоидными фибриллами на основе лизоцима. а–в – Спектры поглощения ThT после проведения равновесного микродиализа в 2-камерной системе (см. раздел “Материал и методика”) в присутствии амилоидных фибрилл на основе лизоцима, полученных в отсутствие (а) и в присутствии GdnHCl в концентрации 0.05 М (б) и 3 М (в): кривая 1 – спектр поглощения свободного красителя в камере 2, кривая 2 – суммарный спектр поглощения свободного и встроенного в амилоидные фибриллы ThТ, кривая 3 – светорассеяние амилоидных фибрилл в образце в камере 1, кривая 4 – спектр поглощения свободного и связанного с фибриллами красителя после исключения светорассеяния фибрилл. г – Спектры поглощения, д – спектры флуоресценции, е – кривые затухания флуоресценции ThT, связанного с амилоидными фибриллами; у кривых указана концентрация GdnHCl.

На рис. 3г представлены спектры поглощения ThT, связанного с фибриллами на основе лизоцима, полученными при различных условиях фибриллогенеза, которые представляют собой разность спектров поглощения образцов из камер 1 (рис. 4а–в, кривая 4) и 2 (рис. 4а–в, кривая 1). Анализ полученных результатов показал, что поглощение красителя, связанного с фибриллами, полученными в присутствии 0.05 М GdnHCl, превышает поглощение ThT, связанного с фибриллами, сформированными в отсутствие и в присутствии 3 М GdnHCl. Также показана различная величина сдвига спектров поглощения красителя, связанного с фибриллами, в длинноволновую область (максимум спектра ThT, встроенного в фибриллы, полученные в отсутствие и в присутствии GdnHCl в концентрации 0.05 и 3 M, регистрируется при длинах волн 451, 455 и 449 нм соответственно) по сравнению со спектром свободного ThT (максимум спектра при длине волны 412 нм). Это, вероятно, обусловлено различной гидрофобностью микроокружения молекул ThT при встраивании в бороздки амилоидных фибрилл.
Для образцов, подготовленных методом равновесного микродиализа, были зарегистрированы и скорректированы на эффект первичного внутреннего фильтра (Fonin et al., 2014) спектры флуоресценции ThT (рис. 4д). Показано, что интенсивность флуоресценции красителя, связанного с фибриллами, полученными в присутствии 0.05 М GdnHCl, превышает интенсивность флуоресценции ThT, связанного с фибриллами, сформированными в отсутствие и в присутствии 3 М GdnHCl. С использованием зарегистрированных спектров флуоресценции (рис. 4д) и кривых затухания флуоресценции (рис. 4е) ThT мы рассчитали квантовый выход флуоресценции и время жизни возбужденного состояния красителя, связанного с фибриллами (табл. 2). Различие значений кантового выхода флуоресценции и времени жизни возбужденного состояния ThT, связанного с различными типами амилоидов на основе лизоцима, вероятно, обусловлено различным ограничением подвижности фрагментов связанного красителя друг относительно друга в возбужденном состоянии. Это, в свою очередь, может быть связано c различной жесткостью микроокружения молекул ThT, а, значит, структурным полиморфизмом фибриллярных волокон, полученных при различных условиях.
Таблица 2.
Квантовый выход флуоресценции (q) и время жизни возбужденного состояния (❬τ❭) ThT, связанного с амилоидными фибриллами, полученными при различных концентрациях GdnHCl
| [GdnHCl], М | q | ❬τ❭, нс |
|---|---|---|
| 0 | (2.7 ± 0.2) × 10–2 | 1.40 ± 0.06 |
| 0.05 | (3.5 ± 0.3) × 10–2 | 1.16 ± 0.04 |
| 3.0 | (1.8 ± 0.2) × 10–2 | 1.29 ± 0.05 |
Устойчивость амилоидных фибрилл на основе лизоцима к воздействию внешних факторов. Для сравнения стабильности амилоидных фибрилл на основе лизоцима, полученных при различных условиях, мы исследовали их устойчивость к воздействию ионного детергента SDS и кипячения с помощью SDS-электрофореза в полиакриламидном геле (SDS-PAGE) (рис. 5).
Рис. 5.
Электрофореграмма мономерного лизоцима (дорожка 1) и амилоидных фибрилл на основе лизоцима, полученных в отсутствие (дорожка 2) и в присутствии GdnHCl в концентрации 0.05 М (дорожка 3) и 3 М (дорожка 4). М – маркерные белки, мол. масса (кДа) указана слева. Мол. масса лизоцима – 14.3 кДа. SDS-электрофорез в полиакриламидном геле.

На дорожке 1 (рис. 5), куда был загружен нативный лизоцим в качестве контроля, обнаружена одна интенсивная полоса, соответствующая молекулярной массе мономерного белка (14.3 кДа). При этом аналогичные полосы для образцов, полученных в отсутствие и в присутствии 0.05 М GdnHCl, оказались заметно менее интенсивными (рис. 5, дорожки 2, 3). Образцу, полученному в присутствии максимальной концентрации GdnHCl (рис. 5, дорожка 4), соответствует наиболее слабая полоса на геле, что свидетельствует о том, что большая часть этих фибрилл не деградировала при термическом и химическом воздействии и не вошла в гель. Таким образом, устойчивость исследуемых амилоидных фибрилл на основе лизоцима к воздействию ионного детергента и кипячения оказалась различной. Фибриллы, полученные в присутствии 3 М GdnHCl, являются наиболее стабильными из исследованных амилоидов, что может быть обусловлено более жесткой и стабильной структурой фибриллярного волокна этих фибрилл.
ЗАКЛЮЧЕНИЕ
В результате исследования амилоидов на основе лизоцима, полученных при различной концентрации денатурирующего агента GdnHCl, с применением широкого спектра физико-химических методов (в том числе специально разработанных) были показаны различия следующих параметров: склонности фибрилл к кластеризации; вторичной структуры как фрагментов белка, формирующих β-складчатый остов фибриллы, так и участков белка все этого остова; микроокружения триптофановых остатков амилоид-формирующих белков; характеристик взаимодействия фибрилл со специфическим флуоресцентным зондом ThT; устойчивости амилоидов к воздействию ионного детергента SDS и кипячения. Полученные данные свидетельствует о структурном полиморфизме этих белковых агрегатов, который, вероятно, обусловлен различной степенью денатурации белка в присутствии GdnHCl в различных концентрациях, а, значит, формированием фибриллярного волокна на основе мономерных молекул лизоцима с различной вторичной и третичной структурой. Результаты работы позволили сделать заключение о том, что полученные амилоидные фибриллы на основе лизоцима являются привлекательным объектом для проведения дальнейших исследований, направленных на выявление связи их структуры с цитотоксичностью.
Список литературы
Avni A., Swasthi H.M., Majumdar A., Mukhopadhyay S. 2019. Intrinsically disordered proteins in the formation of functional amyloids from bacteria to humans. Prog. Mol. Biol. Transl. Sci. V. 166. P. 109.
Barnhart M.M., Chapman M.R. 2006. Curli biogenesis and function. Annu. Rev. Microbiol. V. 60. P. 131.
Biancalana M., Koide S. 2010. Molecular mechanism of Thioflavin-T binding to amyloid fibrils. Biochem. Biophys. Acta. V. 1804. P. 1405.
Biancalana Wu.C., Koide M., Shea S., Shea J.E. 2009. Binding modes of thioflavin-T to the single-layer beta-sheet of the peptide self-assembly mimics. J. Mol. Biol. V. 394. P. 627.
Biancalana M., Makabe K., Koide A., Koide S. 2009. Molecular mechanism of thioflavin-T binding to the surface of beta-rich peptide self-assemblies. J. Mol. Biol. V. 385. P. 1052.
Chartier-Harlin M.C., Kachergus J., Roumier C., Mouroux V., Douay X., Lincoln S., Levecque C., Larvor L., Andrieux J., Hulihan M., Waucquier N., Defebvre L., Amouyel P., Farrer M, Destée A. 2004. Alpha-synuclein locus duplication as a cause of familial Parkinson’s disease. Lancet. V. 364. P. 1167.
Cherny I., Gazit E. 2008. Amyloids: not only pathological agents but also ordered nanomaterials. Angew. Chem. V. 47. P. 4062.
Chiti F., Dobson C.M. 2006. Protein misfolding, functional amyloid, and human disease. Annu. Rev. Biochem. V. 75. P. 333.
Collinson S.K., Emody L., Muller K.H., Trust T.J., Kay W.W. 1991. Purification and characterization of thin, aggregative fimbriae from Salmonella enteritidis. J. Bacteriol. V. 173. P. 4773.
Costerton J.W., Stewart P.S., Greenberg, E. P. 1999. Bacterial biofilms: A common cause of persistent infections. Science. V. 284. P. 1318.
De Ferrari G.V., Mallender W.D., Inestrosa N.C., Rosenberry T.L. 2001. Thioflavin T is a fluorescent probe of the acetylcholinesterase peripheral site that reveals conformational interactions between the peripheral and acylation sites. J. Biol. Chem. V. 276. P. 23282.
Eisenberg D., Jucker M. 2012. The amyloid state of proteins in human diseases. Cell. V. 148. P. 1188.
Fandrich M., Meinhardt J., Grigorieff N. 2009. Structural polymorphism of Alzheimer Abeta and other amyloid fibrils. Prion. V. 3. P. 89.
Fonin A.V., Sulatskaya A.I., Kuznetsova I.M., Turoverov K.K. 2014. Fluorescence of dyes in solutions with high absorbance. Inner filter effect correction. PloS One. V. 9. e103878. https://doi.org/10.1371/journal.pone.0103878
Fowler D.M., Koulov A.V., Balch W.E., Kelly J.W. 2007. Functional amyloid–from bacteria to humans. Trends Biochem. Sci. V. 32. P. 217.
Greenfield N.J. 2006. Using circular dichroism spectra to estimate protein secondary structure. Nat. Protoc. V. 1. P. 2876.
Harada T., Kuroda R. 2011. CD measurements of beta-amyloid (1-40) and (1-42) in the condensed phase. Biopolymers. V. 95. P. 127.
Iadanza M.G., Silvers R., Boardman J., Smith H., Karamanos T., Debelouchina G., Su Y., Griffin R., Ranson N., Radford S. 2018. The structure of a beta2-microglobulin fibril suggests a molecular basis for its amyloid polymorphism. Nat. Commun. V. 9. P. 4517. https://doi.org/10.1038/s41467-018-06761-6
Ivanova M.I., Thompson M.J., Eisenberg D. 2006. A systematic screen of beta(2)-microglobulin and insulin for amyloid-like segments. PNAS. V. 103. P. 4079.
Jahn T.R., Radford S.E. 2008. Folding versus aggregation: polypeptide conformations on competing pathways. Arch. Biochem. Biophys. V. 469. P. 100.
Juarez J., Taboada P., Mosquera V. 2009. Existence of different structural intermediates on the fibrillation pathway of human serum albumin. Biophys. J. V. 96. P. 2353.
Krebs M.R., Bromley E.H., Donald A.M. 2005. The binding of thioflavin-T to amyloid fibrils: localisation and implications. J. Struct. Biol. V. 149. P. 30.
Kuznetsova I.M., Sulatskaya A.I., Povarova O.I., Turoverov K.K. 2012a. Reevaluation of ANS binding to human and bovine serum albumins: key role of equilibrium microdialysis in ligand – receptor binding characterization. PloS One. V. 7. e40845. https://doi.org/10.1371/journal.pone.0040845
Kuznetsova I.M., Sulatskaya A.I., Uversky V.N., Turoverov K.K. 2012b. Analyzing thioflavin T binding to amyloid fibrils by an equilibrium microdialysis-based technique. PloS One. V. 7. e30724. https://doi.org/10.1371/journal.pone.0030724
Kuznetsova I.M., Sulatskaya A.I., Uversky V.N., Turoverov K.K. 2012c. A new trend in the experimental methodology for the analysis of the thioflavin T binding to amyloid fibrils. Mol. Neurobiol. V. 45. P. 488.
Nelson R., Eisenberg D. 2006. Recent atomic models of amyloid fibril structure. Curr. Opin. Struct. Biol. V. 16. P. 260.
Nelson R., Sawaya M.R., Balbirnie M., Madsen A.O., Riekel C., Grothe R., Eisenberg D. 2005. Structure of the cross-beta spine of amyloid-like fibrils. Nature. V. 435. P. 773.
Otzen D., Riek R. 2019. Functional Amyloids. Cold Spring Harb. Perspect. Biol. V. 11. a033860. https://doi.org/10.1101/cshperspect.a033860
Pham C.L., Kwan A.H., Sunde M. 2014. Functional amyloid: Widespread in nature, diverse in purpose. Essays Biochem. V. 56. P. 207.
Provencher S.W., Glockner J. 1981. Estimation of globular protein secondary structure from circular dichroism. Biochemistry. V. 20. P. 33.
Prusiner S.B., McKinley M.P., Bowman K.A., Bolton D.C., Bendheim P.E., Groth D.F., Glenner G.G. 1983. Scrapie prions aggregate to form amyloid-like birefringent rods. Cell. V. 35. P. 349.
Rovnyagina N.R., Sluchanko N.N., Tikhonova T.N., Fadeev V.V., Litskevich A.Y., Maskevich A.A., Shirshin E.A. 2018. Binding of thioflavin T by albumins: An underestimated role of protein oligomeric heterogeneity. Int. J. Biol. Macromol. V. 108. P. 284.
Sen P., Fatima S., Ahmad B., Khan R.H. 2009. Interactions of thioflavin T with serum albumins: spectroscopic analyses. Spectrochim. Acta A Mol. Biomol. Spectrosc. V. 74. P. 94.
Sneideris T., Darguzis D., Botyriute A., Grigaliunas M., Winter R., Smirnovas V. 2015. pH-Driven Polymorphism of insulin amyloid-like fibrils. PloS One. V. 10. e0136602. https://doi.org/10.1371/journal.pone.0136602
Sreerama N., Woody R.W. 2000. Estimation of protein secondary structure from circular dichroism spectra: Comparison of CONTIN, SELCON, and CDSSTR methods with an expanded reference set. Anal. Biochem. V. 287. P. 252.
Stefani M. 2010. Structural polymorphism of amyloid oligomers and fibrils underlies different fibrillization pathways: Immunogenicity and cytotoxicity. Curr. Prot. Pept. Sci. V. 11. P. 343.
Sulatskaya A.I., Maskevich A.A., Kuznetsova I.M., Uversky V.N., Turoverov K.K. 2010. Fluorescence quantum yield of thioflavin T in rigid isotropic solution and incorporated into the amyloid fibrils. PloS One. V. 5. e15385. https://doi.org/10.1371/journal.pone.0015385
Sulatskaya A.I., Rodina N.P., Kuznetsova I.M., Turoverov K.K. 2017. Different conditions of fibrillogenesis cause polymorphysm of lysozyme amyloid fibrils. J. Mol. Struct. V. 1140. P. 52.
Sulatskaya A.I., Rodina N.P., Polyakov D.S., Kuznatsova I.M., Turoverov K.K. 2015. Investigation of amyloid fibrils on the basis of full-length and truncated forms of beta-2-microglobulin with the use of equilibrium microdialysis. Proc. Europ. Conf. Biol. Med. Sci. P. 11.
Sulatsky M.I., Sulatskaya A.I., Povarova O.I., Antifeeva I.A., Kuznetsova I.M., Turoverov K.K. 2020. Effect of the fluorescent probes ThT and ANS on the mature amyloid fibrils. Prion. V. 14. P. 67.
Sunde M., Serpell L.C., Bartlam M., Fraser P.E., Pepys M.B., Blake C.C. 1997. Common core structure of amyloid fibrils by synchrotron X-ray diffraction. J. Mol. Biol. V. 273. P. 729.
Tycko R. 2015. Amyloid polymorphism: Structural basis and neurobiological relevance. Neuron. V. 86. P. 632.
Valentine J.S., Doucette P.A., Zittin Potter S. 2005. Copper-zinc superoxide dismutase and amyotrophic lateral sclerosis. Ann. Rev. Biochem. V. 74. P. 563.
Vassar R., Bennett B.D., Babu-Khan S., Kahn S., Mendiaz E.A., Denis P., Teplow D.B., Ross S., Amarante P., Loeloff R., Luo Y., Fisher S., Fuller J., Edenson S., Lile J. et al. 1999. Beta-secretase cleavage of Alzheimer’s amyloid precursor protein by the transmembrane aspartic protease BACE. Science. V. 286. P. 735.
Vernaglia B.A., Huang J., Clark E.D. 2004. Guanidine hydrochloride can induce amyloid fibril formation from hen egg-white lysozyme. Biomacromol. V. 5. P. 1362.
Vladimirov Y.A., Litvin F.F. 1964. Photobiology and spectroscopic methods. Handbook Gen. Biophis. V. 8. P. 88.
Warby S.C., Montpetit A., Hayden A.R., Carroll J.B., Butland S.L., Visscher H., Collins J.A., Semaka A., Hudson T.J., Hayden M.R. 2009. CAG expansion in the Huntington disease gene is associated with a specific and targetable predisposing haplogroup. Am. J. Hum. Genet. V. 84. P. 351.
Westermark P., Benson M.D., Buxbaum J.N. Cohen A.S., Frangione B., Ikeda S., Masters C.L., Merlini G., Saraiva M.J., Sipe J.D. 2005. Amyloid: Toward terminology clarification. Report from the Nomenclature Committee of the International Society of Amyloidosis. Amyloid. V. 12. P. 1.
Дополнительные материалы отсутствуют.


