Цитология, 2022, T. 64, № 2, стр. 116-125
Роль миелоидных супрессорных клеток в процессах формирования иммунной толерантности в период беременности
К. Ю. Шардина 1, *, С. А. Заморина 1, М. Б. Раев 1, В. А. Черешнев 1
1 Институт экологии и генетики микроорганизмов Уральского отделения Российской академии наук – филиал Пермского федерального исследовательского центра Уральского отделения Российской академии наук
614081 Пермь, Россия
* E-mail: Shardinak@gmail.com
Поступила в редакцию 10.01.2022
После доработки 10.01.2022
Принята к публикации 13.01.2022
- EDN: QHONOA
- DOI: 10.31857/S0041377122020067
Аннотация
Миелоидные супрессорные клетки (MDSC) – это одна из популяций клеток, принимающих участие в регуляции иммунного ответа посредством его угнетения при патологиях, а также во время беременности. В настоящем обзоре собраны имеющиеся данные о воздействии MDSC на разные компоненты врожденного и адаптивного иммунитета с учетом их разнонаправленности в реализации своих иммуносупрессорных функций. Представлен анализ актуальных исследований по изучению механизмов подавления иммунного ответа MDSC, а также проведена оценка роли MDSC в поддержании иммунной толерантности во время беременности. В частности, проанализированы сведения об MDSC при различных патологических состояниях в период беременности, содержании MDSC в пуповинной крови, рассмотрена взаимосвязь между этими клетками и иммунным статусом.
В период нормальной беременности в материнском организме формируется состояние динамической иммунной толерантности, направленное на предотвращение отторжения плода. При этом иммунная система матери должна одновременно защищать организм эмбриона, а также собственный организм от агентов, вызывающих различные патологические состояния, в том числе вирусные и бактериальные инфекции. Исходя из этого очевидно, что для успешного протекания беременности необходим тонкий иммунный баланс, а его сдвиг может вызывать ряд нарушений: недостаточность имплантации, преждевременные роды, преэклампсию, задержку роста плода (Negishi et al., 2018).
Адаптивная иммунная система играет решающую роль в поддержании иммунной толерантности, однако врожденный иммунитет, а именно дендритные клетки (DC), макрофаги, естественные киллерные клетки (NK), NKT-лимфоциты (NKT) также вносят свой вклад в сохранение баланса между защитой организма и толерантностью к эмбриону (Negishi et al., 2018). В 2009 г. был идентифицирован новый тип клеток врожденного иммунитета, так называемые миелоидные супрессорные клетки (myeloid-derived supressor cells, MDSC), представленные незрелыми дендритными клетками, нейтрофилами и моноцитами. Исходя из названия, очевидно, что основная функция MDSC – подавлять иммунный ответ, в том числе опухоли (Gabrilovich et al., 2009; Ostrand-Rosenberg, Sinha, 2009). В русскоязычной литературе для этих клеток используют термин “миелоидные супрессоры” (МС).
К настоящему времени известно, что опухоль защищается от иммунной системы посредством различных механизмов, в том числе через MDSC. MD-SC позволяют новообразованию быть устойчивым к иммунотерапии, однако индуцированная элиминация MDSC из опухолевого микроокружения повышает выживаемость больных онкологическими заболеваниями (Tesi, 2019). С момента открытия MDSC вырос объем данных о функциях, механизмах и фенотипе MDSC. Определено, при каких условиях происходит увеличение этой популяции клеток. Тем не менее, большинство исследований посвящено изучению MDSC при онкологических процессах. В настоящее время известно, что уровень MDSC повышается при многих патологических состояниях, таких как травматический шок, сепсис, аутоиммунные заболевания, воспаление, рак. Не так давно стало известно, что уровень MDSC возрастает и при беременности (Goedegebuure et al., 2011).
MDSC принято разделять на 2 основные субпопуляции: полиморфноядерные (PMN-MDSC, их также называют гранулоцитарные – G-MDSC) и моноцитарные (M-MDSC). Кроме того, некоторые авторы выделяют 3-й тип MDSC – ранние или e-MDSC. Известно, что PMN-MDSC присутствуют в пуповинной крови, что свидетельствует об их участии в модуляции иммунной системы не только матери, но и плода. В то же время известно, что при спонтанных абортах уровень MDSC в плаценте значительно снижен (Rieber et al., 2013). Помимо этого было показано, что MDSC модулируют поляризацию клеток в Т-хелперы, с преобладанием Th2-ответа и ингибированием Th1-ответа (Kostlin et al., 2016). Кроме того, есть исследования, демонстрирующие, что PMN-MDSC способствуют образованию регуляторных T-лимфоцитов (Kang et al., 2016). В совокупности все эти факты являются достаточно убедительным свидетельством того, что MDSC могут способствовать поддержанию толерантности к фетоплацентарным антигенам.
Цель настоящего обзора – обобщить представления о механизмах действия MDSC на клеточное звено иммунной системы и анализ актуальной информации о роли MDSC в поддержании иммунной толерантности во время беременности.
ОСНОВНЫЕ МЕХАНИЗМЫ ИММУНОСУПРЕССИИ, ОПОСРЕДОВАННЫЕ MDSC
Для реализации своих иммуносупрессивных функций MDSC используют как межклеточные взаимодействия, так и короткоживущие медиаторы (Kumar et al., 2016). По-видимому, MDSC в первую очередь ингибируют защитные функции T-лимфоцитов, однако другие клетки иммунной системы также подвержены их воздействию (рис. 1). Ниже описаны основные пути воздействия на нормальное функционирование и жизнедеятельность T-лимфоцитов.
Рис. 1.
Механизмы подавления активности T-клеток, опосредованные миелоидными супрессорными клетками (MDSC). Arg1 – аргиназа 1, ADAM17 – домен 17 металлопептидазы ADAM, Gal-9 – галектин-9, iNOS – индуцибельная NO-синтаза, IDO – индоламин-2,3-диоксигеназа, PD-L1 – лиганд рецептора PD1, TCR – Т-клеточный рецептор.
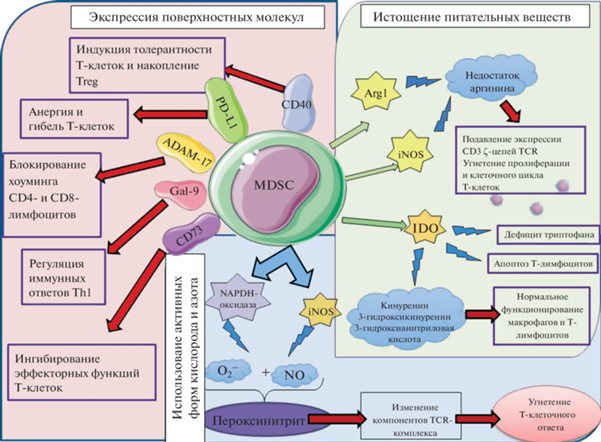
MDSC И T-КЛЕТКИ. ИСТОЩЕНИЕ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ ДЛЯ Т-ЛИМФОЦИТОВ
Основная мишень MDSC для ингибирования T‑лимфоцитов – это метаболизм аргинина и триптофана. Для реализации своей активности MDSC используют аргиназу 1 (Arg1) и индуцибельную NO-синтазу (iNOS). Arg1 – это фермент, который участвует в финальном цикле мочевины, превращая L-аргинин в L-орнитин и мочевину. iNOS – фермент, который участвует в образовании оксида азота и цитруллина из аргинина. Повышенная концентрация этих ферментов приводит к недостатку аргинина в месте иммунного ответа, что в свою очередь подавляет экспрессию CD-3-ζ-цепей TCR (Rodriguez et al., 2007). Также известно, что недостаточное потребление L-аргинина блокирует пролиферацию и клеточный цикл T-лимфоцитов, а также индуцирует накопление MDSC (Fletcher et al., 2015).
Аналогичный механизм иммуносупрессии MDSC заключается в нарушении метаболизма триптофана. Происходит это за счет STAT3-зависимой индукции фермента индоламин-2,3-диоксигеназы (IDO), повышенная продукция которого и приводит к дефициту триптофана (Medzhitov et al., 2011). Помимо этого, повышение уровня IDO приводит к апоптозу T-лимфоцитов (Yu et al., 2014). Кроме того, есть данные, которые показывают, что активность IDO приводит к выделению побочных продуктов (кинуренина, 3-гидроксикинуренина, 3-гидроксиантраниловой кислоты), влияющих на нормальное функционирование макрофагов и T-лимфоцитов (Fallarino et al., 2002).
Таким образом, Arg1, iNOS и IDO создают условия недостаточности питательной среды за счет истощения незаменимых аминокислот триптофана и аргинина, что приводит к подавлению T-клеточной активности.
ИСПОЛЬЗОВАНИЕ АКТИВНЫХ ФОРМ КИСЛОРОДА И АЗОТА
Следующий механизм, который используют MDSC для подавления иммунного ответа, – это продукция активных форм кислорода и азота. MDSC содержат на своей поверхности NADPH-оксидазу – мультимолекулярный ферментативный комплекс, который окисляет NADP+, образуя на поверхности клетки супероксидный анион-радикал ${\text{O}}_{2}^{{ - {\kern 1pt} \centerdot }}$. Как говорилось ранее, iNOS в ходе окисления аргинина образует оксид азота (NO), обладающий противомикробной активностью. Однако ${\text{O}}_{2}^{{ - {\kern 1pt} \centerdot }}$ начинает реактивно взаимодействовать с оксидом азота, образуя пероксинитрит (Pacher et al., 2007). Сам пероксинитрит является одним из сильнейших окислителей, который может напрямую взаимодействовать с различными биологическими мишенями. Пероксинитрит также может изменять структуру белка посредством реакции с различными аминокислотами в пептидной цепи. Так, было показано, что пероксинитрит способен изменять компоненты TCR-комплекса (T-клеточного рецептора) посредством нитрования тирозина, модифицируя его взаимодействие с молекулами MHC (главного комплекса гистосовместимости), что приводит к ингибированию T-клеточного ответа (Nagaraj et al., 2007).
ЭКСПРЕССИЯ МОЛЕКУЛ, СНИЖАЮЩИХ АКТИВНОСТЬ Т-ЛИМФОЦИТОВ
Присутствие определенных молекул на поверхности MDSC – это еще один путь к проявлению их иммуносупрессивных функций. Известно, что MD-SC экспрессируют на своей мембране галектин-9 (Gal-9), который является лигандом для TIM-3. TIM-3 экспрессируется терминально дифференцированными Th1-клетками, которые впоследствии повышают экспрессию Gal-9 посредством продукции IFN-γ. Таким образом, MDSC способны регулировать Th1-иммунный ответ, используя путь TIM-3/Gal-9 (Sakuishi et al., 2011).
Молекула СD73 (экто-5'-нуклеотидаза), которая катализирует разложение АТФ до аденозина, экспрессируется на MDSC. В свою очередь, аденозин способен ингибировать эффекторные функции T‑клеток за счет взаимодействия с аденозиновым рецептором T-лимфоцитов (A2A, A2AR) (Ohta et al., 2006).
Кроме того, MDSC имеют на своей поверхности домен 17 металлопептидазы ADAM (ADAM17), которая индуцирует расщепление эктодомена L-селектина (CD62L) на T-клетках. CD62L – это мембранная молекула адгезии, действующая как хоминговый рецептор периферических лимфоузлов. Таким образом, CD4+- и CD8+-клетки становятся неспособными мигрировать в лимфатические узлы или участки воспаления, где должна происходить их активация (Hanson et al., 2009).
На поверхности MDSC также может экспрессироваться PD-L1 (лиганд рецептора программируемой клеточной гибели). Взаимодействие PD-L1 c PD-1, экспрессируемым на T-лимфоцитах, приводит к анергии или даже гибели клеток (Noman et al., 2014).
В 2010 г. было продемонстрировано, что MDSC также экспрессируют иммуностимулирующий рецептор CD40, с помощью которого они способны индуцировать толерантность T-клеток и накопление регуляторных T-лимфоцитов (Treg). В данном исследовании было показано, что IFN-γ стимулирует миелоидные супрессорные клетки на выработку IL‑10 и TGF-β, которые необходимы для индукции Treg (Pan et al., 2010).
КЛЕТКИ MDSC И Treg
В дополнение к прямому супрессивному действию, MDSC могут оказывать непрямое действие на ингибирование пролиферации T-лимфоцитов через влияние на развитие индуцибельных CD4+CD25+FOXP3+-клеток (Treg) (Huang et al., 2006). Развитие именно таких Treg зависит от продукции IL-10 и TGF-β, а не от классических механизмов, связанных с метаболизмом аргинина или триптофана. Другое исследование, подтверждающее механизм MDSC, связанный с высокой продукцией IL-10 и TGF-β, показало, что MDSC могут активировать Treg как in vitro, так и in vivo. Происходит это посредством стимуляции MD-SC цитокином IFN-γ. Позднее эти же авторы обнаружили, что IFN-γ регулирует экспрессию CD40 на MDSC, влияя на межклеточное взаимодействие MDSC и T-клеток в присутствии IL-10 и TGF-β, что приводит к экспансии Treg (Pan et al., 2010).
КЛЕТКИ MDSC И NK-КЛЕТКИ
В настоящее время известно, что подавление функции естественных киллерных (NK) клеток коррелирует с увеличением количества MDSC. В частности, MDSC уменьшают цитотоксичность NK-клеток, продукцию IFN-γ и экспрессию трансмембранного белка NKG2D (natural-killer receptor group 2, member D) через мембраносвязанный TGFβ (Li et al., 2009). Так как NKG2D служит активирующим рецептором на NK-клетках, который сам по себе способен вызывать цитотоксичность, то MDSC угнетают активность этих клеток.
MDSC И B-КЛЕТКИ
Хотя MDSC-опосредованная иммуномодуляция B-лимфоцитов находится на ранней стадии изучения, тем не менее, предполагается, что MDSC регулируют B-лимфопоэз, продукцию, пролиферацию и функцию антител. Производные адипоцитов (жирные кислоты, свободный холестерин, церамиды, кристаллы липидов) способны увеличивать продукцию IL-1β MDSC (Kennedy, Knight, 2015). Кроме того, основные факторы супрессии MDSC, такие как Arg1, PD-1, IDO, iNOS, подавляют ответы B-клеток так же, как и T-лимфоцитов. Помимо косвенных путей, MDSC способны действовать на B-клетки непосредственно, снижая продукцию IgM и IgG через трансмембранный белок VISTA (V-домен Ig супрессор активации Т-клеток) (Green et al., 2015).
Регуляторные B-клетки (Breg) являются относительно новой описанной субпопуляцией B-лимфоцитов, которая обладает регуляторными функциями по отношению к B-клеткам. Эта регуляция достигается за счет угнетения синтеза антител эффекторными B-лимфоцитами (Özkan et al., 2018). В исследовании, проведенном на LP-BM5-инфицированных мышах, M-MDSC уменьшали количество IL-10, продуцируемого Breg в ответ на стимуляцию ЛПС (Özkan et al., 2018). В другой работе авторы использовали мышиную модель системной красной волчанки и пришли к выводу, что MDSC вызывают экспансию Breg через iNOS, подавляя аутоиммунитет (Park et al., 2016). Таким образом, можно сказать, что MDSC способны косвенно подавлять ответы B-лимфоцитов через экспансию Breg.
MDSC И МИЕЛОИДНЫЕ КЛЕТКИ
К настоящему времени существует не так много работ по исследованию механизмов влияния MDSC на миелоидные клетки. Тем не менее, есть некоторые данные о взаимодействии MDSC с макрофагами. В 2007 г. на модели рака у мышей группой исследователей было показано, что MDSC способны индуцировать поляризацию макрофагов 2-го типа через секрецию IL-10. При этом снижалась продукция IL-12 и прогрессировал рост опухоли (Sinha et al., 2007). Поскольку при онкологии MDSC направляют дифференцировку макрофагов по 2-му типу, то в опухолевом микроокружении нарушается баланс между IL-12 и IL-10. Изменение этого баланса приводит к формированию T-клеточного иммунного Th2-ответа и происходит уменьшение созревания дендритных клеток (Ostrand-Rosenberg et al., 2012).
Помимо взаимодействия с макрофагами, было продемонстрировано воздействие MDSC на DC в условиях in vitro. В 2012 г. показали, что при увеличении MDSC пропорционально уменьшается количество зрелых DC (Ostrand-Rosenberg et al., 2012). В опухолевом микроокружении, в состав которого входят MDSC, вырабатываются цитокины VEGF, M-CSF, GM-CSF, IL-6, IL-10, которые также препятствуют созреванию DC, что приводит к накоплению незрелых DC. Это накопление в итоге приводит к тому, что цитотоксические T-лимфоциты не активируются, тем самым поддерживая ускользание опухоли от иммунной защиты организма (Gabrilovich, 2004).
MDSC И БЕРЕМЕННОСТЬ
С иммунологической точки зрения состояние организма будущей матери при беременности является парадоксальным, поскольку плод защищен от атаки материнской иммунной системы. Иммунная толерантность, которая возникает во время беременности, включает определенный комплекс механизмов, направленных на сохранение беременности. Для объяснения такого неспецифического действия иммунной системы учеными была предложена концепция “Th1/Th2/Th17/Treg”, которая предполагает доминирование Th2- и Treg-клеток над Th1- и Th17-лимфоцитами (Saito et al., 2010). При нарушении этого баланса происходит риск неблагоприятного исхода беременности. Согласно статистике ВОЗ, около 20% беременностей заканчиваются самопроизвольными выкидышами. Основной причиной ранних спонтанных абортов являются генетические аномалии эмбриона. Однако значительная часть спонтанных абортов связана с аутоиммунными и иммунными нарушениями (Kwak-Kim, 2010).
В процессе изучения MDSC было обнаружено, что во время беременности в периферической, децидуальной и пуповинной крови их уровень повышается (рис. 2). На основании уже имеющихся данных о локализации MDSC во время беременности, можно предположить, что эти клетки способны модулировать иммунную систему не только матери, но и плода, поддерживая, таким образом, иммунную толерантность. В 2011 г. в экспериментах на мышах было показано, что MDSC накапливаются в плаценте, а к моменту родов их уровень снижается (Fainaru et al., 2011). Затем было продемонстрировано повышение уровня MDSC в периферической крови у беременных мышей (Pan et al., 2016). В 2017 г. стало известно, что MDSC аккумулируются в кровотоке и матке беременных мышей, а намеренное снижение MDSC антителами против Gr1 затрудняло нормальную имплантацию и привело к проникновению в матку активированных T-клеток. В противоположность этому, восстановление общего пула MDSC с помощью G-CSF приводило к успешной беременности, подавляя при этом T-клеточные ответы (Ostrand-Rosenberg et al., 2017).
Рис. 2.
Схематическое представление роли миелоидных супрессорных клеток (MDSC) во время беременности. PBMC – моноциты периферической крови, PMN-MDSC – полиморфноядерные миелоидные супрессорные клетки, Arg1 – аргиназа 1, iNOS – индуцибельная NO-синтаза.
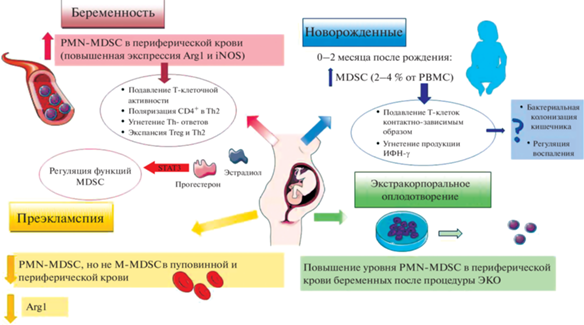
В 2014 г. стало известно, что в периферической крови беременных повышается уровень PMN-MD-SC (CD66b+/CD14–/HLA-DRlow/–), при этом количество M-MDSC остается неизменным. Примечательно, что эти гранулоцитарные MDSC обладают повышенной экспрессией Arg-1 и iNOS, что отражает их выраженную иммуносупрессивную активность. Исследователям удалось подтвердить, что высокий уровень MDSC в организме женщин держится на протяжении всей беременности и только после родов резко снижается (Kostlin et al., 2014). Известно, что уровень MDSC растет в течение I триместра беременности и значительно снижается к III триместру (Nair et al., 2015).
Снижение уровня MDSC в периферической крови, эндометрии и плаценте у человека ассоциировано с ранним выкидышем (Nair et al., 2015), а низкий уровень аргинина и пониженная экспрессия NO-синтазы 2 (NOS2) в тканях плаценты были обнаружены у женщин с преэклампсией (Kim et al., 2007). Установлено, что плацентарные PMN-MDSC, подавляя T-клеточный ответ, поляризуют CD4-лимфоциты в Th2-фенотип (Köstlin-Gille et al., 2019). Одновременно с этим PMN-MDSC пуповинной крови ингибируют Th1-ответ и индуцируют развитие Th2- и Treg-клеток. В этой ситуации MDSC используют свои основные механизмы подавления T‑лимфоцитов за счет экспрессии Arg1, IDO, NOS2 и образования активных форм кислорода (Kumar et al., 2016).
Раннее самопроизвольное прерывание беременности сопровождается снижением уровня MDSC и Th2-цитокинов. Остается вопросом для обсуждения, как при этом гормональная среда организма регулирует экспансию MDSC и баланс Th1-/Th2-цитокинов. В нескольких исследованиях была описана роль STAT3 в регуляции функций MDSC во время беременности. Показано, что STAT3 участвует в экспансии MDSC через эстрадиол и прогестерон (Pan et al., 2016). Кроме того, исследование на мышах продемонстрировало, что отсутствие индуцируемого гипоксией фактора транскрипции 1α (HIF-1α), приводит к снижению накопления MDSC во время беременности и нарушению супрессорной активности (Köstlin-Gille et al., 2019). Пациентки с самопроизвольным абортом имеют пониженные уровни прогестерона и эстрадиола, что коррелирует со снижением уровня MDSC, а также с нарушением баланса Th1/Th2 в сторону преобладания Th1. При изучении экспрессии рецептора эстрогена-α (ER-α), STAT-3/pSTAT-3 и каспазы-3 в децидульном эндометрии у таких пациенток было выявлено снижение экспрессии ER-α и pSTAT-3, но повышение экспрессии каспазы-3 (Verma et al., 2019). Учитывая то, что STAT3 регулирует пролиферацию и дифференцировку MDSC, низкая экспрессия pSTAT3 в эндометрии пациенток с ранним самопроизвольным абортом приводит к нарушению процессов, связанных с накоплением MDSC. Таким образом, подобная ситуация приводит к нарушению иммунной толерантности во время беременности и прерыванию беременности.
Недавние исследования показали, что у мышей со спонтанным прерыванием беременности уровень MDSC значительно снижен по сравнению с контрольной группой. Кроме того, уровни Arg1, iNOS, IL-10 и TGFβ в MDSC были также снижены. Авторы связывают истощение MDSC с повышенной цитотоксичностью децидуальных NK-клеток (Ren et al., 2019).
БЕРЕМЕННОСТЬ И ПРЕЭКЛАМПСИЯ
Преэклампсия – это мультисистемное патологическое состояние, которое возникает после 20 нед. гестации. Преэклампсия встречается у 3–7% беременных. На сегодняшний день есть данные только одного исследования по изучению функционирования MDSC при преэклампсии. Было показано, что уровни PMN-MDSC, но не M-MDSC, были снижены в пуповинной и периферической крови у пациенток с преэклампсией по сравнению с группой сравнения (женщины с нормально протекающей беременностью). При этом частота встречаемости популяции Treg у женщин с преэклампсией и в группе сравнения была примерно одинакова. Кроме того, сывороточные уровни Arg1 были значительно ниже у пациенток с преэклампсией (Wang et al., 2018). Авторы предполагают, что отсутствие экспансии PMN-MDSC является важнейшей особенностью изменения функционирования иммунитета, связанного с данной патологией, что позволяет говорить о возможном потенциале терапии преэклампсии посредством восстановления PMN-MDSC.
БЕРЕМЕННОСТЬ У ПАЦИЕНТОК С АУТОИММУННЫМИ ЗАБОЛЕВАНИЯМИ
Аутоиммунные заболевания распространены среди женщин в большей степени, чем среди мужчин, и процессы, связанные с беременностью, такие как гормональная модуляция и микрохимеризм плода, могут вызывать риск развития аутоиммунных патологий у матери. Для женщин с аутоиммунными заболеваниями, которые планируют беременность, оптимизация репродуктивного здоровья является обязательной процедурой. Именно поэтому важно более пристально изучать механизмы иммуносупрессии во время беременности. Так, метаанализ, проведенный недавно, показал, что введение преднизолона улучшает результаты беременности у женщин с идиопатическим рецидивом невынашивания (Dan et al., 2015). Интересно отметить, что применение дексаметазона и преднизона при наличии аутоиммунных нарушений или при трансплантации, могут вызывать экспрессию MDSC, активно вырабатывающих iNOS, а также прямую экспансию Treg (Liao et al., 2014). Таким образом, можно предположить, что контроль активности MDSC может стать одним из механизмов подавления патологического иммунного ответа во время беременности.
MDSC У НОВОРОЖДЕННЫХ
Накопление MDSC у новорожденных является удивительным фактом, поскольку подавление иммунной системы не считается благоприятным для младенца. Однако в первые недели жизни наблюдается повышенный уровень MDSC (Kostlin et al., 2014).
Известно, что повышение уровня MDSC быстро прекращается у женщин после родов. У новорожденных содержание MDSC повышено в течение первых 6 нед. жизни, варьируя от 2 до 4% от PBMC, а на 2-м месяце она достигает уровня взрослого человека; работа показала, что у новорожденных повышены главным образом PMN-MDSC, подавляющие T-клетки контактно-зависимым способом и уменьшающие продукцию IFN-γ ( Gervassi et al., 2014).
В масштабном исследовании было продемонстрировано, что MDSC, которые присутствуют в первые недели жизни новорожденного, обладают выраженной T-супрессорной активностью (He et al., 2018). Эта подавляющая активность MDSC запускается лактоферрином и опосредуется NO, PGE2, белками S100A9 и S100A8. Интересно, что MDSC новорожденных имеют транскриптом, схожий с транскриптомом MDSC опухоли, но с выраженной активацией антимикробных генов. Авторы предположили, что временное присутствие MDSC может иметь решающее значение в регуляции воспаления у новорожденных. Младенцы с очень низким весом, склонные к НЭК (некротизирующий энтероколит), имели более низкие уровни MDSC с более низкой супрессорной активностью, чем дети с нормальным весом (He et al., 2018). Предполагаемым механизмом является способность MDSC подавлять экспрессию Toll-подобного рецептора 4 (TLR4), что приводит к снижению чувствительности кишечной микрофлоры (Kostlin et al., 2018). На сегодняшний день трудно говорить о биологической роли MDSC у новорожденных. Вероятно, экспансия MDSC связана с неким механизмом, который ограничивает воспаление при бактериальной колонизации кишечника (Veglia et al., 2018).
Еще меньше сведений об уровне MDSC у недоношенных детей. Однако работа 2018 г. показала, что содержание PMN-MDSC увеличивается в пуповинной крови независимо от гестационного периода, остается повышенным у недоношенных детей в неонатальный период, а после 28-х сут снижается до нормального уровня (Schwarz et al., 2018). Интересно, что в случае перинатальной или постнатальной инфекции PMN-MDSC и дальше продолжают накапливаться, а их уровень также коррелирует с показателями основных маркеров воспаления: С-реактивного белка и количества лейкоцитов (Schwarz et al., 2018). Авторы считают, что полученные результаты указывают на важность экспансии PMN-MDSC в контексте иммунорегуляции у недоношенных детей, что делает их потенциальной мишенью для клеточной терапии инфекций у этих пациентов.
MDSC И ЭКСТРАКОРПОРАЛЬНОЕ ОПЛОДОТВОРЕНИЕ
Бесплодие выявляется у миллионов людей репродуктивного возраста во всем мире. По данным ВОЗ, бесплодием страдают от 48 до 186 млн человек в мире. Одной из самых популярных процедур, решающих данную проблему, является экстракорпоральное оплодотворение (ЭКО). Существует не так много исследований взаимосвязи между уровнем MDSC и результатами ЭКО. Тем не менее, было показано, что уровень циркулирующих в периферической крови PMN-MDSC, но не M-MDSC, был значительно увеличен в группе беременных по сравнению с группой небеременных после ЭКО женщин. Авторы исследования связывают высокий уровень PMN-MDSC с повышенной частотой клинической беременности и предполагают, что гранулоцитарная популяция MDSC может стать новой терапевтической мишенью для улучшения результатов ЭКО (Zhu et al., 2017). Позже эти данные были подтверждены другим исследованием (Hu et al., 2019). Помимо этого, авторы (Hu et al., 2019) показали, что эстрадиол 2 (Е2) в зависимости от его концентрации может играть двойственную роль во влиянии на MDSC путем регулирования экспрессии VEGF. У пациенток после ЭКО повышенный уровень MDSC в периферической крови явно коррелировал с беременностью независимо от эффектов E2, что может дать новое представление о неудачных результатах ЭКО (Hu et al., 2019).
ЗАКЛЮЧЕНИЕ
В настоящее время существует уже довольно большой объем исследований, направленных на изучение роли MDSC при таких патологических процессах, как рак, воспаление, аутоиммунные заболевания и др. Известно, что, помимо отрицательного воздействия при патологиях, MDSC являются мощными регуляторами критических иммунологических процессов во время беременности, а также в неонатальный период. Становится очевидным, что поиск новых мишеней, обладающих способностью регулировать MDSC и формировать толерантность между матерью и ребенком, будет иметь большой потенциал для их использования при патологиях беременности. Помимо этого, учитывая двойственную природу этих клеток, ингибирование MDSC может стать одним из механизмов противораковой терапии. Однако до сих пор существует ряд вопросов, связанных с изучением фундаментальных аспектов понимания биологической роли MDSC.
Список литературы
Dan S., Wei W., Yichao S., Hongbo C., Shenmin Y., Jiaxiong W., Hong L. 2015. Effect of prednisolone administration on patients with unexplained recurrent miscarriage and in routine intracytoplasmic sperm injection: A meta–analysis. Am. J. Reprod. Immunol. V. 74. P. 89. https://doi.org/10.1111/aji.12373
Fainaru O., Hantisteanu S., Hallak M. 2011. Immature myeloid cells accumulate in mouse placenta and promote angiogenesis. Am. J. Obstet. Gynecol. V. 204. P. 18. https://doi.org/10.1016/j.ajog.2011.01.060
Fallarino F., Grohmann U., Vacca C., Bianchi R., Orabona C., Spreca A., Fioretti M.C., Puccetti P. 2002. T-cell apoptosis by tryptophan catabolism. Cell Death Differ. V. 9. P.1069.
Fletcher M., Ramirez M.E., Sierra R.A., Raber P., Thevenot P., Al-Khami A.A., Sanchez-Pino D., Hernandez C., Wyczechowska D.D., Ochoa A.C., Rodriguez P.C . 2015. l-Arginine depletion blunts antitumor T-cell responses by inducing myeloid-derived suppressor cells. Cancer Res. V. 75. P. 275. https://doi.org/10.1158/0008-5472.can-14-1491
Gabrilovich D. 2004. Mechanisms and functional significance of tumour-induced dendritic-cell defects. Nat. Rev. Immunol. V. 4. P. 941. https://doi.org/10.1038/nri1498
Gabrilovich D.I., Nagaraj S. 2009. Myeloid- derived suppressor cells as regulators of the immune system. Nat. Rev. Immunol. V. 9. P. 162. https://doi.org/10.1038/nri2506
Gervassi A., Lejarcegui N., Dross S., Jacobson A., Itaya G., Kidzeru E., Gantt S., Jaspan H., Horton H. 2014. Myeloid derived suppressor cells are present at high frequency in neonates and suppress in vitro T cell responses. PLoS One. V 9. e107816 https://doi.org//10.1371/journal.pone.0107816
Goedegebuure P., Mitchem J.B., Porembka M.R., Tan M.C.B., Belt B.A., Wang-Gillam A. Gillanders W.E., Hawkins W.G., Linehan D.C. 2011. Myeloid-derived suppressor cells: General characteristics and relevance to clinical management of pancreatic cancer. Curr. Cancer Drug Targets. V. 11. P. 734.
Green K.A., Wang L., Noelle R.J., Green W.R. 2015. Selective involvement of the checkpoint regulator VISTA in suppression of B-cell, but not T-cell, responsiveness by monocytic myeloid-derived suppressor cells from mice infected with an immunodeficiency-causing retrovirus. J. Virol. V. 89. P. 9693. https://doi.org/10.1128/JVI.00888-15
Hanson E.M., Clements V.K., Sinha P., Ilkovitch D., Ostrand-Rosenberg S. 2009. Myeloid-derived suppressor cells down-regulate L-selectin expression on CD4+ and CD8+ T cells. J. Immunol. V. 183. P. 937. https://doi.org/10.4049/jimmunol.0804253
He Y.M., Li X., Perego M., Nefedova Y., Kossenkov A.V., Jensen E.A., Kagan V., Liu Y.F., Fu S.Y., Ye Q.J., Zhou Y.H., Wei L., Gabrilovich D.I., Zhou J. 2018. Transitory presence of myeloid-derived suppressor cells in neonates is critical for control of inflammation. Nat. Med. V. 24. P. 224. https://doi.org/10.1038/nm.4467
Hu C., Zhen Y., Pang B., Lin X., Yi H. 2019. Myeloid-derived suppressor cells are regulated by estradiol and are a predictive marker for IVF outcome. Front. Endocrinol. V. 10. https://doi.org/10.3389/fendo.2019.00521
Huang B., Pan P.Y., Li Q., Sato A. I., Levy D.E., Bromberg J., Divino C.M., Chen, S.H. 2006. Gr-1+CD115+ immature myeloid suppressor cells mediate the development of tumor-induced T regulatory cells and T cell anergy in tumor-bearing host. Cancer Res. V. 66. P. 1123. https://doi.org/10.1158/0008-5472.can-05-1299
Kang X., Zhang X., Liu Z., Xu H., Wang T., He L., Zhao A. 2016. Granulocytic myeloid-derived suppressor cells maintain feto-maternal tolerance by inducing Foxp3 expression in CD4+CD25-T cells by activation of the TGF-beta/beta-catenin pathway. Mol. Hum. Reprod. V. 22. P. 499. https://doi.org/10.1093/molehr/gaw026
Kennedy D.E., Knight K.L. 2015. Inhibition of B lymphopoiesis by adipocytes and IL-1-producing myeloid-derived suppressor cells. J. Immunol. V. 195. P. 2666. https://doi.org//10.4049/jimmunol.1500957.
Kostlin N., Hofstadter K., Ostermeir A.L. et al. 2016. Granulocytic myeloid-derived suppressor cells accumulate in human placenta and polarize toward a Th2 phenotype. J. Immunol. V. 196. P. 1132. https://doi.org/10.4049/jimmunol.1500340
Kostlin N., Kugel H., Spring B., Leiber A., Marme A., Henes M., Rieber N., Hartl D., Poets C.F., Gille C. 2014. Granulocytic myeloid derived suppressor cells expand in human pregnancy and modulate T-cell responses. Eur. J. Immunol. V. 44. P. 2582. https://doi.org/10.1002/eji.201344200
Kostlin N., Schoetensack C., Schwarz J., Spring B., Marme A., Goelz R., Brodbeck G., Poets C.F., Gille C. 2018. Granulocytic myeloid-derived suppressor cells (GR-MDSC) in breast milk (BM); GR-MDSC accumulate in human BM and modulate T-cell and monocyte function. Front. Immunol. V. 9. P. 1098. https://doi.org/10.3389/fimmu.2018.01098
Köstlin-Gille N., Dietz S., Schwarz J., Spring B., Pauluschke-Fröhlich J., Poets C.F., Gille C. 2019. HIF-1α-deficiency in myeloid cells leads to a disturbed accumulation of myeloid derived suppressor cells (MDSC) during pregnancy and to an increased abortion rate in mice. Front. Immunol. V. 10. P. 161. https://doi.org/10.3389/fimmu.2019.00161
Kumar V., Patel S., Tcyganov E., Gabrilovich D.I. 2016. The nature of myeloid-derived suppressor cells in the tumor microenvironment. Trends Immunol. V. 37. P. 208. https://doi.org/10.1016/j.it.2016.01.004
Kwak-Kim J., Park J.C., Ahn H.K., Kim J.W., Gilman-Sachs A. 2010. Immunological modes of pregnancy loss. Am. J. Reprod. Immunol. V. 63. P. 611. https://doi.org/10.1111/j.1600-0897.2010.00847.x
Li H., Han Y., Guo Q., Zhang M., Cao X. 2009. Cancer-expanded myeloid-derived suppressor cells induce anergy of NK-cells through membrane-bound TGF-b1. J. Immunol. V. 182. P. 240. https://doi.org/10.4049/jimmunol.182.1.240
Liao J., Wang X., Bi Y., Shen B., Shao K., Yang H., Lu Y., Zhang Z., Chen X., Liu H., Wang J., Chu Y., Xue L., Wang X., Liu G. 2014. Dexamethasone potentiates myeloid-derived suppressor cell function in prolonging allograft survival through nitric oxide. J. Leukoc. Biol. V. 96. P. 675. https://doi.org/10.1189/jlb.2HI1113-611RR
Medzhitov R., Shevach E.M., Trinchieri G., Mellor A.L., Munn D.H., Gordon S., Libby P., Hansson G.K., Shortman K., Dong C., Gabrilovich D., Gabrysova L., Howes A., O’Garra A. 2011. Highlights of 10 years of immunology in Nature Reviews Immunology. Nat. Rev. Immunol. V. 11. P. 693. https://doi.org/10.1038/nri3063
Nagaraj S., Gupta K., Pisarev V., Kinarsky L., Sherman S., Kang L., Herber D.L., Schneck J., Gabrilovich D.I. 2007. Altered recognition of antigen is a mechanism of CD8+ T-cell tolerance in cancer. Nat. Med. V. 13. P. 828. https://doi.org/10.1038/nm1609
Nair R.R., Sinha P., Khanna A., Singh K. 2015. Reduced myeloid-derived suppressor cells in the blood and endometrium is associated with early miscarriage. Am. J. Reprod. Immunol. V. 73. P.1046. https://doi.org/10.1111/aji.12351
Negishi Y., Takahashi H., Kuwabara Y., Takeshita T. 2018. Innate immune cells in reproduction. J. Obstet. Gynaecol. Res. V. 44. P. 2025. https://doi.org//10.1111/jog.13759
Noman M.Z., Desantis G., Janji B., Hasmim M., Karray S., Dessen P. et al. 2014. PD-L1 is a novel direct target of HIF-1α, and its blockade under hypoxia enhanced MDSC-mediated T cell activation. J. Exp. Med. V. 211. P. 781. https://doi.org//10.1084/jem.20131916.
Ohta A., Gorelik E., Prasad S.J., Ronchese F., Lukashev D., Wong M.K., Huang X., Caldwell S., Liu K., Smith P., Chen J.F., Jackson E.K., Apasov S., Abrams S., Sitkovsky M. 2006. A2A adenosine receptor protects tumors from antitumor T cells. Proc. Natl. Acad. Sci. V. 103. P. 13132. https://doi.org/10.1073/pnas.0605251103
Ostrand-Rosenberg S., Sinha P. 2009. Myeloid derived suppressor cells: Linking inflammation and cancer. J. Immunol. V. 182. P. 4499. https://doi.org/10.4049/jimmunol.0802740
Ostrand-Rosenberg S., Sinha P., Beury D.W., Clements V.K. 2012. Cross-talk between myeloid-derived suppressor cells (MDSC), macrophages, and dendritic cells enhances tumor-induced immune suppression. Semin. Cancer Biol. V. 22. P. 275. semcancer.https://doi.org/10.1016/j
Ostrand-Rosenberg S., Sinha P., Figley C., Long R., Park D., Carter D., Clements V.K. 2017. Frontline Science: Myeloid-derived suppressor cells (MDSCs) facilitate maternal-fetal tolerance in mice. J. Leukoc. Biol. V. 101. P. 1091. https://doi.org/10.1189/jlb.1HI1016-306RR
Özkan B., Lim H., Park S. 2018. Immunomodulatory function of myeloid-derived suppressor cells during B cell-mediated immune responses. Int. J. Mol. Sci. V. 19. P. 1468. https://doi.org/10.3390/ijms19051468
Pacher P., Beckman J.S., Liaudet L. 2007. Nitric oxide and peroxynitrite in health and disease. Physiol. Rev. V. 87. P. 315. https://doi.org/10.1152/physrev.00029.2006
Pan P.Y., Ma G., Weber K.J., Ozao-Choy J., Wang G., Yin B., Divino C.M., Chen S.H. 2010. Immune stimulatory receptor CD40 is required for T-cell suppression and T-regulatory cell activation mediated by myeloid – derived suppressor cells in cancer. Cancer Res. V. 70. P. 99. https://doi.org/10.1158/0008-5472.CAN-09-1882
Pan T., Zhong L., Wu S., Cao Y., Yang Q., Cai Z., Cai X., Zhao W., Ma N., Zhang W., Zhang H., Zhoucorresponding J. 2016. 17β-Oestradiol enhances the expansion and activation of myeloid-derived suppressor cells via signal transducer and activator of transcription (STAT)−3 signaling in human pregnancy. Clin. Exp. Immunol. V. 185. P. 86. https://doi.org/10.1111/cei.12790
Park M.J., Lee S.H., Kim E.K., Lee E.J., Park S.H., Kwok S.K., Cho M.L. 2016. Myeloid-derived suppressor cells induce the expansion of regulatory B cells and ameliorate autoimmunity in the sanroque mouse model of systemic lupus erythematosus. Arthr. Rheumatol. V. 68. P. 2717. https://doi.org/10.1002/art.39767
Ren J., Zeng W., Tian F. Zhang S., Wu F., Qin X., Zhang Y., Lin Y. 2019. Myeloid-derived suppressor cells depletion may cause pregnancy loss via upregulating the cytotoxicity of decidual natural killer cells. Am. J. Reprod. Immunol. V. 81. P. 1. https://doi.org/10.1111/aji.13099
Rieber N., Gille C., Kostlin N., Schafer I., Spring B., Ost M., Spieles H., Kugel H.A., Pfeiffer M., Heininger V., Alkhaled M., Hector A., Mays L., Kormann M., Zundel S. et al. 2013. Neutrophilic myeloid-derived suppressor cells in cord blood modulate innate and adaptive immune response. Clin. Exp. Immunol. V. 174. P. 45. https://doi.org/10.1111/cei.12143
Rodriguez P.C., Quiceno D.G., Ochoa A.C. 2007. L-arginine availability regulates T-lymphocyte cell-cycle progression. Blood. V. 109. P. 1568. https://doi.org/10.1182/blood-2006-06-031856
Saito S., Nakashima A., Shima T., Ito M. 2010. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy. Amer. J. Reprod. Immunol. V. 63. P. 601. https://doi.org/10.1111/j.1600-0897.2010.00852.x
Sakuishi K., Jayaraman P., Behar S.M., Anderson A.C., Kuchroo V.K. 2011. Emerging Tim-3 functions in antimicrobial and tumor immunity. Trends Immunol. V. 32. P. 345. https://doi.org/10.1016/j.it.2011.05.003
Schwarz J., Scheckenbach V., Kugel H., Spring B., Pagel J., Härtel C., Pauluschke-Fröhlich J., Peter A., Poets C.F., Gille C., Köstlin N. 2018. Granulocytic myeloid-derived suppressor cells (GR-MDSC) accumulate in cord blood of preterm infants and remain elevated during the neonatal period. Clin. Exp. Immunol. V. 191. P. 328. https://doi.org/10.1111/cei.13059
Sinha P., Clements V.K., Bunt S., Albelda S., Ostrand-Rosenberg S. 2007. Cross-talk between myeloid-derived suppressor cells and macrophages subverts tumor immunity toward a type 2 response. J. Immunol. V. 179. P. 977. https://doi.org/10.4049/jimmunol.179.2.977
Tesi R. J. 2019. MDSC; the most important cell you have never heard of. Trends. Pharm. Sci.V. 40. P. 4. https://doi.org/10.1016/j.tips.2018.10.008
Veglia F., Perego M., Gabrilovich D. 2018. Myeloid-derived suppressor cells coming of age. Nat. Immunol. V.19. P. 108. https://doi.org/10.1038/s41590-017-0022-x
Verma P., Verma R., Nair R.R., Budhwar S., Khanna A., Agrawal N.R., Sinha R., Birendra R., Rajender S., Singh K. 2019. Altered crosstalk of estradiol and progesterone with Myeloid-derived suppressor cells and Th1/Th2 cytokines in early miscarriage is associated with early breakdown of maternal-fetal tolerance. Am. J. Reprod. Immunol. V. 81. P. 1. https://doi.org/10.1111/aji.13081
Wang Y., Liu Y., Shu C., Wan J., Shan Y., Zhi X., Sun L., Yi H., Yang Y.G., He J. 2018. Inhibition of pregnancy-associated granulocytic myeloid-derived suppressor cell expansion and arginase-1 production in preeclampsia. J. Reprod. Immunol. V. 127. P. 48. https://doi.org/10.1016/j.jri.2018.05.002
Yu J., Wang Y., Yan F., Zhang P., Li H., Zhao H., Yan C., Yan F., Ren X. 2014. Noncanonical NF-κB activation mediates STAT3-stimulated IDO upregulation in myeloid-derived suppressor cells in breast cancer. J. Immunol. V. 193. P. 2574. https://doi.org/10.4049/jimmunol.1400833
Zhu M., Huang X., Yi S., Sun H., Zhou J. 2017. High granulocytic myeloid-derived suppressor cell levels in the peripheral blood predict a better IVF treatment outcome. J. Matern.-Fetal Neonatal Med. V. 27. P. 1. https://doi.org/10.1080/14767058.2017.1400002
Дополнительные материалы отсутствуют.


