Цитология, 2022, T. 64, № 2, стр. 126-140
Клетки глиобластом человека линий Т2 И Т98G, резистентные к действию темозоломида
А. А. Пиневич 1, 2, *, И. И. Бодэ 2, Н. Л. Вартанян 1, Л. Н. Киселева 1, А. В. Карташев 1, М. П. Самойлович 1, 2
1 Российский научный центр радиологии и хирургических технологий им. акад. А.М. Гранова
197758 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет, кафедра цитологии и гистологии
199034 Санкт-Петербург, Россия
* E-mail: agniapinevich@gmail.com
Поступила в редакцию 25.11.2021
После доработки 12.01.2022
Принята к публикации 14.01.2022
- EDN: HOLCIF
- DOI: 10.31857/S0041377122020043
Аннотация
Появление в процессе химио- и лучевой терапии опухолей резистентных к этим воздействиям клеток является одной из нерешенных проблем онкологии. Исследование условий и механизмов формирования резистентности к темозоломиду, препарату первой линии в терапии глиобластом, проводят на культивируемых клеточных линиях. Учитывая гетерогенность глиобластом, представляет интерес изучение реакций различных клеточных линий на темозоломид. Целью работы были получение и характеристика резистентных в отношении темозоломида клеток линий T2 и Т98G. Источником темозоломида служил препарат Темодал® в форме лиофилизата для приготовления инфузионного раствора. Известно, что клетки T98G высоко устойчивы к темозоломиду, реакция на препарат клеток T2 не исследована. Однократное воздействие темозоломида в дозе 1 мМ приводило к изменению состава клеточных популяций линии Т2 – увеличению доли гигантских одноядерных клеток и клеток с фрагментированными ядрами. В результате воздействия снижалось количество клеток в G0/G1 фазах цикла, при этом содержание полиплоидных клеток возрастало в 4 раза. Клетки, которые после возобновления пролиферации были во второй и в третий раз подвергнуты воздействию темозоломида в дозе 2 мМ, отличались по морфологическому составу и пролиферативной активности от клеток, испытавших однократное действие препарата, по многим признакам приближаясь к интактным клеткам. Так, клетки T2 после однократной инкубации с 2 мМ темозоломида восстанавливали 90% монослоя через 48 сут, после второй инкубации – через 13 сут, а после третьей экспозиции – через 2 сут. Формирование резистентности клеток T2 к темозоломиду не сопровождалось изменениями исходно высокого уровня активности генов множественной лекарственной устойчивости ABCC1, ABCG2 и ABCB1, а также гена MGMT. Формирование резистентности к темозоломиду в культуре глиобластомы T2 скорее всего обусловлено действием других механизмов. Таким образом, линия Т2 может служить источником клеток, резистентных в отношении темозоломида, и может быть использована в качестве модели рецидивирующей глиобластомы. Клетки Т98G, как и ожидалось, показали чрезвычайно высокий уровень резистентности к темозоломиду. Препарат в дозе ниже 5 мМ не оказывал на них заметного действия.
ВВЕДЕНИЕ
Формирование резистентных к химиотерапии опухолевых клеток считается одной из основных причин появления рецидивов в процессе лечения онкологических заболеваний. Несмотря на достигнутые успехи в области изучения механизмов возникновения резистентности опухолевых клеток, разработка способов ее преодоления является далеко не решенной задачей онкологии.
Глиобластомы представляют собой чрезвычайно гетерогенную группу злокачественных новообразований головного мозга. Злокачественные клетки глиобластом проявляют неоднородность как у разных пациентов, так и в пределах одной опухоли, то есть обладают интер- и интраопухолевой гетерогенностью. Одно из следствий гетерогенности глиобластом – значительные различия проявлений резистентности опухолевых клеток к химиотерапии. Химиопрепаратом, широко применяемым после хирургического лечения глиобластом, является темозоломид, цитостатический противоопухолевый препарат алкилирующего типа действия (Клинические рекомендации Ассоциации онкологов России, Ассоциации нейрохирургов России и Российского общества клинической онкологии (https://oncology-association.ru/ clinical-guidelines); Weller et al., 2021). Формирование резистентности опухолей к этому препарату наблюдается в значительном числе случаев его использования.
Для создания клеточной модели, позволяющей исследовать формирование резистентности опухолевых клеток к действию темозоломида, были выбраны две линии глиобластом человека: Т98G и Т2. Линия Т98G используется в лабораторной практике с 70-х годов прошлого века. В ряде работ показано, что ее клетки имеют высокий уровень устойчивости к темозоломиду (Kanzawa et al., 2003; Hermisson et al., 2006; Kinashi et al., 2020). Линия Т2 была получена и охарактеризована в последнее десятилетие (Киселева и др., 2017). Чувствительность клеток линии Т2 к темозоломиду не изучена. Ранее показано, что обе эти линии проявляли высокую устойчивость к действию фотемустина, химиопрепарата второй линии терапии, являющегося производным нитрозомочевины. Резистентность клеток T98G и T2 проявлялась в высоком дозовом пороге фотемустина, останавливающем клеточную пролиферацию, а также в формировании популяций переживающих клеток, которые оставались живыми и метаболически активными после воздействия высоких доз препарата (Киселева и др., 2018).
Цель работы заключалась в получении и характеристике резистентных в отношении темозоломида клеток глиобластом линий Т98G и Т2. В качестве источника темозоломида был использован препарат Темодал® в лекарственной форме лиофилизата для приготовления инфузионного раствора.
МАТЕРИАЛ И МЕТОДИКА
Клеточные линии. Клеточная линия T2 была выделена из операционного материала пациентов в ФГБУ “Петербургский институт ядерной физики им. Б.П. Константинова национального исследовательского центра “Курчатовский институт” (Санкт-Петербург, Россия) и любезно предоставлена М.В. Филатовым. Клетки линии T98G были получены из коллекции клеточных культур ФГБУ “Научно-исследовательский институт гриппа им. А.А. Смородинцева” МЗ РФ (Санкт-Петербург, Россия). Основные характеристики клеток этих двух линий были описаны ранее (Киселева и др., 2016, 2017).
Культивирование клеточных линий. Клетки линий Т2 и T98G культивировали в вентилируемых пластиковых флаконах площадью 12.5 см2 (Jet Biofil, Китай) в среде αMEM (БиолоТ, Россия) с добавлением 5% эмбриональной телячьей сыворотки (HyClone, США) и 0.5% гентамицина (БиолоТ, Россия). Культивирование проводили при 37°С в CO2-инкубаторе (6% CO2 в атмосфере) до образования 80–90%-ного конфлюентного монослоя, после чего клетки пересевали с помощью раствора 0.25% трипсина с версеном (БиолоТ, Россия). Для экспериментов использовали клетки на 7-ом пассаже культивирования после поступления в лабораторию.
Воздействие темозоломида на клеточные линии. Для обработки клеток был использован Темодал® (Baxter Oncology GmbH, Германия), представляющий собой водорастворимый препарат, содержащий, помимо действующего вещества темозоломида, ряд вспомогательных веществ. При приготовлении раствора для внесения в клеточные культуры навеску Темодала® брали из расчета молярности темозоломида в конечном растворе и растворяли в деионизированной воде непосредственно перед внесением. Клетки глиобластом в логарифмической фазе роста культивировали в ростовой среде, содержащей Темодал®, в течение 24 ч. По завершении обработки клетки дважды отмывали ростовой средой. После удаления препарата каждые 3–4 сут проводили полную замену ростовой среды.
Для первичной обработки клеток линии Т2 использовали темозоломид в дозах 0.5, 1, 2 и 3 мМ. Клетки Т2, первично обработанные темозоломидом в дозе 1 мМ, по достижении 80–90%-ного конфлюентного монослоя пересевали, после чего подвергали повторному воздействию темозоломида в дозах 2, 4 и 6 мМ. Для первичной обработки клеток линии T98G применяли темозоломид в дозах 0.5, 1, 2, 3 и 5 мМ.
Морфологические исследования. Живые клетки фотографировали с помощью инвертированного микроскопа со встроенной камерой Primo Vert (Carl Zeiss, Германия). Для морфологического анализа клетки фиксировали ледяным карбинолом, окрашивали по Май-Грюнвальду–Гимзе и фотографировали с помощью инвертированного микроскопа Nikon Diaphot, оборудованного камерами Nikon D60 и Nikon D5600 (Nikon, Япония). Изображения анализировали с помощью программного обеспечения ImageJ (пакет Fiji) и ручного подсчета. Морфологическими параметрами служили размер клеток, количество и размер ядер, а также площадь клеток, которую определяли с помощью программного выделения (Thresholding) с ручным контролем и вычислением с использованием алгоритма ImageJ. В каждом образце анализировали не менее 1000 клеток, за исключением интактных образцов (10000 клеток) и образцов, в которых происходила массовая гибель клеток (100 клеток). Для графического представления данных (violin plot) использовали программу GraphPad Prism 9.
ДНК-цитометрия. Для анализа распределения по фазам клеточного цикла клетки, достигшие 80–90% конфлюента, снимали с поверхности культуральных флаконов с помощью раствора 0.25% трипсина с версеном (БиолоТ, Россия), дважды отмывали фосфатно-солевым буферным раствором (БиолоТ, Россия) и окрашивали с помощью Hoechst 33342 (Sigma, США) в концентрации 2 мкг/мл.
Исследование активности генов методом полимеразной цепной реакции (ПЦР) в режиме реального времени проводили после восстановления клетками 80–90%-ного конфлюэнтного монослоя. Этапы анализа и последовательности использованных праймеров описаны ранее (Киселева и др., 2016). В реакцию обратной транскрипции брали 500 нг РНК. Уровень активности экспрессии генов представляли в виде разницы (ΔСТ) между пороговым циклом исследуемого гена и гена сравнения GAPDH.
Статистический анализ проводили при помощи программного обеспечения Microsoft Excel, IBM SPSS Statistics 22 и GraphPAd Prism 9. Для оценки морфологических параметров использовали критерий Краскела−Уоллиса, так как при предварительной проверке согласно одновыборочному критерию Колмогорова−Смирнова распределения не являлись нормальными (p < 0.05).
Использованные реактивы: среда αMEM, гентамицин, раствор 0.25% трипсина с версеном, деионизированная вода, фосфатно-солевой буферный раствор (БиолоТ, Россия), эмбриональная телячья сыворотка (HyClone, США), Темодал® (Baxter Oncology GmbH, Германия), карбинол (Вектон, Россия), Май-Грюнвальд Гимза (BioVitrum, Россия), Hoechst 33342 (Sigma, США).
РЕЗУЛЬТАТЫ
Характеристика интактных клеток линии Т2. Интактная линия Т2 представляла собой гетерогенную клеточную культуру, более чем на 90% состоявшую из веретеновидных и фибробластоподобных одноядерных клеток (рис. 1а). В ходе морфологического исследования по размеру и количеству ядер клетки были условно разделены на четыре популяции: (1) маленькие одноядерные клетки основной популяции, (2) крупные (гигантские) одноядерные клетки, размер которых превышал размер клеток основной популяции, (3) клетки с двумя и более ядрами (многоядерные) и (4) клетки с фрагментированными ядрами (табл. 1). В интактной культуре Т2 доля гигантских одно- и многоядерных клеток составляла 8.08 ± 0.62%. Менее одного процента культуры представляли клетки с фрагментированными ядрами. Анализ клеточного цикла показал, что большая часть интактных клеток Т2 (69.8%) находилась в фазе G0/G1, количество клеток в S-фазе составляло 10.4%, а в фазе G2 – 12.3% соответственно. Около 6.1% клеток были полиплоидными (рис. 1б).
Рис. 1.
Общий вид культуры клеток Т2 глиобластомы человека: интактная при окраске по Май-Грюнвальду–Гимзе (а), интактная в фазовом контрасте (в) и через 13 сут после воздействия темозоломидом в дозе 0.5 мМ (г, фазовый контраст). Масштабные отрезки: 100 мкм. б – Распределение клеток интактной культуры Т2 по фазам клеточного цикла (проточная цитометрия); по горизонтали – флуоресценция DAPI (окраска ядер), усл. ед.; по вертикали – число клеток.
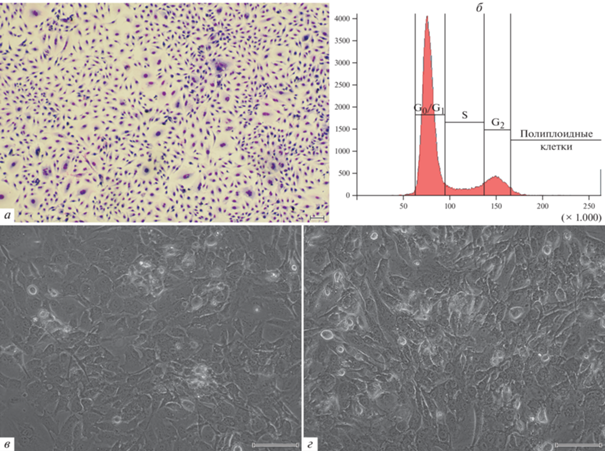
Таблица 1.
Соотношение различных популяций клеток Т2 в интактной культуре и культурах, одно- и многократно обработанных темозоломидом
| Доза темозоломида, мМ | Доля клеток, % | |||
|---|---|---|---|---|
| маленькие одноядерные клетки | гигантские одноядерные клетки | многоядерные клетки | клетки с фрагментированными ядрами | |
| 0 (Контроль) | 91.24 ± 0.64 | 4.37 ± 0.52 | 3.71 ± 0.38 | 0.68 ± 0.14 |
| 1 | 76.34 ± 3.61 | 14.10 ± 3.07 | 3.68 ± 0.65 | 5.88 ± 1.19 |
| 1 + 2 | 74.93 ± 3.07 | 16.34 ± 2.22 | 7.46 ± 1.21 | 1.28 ± 0.43 |
| 1 + 2 + 2 | 87.13 ± 1.26 | 7.24 ± 0.92 | 3.77 ± 0.39 | 1.86 ± 0.12 |
| 3 | 18.62 ± 4.53 | 51.39 ± 8.02 | 22.33 ± 4.86 | 7.67 ± 2.65 |
Однократное воздействие темозоломида на клетки Т2. Воздействие темозоломида в дозе 0.5 мМ на клетки глиобластомы Т2 не приводило к изменению морфологических характеристик клеток (рис. 1в, г). После обработки препаратом пролиферация клеток замедлилась по сравнению с интактной культурой. Обработанные клетки культивировали в течение 14‑ти сут до достижения 90%-ного конфлюентного монослоя.
Воздействие темозоломида в дозе 1 мМ приводило к увеличению размера клеток Т2 и изменению их формы (рис. 2а). Начиная с 7-ми сут после обработки препаратом, в культуре преобладали клетки астроцитарной формы с длинными ветвящимися отростками, увеличилось число гигантских одноядерных клеток и клеток с фрагментированными ядрами (табл. 1). Непосредственно после обработки препаратом происходила временная остановка пролиферации, а в дальнейшем наблюдалось существенное ее замедление по сравнению с интактной культурой. Отдельные пролиферирующие клетки были выявлены в культуре через 9 сут, однако 90%-ного конфлюентного монослоя клетки достигли лишь на 23-e сут культивирования. Следует отметить, что мы не наблюдали признаков пролиферации гигантских клеток, однако при пересеве такие клетки сохраняли жизнеспособность и прикреплялись к поверхности культуральных флаконов наравне с пролиферирующими клетками (рис. 2б). Эффекты воздействия темозоломида на выживаемость и пролиферацию клеток в культурах глиобластом суммированы в табл. 2.
Рис. 2.
Общий вид культуры клеток Т2 глиобластомы человека после воздействия темозоломидом в дозе 1 мМ через 13 сут (а, фазовый контраст) и через 34 сут (б, окраска по Май-Грюнвальду–Гимзе); масштабные отрезки: 100 мкм. в – распределение клеток Т2 по фазам клеточного цикла (проточная цитометрия) через 5 сут после того же воздействия; по горизонтали – флуоресценция DAPI (окраска ядер), усл. ед.; по вертикали – число клеток.
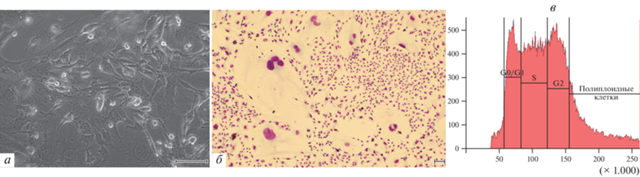
Таблица 2.
Одно- и многократное действие темозоломида на пролиферацию и выживаемость клеток линий глиобластом
| Доза темозоломида, мМ | Линия глиобластом | |
|---|---|---|
| T2 | T98G | |
| Первое воздействие | ||
| 0.5 | Пролиферация (14) | Пролиферация (2) |
| 1 | Пролиферация (23) | Пролиферация (2) |
| 2 | Пролиферация (48) | Пролиферация (2) |
| 3 | Непролиферирующие клетки | Пролиферация (2) |
| 5 | Н.о. | Пролиферация (9) |
| Второе воздействиеа | ||
| 2 | Пролиферация (13) | Н.о. |
| Третье воздействиеб | ||
| 2 | Пролиферация (2) | Н.о. |
| 4 | Пролиферация (10) | Н.о. |
| 6 | Гибель культуры | Н.о. |
Примечание. В скобках указано время (сут) от момента окончания воздействия темозоломида до достижения культурой 80–90%-ного конфлюентного монослоя. Н.о. – не определяли. а – клетки после первого воздействия 1 мМ темозоломида после достижения 80–90%-ного конфлюентного монослоя пересевали и подвергали второму воздействию. б – клетки после второго воздействия 2 мМ темозоломида после достижения 80–90%-ного конфлюентного монослоя пересевали и подвергали третьему воздействию.
Распределение клеток Т2, обработанных 1 мМ темозоломида, по фазам клеточного цикла изменилось по сравнению с интактными клетками (рис. 2в). Наибольшее число клеток находилось в фазе S (29.5%), возросло содержание клеток в фазе G2 (24.7%), в то время как число клеток в фазе G0/G1 снизилось почти в 4 раза по сравнению с исходными клетками (18.7%). В то же время, существенно увеличилось количество полиплоидных клеток; их содержание в культуре составило 24.2%, то есть в 4 раза больше, чем в интактной культуре клеток линии Т2.
Воздействие темозоломида в дозе 2 мМ также приводило к преобладанию в культуре Т2 клеток астроцитарной формы с ветвящимися отростками (рис. 3а) и увеличению числа гигантских клеток (табл. 1, рис. 3б). На 20-е сут культивирования произошла гибель более 90% клеток. На 27-е сут культивирования появились единичные колонии пролиферирующих клеток. К 41-м сут культивирования количество колоний пролиферирующих клеток существенно увеличилось (рис. 3б), и на 48-е сут клетки достигли 90%-ного конфлюентного монослоя (табл. 2). После пересева соотношение различных морфологических типов клеток оставалось неизменным, причем гигантские клетки сохраняли жизнеспособность, хотя не было выявлено признаков их пролиферации.
Рис. 3.
Общий вид культуры клеток Т2 глиобластомы человека после воздействия темозоломидом в дозе 2 мМ через 13 (а) и 41 сут (б), а также в дозе 3 мМ через 13 (в) и 34 сут (г). Стрелка указывает на ядро гигантской клетки. а–в: фазовый контраст. г – окраска по Май-Грюнвальду–Гимзе. Масштабные отрезки: 100 мкм.
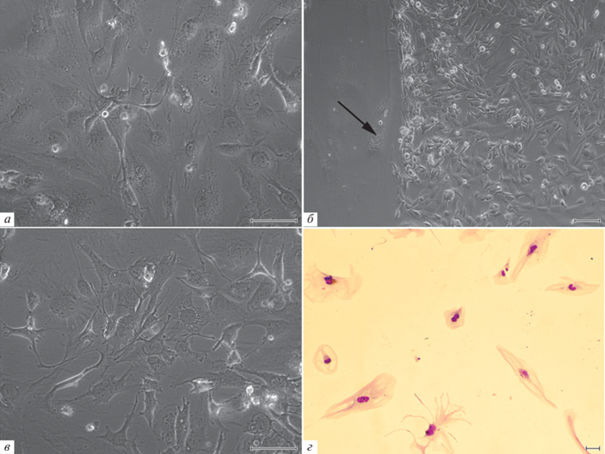
Воздействие темозоломида в дозе 3 мМ приводило к изменениям формы клеток Т2, описанным для дозы 2 мМ (рис. 3в). На 20-е сут культивирования произошла гибель более 90% клеток. Сохранившая жизнеспособность популяция почти полностью состояла из гигантских и многоядерных клеток, а мелкие одноядерные клетки составляли в ней менее 20% (табл. 1). Пролиферация клеток после обработки препаратом прекратилась и в дальнейшем не возобновилась. Наблюдение за клетками проводили в течение 34-х сут после завершения обработки темозоломидом (рис. 3г, табл. 2).
Повторное воздействие темозоломида на клетки Т2. Клетки, сохранившие способность к пролиферации после воздействия темозоломида в дозах 1 или 2 мМ, были обозначены как резистентные. Резистентные клетки, перенесшие первое воздействие темозоломида в дозе 1 мМ, повторно обрабатывали 2 мМ темозоломида. Повторная обработка не приводила к массовой гибели клеток или остановке пролиферации (табл. 2). Число клеток астроцитарной формы и гигантских одноядерных клеток сохранилось практически неизменным, по сравнению с клетками, перенесшими однократную обработку 1 мМ темозоломида (рис. 4а). Вдвое увеличилось число многоядерных клеток, а доля клеток с фрагментированными ядрами вернулась к значениям, характерным для интактных клеток (табл. 1).
Рис. 4.
Общий вид культуры клеток Т2 глиобластомы человека, перенесших первое действие темозоломидом (1 мМ), а затем второе воздействие в дозе 2 мМ через 23 сут (а) и третье воздействие в дозе 2 мМ через 11 сут (в). Окраска по Май-Грюнвальду–Гимзе; масштабные отрезки: 100 мкм. б – Распределение клеток Т2 по фазам клеточного цикла (проточная цитометрия) через 20 сут после второго воздействия темозоломидом (2 мМ); по горизонтали – флуоресценция DAPI (окраска ядер), усл. ед.; по вертикали – число клеток.
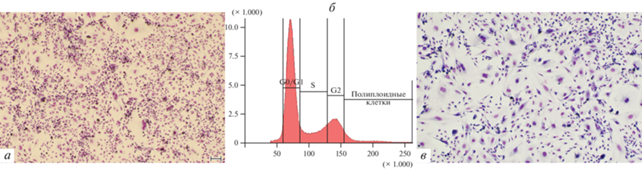
Распределение клеток, повторно обработанных темозоломидом, по фазам клеточного цикла было ближе к норме по сравнению с клетками, подвергнутыми однократному воздействию препарата (рис. 4б). Так, наибольшее количество клеток находилось в фазе G0/G1 (51%), а численность клеток в фазах S (14.9%) и G2 (15.3%) была сопоставимой. Однако, по сравнению с интактными клетками, количество полиплоидных клеток все еще было значительно больше (15.9%).
Резистентные клетки, перенесшие первое воздействие темозоломида в дозе 1 мМ и второе воздействие в дозе 2 мМ, пересевали и повторно обрабатывали темозоломидом в концентрациях 2, 4 и 6 мМ (табл. 2). Третья обработка резистентных клеток темозоломидом в дозе 2 мМ не приводила ни к массовой гибели клеток, ни к остановке клетками пролиферации, при этом в культуре сохранялись как активно пролиферирующие клетки, так и гигантские непролиферирующие клетки (рис. 5в). Число клеток астроцитарной формы и многоядерных клеток возвращалось к показателям, выявленным для интактных клеток. Содержание гигантских одноядерных клеток также уменьшалось, по сравнению с клетками, перенесшими однократное воздействие темозоломида, но превышало таковое в культуре интактных клеток линии Т2 (табл. 1). Третья обработка резистентных клеток темозоломидом в дозе 4 мМ приводила к временной остановке пролиферации, которая возобновилась на 6-е сут после завершения обработки. Наконец, третья обработка резистентных клеток 6 мМ темозоломида привела к гибели всех клеток. Таким образом, резистентые клетки линии Т2 отличались меньшей чувствительностью к воздействиям темозоломида в концентрациях, превышающих использованные при первичной обработке интактных клеток.
Рис. 5.
Площадь клеток линии Т2 интактных и обработанных одно- и многократно темозоломидом. Точки – значения для индивидуальных клеток, горизонтальные линии – медианы. Здесь и на рис. 8, 9, 10 знак “+” на горизонтальной оси при указании концентрации темозоломида означает повторную обработку клеток после достижения культурой, обработанной препаратом, 80–90%-ного конфлюентного монослоя и пересева.
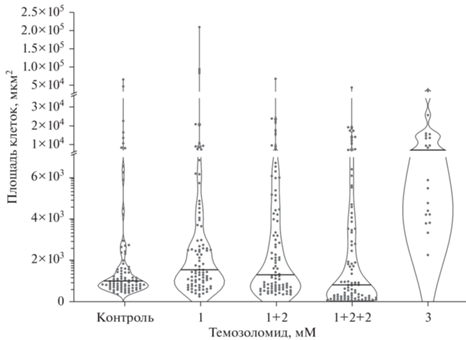
Определение площади клеток Т2, интактных и обработанных темозоломидом. Для оценки морфологических изменений клеток Т2 после обработки темозоломидом было проведено измерение площади клеток (рис. 5). Площадь интактных клеток основной популяции (маленьких одноядерных клеток) варьировала в пределах 450–2000 мкм2 в зависимости от формы клеток. Площадь гигантских одноядерных интактных клеток также варьировала, в основном находясь в пределах (2–4) × 103 мкм2. Наконец, площадь гигантских многоядерных клеток составляла в среднем (10–15) × 103 мкм2. Таким образом, средняя площадь интактных клеток Т2 составила 3463 ± 962 мкм2.
При однократной обработке 1 мМ темозоломида средняя площадь клеток увеличивалась по сравнению с интактными образцами (8124 ± 2854 мкм2), что во многом отражало уменьшение числа мелких клеток и увеличение доли гигантских клеток (табл. 1). Обработка клеток Т2 3 мМ темозоломида приводила к еще более существенному увеличению площади клеток по сравнению с контролем (10 300 ± 1922 мкм2) (рис. 5).
Повторная обработка 2 мМ темозоломида клеток Т2, подвергнутых однократному воздействию 1 мМ темозоломида, привела к уменьшению средней площади клеток (4028 ± 894 мкм2) по сравнению с однократно обработанными клетками. Наконец, вследствие третей обработки клеток 2 мМ темозоломида произошло дальнейшее уменьшение площади клеток, причем средняя площадь клеток Т2, подвергнутых трехкратному воздействию препарата (3319 ± 673 мкм2), была ниже таковой у интактных клеток (рис. 5).
Таким образом, в ответ на первоначальное воздействие темозоломида средняя доля клеток Т2 с увеличенной площадью возрастала по сравнению с интактными клетками, причем степень увеличения площади клеток зависела от дозы препарата. Повторные воздействия темозоломида приводили к возвращению показателя средних размеров клеток к значениям, характерным для интактных клеток.
Характеристика интактных клеток линии T98G. Морфологическая характеристика интактной культуры T98G была проведена ранее (Киселева и др., 2016). В настоящей работе при морфологическом анализе клетки линии T98G были условно разделены на четыре популяции, аналогичные описанным выше для глиомы линии Т2. Показано, что в интактной культуре T98G преобладали маленькие одноядерные клетки (табл. 3), также были выявлены гигантские одно- и многоядерные клетки, в то время как клетки с фрагментированными ядрами практически отсутствовали.
Таблица 3.
Соотношение различных популяций клеток T98G в интактной культуре и культуре, однократно обработанной темозоломидом
| Концентрация темозоломида, мМ | Доля клеток, % | |||
|---|---|---|---|---|
| маленькие одноядерные клетки | гигантские одноядерные клетки | многоядерные клетки | клетки с фрагментированными ядрами | |
| 0 (Контроль) | 88.21 ± 1.81 | 4.99 ± 1.53 | 6.67 ± 0.67 | 0.02 ± 0.02 |
| 5 | 92.83 ± 1.70 | 3.96 ± 1.05 | 1.74 ± 0.33 | 1.80 ± 0.46 |
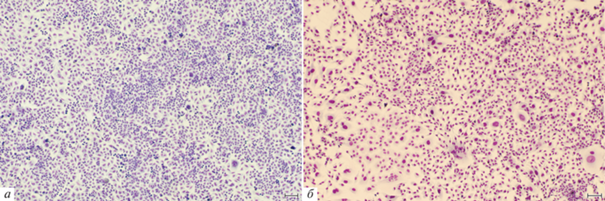
Воздействие темозоломида на клетки Т98G. Обработка клеток Т98G темозоломидом в дозах 0.5, 1, 2, 3 и 5 мМ не приводила ни к изменению морфологии клеток, ни к прекращению клетками пролиферации (рис. 6, табл. 3). При обработке клеток 5 мМ темозоломида было выявлено замедление скорости пролиферации клеток по сравнению с интактной культурой. В культуре клеток T98G, обработанных 5 мМ темозоломида, число маленьких одноядерных клеток увеличивалось по сравнению с контролем, в то время как доля гигантских клеток уменьшалась. Число клеток с фрагментированными ядрами также незначительно увеличивалось (табл. 3).
Рис. 6.
Общий вид культуры клеток Т98G глиобластомы человека: интактная (а) и после воздействия темозоломидом в дозе 5 мМ через 19 сут (б). Окраска по Май-Грюнвальду–Гимзе. Масштабные отрезки: 100 мкм.
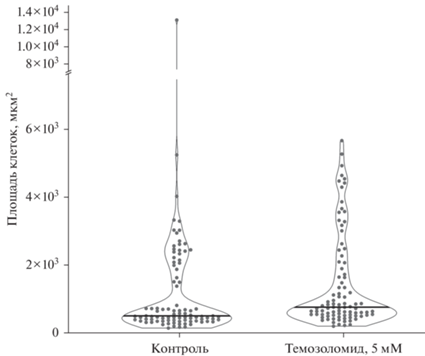
Определение площади клеток Т98G, интактных и обработанных темозоломидом. Площадь интактных клеток основной популяции (маленьких одноядерных клеток) составляла 240–800 мкм2 (рис. 7). Площадь гигантских одноядерных клеток находилась в пределах 2000–3500 мкм2. Площадь многоядерных клеток широко варьировала и составляла 700–13 300 мкм2. При обработке клеток линии T98G 5 мМ темозоломида размерные характеристики клеток оставались практически неизменными по сравнению с контролем (рис. 7).
Рис. 7.
Площадь клеток линии Т98G, интактных и обработанных темозоломидом. Точки – значения для индивидуальных клеток, горизонтальные линии – медианы.
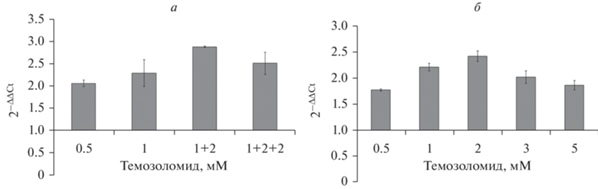
Определение уровня экспрессии генов в клетках Т2 и T98G. В клетках Т2 и T98G была исследована экспрессия генов, связанных с множественной лекарственной устойчивостью: ABCC1, ABCG2 и ABCВ1 (рис. 8а). Интактные клетки T98G отличались высокой экспрессией генов ABCC1 и ABCG2, существенно превышавшей таковую в интактных клетках Т2, однако клетки Т2 характеризовались более высокой активностью гена ABCB1 по сравнению с клетками T98G.
Рис. 8.
Уровень экспрессии генов (указаны справа) множественной лекарственной устойчивости в интактных клетках T2 и T98G (относительный, а) и в клетках Т2, обработанных темозоломидом (б). ПЦР-анализ в режиме реального времени. а: ΔCT – разница между пороговым циклом исследуемого гена и гена сравнения GAPDH.
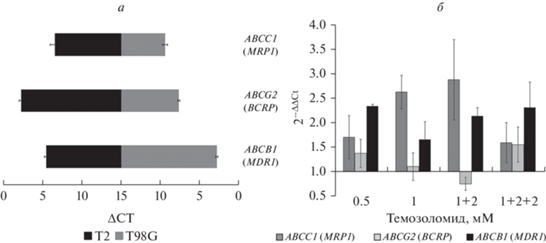
Темозоломид не оказывал значимого влияния на экспрессию генов множественной лекарственной устойчивости в клетках линии Т2, подвергнутых первичной обработке препаратом. Резистентные к действию темозоломида клетки T2 по этому признаку также не отличались от интактных клеток (рис. 8б). В клетках линии T98G, обработанных разными дозами темозоломида, также не было обнаружено изменения экспрессии генов множественной лекарственной устойчивости (данные не представлены).
В интактных и резистентных клетках Т2 после однократного, двукратного и трехкратного воздействий темозоломида была исследована экспрессия генов фактора роста эндотелия сосудов (VEGF), гепатоцитарного фактора роста (HGF), тенасцина (TNC), кислой церамидазы (ASAH1), IL-6 и IL-8 (рис. 9а). По сравнению с исходными клетками резистентные клетки T2 более активно экспрессировали все исследованные гены. Наибольшее усиление экспрессии было отмечено в отношении генов, кодирующих провоспалительные цитокины IL-6 и IL-8.
Рис. 9.
Уровень экспрессии генов в клетках T2 (а) и T98G (б), обработанных темозоломидом в разных концентрациях. ПЦР-анализ в режиме реального времени. Названия генов указаны по горизонтали.
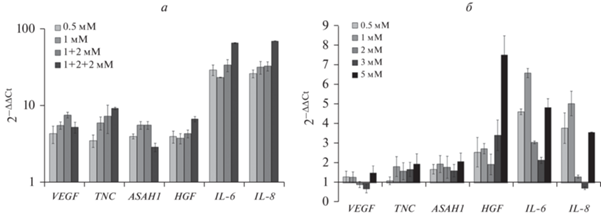
Экспрессия генов VEGF, TNC, ASAH1, HGF, IL-6 и IL-8 была изучена в клетках T98G после обработки разными дозами темозоломида (рис. 9б). Экспрессия генов VEGF, TNC и ASAH1 оставалась практически неизменной. Наиболее существенно увеличивалась экспрессия HGF при обработке клеток T98G 5 мМ темозоломида. Экспрессия провоспалительных цитокинов IL-6 и IL-8 варьировала вне зависимости от использованной дозы темозоломида.
В клетках линий T2 и T98G, интактных и обработанных темозоломидом, была исследована экспрессия гена MGMT, кодирующего белок репарации ДНК (рис. 10). Высокий уровень активности MGMT является одним из ключевых факторов, определяющих неудачу лечения темозоломидом. Интактные клетки T2 и T98G обладали сходным уровнем экспрессии MGMT. Обработка клеток обеих линий темозоломидом не приводила к значимому изменению экспрессии гена, при этом не было обнаружено зависимости между дозой темозоломида и уровнем экспрессии MGMT. Экспрессия MGMT в резистентных клетках линии Т2, подвергнутых повторным обработкам темозоломидом, также оставалась практически неизменной.
ОБСУЖДЕНИЕ
Одной из главных нерешенных проблем современной онкологии является появление рецидивов новообразований спустя то или иное время после проведения химио- и (или) лучевой терапии. Анализ экспериментальных данных и клинических исследований показал, что источником рецидивов опухолей являются клетки, резистентные к предшествовавшей терапии (Свирновский, 2014; Волков, 2021). До настоящего времени нет четкого определения резистентных опухолевых клеток, а, соответственно, не обозначены маркеры, их идентифицирующие. Опухоли могут исходно содержать клетки, высокоустойчивые ко многим химиопрепаратам и облучению, что обозначается как первичная резистентность опухолевых клеток. В процессе терапии опухолей также формируются популяции резистентных клеток, что обозначается как вторичная или приобретенная резистентность, которая имеет многофакторный характер (Mirzayans, Murray, 2020). При этом отдельные клетки в пределах одной опухоли могут использовать разные механизмы устойчивости к препаратам, такие как длительная задержка пролиферации, активация репаративных систем, парадоксальный апоптоз, клеточное слияние и другие (Mirzayans, Murray, 2020).
Для выявления и характеристики резистентных клеток используют различные методические приемы, в том числе оценку жизнеспособности (по проницаемости для витальных красителей, активности клеточных ферментов), которая выполняется в ближайшие дни после применения облучения или химиопрепаратов. Определение колониеобразующих единиц (КОЕ) занимает более длительное время – несколько недель, но, на наш взгляд, является значительно более информативным тестом.
Отличительная особенность нашей работы состояла в том, что наблюдения над клетками линий глиобластом проводили в течение длительного времени (не менее 1 месяца). Для изучения брали клетки, которые выжили после инкубации с темозоломидом в сублетальных дозах, длительное время сохранялись в непролиферирующем (спящем) состоянии, затем возобновляли деление, после чего были однократно пересеяны. Эти резистентные клетки исследовали непосредственно или после следующих аналогичных циклов обработки темозоломидом.
В качестве источника темозоломида в работе был использован препарат Темодал® в лекарственной форме лиофилизата для приготовления инфузионного раствора, что позволило избежать дополнительного токсического действия диметилсульфоксида, стандартно применяемого для растворения темозоломида в экспериментах с клеточными культурами. Наряду с действующим веществом, Темодал® содержит ряд вспомогательных веществ: маннитол, треонин, полисорбат-80, натрия цитрата дигидрат и хлористоводородную кислоту. Это обстоятельство накладывает определенные ограничения на интерпретацию полученных результатов из-за наличия в составе препарата треонина, обладающего протективным действием, в частности способностью снижать интенсивность проапоптотических процессов (Baird et al., 2013). Известно, что клетки Т98G имеют изначально высокий уровень устойчивости к темозоломиду (Lee, 2016), однако исследования чувствительности клеток этой линии к темозоломиду в форме Темодала® нам не известны. Влияние темозоломида на клетки линии Т2 ранее не было исследовано.
Темозоломид оказывал влияние на морфологические характеристики клеток линии Т2 и параметры клеточного цикла, существенно замедляя клеточную пролиферацию. Так, после однократного воздействия темозоломида в дозах 1 или 2 мМ клеткам Т2 для достижения 80–90% конфлюентного монослоя требовалось 23 и 48 сут соответственно. Однако при последующих обработках темозоломидом клеток, переживших первое воздействие препарата, время, необходимое для достижения 80–90% конфлюентного монослоя, сокращалось, приближаясь к значениям, характерным для интактных клеток. Формирование популяций клеток Т2, более резистентных к действию темозоломида, чем исходные, происходило уже после однократного воздействия препарата в дозе 1 мМ. Популяции резистентных клеток Т2, полученные после одно-, двух- и трехкратного воздействия темозоломида, различались по клеточному составу. После первого воздействия препарата было отмечено снижение числа мелких одноядерных клеток, характерных для интактных культур T2, и увеличение числа крупных одноядерных клеток, а также клеток с фрагментированными ядрами. При повторном воздействии препарата возросло число крупных многоядерных клеток, а количество клеток с фрагментированными ядрами, напротив, уменьшилось. После третьего воздействия темозоломида число мелких одноядерных клеток вновь возрастало, а число крупных клеток, напротив, снижалось. Таким образом, после третьего воздействия препарата клетки смогли восстановить исходный “нормальный” фенотип, одновременно приобретя высокую устойчивость к темозоломиду. Размерные характеристики клеток линии Т2 после многократного воздействия темозоломида также возвращались к показателям, характерным для интактных клеток.
Аналогичные тенденции наблюдались и в отношении распределения клеток по фазам клеточного цикла. Так, после первого воздействия темозоломида наибольшее число клеток находилось в фазах S и G2, а содержание полиплоидных клеток по сравнению с интактной культурой возрастало. Однако уже после повторной инкубации клеток Т2 с темозоломидом распределение их по фазам цикла приближалось к таковому для интактных клеток. Количество полиплоидных клеток при этом оставалось существенно увеличенным. Роль полиплоидных клеток опухоли в формировании устойчивости новообразований к терапевтическим воздействиям рассмотрена нами в обзоре 2020 года (Вартанян и др., 2020).
Ранее мы показали, что линии Т2 и T98G имели высокую устойчивость к повреждающему действию фотемустина, препарата второй линии терапии глиобластом. Клетки обеих линий имели высокий дозовый порог, при котором наблюдалось прекращение клеточной пролиферации. Они характеризовались способностью формировать популяции переживающих, непролиферирующих, клеток, которые после воздействия высоких доз препарата долгое время оставались живыми и сохраняли метаболическую активность (Киселева и др., 2018).
Формирование популяции переживающих клеток происходило и в случае действия на клетки Т2 высоких доз темозоломида. Популяции клеток этой линии, сохранившиеся после обработки темозоломидом в дозе 3 мМ, состояли преимущественно из крупных одно-, многоядерных клеток и клеток с фрагментированными ядрами, тогда как мелких одноядерных клеток сохранялось менее 20%. После действия темозоломида в такой высокой дозе клетки не смогли восстановить пролиферативную активность, однако сохраняли жизнеспособность более месяца.
Линия T98G отличалась иным характером ответа на действие темозоломида. Резистентность этих клеток была исходно настолько высока, что лишь максимальная использованная доза 5 мМ смогла снизить их пролиферативную активность, а при более низких дозах препарата антипролиферативный эффект не был отмечен. Морфологические изменения клеток в результате обработки препаратом также были слабо выражены. Наблюдаемый эффект можно объяснить тем, что препарат Темодал®, использованный для обработки клеток, содержал, помимо темозоломида, другие компоненты, концентрация которых существенно возрастала при увеличении концентрации действующего вещества в ходе обработки клеток. При использованных нами дозах темозоломида формирование популяции переживающих клеток линии T98G не наблюдали.
Резистентность опухоли формируется под действием различных молекулярных механизмов. Один из важнейших связан с функционированием транспортных белков – АВС-транспортеров, обеспечивающих эффлюкс химиопрепаратов из клетки против градиента концентрации с затратой энергии АТФ, что приводит к быстрому уменьшению внутриклеточного уровня препарата ниже терапевтической концентрации (Borst et al., 2000; George, 2015; Kathawala et al., 2015). Существенная роль в развитии резистентности к химиопрепаратам принадлежит представителям трех субсемейств данной группы белков. К ним относятся белки ABCB1 (Р-гликопротеин), ABCG2 и ABCC1, экспрессируемые на опухолевых и стволовых опухолевых клетках и усиливающие резистентность к химиопрепаратам, в том числе темозоломиду (Peignan et al., 2011; Coyle et al., 2015; Gooijer et al., 2018; Wang et al., 2019).
Клетки линий Т2 и Т98G имели индивидуальный спектр активности генов белков-транспортеров АВС. Так, в клетках линии Т98G экспрессия генов ABCC1 и ABCG2 превышала таковую в клетках Т2, причем наибольшая активность была характерна для гена ABCC1, кодирующего белок множественной лекарственной устойчивости 1 (Mrp1). Высокий уровень экспрессии Mrp1 в клетках линии Т98G был описан ранее (Peignan et al., 2011). В клетках Т2 наибольшая активность была определена у гена АВСВ1. Воздействие темозоломида не оказывало существенного влияния на уровень экспрессии этих генов.
Ген MGMT кодирует фермент О-6-метилгуанин-ДНК-метилтрансферазу, белок репарации ДНК, защищающий клетку от мутагенных и цитотоксических свойств алкилирующих агентов. Высокая экспрессия MGMT является одним из ключевых факторов, определяющих устойчивость клеток опухоли к алкилирующим препаратам, в том числе к действию темозоломида (Kitange et al., 2009; Perazzoli et al., 2015; Chen et al., 2018; Oldrini et al., 2020). Известно, что уровень экспрессии MGMT в глиобластомах варьирует в широких пределах. Так, клетки линии T98G характеризуются высоким уровнем активности этого гена в отличие, например, от клеток линии А172 (Hermisson et al., 2006; Kinashi et al., 2020).
В наших исследованиях интактные клетки T2 и T98G обладали сходным уровнем экспрессии гена MGMT, кодирующего белок репарации ДНК. Обработка клеток обеих линий темозоломидом не приводила к значимому изменению экспрессии гена MG-MT, при этом не было обнаружено зависимости между дозой темозоломида и активностью данного гена. Экспрессия MGMT в резистентных клетках линии Т2, подвергнутых повторным обработкам темозоломидом, также оставалась практически неизменной. Таким образом, наблюдаемые нами изменения в чувствительности клеток Т2 к темозоломиду скорее всего обусловлены действием других механизмов, определяющих появление химиорезистентности. Однако следует отметить, что существуют данные в пользу того, что действие темозоломида может приводить к снижению в клетках T98G содержания О-6-метилгуанин-ДНК-метилтрансферазы, но не к снижению экспрессии гена MGMT (Vlachostergios et al., 2013).
В интактных и обработанных темозоломидом клетках T2 и T98G была исследована активность ряда генов, связанных с прогрессией опухолей. В клетках линии Т2 наибольшее усиление экспрессии было отмечено в отношении генов, кодирующих провоспалительные цитокины IL-6 и IL-8, являющихся одними из основных компонентов секреторного фенотипа, ассоциированного с клеточным старением (Waugh et al., 2008; Palena et al., 2012; Ortiz-Montero et al., 2017; Бородкина и др., 2018).
Процесс клеточного старения сопровождается секрецией множества факторов, объединенных названием “секреторный фенотип, ассоциированный со старением” (senescence associated secretory phenotype, SASP). С их помощью стареющие клетки способны оказывать влияние на микроокружение, воздействуя на процессы пролиферации и дифференцировки (Coppe at al., 2010) и создавая условия, благоприятные для роста и размножения клеток, в том числе злокачественных (Chen et al., 2014). Резистентные клетки Т2 более активно, чем интактные клетки, экспрессировали ген гепатоцитарного ростового фактора (HGF), также являющегося компонентом SASP и участвующего в процессах регуляции клеточного цикла, дифференцировки, морфогенеза и апопотоза (Lamouille et al., 2014; Inan, Hayran, 2019), ген фактора роста эндотелия сосудов (VEGF) – основного проангиогенного фактора (Melincovici et al., 2018), ген тенасцина (TNC) – компонента метастатической ниши (Brosicke, Faissner, 2015; Angel et al., 2020) и кислой церамидазы (ASAH1) – фермента метаболизма сфигнолипидов, участвующего в формировании резистентности к терапии и связанного с более агрессивным течением заболевания (Bai et al., 2017; Lee, 2016; Nguyen et al., 2018; Parveen et al., 2019). Активация данных генов в изучаемых популяциях резистентных к темозоломиду клеток может свидетельствовать о наличии у них признаков, характерных для более агрессивных клонов опухолевых клеток.
В клетках T98G экспрессия генов VEGF, TNC и ASAH1 после обработки разными дозами темозоломида оставалась практически неизменной. Наиболее существенно увеличивалась экспрессия HGF при использовании темозоломида в дозе 5 мМ. Экспрессия провоспалительных цитокинов IL-6 и IL-8 варьировала вне зависимости от использованной дозы темозоломида.
Таким образом, линия Т2 может служить источником клеток, резистентных в отношении ряда противоопухолевых препаратов, и быть использована в качестве модели рецидивирующей глиобластомы. В то же время, клетки линии Т98G показали чрезвычайно высокий уровень резистентности к темозоломиду, и обработка препаратом даже в очень высоких дозах не оказывала на эти клетки существенного влияния.
Список литературы
Бородкина А.В., Дерябин П.И., Грюкова А.А., Никольский Н.Н. 2018. “Социальная жизнь” стареющих клеток: что такое SASP и зачем его изучать? Acta Naturae. Т. 10. № 1. С. 4–14. (Borodkina A.B., Deryabin P.I., Grukova A.A., Nikolskiy N.N. 2018. “The social life” of aging cells: what is SASP and why study it? Acta Naturae. V. 10. № 1. P. 4–14).
Вартанян Н.Л., Пиневич А.А., Бодэ И.И., Самойлович М.П. 2020. Полиплоидные гигантские клетки опухоли и их роль в формировании устойчивости к терапевтическим воздействиям. Современная онкология. Т. 22. № 3. С. 105–108. (Vartanyan N.L., Pinevich A.A., Bode I.I., Samoylovich M.P. 2020. Polyploid giant cancer cells and their role in the formation of resistance to therapeutic treatment. J. Mod. Oncol. V. 22. № 3. P. 105–108).
Волков Н.М. 2021. Резистентности к химиотерапии – исчерпаны ли возможности? Практическая онкология. Т. 22. № 2. С. 99–108. (Volkov N.M. 2021. Cancer resistance to chemotherapy – are all possibilities exhausted? Pract. Oncol. V. 22. № 2. P. 105–108).
Киселева Л.Н., Карташев А.В., Вартанян Н.Л., Пиневич А.А., Самойлович М.П. 2016. Характеристика клеточных линий А172 и T98G. Цитология. Т. 58. № 5. С. 349–355. (Kiseleva L.N., Kartashev A.V., Vartanyan N.L., Pinevich A.A., Samoilovich M.P. 2016. A172 and T98G cell lines characteristics. Cell Tiss. Biol. V. 10. № 5. P. 341–348).
Киселева Л.Н., Карташев А.В., Вартанян Н.Л., Пиневич А.А., Самойлович М.П. 2018. Действие фотемустина на клетки линий глиобластом человека. Цитология. Т. 60. № 1. С. 21–29. (Kiseleva L.N., Kartashev A.V., Vartanyan N.L., Pinevich A.A., Samoilovich M.P. 2018. The effect of fotemustine on human glioblastoma cell lines. Cell Tiss. Biol. V. 12. № 2. P. 93–101).
Киселева Л.Н., Карташев А.В., Вартанян Н.Л., Пиневич А.А., Филатов М.В., Самойлович М.П. 2017. Характеристика новых клеточных линий глиобластом человека. Цитология. Т. 59. № 10. С. 669–675. (Kiseleva L.N., Kartashev A.V., Vartanyan N.L., Pinevich A.A., Filatov M.V., Samoilovich M.P. 2018. Characterization of new human glioblastoma cell lines. Cell Tiss. Biol. V. 12. № 1. P. 1–6).
Свирновский А.И. 2014. Резистентность опухолевых клеток к терапевтическим воздействиям как медико-биологическая проблема. Международные обзоры: клиническая практика и здоровье. Т. 4. С. 15–38. (Svirnovskiy A.I. 2014. Resistance of tumor cells to therapeutic effects as a medical and biological problem. Int. Rev. Clin. Pract. Health. V. 4. P. 15–38).
Angel I., Kerman O.P., Rousso-Noori L., Friedmann-Morvinsk D. 2020. Tenascin C promotes cancer cell plasticity in mesenchymal glioblastoma. Oncogene. V. 39. P. 6990–7004.
Bai A., Mao C., Jenkins R.W., Szulc Z.M., Bielawska A., Hannun Y.A. 2017. Anticancer actions of lysosomally targeted inhibitor, LCL521, of acid ceramidase. PLoS One. V. 12. P. e0177805. https://doi.org/10.1371/journal.pone.0177805
Baird C.H., Niederlechner S., Beck R., Kallweit A.R., Wisch-meyer P.E. 2013. L-Threonine induces heat shock protein expression and decreases apoptosis in heat-stressed intestinal epithelial cells. Nutrition. V. 29. P. 1404–1411.
Borst P., Evers R., Kool M., Wijnholds J. 2000. A family of drug transporters: the multidrug resistance-associated proteins. J. Natl. Cancer Inst. V. 92. P. 1295–1302.
Brosicke N. and Faissner A. 2015. Role of tenascins in the ECM of gliomas. Cell Adh. Migr. V. 9. P. 131–140.
Chen F., Qi X., Qian M., Dai Y., Sun Y. 2014. Tackling the tumor microenvironment: what challenge does it pose to anticancer therapies? Protein Cell. V. 5. P. 816–826.
Chen X., Zhang M., Gan H., Wang H., Lee J.H., Fang D., Kitange G.J., He L., Hu Z., Parney I.F., Meyer F.B., Giannini C., Sarkaria J.N., Zhang Z. 2018. A novel enhancer regulates MGMT expression and promotes temozolomide resistance in glioblastoma. Nat. Commun. V. 9. P. 2949. https://doi.org/10.1038/s41467-018-05373-4
Coppe J.P., Desprez P.Y., Krtolica A., Campisi J. 2010. The senescence-associated secretory phenotype: the dark side of tumor suppression. Ann. Rev. Pathol. V. 5. P. 99–118.
Coyle B., Kessler M., Sabnis D.H., Kerr I.D. 2015. ABCB1 in children’s brain tumors. Biochem. Soc. Trans. V. 43. P. 1018–1022.
George A.M. 2015. ABC transporters – 40 years on. Springer.
Gooijer M.C., de Vries N.A., Buckle T., Buil L.C.M., Beijnen J.H., Boogerd W., van Tellingen O. 2018. Improved brain penetration and antitumor efficacy of temozolomide by inhibition of ABCB1 and ABCG2. Neoplasia. V. 20. P. 710–720.
Hermisson M., Klumpp A., Wick W., Wischhusen J., Nagel G., Roos W., Kaina B., Weller M. 2006. O6-methylguanine DNA methyltransferase and p53 status predict temozolomide sensitivity in human malignant glioma cells. J. Ne-urochem. V. 96. P. 766–776.
Inan S., Hayran M. 2019. Cell signaling pathways related to e-pithelial mesenchymal transition in cancer metastasis. Crit. Rev. Oncog. V. 24. P. 47–54.
Kanzawa T., Bedwell J., Kondo Y., Kondo S., Germano I.M. 2003. Inhibition of DNA repair for sensitizing resistant gl-ioma cells to temozolomide. J. Neurosurg. V. 99. P. 1047–1052.
Kathawala R.J., Gupta P., Ashby C.R., Chen Z.S. 2015. The modulation of ABC transporter-mediated multidrug resistance in cancer: a review of the past decade. Drug Resist. Updat. V. 18. P. 1–17.
Kinashi Y., Ikawa T., Takahashi S. 2020. The combined effect of neutron irradiation and temozolomide on glioblastoma cell lines with different MGMT and P53 status. Appl. R-adiat. Isot. V. 163. P. 109204. https://doi.org/10.1016/j.apradiso.2020.109204
Kitange G.J., Carlson B.L., Schroeder M.A., Grogan P.T., Lam-ont J.D., Decker P.A., Wu W., James C.D., Sarkaria J.N. 2009. Induction of MGMT expression is as-sociated with temozolomide resistance in glioblastoma xenografts. Neuro Oncol. V. 11. P. 281–291.
Lamouille S., Xu J., Derynck R. 2014. Molecular mechanisms of epithelial-mesenchymal transition. Nat. Rev. Mol. Cell B-iol. V. 15. P. 178–196.
Lee S.Y. 2016. Temozolomide resistance in glioblastoma multiforme. Genes Dis. V. 3. P. 198–210.
Melincovici C.S., Bosca A.B., Susman S., Marginean M., Mihu C., Istrate M., Moldovan I.M., Roman A.L, Mihu C.M. 2018. Vascular endothelial growth factor (VEGF) – key factor in normal and pathological angiogenesis. Rom. J. Morphol. Embryol. V. 59. P. 455–467.
Mirzayans R., Murray D. 2020. Intratumor heterogeneity and therapy resistance: contributions of dormancy, apoptosis reversal (anastasis) and cell fusion to disease recurrence. Int. J. Mol. Sci. V. 15. P. 1308. https://doi.org/10.3390/ijms21041308
Nguyen H.S., Shabani S., Awad A.J., Kaushal M., Doan N. 2018. Molecular markers of therapy-resistant glioblastoma and potential strategy to combat resistance. Int. J. Mol. Sci. V. 19. P. 1765. https://doi.org/10.3390/ijms19061765
Oldrini B., Vaquero-Siguero N., Mu Q., Kroon P, Zhang Y., Galan-Ganga M., Bao Z., Wang Z., Liu H., Sa J.K., Zhao J., Kim H., Rodriguez-Perales S., Nam D.H., Verhaak R.G.W., Rabadan R., Jiang T., Wang J., Squatrito M. 2020. MGMT genomic rearrangements contribute to chemotherapy r-esistance in gliomas. Nat. Commun. V. 11. https://doi.org/10.1038/s41467-020-17717-0
Ortiz-Montero P., Londono-Vallejo A., Vernot J.P. 2017. Senescence-associated IL-6 and IL-8 cytokines induce a self- and cross-reinforced senescence/inflammatory milieu strengthening tumorigenic capabilities in the MCF-7 breast cancer cell line. Cell Commun. Signal. V. 15. P. 17. https://doi.org/10.1186/s12964-017-0172-3
Palena C., Hamilton D.H., Fernando R.I. 2012. Influence of IL-8 on the epithelial-mesenchymal transition and the tumor microenvironment. Future Oncol. V. 8. P. 713–722.
Parveen F., Bender D., Law S.H., Mishra V.K., Chen C.C., Ke L.Y. 2019. Role of ceramidases in sphingolipid meta-bolism and human diseases. Cells. V. 8. P. 1573. https://doi.org/10.3390/cells8121573
Peignan L, Garrido W., Segura R., Melo R., Rojas D., Carcamo J.G., San Martin R., Quezada C. 2011. Combined use of anticancer drugs and an inhibitor of multiple drug resistance-associated protein-1 increases sensitivity and decreases survival of glioblastoma multiforme cells in vitro. Neurochem. Res. V. 36. P. 1397–1406.
Perazzoli G., Prados J., Ortiz R., Caba O., Cabeza L., Berdasco M., Gonzalez B., Melguizo C. 2015. Temozolomide resistance in glioblastoma cell lines: implication of MGMT, MMR, P‑glycoprotein and CD133 expression. PLoS One. V. 10. P. e0140131. https://doi.org/10.1371/journal.pone.0140131
Vlachostergios P.J., Hatzidaki E., Papandreou C.P. 2013. MGMT repletion after treatment of glioblastoma cells with temozolomide and O6-benzylguanine implicates NFkB and mutant p53. Neurol. Res. V. 35. P. 879–882.
Wang D., Wang C., Wang L., Chen Y. 2019. A comprehensive review in improving delivery of small-molecule chemotherapeutic agents overcoming the blood-brain/brain t-umor barriers for glioblastoma treatment. Drug Deliv. V. 26. P. 551–565.
Waugh D.J., Wilson C. 2008. The interleukin-8 pathway in cancer. Clin. Cancer Res. V. 14. P. 6735–6741.
Weller M., van den Bent M., Preusser M., Le Rhun E., Tonn J.C., Minniti G., Bendszus M., Balana C., Chinot O., Dirven L., French P., Hegi M.E., Jakola A.S., Platten M., Roth P. et al., 2021. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat. Rev. Clin. Oncol. V. 18. P. 170–186.
Дополнительные материалы отсутствуют.