Цитология, 2022, T. 64, № 2, стр. 172-180
Морфология мышечной ткани крыс после имплантации системы доставки, состоящей из пористых ватеритов, допированных декстрансульфатом и содержащих доксорубицин
Н. Н. Сударева 1, 2, *, П. В. Попрядухин 1, О. М. Суворова 1, Г. Ю. Юкина 2, Е. Г. Сухорукова 2
1 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова
197376 Санкт-Петербург, Россия
* E-mail: nnsas@mail.ru
Поступила в редакцию 10.12.2021
После доработки 29.12.2021
Принята к публикации 09.01.2022
- EDN: AQMEDZ
- DOI: 10.31857/S0041377122020079
Аннотация
В представленной работе описано поведение системы доставки лекарственных препаратов на базе пористых СаСО3 ватеритов, допированных сульфатом декстрана и содержащих противоонкологический антибиотик доксорубицин, в мышечной ткани на сроках от 3 сут до 3 мес. На ранних сроках было выявлено токсическое влияние доксорубицина на окружающую мышечную ткань и печень. С течением времени токсическая реакция уменьшалась, место имплантации отграничивалось выраженной соединительнотканной капсулой, а имплантат подвергался биорезорбции. Практически полная биорезорбция системы доставки наблюдалась через 3 мес. после начала эксперимента.
Онкологические заболевания занимают второе место в мире по смертности. Не исключено, что при имеющейся сейчас скорости роста заболеваемости раком, они займут первое место, опередив сердечно-сосудистые заболевания (Bray et al., 2018). Одним из основных методов лечения таких заболеваний является химиотерапия, которая осуществляется путем системного введения токсичного для клеток опухоли препарата. Доксорубицин (DOX) – наиболее мощный на сегодняшний день противоопухолевый препарат, который относится к ряду антрациклиновых антибиотиков. Монотерапия DOX во многих странах является стандартной химиотерапевтической процедурой первой очереди (Basin, 2008). Механизм действия DOX на ингибирование раковых клеток широкого спектра основан в частности на его интеркаляции в ДНК (Gao et al., 2021). Высокая эффективность DOX, к сожалению, нивелируется значительной дозо-зависимой кардио- и гепатотоксичностью и быстрым выведением из организма (Minotti et al., 2004). Преодолеть эти недостатки можно, используя системы доставки (СД) DOX, пролонгирующие высвобождение лекарства в кровь, и снижающие его кардиотоксичность за счет уменьшения концентрации в крови при сохранении общей дозы препарата. Структуры СД DOX могут быть разнообразными (Matyszewska, 2014; Ruman et al., 2020; Alven et al., 2020; Jiang et al., 2020; Edis et al., 2021).
Мы остановимся на СД с использованием СаСО3 ватеритов. Ватерит – единственная пористая структура из трех полиморфных модификаций карбоната кальция. В связи с этим ватериты используют для инкапсулирования DOX (Dizaj et al., 2015; Mydin et al., 2018; Trofimov et al., 2018) и других соединений – низкомолекулярного продукта традиционной китайской медицины камптотицина (Qui et al., 2012), пептидов и белков (Sudareva et al., 2018; Binevski et al., 2019), а также генов (Dizaj et al., 2019). Биосовместимость, способность к биорезорбции, низкая токсичность и невысокая стоимость – свойства СаСО3 ватеритов, позволяющие использовать их в терапевтических целях (Mydin et al., 2018; Trofimov et al., 2018). Кроме того, структуры СаСО3 ватеритов зависят от значения рH, ионной силы и состава окружающих растворов (Parakhonskij et al., 2013; Sudareva et al., 2015), что играет большую роль в их поведении в биологических средах. Зависимость от рН определяет таргетный (противоопухолевый) потенциал СаСО3 носителей DOX, обеспечивая более интенсивное высвобождение инкапсулированного соединения в кислой среде опухолей. В литературе имеются данные об ингибирующем влиянии СаСО3 на рост раковых клеток. Рост опухоли сопровождается увеличением концентрации ионов H+ во внеклеточной среде (Neri et al., 2011). В такой кислой среде СаСО3 разрушается, что приводит к увеличению рН среды и ингибированию роста опухоли (Som et al., 2016). Таким образом, носители СаСО3 усиливают противоопухолевую активность инкапсулированного противоракового препарата.
В водной среде происходит перекристаллизация ватеритов в непористые кальциты или арагониты (Ogino et al., 1987). В результате высвобождается инкапсулированное в пористую среду соединение. С целью сохранения пористой структуры ватеритов (Sudareva et al., 2021a) и для увеличения их сорбционной активности по отношению к инкапсулируемому веществу, а также для мукоадгезии (Borodina et al., 2016), карбонатные ядра покрывают полимерами разной природы. Происхождение полимеров может быть как синтетическим (Wang et al., 2006; Huang et al., 2008; Richardson et al., 2015), так и природным (Wang et al., 2010; Zhao et al., 2012; Bai et al., 2017). В представленной нами работе в качестве такого полимера был использован биосовместимый и биорезорбируемый полианион – натриевая соль сульфата декстрана (DexS).
Важным фактором, влияющим на процесс фармакодинамики лекарственного соединения, является способ его введения в организм. В нашей предыдущей работе (Sudareva et al., 2020) были приведены примеры из литературы экспериментов in vivo с разными способами ведения CаCО3 ватеритов: пероральным, парентеральным, внутритрахеальным, трансдермальным, интраназальным, а также введением в костную ткань. В ряде случаев ватериты содержали лекарственные или модельные соединения, а также были покрыты различными полимерами. Авторы одной из работ (de Koker et al., 2007) вводили мышам подкожно компоненты СД, содержащие DexS (полиэлектролитные капсулы из 4 пар слоев DexS – полиаргинин-сформированные на ядрах С-аСО3 с последующим разрушением ядер) и продемонстрировали при помощи конфокальной микроскопии клеточное поглощение и постепенное внутриклеточное разрушение СД. В последние годы в литературе появились данные о внутриопухолевом введении СД различной структуры, содержащих DOX (Mondal et al., 2021; Gao et al., 2021). В работах показано увеличение апоптоза опухолевых клеток и уменьшение объема опухолей. Следует, однако, иметь в виду риск стимулирования процесса метастазирования.
Ранее нами (Попрядухин и др., 2020; Popryadukhin et al., 2020) был проведен ряд исследований по изучению трансформации и резорбции ватеритов в условиях in vivo. После введения в мышечную ткань крыс СаСО3 и СаСО3, покрытого DexS, была выявлена структурная трансформация и полная биорезорбция обоих типов СД в течение 2 и 4 нед. соответственно. Кроме того, ватериты, покрытые DexS и содержащие DOX, вводили интаперитониально крысам для лечения привитой гепатомы Зайделя. Было показано, что у крыс, получавших терапию DOX в указанных СД, вдвое увеличилась продолжительность жизни и вдвое уменьшился объем асцита по сравнению с контрольной группой крыс с гепатомой Зайделя (Sudareva et al., 2021b). Работ, направленных на исследование морфологических изменений мышечной ткани крыс после введения СД на базе ватеритов, содержащих DOX, нами в литературе не обнаружено. Тем не менее, введение в мышечную ткань целесообразно, как минимум по двум причинам: для возможного в будущем лечения опухоли поперечно-полосатой мышечной ткани (рабдомиосаркомы) и для создания депо противоопухолевого препарата при лечении опухолей других видов и локализаций.
Поэтому цель настоящей работы заключалась в исследовании поведения в мышечной ткани крыс системы адресной доставки лекарственных препаратов на базе пористых СаСО3 ватеритов, допированных сульфатом декстрана и содержащих доксорубицин.
МАТЕРИАЛ И МЕТОДИКА
Получение систем доставки (CaCO3 + DexS). Пористые СаСО3 ватериты получали по описанной методике (Volodkin et al., 2004) с небольшими модификациями, а именно: аликвоты 1 М растворов СаСl2⋅2Н2О и Na2CO3 быстро сливали и интенсивно перемешивали в течение 30 с. Образовавшийся осадок фильтровали через фильтр Шотта, промывали и сушили до постоянного веса при 40°С. Получившиеся СаСО3 ватериты обрабатывали раствором DexS в концентрации 1 мг/мл в течение 1 ч, затем промывали, фильтровали и сушили при 40°С до постоянного веса. Размеры полученных ватеритов находились в интервале 1–3 мкм.
Насыщение ватеритов, допированных DexS, доксорубицином. Навеску ватеритов, обработанных DexS, суспендировали в водном растворе DOX (2 мг/мл; соотношение DOX/CaCO3 составляло 0.2) и перемешивали в течение 3.5 ч, затем суспензию центрифугировали, удаляли супернатант и лиофилизировали. Загрузку DOX в ватериты (СаСО3 + DexS) определяли по разности количеств DOX в начальном растворе и в супернатанте, которую делили на вес обработанных ватеритов. Она составила 70 мкг/мг. Наличие DOX в растворах определяли спектрофотометрически. Косвенным доказательством сохранения структуры (следовательно, и функции) служит неизменность УФ-спектра растворов DOX как в супернатанте, так и в процессе высвобождения в соответствующую среду. Таким образом, были получены системы доставки (СД) лекарственного препарата, состоящие из пористых СаСО3 ватеритов, допированных декстрансульфатом и загруженных доксорубицином (далее по тексту используется сокращение СД)
Материалы. Соли, используемые для синтеза карбонатных ядер СаСl2⋅2Н2О, Na2CO3 и натриевая соль сульфата декстрана ММ в диапазоне 9–20 кДа, все – производства Sigma-Aldrich (США). DOX – препарат Синдроксоцин (Actavis, Hafnarfjordur, Исландия), содержит 17% DOX and 83% лактозы. Концентрацию DOX в растворах определяли по спектрофотометрической калибровке при длине волны λ = 480 нм.
Эксперименты на животных. Для экспериментов in vivo использовали 30 самцов белых крыс Wistar, по 5 животных на каждый срок эксперимента. Вес животных составлял 200–250 г, возраст – 3 мес. Для изучения резорбции in vivo СД стерилизовали методом автоклавирования при 110°С в течение 1 ч. Для этого каждую навеску СД по 10 мг (содержащую 0.7 мг DOX), предназначенную для эксперимента, максимально герметично упаковывали в алюминиевую фольгу. Животных оперировали под общей анестезией с помощью растворов золетила 100 (растворенного в 20 мл физиологического раствора) и рометара (20 мг/мл), которые вводили интраперитонеально по 0.1 и 0.015 мл раствора соответственно на 0.1 кг массы животного. Навески СД помещали в большую приводящую мышцу бедра (musculus adductor magnus) на одной из тазовых конечностей, в каждое животное по одному образцу. Затем раны конечностей послойно ушивали атравматическими иглами с проленовой нитью 4/0. После наложения наружных швов крыс содержали в индивидуальных клетках, животные получали свободный доступ к воде и стандартную диету. После операции выраженного негативного влияния со стороны имплантированных материалов не выявлено. Животные проявляли активность, в зоне имплантации отсутствовали признаки избыточного воспалительного процесса.
Морфологическое исследование СД в мышечной ткани. Через 3 сут, 1, 2, 4, 8 и 12 нед животных выводили из эксперимента. Образцы мышечной ткани, содержащие СД, а также печень и сердце фиксировали в 10%-ном нейтральном формалине на фосфатном буфере (рН 7.4) не менее 24 ч, обезвоживали в серии растворов этанола возрастающей концентрации и заключали в парафиновые блоки по стандартной гистологической методике. Парафиновые срезы толщиной 5 мкм, поперечные мышечным волокнам, готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония), окрашивали гематоксилином Майера и эозином (БиоВитрум, Россия). Соединительную ткань визуализировали методом Маллори (БиоВитрум, Россия). Микроскопический анализ проводили на световом микроскопе Nikon Eclipse E200 (Nikon, Япония) с использованием окуляра с увеличением 10× и объективов с увеличением 4, 10, 20 и 40×. Запись цифровых изображений выполняли с помощью фотокамеры Nikon DS-Fi3 (Nikon, Япония).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Трое суток после имплантации СД. На 3-и сут после операции визуально в мышечной ткани на месте имплантации во всех случаях определяются складчатые прослойки красного цвета, очевидно, содержащие СД, т.к. DOX имеет характерный красный цвет (рис. 1а). Наличия полостей, появление которых мы ранее фиксировали при имплантации СаСО3 ватеритов без DexS и DOX, не выявлено (Попрядухин и др., 2020). Причина – в замедлении скорости химических реакций, протекающих с СаСО3, в результате которых образуется в частности углекислый газ, формирующий полости. Замедление скорости химических реакций, в свою очередь, связано с токсическим воздействием DOX на окружающие ткани, что приводит к нарушению процессов обмена веществ в зоне имплантации. Микроскопически СД находятся в окружении многочисленных рыхло лежащих клеток, в основном сегментоядерных лейкоцитов (нейтрофилов и эозинофилов) с единичными макрофагами и лимфоцитами, а также экстравазальными эритроцитами. Соединительнотканная капсула практически отсутствует. Сосуды расширены, полнокровны, определяются стопки эритроцитов, эндотелий набухший. Между мышечными волокнами, прилежащими к месту имплантации, определяется выраженный отек. Мышечные волокна разрушаются (рис. 2а, б). Очевидно, что наблюдаемые значительные воспалительная инфильтрация и деструктивные изменения, являются проявлением токсического действия DOX.
Рис. 1.
Фотографии поперечного среза мышц с системой доставки (СД). а – Через 3 сут после имплантации, б – через 2 нед., в – через 1 мес., г – через 3 мес. Мышцы предварительно были фиксированы в нейтральном 10%-ном формалине не менее 48 ч.
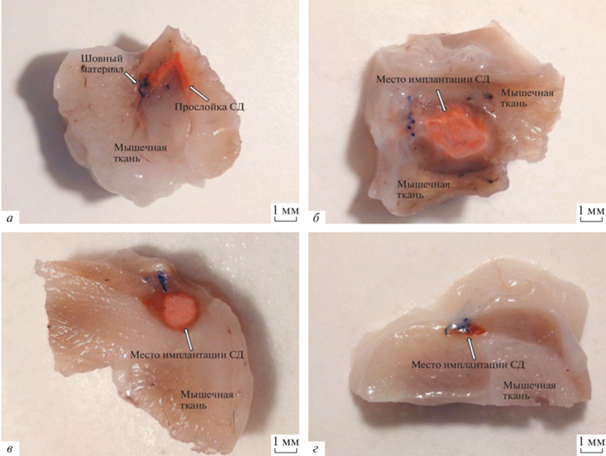
Рис. 2.
Гистологические срезы мышечной ткани крысы через 3 сут (а, б), 1 нед. (в, г) и 2 нед. (д, е) после имплантации СД. Окраска гематоксилином и эозином. Увел. об.: 4× (а, в, д), 10× (б, г) и 20× (е).
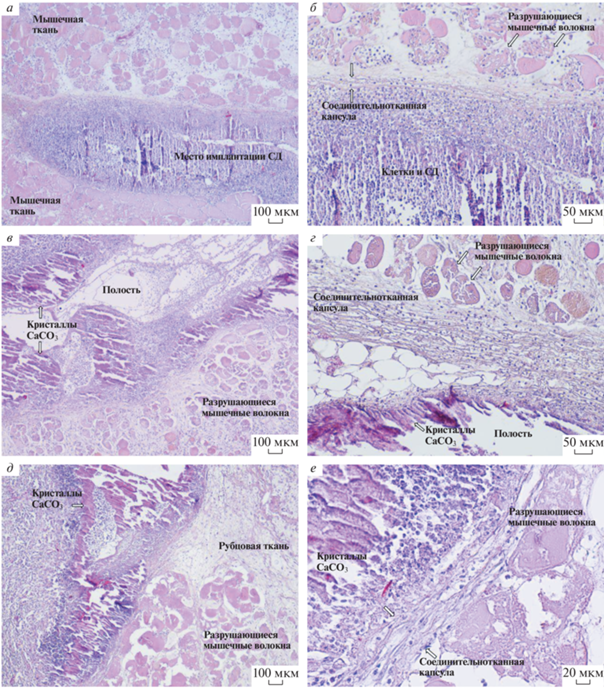
Одна неделя после имплантации СД. Через 1 нед. после операции визуально на месте имплантации в 3 случаях из 5 определяются слабовыраженные щелевидные полости неправильной формы. Микроскопически наблюдается перекристаллизация CaCO3 ватеритов в продолговатые кристаллы, вокруг которых отмечается гибель мышечных волокон с замещением их соединительной тканью (рис. 2в, г). Эта соединительная ткань инфильтрирована макрофагами и фибробластами. Полость с СД, многочисленными лейкоцитами и клеточным детритом окружена тонкой соединительнотканной капсулой. Сохранившаяся мышечная ткань имеет выраженный отек. Сосуды расширены, полнокровны, определяются стопки эритроцитов.
Две недели после имплантации СД. Через 2 нед. после имплантации в мышечной ткани во всех случаях определяются округлые структуры бледно-красного цвета и имеющие максимальный размер за весь период наблюдения (рис. 1б). Микроскопически полость, занимаемая СД, лейкоцитами и клеточным детритом, окружена выраженной соединительнотканной капсулой. На месте погибших мышечных волокон определяется соединительнотканный рубец, инфильтрированный многочисленными лимфоцитами. Сосуды расширены, полнокровны, определяются стопки эритроцитов. Отек в мышечной ткани вокруг рубца сохраняется (рис. 2д, е).
Четыре недели после имплантации СД. Через 4 нед. размер структур на месте имплантации уменьшается по сравнению с предыдущим сроком, они также приобретают более округлую форму, что свидетельствует о протекании процессов биорезорбции и компактизации (рис. 1в). Микроскопически капсула вокруг полости с кристаллами CaCO3 и клеточным детритом (в виде гомогенной массы) ярко выражена, полностью сформирована и представлена толстым слоем зрелых коллагеновых волокон. Эта картина, по-видимому, является реакцией организма на токсическое повреждение тканей, непосредственно прилегающих к месту имплантации СД. Капсула полностью инфильтрирована многочисленными лимфоцитами и макрофагами с оранжево-красной цитоплазмой (очевидно, окрашенной поглощенным доксорубицином). Гигантские многоядерные клетки инородных тел (ГМКИТ) встречаются в небольшом числе. Сосуды капсулы расширены и полнокровны. Количество кристаллов меньше, чем на предыдущем сроке. Отек в мышечной ткани вокруг рубца сохраняется (рис. 3а, б).
Рис. 3.
Гистологические срезы мышечной ткани через 4 нед. (а, б), 12 нед. (в, г) и печени крысы через 1 нед. (д, е) после имплантации СД. Окраска гематоксилином и эозином. Увел.об.: 4× (а), 10× (б, в, д), 20× (г) и 40× (е).
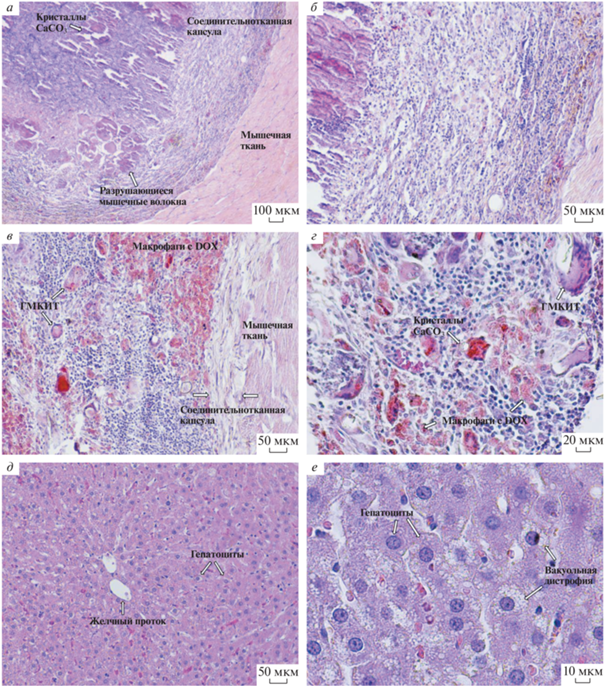
Двенадцать недель после имплантации СД. Через 12 нед. эксперимента на месте имплантации СД во всех случаях визуально выявляется наличие следового количества структур красного цвета, что говорит о практически полной биорезорбции СД и о наличии остаточного количества DOX (рис. 1г). На этом сроке морфологическая картина схожа с таковой на предыдущем сроке. Соединительнотканная капсула вокруг полости полностью отграничивает содержимое полости от окружающей мышечной ткани. Выявляются единичные кристаллы CaCO3. В капсуле выявляется умеренное число лимфоцитов и макрофагов с оранжево-красной цитоплазмой и умеренное число ГМКИТ. Сосуды в пределах нормы. Мышечная ткань, прилежащая к капсуле, имеет умеренный отек (рис. 3в, г).
Изменения в печени и миокарде после имплантации СД. На указанных сроках эксперимента также исследовали печень и миокард. Максимальные изменения в печени определяются на сроке 7 сут в виде выраженной вакуольной дистрофии гепатоцитов (рис. 3д, е), что, очевидно, связано с токсическим действием DOX. Морфологических изменений в миокарде на всех сроках эксперимента не выявлено.
Таким образом, было показано, что процессы, проходящие в мышечной ткани крыс после имплантации СД, содержащих DOX, значительно отличаются от процессов, развитие которых мы наблюдали ранее, при имплантации компонентов СД без DOX (Попрядухин и др., 2020; Popryadukhin et al., 2020). В настоящем исследовании мы наблюдали более выраженную воспалительную реакцию в зоне имплантации СД, токсическое повреждение и некроз прилегающих тканей, прежде всего мышечных волокон. Кроме того, констатировали более выраженный процесс образования соединительнотканной капсулы и значительное замедление процесса биорезорбции СД, который продлился 3 мес. При этом скорость перекристаллизации сферических пористых CaCO3 ватеритов в продолговатые непористые кристаллы, предположительно арагонита, значимо не отличалась от таковой, наблюдаемой нами ранее (Popryadukhin et al., 2020). Это обусловлено наличием в зоне протекания процесса необходимых условий: водной среды и приемлемой температуры.
Помимо местного токсического воздействия было выявлено и системное воздействие на клетки печени, что четко свидетельствует о выходе DOX за пределы зоны первоначальной имплантации. Следовательно, предложенный способ введения противоопухолевого препарата имеет ряд преимуществ. Он дает возможность создания локально высокой концентрации препарата в течение длительного времени, что приводит к значительному повреждающему воздействию. Такое воздействие является положительным при введении СД внутрь опухоли или инъецировании вокруг нее. Хотя оно полностью не исключает токсического влияния на организм, как местного, так и системного характера. Однако этот эффект может быть с успехом использован в случае применения СД в качестве депо лекарственного препарата. В частности, при лечении опухолей, для которых необходимо поддержание в течение длительного времени терапевтической концентрации препарата в крови, но при этом невозможно внутриопухолевое введение.
Таким образом, показана перспективность системы доставки лекарственного препарата, состоящей из пористых СаСО3 ватеритов, допированных декстрансульфатом и насыщенных доксорубицином, а также целесообразность ее дальнейшего исследования.
Список литературы
Попрядухин П.В., Сударева Н.Н., Суворова О.М., Юкина Г.Ю., Сухорукова Е.Г., Сапрыкина Н.Н. 2020. Морфология компонентов систем адресной доставки лекарственных препаратов (пористых ватеритов СаСО3) в мышечной ткани крыс. Цитология. Т. 62. № 10. С. 1. (Popryadukhin P.V., Sudareva N.N., Suvorova O.M., Yukina G.Yu., Sukhorukova E.G., Saprykina N.N. 2020. Morphology of porous CaCO3 vaterites as components of target drug delivery systems in rat muscle tissue. Cell Tiss. Biol. (Tsitologiya). V. 15. P. 208.) https://doi.org/10.31857/S0041377120100053 https://doi.org/10.1134/S1990519X21020061
Alven S., Nqoro X., Buyana B., Aderibigbe B. 2020. Polymer-drug conjugate, a potential therapeutic to combat breast and lung cancer. Pharmaceutics. V. 12. P. 406. https://doi.org/10.3390/pharmaceutics12050406
Bai J., Xu J., Zhao J., Zhang R. 2017. Hyaluronan and calcium carbonate hybrid nanoparticles for colorectal cancer chemotherapy. Mater. Res. Express. V. 4. P. 095401. https://doi.org/10.1088/2053-1591/aa822d
Basin I.S. 2008. Hepatocellular cancer – modern status. Problems. Practical Oncology. V. 9. P. 216.
Binevski P.V., Balabushevich N.G., Uvarova V.I., Vikulina A.S., Volodkin D. 2019. Bio-friendly encapsulation of superoxide dismutase into vaterite CaCO3 crystals. Enzyme activity, release mechanism, and perspectives for ophthalmology. Coll. and Surf. B: Biointerfaces. V. 181. P. 437. https://doi.org/10.1016/j.colsurfb.2019.05.077
Borodina T.N., Trushina D.B., Marchenko I.V., Bukreeva T.V. 2016. Calcium carbonate-based mucoadhesive microcontainers for intranasal delivery of drugs bypassing the blood–brain barrier. BioNanoScience. V. 6. P. 261. https://doi.org/10.1007/s12668-016-0212-2
Bray F., Ferlay J., Soerjomataram I., Siegel P.,Torre L.A., Jemal A. 2018. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. V. 68. P. 394. https://doi.org/10.3322/caac.21492
De Koker S., De Geest B.G., Cuvelier C., Ferdinande L., Deckers W., Hennink W.E., De Smedt S., Mertens N. 2007. In vivo cellular uptake, degradation, and biocompatibility of polyelectrolyte microcapsules. Adv. Funct. Mater. V. 17. P. 3754. https://doi.org/10.1002/adfm.200700416
Dizaj M., Barzegar-Jalali M., Zarrintan M., Adibkia K., Lotfipour F. 2015. Calcium carbonate nanoparticles as cancer drug delivery system. Expert Opin. Drug Del. V. 12. P. 1649. https://doi.org/10.1517/17425247.2015.1049530
Dizaj M., Sharifi S., Ahmadian E., Eftekhari A., Adibkia K., Lotfipour F. 2019.An update on calcium carbonate nanoparticles as cancer drug/gene delivery system. Expert Opin. Drug Deliv. V. 16. P. 331. https://doi.org/10.1080/17425247.2019.15874
Edis Z., Wang J., Waqas M.K., Ijaz M., Ijaz M. 2021.Nanocarriers-mediated drug delivery systems for anticancer agents: an overwiev and perspectives. Int. J. Nanomed. V. 16. P. 1313. https://doi.org/10.2147/IJN.S289443
Gao B., Luo J., Liu Y., Su S., Fu S., Yang X., Li B. 2021.Intratumoral administration of thermosensitive hydrogel co-loaded with norcantharidin nanoparticles and doxorubicin for the treatment of hepatocellular carcinoma. Int. J. Nanomed. V. 16. P. 4073. https://doi.org/10.2147/IJN.S308057
Huang S., Naka K., Chujo Y. 2008. Effect of molecular weights of poly(acrylic acid) on crystallization of calcium carbonate by the delayed addition method. Polymer J. V. 40. P. 154. https://doi.org/10.1295/polymj.PJ2007162
Jiang Y., Zhou Y., Zhang C., Fang T. 2020. Co-delivery of paclitaxel and doxorubicin by ph-responsive prodrug micelles for cancer therapy. Int. J. Nanomed. V. 15. P. 3319. https://doi.org/10.2147/IJN.S249144
Matyszewska D. 2014. Drug delivery systems in the transport of doxorubicin. Inst. Civil Eng. Surf. Innovat. V. 2. P. 201. https://doi.org/10.1680/si.13.00040
Minotti G., Menna P., Salvatorelli E., Cairo G., Gianni L. 2004. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacol. Rev. V. 56. P. 185. https://doi.org/10.1124/pr.56.2.6
Mondal L., Mukherjee B., Das K., Bhattacharya S., Dutta D., Chakraborty S., Pal M., Gaonkar R.H., Debnath M.Ch. 2021. CD-340 functionalized doxorubicin-loaded nanoparticle induces apoptosis and reduces tumor volume along with drug-related cardiotoxicity in mice. Int. J. Nanomed. V. 14. P. 1001. https://doi.org/10.2147/IJN.S305317
Mydin R., Zahidi I., Ishak N., Ghazali N., Moshawih S., Siddiquee S. 2018. Potential of calcium carbonate nanoparticles for therapeutic applications. Malayas. J. Med. Health Sci. V. 14 (SUPP1). P. 201.
Neri D., Supuran C. 2011. Interfering with pH regulation in tumors as therapeutic strategy. Nat. Rev. Drug Discov. V. 10. P. 767. https://doi.org/10.1038/nrd3554
Ogino T., Suzuki T., Sawada K. 1987. The formation and transformation mechanism of calcium carbonate in water. Geochim. Cosmochim. Acta. V.51. P. 2757. https://doi.org/10.1016/0016-7037(87)90155-4
Parakhonskiy B., Tessarolo F., Haase A., Antolini R. 2013. Dependence of sub-micron vaterite container release properties on pH and ionic strength of the surrounding solution. Adv. Sci. Technol. V. 86. P. 81. https://doi.org/10.4028/www.scientific.net/AST.86.81
Popryadukhin P.V., Sudareva N.N., Suvorova O.M., Yuki-na G.Yu., Sukhorukova E.G., Saprykina N.N., Galibin O.V., Vilesov A.D. 2020. Morphology of target drug delivery systems (CaCO3 vaterites covered with dextran sulfate) in rat muscular tissue. Cell. Ther. Transpl. V. 9. P. 78. https://doi.org/10.18620/ctt-1866-8836-2020-9-4-78-84
Qiu N., Yin H., Ji B., Klauke N., Glidle A., Zhang Y., Song H., Cai L., Ma L., Wang G., Chen L., Wang W. 2012. Calcium carbonate microspheres as carriers for the anticancer drug camptothecin. Mater. Sci. Eng. C. V. 32. P. 2634. https://doi.org/10.1016/j.msec.2012.08.026
Richardson J., Maina J., Ejima H., Hu M., Guo J.,Cho M., Gunawan S.T., Lybaert L., Hagemeyer C.E., De Geest B.G., Caruso F. 2015.Versatile loading of diverse cargo into functional polymer capsules. Adv. Sci. V. 2. P. 1400007. https://doi.org/10.1002/advs.201400007
Ruman U., Fakurazi S., Masarudin M., Hussein M. 2020. Nanocarrier-based therapeutics and theranostics drug delivery systems for next generation of liver cancer nanodrug modalities. Int. J. Nanomed.V. 15. P. 1437. https://doi.org/10.2147/IJN.S236927
Som A., Raliya R., Tian L., Akers W., Ippolito J., Singamaneni S., Biswas P., Achilefu S. 2016. Monodispersed calcium carbonate nanoparticles modulate local pH and inhibit tumor growth in vivo. Nanoscale. V. 8. P. 12639. https://doi.org/10.1039/C5NR06162H
Sudareva N.N., Popryadukhin P.V., Saprykina N.N., Suvorova O.M., Yukina G.Yu., Galibin O.V., Vilesov A.D. 2020. CaCO3 vaterites as components of target drug delivery systems Cell. Ther. Transpl. V. 9. P. 13. https://doi.org/10.18620/ctt-1866-8836-2020-9-2-13-19
Sudareva N.N., Saprykina N.N., Popova E.V., Vilesov A.D. 2015. Porous calcium carbonate cores as templates for preparation of peroral proteins delivery systems. The influence of composition of simulated gastrointestinal fluids on the structure and morphology of carbonate cores. In: Calcium carbonate: occurrence, characterization and applications. NY: Nova Science Publishers. P. 73.
Sudareva N., Suvorova O., Saprykina N., Smirnova N., Bel’tiukov P., Petunov S., Radilov A., Vilesov A. 2018. Two-level delivery systems based on CaCO3 cores for oral administration of therapeutic peptides. J. Microencapsul. V. 35. P. 619. https://doi.org/10.1080/02652048.2018.155924
Sudareva N., Suvorova O., Saprykina N., Vlasova H., Vilesov A. 2021a. Doxorubicin delivery systems based on doped CaCO3 cores and polyanion drug conjugates. J. Microencaps. V. 38. P. 164. https://doi.org/10.1080/02652048.2021.1872724
Sudareva N.N., Suvorova O.V., Suslov D.N., Galibin O.V., Vilesov A.D. 2021b. Dextran sulfate coated CaCO3 vaterites as the systems for regional administration of doxorubicin. Cell. Ther.T ranspl. V. 10. P. 71. https://doi.org/1018620/ctt-1866-8836-2021-10-3-4-71-77
Trofimov A., Ivanova A., Zyuzin M., Timin A. 2018. Porous inorganic carriers based on silica, calcium carbonate and calcium phosphate for controlled/modulated drug delivery: Fresh outlook and future perspectives. Pharmaceutics. V. 10. P. 167. https://doi.org/10.3390/pharmaceutics10040167
Volodkin D.V., Petrov A.I., Prevot M., Sukhorukov G.B. 2004. Matrix polyelectrolyte microcapsules: New system for macromolecule encapsulation. Langmuir. V. 20. P. 3398.
Wang C., He C., Tong Z., Liu X., Ren B., Zeng F. 2006. Combination of adsorption by porous CaCO3 microparticles and encapsulation by polyelectrolyte multilayer films for sustained drug delivery. Int. J. Pharm. V. 308. P.160. https://doi.org/10.1016/j.ijpharm.2005.11.004
Wang J., Chen J., Zong J., Zhao D., Li F., Zhuo R., Cheng S. 2010. Calcium carbonate/carboxymethyl chitosan hybrid microspheres and nanospheres for drug delivery. J. Phys. Chem. C. V. 114. P. 18940. https://doi.org/10.1021/jp105906p
Zhao D., Zhuo R., Cheng S. 2012. Alginate modified nanostructured calcium carbonate with enhanced delivery efficiency for gene and drug delivery. Mol. BioSystems. V. 8. P. 753. https://doi.org/10.1039/C1MB05337J
Дополнительные материалы отсутствуют.


