Цитология, 2022, T. 64, № 2, стр. 159-171
Морфофункциональные изменения нервной ткани мозга трансгенных мышей линии 5XFAD
Н. Л. Туманова 1, Д. С. Васильев 1, *, Н. М. Дубровская 1, Н. Н. Наливаева 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
* E-mail: dvasilyev@bk.ru
Поступила в редакцию 15.12.2021
После доработки 02.01.2022
Принята к публикации 13.01.2022
- EDN: WAYMBQ
- DOI: 10.31857/S0041377122020080
Аннотация
В настоящем исследовании у мышей трансгенной линии 5хFAD, моделирующих патогенез болезни Альцгеймера, проводили сравнительный анализ структурных и ультраструктурных изменений в нервной ткани обонятельных луковиц, гиппокампа и энторинальной коры, а также исследовали распределение основной амилоид-деградирующей нейропептидазы неприлизина (НЕП) относительно мышей дикого типа. Исследование структуры нервной ткани показало, что у трансгенных животных, характеризующихся усиленной продукцией амилоидного пептида Аβ, наблюдается нарастающая гибель нейронов головного мозга, вследствие чего прерываются связи между нейронами и нарушается нейронная сеть. Кроме того, проведенное нами электронномикроскопическое исследование обнаружило у мышей линии 5хFAD снижение плотности расположения синаптических контактов и дендритных шипиков, локальные очаги поражения нервной ткани, появление аутофаголизосом в нейропиле этих структур. Были выявлены признаки, указывающие на усиление нейродегенеративных процессов по сравнению с мышами дикого типа. У мышей линии 5хFAD имеет место изменение распределения амилоид-деградирующей пептидазы НЕП в энторинальной коре и в гиппокампе, а также снижение интенсивности ее окрашивания в энторинальной коре. У трансгенных мышей в возрасте 6 мес. также наблюдалось нарушение памяти при анализе в тесте распознавания новых объектов относительно мышей дикого типа.
Болезнь Альцгеймера (БА) представляет собой многофакторное нейродегенеративное заболевание, характеризующееся когнитивной дисфункцией, а также патологическим накоплением в ткани мозга амилоидного пептида (Aβ) и гиперфосфорилированного белка тау-1 (для обзора см. Lane et al., 2018). Трансгенные модели БА на животных, в частности на мышах, экспрессируют гены человека, которые содержат мутации, характерные для ранних, “семейных” форм БА, и повторяют ключевые особенности патологии Aβ и тау. Они позволяют получать ценную информацию о молекулярных и поведенческих нарушениях, характерных для пациентов с БА. Трансгенные мыши линии 5xFAD экспрессируют два гена человека: АРР (ген белка-предшественника амилоидного пептида) с тремя типами мутаций (шведской (K670N, M671L), флоридской (I716V) и лондонской (V717I)), а также ген пресенилина 1 с мутациями (M146L и L286V), характерными для семейных форм БА (FAD). Эти мутации приводят к накоплению в ткани мозга мышей амилоидных агрегатов, гибели нейронов и когнитивному дефициту (Oakley et al., 2006; Ohno et al., 2007). Растворимый Aβ42 обнаруживается в ткани мозга 5xFAD мышей уже к 1.5 мес., и его уровни резко повышаются с возрастом (Ohno et al., 2007). Уровни Aβ40 также увеличиваются с возрастом, но повышаются медленнее и значительно ниже, чем Aβ42, при этом соотношение Aβ42/Aβ40 достигает порядка 3.6 у самцов в возрасте 6 мес. и коррелирует с уровнем экспрессии трансгена АРР (Oakley et al., 2006). Также у этих мышей увеличена экспрессия BACE1, ключевого фермента амилоидогенного пути превращения АРР (Devi et al., 2010; Maarouf et al., 2013).
Из структурных нарушений ткани мозга трансгенных животных, помимо амилоидоза, наиболее часто отмечают дегенерацию и гибель нейронов, синаптопатии и нейровоспалительные процессы. По литературным данным, у 5xFAD мышей примерно на третьем месяце жизни одновременно с образованием бляшек начинает развиваться астроглиоз и микроглиоз (Oakley et al., 2006). В возрасте 6 мес. показана активация микроглии в коре и гиппокампе, которую авторы связывают с нарушением нейрональных функций и пластичности мозга (Mirzaei et al., 2016). Дегенерация синапсов, оцениваемая по уровням пресинаптического маркера синаптофизина, начинается во всем мозге к 4-мес. возрасту, а уровни другого пресинаптического маркера синтаксина и постсинаптического маркера PSD-95 снижаются к 9 мес. (Shao et al., 2011). Имеется мало информации о пространственно-временном паттерне или деталях потери синапсов, хотя есть данные, что в гиппокампе 12-мес. 5xFAD мышей наблюдается почти 50%-я потеря аксо-шипиковых синапсов в stratum lacunosum-moleculare, в то время как количество синапсов в stratum radiatum не отличается от мышей дикого типа (Neuman et al., 2015). При этом данные об изменениях на ультраструктурном уровне на этой модели единичны (Park et al., 2017) и в основном подтверждают данные светооптических исследований, не касаясь специфических патологических процессов в самих клетках, что требует дальнейшего изучения.
Известно, что гибель нейронов у 5xFAD мышей наблюдается во многих областях мозга. В областях с наиболее тяжелым амилоидозом – субикулуме и кортикальном слое V – гибель нейронов начинается примерно в 6-мес. возрасте и коррелирует с накоплением Aβ42 (Oakley et al., 2006; Eimer, Vassar, 2013). В этом же возрасте наблюдается уменьшение количества холинергических нейронов в базальной части переднего мозга (Devi, Ohno, 2010).
У 5xFAD мышей также наблюдаются существенные когнитивные нарушения. С помощью теста контекстуальной обусловленности страхом, было установлено нарушение памяти у 5xFAD мышей в возрасте 4–5 мес. При этом наблюдалось поражение гиппокампа, сопровождавшееся нарушением кратковременной и долговременной памяти (Kimura, Ohno, 2009; O’Leary et al., 2020). Тестирование трансгенных мышей в водном лабиринте Морриса показало, что в возрасте 6 мес. у них наблюдается увеличение времени поиска платформы, однако уровень фосфорилирования белка тау в гиппокампе повышался намного раньше, чем регистрировались нарушения памяти (Kanno et al., 2014). Это свидетельствует о том, что изменения на молекулярном уровне начинаются раньше формирования функциональных нарушений. Поскольку патогенез БА существенным образом связан с ранним нарушением обоняния (Murphy, 2019), исследования изменений обонятельной функции в процессе взросления трансгенных мышей и развития у них патологии БА представляет большой интерес. Однако число таких исследований довольно невелико, и они весьма противоречивы. Так, имеются данные, что нарушение обоняния имеет место только у самок трансгенных 5xFAD мышей и отсутствует у самцов (Roddick et al., 2016). Также у 5xFAD мышей не наблюдалось нарушения памяти на запахи (O’Leary et al., 2020). Тем не менее, имеются данные, что в процессе развития патологии у этих мышей происходит дегенерация терминальных окончаний обонятельного нерва, вызванная не столько наличием внеклеточных депозитов Aβ, сколько накоплением в них АРР (Cai et al., 2012). Также имеются данные о нарушении у 5xFAD мышей экспрессии транскрипта обонятельного рецептора Olfr110/111 в коре и гиппокампе (Gaudel et al., 2018). Это свидетельствует о необходимости сопоставления патологических изменений в периферической и центральной частях обонятельного анализатора.
Накопление Aβ в ткани мозга тесно связано с дефицитом содержания и активности в нервной ткани амилоид-деградирующего фермента неприлизина (НЕП) (для обзора см. Nalivaeva, Turner, 2019; Nalivaeva et al., 2020), который также является основным ферментом, регулирующим действие нейромедиатора соматостатина в обонятельной луковице (Nocera et al., 2019). Ранее нами было показано, что пренатальная гипоксия у крыс приводит к существенным изменениям структурной организации и архитектоники энторинальной коры, теменной коры и гиппокампа, в которых наблюдается снижение экспрессии НЕП как на уровне мРНК, так и белка, что коррелирует с нарушением их обоняния и когнитивных функций (Туманова и др., 2021; Vasilev et al., 2021). У трансгенных 5xFAD мышей также наблюдается снижение содержание НЕП в ткани мозга, коррелирующее с уровнем накопления Aβ (Hüttenrauch et al., 2015), однако характер экспрессии НЕП в структурах конечного мозга этих мышей не изучался.
Цель настоящего исследования заключалась в проведение сравнительного анализа структурных и ультраструктурных изменений в обонятельных луковицах, гиппокампе и энторинальной коре, а также содержания и распределения в них НЕП, как у трансгенных мышей линии 5xFAD, так и у мышей дикого типа. Выбор для изучения структур конечного мозга был обусловлен их вовлеченностью в механизмы памяти (кора, гиппокамп) и работу обонятельного анализатора (обонятельные луковицы, энторинальная кора, гиппокамп) у грызунов.
МАТЕРИАЛ И МЕТОДИКА
Животные. В работе использовали самцов мышей двух линий С57Bl (С57BL/6 – дикий тип) и 5xFAD (C57BL6 – гемизиготы (Tg(APPSwFlLon, PSEN1*M146L*L286V) 6799Vas/J) – модель патологии альцгеймеровского типа) в возрасте 6 мес. из питомника “Черноголовка”. Животных содержали в стандартных условиях вивария ИЭФБ РАН при световом режиме (12 ч день/12 ч ночь) по 4–5 особей в клетке, со свободным доступом к воде и пище. Эксперименты осуществляли согласно протоколу использования лабораторных животных ИЭФБ им. И.М. Сеченова РАН, основанному на директиве Европейского Сообщества по гуманному обращению с экспериментальными животными (European Communities Council Directive #86 ⁄ 609 for the Care of Laboratory Animals).
Исследование памяти в тесте “Распознавание новых объектов”. В тестировании участвовали 6 мышей дикого типа и 10 мышей линии 5хFAD в возрасте 6 мес. В начале тестирования мышей в течение 5 мин адаптировали к условиям эксперимента, для чего их помещали на специальную площадку 500 × 500 мм2, ограниченную непрозрачными стенками 200 мм высотой. Через 2 ч после адаптации, на экспериментальной площадке проводили тренировочное предъявление животному двух предметов в течение 5 мин. При последующем тестировании один объект заменяли новым предметом, а другой объект оставляли неизменным, но при этом меняли место его расположения. Через 1 и 24 ч после тренировки оценивали долговременную память, для чего животному предъявляли пару объектов, состоящую из известного и нового предметов. Регистрировали время, проведенное в непосредственном тактильном или обонятельном контакте животного с каждым объектом, и вычисляли индекс дискриминации, как отношение времени обнюхивания неизвестного (нового) предмета к времени обнюхивания известного:
индекс дискриминации = tнового/tизвестного.
Все предметы были сделаны из толстого стекла, и после каждого предъявления их и экспериментальную площадку протирали 50%-ным раствором этилового спирта.
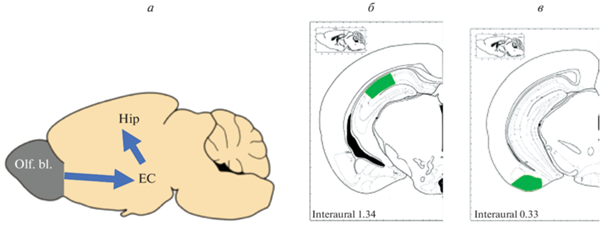
Световая микроскопия. Светооптическое исследование ткани мозга проводили на мышах дикого типа (n = 8) и линии 5хFAD (n = 8) в возрасте 6 мес. Ткань мозга фиксировали методом транскардиальной перфузии 10%-ным нейтральным формалином на фосфатном буфере (PBS, 4°C, pH 7.4). Замороженные фронтальные срезы мозга толщиной 20 мкм изготавливали на криостате Leica CM 1510S (Leica Microsystems, Германия). Для исследования отбирали срезы обонятельной луковицы (4.0–2.5 мм от bregma), гиппокампа и энторинальной коры мозга (2.0–3.3 мм от bregma в каудальном направлении) (Paxinos, Franklin, 2001) (рис. 1а–в) и проводили комбинированное окрашивание по Нисслю и красителем Конго Ред (4%-й водный раствор). С использованием микроскопа ImagerA (Zeiss, Германия) оценивали состояние нервной ткани мозга. Количественное сравнение клеток поля СА1 гиппокампа и энторинальной коры проводили на серии срезов толщиной 20 мкм; первый срез серии выбирался случайно, расстояние между последующими срезами в серии составляло 40 мкм. При проведении анализа использовали программу Video Test Master-Morphology (Video Test, Санкт-Петербург, Россия). По срезам (6 на каждое животное), содержащим дорсальный гиппокамп или энторинальную кору вычисляли средние величины общего количества клеток и количества нейронов (на участке ткани площадью 10 000 мкм2) для каждого животного дикого типа (WT, n = 8) и линии 5хFAD (n = 8).
Рис. 1.
Области интереса в обонятельных луковицах (Olf. bl.), энторинальной коре (ЕС) и гиппокампе (Hip) мозга мышей. Синими стрелками (а) показан восходящий путь от обонятельных луковиц к энторинальной коре и гиппокампу; светло-зеленым цветом обозначены области гиппокампа (б) и энторинальной коры (в), в которых исследовали экспрессию НЕП и амилоидоз.
Электронная микроскопия. Для анализа мозг мышей (С57Bl n = 5, 5хFAD n = 4) фиксировали методом транскардиальной перфузии смесью 1%-го глутарового альдегида и 1%-го формальдегида на 0.1 M PBS, рН 7.4. Блоки, содержащие обонятельную луковицу, энторинальную кору или гиппокамп дополнительно фиксировали 1%-м OsO4, контрастировали уранилацетатом, обезвоживали и заливали в аралдит по стандартному протоколу (Туманова и др., 2018). На ультратоме Leica (Leica Microsystems, Германия) изготавливали срезы исследуемых структур толщиной 500Å, которые затем исследовали на электронном микроскопе FEI Tecnai V2 (FEI, США).
Иммуногистохимия. Для исследования отбирали срезы обонятельной луковицы (4.0–2.5 мм от bregma, рис. 1а), энторинальной области коры и поля СА1 дорсального гиппокампа (на уровне 2.0—3.3 и 4.5–5.5 мм от bregma соответственно, рис 1б, в) (Paxinos, Franklin, 2001) животных дикого типа (n = 8) и линии 5хFAD (n = 8). Мозг фиксировали раствором 10%-ного нейтрального формалина на 0.1 М фосфатном буфере (рН 7.4), затем изготавливали срезы на криостате Leica CM 1510S (Leica Microsystems, Германия). Для снижения аутофлуоресценции срезы инкубировали в 0.1 М растворе глицина (SIGMA, Германия) на 0.1 М фосфатном буфере (рН 7.4) под визуальным контролем до максимального ослабления свечения в диапазоне длин волн 490–550 нм. Блокировку неспецифического связывания антител осуществляли путем часовой инкубации в 2%-м растворе бычьего сывороточного альбумина (Sigma, Германия) на 0.1 М фосфатном буфере (рН 7.4), в который добавляли 0.01% Triton X-100 для пермеабилизации клеточных мембран. Для иммуногистохимического исследования распределения НЕП использовали поликлональные антитела кролика Anti-CD10 (EPR5904, ab126593; Abcam, Великобритания, разведение 1 : 100). Визуализацию осуществляли с помощью FITC-конъюгированных вторичных антител против IgG кролика (ab96902; Abcam, Великобритания, разведение 1 : 500). В качестве негативного контроля неспецифического связывания ставили иммунохимическую реакцию в отсутствии первичных антител для исследуемых областей мозга у каждого животного. В качестве позитивного контроля использовали ткань печени, характеризующейся высоким содержанием НЕП, взятой от мыши дикого типа. Иммунофлюоресцентное исследование выполняли на микроскопе Leica DMR, оборудованном конфокальным сканером Leica TCS SL (Leica Microsystems, Германия). Возбуждение флюорохрома FITC осуществляли светом He/Ar лазера при длине волны 488 нм. Свечение FITC регистрировали в диапазоне длин волн 496–537 нм. Яркость свечения FITC на поле нервной ткани площадью 10 000 мкм2 оценивали при помощи программы Video Test Master-Morphology (Video Test, Санкт-Петербург, Россия). Для каждого животного вычисляли среднее значение по 6 срезам. Нормировку полученных значений для каждого животного осуществляли путем вычета среднего значения для негативного контроля (иммунохимическая реакция в отсутствии первичных антител) и сравнивали средние нормированные значения уровня сигнала FITC для мышей дикого типа и линии 5хFAD.
Статистическая обработка данных. Статистическую обработку полученных данных проводили с помощью пакета программ “SigmaStat 3.0”, используя непарный двусторонний t-критерий (unpaired two-tailed t-test), и непараметрический критерий Манна−Уитни (Mann−Whitney U-test). Множественное сравнение проводили методом однофакторного дисперсионного анализа (one-way ANOVA with Dunn’s post-hoc). Результаты представлены как среднее ± SEM. Значимыми считались различия при p < 0.05.
РЕЗУЛЬТАТЫ
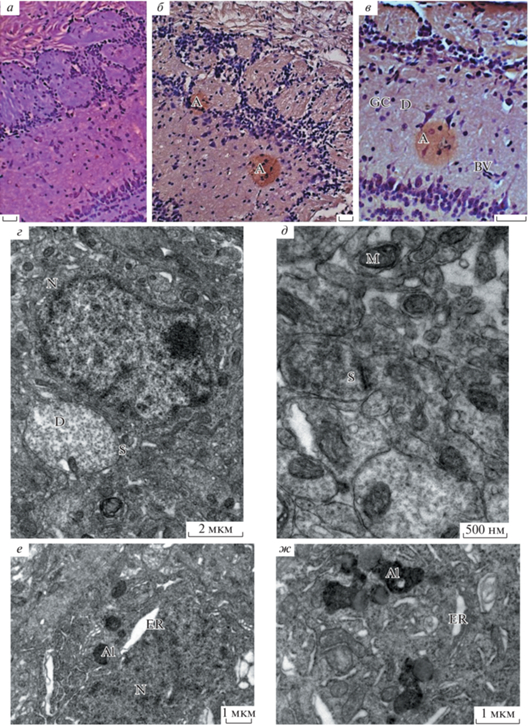
Морфологическое исследование структур мозга мышей дикого типа и линии 5хFAD. Обонятельные луковицы. При комбинированном окрашивании срезов мозга методом Ниссля и Конго Ред в обонятельных луковицах трансгенных мышей по сравнению с мышами дикого типа были выявлены существенные различия в строении нервной ткани. На рис. 2б, в показаны сферические образования (амилоидные бляшки) размером от 0.1 до 1.3 мм, которые наблюдались либо в слое митральных клеток, либо в волокнистых слоях обонятельных луковиц у трансгенных мышей. У мышей дикого типа (рис. 2а) таких сферических образований не отмечено. Амилоидные образования были окружены большим количеством глиальных клеток. На рис. 2в внутри амилоидных образований заметны признаки деструкции клеточных тел и их отростков. На периферии этих образований наблюдались кровеносные сосуды. На электроннограммах обонятельной луковицы у трансгенных мышей по сравнению с мышами дикого типа заметны локальные очаги поражения нервной ткани с признаками клеточной гибели: деструкция ядерной и цитоплазматической мембраны, разрушение митохондрий и других клеточных органелл и появление большого количества глиальных клеток. На рис. 2е, ж заметны расширения ЭПР у трансгенных мышей. В нейронах и нейропиле обонятельных луковиц этих мышей видно большое количество аутофаголизосом различных форм и размеров. Синаптических контактов в нейропиле обонятельных луковиц трансгенных мышей наблюдалось намного меньше, чем у мышей дикого типа (рис. 2г, д).
Рис. 2.
Обонятельные луковицы у мышей дикого типа (а, г, д) и трансгенных мышей линии 5хFAD (б, в, е, ж) в возрасте 6 мес. а–в – Окраска Конго красным, масштабные отрезки – 30 мкм; г–ж – электроннограммы участков нейропиля с нейронами обонятельной луковицы. Обозначения: A – амилоидные образования (бляшки), D – дендриты, BV – кровеносные сосуды, GC – глиальные клетки, N – нейроны, S – синаптические контакты, M – митохондрии, ER – ЭПР, Al – аутофаголизосомы.
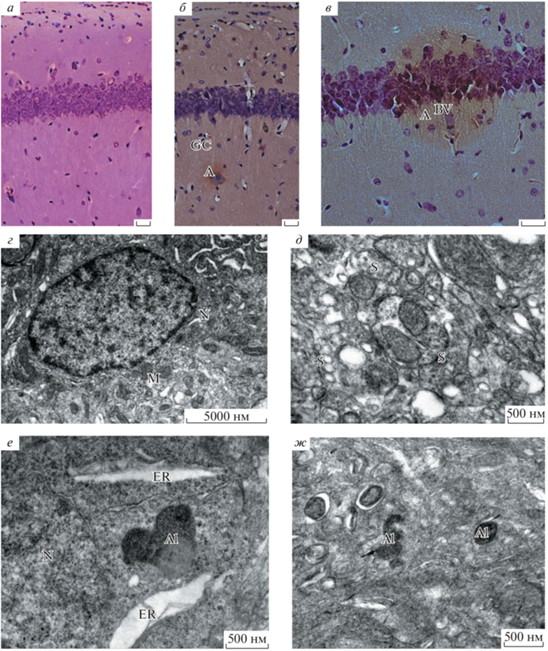
Поле СА1 дорзального гиппокампа. На препаратах, окрашенных комбинированным методом Ниссля и Конго Ред, в поле СА1 дорзального гиппокампа трансгенных мышей, по сравнению с мышами дикого типа, также выявлены различия в строении нервной ткани. На рис. 3б, в заметны амилоидные образования сферической формы. В гиппокампе амилоидные бляшки небольшого размера, около 0.1 мм и находятся, в основном, в волокнистых слоях. В пирамидном слое гиппокампа они встречаются реже. У мышей дикого типа они отсутствуют (рис. 3а). В гиппокампе трансгенных животных увеличено количество глиальных клеток. Внутри амилоидных образований заметны признаки деструкции клеточных тел и отростков нейронов, и глиальные клетки. Вблизи этих образований находятся кровеносные сосуды (рис. 3в). На электроннограммах поля СА1 дорзального гиппокампа у трансгенных мышей по сравнению с мышами дикого типа отмечены очаги локального поражения нервной ткани с признаками гибели клеток и их отростков (рис. 3е, ж). В цитоплазме нейронов замечены расширенные канальцы ЭПР. В нервных клетках, особенно в нейропиле гиппокампа, появляются аутофаголизосомы разных размеров и форм (рис. 3е, ж). Синаптические контакты и шипики в нейропиле гиппокампа трансгенных мышей встречаются редко, в отличие от мышей дикого типа (рис. 3г, д).
Рис. 3.
Гиппокамп у мышей дикого типа (а, г, д) и трансгенных мышей линии 5хFAD (б, в, е, ж) в возрасте 6 мес. а–в – Окраска Конго Ред, масштабные отрезки 30 мкм; г–ж – электроннограммы участков нейропиля с нейронами гиппокампа мышей дикого типа (г, д) и трансгенных мышей линии 5хFAD (е, ж) с амилоидными образованиями и аутофаголизосомами (Al). Обозначения: A – амилоидные образования (бляшки), BV – кровеносные сосуды, GC – глиальные клетки, N – нейроны, S – синаптические контакты, M – митохондрии, ER – ЭПР, Al – аутофаголизосомы.
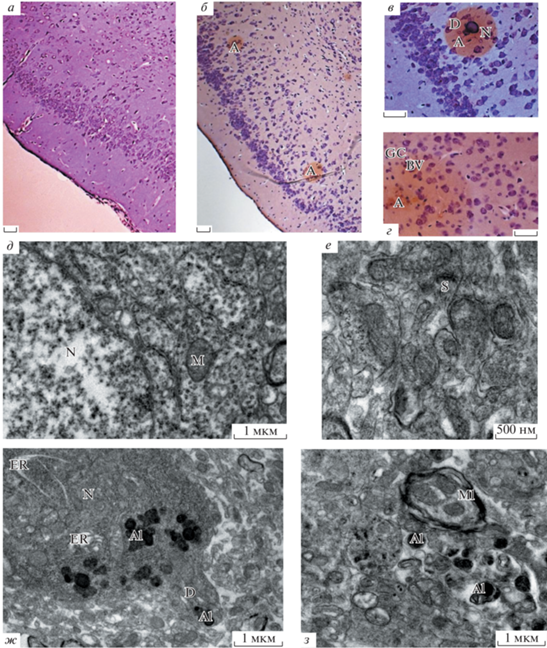
Энторинальная кора. Светооптическое исследование с использованием комбинированного окрашивания по методу Ниссля и Конго Ред выявило существенные различии в строении нервной ткани трансгенных мышей и мышей дикого типа. На рис. 4б–г в нервной ткани энторинальной коры заметно большое количество крупных амилоидных образований сферической формы. Их количество намного больше, чем в гиппокампе, и располагаются они, в основном, в клеточном слое. Заметно увеличение количества глиальных клеток (рис. 4б–г) по сравнению с мышами дикого типа (рис. 4а). На рис. 4б–г в крупных амилоидных образованиях представлены: дегенеративные изменения нейронов, изогнутые потерявшие форму дендриты и глиальные клетки. На периферии амилоидных образований располагаются кровеносные сосуды. На электроннограммах нервной ткани энторинальной коры трансгенных мышей при сравнении с мышами дикого типа обнаружены очаги локального поражения нервной ткани, которые выражаются в усилении нейродегенеративных изменений. На рисунке 4ж представлен нейрон с отходящим от его тела дендритом с многочисленными аутофаголизосомами. В нейропиле энторинальной коры трансгенных мышей в большом количестве также выявлены аутофаголизосомы различной формы (рис. 4ж, з). Более того, в этой части мозга заметно наличие расслоения миелиновой оболочки нервных отростков. Синаптических контактов и шипиков в энторинальной коре трансгенных мышей намного меньше по сравнению с мышами дикого типа (рис. 4д, е).
Рис. 4.
Энторинальная кора у мышей дикого типа (а, д, е) и трансгенных мышей линии 5хFAD (б–г, ж, з) в возрасте 6 мес. а–г – Окраска Конго красным, масштабные отрезки – 30 мкм; д–з – электроннограммы участков нейропиля с нейронами энторинальной коры мышей дикого типа (д, е) и трансгенных мышей линии 5хFAD (ж, з) с амилоидными образованиями с аутофаголизосомами (Al). Обозначения A – амилоидные образования (бляшки), D – дендриты, BV – кровеносные сосуды, GC – глиальные клетки, N – нейроны, S – синаптические контакты, M – митохондрии, ER – ЭПР, Ml – миелиновые волокна, Al – аутофаголизосомы.
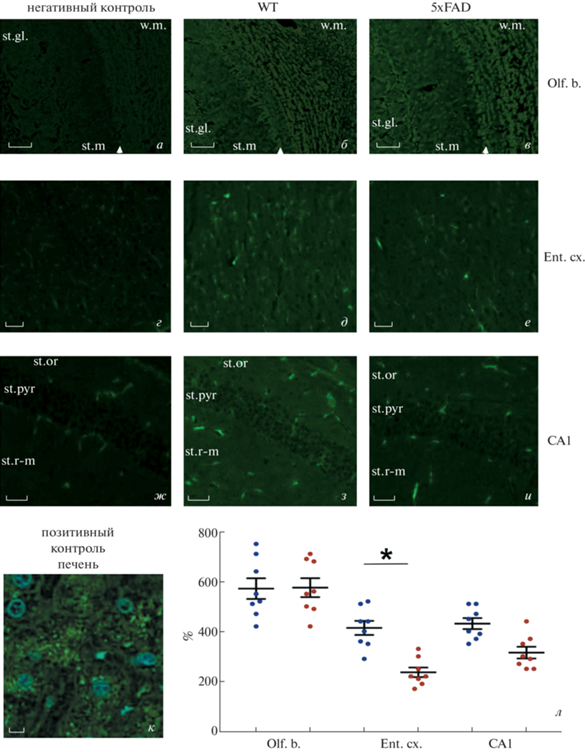
Иммуногистохимическое исследование распределения НЕП. В обонятельных луковицах, энторинальной коре и гиппокампе мышей дикого типа и трансгенных животных линии 5хFAD выявлены статистически значимые различия в интенсивности иммуногистохимического окрашивания НЕП (Kruskal−Wallis test, F5,47 = 34.7, p < 0.01) (рис. 5). В энторинальной коре трансгенных мышей линии 5хFAD обнаружено статистически значимое снижение уровня флуоресцентного сигнала по сравнению с мышами дикого типа (Dunn’s post-hoc p = 0.0088). При этом достоверных различий в уровне сигнала в ткани поля СА1 гиппокампа (р = 0.0711) и обонятельных луковиц (p = 0.99) выявить не удалось. В обонятельных луковицах мышей из обеих групп наиболее выраженное иммунное окрашивание НЕП отмечалось в нейропиле белого вещества, телах и отростках митральных клеток, а также мелких клеток, диффузно располагающихся в молекулярном слое и по краям гламерул (рис. 5б, в). Следует отметить, что в энторинальной коре мышей дикого типа, помимо относительно равномерного окрашивания нейропиля, наблюдались многочисленные НЕП-позитивные тела пирамидных нейронов (рис. 5г), а у мышей линии 5хFAD таких нейронов было заметно меньше, и их количество составляло 44.5 ± 6.1% от уровня контроля (Mann−Whitney test U = 21, p = 0.02). В дорсальном гиппокампе мышей обеих исследованных групп иммунопозитивными были преимущественно интернейроны, тогда как в пирамидном слое поля СА1 отмечались лишь единичные иммунопозитивные клетки (рис. 5ж, з). Разницы в общем количестве иммунопозитивных клеток между группами не отмечалось (Mann−Whitney test U = 3, p = 0.25).
Рис. 5.
Распределение металлопептидазы неприлизина (FITC-позитивный сигнал зеленого цвета) в ткани обонятельных луковиц (Olf. b., а–в), энторинальной коры (Ent. cx., г–е) и поля СА1 гиппокампа (СА1, ж–и) у 6-мес. мышей дикого типа (б, д, з) и мышей линии 5хFAD (в, е, и). a, г, ж – Негативный контроль иммуногистохимического окрашивания ткани мозга (в отсутствие первичных антител к неприлизину (НЕП) иммунохимическая реакция не наблюдается), к – позитивный контроль иммунохимической реакции на НЕП в ткани печени мыши дикого типа. Печень характеризуется высоким содержанием НЕП (зеленый цвет FITC-сигнала); ядра окрашены неспецифическим ядерным красителем DAPI (синий цвет). л – Результаты денситометрического анализа яркости свечения FITC-позитивных структур в ткани энторинальной коры (Ent. cx.), поля СА1 гиппокампа (СА1) и обонятельной луковицы (Olf. b.) мышей дикого типа (синие точки, n = 8) и мышей линии 5XFAD (красные точки, n = 8); данные представлены в виде среднего значения и его ошибки в % от уровня среднего значения свечения FITC в ткани негативного контроля; различия между группами животных достоверны при *p < 0.05 (one-way AN-OVA with Dunn’s post-hoc). Масштабные отрезки: 70 (a–в) и 50 (г–и) мкм.
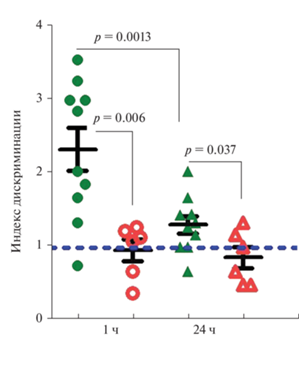
Исследование долговременной памяти в тесте “Распознавание новых объектов”. Сравнительный анализ поведения мышей линии 5xFAD и мышей дикого типа при предъявлении известных и новых объектов показал, что у трансгенных мышей в возрасте 6 мес. нарушена долговременная память. Было выявлено, что мыши дикого типа уделяли больше внимания исследованию новых объектов, при этом через 1 ч после тренировочного предъявления объектов индекс дискриминации составлял 2.44, а через 1 сут снижался (Mann–Whitney test U = 138.5, р = = 0.013) до 1.30. В то же время у трансгенных мышей индекс дискриминации был ниже по сравнению с диким типом: на 55% через 1 ч (Mann–Whitney test U = 25, р = 0.006) и на 44% через 24 ч после тренировки (t-test t = 2.3, р = 0.037) и приближался к 1, что свидетельствует об отсутствии предпочтения между новыми и известными объектами (рис. 6).
Рис. 6.
Сравнительный анализ уровня исследовательской деятельности в отношении нового объекта у мышей линии 5xFAD (n = 10) и дикого типа (n = 6). По вертикали – индекс дискриминации, вычисленный как частное чисел, отражающих время обнюхивания неизвестного (нового) и известного предметов. По горизонтали – время, прошедшее после тренировочного предъявления пары объектов. Над горизонтальными линиями, соединяющими сравниваемые группы животных, обозначен уровень значимости выявленных межгрупповых различий. Данные о животных дикого типа показаны зелеными кружками (1 ч) и треугольниками (24 ч), данные по животным линии 5xFAD представлены белыми кружками (1 ч) и треугольниками (24 ч) с красными границами. Пунктирной горизонтальной линией обозначен уровень, при котором наблюдается равнозначное предпочтение нового и известного объектов.
ОБСУЖДЕНИЕ
Сравнительное исследование нервной ткани обонятельных луковиц, а также входящих в общий гиппокампальный комплекс гиппокампа и энторинальной коры у мышей линии 5хFAD и дикого типа (рис. 1), с использованием светооптического, электронномикроскопического и имуногистохимического методов показало наличие существенных различий в их ультраструктуре. У трансгенных мышей 5хFAD в возрасте 6 мес. в этих трех структурах на светооптическом уровне были обнаружены амилоидные сенильные бляшки, как в клеточных, так и в волокнистых слоях, которые не наблюдались у мышей дикого типа. У 5хFAD мышей в очагах поражения головного мозга, где концентрируются бляшки, увеличено количество глиальных клеток, свидетельствующее о нейровоспалительном процессе. Нейроны и их дендриты подвергаются дегенеративным изменениям, происходит гибель клеток и прерываются межнейрональные связи. Кроме того, проведенное нами электронномикроскопическое исследование обнаружило локальные очаги поражения нервной ткани, появление аутофаголизосом в этих структурах, которые еще раз указывают на усиление нейродегенеративных процессов. У трансгенных мышей, по сравнению с мышами дикого типа, уменьшается число синаптических контактов и шипиков. Все эти изменения, обнаруженные нами, свидетельствуют об очевидном нарушении функционирования нейрональной сети как обонятельных луковиц, так и энторинальной коры и гиппокампа. Полученные нами данные согласуются с результатами других авторов, показавших гибель нейронов во многих областях мозга (Oakley et al., 2006; Eimer, Vassar, 2013), а также развитие астро- и микроглиоза, которое идет параллельно с образованием амилоидных бляшек (Oakley et al., 2006).
В проведенном нами исследовании выявлено нарушение долговременной памяти у трансгенных мышей в тесте распознавание нового объекта (NOR), который широко используется для исследования изменений памяти у животных (Antunes, Biala, 2012). Общепризнано, что на результаты NOR тестирования влияют как гиппокампальные, так и кортикальные нарушения (Cohen, Stackman, 2015). Исследования на приматах и грызунах показали, что для распознавания визуальных объектов очень важны парагиппокампальные области височной доли, а именно периринальная, энторинальная и нижняя височная кора (Hammond et al., 2004). В нашем исследовании у мышей линии 5xFAD были обнаружены существенные ухудшения долговременной памяти при распознавании визуальных объектов вместе с структурными изменениями, наблюдаемыми в энторинальной коре и гиппокампе.
Наличие существенных изменений в исследованных структурах мозга указывает на то, что у 5xFAD мышей имеет место нарушение нейрональных связей , что не может не сказаться на формировании их обонятельной функции. Полученные нами данные также свидетельствуют, о том, что у 5xFAD мышей имеет место нарушение распознавания запаха масла валерианы (Vasilev et al., 2022), один из составляющих компонентов которого – изовалериановая кислота, имеет феромональную значимость для мышей (Мельник и др., 2009).
Полученные нами данные об изменении распределения амилоид-деградирующего фермента НЕП в ткани исследуемых нами структур мозга мышей линии 5хFAD по сравнению с диким типом позволяют предположить, что снижение уровня содержания НЕП в энторинальной коре может быть одной из причин нарушения деградации растворимых форм амилоидного пептида, который при его накоплении активно образует амилоидные агрегаты (Nalivaeva, Turner, 2019). Кроме того, в структурах мозга трансгенных мышей нами выявлено нарушение числа синаптических контактов, которые, по имеющимся представлениям, являются основными местами локализации и действия НЕП (Наливаева и др., 2020), что может нарушать нормальное функционирование этого фермента и доступность его субстратов, к числу которых относятся Aβ и соматостатин. С этой точки зрения представляет также интерес в будущем проанализировать уровень содержания и распределения соматостатина в обонятельном анализаторе 5xFAD мышей, поскольку есть данные, что у пациентов с БА имеет место нарушение его распределения в переднем обонятельном ядре (Saiz-Sanchez еt al., 2010).
Проведенное нами исследование является важным шагом на пути к пониманию молекулярно-клеточных нарушений при патологии нервной ткани, вызванной накоплением амилоидного пептида. Особый интерес представляют результаты электронно-микроскопического исследования ткани мозга трансгенных мышей, показавшего, что накопление амилоидных отложений сопровождается развитием аутофагии, о чем свидетельствует наличие большого числа аутофаголизосом различных форм и размеров во всех исследованных нами участках мозга. Существует ряд гипотез о том, что в ходе развития БА происходит нарушение молекулярных механизмов образования аутофаголизосом (Reddy, Oliver, 2019), которое приводит к их накоплению в теле и отростках нейрона (Wang et al., 2018). Данные литературы согласуются с наблюдаемым нами накоплением аутофагосом и аутофаголизосом в нервных клетках. Однако доказательство активации аутофагии в нейронах у мышей линии 5xFAD требует проведения специального исследования с привлечением данных о динамике специфических маркерных белков (Atg-комплекс, Beclin-1, Lamp-1, Lamp-2, LC3 и др.). Так или иначе, результаты проведенного исследования впервые четко показывают накопление аутофаголизосом в нейронах кортикальных структур мозга мышей линии 5xFAD и свидетельствуют о вовлечении аутофагии в механизмы нейродегенеративных процессов у таких животных, что указывает на перспективность исследования аутофагии на данной модели.
Еще одним новым наблюдением в нашем исследовании является обнаружение различного характера клеточной локализации НЕП в исследуемых структурах, свидетельствующее, что в гиппокампе мышей НЕП-позитивными являются преимущественно интернейроны, а в энторинальной коре – тела пирамидных нейронов. При этом в обонятельных луковицах НЕП имеет более широкую локализацию: в нейропиле белого вещества, в телах и отростках митральных клеток и в мелких клетках гломерулярного слоя. Все это указывает на то, что локализация НЕП в разных популяциях клеток и структурах мозга различна, что, вероятно, отражает специфический характер распределения его субстратов. Различия в распределении НЕП у трансгенных животных и мышей дикого типа может свидетельствовать о нарушении его внутриклеточного транспорта и локализации, что наблюдалось нами в нервных клетках при гипоксии (Fisk et al., 2007).
Несмотря на то, что различные трансгенные модели БА различаются по своим характеристикам и не могут полностью отражать патогенез БА у человека, они дают возможность исследовать основополагающие молекулярные механизмы нарушений, вызываемых усиленной продукцией и накоплением амилоидного пептида, что делает их важным инструментом для исследований и тестирования фармакологических препаратов (Yang et al., 2017).
Список литературы
Мельник С.А., Гладышева О.С., Крылов В.Н. 2009. Возрастные изменения обонятельной чувствительности самцов мышей к запаху изовалериановой кислоты. Сенс. Сист. Т. 23. P. 151. (Melnik S.A., Gladysheva O.S., Krylov V.N. 2009. Age-related changes in the olfactory sensitivity of male mice to the smell of isovaleric acid. Sensory Systems. V. 23. P. 151.)
Наливаева Н.Н., Васильев Д.С., Дубровская Н.М., Turner A.J., Журавин И.А. 2020. Role of neprilysin in synaptic plasticity and memory. Рос. физиол. журнал. им. И.М. Сеченова. Т. 106. № 10. С. 1191. (Nalivaeva N.N., Vasiliev D.S., Dubrovskaya N.M., Turner A.J., Zhuravin I.A. 2020. Role of neprilysin in synaptic plasticity and memory. Russian J. Physiol. V. 106. P. 1191. ).https://doi.org/10.31857/S0869813920100076
Туманова Н.Л., Васильев Д.С., Дубровская Н.М., Журавин И.А. 2018. Ультраструктурные изменения в сенсомоторной коре при отставании развития двигательного поведения в раннем онтогенезе крыс, перенесших пренатальную гипоксию. Цитология. Т. 60. № 5. С. 390. (Tumanova N.L., Vasiliev D.S., Dubrovskaya N.M., Zhuravin I.A. 2018. Changes in ultrastructure of the sensorimotor cortex accompanied by the motor behavior dysfunctions in the early ontogenesis of rats subjected to the prenatal hypoxia. Tsitologiia. V. 60. P. 390.) https://doi.org/10.31116/tsitol.2018.05.09
Туманова Н.Л., Васильев Д.С., Дубровская Н.М., Наливаева Н.Н. Журавин И.А. 2021. Влияние пренатальной гипоксии на цитоархитектонику и ультраструктурную организацию структур мозга, связанных с обонятельной функцией у крыс. Цитология. Т. 63. № 2. С. 163. (Tumanova N.L., Vasiliev D.S., Dubrovskaya N.M., Nalivaeva N.N., Zhuravin I.A. 2021. Effect of prenatal hypoxia on cytoarchitectonics and ultrustructural organisation of brain regions related to olfaction in rats. Tsitologiia. V. 63. P. 193. )https://doi.org/10.31857/S0041377121020085
Antunes M., Biala G. 2021. The novel object recognition memory: neurobiology, test procedure, and its modifications. Cogn. Process. V. 13. P. 93. https://doi.org/10.1007/s10339-011-0430-z
Cai Y., Xue Z.Q., Zhang X.M., Li M.B., Wang H., Luo X.G., Cai H., Yan X.X. 2012. An age-related axon terminal pathology around the first olfactory relay that involves amyloidogenic protein overexpression without plaque formation. Neuroscience. V. 215. P. 160. https://doi.org/10.1016/j.neuroscience.2012.04.043
Cohen C.J, Stackman R.W. Jr. 2015. Assessing rodent hippocampal involvement in the novel object recognition task. A review. Behav. Brain Res. V. 285. P. 105. https://doi.org/10.1016/j.bbr.2014.08.002
Devi L., Alldred M.J., Ginsberg S.D., Ohno M. 2010. Sex- and brain region-specific acceleration of β-amyloidogenesis following behavioral stress in a mouse model of Alzheimer’s disease. Mol. Brain. V. 3. P. 34. https://doi.org/10.1186/1756-6606-3-34
Devi L., Ohno M. 2010. Phospho-eIF2α level is important for determining abilities of BACE1 reduction to rescue cholinergic neurodegeneration and memory defects in 5XFAD mice. PLoS One. V. 5. P. e12974. https://doi.org/10.1371/journal.pone.0012974
Eimer W.A., Vassar R. 2013. Neuron loss in the 5XFAD mouse model of Alzheimer’s disease correlates with intraneuronal Abeta42 accumulation and Caspase-3 activation. Mol. Neurodegener. V. 8. P. 2. https://doi.org/10.1186/1750-1326-8-2
Fisk L., Nalivaeva N.N., Boyle J.P., Peers C.S., Turner A.J. 2007. Effects of hypoxia and oxidative stress on expression of neprilysin in human neuroblastoma cells and rat cortical neurones and astrocytes. Neurochem. Res. V. 32. P. 1741. https://doi.org/10.1007/s11064-007-9349-2
Gaudel F., Stephan D., Landel V., Sicard G., Féron F., Guiraudie-Capraz G. 2018. Expression of the cerebral olfactory receptors Olfr110/111 and Olfr544 is altered during aging and in Alzheimer’s disease-like mice. Mol. Neurobiol. V. 56. P. 2057. https://doi.org/10.1007/s12035-018-1196-4
Hammond R.S., Tull L.E., Stackman R.W. 2004. On the delay-dependent involvement of the hippocampus in object recognition memory. Neurobiol. Learn. Mem. V. 82. P. 26. https://doi.org/10.1016/j.nlm.2004.03.005
Hüttenrauch M., Baches S., Gerth J., Bayer T.A., Weggen S., Wirths O. 2015. Neprilysin deficiency alters the neuropathological and behavioral phenotype in the 5XFAD mouse model of Alzheimer’s disease. J. Alzheimers Dis. V. 44. P. 1291. https://doi.org/10.3233/JAD-142463
Kanno T., Tsuchiya A., Nishizaki T. 2014. Hyperphosphorylation of Tau at Ser396 occurs in the much earlier stage than appearance of learning and memory disorders in 5XFAD mice. Behav. Brain Res. V. 274. P. 302. https://doi.org/10.1016/j.bbr.2014.08.034
Kimura R., Ohno M. 2009. Impairments in remote memory stabilization precede hippocampal synaptic and cognitive failures in 5XFAD Alzheimer mouse model. Neurobiol. Dis. V. 33. P. 229. https://doi.org/10.1016/j.nbd.2008.10.006
Lane C.A., Hardy J., Schott J.M. 2018. Alzheimer’s disease. Eur. J. Neurol. V. 25. P. 59. https://doi.org/10.1111/ene.13439
Maarouf C.L., Kokjohn T.A., Whiteside C.M., Macias M.P., Kalback W.M., Sabbagh M.N., Beach T.G, Vassar R., Roher A.E. 2013. Molecular differences and similarities between Alzheimer’s disease and the 5XFAD transgenic mouse model of amyloidosis. Biochem. Insights. V. 6. P. 1. https://doi.org/10.4137/BCI.S13025
Mirzaei N., Tang S.P., Ashworth S., Coello C., Plisson C., Passchier J., Selvaraj V., Tyacke R.J., Nutt D.J., Sastre M. 2016. In vivo imaging of microglial activation by positron emission tomography with [(11)C]PBR28 in the 5XFAD model of Alzheimer’s disease. Glia. V. 64. P. 993. https://doi.org/10.1002/glia.22978
Murphy C. 2019. Olfactory and other sensory impairments in Alzheimer disease. Nat. Rev. Neurol. V. 15. P. 11. https://doi.org/10.1038/s41582-018-0097-5
Nalivaeva N.N., Turner A.J. 2019. Targeting amyloid clearance in Alzheimer’s disease as a therapeutic strategy. Br. J. Pharmacol. V. 176. P. 3447. https://doi.org/10.1111/bph.14593
Nalivaeva N.N., Zhuravin I.A., Turner A.J. 2020. Neprilysin expression and functions in development, ageing and disease. Mech. Ageing Dev. V. 192. P. 111363. https://doi.org/10.1016/j.mad.2020.111363
Neuman K.M., Molina-Campos E., Musial T.F., Price A.L., Oh K.J., Wolke M.L., Buss E.W., Scheff S.W., Mufson E.J., Nicholson D.A. 2015. Evidence for Alzheimer’s disease-linked synapse loss and compensation in mouse and human hippocampal CA1 pyramidal neurons. Brain Struct. Funct. V. 220. P. 3143. https://doi.org/10.1007/s00429-014-0848-z
Nocera S., Simon A., Fiquet O., Chen Y., Gascuel J., Datiche F., Schneider N., Epelbaum J., Viollet C. 2019. Somatostatin serves a modulatory role in the mouse olfactory bulb: Neuroanatomical and behavioral evidence. Front. Behav. Neurosci. V. 13. P. 61. https://doi.org/10.3389/fnbeh.2019.00061
O’Leary T.P., Stover K.R.,Mantolino H.M., Darvesh S., Brown R.E. 2020. Intact olfactory memory in the 5xFAD mouse model of Alzheimer’s disease from 3 to 15 months of age. Behav. Brain Res. V. 393. P. 112731. https://doi.org/10.1016/j.bbr.2020.112731
Oakley H.O., Cole S.L., Logan S., Maus E., Shao P., Craft J., Guillozet-Bongaarts A., Ohno M., Disterhoft J., Van Eldik L., Berry R., Vassar R. 2006. Intraneuronal β-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer’s disease mutations: Potential factors in amyloid plaque formation. J. Neurosci. V. 26. P. 10129. https://doi.org/10.1523/JNEUROSCI.1202-06.2006
Ohno M., Cole S.L., Yasvoina M., Zhao J., Citron M., Berry R., Disterhoft J.F., Vassar R. 2007. BACE1 gene deletion prevents neuron loss and memory deficits in 5XFAD APP/PS1 transgenic mice. Neurobiol. Dis. V. 26. P. 134. https://doi.org/10.1016/j.nbd.2006.12.008
Park S.W., Im S., Jun H.O., Lee K., Park Y.J., Kim J.H., Park W.J., Lee Y.H., Kim J.H. 2017. Dry age-related macular degeneration like pathology in aged 5XFAD mice: Ultrastructure and microarray analysis. Oncotarget. 2017. V. 8. P. 40006 https://doi.org/10.18632/oncotarget.16967
Paxinos G., Franklin K.B.J. 2001. The mouse brain in stereotaxic coordinates. 2nd Edition, Academic Press, San Diego.
Reddy P.H., Oliver D.M. 2019. Amyloid β and phosphorylated tau-induced defective autophagy and mitophagy in Alzheimer’s disease. Cells. V. 8. P. 488. https://doi.org/10.3390/cells8050488
Roddick K.M., Roberts A.D., Schellinck H.M., Brown R.E. 2016. Sex and genotype differences in odor detection in the 3×Tg-AD and 5XFAD mouse models of Alzheimer’s disease at 6 months of age. Chem. Senses. V. 41. P. 433. https://doi.org/10.1093/chemse/bjw018
Saiz-Sanchez D., Ubeda-Bañon I., de la Rosa-Prieto C., Argandoña-Palacios L., Garcia-Muñozguren S., Insausti R., Martinez-Marcos A. 2010. Somatostatin, tau, and β-amyloid within the anterior olfactory nucleus in Alzheimer disease. Exp. Neurol. V. 223. P. 347. https://doi.org/10.1016/j.expneurol.2009.06.010
Shao C.Y., Mirra S.S., Sait H.B., Sacktor T.C., Sigurdsson E.M. 2011. Postsynaptic degeneration as revealed by PSD-95 reduction occurs after advanced Aβ and tau pathology in transgenic mouse models of Alzheimer’s disease. Acta Neuropathol. V. 122. P. 285. https://doi.org/10.1007/s00401-011-0843-x
Vasilev D.S., Dubrovskaya N.M., Zhuravin I.A., Nalivaeva N.N. 2021. Developmental profile of brain neprilysin expression correlates with olfactory behaviour of rats. J. Mol. Neurosci. V. 71. P. 1772. https://doi.org/10.1007/s12031-020-01786-3
Vasilev D.S., Dubrovskaya N.M., Tumanova N.L., Nalivaeva N.N. 2022. Analysis of expression of the amyloid-degrading enzyme neprilysin in brain structures of 5xFAD transgenic mice. J. Evol. Biochem. Physiol. V. 108. P. 417. https://doi.org/10.1134/S0022093022010173
Wang C., Telpoukhovskaia M.A., Bahr B.A., Chen X., Gan L. 2018. Endo-lysosomal dysfunction: A converging mechanism in neurodegenerative diseases. Curr. Opin.Neurobiol. V. 48. P. 52. https://doi.org/10.1016/j.conb.2017.09.005
Yang Z., Kuboyama T., Tohda C. 2017. A systematic strategy for discovering a therapeutic drug for Alzheimer’s disease and its target molecule. Front. Pharmacol. V. 8. P. 340. https://doi.org/10.3389/fphar.2017.00340
Дополнительные материалы отсутствуют.


