Цитология, 2022, T. 64, № 3, стр. 249-261
Структура и физико-химические свойства паравертебральных сухожилий
А. А. Гайдаш 1, *, В. К. Крутько 1, М. И. Блинова 2, А. В. Нащекин 3, О. Н. Мусская 1, К. В. Скроцкая 4, О. А. Сычева 1, Л. В. Кульбицкая 1, Ю. П. Токальчик 5, А. И. Кулак 1
1 Институт общей и неорганической химии НАН Белоруссии
220072 Минск, Белоруссия
2 Институт цитологии РАН
194064 Санкт-Петербург, Россия
3 Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, Россия
4 Научно-исследовательский институт физико-химических проблем Белорусского государственного университета
220006 Минск, Белоруссия
5 Институт физиологии НАН Белоруссии
220072 Минск, Белоруссия
* E-mail: aljack880@gmail.com
Поступила в редакцию 10.02.2022
После доработки 01.03.2022
Принята к публикации 04.03.2022
- EDN: LAHMNF
- DOI: 10.31857/S0041377122030038
Аннотация
Сухожильная ткань активно используется в качестве сырья при получении коллагеновых гелей. При этом не всегда учитываются структура и физико-химические свойства внутрикапсулярных пучков и оболочек (перитеноны) сухожилий. С целью уточнения этих сведений методами сканирующей электронной микроскопии, рентгенофазового и термического анализов, а также инфракрасной (ИК) спектроскопии изучены внутрикапсулярные пучки и перитеноны паравертебральных сухожилий крыс линии Вистар. Установлено, что внутрикапсулярные сухожильные коллагеновые волокна собраны в пучки цилиндрической формы, сшитые фибриллярными узлами. Приоритетными локациями фибриллярных узлов являются обжимы в пограничных слоях внутрикапсулярных пучков и перитенонов, эндотеноны и зоны ремоделирования коллагеновых фибрилл. Перитеноны имеют каркасную структуру, образующую в наружном и внутреннем слоях солидные блоки коллагеновых массивов. Тканеспецифическими структурами перитенонов являются сесамоидные островки и глобулы, игольчатые и пластинчатые разрастания, остеоноподобные ламеллы, участвующие в упрочнении и оссификации сухожилий по механизмам гетерогенной и гомогенной нуклеации кальцийфосфатов. Основными компонентами минеральной фазы являются пирофосфаты семейства Ca2P2O7 · nH2O и гидроксиапатиты. В сухожильных пучках пирофосфаты деконденсированы, что препятствует образованию гидроксиапатита. В перитенонах пирофосфаты конденсированы в моноклинные фенотипы, индуцирующие синтез гидроксиапатита. Имеются различия и в состоянии гидроксиапатита: в пучках он кристалличен, в перитенонах – аморфный. По данным термического анализа и ИК-спектроскопии внеклеточный матрикс внутрикапсулярных сухожильных пучков более подвижен, фибриллярный коллаген частично коагулирован и гидрофобен, устойчив к мацерации. В перитенонах внеклеточный матрикс вязкий, коллагеновые волокна гидрофильны и чувствительны к мацерации. Полученные данные имеют значение при прогнозировании специализированных свойств коллагеносодержащих материалов, учитывающих структурно-метаболические особенности анатомических компонентов сухожилий.
Сухожильная ткань – это переходная структура, которая занимает специализированные анатомические пространства между мышцами и костным остовом. Сухожилия призваны реагировать, прежде всего, на сжимающие нагрузки. Именно поэтому сухожильная ткань филогенетически структурируется достаточно скоро: впервые появляется у беспозвоночных хордовых в виде миосепт (Gemballa et al., 2003). В целом эволюция сухожильной ткани предопределяет необходимость реагировать на сжимающие и растягивающие силы путем последовательного приобретения дополнительных степеней свободы одно- дву- и трехмерных массивов коллагеновых волокон. При нарастании мощности деформирующих нагрузок сухожилия оптимизируют соотношение жесткости и прочности локальным уплотнением коллагеновых фибрилл и отвердеванием экстрафибриллярного матрикса, образуя временные или постоянно присутствующие, в той или иной мере подвижные очаги кальцификации, формирующиеся в том числе и в составе сесамовидной ткани (Summers, 2002).
Важным объектом адаптивных модификаций является внеклеточный матрикс – объем, состав и структура которого прогрессируют в ходе эволюции нелинейным образом. В одноосных сухожилиях, собранных в пучки, появляются многоосные оболочечные надстройки, создаваемые для более дифференцированного реагирования на механические нагрузки. Механобиологический посыл очевиден – сформировать композит-чувствительный материал, армированный фибриллярным коллагеном, с возможностями к механорецепции и направленному структурированию внеклеточного матрикса (Lanir, 1978).
Многомерность механобиологических трендов, их консерватизм, скачки структурно-генетических проявлений (подавлений), персистенция рудиментов и непредсказуемая актуализация атавизмов – природные обстоятельства, безусловно, затрудняющие разработку стратегий технологической обработки коллагенсодержащих сырьевых материалов. Механобиологический тренд главный, но не единственный. Не менее важен и морфогенетический тренд, реализующий сближение сухожилий с камбиальными структурами скелетных надкостниц. В такой ситуации в пограничные слои, в оболочечные образования сухожилий неизбежно проникают структуры регенераторного пула.
Механобиологические и морфогенетические факторы диверсифицируют структурно-метаболический континуум сухожильной ткани, вносят нюансы в состав и структуру пучковых и оболочечных компонентов сухожилий. Осознание механизмов действия этих факторов определит проектирование многомерных биоматериалов, тактику специализации задаваемых свойств по разным целевым направлениям (Zhang et al., 2021). Особое значение это имеет в матричных технологиях in vitro, где коллагеновые подложки используют в качестве индукторов, формирующих эпидермальные пласты и эпителиально-мезенхимные переходы, направляют хондро- или остеогегенез.
Цель работы: определить особенности структуры и физико-химических свойств внутрикапсулярных пучков и оболочечных перитенонов паравертебральных сухожилий, извлеченных из хвостов крыс Вистар.
МАТЕРИАЛ И МЕТОДИКА
Объект исследования. Использовали половозрелых самцов крыс Вистар c массой тела 250–300 г, выдержанных на сбалансированном рационе. Изучали внутрикапсулярные сухожильные нити и перитеноны паравертебральных сухожилий, извлеченные из хвостов крыс. Биопсию производили у крыс, наркотизированных этиловым эфиром. Протоколы эксперимента утверждены этическим комитетом Института физиологии НАН Белоруссии и соответствовали Санитарным нормам 2.1.2.12-18-2006 (Национальный реестр правовых актов Республики Белоруссия, 2012. № 8/25189).
Иссечение образцов произведено по следующему алгоритму: отсепаровка кожи и круговой надрез связок, перелом и разделение позвоночного столба в средней части хвоста, извлечение из проксимального сегмента внутрикапсулярных сухожильных пучков, продольное вскрытие сухожильной оболочки, отсечение свободной части париетальных листков перитенонов. Данная техника позволяет выделять перитеноны без примеси надкостницы и, соответственно, уменьшает вероятность проникновения в образцы костного гидроксиапатита (HA). Исследуемые образцы распределены на две группы: 1-я – внутрикапсулярные сухожильные нити, 2-я – париетальные листки перитенонов.
Сканирующая электронная микроскопия (СЭМ). Образцы фиксировали на протяжение 3–5 сут в водном 3%-ном растворе глутарового альдегида, промывали в трех сменах дистиллированной воды, высушивали в течение 24 ч при температуре 37°C, дегидратировали в водных растворах этанола восходящей концентрации. Анализ морфологии поверхности полученных образцов производили на сканирующем электронном микроскопе LEO 1420 (Carl Zeiss, Германия) после напыления золота на установке K550X (Emitech, Англия).
Рентгенофазовый анализ (РФА). Режимы подготовки образцов, предназначенных для физико-химических исследований, представлены в табл. 1. Особенности пробоподготовки для РФА: свежесрезанные образцы хранили в морозильной камере до использования. Для уменьшения избыточного рассеяния рентгеновского излучения толстыми образцами отбирали тонкие (толщиной около 1 мм) внутрикапсулярные сухожильные нити и листки перитенонов и помещали на 3–5 сут в морозильную камеру (при −6°C) до проведения анализа. Непосредственно перед выполнением анализа образцы размораживали и подвергали обработке: в режимах 1 и 2 (табл. 1), РФА выполнен на дифрактометре ADVANCE D8 (Bruker, Германия) при СuКα = 0.15405 нм с использованием базы данных ICDD PDF-2: карбонат-гидроксиапатит [00-035-0180], гидроксиапатит [01-084-1998]. Дифрактограммы сняты в диапазоне 5°–70° в масштабе 2θ с шагом 0.01°, что позволило идентифицировать фазы.
Таблица 1.
Характеристика режимов подготовки образцов для физико-химических исследований
| Режим | Пробоподготовка |
|---|---|
| 1 | После размораживания образцы разогревали до комнатной температуры и выдерживали 24 ч в герметичном контейнере |
| 2 | Размороженные образцы отжигали в течение 5 ч при 500°С |
| 3 | Образцы подвергали анализу не позднее чем через 0.5 ч после биопсирования |
| 4 | Сразу после биопсирования образцы помещали на 24 ч в термостат при температуре 37°C в открытом контейнере. Навеску образца с 800 мг порошка KBr измельчали на лабораторной шаровой вибромельнице с частотой колебаний 50 Гц, повторяя три раза. Таблетки прессовали на прессе Carl Zeiss Jena при нагрузке 400 кг/см2 |
Термический анализ. Для дериватографии использовали образцы, подготовленные в режиме 3 (табл. 1). Параметры термогравиметрии (ТГ), дифференциальной термогравиметрии (ДТГ) и дифференциально-термического анализа (ДТА) определены на дериватографе STA 409 PC LUXX (NETZSCH, Германия) при скорости потока воздуха 50 мл/мин.
ИК-спектроскопия. Использовали “влажный” и “твердотельный” варианты. Для влажного варианта готовили образцы в режиме 3 (табл. 1). Съемку спектров осуществляли в режиме “отражения” на ИК-Фурье-микроскопе Hyperion (Bruker, Германия) в диапазоне 2000−8000 см–1 с применением 15-кратного Gir-объектива, позволяющего с приемлемой точностью позиционировать зонд спектрометра. Для твердотельного варианта использовали образцы, подготовленные в режиме 4 (табл. 1), спектры на отражение записывали на ИК-спектрометре Tensor-27 (Bruker, Германия) в диапазоне 400−4000 см–1.
Методологический подход реализован на принципе инструментального континуума: непротиворечивость результатов, полученных разными видами анализов, признание значимыми малых структурных сдвигов, если таковые затрагивают разнородные компартменты, выявление системности и стремление к целостным интерпретациям.
Статистическую достоверность межгрупповых различий оценивали по tSt-критерию Стьюдента. По этическим соображениям выборки животных минимизировали: 3–5 особей в группе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сканирующая электронная микроскопия. Между висцеральным листком перитенона и позвоночным столбом (подлежащей надкостницей) имеется рыхлый волокнистый слой. Слой пронизан широкими интерстициальными каналами, местами, придающими ему спонгиозность, и ориентированными вдоль позвоночников (рис. 1а). Очевидно, что в условиях in vivo слой заполнен тканевой жидкостью (в том числе лимфой) и в этом смысле представляет собой гидродинамическую подушку, смягчающую локальные механические напряжения.
Рис. 1.
Микрофотографии сухожилий (СЭМ). а – Интерстициальные каналы между висцеральным листком перитенона и подлежащей надкостницей позвоночного столба (стрелка); б – волнистые внутрикапсулярные пучки, направленные по длинной оси; в – фибриллярные узлы, образованные перекидыванием контактирующих коллагеновых волокон с формированием спаренных структур (стрелка); г – зигзагообразные структуры в области образования фибриллярных узлов (стрелка); д – упакованные в солидные блоки коллагеновых волокон в наружном слое перитенона; е – широкопетлистая сеть, образованная расправленными коллагеновыми волокнами в срединном слое перитенона (стрелка).
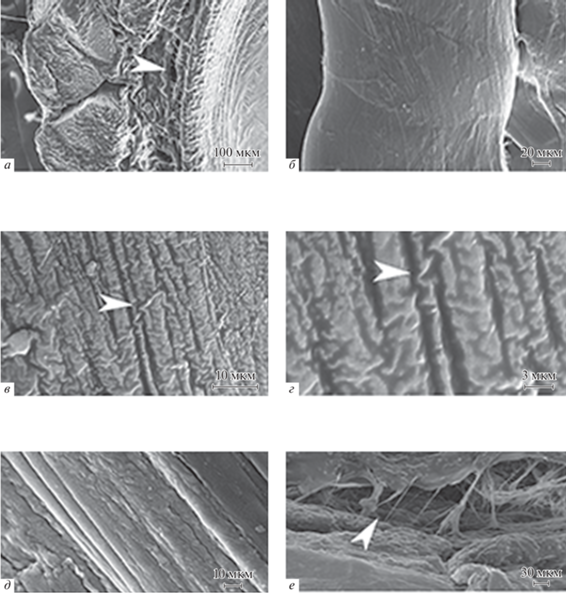
Внутрикапсулярные сухожильные нити собраны в плотно упакованные симметричные пучки цилиндрической формы, что придает волокнам линейную эластичность. В одном сухожилии в зависимости от возраста содержится 7–10 пучков диаметром 300–500 мкм. Пучки неравномерно волнисты, направлены вдоль длинной оси (рис. 1б). При растяжении за счет вязкой упругости пучки выпрямляются, увеличивая жесткость ткани с некоторой потерей прочности на изгиб (Lanir, 1980). На поверхностях пучков в изгибах контактирующие волокна перебрасываются друг относительно друга, образуя спаренные структуры – “фибриллярные узлы” (рис. 1в). В глубоких слоях пучков выявляются резко меняющие направление микрофибриллы: изгибаются под острыми углами и уходят вглубь (характерная для фибриллярного коллагена экваториальная исчерченность становится невидимой), уплощаются и принимают зигзагообразный ход (рис. 1г). Узлы участвуют в обжимах, углы и длина которых варьируют в разных слоях пучков: чем глубже, тем уже и короче. Не менее важен и показатель связности (r) в узлах: в сухожильных пучках r варьирует в пределах 3.1–3.3, что свидетельствует о понижении пластичности и увеличении устойчивости к действию интенсивных нагрузок (Burla et al., 2020). Зигзагообразные структуры, возможно являющиеся ранней разновидностью фибриллярных узлов, склонны накапливаться вблизи участков ремоделирования микрофибрилл, что способствует структурированию внеклеточного матрикса. Однако в зрелом сухожилии главным предназначением фибриллярных узлов является демпфирование сил растяжения (сжатия), а также скручивания при вращательно-колебательных движениях (Kastelic et al., 1978).
Перитеноны – это оболочечная ткань каркасной структуры, оплетающая внутрикапсулярные сухожильные пучки. В перитенонах ход волокон определяется слоем оболочки. В пограничных слоях перитенонов фибриллы складываются: в наружном слое в широкие пласты и упакованные солидные блоки (рис. 1д), внутренние волокна собраны в тяжи эндотенонов, которые разветвляются и уходят вглубь сухожильных пучков. Большая часть контактирующих микрофибрилл параллельны друг другу, они реже переплетаются и еще реже формируют фибриллярные узлы обжатия. В срединном слое перитенонов каркас преимущественно расправлен: волокна образуют широкопетлистую сеть, ячейки которой заполнены клеточными и волокнистыми (рис. 1е) компонентами матрикса. Каркас полиморфен: где-то расправлен, где-то коллабирован. Показатель связности варьирует в пределах 2.1, что свидетельствует о высокой пластичности и подвижности каркаса (Jansen et al., 2018). Это разупорядочивает гидродинамические потоки внеклеточного матрикса, усиливает внутреннее трение и повышает риски локальных микромеханических конфликтов в виде эксцессов неупругих деформаций и релаксаций. Очевидно, что ведущим механобиологическим мотивом структурирования каркаса перитенонов становится рассеивание механической энергии. И в ходе эволюции этот мотив развивает морфогенетический потенциал перитенонов. В поле этого тренда формируются пластинчатые структуры, а именно: сесамоидные островки, игольчатые и ламеллоподобные разрастания.
Островки сесамоидной ткани неравномерно рассеяны в межклеточном пространстве и расположены преимущественно вблизи мягкой части энтез – костно-сухожильных соединений. Предпочтительность локации не случайна: энтезы – это механосенситивные центры, регулирующие распределение механических напряжений (Benjamin et al., 2006). На СЭМ островки представлены очагами уплотненного внеклеточного матрикса, в центре которых имеются отростчатые минерализованные теноциты с признаками распада. Вблизи островков, а иногда и в контакте с ними располагаются ветвящиеся теноциты с признаками метаболической активности (рис. 2а). Важным компонентом островков являются сесамоидные тельца – овальные частицы (глобулы), диаметром до 15 мкм. Глобулы двухслойны – внутренний рыхлый слой интегрирован с подлежащим матриксом, наружный имеет вид полуободка (рис. 2б). Сесамоидные тельца имеют клеточное происхождение и цитогенетически связаны с матриксными пузырьками отростков теноцитов. Структура мембран (билипидная цитолемма), состав содержимого (кислые и щелочные фосфатазы; полисахариды, устойчивые к гиалуронидазам; протеогликаны; белки-транспортеры и кальцийфосфаты (CP)), а также поведение глобул (накопление в зонах ремоделирования) идентичны свойствам матриксных везикул, участвующих в процессах первичной минерализации регенерирующей хрящевой и костной тканей (Amizuka et al., 2012; Hasegawa et al., 2017). Основная часть сесамоидных глобул залегает в поверхностных слоях островков разрозненно, но нередко частицы обнаруживаются вблизи пор и лакун (рис. 2в). В области одного островка может находиться несколько десятков глобул, количество которых регулируется путем почкования с неравномерным распределением внутреннего содержимого.
Рис. 2.
Микрофотографии перитенонов (СЭМ). а – Сесамоидный островок, контактирующий с отростчатым теноцитом (стрелка); б – двухслойные глобулы сесамоидных островков, внутренний слой непосредственно интегрирован с подлежащим матриксом, наружный – имеет вид полуободка; в – сесамоидные глобулы, расположенные на поверхности островков, вблизи пор и лакун; г – игольчатые разрастания (“клювики”), расположенные на поверхностях сесамоидных островков (стрелка); д – остроконечные ветвящиеся пластинки с гаверсоподобными отверстиями; е – пластинки компактизированных коллагеновых микрофибрил, расположенные в межфибриллярных пространствах.
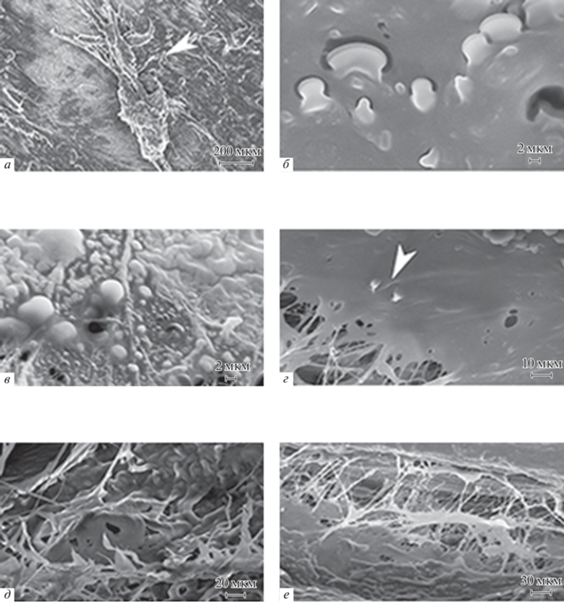
Игольчатые разрастания – это остроконечные выросты матрикса, напоминающие “клювики”, расположенные чаще на поверхностях сесамоидных островков (рис. 2г). Направление структурных преобразований очевидно – расширение площади для гетерогенной нуклеации CP, что, по сути, является проявлением остеогенной дифференцировки. Остеогенная направленность проявляется и в другой функционально важной локации, а именно в пограничных слоях, в париетальных листках перитенонов. Здесь игольчатые формы принимают более развернутую структуру остеогенной направленности: пластинки имеют широкие основания, остроконечны, ветвятся и переплетаются, содержат гаверсоподобные отверстия (рис. 2д). Пластинчатые образования − структуры полиморфные. Наиболее распространенной формой являются пластинки компактизированных коллагеновых микрофибрилл, располагающиеся в широких межфибриллярных пространствах. Это тонкие, плотные в основаниях, прозрачные и разволокненные в оконечностях листки (рис. 2е).
Другой разновидностью пластинчатых образований являются остеоноподобные ламеллы, встречающиеся также в париетальных листках перитенонов в основном по линии прикрепления к позвоночному столбу. Форма ламелл схожа с формой зрелых остеонов с характерным отверстием гаверсовых каналов в центре, но без кровеносных сосудов и нервных стволов (рис. 3а). Ламеллы бесклеточны, слоисты (3–5 плотно склеенных слоев), строго располагаются на внутренней поверхности перитенонов и являются отвердевшими структурами. Это указывает на атавистичность и рудиментарность остеоноподобных ламелл, на развитие которых, по-видимому, наложен эволюционный запрет.
Рис. 3.
Микрофотографии остеодных структур перитенонов (СЭМ). а – Ламеллы в виде тонких остеоноподобных пластинок с типичным отверстием гаверсового канала без кровеносных сосудов и нервных стволов (стрелки); б – отложения зерен кальцийфосфатов на поверхностях межфибриллярных пластинок; в – минеральные депозиты на коллагеновых субфибриллах (стрелки); г – ограненные депозиты на поверхности капсул сесамоидных глобул (стрелка).
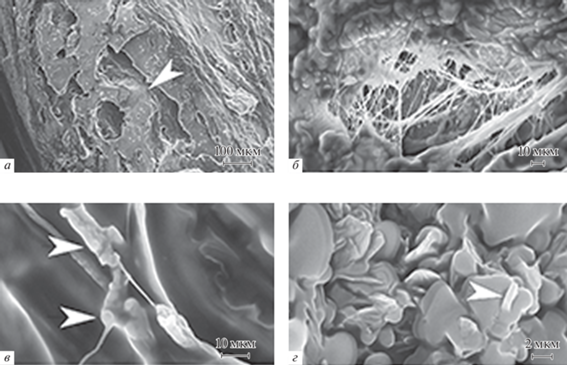
Сесамоидные островки, игольчатые и пластинчатые межфибриллярные разрастания локализованы в глубоких слоях перитенонов, подвержены структурным метаморфозам, ориентируются к сухожильно-костным переходам. Приближение этих структур в область энтез усиливает их регенераторный потенциал остеогенной направленности, реализуемый с участием механизмов гетерогенной и гомогенной нуклеации CP. Гетерогенная нуклеация на матрицах коллагеновых волокон проявляется в виде отложения на поверхностях субфибрилл и межфибриллярных пластинок микрогранул CP и депозитов (рис. 3б, в). Это отражает общие представления о стадиях матричного структурирования CP: первичное осаждение аморфных гранул в просветах интердигитирующих каналов – зазоров вдоль осей α-цепей тропоколлагенов, на которых кластеры заряженных аминокислот формируют нуклеационные центры, и далее темплатирующий рост аморфных CP и формирование массивов параллельно ориентированных кристаллитов гидроксиапатита (HA). По мере созревания кристаллиты захватывают внешние поверхности фибрилл и переходят в стадию отвердевания (Landis et al., 2009; Nudelman et al., 2010).
Явления матричной нуклеации проявляются в виде отложения депозитов преимущественно вблизи мест бифуркации, а также в виде структурного полиморфизма: ассиметричное смещение центров коротких осей, не строгая перпендикулярность ходу коллагеновых субфибрилл, размерная и пространственная разупорядоченность. Это свидетельствует о том, что в состоянии физиологического покоя процессы гетерогенной нуклеации “заторможены” на разных стадиях, из которых более зрелые при действии соответствующих факторов среагируют полным развертыванием потенций к остеогенной дифференцировке. Во внутрикапсулярных пучках структуры гетерогенной нуклеации выявляются в значительно меньших объемах, нежели в слоях оболочек сухожилий. Кроме того, в сухожильных пучках отсутствуют сесамоидная ткань, игольчатые и пластинчатые структуры, эксклюзивное наличие которых в перитенонах обусловливает повышенную чувствительность к остеогенным откликам.
Гомогенная нуклеация осуществляется с участием сесамоидных глобул. С помощью СЭМ это наблюдается в виде прорастания мембран сфероидов ограненными депозитами в основном призматической формы (рис. 3г). Депозиты встречаются примерно в 10% глобул, которые в ходе прорастания деформируются: уплощаются, принимают полиморфные, угловатые формы. Мономорфное, преимущественно ограненное состояние депозитов, отсутствие промежуточных форм, проросшие глобулярные мембраны, свидетельствует о том, что процессы гомогенной нуклеации осуществляются в сесамоидных структурах по архаичным геобиохимическим механизмам, возможно, более консервативным, но для возбуждения которых требуются энергозатратные стимулы.
Рентгенофазовый анализ. На рентгендифрактограммах внутрикапсулярных сухожильных пучков и перитенонов, подготовленных в режиме 1, регистрируются рентгеноаморфные гало, формирующееся за счет вклада упругого рассеяния фибриллярного коллагена, имеющего квазикристаллическую структуру (рис. 4а, кривые 1, 2). Кристалличность обусловлена регулярными межмолекулярными ковалентными поперечными связями, определяется генетически детерминированной последовательностью аминокислотной сборки фибриллярных коллагенов (I, II, III и IV типов), не подвержена межвидовым вариациям и не является эксклюзивной особенностью хвостовых сухожилий. Учитывая, что фибриллярный коллаген I типа составляет более 95% органической фазы сухожилий, динамику гало можно соотнести к структурным вариациям, прежде всего именно этого типа коллагена. Вышеприведенные гало не позволяют судить о тонких изменениях в кристаллической структуре фибриллярного коллагена, организованного в крупную некристаллическую субстанцию. И тем не менее, присущие сухожильной ткани гофрированность и симметричная цилиндричность пучков в сочетании с пластинчатой и блочной организацией коллагенового каркаса, подвижность фибриллярных узлов в угловых и плоскостных обжимах структурированы, что делает возможным изучение такого типа образцов с помощью малоугловой рентгеновской дифракции (Gathercole, Keller, 1978).
Рис. 4.
Рентгендифрактограммы анатомических компонентов сухожилий. а – Дифрактограммы органической фазы (галло); б – дифрактограммы в области выхода рефлексов минеральной фазы нативных образцов; в – дифрактограммы в области выхода рефлексов минеральной фазы образцов после 500°С; 1 – сухожильные пучки нативные, 2 − перитеноны нативные, 3 – сухожильные пучки после 500°С, 4 − перитеноны после 500°С.
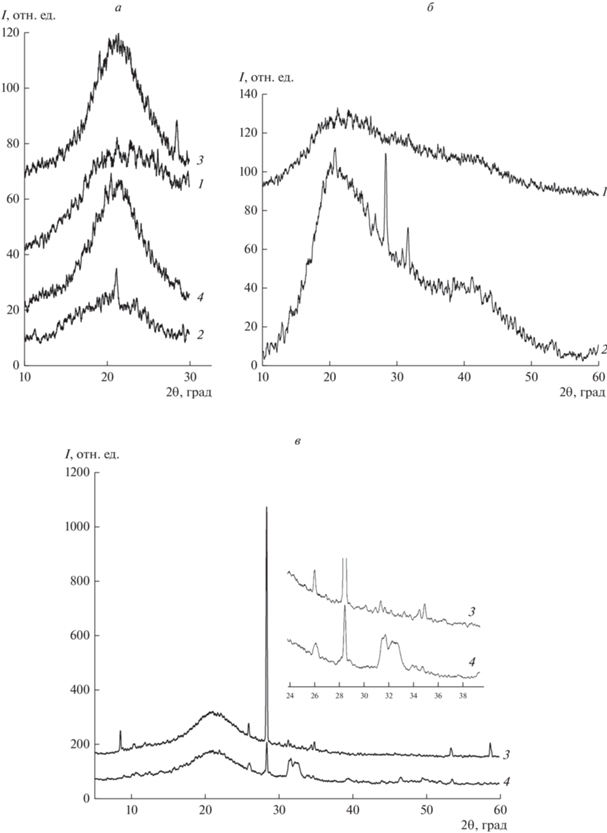
Технические условия проведенного анализа, а именно существенное превышение размеров ячейки коллагенового домена (от ≈64 нм) относительно длины излучаемой волны (λСuKα = 0.15405 нм) обеспечивают соблюдение условий корректности измерений в режиме малоугловой рентгендифрактометрии. Исходя из этого, допущено, что динамика параметров гало, рефлексы которого устойчиво наблюдаются в диапазоне углов 2θ < 30°, полезна при оценке интегральных трендов структурной (дисперсность, упорядоченность) вариабельности органической фазы сухожилий. Так, на рентгендифрактограммах сухожильных пучков усредненное положение пиков гало варьирует в пределах 21.1°, перитенонов – 21.9° (рис. 4а, кривые 1, 2), что свидетельствует о более агрегированном и упорядоченном состоянии коллагеновой фракции внутрикапсулярных волокон, в сравнении с перитенонами. При прогреве до 500°C пик гало внутрикапсулярных волокон уширяется, изменяясь в диапазоне 20.5°–21.7°, но усредненное положение пика сохраняется в исходном диапазоне (21.1°), а перитенонов сужается со сдвигом в малоугловую сторону – 20.5° (рис. 4а, кривые 3, 4). Это указывает на разнонаправленные тренды реагирования коллагеновых белков на экстремальные температуры: сухожильных пучков, склонных к разупорядочению, а перитенонов – наоборот.
Положения рефлексов минеральной фазы в значительной мере зависят от анатомического компонента сухожилий и способов пробоподготовки. В образцах 1-й и 2-й групп, подготовленных в режиме 1, наблюдается выход рефлексов HA и гидратированных неорганических пирофосфатов кальция (PPi) семейства Ca2P2O7 · nH2O (рис. 4б, кривая 2; рис. 4в, кривые 3, 4). Диагностика кристалличности и наноструктурности HA по данным РФА затруднительна. В сухожильных пучках характерный пик (31.8°) узкий, четко очерчен, что свидетельствует о доминировании упругого рассеяния. В перитенонах положение пика такое же (31.7°), но он широкий, контуры плохо очерчены, что говорит об уменьшении вклада упругого рассеяния. При отжиге сухожильных пучков характерные пики смещаются к 31.2°, сужаются и появляются дополнительные рефлексы (рис. 4в, кривая 3). В отожженных образцах перитенонов пики сдвигаются к 32.3°, уширяются, контуры расщепляются, деформируются, регрессируют дополнительные рефлексы и увеличивается их интенсивность (рис. 4в, кривая 4). Вышеприведенные соотношения параметров дифрактограмм свидетельствует о том, что в сухожильных пучках HA более кристалличен, а сами кристаллы HA достаточно крупные. В перитенонах кристаллиты HA мельче и, по-видимому, находятся в более аморфном состоянии.
Интенсивность образования HA регулируется молярным отношением неорганических фосфатов [Pi] к [PPi]: при увеличении [Pi]/[PPi] синтез HA возрастает (Thouverey et al., 2009). Однако метаболические особенности анатомических компонентов сухожилий вносят принципиальные нюансы. В нативных образцах сухожильных пучков PPi не выявляются (рис. 4б, кривая 1), но их количество в виде триклинных форм PPi резко увеличивается в отожженных образцах (рис. 4в, кривая 3). Это означает, что в сухожильных пучках присутствуют предшественники TPPi. Синтез триклинных форм PPi контролируется согласно [Pi]/[PPi], из чего следует, что рост TPPi подавляют высокие концентрации соединений семейства PPi (Cheng et al., 1981). Учитывая это и данные РФА, можно предположить, что во внутрикапсулярных сухожильных пучках концентрации Pi высокие, а химически активных PPi – низкие. При этом PPi находятся в деконденсированном состоянии. И будучи мощными ингибиторами синтеза HA, подавляют его образование, а интенсивность рефлексов HA сухожильных пучков минимальна (рис. 4б, кривая 1). На дифрактограммах нативных образцов перитенонов в диапазоне кислых фосфатов выходят рефлексы PPi (рис. 4б, кривая 2), что указывает на то, что PPi в перитенонах присутствуют в рентгеноаморфном состоянии, а также в форме моноклинных фенотипов PPi. Количество PPi в отожженных образцах перитенонов значительно меньше, чем в сухожильных пучках (рис. 4в, кривая 4). В то время как в нативных образцах перитенонов концентрации PPi, по-видимому, достаточно высоки, чтобы активировать синтез моноклинных фенотипов (Cheng et al., 1980), повышенные концентрации которых, в свою очередь, активируют синтез HA (Cheng, Pritzker, 1983; Mandel N., Mandel G. 1988), что отражают соответствующие дифрактограммы (рис. 4б, кривая 2; 4в, кривая 4). Таким образом, именно различия химической активности PPi определяет регуляторные нюансы синтеза HA в сухожильной ткани. Характерные рефлексы HA, выявляемые во внутрикапсулярных сухожильных пучках и в перитенонах при термической нагрузке, отличаются поведением: при отжиге сухожильных пучков рефлексы HA сужаются и смещаются в область малых углов (рис. 4в, кривая 3), а в перитенонах обратный тренд: рефлексы HA уширяются и пики смещаются в широкоугловом направлении (рис. 4в, кривая 4). Это значит, что в физиологических условиях предшественники HA пучковых сухожилий находятся в состоянии ближе к твердым телам кристаллической группы, решетки которых при нагревании упорядочиваются и увеличиваются в размерах. В перитенонах, наоборот, предшественники HA проявляют свойства стабильно аморфных тел, так как их структура при нагревании разупорядочивается и уменьшаются размеры доменов. Главная особенность обсуждаемых явлений – это разнонаправленность метаболических каскадов в органической и неорганической фазах сухожильной ткани. Это повышает вероятность возникновения рисков разных по содержанию, провоцирующих метаболические растройства. Один из таких конфликтов хорошо известен – пирофосфатные тендинопатии, артропатии и т.п.
Термический анализ. В образцах внутрикапсулярных коллагеновых волокон в сравнении с перитенонами регистрируется повышенная скорость потери массы воды до 49.2 ± 2.5% (рис. 5а, кривая 1) и понижение температуры при кипении до 110 ± 3.2°С. Это в сочетании с ростом поглощаемой энергии свидетельствует о большей подвижности химических связей водной фазы, менее сильных адгезионных взаимодействих и, следовательно, об относительно меньшей вязкости жидкой фракции внеклеточного матрикса. В изученной литературе нет ясности о природе этих эффектов.
Рис. 5.
Данные термического анализа анатомических компонентов сухожилий. а – Термогравиметрия и дифференциальная гравиметрия; б – дифференциально-термический анализ; 1 – сухожильные пучки, 2 − перитеноны.
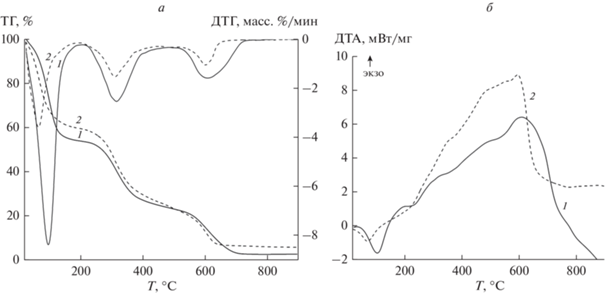
В связи с данными РФА о накоплении во внутрикапсулярных коллагеновых волокнах химически активных PPi, можно предположить, что во внеклеточном матриксе сухожильных пучков более кислая среда, в которой неизбежно повышается действие коагулирующих катионов PPi в отношении отрицательно заряженных частиц. С другой стороны, известно, что поверхностный заряд тройных спиралей коллагена сильно зависит от рН – при увеличении кислотности в физиологически значимом диапазоне увеличивается доля отрицательных зарядов (Morozova, Muthukumar, 2018). Последствия очевидны: возрастет коагулирующее влияние PPi за счет связывания катионами. Именно этим объясняются относительно высокие значения экзотермических эффектов (609.7 ± 3.6°С) и уменьшенная скорость их нарастания (рис. 5б, кривая 1), свидетельствующие о повышенном уровне прочности, учитывая объем коллагеновой фракции, в первую очередь пептидных связей. Повышенная кислотность упрочнит связи и в интерфейсе коллаген−гиалуроновая кислота, так как увеличивается ее способность к самоассоциации, что, в свою очередь, увеличит плотность межмолекулярных контактов.
Тренды теплофизических параметров перитенонов противоположны, что позволяет предположить факт относительной щелочности межклеточного вещества, в сравнении с сухожильными пучками. По отношению к водной фазе повышенная щелочность сделает более вязкой жидкую среду внеклеточного матрикса (на ДТА наблюдаются замедление скорости потери массы до 36.6 ± 3.8% (рис. 5а, кривая 2) и повышение температуры кипения 123.1 ± 7.8°С). Однако по отношению к органической фазе за счет внутримолекулярной динамики гиалуроновой кислоты (ГК) ситуация складывается иначе.
Известно, что по мере роста щелочности карбоксильные группы ГК депротонируются, гидроксильные группы диссоциируют, что вызывает разрывы и препятствует образованию водородных связей. В результате вязкость щелочных растворов ГК уменьшается. Разрывы водородных связей приводят к усадке полимера, так как ускоряется свободное вращение гликозидных связей и уменьшается агрегационный потенциал гиалуроновой кислоты (Cowman et al., 2015; Caspersen et al., 2014; Gatej et al., 2005). Повышенная способность к деагрегации имеет и кинетические последствия: при деагрегации увеличивается межфазное расслоение и соответственно увеличиваются площади поверхностей, что обеспечит соответствующий рост скоростей химических реакций. Интегральным свидетельством этих процессов являются пониженная (относительно сухожильных пучков) температура экзотермических эффектов в среднем до 571.3 ± 9.7°С на фоне увеличения скорости их нарастания (рис. 5б, кривая 2).
ИК-спектроскопия. На ИК-спектрах перитенонов и внутрикапсулярных пучков фибриллярный коллаген I типа верифицируется наличием характеристичных полос валентных колебаний С=О в полосе Амида I, составные частоты деформационных колебания NH и колебаний C−N в полосе Амида II, деформационных колебаний NH и валентных колебаний С−N в полосе Амида III, группы колебаний связанных гидроксильных групп и С=О, а также колебаний скелетных связей C−C (табл. 2). ИК-спектры влажных образцов перитенонов и пучковых сухожилий, охлажденных до комнатной температуры, не отличаются (табл. 2). Однако при действии температуры в физиологическом пределе на ИК-спектрах перитенонов и пучковых сухожилий появляются существенные различия. Так, в образцах перитенонов, прогретых при 37°C, регистрируется системный низкочастотный сдвиг пиков характеристичных полос коллагеновых белков: в комплексе Амида II, который свидетельствует о расширении углов деформационных колебания NH и, соответственно, указывает на разупрочнение пептидных связей в первичной цепи с замещением межцепочечных водородных связей интерстициальными водными мостиками; в полосе Амида III, который отражает уменьшение прочности пептидных водородных связей между первичными цепями. При этом полосы Амида I не сдвигаются.
Таблица 2.
Данные ИК-спектроскопии внутрикапсулярных сухожильных пучков и перитенонов
| Функциональные молекулярные группы | Характеристичные частоты (ν, см–1) | |||
|---|---|---|---|---|
| перитеноны, обработанные при 37°C | перитеноны нативные | внутрикапсулярные пучки, обработанные при 37°C | внутрикапсу-лярные пучки, нативные | |
| PO4 растяжения (ν1) | 875 | 1056 | 875 | 937 |
| CO3 групповая | 1350 | 1443 | 1400 | 1459 |
| Амид I | 1723 | 1709 | 1712 | 1694 |
| Амид II | 1471 | 1568 | 1622 | 1567 |
| Амид III | 1134 | 1272 | 1164 | 1288 |
| Скелетные колебания связей C−C | 668 | 776 | 742 | − |
Существенный низкочастотный сдвиг наблюдается и в полосе скелетных колебаний связей C−C (табл. 2). Причины растяжения связей в молекулах коллагена термообработанных перитенонов не ясны. Наиболее вероятный сценарий – это заполнение межцепочечных пространств водой, высвобождаемой в ходе мацерации. Внутрикапсулярные сухожильные пучки проявляют большую устойчивость: пики полос Амидов I и II остаются в прежнем положении и только у Амида III смещаются в низкочастотную область (табл. 2). Подобная устойчивость, возможно, обусловлена сшивающим действием фибриллярных узлов, препятствующих локальному растяжению.
На ИК-спектрах перитенонов и внутрикапсульных пучков присутствуют характеристичные полосы полносимметричных колебаний связи P−O (ν1), а также выходят полосы групповых колебательных мод карбонильных групп (табл. 2). Здесь также наблюдаются низкочастотные сдвиги в прогретых образцах, причем в равной мере как в перитенонах, так и во внутрикапсулярных сухожильных пучках. Сдвиги явно обусловлены действием повышенной температуры и, возможно, гидратацией CP.
ЗАКЛЮЧЕНИЕ
Сухожилия – это природный композитный материал, иерархическая организация которого завершает мультимодальную эволюцию структурно-механических, физико-химических и морфогенетических тенденций. Структурно-механические детерминанты организуют внутрикапсулярные коллагеновые волокна в симметричных сухожильных пучках, а в перитенонах – каркасно-пластинчатые подструктуры. Универсальным регулятором структурно-механических трансформаций являются фибриллярные узлы – воспринимающие и демпфирующие линейные механические нагрузки. Приоритетным размещением фибриллярных узлов являются внутрикапсулярные сухожильные пучки, эндотеноны, а также зоны повышенной потребности в структурировании внеклеточного матрикса. Каркасная организация перитенонов амбивалентна: в пограничных слоях структурно консервативна, в срединных – мобильна и полиморфна. Это противоречие сглаживается при подводе механической энергии: каркас упорядочивается, сопряжение фибриллярных структур становится термодинамически выгодным, риски механических конфликтов на границах субкомпозитных переходов снижаются. Эксклюзивными структурными атрибутами перитенонов являются сесамоидная ткань, игольчатые разрастания и пластинчатые структуры, предоставляющие резервные опции в упрочнении/разупрочнении сухожилий.
Внеклеточный матрикс внутрикапсулярных сухожильных пучков содержит больше кислых функциональных групп, а в перитенонах, соответственно, − щелочных. Это ключевой отличительный фактор физико-химического гомеостаза, который определяет разнонаправленные регуляторные мотивы в органической и неорганической фазах сухожилий. В межклеточном веществе внутрикапсулярных сухожильных пучков более подвижна водная фаза, превалирует деконденсация неорганических пирофосфатов, что препятствует образованию кристаллитов гидроксиапатита, частично коагулирован фибриллярный коллаген и его поверхность гидрофобизируется. У перитенонов обратные тренды: более вязкая водная фаза, доминирует конденсация пирофосфатов, что благоприятствует синтезу и росту кристаллов гидроксиапатита, повышена гидрофильность, смачиваемость и адгезивность коллагеновых волокон. Во внутрикапсулярых сухожильных пучках органические полимеры более агрегированы, в перитенонах, наоборот, склонны к деагрегации. Это имеет кинетические последствия − скорости химических реакций в условиях межфазовых расслоений, увеличения площадей поверхностей будут расти. Таким образом, в перитенонах имеются структурные предпосылки, ускоряющие обмен веществ относительно метаболизма в сухожильных пучках. Полученные данные имеют значение при проектировании структурно-чувствительных материалов, предназначенных для клеточных технологий, с заданными составом, структурой и состоянием.
Список литературы
Amizuka N., Hasegawa T., Oda K. 2012. Histology of epiphyseal cartilage calcification and endochondral ossification. Frontiers in Bioscience. V. E4. P. 2085. https://doi.org/10.2741/526
Benjamin M., Toumi H., Ralphs J.R., Bydder G., Best T.M., Milz S. 2006. Where tendons and ligaments meet bone: attachment sites (‘entheses’) in relation to exercise and/or mechanical load. J. Anat. V. 208. P. 471. https://doi.org/10.1111/j.1469-7580.2006.00540.x
Burla F., Dussi S., Martinez-Torres C., Tauber J., van der Gucht J., Koenderink G.H. 2020. Connectivity and plasticity determine collagen network fracture. PNAS. V. 117. P. 8326. https://doi.org/10.1073/pnas.1920062117
Caspersen M.B., Roubroeks J.P., Qun L., Shan H., Fogh J., Ruidong Z., Tømmeraas K. 2014. Thermal degradation and stability of sodium hyaluronate in solid state. Carbohydr Polym. V. 107. P. 25. https://doi.org/10.1016/j.carbpol.2014.02.005
Cheng P.T., Pritzker K.P. 1983. Pyrophosphate, phosphate ion interaction: effects on calcium pyrophosphate and calcium hydroxyapatite crystal formation in aqueous solutions. J. Rheumatol. V. 10. P. 769.
Cheng P.T., Pritzker K.P. 1981. The effect of calcium and magnesium ions on calcium pyrophosphate crystal formation in aqueous solutions. J. Rheumatol. V. 8. P. 772.
Cheng P.T., Pritzker K.P., Adams M.E., Nyburg S.C., Omar S.A. 1980. Calcium pyrophosphate crystal formation in aqueous solutions. J. Rheumatol. V. 7. P. 609.
Cowman M.K, Schmidt T.A., Raghavan P., Stecco A. 2015. Viscoelastic properties of hyaluronan in physiological conditions. F1000Res. V. 4. P. 622. https://doi.org/10.12688/f1000research.6885.1
Gatej I., Popa M., Rinauo M. 2005. Role of the pH on hyaluronan behavior in aqueous solution. Biomacromolecules. V. 6. P. 61. https://doi.org/10.1021/bm040050m
Gathercole L.J., Keller A. 1978. X-ray diffraction effects related to superstructure in rat tail tendon collagen. Biochim. Biophys. Acta. V. 535. P. 253. https://doi.org/10.1016/0005-2795(78)90092-2
Gemballa S., Ebmeyer L., Hagen K., Hannich T., Hoja K., Rolf M., Treiber K., Vogel F., Weitbrecht G. 2003. Evolutionary transformations of myoseptal tendons in gnathostomes. Proc. R. Soc. B: Biol. Sci. V. 270. P. 1229. https://doi.org/10.1098/rspb.2003.2345
Hasegawa T., Yamamoto T., Tsuchiya E., Hongo H., Tsuboi K., Kudo A., Abe M., Yoshida T., Nagai T., Khadiza N., Yokoyama A., Oda K., Ozawa H., de Freitas P.H.L., Li M., Amizuka N. 2017. Ultrastructural and biochemical aspects of matrix vesicle-mediated mineralization. Jpn. Dent. Sci. Rev. V. 53. P. 34. https://doi.org/10.1016/j.jdsr.2016.09.002
Jansen K.A., Licup A.J., Sharma A., Rens R., MacKintosh F.C., Koenderink G.H. 2018. The role of network architecture in collagen mechanics. Biophys. J. V. 114. P. 2665. https://doi.org/10.1016/j.bpj.2018.04.043
Kastelic J., Galeski A., Baer E. 1978. The multicomposite structure of tendon. Connect. Tiss. Res. V. 6. P.11. https://doi.org/10.3109/03008207809152283
Landis W.J., Silver F.H. 2009. Mineral deposition in the extracellular matrices of vertebrate tissues: identification of possible apatite nucleation sites on type I collagen. Cells Tiss. Organs. V. 189. P. 20. https://doi.org/10.1159/000151454
Lanir Y. 1978. Structure-strength relations in mammalian tendon. Biophys. J. V. 24. P. 541. https://doi.org/10.1016/S0006-3495(78)85400-9
Lanir Y. 1980. A microstructure model for the rheology of mammalian tendon. J. Biomech. Eng. V. 102. P. 332. https://doi.org/10.1115/1.3138231
Mandel N., Mandel G. 1988. Calcium pyrophosphate crystal deposition in model systems. Rheum. Dis. Clin. North. Am. V. 14. P. 321.
Morozova S., Muthukumar M. 2018. Electrostatic effects in collagen fibril formation. J. Chem. Physics. V. 149. P. 163333. https://doi.org/10.1063/1.5036526
Nudelman F., Pieterse K., George A., Bomans P. H.H., Friedrich H., Brylka L.J., Hilbers P.A. J., With G., Sommerdijk N.A.J.M. 2010. The role of collagen in bone apatite formation in the presence of hydroxyapatite nucleation inhibitors. Nat. Mater. V. 9. P. 1004. https://doi.org/10.1038/nmat2875
Summers A.P., Koob T.J. 2002. The evolution of tendon–morphology and material properties. Comp. Biochem. Physiol.: A. V.133. P. 1159. https://doi.org/10.1016/s1095-6433(02)00241-6
Thouverey C., Bechko G., Pikula S., Buchet R. 2009. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarth. Cartilage. V. 17. P. 64. https://doi.org/10.1016/j.joca.2008.05.020
Zhang S., Ju W., Chen X., Zhao Y., Feng L., Yin Z., Chen X. 2021. Hierarchical ultrastructure: An overview of what is known about tendons and future perspective for tendon engineering. Bioact. Mater. V. 8. P. 124. https://doi.org/10.1016/j.bioactmat.2021.06.007
Дополнительные материалы отсутствуют.


