Цитология, 2022, T. 64, № 3, стр. 240-248
Нитроксидергические и кальретинин-содержащие непирамидные нейроны гиппокампа крысы
И. О. Илясов 1, Д. А. Суфиева 1, *, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: dinobrione@gmail.com
Поступила в редакцию 05.03.2022
После доработки 10.03.2022
Принята к публикации 13.03.2022
- EDN: FMULCF
- DOI: 10.31857/S004137712203004X
Аннотация
Интернейроны гиппокампа, в отличие от пирамидных нейронов, представляют собой разнородную группу нейронов, которые отличаются морфологическими, цитохимическими и функциональными характеристиками. Целью данного исследования стало проведение сравнительного морфологического анализа нитроксидергических (NOS+) и кальретинин-содержащих (CR+) непирамидных нейронов зон CA1 и CA3 гиппокампа крысы с помощью иммуногистохимических методов. Были продемонстрированы качественные и количественные различия популяций NOS+ и CR+ непирамидных нейронов в различных слоях изучаемых зон гиппокампа. Также были показаны различия в количественном составе изучаемых популяций интернейронов в двух субрегионах гиппокампа, которые соответствуют дорсальному и промежуточному гиппокампу. Было установлено, что NOS+-интернейроны более характерны для дорсального гиппокампа, в то время как большее число CR+-интернейронов представлено в промежуточном гиппокампе. Полученные в ходе исследования данные могут способствовать пониманию роли непирамидных нейронов в формировании функциональной специализации разных областей гиппокампа.
Гиппокамп является важной, сложноорганизованной и одной из наиболее изучаемых структур головного мозга. Установлено, что он задействован в обучении, консолидации памяти и пространственной ориентации, а также выполняет ряд других функций (Burgess et al., 2002; Squire, 2004). В гиппокампе принято выделять 4 зоны – CA1−CA4 и зубчатую фасцию (Lorente de Nò, 1934). Эта структура характеризуется ламинарной организацией. В зонах гиппокампа различают несколько слоев: stratum pyramidale (str. pyramidale), сформированный основными клетками гиппокампа – глутаматергическими пирамидными нейронами; str. oriens, образованный дендритами пирамидных нейронов; str. lucidum, который выделяется только в зоне CA3 и состоит из проксимальных участков дендритов пирамидных нейронов, где формируются синаптические контакты с аксонами мшистых волокон; str. radiatum, состоящий из множества дендритных ветвей пирамидных клеток, также здесь проходят коллатерали Шафера, идущие из зоны CA3 в зону CA1; и str. lacunosum-moleculare, образованный, главным образом, из претерминальных и терминальных ветвлений апикальных дендритов пирамидных нейронов, здесь проходят афферентные волокна от энториальной коры и таламуса (Amaral et al., 1984).
Пирамидные нейроны являются основными клетками гиппокампа и опосредуют его главные функции. Известно, что развитие таких заболеваний как болезнь Альцгеймера, височная эпилепсия, шизофрения могут быть спровоцированы нарушениями в работе этих нейронов (Leite et al., 2002; Tóth et al., 2010; Zhou et al., 2017; Farahimanesh et al., 2018). В связи с этим, именно данные клетки всегда привлекали пристальное внимание исследователей. Однако исследования последних лет показывают, что не менее важную роль играют клетки, модулирующие работу пирамидных клеток – непирамидные нейроны гиппокампа. Эти клетки важны не только для регулирования возбудимости отдельных нейронов, но также участвуют во временно́й и пространственной синхронизации передачи нервного импульса гранулярными клетками зубчатой фасции и пирамидными клетками гиппокампа (Pelkey et al., 2017; Booker, Vida, 2018).
В то время как пирамидные нейроны представляют собой морфологически однородную группу клеток, непирамидные нейроны (10–20% от общего числа нейронов гиппокампа) формируют гетерогенную популяцию, состоящую из трех основных типов ГАМКергических нейронов: корзинчатых и аксо-аксональных интернейронов, образующих контакты с начальными сегментами аксонов, а также проксимальными отделами дендритов пирамидных нейронов; интернейронов, формирующих синаптические связи с дистальными отделами дендритов пирамидных нейронов; интернейронов, регулирующих активность других интернейронов (Tóth, Maglóczky, 2014). Сведения, касающиеся организации интернейронов гиппокампа, фрагментарны и часто противоречивы, что может объясняться как методическими сложностями при их идентификации, так и функциональной специализацией различных участков гиппокампа, которая может проявляться в различиях клеточного состава. Исследование непирамидных нейронов, их строения, организации и функций, необходимо для понимания механизмов функционирования нейронных сетей гиппокампа. Целью данного исследования стало сравнительное морфологическое изучение нитроксидергических (NOS+) и кальретинин-содержащих (CR+) непирамидных нейронов зон CA1 и CA3 гиппокампа крысы.
МАТЕРИАЛ И МЕТОДИКА
Материалом для настоящего исследования стал головной мозг половозрелых крыс-самцов породы Вистар (n = 6). При содержании и умерщвлении животных соблюдали международные правила Хельсинкской декларации о гуманном обращении с животными и “Правила проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977 г.). Материал был фиксирован в цинк-этанол-формальдегиде и залит в парафин по общепринятой методике. Изготавливали фронтальные срезы толщиной 5 мкм. Предметом изучения стала область гиппокампа, расположенная от 3 мм до 5.52 мм относительно Брегмы (Paxinos, Watson, 2007).
Для иммуногистохимического исследования интернейронов гиппокампа препараты после стандартной процедуры депарафинирования подвергали тепловому демаскированию в модифицированном цитратном буфере S1700 (Dako, Дания). Для выявления интернейронов гиппокампа использовали мышиные моноклональные антитела к NeuN (клон A60) (Chemicon, США) в разведении 1 : 800, кроличьи поликлональные антитела к антигену нитроксидсинтазы (NOS) (Spring Bioscience, США) в разведении 1 : 1000 и кроличьи поликлональные антитела к кальретинину (CR) (RTU, Genemed, США). Для выявления NeuN в качестве вторичных антител использовали набор Mach 2 Universal HRP Polymer Kit for mouse or rabbit (Biocare medical, США) с добавлением 2% сыворотки крови крысы, для выявления NOS и CR применяли набор Reveal Polyvalent HRP DAB Detection System (Spring Bioscience, США). Визуализацию продукта реакции проводили с использованием хромогена 3,3'-диаминобензидина (DAB+, Dako, Дания). Часть срезов подкрашивали квасцовым гематоксилином. После стандартной процедуры обезвоживания препараты заключали в перманентную среду Cytoseal 60 (Richard-Allan Scientific, США). Анализ препаратов проводили, используя световой микроскоп Leica DM750, оснащенный камерой ICC 50. Получение и обработку изображений осуществляли в программе LAS EZ (Leica, Германия).
Определение числа клеток осуществляли в программе Fiji (ImageJ) с применением плагина Cell Counter. В каждом случае подсчет клеток производили в зонах CA1 и CA3 гиппокампа по трем полям зрения для каждой зоны. Количество клеток пересчитывали на единицу площади, равную 1 мм2. Также, расчеты производили в двух субрегионах гиппокампа, соответствующих координатам 3–4.36 мм (далее регион I) и 4.36–5.52 мм (далее регион II) относительно Брегмы. Данные представлены в виде средней ± ошибка средней. Проверку на нормальность распределения вариант выборок производили с помощью критерия Колмогорова–Смирнова, далее использовали непараметрический критерий Манна−Уитни. Для сравнения популяций интернейронов выбранных субрегионов и сравнения количества интернейронов, выявляемых разными маркерами (NeuN, NOS и CR), использовали непараметрический критерий Манна−Уитни. Для статического анализа использовали программу Graph Pad Prism (Graph Pad Software, США).
РЕЗУЛЬТАТЫ
При изучении препаратов, окрашенных с использованием антител к ядерному антигену NeuN, наблюдали, что данный маркер выявляет как нейроны слоя str. pyramidale, так и нейроны, локализующиеся в других слоях гиппокампа – непирамидные нейроны (рис. 1). Продукт реакции локализовался в ядрах и перинуклеарной цитоплазме этих клеток. Иногда окрашивались начальные сегменты отростков. Непирамидные клетки имели либо округлую, либо веретеновидную форму, которая была типична для определенного слоя в каждой из исследуемых зон. Так, на границе str. lacunosum-moleculare и str. radiatum зоны CA1 была обнаружена большая популяция интернейронов, клетки которых имели веретеновидную форму и лежали тангенциально слою str. pyramidale (рис. 1в). В str. radiatum зоны CA1 интернейроны были округлой или веретеновидной формы, с радиально направленным отростком (рис. 1в). В str. oriens локализовались непирамидные нейроны с перикарионом веретеновидной или округлой формы (рис. 1в). В зоне CA3 в слоях str. lucidum, str. radiatum и str. lacunosum-moleculare найдены нейроны преимущественно округлой формы.
Рис. 1.
Иммуногистохимическая реакция на антиген NeuN в регионе I (3–4.36 мм) (а), регионе II (4.36–5.52 мм) (б) и в зоне CA1 (в) гиппокампа крысы. Стрелками обозначены непирамидные нейроны. г – Число NeuN+-интернейронов в различных слоях зон CA1 и CA3 двух субрегионов гиппокампа. SL – str. lacunosum, SLM – str. lacunosum-moleculare, SR – str. radiatum, SP – str. pyramidale; SO – str.oriens; DG – зубчатая фасция гиппокампа. * – различия достоверны для p < 0.05; ** – для p < 0.01.
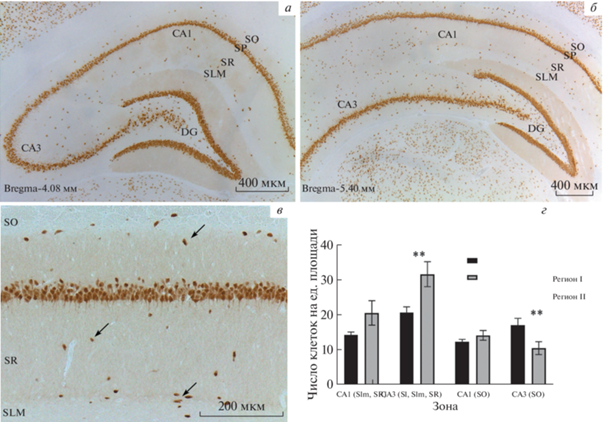
Было установлено, что при сравнении количества NeuN+-клеток между зонами CA1 и CA3 по всем слоям (кроме пирамидного) непирамидных нейронов в зоне CA3 было достоверно больше, по сравнению с зоной CA1 (p = 0.006). При сравнении количества непирамидных нейронов, расположенных в разных слоях зон CA1 и CA3 двух субрегионов гиппокампа, статистически значимые различия были выявлены в слоях str. lacunosum, str. lacunosum-moleculare, str. radiatum зоны CA3 (достоверно больше в регионе II, p = 0.006) и в str. oriens зоны CA1 (достоверно больше в регионе I, p = 0.007) (рис. 1г).
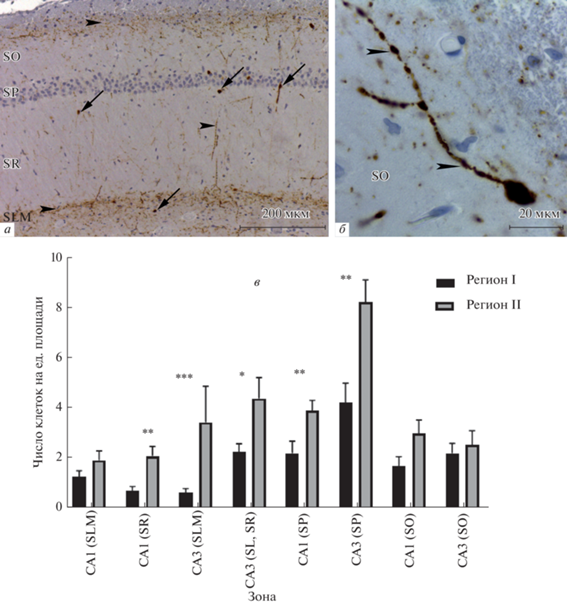
При анализе препаратов, окрашенных с использованием антител к NOS, наблюдали, что данный маркер не идентифицируется в пирамидных нейронах, но выявляется в непирамидных нейронах всех слоев гиппокампа. Данный белок локализуется как в телах (перинуклеарная область), так и в отростках клеток. Степень интенсивности окраски для разных клеток варьировала от слабой до умеренной. Часто выявлялись отростки мультиполярных нейронов (рис. 2а). Хорошо выявлялись, как правило, 1–2 радиально направленных отростка, которые имели варикозные утолщения по всей их длине (рис. 2б).
Рис. 2.
Иммуногистохимическая реакция на NO-синтазу (NOS). а, б – Зона CA1 гиппокампа. Стрелкой обозначены NOS+-интернейроны, головки стрелок указывают на варикозные утолщения. в – Число NOS+ интернейронов в различных слоях зон CA1 и CA3 двух субрегионов гиппокампа. SLM – str. lacunosum-moleculare; SR – str. radiatum; Sl – str. lucidum; SP – str. pyramidale; SO – str. oriens. * – различия достоверны для p < 0.05; ** – для p < 0.01.
При сопоставлении количества интернейронов, расположенных в разных слоях зон CA1 и CA3 субрегионов I и II гиппокампа, статистически значимые различия были выявлены в str. pyramidale зоны CA1 (достоверно больше в регионе I, p = 0.002) и str. lucidum зоны CA3 (достоверно больше в регионе I, p = 0.009) (рис. 2в).
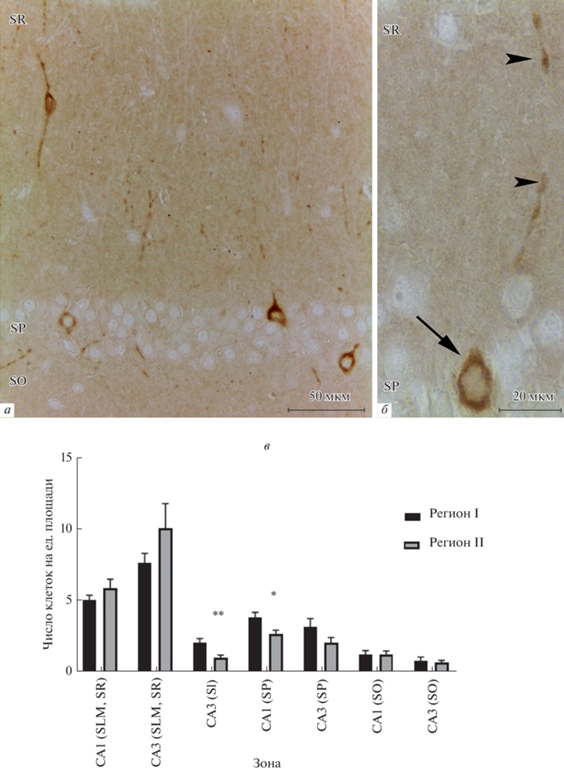
Исследование кальретинина (CR) показало, что данный белок не обнаруживается в пирамидных нейронах, но идентифицируется в непирамидных нейронах всех слоев гиппокампа (рис. 3а). Продукт реакции локализуется как в телах, так и в отростках этих клеток. Отростки длинные, и часто имеют варикозные расширения по всей длине. Как правило, встречались биполярные, либо мультиполярные нейроны, крупные отростки которых были направленны радиально. Также кальретинин-иммуноположительные клетки и отростки были обнаружены в слоях str. oriens и str. lacunosum-moleculare, однако здесь они были ориентированы тангенциально, вдоль слоя (рис. 3б).
Рис. 3.
Иммуногистохимическая реакция на кальретинин (CR). а – Зона CA1 гиппокампа. Стрелки указывают на CR+-интернейроны, головки стрелок – на CR+-волокна иммунореактивных клеток; SLM – str. lacunosum-moleculare; SR – str. radiatum; SP – str. pyramidale; SO – str. oriens; б – CR+-интернейрон слоя str. oriens с отростком, имеющим варикозные утолщения. в – Число CR+-интернейронов в различных слоях зоны CA1 и CA3 регионов I и II гиппокампа. SLM – str. lacunosum-moleculare; SR – str. radiatum; SL – str. lacunosum; SP – str. pyramidale; SO – str. oriens; * – различия достоверны для p < 0.05; ** – для p < 0.01; *** – для p < 0.001.
Количественная оценка CR+-непирамидных нейронов при сравнении зон CA1 и CA3 по всем слоям показала, что в зоне CA3 CR+-нейронов локализуется больше, по сравнению с CA1 зоной гиппокампа (p = 0.0009). Максимальное число кальретинин-положительных клеток было характерно для слоя str. pyramidale зоны CA3 (рис. 3в). Кроме того, в регионе II этих клеток оказалось значительно больше (в 2 раза), по сравнению с регионом I (p = 0.002). В зоне CA1 слоя str. pyramidale также число этих нейронов оказалось больше для региона II по сравнению с регионом I (p = 0.002). Для этого региона характерно большее число CR+-непирамидных нейронов по сравнению с регионом I также и для str. radiatum зоны CA1 (p = 0.003), для str. lacunosum-moleculare зоны CA3 (p = 0.0008) и слоев str. radiatum, str. lucidum зоны CA3 (p = 0.04) (рис. 3в).
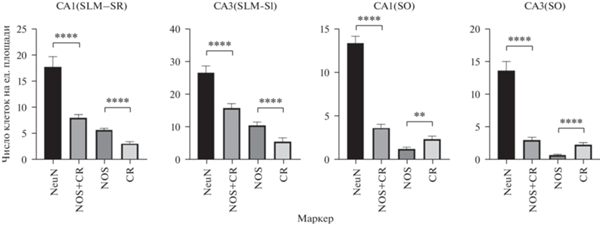
При оценке различий числа клеток, иммунореактивных к NeuN, NOS и CR, было установлено, что различия статистически значимы для группы непирамидных нейронов, выявленных при реакции на NeuN, и группы NOS совместно с СR во всех исследуемых зонах (p < 0.0001). Также статистически значимые различия наблюдаются при сравнении клеток иммунореактивных к NOS и CR во всех исследуемых зонах (рис. 4).
ОБСУЖДЕНИЕ
Интернейроны гиппокампа представляют собой разнообразную группу нейронов, которые различаются не только морфологическими и физиологическими, но и цитохимическими особенностями, что позволяет идентифицировать определенные типы непирамидных нейронов гиппокампа с помощью иммуногистохимических методов. Среди таких маркеров можно выделить NO-синтазу (NOS), кальретинин (CR), парвальбумин, соматостатин, вазоинтестинальный пептид (VIP) и др. (Booker, Vida, 2018). Настоящее исследование было сфокусировано на анализе нитороксидергических и кальретинин-содержащих интернейронов гиппокампа, как одних из наименее охарактеризованных типов интернейронов.
При анализе препаратов, окрашенных на NOS, были идентифицированы нейроны, характеризующиеся бисеровидными утолщениями отростков, которые преимущественно локализовались в слоях str. lacunosum-moleculare и str. radiatum, а также встречались в слое str. pyramidale. В литературных источниках описаны два типа интернейронов гиппокампа, содержащих NOS. К ним относятся нейроглиоформные клетки (neurogliaform cells) и плющевидные клетки (Ivy cells) и интернейроны, ингибирующие активность других интернейронов, 3-его типа (Interneuron selective interneurons type 3, ISI-3 клетки) (Pelkey et al., 2017). NOS+-интернейроны, локализующиеся в слое str. lacunosum-moleculare, можно отнести к нейроглиоформным клеткам, так как только этот тип NOS+ интернейронов локализуется в данном слое. Для плющевидных и ISI-3 клеток типична локализация в str. radiatum и str. pyramidale (Booker, Vida, 2018; Guet-McCreight et al., 2020).
CR-содержащие интернейроны в настоящей работе встречались во всех слоях зон CA1 и CA3 гиппокампа. Известно, что в гиппокампе CR+-клетками являются интернейроны, ингибирующие активность других интернейронов (ISI cells), среди которых выделяют три типа по цитохимическим, топографическим и функциональным особенностям. CR+-интернейроны, обнаруженные в слое str. lacunosum-moleculare и на границе этого слоя со слоем str. radiatum, можно отнести к ISI клеткам 2-го типа. В слоях str. pyramidale и str. radiatum располагаются ISI 1-го и 3-его типов, в то время как лежащие тангенциально вдоль слоя CR+ клетки в слое str. oriens относятся только к ISI клеткам 1-го типа (Pelkey et al., 2017; Booker, Vida, 2018; Guet-McCreight et al., 2020). Выявленные нами CR+-волокна в str.lacunosum-moleculare зон CA1 и CA3 являются аксонами глутаматергических CR-содеражащих нейронов маммилярных и таламических ядер (Tóth, Maglóczky, 2014). Кальретинин-положительные волокна слоя str. oriens могут оказаться аксонами и дендритами интернейронов этого слоя. Была выявлена группа CR+-интернейронов слоя str. oriens, посылающих аксон к ядрам медиальной перегородки (Gulyás et al., 1996).
Известно, что зоны гиппокампа CA1 и CA3 выполняют различные функции и отличаются не только по морфологии пирамидных нейронов и экспрессии в них ряда маркеров (Meyer, Radulovic, 2021), но также и составом интернейронов в этих регионах. В нашем исследовании установлено, что общее количество интернейронов в зоне CA3 превышает таковое в зоне CA1. Зона CA3 отличается более выраженной модуляцией активности нейронов с помощью ГАМК, по сравнению с зоной CA1 (Suzuki, Okada, 2007; Alkadhi, 2019). Это может объясняться тем, что зона CA3 является промежуточным звеном перфоратного пути (между гранулярными клетками зубчатой фасции и пирамидными нейронами зоны CA1 гиппокампа) (Lorente de Nò, 1934), и, вероятно, для данной области более важно обеспечение вариативности регуляторных механизмов, контролирующих различные афферентные волокна и, соответственно, активность пирамидных нейронов зоны CA3. Наибольшее количество NOS+-интернейронов также характерно для str. lucidum и str. lacunosum-moleculare зоны CA3. Показано, что нейроглиаформные клетки вносят существенный вклад в ингибирование гранулярных клеток зубчатой фасции и сравнительно недавно открытых гранулярных клеток зон CA2 и CA3 (Price et al., 2005; Krook-Magnuson et al., 2012; Lau et al., 2017), что может объяснить функциональную значимость NOS-реактивных интернейронов поверхностных слоев и str. pyramidale этих зон. Наибольшее количество CR+-интернейронов было зарегистрировано в пирамидном слое CA3. Здесь они необходимы для подавления активности интернейронов, ингибирующих дистальные отделы дендритов пирамидных нейронов, таким образом, обеспечивая локальную активацию пирамидных нейронов зоны CA3. Известно, что популяция непирамидных нейронов, экспрессирующих соматостатин (SOM), также иннервируется CR+-интернейронами (Tyan et al., 2014).
В настоящее время известно, что существуют функциональные и морфологические различия между областями гиппокампа вдоль септотемпоральной оси, на основании которых выделяют дорсальный, промежуточный и вентральный гиппокамп (Farahimanesh et al., 2018; Gergues et al., 2020; Lothmann et al., 2021; Levone et al., 2021). Одной из самых изученных функций дорсальной области гиппокампа считается консолидация долговременной пространственной памяти, которая может быть следствием генерации долговременных депрессий синаптической передачи, после долговременных потенциаций в зубчатой фасции и в зоне CA1 в данном регионе (Kemp, Manahan-Vaughan, 2008). В ходе другого недавнего исследования, было показано, что в сходных условиях генерации долговременной депрессии не происходит в промежуточном субрегионе гиппокампа, где регистрировалась только кратковременная депрессия. Это, вероятно, вызвано быстрой обработкой поступающей информации и может быть связано с участием промежуточного гиппокампа в формировании кратковременной памяти (Bikbaev, Manahan-Vaughan, 2008). Основой перечисленных выше различий могут быть вариации в качественном и количественном составе интернейронов промежуточного и дорсального отделов гиппокампа. В настоящем исследовании вдоль септотемпоральной оси были выделены две области, которые топографически могут соответствовать областям в дорсальном (3–4.36 мм – Регион I) и промежуточном (4.36–5.52 мм – Регион II) гиппокампе. Количественная оценка интернейронов показала, что в некоторых слоях гиппокампа число изучаемых типов непирамидных нейронов различаются по выделенным двум регионам. Так, общее количество интернейронов в поверхностных слоях зоны CA3 оказалось большим в промежуточном гиппокампе, по сравнению с дорсальным субрегионом. В str. oriens наблюдалась противоположная картина, здесь количество NeuN-содержащих непирамидных нейронов зоны CA3 дорсального гиппокампа было больше, по сравнению с соответствующей областью промежуточного субрегиона. Часть клеток, локализованная в str. oriens CA3 дорсального гиппокампа, по своей морфологии соответствует OLM-клеткам (oriens/alveus interneurons with lacunosum-moleculare axon arborization) (Mikulovic et al., 2015). Данные интернейроны посылают аксон в str. lacunosum-moleculare, ингибирующий дистальные дендриты пирамидных клеток и контролируя афферентный вход от нейронов энториальной коры и таламуса (Klausberger, 2009). Возможно, регуляция данного звена нейронной цепи имеет большее значение в дорсальном гиппокампе. Роль OLM-клеток в ритмогенезе подтверждается рядом исследований, в связи с чем они могут играть важную роль в механизме формирования памяти (Klausberger et al., 2003; Gulyás et al., 2003; Antonoudiou et al., 2020). Содержание NOS+-интернейронов слоя str. pyramidale зоны CA1 оказалось выше в дорсальном гиппокампе, по сравнению с той же областью промежуточного субрегиона. За счет большего количества NOS-реактивные клетки, вероятно, индуцируют в дорсальном гиппокампе более выраженный и зависимый от тета-колебаний тормозящий постсинаптический потенциал в пирамидных нейронах CA1 (Price et al., 2005). Это может быть важно для обеспечения регуляции тета-ритма и переключения работы пирамидных нейронов CA1 между режимами, которые зависят от прямых афферентных путей от энториальной коры в str. lacunosum-moleculare и путей от коллатерали Шаффера (Meyer, Radulovic, 2021). Большее количество CR+-интернейронов, найденных в пирамидном и поверхностных слоях зон CA1 и CA3 промежуточного гиппокампа, по сравнению с аналогичными слоями в дорсальном гиппокампе, может говорить о большей степени растормаживания нейронной сети, путем подавления активности интернейронов, формирующих синаптические связи с дистальными отделами дендритов пирамидных нейронов, что может иметь значение для кратковременной памяти. Также было отмечено максимальное количество NeuN+-интернейронов в поверхностных слоях зоны CA3, большая часть которых должна соответствовать интернейронам, иннервирующим дистальные отделы дендритов пирамидных нейронов, регуляцию которых осуществляют CR+-интернейроны, численность которых здесь также высока. Популяция CR+-интернейронов зоны CA3 может играть важную роль и в регуляции активности интернейронов слоя str. oriens, например, OLM-клеток (Gulyás et al., 1996).
Известно, что в нервной ткани ядерный антиген NeuN обнаруживается в большинстве зрелых нейронов (Gusel’nikova, Korzhevskiy, 2015), что позволяет выявить как пирамидные, так и непирамидные нейроны вне зависимости от их цитохимических маркеров. Было отмечено, что NeuN+-интернейронов значительно больше, по сравнению с интернейронами CR+ и NOS+. Это может указывать на то, что эти интернейроны составляют относительно небольшую долю интернейронов гиппокампа. Популяции CR+ и NOS+ интернейронов существенно меньше по численности, поскольку данные маркеры не характерны для многих групп интернейронов, в том числе иннервирующих дистальные отделы пирамидных нейронов, а также для корзинчатых и аксо-аксональных клеток, которые относятся к группе паравальбумин-содержащих интернейронов и которые являются доминирующей (примерно 50% всех интернейронов) и одной из наиболее хорошо охарактеризованных типов интернейронов (Klausberger, 2009; Tóth, Maglóczky, 2014; Booker, Vida, 2018).
Таким образом, в ходе настоящего исследования были установлены качественные и количественные различия популяций нитроксидэргических и кальретинин-содержащих непирамидных нейронов зон CA1 и CA3 гиппокампа крысы. Было продемонстрировано, что в зоне CA3 наблюдается большее число непирамидных нейронов, чем в зоне CA1. Были выявлены различия в составе и количестве непирамидных нейронов в выбранных для анализа регионах (регион I и регион II), которые относятся к дорсальному и промежуточному гиппокампу соответственно. Было установлено, что NOS+-интернейроны более характерны для дорсального гиппокампа, в то время как большее число CR+-интернейронов представлено в промежуточном гиппокампе. Полученные в ходе исследования данные указывают на необходимость раздельного анализа клеточного состава интернейронов различных регионов гиппокампа при проведении физиологических исследований.
Список литературы
Alkadhi K.A. 2019. Cellular and molecular differences between area CA1 and the dentate gyrus of the hippocampus. Mol. Neurobiol. V. 56. P. 6566. https://doi.org/10.1007/S12035-019-1541-2
Amaral D.G., Insausti R., Cowan W.M. 1984. The commissural connections of the monkey hippocampal formation. J. Comp. Neurol. V. 224. P. 307. https://doi.org/10.1002/CNE.902240302
Antonoudiou P., Tan Y.L., Kontou G., Louise Upton A., Mann E.O. 2020. Parvalbumin and somatostatin interneurons contribute to the generation of hippocampal gamma oscillations. J. Neurosci. V. 40. P. 7668. https://doi.org/10.1523/JNEUROSCI.0261-20.2020
Bikbaev A., Manahan-Vaughan D. 2008. Relationship of hippocampal theta and gamma oscillations to potentiation of synaptic transmission. Front. Neurosci. V. 2. P. 56. https://doi.org/10.3389/NEURO.01.010.2008
Booker S.A., Vida I. 2018. Morphological diversity and connectivity of hippocampal interneurons. Cell Tissue Res. V. 373. P. 619. https://doi.org/10.1007/S00441-018-2882-2
Burgess N., Maguire E.A., O’Keefe J. 2002. The human hippocampus and spatial and episodic memory. Neuron. V. 35. P. 625. https://doi.org/10.1016/S0896-6273(02)00830-9
Farahimanesh S., Karimi S., Haghparast A. 2018. Role of orexin-1 receptors in the dorsal hippocampus (CA1 region) in expression and extinction of the morphine-induced conditioned place preference in the rats. Peptides. V. 101. P. 25. https://doi.org/10.1016/J.PEPTIDES.2017.12.017
Gergues M.M., Han K.J., Choi H.S., Brown B., Clausing K.J., Turner V.S., Vainchtein I.D., Molofsky A.V., Kheirbek M.A. 2020. Circuit and molecular architecture of a ventral hippocampal network. Nat. Neurosci. V. 23. P. 1444. https://doi.org/10.1038/S41593-020-0705-8
Guet-McCreight A., Skinner F.K., Topolnik L. 2020. Common principles in functional organization of VIP/calretinin cell-driven disinhibitory circuits across cortical areas. Front. Neural Circuits. V. 14. P. 32. https://doi.org/10.3389/FNCIR.2020.00032/BIBTEX
Gulyás A.I., Hájos N., Freund T.F. 1996. Interneurons containing calretinin are specialized to control other interneurons in the rat hippocampus. J. Neurosci. V. 16. P. 3397. https://doi.org/10.1523/JNEUROSCI.16-10-03397.1996
Gulyás A.I., Hájos N., Katona I., Freund T.F. 2003. Interneurons are the local targets of hippocampal inhibitory cells which project to the medial septum. The Eur. J. Neurosci. V. 17. P. 1861. https://doi.org/10.1046/J.1460-9568.2003.02630.X
Gusel’nikova V.V., Korzhevskiy D.E. 2015. NeuN as a neuronal nuclear antigen and neuron differentiation marker. Acta naturae. V. 7. P. 42. https://doi.org/10.32607/20758251-2015-7-2-42-47
Kemp A., Manahan-Vaughan D. 2008. The hippocampal CA1 region and dentate gyrus differentiate between environmental and spatial feature encoding through long-term depression. Cereb. Cortex. V. 18. P. 968. https://doi.org/10.1093/CERCOR/BHM136
Klausberger T., Magill P.J., Márton L.F., Roberts J.D.B., Cobden P.M., Buzsáki G., Somogyi P. 2003. Brain-state- and cell-type-specific firing of hippocampal interneurons in vivo. Nature. V. 421. P. 844. https://doi.org/10.1038/NATURE01374
Krook-Magnuson E., Varga C., Lee S.H., Soltesz I. 2012. New dimensions of interneuronal specialization unmasked by principal cell heterogeneity. Trends Neurosci.V. 35. P. 175. https://doi.org/10.1016/J.TINS.2011.10.005
Lau P.Y.P., Katona L., Saghy P., Newton K., Somogyi P., Lamsa K.P. 2017. Long-term plasticity in identified hippocampal GABAergic interneurons in the CA1 area in vivo. Brain Struct. Funct. V. 222. P. 1809. https://doi.org/10.1007/S00429-016-1309-7
Leite J.P., Chimelli L., Terra-Bustamante V.C., Costa E.T., Assirati J.A., De Nucci G., Martins A.R. 2002. Loss and sprouting of nitric oxide synthase neurons in the human epileptic hippocampus. Epilepsia. V. 43 Suppl. 5. P. 235. https://doi.org/10.1046/J.1528-1157.43.S.5.29.X
Levone B.R., Codagnone M.G., Moloney G.M., Nolan Y.M., Cryan J.F., O’Leary O.F. 2021. Adult-born neurons from the dorsal, intermediate, and ventral regions of the longitudinal axis of the hippocampus exhibit differential sensitivity to glucocorticoids. Mol. Psychiatry. V. 26. P. 3240. https://doi.org/10.1038/S41380-020-0848-8
Lothmann K., Deitersen J., Zilles K., Amunts K., Herold C. 2021. New boundaries and dissociation of the mouse hippocampus along the dorsal-ventral axis based on glutamatergic, GABAergic and catecholaminergic receptor densities. Hippocampus. V. 31. P. 56. https://doi.org/10.1002/HIPO.23262
Lorente de Nò R. 1934. Studies on the structure of the cerebral cortex. Journal für Psychologie und Neurologie. V. 46. P. 113.
Meyer M.A.A., Radulovic J. 2021. Functional differentiation in the transverse plane of the hippocampus: An update on activity segregation within the DG and CA3 subfields. Brain Res. Bull. V. 171. P. 35. https://doi.org/10.1016/J.BRAINRESBULL.2021.03.003
Mikulovic S., Restrepo C.E., Hilscher M.M., Kullander K., Leão R.N. 2015. Novel markers for OLM interneurons in the hippocampus. Front. Cell Neurosci.V. 9. P. 201. https://doi.org/10.3389/FNCEL.2015.00201
Paxinos G., Watson C. 2007. The rat brain in stereotaxic coordinates, 6th edition. N.Y.: Elsevier/Academic Press. 456 p. https://doi.org/10.1016/S0166-2236(84)80278-7
Pelkey K.A., Chittajallu R., Craig M.T., Tricoire L., Wester J.C., McBain C.J. 2017. Hippocampal GABAergic inhibitory interneurons. Physiol. Rev. V. 97. P. 1619. https://doi.org/10.1152/PHYSREV.00007.2017
Price C.J., Cauli B., Kovacs E.R., Kulik A., Lambolez B., Shigemoto R., Capogna M. 2005. Neurogliaform neurons form a novel inhibitory network in the hippocampal CA1 area. J. Neurosci. V. 25. P. 6775. https://doi.org/10.1523/JNEUROSCI.1135-05.2005
Squire L.R. 2004. Memory systems of the brain: a brief history and current perspective. Neurobiol. Learn Mem. V. 82. P. 171. https://doi.org/10.1016/J.NLM.2004.06.005
Suzuki E., Okada T. 2007. Regional differences in GABAergic modulation for TEA-induced synaptic plasticity in rat hippocampal CA1, CA3 and dentate gyrus. Neurosci. Res. V. 59. P. 183. https://doi.org/10.1016/J.NEURES.2007.06.1472
Tóth K., Ero’ss L., Vajda J., Halász P., Freund T.F., Maglóczky Z. 2010. Loss and reorganization of calretinin-containing interneurons in the epileptic human hippocampus. Brain. V. 133. P. 2763. https://doi.org/10.1093/BRAIN/AWQ149
Tóth K., Maglóczky Z. 2014. The vulnerability of calretinin-containing hippocampal interneurons to temporal lobe epilepsy. Front. Neuroanat. V. 8. P. 100. https://doi.org/10.3389/FNANA.2014.00100
Tyan L., Chamberland S., Magnin E., Camiré O., Francavilla R., Suzanne David L., Deisseroth K., Topolnik L. 2014. Dendritic inhibition provided by interneuron-specific cells controls the firing rate and timing of the hippocampal feedback inhibitory circuitry. J. Neurosci. V. 34. P. 4534. https://doi.org/10.1523/JNEUROSCI.3813-13.2014
Zhou X. yan, Zhang F., Ying C. jiang, Chen J., Chen L., Dong J., Shi Y., Tang M., Hu X. tong, Pan Z. hua, Xu N. na, Zheng K. yang, Tang R. xian, Song Y. jian. 2017. Inhibition of iNOS alleviates cognitive deficits and depression in diabetic mice through downregulating the NO/sGC/cGMP/PKG signal pathway. Behav. Brain Res.V. 322. P. 70. https://doi.org/10.1016/J.BBR.2016.12.046
Дополнительные материалы отсутствуют.