Цитология, 2022, T. 64, № 3, стр. 183-207
Скаффолды – носители лекарственных средств и биологических молекул для биоинженерии костной ткани
И. А. Хлусов 1, 2, Е. Д. Порохова 1, 2, Е. Г. Комарова 1, Е. А. Казанцева 1, 3, Ю. П. Шаркеев 1, К. А. Юрова 4, Л. С. Литвинова 4, *
1 Лаборатория физики наноструктурных биокомпозитов Института физики прочности и материаловедения СО РАН
634055 Томск, Россия
2 Кафедра морфологии и общей патологии Сибирского государственного медицинского университета
634050 Томск, Россия
3 Кафедра прочности и проектирования Национального исследовательского Томского государственного университета
634050 Томск, Россия
4 Центр иммунологии и клеточных биотехнологий Балтийского федерального университета им. И. Канта
236041 Калининград, Россия
* E-mail: larisalitvinova@yandex.ru
Поступила в редакцию 02.02.2022
После доработки 05.03.2022
Принята к публикации 10.03.2022
- EDN: YRNSWN
- DOI: 10.31857/S0041377122030051
Аннотация
Тема систем доставки разнообразных лекарственных средств и биологических молекул, включая скаффолд-технологии, актуальна, сложна и многогранна, но освещена в научной литературе фрагментарно. Во многих публикациях не представлены физико-химические свойства материалов-носителей, особенности их биодеградации, которые могут влиять на высвобождение молекул из матрицы и их фармакологическую активность. В других источниках слабо описаны фармакокинетика препаратов и/или клеточные/тканевые реакции. В результате разрозненная информация затрудняет целенаправленный поиск материала и не позволяет делать однозначные выводы по актуальной проблематике. В связи с этим, на основе обзорных и оригинальных статей собраны и критически осмыслены сведения в области разработки и функционирования скаффолдов как носителей лекарственных и биологических молекул; классифицированы материалы и вещества, применяемые в системах доставки лекарств и биологических молекул, а также клеточные и тканевые реакции при их использовании. Особое внимание в обзоре уделено композитным скаффолдам с кальцийфосфатным компонентом в качестве носителей различных фармакологических агентов как эффективных систем доставки в приложениях к биоинженерии костной ткани.
Разработка и внедрение новых эффективных технологий, материалов и лекарственных средств для реконструкции тканевых дефектов становится лидирующим направлением исследований и коммерциализации во всем мире. Разработка систем капсулирования и адресной доставки лекарств, активных веществ и генетического материала признается одними из приоритетных направлений фундаментальных и прикладных исследований в Российской Федерации с перспективой выхода на мировые рынки к 2030 году (Программа фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 гг.)).
Для поддержания роста, усиления пролиферации и дифференцировки клеток в тканевые структуры активно изучаются “скаффолды” (от английского scaffolds – строительные леса, матрицы, носители, подложки, каркасы), обеспечивающие трехмерную архитектуру для клеточных взаимодействий (Ratner et al., 2004). Скаффолды перспективны при коррекции различных заболеваний и их осложнений (заболевания опорно-двигательного аппарата, сердечно-сосудистые болезни, диабет, опухоли) во многих направлениях тканевой инженерии, включая, но не ограничиваясь, регенерацию костной и хрящевой ткани, восстановление периодонта, сухожилий, роговицы и сердечных клапанов, коррекцию пороков развития носа и ушной раковины, замещение связок, восстановления кожных покровов (Garg et al., 2012).
На мировом рынке медицинских изделий сегмент имплантатов для биоинженерии и замещения дефектов костной ткани, согласно маркетинговому исследованию компании Stratistics MRC (США, http://www.strategymrc.com), является одним из самых быстроразвивающихся (прогнозируемый трехкратный прирост в период с 2015 по 2022 г.) со среднегодовым темпом роста 18.6% к 2022 г. (Orthopedic Biomaterials – Global Market Outlook (2015–2022)). Тем не менее, многие проблемы остеосинтеза (остеопоретические изменения кости, несрастающиеся переломы, формирование ложных суставов и пр.) и эндопротезирования (разрушение и расшатывание имплантатов), включая перипротезные инфекционные осложнения вообще (Kapadia et al., 2016) и в онкохирургии костей, в частности (Lin et al., 2021), имеют тенденцию к нарастанию.
Одним из направлений преодоления сложившегося кризиса представляется использование скаффолдов, подходящих для доставки в патологический очаг и высвобождения фармакологических агентов, обладающих терапевтическим и/или регенераторным потенциалом (Garg et al., 2012). Функционализация объема и/или поверхности скаффолдов посредством биологических и лекарственных молекул (Czekanska et al., 2018) призвана улучшить эффективность тканевой инженерии и регенеративной медицины; соответственно, скаффолды становятся носителями и средствами доставки веществ для стимуляции тканевой регенерации посредством активации эндогенных стволовых клеток, контроля процессов воспаления и опухолевого роста, профилактики/лечения инфекционных осложнений. При этом скаффолды должны способствовать стабильному, пролонгированному и, по возможности, контролируемому высвобождению лекарств с достижением высоких локальных концентраций, уменьшением системных и побочных эффектов фармакологических агентов и, соответственно, стоимости лечения хронических дегенеративных заболеваний.
Тема разработки, изучения принципов работы и применения систем доставки разнообразных лекарственных средств и биологических молекул, включая скаффолд-технологии, сложна, многогранна и в настоящее время освещена в научной литературе недостаточно. Во многом это обусловлено научной специализацией авторов публикаций (материаловедение, фармакология, клеточные технологии). Так, некоторые авторы обращают особое внимание на классификацию (например, Garg et al., 2012; Sayed et al., 2017), методы получения и физико-химические свойства скаффолдов-носителей препаратов (Bose, Tarafder, 2012; Sayed et al., 2017; Limongi et al., 2020); в других работах внимание ацентируется на некоторые принципы создания и функционирования систем доставки, пути высвобождения лекарств и биомолекул (Porter et al., 2009; Zeng et al., 2019). Обширными, но разобщенными направлениями в литературе являются иммобилизация в материалы и скаффолды лекарств и биомолекул различных классов (Bose, Tarafder, 2012; Ferracini et al., 2018), а также апробация разрабатываемых систем доставки in vitro и/или in vivo (Tenkumo et al., 2020; Paulini et al., 2022). Во многих публикациях либо не охарактеризованы физико-химические свойства материалов-носителей, особенности их биодеградации, которые могут влиять на высвобождение молекул из матрицы и их фармакологическую активность, либо слабо описаны фармакокинетика препаратов и/или клеточные/тканевые реакции. Как следствие, разрозненная информация затрудняет целенаправленный поиск материала и не позволяет делать однозначные выводы по актуальной проблематике.
В связи с этим, на основе обзорных и оригинальных статей собраны и критически осмыслены сведения в области разработки и функционирования скаффолдов как носителей лекарственных и биологических молекул; классифицированы материалы и вещества, применяемые в системах доставки лекарств и биологических молекул, а также клеточные и тканевые реакции при их использовании, преимущественно, в приложении к биоинженерии костной ткани.
СКАФФОЛДЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВ И БИОЛОГИЧЕСКИХ МОЛЕКУЛ
Варианты имплантируемых (в качестве покрытий или скаффолдов) или инъецируемых скаффолдов/цементов для доставки клеток и/или молекул весьма разнообразны (Zeng et al., 2019) и могут в себя включать (самостоятельно или в виде композитов) (Garg et al., 2012) по структуре и/или форме: 1) трехмерные (3D) пористые конструкции; 2) (нано)волокнистые матрицы; 3) микро- и наносферы. По природе материала: 1) металлы, их оксиды и сплавы (Sayed et al., 2017); 2) деминерализованный костный матрикс (Van de Putte, Urist, 1965); 3) фосфаты кальция (гидроксиапатит (ГАП), ди-, три- и октакальцийфосфаты (КФ)) (Bose, Tarafder, 2012; Garg et al., 2012; Liang et al., 2020); 3) биоактивные стекла (силикатные, боратные, фосфатные, боросиликатные) и их композиты (Ge et al., 2019); 4) натуральные (альгинат, коллаген, хитозан, желатин, фибрин, фибронектин, фиброин шелка, альбумин, декстран, гепарин и др.) или синтетические полимеры (в частности, полилактид, полигликолид, поликапролактон, поливиниловый спирт, полиуритан, полиалконоаты и их сополимеры) (Santoro et al., 2014; Abdel-Fattah et al., 2015; Bhattacharjee et al., 2017; Zhang et al., 2018; Huang et al., 2019; Литвинова и др., 2020; Shafabakhsh et al., 2020); 5) кремний и его оксиды (Sayed et al., 2017); 8) углеродные материалы (Yadavalli et al., 2019).
По размерам пор 3D-скаффолды как системы доставки разделяют на: 1) макропористые (диаметр пор более 50 нм); 2) мезопористые (2–50 нм); 3) микропористые (диаметр менее 2 нм) (Sayed et al., 2017) согласно The International Union of Pure and Applied Chemistry (IUPAC) (Arruebo, 2012). Существует определенное противоречие различных классификаций, поскольку с точки зрения тканевой инженерии (Ebrahimi, 2021) распределение материалов по размерности пор выглядит следующим образом: 1) макропористые (диаметр пор более 100 мкм); 2) микропористые (1–100 мкм); 3) субмикропористые (0.1–1 мкм); 4) нанопористые (менее 100 нм).
В свою очередь, среди материалов с разной природой, структурой, формой и размерами, по особенностям реакций на раздражители выделяют отдельный класс “интеллектуальных” (Ju et al., 2009) или “умных” (Montoya et al., 2021) систем (инертных, активных, чувствительных, саморегулируемых), предсказуемо реагирующих изменением свойств на вариации температуры, ионной силы раствора, концентрации веществ, электромагнитного поля, ультразвука, смачиваемости и топографии поверхности и т.п.
Методы получения скаффолдов, включая современные аддитивные технологии (Wang et al., 2016; Yan et al., 2019; Limongi et al., 2020), обширны и многократно описаны (например, Raeisdasteh Hokmabad et al., 2017; Sayed et al., 2017). Следует отметить, что загрузка биологически активных веществ в материал скаффолдов на этапе их изготовления значительно сужает круг методов получения систем доставки, поскольку влияние химических растворителей и высоких температур оказывает разрушающее действие на биомолекулы.
ОСНОВНЫЕ ПРИНЦИПЫ ФУНКЦИОНИРОВАНИЯ СИСТЕМ ДОСТАВКИ НА ОСНОВЕ СКАФФОЛДОВ ДЛЯ КОСТНОЙ ТКАНИ
Системное введение лекарственных веществ и/или биологических молекул часто является малоэффективным вследствие их короткого времени жизни (особенно в физиологических средах), неизбирательного биораспределения, потенциальной токсичности и риска канцерогенной активности. Таким образом, включение биоактивных веществ в скаффолд позволяет, теоретически, решать несколько основных задач: обеспечение локализованной доставки оптимальных концентраций фармакологических агентов; сохранение биологической активности молекул; контролируемое высвобождение веществ в течение необходимого периода времени; снижение системной токсичности.
Дополнительными преимуществами рельефных (пористых (диаметр пор 50–150 мкм) и/или шероховатых скаффолдов (биодеградируемых и нерастворимых), как носителей лекарств и биомолекул, является их способность модулировать активность стволовых клеток и иммунной системы, способствовать ангиогенезу, необходимому для процессов костного ремоделирования (Sundelacruz, Kaplan, 2009; Li et al., 2019; Khlusov et al., 2020).
Основные варианты разработки систем доставки описаны в многочисленных работах, например (Porter et al., 2009; Sundelacruz, Kaplan, 2009). Мы представили на рис. 1 общие принципы создания и функционирования систем доставки лекарств и биомолекул, основываясь на одном из последних обзоров (Zeng et al., 2019).
Рис. 1.
Общие принципы создания и функционирования систем доставки лекарств и биомолекул (по Zeng et al., 2019).
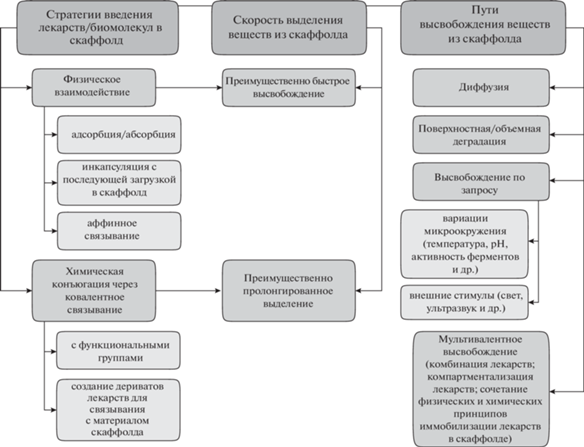
При разработке конкретных систем доставки способ загрузки в скаффолд-носитель лекарственных средств и биологических молекул вытекает из конечной цели их создания (свойства препарата, требуемая скорость/время и концентрация выделения вещества, место применения), базируется на двух основных методах их связывания с материалом – физическом и химическом (рис. 1). Физический способ загрузки достаточно простой и эффективный, использует разнообразные принципы (поверхностная адсорбция или объемная абсорбция, инкапсуляция, ионное комплесирование, афинное связывание) и методы заполнения матрицы (экстракция из растворителя, механический способ, высокое давление, смешивание в горячем расплаве и др.), которые минимально влияют на лекарственное средство и его эффективность. В то же время, физическая загрузка приводит, как правило, к быстрому высвобождению веществ из скаффолдов (за исключением некоторых видов инкапсулирования), слабое взаимодействие вещества и материала скаффолда ограничивает равномерность выделения лекарства. Химический способ загрузки помогает преодолеть данные ограничения, увеличить время выделения (рис. 1) и стабилизировать концентрацию высвобождаемых препаратов. Однако, в некоторых случаях, например, при загрузке антибиотиков, их медленное выделение в низких концентрациях может способствовать развитию микробной антибиотикорезистентности (Parent et al., 2017).
В свою очередь, активно изучаются принципы функционирования систем доставки, сложные по своей природе, поскольку они основаны на свойствах лекарств и биомолекул, параметрах матриц-носителей (например, способности к биодеградации, степени “интеллектуальности” и др.), принципах создания (физических, химических) самих скаффолдов и систем доставки в целом, что, в совокупности, определяет пути и скорость высвобождения препаратов (рис. 1). До конца нерешенными, в сравнении с обычным использованием лекарственных средств, являются вопросы фармакокинетики и фармакодинамики, поддержания терапевтической концентрации (Zeng et al., 2019), чувствительности таргетных клеточных систем и тканей в организме.
ОСНОВНЫЕ ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА И БИОМОЛЕКУЛЫ В СИСТЕМАХ ДОСТАВКИ ДЛЯ БИОИНЖЕНЕРИИ КОСТНОЙ ТКАНИ
В различных исследованиях изучали внедрение в системы доставки таких лекарственных и биологических молекул, как антимикробные и противовоспалительные препараты, цитокины и факторы роста, нуклеиновые кислоты, гормоны, цитостатики (табл. 1) (Garg et al., 2012; Limongi et al., 2020). В качестве клинических приложений рассматриваются различные нозологические формы патологии костной ткани: длительно несрастающиеся переломы (антибиотики, остеоиндуктивные агенты), остеомиелит (антибиотики), остеоартрозы/остеоартриты (декстран), остеонекроз (симвастатин), остеосаркома и костные метастазы (доксорубицин) (Ferracini et al., 2018), остеопороз (бисфосфонаты, паратиреоидный гормон) (Asafo-Adjei et al., 2016; Wang et al., 2018).
Таблица 1.
Примеры перспективных препаратов и биологических молекул в составе скаффолдов и других систем доставки для повышения эффективности биоинженерии костной ткани
| Название | Цель использования | Ссылки |
|---|---|---|
| Бисфосфонаты | ||
| Бисфосфонаты (хлордронат, этидронат), включая азотсодержащие формы (ризедронат, алендронат, ибандронат, золедронат и др.) | Антирезорбтивная активность и усиление минеральной плотности костей при остеопорозе и раковых метастазах в кость за счет преимущественного подавления остеокластов. Азотсодержащие БФ имеют более высокую аффинность к апатитам. Нет существенных различий в клинической эффективности разных классов БФ | Nancollas et al., 2006; Puljula et al., 2015; Ferracini et al., 2018; Zeng et al., 2019; Bae et al., 2021 |
| Антимикробные средства | ||
| Тетрациклин, доксициклин; гентамицин; ванкомицин; цефалексин | Антимикробный эффект с риском формирования микробной резистентности к препаратам | Bose, Tarafder, 2012 |
| Ионы металлов (Ag, Zn, Cu и др.) | Антимикробный эффект; профилактика образования бактериальной биопленки; отсутствие
микробной резистентности к препаратам Стимуляция (за исключением Ag) регенераторного потенциала клеток кости и костного мозга |
Wang, Yeung, 2017; Rizwan et al., 2018; Sedelnikova et al., 2019 |
| Противоопухолевые препараты | ||
| Метотрексат; Цисплатина; Доксорубицин |
Инкапсуляция и/или включение в состав скаффолдов (прежде всего, костного цемента) для профилактики минимальной остаточной болезни, метастазов и микробных осложнений. Снижение системной токсичности химиотерапии, усиление противоопухолевой эффективности препаратов | Yang et al., 2009; Tanzawa et al., 2011; Ferracini et al., 2018 |
| Полипептидные факторы роста и гормоны | ||
| Морфогенетические белки кости (Bone morphogenic proteins; BMPs) | Индукция роста кости из мезенхимных стволовых клеток (МСК) без инициации остеокластов | Boontheekul, Mooney, 2003; Kempen et al., 2010; Bose, Tarafder, 2012; Liang et al., 2020 |
| Трансформирующий фактор роста-β (Transforming growth factor-β; TGF-β) | Способствует росту кости за счет стимуляции миграции клеток-предшественников, регуляции их пролиферации, дифференцировки и синтеза костного матрикса. Подавляет пролиферацию и дифференцировку предшественников остеокластов | |
| Фактор роста фибробластов (Fibroblast growth factor; FGF) | Стимулирует ранозаживление; усиливает пролиферацию остеобластов, что способствует ангиогенезу | |
| Фактор роста тромбоцитов (Platelet-derived growth factor; PDGF) | Активирует ранозаживление, пролиферацию костных клеток и ангиогенез | |
| Инсулиноподобный фактор роста (Insulin-like growth factor; IGF) | Ситмулирует пролиферацию остеобластов, синтез костного матрикса и активность остеокластов | |
| Фактор роста эндотелия сосудов (Vascular endothelial growth factor; VEGF) | Индуцирует ангиогенез и неоваскуляризацию посредством усиления миграции, пролиферации и выживания эндотелиоцитов | |
| Антагонист рецептора к интерлейкину-1 (IL-1Ra) | Противовоспалительные свойства при остеоартрите: уве-личение биоактивности и периода полураспада молекулы; снижение дегенеративных изменений хрящевой ткани | Whitmire et al., 2012 |
| Гены факторов роста | Доставка и экспрессия генов в клетках организма-хозяина для преодоления проблемы иммуногенности, короткого периода жизни и необходимости применения высоких доз рекомбинантных факторов роста | Kofron, Laurencin, 2006; Phillips et al., 2007; Malek-Khatabi et al., 2020 |
| Паратиреоидный гормон | Повышение минерализации костной мозоли и ремоделирования кости в месте перелома | Ferracini et al., 2018 |
| Другие классы препаратов и биомолекул | ||
| микроРНК | Биотехнологические подходы к позитивной/негативной внутриклеточной регуляции стволовых, прогениторных и опухолевых клеток, в том числе, кости, на (пост)транскрипционном уровне | Eskildsen et al., 2011; Zhou et al., 2014; Peng et al., 2015 |
| “молчащие” РНК (siRNA) | Ferracini et al., 2018 | |
| “Малые” молекулы (ресвератрол; стронция ранелат; хелидонат кальция; кальций; литий;
дексаметазон; глицерофосфат; аскорбиновая кислота; аденозин; статины; апатиниб и др.) |
Молекулярная масса молекул обычно менее 900 Дальтон (Ferracini et al., 2018). Регуляция
определенных клеток-мишеней (МСК, остеобласты, остеокласты, эндотелиоциты) для усиления
остеогенной дифференцировки
in vitro и ремоделирования кости in vivo. Апатиниб (ингибитор тирозинкиназы, блокирующий рецепторы VEGF 2-го типа) проходит клинические испытания в приложении к комиплексному лечению остеосаркомы |
Ferracini et al., 2018; Avdeeva et al., 2019; Zhang et al., 2020; Xie et al., 2021 |
| Противовоспалительные (ибупрофен) | Профилактика и снижение интенсивности постимплантационного воспаления | Girod Fullana et al., 2010 |
| Гепарин | Самостоятельная система доставки лекарств и молекул; регулятор остеогенной и ангиогенной активности МСК | Zhang et al., 2018; Литвинова и др., 2020; Норкин и др., 2021 |
Так, бисфосфонаты (БФ) являются производными фосфоновых кислот, содержащими две фосфонатные группы $\left( {{\text{PO}}_{3}^{{2 - }}} \right),$ и синтетическими аналогами природных неорганических пирофосфатов – эндогенных регуляторов минерализации костной ткани, обладающих аффинностью к ионам кальция. Последовательность P–C–P в молекулах БФ устойчива к гидролизу в отличие от P–О–P цепочки в пирофосфатах. БФ, включая их азотсодержащие формы, замедляют темп костного ремоделирования. Они в большей степени подавляют костную резорбцию, чем костеобразование, за счет прямого ингибировании функциональной активности, подвижности остеокластов и их связывания с костной тканью. Такие эффекты сопровождаются увеличением костной массы. В боковых цепях атомов углерода БФ содержатся два радикала, которые используются для химической конъюгации БФ со скаффолдами (Хлусов и др., 2013; Zeng et al., 2019). При этом присутствие КФ материалов в культуре клеток костного мозга in vitro модифицирует биологическую активность БФ (Хлусов и др., 2014).
Остеосаркомы являются часто встречающейся злокачественной опухолью в первые 10–20 лет жизни человека (Morrow, Khanna, 2015). В их лечении применяют традиционные хирургические, радио- и химиотерапевтические подходы. Тем не менее, 5-летняя выживаемость при саркомах мягких тканей не превышает 50–60%, поскольку системная токсичность применяемых цитостатических препаратов резко ограничивает их терапевтическую эффективность. В связи с этим, системы местной доставки цитостатиков и БФ (Ferracini et al., 2018), наряду с другими фармакологическими веществами (остеопонтин, сиалопротеин, малые интерферирующие РНК, микроРНК) (Elazar et al., 2010; Reufsteck et al., 2012; Chen et al., 2019), рассматриваются как перспективная терапевтическая стратегия при опухолях кости и раковых метастазах в кость (табл. 1).
Современной проблемой является перипротезная инфекция (ППИ), особенно в первые два года после эндопротезирования крупных суставов (Ellenrieder et al., 2011; Тихилов и др., 2014), остеосинтеза и других костных операциях. Несмотря на тот факт, что различные антибиотики в составе имплантатов и средств доставки (например, в костном цементе при эндопротезировании) снижают риск ППИ, существует реальная необходимость дополнительной антимикробной модификации поверхности и структуры имплантатов, способствующей снижению их бактериальной колонизации и последующих инфекционных осложнений (Parvizi et al., 2008). В этом плане ионы серебра, меди, цинка (табл. 1) и других металлов (Юрова и др., 2021) рассматриваются как перспективные компоненты систем доставки с точки зрения эффективности, биобезопасности и экономической целесообразности (Parvizi et al., 2013; Wang, Yeung, 2017).
Разнообразной группой биологически активных веществ, модулирующих процессы регенерации костной ткани, являются многочисленные цитокины, хемокины (Khlusov et al., 2020) и факторы роста, обладающие, как правило, плейотропными эффектами. Так, морфогенетические белки кости (bone morphogenic proteins, BMPs) из семейства трансформирующего фактора роста-β (transforming growth factor-β, TGF-β) вызывают локальное образование хрящевой и костной ткани в месте их введения, что позволяет считать их одними из немногих истинных остеоиндукторов (Urist, Strates, 1971). С другой стороны, они оказывают широкое влияние на морфогенез нервных волокон, сосудов, зубов, сердца, лимфатической и кроветворной систем в кооперации с другими регуляторными молекулами, прежде всего, трансформирующим фактором роста-β (Lyons et al., 1990).
Рекомбинантные белки BMP-2 и BMP-7 были рекомендованы Управлением по контролю за продуктами питания и лекарственными средствами США (Food and Drug Administration, FDA) для клинических исследований и приложений к регенерации костной ткани (Kofron, Laurencin, 2006), в том числе на носителях в виде коллагеновой губки или пасты (Ratko et al., 2010). По мере накопления опыта клинического применения BMPs частота осложнений при их системном назначении составила 20–70% со стороны нервной системы и урогенитального тракта; отмечены нарушения заживления ран (гематома, инфицирование), случаи эктопического костеобразования в мягких тканях и повышенная резорбция костей (James et al., 2016). Сдерживающим фактором широкого использования BMPs является также высокая цена (вследствие больших затрат на стадии R&D), несопоставимая с эффективностью белковых препаратов. По состоянию на 2017 г., согласно отчету международной маркетинговой и консалтинговой фирмы iData Research Inc. (США, https://www.idataresearch.com) (US Market Overview for Orthopedic Biomaterials 2017), в США, наиболее объемном сегменте мирового рынка, другие препараты BMPs пока не получили разрешения к широкому клиническому применению. Кроме того, BMPs пока не получили одобрения к клиническому применению у детей, беременных женщин и больных с онкологическими заболеваниями (Emara et al., 2015).
В связи с этим, полипептидные факторы роста привлекли внимание в качестве перспективных наполнителей систем доставки для их локального высвобождения в патологических очагах (табл. 1) в меньшей концентрации, что, соответственно, позволит снизить затраты и риск побочных эффектов при системном назначении. Новым экспериментальным направлением стало развитие генной терапии на основе вирусных, наноразмерных и других систем доставки генов факторов роста (Kofron, Laurencin, 2006; Phillips et al., 2007; Malek-Khatabi et al., 2020).
Еще одним интересным и перспективным биотехнологическим направлением в регенеративной медицине является изучение и применение микроРНК, модулирующих посттранскрипционную активность генов на уровне мРНК. Малые интерфирирующие РНК (siRNA) и микроРНК являются внутриклеточными регуляторами функций (пролиферация, дифференцировка, созревание, апоптоз) стволовых и прогениторных клеток, включая мезенхимные стволовые клетки (МСК) и преостеобласты (Peng et al., 2015; Ferracini et al., 2018). В рамках проблемы локальной доставки нуклеиновых кислот активно изучаются как вирусные (Liao et al., 2014), так и скаффолд-системы (иммобилизация молекул на поверхности и/или в объеме скаффолда) (Eskildsen et al., 2011; Pan et al., 2021) со своими преимуществами и недостатками.
Однако лишь немногие разработки дошли до клинического использования и имеют перспективу для клинических приложений (Kabu et al., 2015) в инженерии костной ткани, несмотря на значительное количество патентов в этой области (например, Farrar et al., 2013; Митриченко и др., 2021). Исключениями считаются местная противоопухолевая химиотерапия, а также введение антибиотиков и антимикробных металлов в системы доставки и ортопедические конструкции (Ellenrieder et al., 2011; Ferracini et al., 2018; Huang et al., 2019). Так, описан успешный клинический случай (табл. 1) применения TiCuN покрытия на имплантатах для профилактики остеомиелита после ревизионного замещения эндопротеза тазобедренного сустава (Ellenrieder et al., 2011). Рекомбинантный паратиреоидный гормон (ПТГ) и его некоторые производные (ПТГ 1–34) разрешены FDA для системного подкожного введения при остеопорозе; изучается эффективность ПТГ при костных переломах (Ferracini et al., 2018), в том числе, в случае локальной доставки в место перелома (Jung et al., 2007). Лимитирующим фактором для иммобилизации ПТГ, как и для других полипептидных молекул, является сохранение их активности при введении в систему доставки и последующем хранении перед использованием (Kothari et al., 2011), а также вопросы предимплантационной стерилизационной подготовки.
КЛЕТОЧНЫЕ И ТКАНЕВЫЕ РЕАКЦИИ НА СКАФФОЛДЫ-НОСИТЕЛИ ЛЕКАРСТВЕННЫХ СРЕДСТВ И БИОЛОГИЧЕСКИХ МОЛЕКУЛ
Примеры применения скаффолдов в исследованиях in vitro
Многообразие комбинаций лекарственных средств и бимолекул (табл. 1), а также материалов, предлагаемых для их доставки в костную ткань, не позволяет даже кратко изложить их в одной обзорной статье. Исторически BMPs рассматриваются как одни из ведущих стимуляторов костеобразования, в том числе в составе скаффолдов-носителей. В одном из последних обзоров (Paulini et al., 2022) представлены клеточные эффекты рекоминантного белка BMP-2, иммобилизованного на носителях из различного материала (коллаген, коллаген/ГАП, гликозаминогликаны, эластин, шелк, полимеры), включая пористые 3D-скаффолды, полученные in vitro различными авторами, в отношении МСК человека и животных. Отмечено усиление клеточной адгезии, повышение экспрессии мРНК генов остеодифференцировки (runt-related transcription factor 2 (RUNX2), остеокальцин (OC)), экспрессии и секреции маркеров остеогенеза (щелочная фосфатаза (alkaline phosphatase, ALP), OC, остеопонтин и костный сиалопротеин), обусловленные выделением BMP-2 из матриц носителей.
Например, Тан с соавторами (Tan et al., 2012) показали in vitro возможность продолжительного (до 21 сут) линейного кумулятивного высвобождения до 80% введеного рекомбинантного белка человека BMP-2 (15 мкг/мл) из частиц ГАП/коллаген, помещенных в альгинатный гидрогель и сформованных в цилиндры. Остеогенная активность BMP-2 фиксировалась авторами in vitro по усилению секреции ALP МСК человека после контакта с экстрактами цилиндров, содержащими фактор роста (табл. 2). Согласно представленным графикам, к 21-м сут активность белка постепенно снижалась (примерно в 2 раза по сравнению с таковой в 1-е сут экстракции) и достигала 60 Ед/л. В случае добавления 0.5 мкг/мл BMP-2 активность ALP в контрольной (без цилиндров) культуре клеток составила 275 Ед/л. Полученные результаты свидетельствовали о возможности длительного выделения полипептидного фактора роста с относительным сохранением его биоактивности. Достоинством работы является краткое описание методов стерилизации отдельных компонентов системы доставки и упоминание, что смешивание и изготовление цилиндрических скаффолдов проводилось в стерильных условиях чистой комнаты.
Таблица 2.
Примеры применения скаффолдов, преимущественно с кальцийфосфатным компонентом, в качестве носителей лекарственных и биологических молекул для биоинженерии костной ткани и замещения ее дефектов (в хронологическом порядке)
| Материал/ композит |
Свойства объемной или поверхностной структуры | Метод получения | Введенное вещество | Метод/кинетика/ эффективность высвобождения молекул |
Клеточные/ тканевые эффекты |
Ссылки |
|---|---|---|---|---|---|---|
| Исследования in vitro | ||||||
| ГАП/ТКФ покрытие на Ti-6Al-4V дисках (диаметр 12.5 мм; толщина 3 мм) | Толщина покрытия
5–80 мкм; масса 8–24 мг |
Электрофорез суспензии ГАП + последующее спекание. Часть образцов дополнительно покрывалась слоем фосфатидилхолина (ФХ) куриного яйца (10–20 мг/мл) |
Ванкомицин 800–1200 мкг/см2; физическая адсорбция из раствора |
Иммерсионный метод в аналоге физиологической жидкости. Экспоненциальное убывание выхода
анти-биотика с 60 мкг/мг покрытия (1 ч экстракции) до следовых количеств после 24
ч; ФХ слой продлевает высвобождение ванкомицина до 72 ч в концентрации 5–20 мкг/мг покрытия |
Подавление роста золотистого стафилококка экстрактами покрытия в первые 24 ч. ФХ слой продлевает антибактериальный эффект до 72 ч |
Radin et al., 1997 |
| ГАП/поликапролактон (PCL) губка 20 × 20 × 6 мм3 (масса 0.8–1 г) | Свободные связанные поры (диаметр 150–200 мкм); общая пористость 87% | Погружение пористо-сетчатой полиуретановой (ПУ) формы в суспензию ГАП с последующей сушкой и выжиганием ПУ матрицы. Нанесение ГАП/PCL/антибиотик покрытия методом погружения/сушки в течение 48 ч | Тетрациклина гидрохлорид 0.25–0.75 мас. % | Иммерсионный метод в фосфатном буфере. Линейная деградация скаффолда с потерей 20–45% исходной массы к 7 дню. Логарифмическое кумулятивное высвобождение антибиотика в период от 2 ч до 7 дней: 20–30% в первые 2 ч и 40–60% (до 0.05 мг/мл) к 7 дню наблюдения | Не описаны | Kim et al., 2004 |
| Биоактивная костная паста (БКП; CERAPASTE. Япония) или костный цемент (КЦ; Stryker Co., Япония) | Цилиндры (диаметр 7 мм, длина 14 мм) | Формование суспензии в акриловых трубках до затвердения | Цис-диаминдихлорплатина (100 мг порошка на 21 г цилиндра) | Иммерсионный метод в фосфатном буфере. Убывание по экспоненте со 180 мкг/мл почти до нуля за 1 нед. для БКП (14% за 8 нед.). Всего 0.3% препарата выходит линейно из КЦ за 4 нед. | Полулетальная доза цисплатины 2.08 мМ в отношении SOSN2 клеток остеосаркомы крысы. Экстракты (1–7 дней) цилиндров с цисплатиной вызывали 2-кратное торможение 24-ч роста опухолевых клеток согласно МТТ тесту | Tanzawa et al., 2011 |
| Частицы гидроксиапатит (ГАП)/коллаген в гидрогеле на основе альгината/глюконолактона, формованном в цилиндры | Диаметр частиц ГАП/коллаген 50 ± 6.6 мкм; Размер цилиндров 8 мм в диаметре и 10 мм в длину |
Метод формования композита из гидрогеля описан | Рекомбинантый BMP-2 человека (15 мкг/мл) | Линейное высвобождение до 80% BMP-2 в течение 21 дня с сохранением остеогенной активности белка | Усиление секреции щелочной фосфатазы (ALP) МСК костного мозга после 5 дней контакта с экстрактом цилиндров, содержащих BMP-2 | Tan et al., 2012 |
| КФ покрытие на чистом Ti (ВТ1-0) или Ti–40Nb сплаве | Металлические пластины (10 × 10 мм), толщина 1 мм. Свойства ди- и моноКФ покрытия: индекс шероховатости Ra = = 2.9–3.3 мкм; толщина 48–60 мкм; масса 13.5–15 мг | Микродуговой способ формирования покрытия из порошка ГАП-Zn или ГАП-Cu в электролите | Zn или медь (Cu) (0.3–0.4 ат. % в покрытии) | Иммерсионный метод в среде RPMI-1640. Выход Cu в 7-дневном экстракте составил 0.5% от количества в покрытии | Увеличение подвижности МСК человека (КФ-Zn), секреции остеокальцина (КФ-Cu). Бактериостатический эффект в отношении роста колоний S. aureus (КФ-Zn и КФ-Cu). Результаты варьируют на разных металлических подложках | Литвинова и др., 2017; Komarova et al., 2020 |
| Наночастицы CaP/PEI/ siRNA/SiO2, содержащие siRNA против гена фактора некроза опухоли (TNF-α) | Диаметр частиц 40–90 нм; дзета-потенциал 23 мВ | Наночастицы фосфата кальция (CaP) с полиэтиленимином (PEI) смешивали с водным раствором TNF-α-siRNA, потом с тетраэтилортосиликатом; CaP/PEI/siRNA частицы, покрытые SiO2 слоем, выделяли ультрацентри-фугированием и разбивали ультразвуком | 2000 молекул siRNA/частицу | Не описаны. Наночастицы поглощались клетками |
Эффективность снижения экспрессии мРНК гена TNF-α в J774.2 моноцитах мышей, миелокариоцитах и клетках десны крыс составила 12–36% при клеточной жизнеспособности >65%; активность ALP повышалась в миелокариоцитах через 24 ч культивирования с наночастицами | Tenkumo et al., 2020 |
| Паста для 3D-печати: порошок силиката кальция, легированного магнием (MgCS) + + PCL в соотношении 50 : 50 | Скаффолды из пасты с внутренними балками и порами 500 × 300 мкм. Размер скаффолдов не указан. Химически Ca2Mg(SiO4)4 | Послойная 3D-печать при 80°C. Покрытие из желатина в 0–5%-ном растворе с последующей сшивкой генипином | Физическая 2-ч адсорбция рекомбинантного FGF-2 из раствора 500 нг/мл в желатиновое покрытие | Иммерсионный метод до 3 мес., растворитель не указан. Желатиновый слой логарифмически замедляет потерю массы скаффолдов к 3 мес. с 45 до 30%; усиливает кумулятивный логарифмический выход FGF-2 c 20 нг (скаффолд без покрытия) до 90 нг (покрытие из 5% раствора желатина) к 14 дню растворения | В остеогенной среде МСК пупочного канатика на 3 и 7 сут лучше пролиферируют и экспрессируют ALP на скаффолдах с желатиновым слоем, насыщенным FGF-2 |
Lai et al., 2021 |
| Наночастицы ГАП/коллаген I типа + PLGA, формованные в полиметилсилоксане | Средний диаметр ГАП частиц 98 нм; сетка поперечно-сшитого коллагена крысы; микросферы (диаметр 30 мкм) PLGA (50 : 50) | Метод формования дисков 8 × 2 мм | Рекомбинантый BMP-2 человека (0.25 мкг/мл) и/или алендронат (АЛД) (80 мкг/мл) | Иммерсия в фосфатный буфер при встряхивании до 8 нед. Логарифмический кумулятивный
выход веществ, физически адсорбированных в скаффолде: BMP-2 (30% в 1-й день; 90% в
течение 7 дней); АЛД (60% в 1-й день; 90% в течение 14 дней). PLGA капсулы замедляли, но продлевали выход BMP-2 (до 15 дней) и АЛД (до 8 нед.) |
Синергетический эффект препаратов на жизнеспособность и ALP активность MC3T3-E1 преостеобластов в 7-дневной культуре. | Lee et al., 2021 |
| КФ покрытие на Ti–6Al–4V или Ti–6Al–7Nb сплавах | Металлические диски диаметром 11 мм и пластины (10 × 10 мм), толщина 1 мм; тонкое (толщина 1.2–1.3 мкм) КФ покрытие (Са/Pат = 2.2–2.3) | Магнетронное напыление ГАП-Zn мишени на металлическую подложку | Цинк (Zn; 0.4–0.8 мас. % в покрытии) | Иммерсионный метод в 0.9% растворе хлорида натрия. Линейное 5-нед нарастание выхода Zn из покрытия (до 0.05−0.07 мг/л) в противовес линейно убывающему высвобождению ионов кальция и фосфора | 7-дневные экстракты КФ-Zn покрытия подавляют в 4–5 раз 24 ч рост колоний S. aureus на агаре. Кроме того, КФ-Zn покрытия контактно подавляют 48 ч жизнеспособность лейкозных T-лимфобластов линии Jurkat; не нарушают индуцированную КФ остеодифференцировку и минерализацию (при окраске ализириновым красным) МСК человека | Prosolov et al., 2021 |
| Исследования in vivo | ||||||
| КФ покрытие на Ti–6Al–4V дисках (диаметр 10 мм) | Толщина безпористого октакальций-фосфатного покрытия 23–25 мкм; критическая нагрузка
(до разрушения покрытия) в скретч-тесте 1.8–2.5 Н |
Осаждение на подложку в течение 48 ч при 37°С из перенасыщенной суспензии КФ, содержащей
10 мг/л BMP-2. Хранение образцов при –80°С |
Рекомбинантный BMP-2 (0.1–0.5 мкг/мг покрытия; 0.98–1.7 мг/диск) | Линейная 5-недельная деградация КФ покрытия; 60% BMP-2 выделялось в течение 5 нед.
после подкожной имплантации крысам. Наличие BMP-2 ускоряет деградацию покрытия через активацию остеокластов |
Только в группе с BMP-2 отмечено эктопическое костеообразование на имплантированных образцах: 6–10 мм3 со 2-й нед. эксперимента; до 65% всей поверхности имплантата к 5 нед. | Liu et al., 2005 |
| Гранулят ГАП/ТКФ (Zimmer Scandinavia) | Не описаны | Олигонуклеотидная трансфекция (25 нМ) иммортализированной линии МСК костного мозга человека in vitro; их введение в гранулят (5 × 105 клеток на 40 мг) | микроРНК-138 или ее антагонист | Подкожная имплантация системы доставки NOD/SCID мышам | МикроРНК-138 подавляет экспрессию остеогенных генов (RUNX2, ALPL и OC) через 1 нед. и уменьшает в 5 раз площадь роста эктопической кости через 8 нед. после имплантации трансфицированных МСК на грануляте. Анти- микроРНК-138, напротив, усиливает в 2 раза рост кости из трансфицированных МСК, засеянных в гранулят, в эктопическом тесте | Eskildsen et al., 2011 |
| Биоактивная костная паста (CERAPASTE, Япония) или костный цемент (Stryker Co., Япония) | Цилиндры (диаметр 7 мм, длина 14 мм) | Формование суспензии в акриловых трубках до затвердения | Цис-диаминдихлорплатина (100 мг порошка на 21 г цилиндра) | Иммерсионный метод в фосфатном буфере. Убывание по экспоненте со 180 мкг/мл почти до нуля за 1 нед. для БКП (14% за 8 нед.). Всего 0.3% препарата выходит линейно из КЦ за 4 нед. | Торможение роста (пролиферации) SOSN2 остеосаркомы, перевитой в матригеле в костномозговой канал крыс. К 6-й нед. объем опухоли вокруг цилиндров с цитостатиком составил 20 см3 при 40 см3 в контроле; 2 из 7 крыс выжили в течение 14 нед. | Tanzawa et al., 2011 |
| Частицы гидроксиапатит (ГАП)/коллаген в гидрогеле на основе альгината/глюконолактона | Диаметр частиц ГАП/коллаген 50 ± 6.6 мкм | Получение инъекционного гидрогеля описано | Рекомбинантый BMP-2 человека | Введение в дефект свода черепа (8 мм в диаметре) 1 мл геля, содержащего 15 мкг/мл BMP-2 | BMP-2 улучшает гистологические и рентгеновские (объем новой кости; толщина костных трабекул) результаты ремоделирования костной ткани через 4–8 нед. после введения в костный дефект | Tan et al., 2012 |
| ТКФ-α порошок | Пластины 1.8 × 3 мм. Толщина каждого слоя 89 мкм | Послойная 3D-печать с применением 8.75 мас. % фосфорной кислоты. Загрузка антибиотиков в виде порошка при печати либо инфузией растворов антибиотиков в скаффолд. PLGA (50 : 50) покрытие на скаффолды |
Ванкомицин 5–10 мас. % (182.5–365 мкг/скаф-фолд) и рифампин 0.05–0.5 мас. % (3.5–35 мкг/скаффолд) | Без PLGA слоя быстрый выход всего рифампина из скаффолда in vivo в течение 2 дней. PLGA (5–20%) обеспечивает высвобождение антибиотика по синусоиде с пиком (выше 10 мкг/мл) на 9-й день. В течение 14 дней дозы (70–1.8 мкг/мл) рифампицина выше минимальной подавляющей концентрации (0.08 мкг/мл) | Подавление роста микробной пленки метициллин-чувствительного S. aureus на скаффолдах + PLGA на модели остеомиелита бедра мышей BALB/c. Снижение костной резорбции, обусловленной инфекцией. 50%-ное снижение случаев высевания микробов из кости после терапии | Inzana et al., 2015 |
| КФ покрытие на чистом Ti (ВТ1-0) или Ti–40Nb сплаве | Металлические пластины (10 × 10 мм), толщина 1 мм. Свойства ди- и моноКФ покрытия: индекс шероховатости Ra = = 2.9–3.3 мкм; толщина 48–60 мкм; масса 13.5–15 мг | Микродуговой способ формирования покрытия из порошка ГАП в электролите | Zn или медь (Cu) (0.3–0.4 ат. % в покрытии) | Эктопический подкожный тест костеообразования на мышах | Присутствие в КФ покрытии Zn или Cu несколько снижает (со 100 до 67%; КФ покрытие на титане) либо не влияет (КФ покрытие на Ti–40Nb сплаве) на частоту остеогенеза из сингенного костного мозга | Komarova et al., 2020 |
| Паста на основе наночастиц CaP/PEI/ siRNA/SiO2, содержащая siRNA против гена фактора некроза опухоли (TNF-α) | Диаметр частиц 40–90 нм; дзета-потенциал 23 мВ. 2000 молекул siRNA/частицу |
Смешивание компонентов в водных расторах |
∼5.4 μg siRNA-TNF-α в 1.6 мг пасты/дефект периодонта | Не описаны | Противовоспалительный и костно-заживляющий эффект, обусловленный снижением экспрессии мРНК гена TNF-α, увеличением мРНК ALP и активности фермента через 21 сут после имплантации пасты | Tenkumo et al., 2020 |
| Синтетический бифазный кальцийфосфатный (КФ) материал (inRoad) в сравнении с коммерческим ксенографтом кости (Bio-oss) | 90 ± 5% ГАП и 10 ± 5% β-трикальцийфосфат (β-ТКФ); кристалличность 90%; соотношение Ca/P = 1.66 | Пористые гранулы (0.3–1 мм) получены размалыванием цельного блока, спеченного (3 ч при 1230°C) из пасты на основе бифазной КФ наносупензии (частицы 200–400 нм) в поливиниловом спирте, карбоксиметилцеллюлозе и аммониевом полиакрилате | Алендронат (0; 1 или 5 мг) введен иммерсионным методом при 24-ч встряхивании на шейкере с последующей вакуумной сушкой. Степень загрузки в скаффолд 72–83% | Эффективность in vitro логарифмического высвобождения алендроната в фосфатный буфер составила (при встряхивании в течение 1–28 дней) 69% при дозе 1 мг и 27% при дозе 5 мг (из Bio-oss 83 и 29%, соответственно) | Дозозависимое увеличение, в большей степени, минеральной плотности кости свода черепа, чем усиление остеогенеза, в течение 4, 8 и 12 недель после имплантации овариэктомированным крысам в 5 мм дефект свода черепа | Bae et al., 2021 |
| Паста для 3D-печати: порошок силиката кальция, легированного магнием (MgCS) + + поликапролактон (PCL) в соотношении 50 : 50 | Скаффолды из пасты с внутренними балками и порами 500 × 300 мкм. Размер скаффолдов не указан. Химический состав Ca2Mg(SiO4)4 | Послойная 3D-печать при 80°C. Покрытие из желатина в 0–5% растворе с последующей сшивкой генипином | Физическая 2 ч адсорбция рекомбинантного FGF-2 из раствора 500 нг/мл в желатиновое покрытие | Критический дефект (6 × 6 мм) в мыщелке бедренной кости кроликов | Наличие FGF-2 в скаффолде улучшает в 1.5 раза рентгеновские (объем новой кости, толщина костных трабекул) и гистологические (окраска по Массону и ван Коссу) результаты ремоделирования костной ткани через 4 и 8 нед. после введения в область костного дефекта | Lai et al., 2021 |
| Наночастицы ГАП/коллаген I типа + PLGA, формованные в полиметилсилоксане | Средний диаметр ГАП частиц 98 нм; сетка поперечно-сшитого коллагена крысы; микросферы (диаметр 30 мкм) PLGA (50 : 50) | Метод формования дисков 8 × 2 мм | Рекомбинантый BMP-2 человека (0.25 мкг/мл) и/или алендронат (80 мкг/мл) | Введение дисков в дефект свода черепа крысы (8 мм в диаметре) | Синергетический эффект препаратов на микрокомпьютерные и гистологические признаки усиления остеогенеза в течение 2–8 нед. после имплантации | Lee et al., 2021 |
| Клинические испытания/апробация | ||||||
| TiCuN покрытие на временном металлическом эндопротезе (спейсере) тазобедренного сустава | Гладкое покрытие на ножке и головке спейсера | Физическое осаждение покрытия из газовой фазы (PVD метод) на ножку эндопротеза | Медь (Cu) | Не представлено. Предположительно, деградация/резорбция покрытия | Отсутствие микробиологических и гистологических (при биопсии) признаков стафилококковой инфекции через 6 нед. после имплантации спейсера. Концентрация Cu в крови в пределах нормы (11–23.5 мкМ). Через 1 год после установки постоянного эндопротеза − оссификация вокруг ножки эндопротеза без признаков ее расшатывания | Ellenrieder et al., 2011 |
| Покрытие из геля, содержащего антибиотики | Не описаны | Аппликация 5–10 мл гидрогеля (состав не указан) на поверхность ножки эндопротеза сразу после установки в канал бедренной кости | Гентамицин 200 мг + ванкомицин 250 мг | Не представлено. Предположительно, деградация гидрогеля | Улучшение результатов тотального эндопротезирования тазобедренного сустава у 17 пациентов в течение 6 мес. после операции: 3 осложнения при 11 в контроле, из них 0 случаев ППИ при 6 случаях в контроле | De Meo et al., 2020 |
Ли с соавторами (Lee et al., 2021) создали многокомпонентную композитную матрицу, состоящую из наночастиц (средний диаметр 98 нм) ГАП и сетки коллагена I типа, в которую помещали BMP-2 и/или алендронат методом физической адсорбции или в пористых микросферах (средний диаметр 30 мкм) из полилактидгликолида (PLGA). В последующем материал формовали в скаффолды (диски 8 × 2 мм) в полиметилсилоксане (1 мкг/скаффолд). Показан синергетический эффект иммобилизованных веществ на остеодифференцировку преостеобластных клеток линии MC3T3-E1 (табл. 2). Скаффолды системы “ГАП/коллаген” стерилизовали ультрафиолетом, что неприемлемо для апроксимации разработки в клиническую практику. Кроме того, начальные (до растворения) дозы препаратов в скаффолде были нами высчитаны из кинетики их высвобождения, поскольку прямые указания в самой статье не обнаружены.
Проводится также изучение других факторов роста в приложении к биоинженерии костной ткани. В частности, in vitro и in vivo тестировали остеогенную активность фактора роста фибробластов-2 (fibroblast growth factor, FGF-2) на композитных кальций-магний-силикатных скаффолдах, полученных методом послойной 3D-печати, с последующим формированием желатинового покрытия и загрузкой FGF-2 из раствора (Lai et al., 2021). Авторы отметили позитивный эффект фактора роста на культуре МСК вартонова студня пупочного канатика и при закрытии дефекта бедренной кости кроликов (табл. 2). В то же время многие методические моменты (размеры скаффолдов, подробности иммерсионного метода растворения in vitro), включая стерилизацию конструкций и их компонентов, в указанной работе не описаны.
В плане разработки подходов к генной терапии вызывает интерес исследование, выполненное in vitro и in vivo на наноразмерной системе доставки “CaP/PEI/siRNA/SiO2” (Tenkumo et al., 2020). Система состоит из наночастиц фосфата кальция (CaP) с полиэтиленимином (PEI) с включением siRNA против гена фактора некроза опухоли α (tumor necrosis factor-alpha; TNF-α), покрытой тонкой оболочкой из силикатного стекла (SiO2) (табл. 2). Показано снижение экспрессии гена провоспалительного цитокина в клетках, противосопалительный и костно-заживляющий эффекты на модели дефекта периодонта крыс при использовании данной системы. О стерилизации системы доставки и ее компонентов данные не приводятся.
КФ носители лекарственных и биологических молекул имеют определенные преимущества перед другими классами материалов, поскольку служат естественным резервуаром ионов кальция и фосфора, необходимых для инициации процессов остеогенеза и минерализации (Zeng et al., 2019). КФ материалы применяются в форме наночастиц, цементов, объемных пористых скаффолдов, покрытий и др. (Bose, Tarafder, 2012). В случае КФ скаффолдов и покрытий, технологически формируемая внутренняя и наружная пористость опосредуют не только различные варианты иммобилизации веществ-наполнителей, но и обеспечивают транспорт жидкостей, клеточную инфильтрацию, врастание кровеносных сосудов и тканей (Zeng et al., 2019). Известными полезными свойствами КФ являются их стойкость к температурной стерилизации, а также относительная механическая прочность (прежде всего, в виде покрытий на металлических конструкциях), требуемая при хирургической коррекции травм и заболеваний длинных трубчатых костей.
КФ материалы могут использоваться как самостоятельные системы доставки, а также в комбинации с микро- и наночастицами (капсулами), наполненными лекарственными и биомолекулами, и покрытыми полимерными/липидными слоями, предохраняющими от “взрывного” выделения иммобилизованного вещества. Для иммобилизации препаратов используются как физическая адсорбция лекарственного агента, так и его химическая коньюгация в полимерном слое (Bose, Tarafder, 2012). Так, Радин с соавторами (Radin et al., 1997) показали быстрое (в первые 24 ч) высвобождение ванкомицина, загруженного в КФ покрытие по механизму физической адсорбции иммерсионным методом. Тонкий слой фосфатидилхолина на КФ покрытии замедляет и продлевает выделение антибиотика до 72 ч в концентрациях, подавляющих рост золотистого стафилококка (Staphylococcus aureus) (табл. 2).
Биодеградируемые магниевые сплавы считаются перспективными материалами для биоинженерии костной ткани. В то же время, при их имплантации in vivo отмечается высокая частота ППИ (Хлусов и др., 2019). Недавно разработан скаффолд на основе магниевого сплава – Mg + микродуговое кремнийсодержащее покрытие + альгинатный гель + ванкомицин (0.5 мас. % методом погружения) (Minting et al., 2020). Модифицированный скаффолд улучшал коррозионное поведение и гемосовместимость (снижение гемолиза эритроцитов и адгезии тромбоцитов). В то же время, массивное логарифмическое выделение антибиотика (до 0.7 мг/см2 скаффолда) в фосфатный буфер с достижением участка насыщения наблюдалось уже в первые 50 мин теста на растворение. Противомикробное действие (зона просветления вокруг дисков с загруженным антибиотиком через 24 ч культивирования на агаре) отмечено авторами в отношении золотистого стафилококка (S. aureus), но не кишечной палочки (Esherichia coli). Во многом аналогичное (“взрывное”) высвобождение тетрациклина в первые 2 ч с последующим выходом на плато к 7-м сут деградации пористого скаффолда “ГАП/поликапролактон” (табл. 2) выявлено другими авторами (Kim et al., 2004). По-видимому, системы доставки в обоих случаях были собраны в стерильных условиях из стерильных компонентов, поскольку методы обеззараживания матриц или готовых изделий перед исследованиями не представлены.
В свою очередь, микроэлементы цинк и медь, помимо антимикробных и остеогенных свойств в составе скаффолдов (Limongi et al., 2020), допускают возможность различных способов стерилизации перед использованием. В одной из работ показано антимикробное и противоопухолевое действие ионов цинка в составе термически стерилизованных (сухожаровый шкаф) КФ магнетронных покрытий на титановых сплавах при сохранении способности МСК жировой ткани человека к дифференцировке в остеобласты и формированию межклеточного минерализованного матрикса (Prosolov et al., 2021). Введение Zn в состав КФ покрытия существенно не влияло на его растворимость (табл. 2).
Во многом схожие результаты in vitro (подвижность и дифференцировка МСК человека в остеобласты; бастериостатический эффект) и in vivo (эктопический остеогенез) (табл. 2) получены для малых концентраций Zn или Cu в составе КФ покрытий, сформированных на титановых сплавах методом микродугового оксдирования и стерилизованных сухим жаром (Komarova et al., 2020).
При реконструктивных операциях на костях после удаления злокачественных новообразований и метастазов КФ цемент с химиотерапевтическими препаратами (6-меркаптопурин, цисплатин, доксорубицин, метотрексат) является одним из решений для снижения риска опухолевых рецидивов и расшатывания имплантатов и эндопротезов. При этом эффективность in vitro высвобождения цитостатиков из КФ цемента (14–64%) выше таковой для цементов на основе полиметилакрилата (5–20%) (Phull et al., 2020). Многочисленные исследования КФ цементов, несущих противоопухолевые препараты, начались с 1994 г. (Otsuka et al., 1994). Например, в одном из исследований формировали цилиндры (диаметр 7 мм, длина 14 мм) из костного цемента или биоактивной костной пасты, насыщенных противоопухолевым цитостатиком (цисплатиной) (Tanzawa et al., 2011). Была установлена эффективность композиции в отношении торможении роста клеток остеосаркомы крыс линии SOSN2 in vitro и in vivo (табл. 2). К сожалению, методы стерилизации скаффолдов и/или конечной системы доставки цитостатика не описаны.
Несмотря на продолжающиеся исследования (Pountos et al., 2018; Dewhurst et al., 2020) гиперкальциемия вследствие остеолитического эффекта опухолевого роста и биодеградации самого КФ цемента вызывают настороженность при внедрении разработок в клиническую практику (Phull et al., 2020).
Примеры применения скаффолдов в исследованиях in vivo
Опубликованы результаты изучения эффекта системы доставки БФ (алендронат) на основе гранул синтетического бифазного КФ материала в сравнении с коммерческим ксенографтом кости (Bio-oss) (Bae et al., 2021). Установлены 28-дневное логарифмическое высвобождение БФ in vitro и улучшенная эффективность синтетической системы доставки (в сравнении с Bio-oss) в отношении минерализации дефекта свода черепа у крыс с остеопорозом после удаления яичников (табл. 2). На основании гистологического исследования (без использования морфометрического анализа) авторы делают заключение о постимплантационном усилении остеогенеза (в сравнении с Bio-oss), которое, однако, не подтвердилось методом микрокомпьютерной морфометрии. Кроме того, отсутствует информация о стерилизации изделий, способной оказывать модулирующее действие на свойства скаффолда и/или эффективность введенных в него лекарств и биомолекул (см. выше). По-видимому, изготовление систем доставки проводилось в стерильных условиях, что затруднительно воспроизвести в условиях неспециализированных лечебных учреждений.
Ранее другие авторы (Peter et al., 2005; Garbuz et al., 2008) сообщили об усилении периимплантационного роста кости, повышенной костной плотности и механической фиксации металлических имплантатов с КФ покрытиями, насыщенными золедронатом (0.2–16 мкг/титановый цилиндр 3 × 5 мм) или алендронатом (1.37 мкг на пластины 8 × 3 мм из пористого тантала), на модели костной полости в бедре крыс или кроликов. Напротив, неубедительные (в сравнении с композитом “титан/ГАП” без препарата) данные получены для пористых цилиндров из титана, напечатанных на 3D-принтере, несущих ГАП покрытие с алендронатом (20–180 мкг/см2), имплантированных в костномозговой канал бедренной кости собак (Pura et al., 2016).
Представляет интерес сложное исследование, выполненное относительно недавно (Inzana et al., 2015). Методом 3D-печати получены многокомпонентные антибиотикосодержащие скаффолды из порошка ТКФ. Показана их эффективность на модели дефекта бедренной кости у мышей, осложненного остеомиелитом, вызванным золотистым стафилококком (S. aureus) (табл. 2). К сожалению, в работе отсутствуют четкие описания условий стерилизационной подготовки скаффолдов перед имплантацией зараженным животным. Кроме того, многокомпонентные имплантаты, как правило, редко находят широкое клиническое применение.
В литературе имеются данные о том, что линия МСК, выделенная из костного мозга человека и трансфицированная микроРНК-138, после заселения на гранулят ГАП/ТКФ слабее дифференцируется в остеобласты при подкожной имплантации мышам (Eskildsen et al., 2011) (табл. 2). Напротив, in vitro трансфекция МСК антагонистом микроРНК-138 способствует экспрессии в них генов остеогенной дифференцировки (RUNX2, ALP и OC) in vivo и усилению подкожного эктопического костеобразования на грануляте ГАП/ТКФ.
Остеогенные эффекты относительно низких (единицы/десятки мкг) и высоких (до 12 мг) доз BMPs, иммобилизованных на различных носителях, включая КФ материалы (керамика, цемент) и биостекло, в разновидностях эктопического теста и при моделировании дефектов кости у мелких и крупных лабораторных животных подробно представлены в литературе (например, Stokovic et al., 2021). Общей тенденцией является снижение применяемой концентрации BMP белков и разработка носителей с максимальным высвобождением белка. Отмечаются удовлетворительные либо очень хорошие результаты, свидетельствующие об усилении регенерации и минерализации кости в зоне дефекта, подтвержденные данными рентгенографии, компьютерной томографии и гистологии (Paulini et al., 2022). Исследования, в центре которых находятся вопросы снижения концентрации молекул BMP и улучшения их фармакокинетики (Liu et al., 2005; Eskildsen et al., 2011; Lee et al., 2021), кратко описанные в табл. 2, находятся в современном тренде.
Удивительно, что способы стерилизации систем доставки описываются только в 35% проанализированных публикаций (в частности, Swanson et al., 2020) и упоминаются, чаще всего, обтекаемо. Из них в 60% случаев представлены методы, не разрешенные к клиническому использованию для имплантируемых изделий, например, ультрафиолетовое облучение (Hickey et al., 2015; Abdollahi Boraei et al., 2020) в комбинации с этиловым спиртом (Shie et al., 2013). В то же время, существующие химические (растворы и газы) и физические (температура, лучевая энергия) методы, разрешенные к использованию для стерилизации медицинских изделий, могут в значительной степени влиять на физико-химические и биомедицинские свойства как скаффолда-носителя (Хлусов и др., 2011; Bykova et al., 2014; Lenfeld et al., 2020), так и лекарственного наполнителя. В свою очередь, смешивание в асептических условиях препаратов с несущим материалом непосредственно перед применением, как делается во многих случаях (табл. 2), снижает равномерность распределения лекарственных и биологических молекул, предъявляет серьезные (био)технологические требования к помещениям и персоналу, которые трудно и затратно создавать и контролировать в лечебных учреждениях.
Примеры клинических исследований и применения скаффолдов
Часть разработок с иммобилизацией BMP белков на различных носителях дошла до клинических испытаний, как например, исследования рекомбинантного BMP-6 в сгустке аутологичной крови при остеотомии большеберцовой кости (Chiari et al., 2020), а также при дистальном радиальном переломе (Durdevic et al., 2020).
Огромное количество синтетических КФ материалов в различных сочетаниях и приложениях применяется в клинике ортопедии и травматологии, прежде всего, в форме костных цементов. Кроме того, в США и Европе проводятся свыше 300 клинических испытаний, из которых 118 уже завершились (Thrivikraman et al., 2017). Клинически доказана необходимость добавления антибиотиков в костный цемент (Parvizi et al., 2008) и в состав покрытий (De Meo et al., 2020) (табл. 2) при операциях эндопротезирования крупных суставов для снижения риска ППИ.
Тем не менее, короткий период высвобождения антибиотиков из костного цемента (иногда всего несколько дней) (Anagnostakos et al., 2009) вызывает существенную проблему при операциях, осложненных ППИ и формированием микробных биопленок. Одним из современных решений является модификация поверхности имплантатов с помощью покрытий, содержащих на поверхности или в объеме антимикробные металлы. Так, показана 6-недельная клиническая эффективность TiCuN покрытия, нанесенного на поверхность временного имплантата (спейсера), при двухэтапном эндопротезировании тазобедренного сустава, осложненного стафилококковой ППИ (Ellenrieder et al., 2011). Выбор меди обусловлен ее эффективностью при подавлении роста микробных биопленок и относительно низкой токсичностью в сравнении с другими антибактериальными металлами (серебро, цинк, кобальт и другие) (Nie et al., 2010).
ЗАКЛЮЧЕНИЕ
Системы доставки лекарств и биологических молекул являются современным, междисциплинарным направлением на стыке фармакологии и фармации, биотехнологий, медицинского материаловедения и биомедицины с 10-кратным приростом числа публикаций за последние 30 лет (к 2020 г. до 22618 статей/год по запросу “drug delivery” в Pubmed, https://pubmed.ncbi.nlm.nih.gov). Преимуществами систем доставки, по сравнению с традиционным назначением лекарств, считаются стабильное, пролонгированное, контролируемое высвобождение препаратов с сохранением их активности, достижением локальных терапевтических концентраций, уменьшением системных и побочных проявлений и стоимости лечения хронических и опухолевых заболеваний. Помимо этого структура и материал скаффолдов-носителей влияют на пролиферацию, дифференцировку и созревание стволовых и прогениторных клеток, эндотелиальных и иммунокомпетентных клеток, способствуют врастанию тканей и кровеносных сосудов организма-хозяина (Sundelacruz, Kaplan, 2009; Khlusov et al., 2020), что может усиливать терапевическое/регенеративное действие лекарственных средств и биологических молекул при бионженерии костной и других тканей. Бурно развивающиеся методы 3D-биопечати (Shafiee et al., 2019; Matai et al., 2020; Zhang et al., 2020; Wang et al., 2021) дают новые возможности в этом направлении.
Несомненным достоинством проанализированных работ является, во многих случаях, апробация разрабатываемых систем доставки как in vitro, так и in vivo. Однако во многих публикациях недостаточно представлены физико-химические свойства материалов-носителей препаратов, особенности их биодеградации и клеточных/тканевых реакций, которые могут влиять на высвобождение молекул из матрицы и их фармакологическую активность. Следует отметить, что многочисленные разработки с трудом доходят до практического использования; в литературе встречаются единичные клинические публикации (табл. 2). Одним из ограничений является, без сомнения, сложная и длительная система обращения (регистрации, производства, хранения, контроля качества и реализации) лекарственных препаратов. На основе проведенного анализа, общей проблемой доклинического изучения и применения всех лекарств и биологических молекул (за исключением, пожалуй, антимикробных металлов) в составе систем доставки являются вопросы их стерилизационной подготовки, условий хранения (прежде всего, скаффолдов и наполнителей, разработанных на основе биотехнологий) и увеличения стоимости разработок, обусловленного наметившейся тенденцией к усложнению состава таких конструкций.
Список литературы
Литвинова Л.С., В.В. Шуплецова, Дунец Н.А., Хазиахматова О.Г., Юрова К.А., Хлусова М.Ю., Слепченко Г.Б., Черемпей Е.Г., Шаркеев Ю.П., Комарова Е.Г., Седельникова М.Б., Хлусов И.А. 2017. Дисбаланс морфофункциональных реакций Т-лимфобластов линии Jurkat при краткосрочном культивировании с рельефным цинк-или медьсодержащим кальцийфосфатным покрытием на титане. Доклады академии наук. Т 472. № 3. С. 354 (Litvinova L.S., Shupletsova V.V., Dunets N.A., Khaziakhmatova O.G., Yurova K.A., Khlusova M.Yu., Slepchenko G.B., Cherempey E.G., Sharkeev Yu.P., Komarova E.G., Sedelnikova M.B., Khlusov I.A. 2017. Imbalance of morphofunctional responses of Jurkat T lymphoblastsat short-term culturing with relief zinc- or copper-containing calcium phosphate coating on titanium. Doklady Biochemistry and Biophysics. V. 472. P. 35. https://doi.org/10.1134/S160767291701009410.1134/S1607672917010094)https://doi.org/10.7868/S0869565217030252
Литвинова Л.С., Юрова К.А., Хазиахматова О.Г., Хлусова М.Ю., Малащенко В.В., Шунькин Е.О., Тодосенко Н.М., Норкин И.К., Иванов И.А., Хлусов И.А. 2020. Остеогенные и ангиогенные свойства гепарина как системы доставки биомолекул при биоинженерии кости: краткий критический обзор. Биомедицинская химия. Т. 66. № 6. С. 431 (Litvinova L.S., Yurova K.A., Khaziakhmatova O.G., Khlusova M.Yu., Malashchenko V.V., Shunkin E.O., Todosenko N.M., Norkin I.K., Ivanov I.A., Khlusov I.A. 2021. Osteogenic and angiogenic properties of heparin as a system for delivery of biomolecules for bone bioengineering: a brief critical review. Biochemistry (Moscow), Supplement Series B: Biomedical Chemistry. V. 15. № 2. P. 147. https://doi.org/10.1134/S199075082102005010.1134/S1990750821020050)https://doi.org/10.18097/PBMC20206606431
Митриченко Д.В., Просолов А.Б., Хлусов И.А., Комков А.Р. Интрамедуллярный антимикробный фиксатор: Патент РФ на полезную модель № 202062 от 28.01.2021 (Mitrichenko D.V., Prosolov A.B., Khlusov I.A., Komkov A.R. Intramedullar antimicrobic implant: RU patent 202062 from 28.01.2021.)
Норкин И.К., Юрова К.А., Хазиахматова О.Г., Мелащенко Е.С., Малащенко В.В., Шунькин Е.О., Хлусов И.А., Литвинова Л.С. 2021. Стимулирующее влияние высоких доз гепарина на миграционную активность и сохранение стволовости МСК в присутствии остеозамещающих материалов. Медицинская иммунология. Т. 23. № 4. С. 831 (Norkin I.K., Yurova K.A., Khaziakhmatova O.G., Melashchenko E.S., Malashchenko V.V., Shunkin E.O., Khlusov I.A., Litvinova L.S. 2021. Stimulating effect of high dose heparin on migration activity and MSC stemness preservation in the presence of bone-substituting materials. Medical Immunology (Russia). V. 23. № 4. Р. 831.)
Программа фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 гг.), утвержденная Распоряжением Правительства РФ от 31.12.2020. № 3684-р (Long-term program of fundamental scientific research in the Russian Federation (2021–2030) approved by the Decree of the Government of the Russian Federation of December 31. 2020. № 3684-r.)
Тихилов Р.М., Шубняков И.И., Коваленко А.Н., Тотоев З.А., Бо Л., Билык С.С. 2014. Структура ранних ревизий эндопротезирования тазобедренного сустава. Травматология и ортопедия России. № 2. С. 5. (Tikhilov R.M., Shubnyakov I.I., Kovalenko A.N., Totoyev Z.A., Bo L., Bilyk S.S. 2014. The structure of early revisions after HIP replacement. Traumatology and Orthopedics of Russia. № 2. P. 5.)
Хлусов И.А., Пичугин В.Ф., Гостищев Э.А., Шаркеев Ю.П., Сурменев Р. А., Сурменева М. A., Легостаева Е.В., Чайкина М.В., Дворниченко М.В., Морозова Н.С. 2011. Влияние физических, химических и биологических манипуляций на поверхностный потенциал кальцийфосфатных покрытий на металлических подложках. Бюллетень сибирской медицины. № 3. С. 72. (Khlusov I.A., Pichugin V.F., Gostischev E.A., Sharkeyev Yu.P., Surmenev R.A., Surmeneva M.A., Legostayeva Ye.V., Chaikina M.V., Dvornichenko M.V., Morozova N.S. 2011. The influence of physical, chemical and biological manipulations on surface potential of calcium phosphate coatings on metal substrates. Bulletin of Siberian Medicine. V. 10. № 3. P. 72.)
Хлусов И.А., Венгеровский А.И., Нечаев К.А., Дворниченко М.В., Саприна Т.В. 2013. Применение бисфосфонатов при несовершенном остеогенезе у детей. Клиническая фармакология и терапия. Т. 22. № 2. С. 78. (Khlusov I.A., Vengerovskii A.I., Nechaev K.A., Dvornichenko M.V., Saprina T.V. 2013. The use of bisphosphonates in osteogenesis imperfecta in children. Clinical Pharmacology and Therapy. V. 22. № 2. P. 78.)
Хлусов И.А., Рязанцева Н.В., Венгеровский А.И., Нечаев К.А., Якушина В.Д., Дворниченко М.В., Шаркеев Ю.П., Легостаева Е.В., Новицкий В.В. 2014. Модулирующее влияние матриц с кальцийфосфатным покрытием на цитотоксичность стронция ранелата и ибандроновой кислоты in vitro. Бюллетень экспериментальной биологии и медицины. Т. 157. № 2. С. 177. (Khlusov I.A., Ryazantseva N.V., Vengerovskii A.I., Nechaev K.A., Yakushina V.D., Dvornichenko M.V., Sharkeev Yu.P., Legostayeva E.V., Novitskii V.V. 2014. Modulating effect of matrices with calcium phosphate coating on cytotoxicity of strontium ranelate and ibandronic acid in vitro. Bulletin of Experimental Biology and Medicine. V. 157. № 2. Р. 215.)
Хлусов И.А., Митриченко Д.В., Просолов А.Б., Николаева О.О., Слепченко Г.Б., Шаркеев Ю.П. 2019. Краткий обзор биомедицинских свойств и применения магниевых сплавов для биоинженерии костной ткани. Бюллетень сибирской медицины. Т. 18. № 2. С. 274 (Khlusov I.A., Mitrichenko D.V., Prosolov A.B., Nikolaeva O.O., Slepchenko G.B., Sharkeev Yu.P. 2019. Short review of the biomedical properties and application of magnesium alloys for bone tissue bioengineering. Bulletin of Siberian Medicine. V. 18. № 2. P. 274). .
Юрова К.А., Хазиахматова О.Г., Малащенко В.В., Шунькин Е.О., Мелащенко Е.С., Норкин И.К., Иванов П.А., Кривошеев В.В., Хлусов И.А., Литвинова Л.С. 2021. Роль компонентов искусственных матриксов, применяемых для регенеративной медицины, в борьбе с перипротезной инфекцией. Гены & Клетки. Т. XVI. № 2. С. 6. https://doi.org/ (Yurova K.A., Khaziakhmatova О.G., Malashchenko V.V., Shunkin E.O., Melashchenko E.S., Norkin I.K., Ivanov P.A., Krivosheev V.V., Khlusov I.A., Litvinova L.S. 2021. The role of artificial matrix components used for regenerative medicine in combating periprothetic infection. Genes and Cells. V. 16. № 2. P. 10.)https://doi.org/10.23868/202107018
Abdel-Fattah W.I., Atwa N., Ali G.W. 2015. Influence of the protocol of fibroin extraction on the antibiotic activities of the constructed composites. Progress in Biomaterials. V. 4. № 2–4. P. 77. https://doi.org/10.1007/s40204-015-0039-x
Abdollahi Boraei S.B., Nourmohammadi J., Sadat Mahdavi F., Yus J., Ferrandez-Montero A., Sanchez-Herencia A.J., Gonzalez Z., Ferrari B. 2020. Effect of SrR delivery in the biomarkers of bone regeneration during the in vitro degradation of HNT/GN coatings prepared by EPD. Colloids Surf. B Biointerfaces. V. 190. P. 110944. https://doi.org/10.1016/j.colsurfb.2020.110944
Anagnostakos K., Wilmes P., Schmitt E., Kelm J. 2009. Elution of gentamicin and vancomycin from polymethylmethacrylate beads and hip spacers in vivo. Acta Orthop. V. 80. P. 193. https://doi.org/10.3109/17453670902884700
Arruebo M. 2012. Drug delivery from structured porous inorganic materials. Wiley Interdiscip. Rev. Nanomed Nanobiotechnol. V. 4. P. 16. https://doi.org/10.1002/wnan.132
Asafo-Adjei T.A., Chen A.J., Najarzadeh A., Puleo D.A. 2016. Advances in controlled drug delivery for treatment of osteoporosis. Curr. Osteoporos Rep. V. 14. P. 226. https://doi.org/10.1007/s11914-016-0321-4
Avdeeva E., Shults E., Rybalova T., Reshetov Y., Porokhova E., Sukhodolo I., Litvinova L., Shupletsova V., Khaziakhmatova O., Khlusov I., Guryev A., Belousov M. 2019. Chelidonic acid and its derivatives from saussurea controversa: isolation, structural elucidation and influence on the osteogenic differentiation of multipotent mesenchymal stromal cells in vitro. Biomolecules. V. 9. P. 189. https://doi.org/10.3390/biom9050189
Bae C.S., Kim S.H., Ahn T., Kim Y., Kim S.E., Kang S.S., Kwon J.S., Kim K.M., Kim S.G., Oh D. 2021. Multiple porous synthetic bone graft comprising engineered micro-channel for drug carrier and bone regeneration. Materials (Basel). V. 14. P. 5320. https://doi.org/10.3390/ma14185320
Bhattacharjee P., Kundu B., Naskar D., Kim H.W., Maiti T.K., Bhattacharya D., Kundu S.C. 2017. Silk scaffolds in bone tissue engineering: An overview. Acta Biomater. V. 63. P. 1. https://doi.org/10.1016/j.actbio.2017.09.027
Boontheekul T., Mooney D.J. 2003. Protein-based signaling systems in tissue engineering. Curr. Opin. Biotechnol. V. 14. P. 559. https://doi.org/10.1016/j.copbio.2003.08.004
Bose S., Tarafder S. 2012. Calcium phosphate ceramic systems in growth factor and drug delivery for bone tissue engineering: a review. Acta Biomater. V. 8. P. 1401. https://doi.org/10.1016/j.actbio.2011.11.017
Bykova Iu., Weinhardt V., Kashkarova A., Lebedev S., Baumbach T., Pichugin V., Zaitsev K., Khlusov I. 2014. Physical properties and biocompatibility of UHMWPE-derived materials modified by synchrotron radiation. J. Mater. Sci: Mater. Med. V. 25. P. 1843. https://doi.org/10.1007/s10856-014-5222-4
Chen R., Wang G., Zheng Y., Hua Y., Cai Z. 2019. Drug resistance-related microRNAs in osteosarcoma: Translating basic evidence into therapeutic strategies. J. Cell Mol. Med. V. 23. P. 2280. https://doi.org/10.1111/jcmm.14064
Chiari C., Grgurevic L., Bordukalo-Niksic T., Oppermann H., Valentinitsch A., Nemecek E., Staats K., Schreiner M., Trost C., Kolb A., Kainberger F., Pehar S., Milosevic M., Martinovic S., Peric M., Sampath T.K., Vukicevic S., Windhager R. 2020. Recombinant human BMP6 applied within autologous blood coagulum accelerates bone healing: randomized controlled trial in high tibial osteotomy patients. J. Bone Miner. Res. V. 35. P. 1893. https://doi.org/10.1002/jbmr.4107
Czekanska E.M., Geng J., Glinka M., White K., Kanczler J., Evans N.D., Oreffo R.O.C., Bradley M. 2018. Combinatorial delivery of bioactive molecules by a nanoparticle-decorated and functionalized biodegradable scaffold. J. Mater. Chem. B. V. 6. P. 4437. https://doi.org/10.1039/c8tb00474a
De Meo D., Calogero V., Are L., Cavallo A.U., Persiani P., Villani C. 2020. Antibiotic-loaded hydrogel coating to reduce early postsurgical infections in aseptic hip revision surgery: a retrospective, matched case-control study. Microorganisms. V. 8(4). P. 571. https://doi.org/10.3390/microorganisms8040571
Dewhurst R.M., Scalzone A., Buckley J., Mattu C., Rankin K.S., Gentile P., Ferreira A.M. 2020. Development of natural-based bone cement for a controlled doxorubicin-drug release. Front Bioeng Biotechnol. V. 8. P. 754. https://doi.org/10.3389/fbioe.2020.00754
Durdevic D., Vlahovic T., Pehar S., Miklic D., Oppermann H., Bordukalo-Niksic T., Gavrankapetanovic I., Jamakosmanovic M., Milosevic M., Martinovic S., Sampath T.K., Peric M., Grgurevic L., Vukicevic S. 2020. A novel autologous bone graft substitute comprised of rhBMP6 blood coagulum as carrier tested in a randomized and controlled Phase I trial in patients with distal radial fractures. Bone. V. 140. P. 115551. https://doi.org/10.1016/j.bone.2020.115551
Ebrahimi M. 2021. Porosity parameters in biomaterial science: Definition, impact, and challenges in tissue engineering. Front. Mater. Sci. V. 15. P. 352. https://doi.org/10.1007/s11706-021-0558-4
Elazar V., Adwan H., Bäuerle T., Rohekar K., Golomb G., Berger M.R. 2010. Sustained delivery and efficacy of polymeric nanoparticles containing osteopontin and bone sialoprotein antisenses in rats with breast cancer bone metastasis. Int. J. Cancer. V. 126. P. 1749. PMID: https://doi.org/10.1002/ijc.2489019739076
Ellenrieder M., Haenle M., Lenz R., Bader R., Mittelmeier W. 2011. Titanium-copper-nitride coated spacers for two-stage revision of infected total hip endoprostheses. GMS Krankenhhyg Interdiszip. V. 6. P. 16. https://doi.org/10.3205/dgkh000173
Emara K.M., Diab R.A., Emara A.K. 2015. Recent biological trends in management of fracture non-union. World J. Orthop. V. 6. P. 623. https://doi.org/10.5312/wjo.v6.i8.623
Eskildsen T., Taipaleenmäki H., Stenvang J., Abdallah B.M., Ditzel N., Nossent A.Y., Bak M., Kauppinen S., Kassem M. 2011. MicroRNA-138 regulates osteogenic differentiation of human stromal (mesenchymal) stem cells in vivo. Proc. Natl. Acad. Sci. USA. V. 108. P. 6139. https://doi.org/10.1073/pnas.1016758108
Farrar D.F., Macauley N.J., Rose J. 2013. Bone putty: WO/2013/165333 from 07.11.2013
Ferracini R., Martínez Herreros I., Russo A., Casalini T., Rossi F., Perale G. 2018. Scaffolds as structural tools for bone-targeted drug delivery. pharmaceutics. V. 10. P. 122. https://doi.org/10.3390/pharmaceutics10030122
Garbuz D.S., Hu Y., Kim W.Y., Duan K., Masri B.A., Oxland T.R., Burt H., Wang R., Duncan C.P. 2008. Enhanced gap filling and osteoconduction associated with alendronate-calcium phosphate-coated porous tantalum. J. Bone Joint Surg. Am. V. 90. P. 1090. PMID: https://doi.org/10.2106/JBJS.G.0041518451402
Garg T., Singh O., Arora S., Murthy R. 2012. Scaffold: a novel carrier for cell and drug delivery. Crit. Rev. Ther. Drug Carrier Syst. V. 29. P. 1. https://doi.org/10.1615/critrevtherdrugcarriersyst.v29.i1.10
Ge Y.W., Lu J.W., Sun Z.Y., Liu Z.Q., Zhou J., Ke Q.F., Mao Y.Q., Guo Y.P., Zhu Z.A. 2019. Ursolic acid loaded-mesoporous bioglass/chitosan porous scaffolds as drug delivery system for bone regeneration. Nanomedicine. V. 18. P. 336. https://doi.org/10.1016/j.nano.2018.10.010
Girod Fullana S., Ternet H., Freche M., Lacout J.L., Rodriguez F. 2010. Controlled release properties and final macroporosity of a pectin microspheres-calcium phosphate composite bone cement. Acta Biomater. V. 6. P. 2294. https://doi.org/10.1016/j.actbio.2009.11.019
Hickey D.J., Ercan B., Sun L., Webster T.J. 2015. Adding MgO nanoparticles to hydroxyapatite-PLLA nanocomposites for improved bone tissue engineering applications. Acta Biomater. V. 14. P. 175. https://doi.org/10.1016/j.actbio.2014.12.004
Huang P., Wang X., Liang X., Yang J., Zhang C., Kong D., Wang W. 2019. Nano-, micro-, and macroscale drug delivery systems for cancer immunotherapy. Acta Biomater. V. 85. P. 1. https://doi.org/10.1016/j.actbio.2018.12.028
Huang S., Huang G. 2019. The dextrans as vehicles for gene and drug delivery. Future Med. Chem. V. 11. P. 1659. https://doi.org/10.4155/fmc-2018-0586
Inzana J.A., Trombetta R.P., Schwarz E.M., Kates S.L., Awad H.A. 2015. 3D printed bioceramics for dual antibiotic delivery to treat implant-associated bone infection. Eur. Cell Mater. V. 30. P. 232. https://doi.org/10.22203/ecm.v030a16
James A.W., LaChaud G., Shen J., Asatrian G., Nguyen V., Zhang X., Ting K., Soo C. 2016. A review of the clinical side effects of bone morphogenetic protein-2. Tissue Eng. Part B Rev. V. 22. P. 284. https://doi.org/10.1089/ten.TEB.2015.0357
Ju X.J., Xie R., Yang L., Chu L.Y. 2009. Biodegradable 'intelligent' materials in response to physical stimuli for biomedical applications. Expert Opin. Ther. Pat. V.19. P.493. https://doi.org/10.1517/13543770902771282
Jung R.E., Cochran D.L., Domken O., Seibl R., Jones A.A., Buser D., Hammerle C.H. 2007. The effect of matrix bound parathyroid hormone on bone regeneration. Clin. Oral Implants Res. V. 18. P. 319. https://doi.org/10.1111/j.1600-0501.2007.01342.x
Kabu S., Gao Y., Kwon B.K., Labhasetwar V. 2015. Drug delivery, cell-based therapies, and tissue engineering approaches for spinal cord injury. J. Control Release. V. 219. P. 141. https://doi.org/10.1016/j.jconrel.2015.08.060
Kapadia B.H., Berg R.A., Daley J.A., Fritz J., Bhave A., Mont M.A. 2016. Periprosthetic joint infection. Lancet. V. 387. P. 386. https://doi.org/10.1016/S0140-6736(14)61798-0
Kempen D.H., Creemers L.B., Alblas J., Lu L., Verbout A.J., Yaszemski M.J., Dhert W.J. 2010. Growth factor interactions in bone regeneration. Tissue Eng. Part B Rev. V. 16. P. 551. https://doi.org/10.1089/ten.teb.2010.0176
Khlusov I.A., Litvinova L.S., Shupletsova V.V., Khaziakhmatova O.G., Malashchenko V.V., Yurova K.A., Shunkin E.O., Krivosheev V.V., Porokhova E.D., Sizikova A.E., Safiullina L.A., Legostaeva E.V., Komarova E.G., Sharkeev Y.P. 2020. Costimulatory effect of rough calcium phosphate coating and blood mononuclear cells on adipose-derived mesenchymal stem cells in vitro as a model of in vivo tissue repair. materials. V. 13. P. 4398. https://doi.org/10.3390/ma13194398
Kim H.W., Knowles J.C., Kim H.E. 2004. Hydroxyapatite/poly(epsilon-caprolactone) composite coatings on hydroxyapatite porous bone scaffold for drug delivery. Biomaterials. V. 25. P. 1279. https://doi.org/10.1016/j.biomaterials.2003.07.003
Kofron M.D., Laurencin C.T. 2006. Bone tissue engineering by gene delivery. Adv. Drug Deliv. Rev. V. 58. P. 555. https://doi.org/10.1016/j.addr.2006.03.008
Komarova E.G., Sharkeev Y.P., Sedelnikova M.B., Prymak O., Epple M., Litvinova L.S., Shupletsova V.V., Malashchenko V.V., Yurova K.A., Dzyuman A.N., Kulagina I.V., Mushtovatova L.S., Bochkareva O.P., Karpova M.R., Khlusov I.A. 2020. Zn- or Cu-containing CaP-based coatings formed by micro-arc oxidation on titanium and Ti-40Nb alloy: part II–wettability and biological performance. Materials. V. 13. P. 4366. https://doi.org/10.3390/ma13194366
Kothari R., Kumar V., Jena R., Tunga R., Tunga B.S. 2011. Modes of degradation and impurity characterization in rhPTH (1-34) during stability studies. PDA J. Pharm. Sci. Technol. V. 65. P. 348. PMID: https://doi.org/10.5731/pdajpst.2011.007452229352
Lai W.Y., Chen Y.J., Lee A.K., Lin Y.H., Liu Y.W., Shie M.Y. 2021. Therapeutic effects of the addition of fibroblast growth factor-2 to biodegradable gelatin/magnesium-doped calcium silicate hybrid 3D-printed scaffold with enhanced osteogenic capabilities for critical bone defect restoration. Biomedicines. V. 9. P. 712. https://doi.org/10.3390/biomedicines9070712
Lee D., Wufuer M., Kim I., Choi T.H., Kim B.J., Jung H.G., Jeon B., Lee G., Jeon O.H., Chang H., Yoon D.S. 2021. Sequential dual-drug delivery of BMP-2 and alendronate from hydroxyapatite-collagen scaffolds for enhanced bone regeneration. Sci. Rep. V. 11. P. 746. https://doi.org/10.1038/s41598-020-80608-3
Lenfeld P., Brdlík P., Borůvka M., Běhálek L., Habr J. 2020. Effect of radiation crosslinking and surface modification of cellulose fibers on properties and characterization of biopolymer composites. Polymers (Basel). Vol.12. P.3006. https://doi.org/10.3390/polym12123006
Li C., Yang L., Ren X., Lin M., Jiang X., Shen D., Xu T., Ren J., Huang L., Qing W., Zheng J., Mu Y. 2019. Groove structure of porous hydroxyapatite scaffolds (HAS) modulates immune environment via regulating macrophages and subsequently enhances osteogenesis. J. Biol. Inorg. Chem. V. 24. P. 733. https://doi.org/10.1007/s00775-019-01687-w
Liang Y., Luan X., Liu X. 2020. Recent advances in periodontal regeneration: A biomaterial perspective. Bioact. Mater. V. 5. P. 297. https://doi.org/10.1016/j.bioactmat.2020.02.012
Liao Y.H., Chang Y.H., Sung L.Y., Li K.C., Yeh C.L., Yen T.C., Hwang S.M., Lin K.J., Hu Y.C. 2014. Osteogenic differentiation of adipose-derived stem cells and calvarial defect repair using baculovirus-mediated co-expression of BMP-2 and miR-148b. Biomaterials. V. 35. P. 4901. https://doi.org/10.1016/j.biomaterials.2014.02.055
Limongi T., Susa F., Allione M., di Fabrizio E. 2020. Drug delivery applications of three-dimensional printed (3DP) mesoporous scaffolds. Pharmaceutics. V. 12. P. 851. https://doi.org/10.3390/pharmaceutics12090851
Lin T., Jin Q., Mo X., Zhao Z., Xie X., Zou C., Huang G., Yin J., Shen J. 2021. Experience with periprosthetic infection after limb salvage surgery for patients with osteosarcoma. J. Orthop. Surg. Res. V. 16. P. 93. https://doi.org/10.1186/s13018-021-02243-6
Liu Y., de Groot K., Hunziker E.B. 2005. BMP-2 liberated from biomimetic implant coatings induces and sustains direct ossification in an ectopic rat model. Bone. V. 36. P. 745. https://doi.org/10.1016/j.bone.2005.02.005
Lyons K.M., Pelton R.W., Hogan B.L. 1990. Organogenesis and pattern formation in the mouse: RNA distribution patterns suggest a role for bone morphogenetic protein-2A (BMP-2A). Development. V. 109. P. 833
Malek-Khatabi A., Javar H.A., Dashtimoghadam E., Ansari S., Hasani-Sadrabadi M.M., Moshaverinia A. 2020. In situ bone tissue engineering using gene delivery nanocomplexes. Acta Biomater. V. 108. P. 326. https://doi.org/10.1016/j.actbio.2020.03.008
Matai I., Kaur G., Seyedsalehi A., McClinton A., Laurencin C.T. 2020. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials. V. 226. P. 119 536. https://doi.org/10.1016/j.biomaterials.2019.119536
Minting D., Linlin H., Mengke P., Fenyan H., Qiang G., Yasha C., Peng L. 2020. Preparation of vancomycin-loaded alginate hydrogel coating on magnesium alloy with enhanced anticorrosion and antibacterial properties. Thin Solid Films. V. 693. P. 137679. https://doi.org/10.1016/j.tsf.2019.137679
Montoya C., Du Y., Gianforcaro A.L., Orrego S., Yang M., Lelkes P.I. 2021. On the road to smart biomaterials for bone research: definitions, concepts, advances, and outlook. Bone Res. V. 9. P. 12. https://doi.org/10.1038/s41413-020-00131-z
Morrow J.J., Khanna C. 2015. Osteosarcoma genetics and epigenetics: Emerging biology and candidate therapies. Crit. Rev. Oncog. V. 20. P. 173. https://doi.org/10.1615/critrevoncog.2015013713
Nancollas G.H., Tang R., Phipps R.J., Henneman Z., Gulde S., Wu W., Mangood A., Russell R.G., Ebetino F.H. 2006. Novel insights into actions of bisphosphonates on bone: differences in interactions with hydroxyapatite. Bone. V. 38. P. 617. https://doi.org/10.1016/j.bone.2005.05.003
Nie Y., Kalapos C., Nie X., Murphy M., Hussein R., Zhang J. 2010. Superhydrophilicity and antibacterial property of a Cu-dotted oxide coating surface. Ann. Clin. Microbiol. Antimicrob. V. 9. P. 25. https://doi.org/10.1186/1476-0711-9-25
Otsuka M., Matsuda Y., Suwa Y., Fox J.L., Higuchi W.I. 1994. A novel skeletal drug delivery system using a self-setting calcium phosphate cement. 5. Drug release behavior from a heterogeneous drug-loaded cement containing an anticancer drug. J Pharm Sci. V. 83. P. 1565. https://doi.org/10.1002/jps.2600831109
Pan T., Song W., Xin H., Yu H., Wang H., Ma D., Cao X., Wang Y. 2021. MicroRNA-activated hydrogel scaffold generated by 3D printing accelerates bone regeneration. Bioact. Mater. V. 10. P. 1. PMCID: PMC8637000https://doi.org/10.1016/j.bioactmat.2021.08.03434901525
Parent M., Baradari H., Champion E., Damia C., Viana-Trecant M. 2017. Design of calcium phosphate ceramics for drug delivery applications in bone diseases: A review of the parameters affecting the loading and release of the therapeutic substance. J. Control Release. V. 252. P. 1. https://doi.org/10.1016/j.jconrel.2017.02.012
Parvizi J., Saleh K.J., Ragland P.S., Pour A.E., Mont M.A. 2008. Efficacy of antibiotic-impregnated cement in total hip replacement. Acta Orthop. V. 79. P. 335. https://doi.org/10.1080/17453670710015229
Parvizi J., Gehrke T., Chen A.F. 2013. Proceedings of the international consensus on periprosthetic joint infection. bone Joint J. V.95. P. 1450. https://doi.org/10.1302/0301-620X.95B11.33135
Paulini M., Camal Ruggieri I.N., Ramallo M., Alonso M., Rodriguez-Cabello J.C., Esbrit P., Mardegan Issa J.P., Feldman S. 2022. Recombinant proteins-based strategies in bone tissue engineering. Biomolecules. V. 12. P. 3. https://doi.org/10.3390/biom12010003
Peng B., Chen Y., Leong K.W. 2015. MicroRNA delivery for regenerative medicine. Adv. Drug Deliv. Rev. V. 88. P. 108. https://doi.org/10.1016/j.addr.2015.05.014
Peter B., Pioletti D.P., Laïb S., Bujoli B., Pilet P., Janvier P., Guicheux J., Zambelli P.Y., Bouler J.M., Gauthier O. 2005. Calcium phosphate drug delivery system: influence of local zoledronate release on bone implant osteointegration. Bone. V. 36. P. 52. https://doi.org/10.1016/j.bone.2004.10.004
Phillips J.E., Gersbach C.A., García A.J. 2007. Virus-based gene therapy strategies for bone regeneration. Biomaterials. V. 28. P. 211. https://doi.org/10.1016/j.biomaterials.2006.07.032
Phull S.S., Yazdi A.R., Ghert M., Towler M.R. 2020. Bone cement as a local chemotherapeutic drug delivery carrier in orthopedic oncology: A review. J. Bone Oncol. V. 26. P. 100 345. https://doi.org/10.1016/j.jbo.2020.100345
Porter J.R., Ruckh T.T., Popat K.C. 2009. Bone tissue engineering: a review in bone biomimetics and drug delivery strategies. Biotechnol. Prog. V. 25. P. 1539. https://doi.org/10.1002/btpr.246
Pountos I., Giannoudis P.V. 2018. Drug-eluting implants for the suppression of metastatic bone disease: current insights. Expert Rev. Med. Devices. V. 15. P. 301. https://doi.org/10.1080/17434440.2018.1456336
Prosolov K.A., Mitrichenko D.V., Prosolov A.B., Nikolaeva O.O., Lastovka V.V., Belyavskaya O.A., Chebodaeva V.A., Glukhov I.A., Litvinova L.S., Shupletsova V.V., Khaziakhmatova O.G., Malashchenko V.V., Yurova K.A., Shunkin E.O., Fedorov M.A., Komkov A.R., Pavlenko V.V., Anisenya I.I., Sharkeev Yu.P., Vladescu A., Khlusov I.A. 2021. Zn-Doped CaP-based coatings on Ti–6Al–4V and Ti–6Al–7Nb alloys prepared by magnetron sputtering: controllable biodegradation, bacteriostatic, and osteogenic activities. Coatings. V. 11. P. 809. ISSN: 2079-6412https://doi.org/10.3390/coatings11070809
Puljula E., Turhanen P., Vepsäläinen J., Monteil M., Lecouvey M., Weisell J. 2015. Structural requirements for bisphosphonate binding on hydroxyapatite: NMR study of bisphosphonate partial esters. ACS Med. Chem. Lett. V. 6. P. 397. https://doi.org/10.1021/ml5004603
Pura J.A., Bobyn J.D., Tanzer M. 2016. Implant-delivered alendronate causes a dose-dependent response on net bone formation around porous titanium implants in canines. Clin. Orthop. Relat. Res. V. 474. P. 1224. https://doi.org/10.1007/s11999-016-4714-6
Radin S., Campbell J.T., Ducheyne P., Cuckler J.M. 1997. Calcium phosphate ceramic coatings as carriers of vancomycin. Biomaterials. V. 18. P. 777. https://doi.org/10.1016/s0142-9612(96)00190-1
Raeisdasteh Hokmabad V., Davaran S., Ramazani A., Salehi R. 2017. Design and fabrication of porous biodegradable scaffolds: a strategy for tissue engineering. J. Biomater. Sci. Polym. Ed. V. 28. P. 1797. https://doi.org/10.1080/09205063.2017.1354674
Ratko T.A., Belinson S.E., Samson D.J., Bonnell C., Ziegler K.M., Aronson N. 2010. Bone morphogenetic protein: the state of the evidence of on-label and off-Label Use. Rockville (MD): Agency for Healthcare Research and Quality (US).
Ratner B.D., Hoffman A.S., Schoen F.J., Lemons J.E. 2004. Biomaterials science: An introduction to materials in medicine, 2nd ed. San Diego: Elsevier Science Publishing Co. 864 p.
Orthopedic biomaterials – global market outlook (2015–2022). электронный доступ: https://www.mynewsdesk.com/us/stratistics-market-research-consulting/pressreleases/orthopedic-biomaterials-global-market-outlook-2015-2022-1598444
Reufsteck C., Lifshitz-Shovali R., Zepp M., Bäuerle T., Kübler D., Golomb G., Berger M.R. 2012. Silencing of skeletal metastasis-associated genes impairs migration of breast cancer cells and reduces osteolytic bone lesions. Clin. Exp. Metastasis. V. 29. P. 441. https://doi.org/10.1007/s10585-012-9462-8
Rizwan M., Alias R., Zaidi U.Z., Mahmoodian R., Hamdi M. 2018. Surface modification of valve metals using plasma electrolytic oxidation for antibacterial applications: A review. J. Biomed. Mater. Res. A. V. 106. P. 590. https://doi.org/10.1002/jbm.a.36259
Santoro M., Tatara A.M., Mikos A.G. 2014. Gelatin carriers for drug and cell delivery in tissue engineering. J. Control Release. V. 190. P. 210. https://doi.org/10.1016/j.jconrel.2014.04.014
Sayed E., Haj-Ahmad R., Ruparelia K., Arshad M.S., Chang M.W., Ahmad Z. 2017. Porous inorganic drug delivery systems-a review. AAPS PharmSciTech. V. 18. P. 1507. https://doi.org/10.1208/s12249-017-0740-2
Sedelnikova M.B., Komarova E.G., Sharkeev Y.P., Ugodchikova A.V., Mushtovatova L.S., Karpova M.R., Sheikin V.V., Litvinova L.S., Khlusov I.A. 2019. Zn-, Cu- or Ag-incorporated micro-arc coatings on titanium alloys: Properties and behavior in synthetic biological media. Surface and Coatings Technology. V. 369. P. 52. https://doi.org/10.1016/j.surfcoat.2019.04.021
Shafabakhsh R., Yousefi B., Asemi Z., Nikfar B., Mansournia M.A., Hallajzadeh J. 2020. Chitosan: A compound for drug delivery system in gastric cancer-a review. Carbohydr. Polym. V. 242. P. 116403. https://doi.org/10.1016/j.carbpol.2020.116403
Shafiee A., Atala A. 2017. Tissue engineering: toward a new era of Medicine. Ann. Rev. Med. V. 68. P. 29. https://doi.org/10.1146/annurev-med-102715-092331
Shie M.Y., Ding S.J. 2013. Integrin binding and MAPK signal pathways in primary cell responses to surface chemistry of calcium silicate cements. Biomaterials. V. 34. P. 6589. https://doi.org/10.1016/j.biomaterials.2013.05.075
Stokovic N., Ivanjko N., Maticic D., Luyten F.P., Vukicevic S. 2021. Bone morphogenetic proteins, carriers, and animal models in the development of novel bone regenerative therapies. Materials (Basel). V. 14. P. 3513. https://doi.org/10.3390/ma14133513
Sundelacruz S., Kaplan D.L. 2009. Stem cell- and scaffold-based tissue engineering approaches to osteochondral regenerative medicine. Semin. Cell Dev. Biol. V. 20. P. 646. https://doi.org/10.1016/j.semcdb.2009.03.017
Swanson W.B., Zhang Z., Xiu K., Gong T., Eberle M., Wang Z., Ma P.X. 2020. Scaffolds with controlled release of pro-mineralization exosomes to promote craniofacial bone healing without cell transplantation. Acta Biomater. V. 118. P. 215. https://doi.org/10.1016/j.actbio.2020.09.052
Tan R., She Z., Wang M., Yu X., Jin H., Feng Q. 2012. Repair of rat calvarial bone defects by controlled release of rhBMP-2 from an injectable bone regeneration composite. J. Tissue Eng. Regen. Med. V. 6. P. 614. https://doi.org/10.1002/term.463
Tanzawa Y., Tsuchiya H., Shirai T., Nishida H., Hayashi K., Takeuchi A., Kawahara M., Tomita K. 2011. Potentiation of the antitumor effect of calcium phosphate cement containing anticancer drug and caffeine on rat osteosarcoma. J. Orthop. Sci. V. 16. P. 77. https://doi.org/10.1007/s00776-011-0045-3
Tenkumo T., Rojas-Sánchez L., Vanegas Sáenz J.R., Ogawa T., Miyashita M., Yoda N., Prymak O., Sokolova V., Sasaki K., Epple M. 2020. Reduction of inflammation in a chronic periodontitis model in rats by TNF-α gene silencing with a topically applied siRNA-loaded calcium phosphate paste. Acta Biomater. P. 105. V. 263. https://doi.org/10.1016/j.actbio.2020.01.031
Thrivikraman G., Athirasala A., Twohig C., Boda S.K., Bertassoni L.E. 2017. Biomaterials for craniofacial bone regeneration. Dent. Clin. North. Am. V. 61. P. 835. https://doi.org/10.1016/j.cden.2017.06.003
Urist M.R., Strates B.S. 1971. Bone morphogenetic protein. J. Dent. Res. V. 50. P. 1392
US Market Overview for Orthopedic Biomaterials 2017 – MedView. электронный доступ: https://www.reportbuyer.com/product/4759849/us-market-overview-for-orthopedic-biomaterials-2017-medview.html
Van de Putte K.A., Urist M.R. 1965. Osteogenesis in the interior of intramuscular implants of decalcified bone matrix. Clin. Orthop. V. 40. P. 48.
Wang Y., Newman M.R., Benoit D.S.W. 2018. Development of controlled drug delivery systems for bone fracture-targeted therapeutic delivery: A review. Eur. J. Pharm. Biopharm. V. 127. P. 223. https://doi.org/10.1016/j.ejpb.2018.02.023
Wang X., Xu S., Zhou S., Xu W., Leary M., Choong P., Qian M., Brandt M., Xie Y.M. 2016. Topological design and additive manufacturing of porous metals for bone scaffolds and orthopaedic implants: A review. Biomaterials. V. 83. P. 127. https://doi.org/10.1016/j.biomaterials.2016.01.012
Wang W., Yeung K.W.K. 2017. Bone grafts and biomaterials substitutes for bone defect repair: A review. Bioact. Mater. V. 2. P. 224. https://doi.org/10.1016/j.bioactmat.2017.05.007
Wang Z., Wang Y., Yan J., Zhang K., Lin F., Xiang L., Deng L., Guan Z., Cui W., Zhang H. 2021. Pharmaceutical electrospinning and 3D printing scaffold design for bone regeneration. Adv. Drug. Deliv. Rev. V. 174. P. 504. https://doi.org/10.1016/j.addr.2021.05.007
Whitmire R.E., Wilson D.S., Singh A., Levenston M.E., Murthy N., García A.J. 2012. Self-assembling nanoparticles for intra-articular delivery of anti-inflammatory proteins. Biomaterials. V. 33. P. 7665. https://doi.org/10.1016/j.biomaterials.2012.06.101
Xie L., Xu J., Sun X., Li X., Liu K., Liang X., Zhou Z., Zhuang H., Sun K., Wu Y., Gu J., Guo W. 2021. Apatinib plus ifosfamide and etoposide for relapsed or refractory osteosarcoma: A retrospective study in two centres. Oncol. Lett. V. 22. P. 552. https://doi.org/10.3892/ol.2021.12813
Yadavalli T., Ames J., Agelidis A., Suryawanshi R., Jaishankar D., Hopkins J., Thakkar N., Koujah L., Shukla D. 2019. Drug-encapsulated carbon (DECON): A novel platform for enhanced drug delivery. Sci. Adv. V. 5. P. 0780. https://doi.org/10.1126/sciadv.aax0780
Yan Y., Chen H., Zhang H., Guo C., Yang K., Chen K., Cheng R., Qian N., Sandler N., Zhang Y.S., Shen H., Qi J., Cui W., Deng L. 2019. Vascularized 3D printed scaffolds for promoting bone regeneration. Biomaterials. V. 190. P. 97. https://doi.org/10.1016/j.biomaterials.2018.10.033
Yang Z., Han J., Li J., Li X., Li Z., Li S. 2009. Incorporation of methotrexate in calcium phosphate cement: behavior and release in vitro and in vivo. Orthopedics. V. 32. P. 27. https://doi.org/10.3928/01477447-20090101-28
Zeng Y., Hoque J., Varghese S. 2019. Biomaterial-assisted local and systemic delivery of bioactive agents for bone repair. Acta Biomater. V. 93. P. 152. https://doi.org/10.1016/j.actbio.2019.01.060
Zhang W., Shi W., Wu S., Kuss M., Jiang X., Untrauer J.B., Reid S.P., Duan B. 2020. 3D printed composite scaffolds with dual small molecule delivery for mandibular bone regeneration. Biofabrication. V. 12. P. 035020. https://doi.org/10.1088/1758-5090/ab906e
Zhang Y., Sun T., Jiang C. 2018. Biomacromolecules as carriers in drug delivery and tissue engineering. Acta Pharm. Sin. B. V. 8. P. 34. https://doi.org/10.1016/j.apsb.2017.11.005
Zhou W., Hao M., Du X., Chen K., Wang G., Yang J. 2014. Advances in targeted therapy for osteosarcoma. Discov. Med. V. 17. P. 301
Дополнительные материалы отсутствуют.
Инструменты
Цитология


