Цитология, 2022, T. 64, № 4, стр. 390-395
Анализ перестроек фибриллярного актина в мезенхимных стволовых клетках человека линии FetMSC с использованием фрактальной размерности Минковского
А. В. Ревитцер 1, *, В. И. Чубинский-Надеждин 1, Ю. А. Негуляев 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: eetytnet@gmail.com
Поступила в редакцию 15.03.2022
После доработки 15.03.2022
Принята к публикации 22.03.2022
- EDN: MCTLFH
- DOI: 10.31857/S0041377122040071
Аннотация
Квантификация перестроек фибриллярного актина с использованием микрофотографий возможна не только с помощью стандартного измерения относительной интенсивности флуоресценции, но и с помощью разработанного нами нового подхода на базе расчета фрактальной размерности Минковского. Для вычисления фрактальной размерности использовали плагин FracLac для ImageJ. Перестройки фибриллярного актина выявляли в мезенхимных стволовых клетках человека линии FetMSC после воздействия ингибитора полимеризации актина латрункулина Б или предсердного натрийуретического пептида, влияние которого на актиновый цитоскелет мезенхимных стволовых клеток было обнаружено нами ранее. Проведенный в данной работе анализ изображений выявил изменения параметра фрактальной размерности, отражающие реорганизацию микрофиламентов в нативных клетках. Полученные результаты демонстрируют, что фрактальная размерность Минковского является удобным инструментом для оценки перестроек фибриллярного актина и может использоваться, дополняя или заменяя результаты измерения относительной интенсивности флуоресценции.
Многие биологические структуры и клеточные органеллы, такие как цитоскелет, комплекс Гольджи, дендриты нейронов, внутренние мембраны митохондрий (кристы) обладают сложной геометрической формой. В ряде случаев количественная морфометрическая оценка таких объектов практически невозможна, что накладывает ограничения на применение сравнительного анализа состояния данных структур, например, при оценке действия различных биологически активных соединений. Одним из решений может быть использование фрактальной геометрии, в рамках которой изображения таких структур рассматриваются как геометрические фигуры, и далее проводится их количественная оценка с применением фрактальной размерности Минковского (ФРМ, или box-counting алгоритм; Karperien, 2004). Понятие “фрактал” впервые ввел Бенуа Мандельброт (Mandelbrot, 1983), и по его определению фрактал – это самоподобная структура, а фрактальная размерность – это мера ее геометрической сложности. Для проведения вычислений фрактальной размерности изображений были созданы различные программные продукты, среди которых можно выделить плагин FracLac (Karperien, 2004) как дополнение для свободно распространяемого программного обеспечения ImageJ. Его преимуществами являются бесплатный доступ, понятный интерфейс и настройки, позволяющие точно подобрать параметры вычисления для интересующего набора изображений.
Одним из объектов в клеточной биологии, которые нуждаются в качественной и количественной оценке, является фибриллярный (F) актин. F-актин (состоящий из глобулярного G-актина) и актин-связывающие белки формируют актиновый цитоскелет клетки (Fletcher, Mullins, 2010). В структуре цитоскелета нативных клеток F- и G-актин находятся в постоянном динамическом балансе: с плюс-конца нити происходит сборка филамента, а с минус-конца его разборка (Neuhaus et al., 1983). Актиновый цитоскелет имеет критическое значение для клеточной подвижности и миграционного потенциала немышечных клеток как в норме, так и при различных патологиях, включая метастазирование и диссеминацию раковых клеток. Наиболее широко распространенным методом выявления F-актина в клетках является флуоресцентная микроскопия. В препаратах клеток F-актин окрашивают специфическими антителами, или с помощью фаллоидина, природного актин-связывающего соединения рода фаллотоксинов, конъюгированного с флуоресцентными красителями. Важно отметить, что фаллоидин специфически связывается с нитями F-актина, и, в то же время, не способен присоединяться к G-актину (Cooper, 1987).
Ранее нами было обнаружено, что предсердный натрийуретический пептид (ПНП) способен влиять на организацию F-актина и подвижность мезенхимных стволовых клеток линии FetMSC (Ревитцер и др., 2019). Цель настоящей работы заключается в проведении количественной оценки состояния структур F-актина в клетках FetMSC, обработанных ПНП или латрункулином Б (Lat B), с помощью вычисления фрактальной размерности Минковского (Revittser et al., 2021).
МАТЕРИАЛ И МЕТОДИКА
Клетки. Мезенхимные стволовые клетки, выделенные из костного мозга 5–6 недельного эмбриона человека (FetMSC) получены из Центра коллективного пользования ИНЦ РАН (Санкт-Петербург) “Коллекция культур клеток позвоночных” (Соглашение № 075-15-2021-683) (Крылова и др., 2012). Перед экспериментами клетки высевали на покровные стекла, помещенные в чашки Петри, плотность составляла 104 клеток/см2. В качестве питательной среды использовали DМЕМ/F12 (Биолот, Россия), содержащую 10% сыворотки плодов коровы (HyClone, США), 2 мМ L-глутамина, смесь пенициллина (50 Ед/мл) и стрептомицина (50 мкг/мл) (Биолот, Россия). Клетки культивировали в инкубаторе при 37°С, 5% СО2 и 90%-ной влажности, смену среды проводили каждые 2–3 сут, эксперименты проводили на клетках, достигших субконфлюентности.
Обработка модификаторами актинового цитоскелета. В работе использовали хорошо изученный модификатор актинового цитоскелета токсин биологического происхождения Lat B (Spector et al., 1989). Lat B растворяли в DMSO (25 мг/мл). Механизм действия Lat B на актиновый цитоскелет клетки известен: связываясь с мономерами актина в стехиометрии 1 : 1 он ингибирует его полимеризацию, что препятствует образованию новых актиновых филаментов. Обработку клеток Lat B в концентрации 10 или 1000 нМ в среде культивирования проводили в течение 30 мин в СО2-инкубаторе; в качестве контроля использовали клетки без обработки или клетки после действия 1 мкМ диметилсульфоксида (DMSO, растворителя для Lat B). Во второй серии экспериментов клетки обрабатывали ПНП в концентрации 10 или 1000 нМ в течение 24 ч в СО2-инкубаторе; контрольными служили клетки без обработки (растворитель для ПНП − дистиллированная вода).
Выявление F-актина в клетках FetMSC. После культивирования с исследуемыми веществами клетки фиксировали 10 мин при 25°С 5%-ным раствором формальдегида в однократном фосфатно-солевом буферном растворе (PBS). Затем проводили пермеабилизацию клеточной мембраны с помощью 0.5%-ного раствора Triton Х-100 (10 мин в PBS). Для флуоресцентного мечения F-актина образцы инкубировали с фаллоидином, конъюгированным с родамином (TRITC-phalloidin, 1 мкг/мл; Sigma-Aldrich, Германия) в течение 15 мин при 37°С. Ядра окрашивали с помощью красителя Hoechst 33342 (Sigma, США; 2 мкг/мл в PBS). Далее покровные стекла крепили к предметному стеклу, используя среду Vectashield Mounting Media (Vector Labs, США), препятствующую “выгоранию” образцов. Микрофотографии получали с использованием лазерного сканирующего конфокального микроскопа Olympus FV3000 (Оlympus Сorporation, Япония), укомплектованного лазерами с длиной волны возбуждения 561 и 350 нм (для выявления родамин-фаллоидина и красителя Hoechst 33 342 соответственно). Параметры мощности лазеров, апертурной диафрагмы, свойства регистрирующих фотоумножителей были постоянными при визуализации всех препаратов.
Измерение относительной интенсивности флуоресценции (ИФ) и фрактальной размерности Минковского. Использовали программу ImageJ (NIH, США). Предварительно в меню Analyze → Set measurements устанавливали измерение “среднее значение серого” (Mean gray value). Далее в микрофотографии выделяли слой, содержащий изображение F-актина, и переводили его в 8-битный формат, содержащий только оттенки серого (функция Image → Type → 8-bit). После этого с помощью курсора выделяли область клетки “свободное выделение” (Freehand selection) и получали значение ИФ выделенного участка с помощью функции Analyze → Measure. Данные заносили в таблицу Microsoft Excel (Microsoft Ofiice, США), итоговые значения ИФ представлены средними из 10 измерений (n) и их стандартной ошибки, достоверность различий оценивали с помощью дисперсионного анализа с уровнем значимости Р < 0.05.
Измерение ФРМ проводили с помощью плагина FracLac (NIH, США). Предварительно в плагине устанавливали тип измерений Box-counting. Далее с помощью функции Image → Color → Split Channels в микрофотографии выделяли канал, содержащий изображение F-актина. После этого полученное изображение переводили в черно-белый формат с помощью функции Process → Binary → Make Binary и возвращали “скелет” фигуры с помощью Process → → Binary → Skeletonize. Затем с помощью курсора (Freehand selection) выделяли область клетки и в плагине FracLac проводили расчет ФРМ с помощью функции Scan. Полученные данные вносили в таблицу Exсel, итоговые значения ФРМ представлены средними из 10 измерений (n = 10) и их стандартной ошибки, достоверность различий оценивали с помощью дисперсионного анализа с уровнем значимости Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Окрашивание F-актина в клетках FetMSC после действия Lat B. Известно, что фаллоидин специфично связывается с F-актином, поэтому качественная и количественная оценка окрашенных нитей актина может отражать сборку или разборку актинового цитоскелета (Cooper, 1987). Мы окрашивали F-актин клеток FetMSC родамин-фаллоидином в контроле (рис. 1а), и в образцах, обработанных 1000 нМ DMSO (растворителем Lat B; рис. 1б) и Lat B в концентрации 50 нМ (рис. 1в) и 1000 нМ (рис. 1г). В контрольных условиях, как и в присутствии DMSO или 50 нМ Lat B все клетки имеют фибробластоподобную морфологию и выраженные стресс-фибриллы, что типично для меземхимных стволовых клеток. Как и следовало ожидать, после обработки клеток 1000 нМ Lat B мы не наблюдали выраженных стресс фибрилл, а само окрашивание было дисперсным и не имело четко выраженной организации. Полученные результаты согласуются с описанным ранее в литературе действием Lat B: при малых концентрациях (менее 50 нМ) вещество не оказывает влияния на актиновые структуры, а при концентрациях 500 нМ и выше ингибирует сборку актиновых фибрилл в клетке (Wakatsuki et al., 2001), что приводит к паттерну флуоресцентного окрашивания, схожему с наблюдаемым нами в FetMSC. Процессы формирования нитей актина в клетке динамичны, а именно включают в себя постоянную сборку нити с одного конца и ее разборку с другого; по этой причине ингибирование сборки нитей при инкубации Lat B вызывает ее последующую разборку (Spector et al., 1989).
Рис. 1.
Флуоресценция F-актина (красный цвет) клеток FetMSC, окрашенных родамин-фаллоидином в контроле (а) и после 30-минутного действия Lat B в концентрации 50 нМ (в) и 1000 нМ (г). б – После 30-минутного действия 1000 нМ DMSO (растворителя Lat B). Ядра окрашены Hoechst (синий цвет). Масштабная линейка: 50 мкм.

Численная оценка разборки F-актина после действия Lat B. Оценку (в каждой крупе было по 10 клеток) проводили двумя методами: с помощью вычисления ИФ или ФРМ (рис. 2 и табл. 1). Применяя дисперсионный анализ, мы не выявили отличий между контрольной группой клеток и группой, обработанной 1000 нМ DMSO ни по параметру ИФ, ни по параметру ФРМ, что указывает на отсутствие влияния растворителя DMSO на F-актин FetMSC. Кроме того, не было выявлено различий между контрольной группой и группой, обработанной 10 нМ Lat B. Мы предполагаем, что этой концентрации вещества, по-видимому, недостаточно для детектируемого ингибирования полимеризации актина и разрушения цитоскелета за 30 мин действия. Наши результаты согласуются с данными из литературы. Так, показано, что при воздействии Lat B в концентрации 10 нМ на клетки линии NIH/3T3 в течение 30 мин перед фиксацией не выявлено значимых различий в структуре F-актина по сравнению с контролем ни с помощью визуального анализа микрофотографий, ни с помощью сравнения значений ИФ (Liu et al., 2020). Другие авторы также не наблюдали изменений свойств клеток при воздействии Lat B в концентрациях ниже 50 нМ (Wakatsuki et al., 2001). Мы обнаружили достоверные различия средних значений ИФ и ФРМ между контрольной группой и группой, обработанной 1000 нМ Lat B, что совпадает с визуальной оценкой микрофотографий окрашенного F‑актина (рис. 1).
Рис. 2.
Интенсивность флуоресценции (ИФ) (а) и фрактальная размерность Минковского (ФРМ) (б) F-актина в контроле и при действии Lat B в разной концентрации. Представлены средние значения и стандартная ошибка среднего. Отличия от контроля (К) достоверны при *Р < 0.05 или **Р < 5 × 10−7.
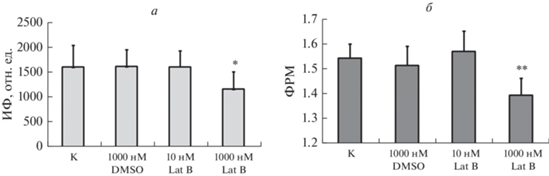
Таблица 1.
Значения показателей ИФ и ФРМ в клетках FetMSC контрольных и после обработки Lat B или ПНП в различных концентрациях
| Условия | ИФ, отн. ед. | ФРМ, отн. ед. |
|---|---|---|
| Lat B в течение 30 мин | ||
| Контроль | 1624 ± 438 | 1.54 ± 0.06 |
| DMSO, 1000 нМ | 1633 ± 336 | 1.52 ± 0.08 |
| Lat B, 10 нМ | 1625 ± 325 | 1.57 ± 0.08 |
| Lat B, 1000 нМ | *1177 ± 350а | 1.40 ± 0.07б |
| ПНП в течение 24 ч | ||
| Контроль | 1824 ± 237 | 1.45 ± 0. 05 |
| 10 нМ ПНП | 2408 ± 292а | 1.56 ± 0.05а |
| 1000 нМ ПНП | 1751 ± 201 | 1.43 ± 0. 04 |
Таким образом, наблюдаемые изменения структуры F-актина были подтверждены при численной оценке как с помощью измерений ИФ, так и при расчете ФРМ, при этом уровни достоверной значимости различий составили P < 0.05 для ИФ и Р < 5 × 10–7 для ФРМ, которые свидетельствуют о том, что оценка значений ФРМ является более чувствительным показателем, чем ИФ в данной серии экспериментов.
Оценка изменений структуры F-актина в FetMSC после действия ПНП. В настоящей работе, как и ранее (Ревитцер и др., 2019), мы наблюдали сборку F‑актина при воздействии ПНП в концентрации 10 нМ в течение 24 ч перед фиксацией (рис. 3а–в). Эти результаты подтверждаются анализом литературы: показано, что добавление 10 нМ ПНП в культуральную среду эндотелиальных клеток аорты вызывает сборку F-актина (Kook et al., 2003; Chen et al., 2008). В то же время мы не обнаружили различий организации F-актина между контрольными клетками и клетками, обработанными 1000 нМ ПНП, что тоже согласуется с нашими предыдущими результатами (Ревитцер и др., 2019). Этот факт вызывает особый интерес, а анализ литературы позволяет обнаружить, что существует несколько примеров веществ, которые оказывают действие только в малых концентрациях, а при ее повышении эффекта нет. Среди таких веществ можно выделить трансформирующий фактор роста β1 (Pepper et al., 1993) и бортезамиб (Veschini et al., 2007). Подобный тип влияния называется U‑образным (u-shape) или bell-образным (bell-shape) (Reynolds et al., 2010).
Рис. 3.
Флуоресцентное окрашивание F-актина клеток FetMSC в контроле и после 24-часового действия ПНП. а – Контроль (К); б – 10нМ ПНП; в – 1000 нМ ПНП; г – ФРМ изображений F-актина, приведены средние значения и стандартная ошибка среднего, различия достоверны при *Р < 0.05. Масштабная линейка: 100 мкм.

Численная оценка перестроек F-актина после действия ПНП. Мы оценили ФРМ F-актина для клеток, обработанных ПНП в различных концентрациях в течение 24 ч перед фиксацией и окрашиванием (рис. 3, табл. 1). В табл. 1 показано сопоставление значений ФРМ, полученных в настоящей работе, со значениями ИФ, рассчитанными нами ранее (Ревитцер и др., 2019). Выявленные в настоящей работе значения ФРМ составили для контрольной группы 1.45 ± 0. 05 отн. ед.; для клеток, обработанных 10 или 1000 нМ ПНП, 1.56 ± 0.05 и 1.43 ± 0.04 отн. ед. соответственно.
Применяя дисперсионный анализ, мы выявили различия значений как ФРМ, так и в ИФ между контрольной группой и группой клеток, обработанных 10 нМ ПНП. Однако мы не выявили различий между контролем и группой клеток, обработанных ПНП в большей концентрации (1000 нМ). Уровни значимости составили P < 0.05 как для ИФ, так и для ФРМ, что указывает на схожий уровень чувствительности используемых методов и оценок в данной серии экспериментов. Полученные результаты согласуются с визуальной оценкой микрофотографий и данными, опубликованными ранее (Ревитцер и др., 2019), в том числе показывающими изменение подвижности FetMSC при воздействии только 10 нМ ПНП.
Качественная оценка изменений F-актина не всегда является надежным методом, так как во многом зависит от личного мнения исследователя, осуществляющего эту оценку. Чтобы обеспечить объективность оценки результатов экспериментов, следует прибегнуть к количественным методам. В настоящей работе были рассмотрены два метода квантификации: измерение относительной ИФ и ФРМ. Оба метода показали себя способными выявлять и подтверждать изменения организации F-актина при действии биологически активных веществ (Lat B и ПНП), причем в случае с Lat B достоверность измеряемых значений различий была существенно выше в случае ФРМ, чем ИФ. В настоящее время чаще оценивают ИФ, чем ФРМ для квантификации изменений, что можно связать с простотой регистрации в ходе расчета ИФ. Однако необходимо заметить, что ФРМ, в отличие от ИФ, позволяет учитывать не саму интенсивность свечения флуоресцентных изображений F-актина, а именно форму и расположение актиновых фибрилл. Таким образом, разные принципы получения численных значений делают ФРМ и ИФ взаимодополняющими методами при квантификации изображений F-актина.
Список литературы
Крылова Т.А., Кольцова А.М., Зенин В.В., Мусорина А.С., Яковлева Т.К., Полянская Г.Г. 2012. Сравнительные характеристики новых линий мезенхимных стволовых клеток, полученных из эмбриональных стволовых клеток, костного мозга и крайней плоти человека. Цитология. Т. 54. С. 5. (Krylova T.A., Koltsova A.M., Zenin V.V., Musorina A.S., Yakovleva T.K., Poljanskaya G.G. 2012. Comparative characteristics of new mesenchymal stem cell lines derived from human embryonic stem cells, bone marrow and foreskin. Tsitologiya. V. 54. P. 5.)
Ревитцер А.В., Чубинский-Надеждин В.И., Негуляев Ю.А. 2019. Влияние предсердного найтрийуретического пептида на реорганизацию актинового цитоскелета и миграцию мезенхимных стволовых клеток человека. Цитология. Т. 61. С. 817. (Revittser A.V., Chubinsky-Nadezhdin V.I., Neguliaev Yu.A. 2018. The Effect of Atrial Natriuretic Peptide on Reorganization of Actin Cytoskeleton and Migration of Human Mesenchymal Stem Cells. Tsitologiya. V. 61. P. 817.)
Chen H., Levine C., Golan E., Michel T., Lin J. 2008. Atrial natriuretic peptide-initiated cGMP pathways regulate vasodilator-stimulated phosphoprotein phosphorylation and angiogenesis in vascular endothelium. J. Biol. Chem. V. 283. P. 4439.
Cooper J.A. 1987. Effects of cytochalasin and phalloidin on actin. J. Cell Biol. V. 105. P. 1473.
Fletcher D.A., Mullins R.D. 2010. Cell mechanics and the cytoskeleton. Nature. V. 7280. P. 485.
Karperien A. 2004. Defining microglial morphology: Form, function, and fractal dimension. Melbourne: Charles Sturt University.
Kook H., Itoh H., Choi B., Sawada N., Doi K., Hwang T., Kim K., Arai H., Baik Y., Nakao K. 2003. Physiological concentration of atrial natriuretic peptide induces endothelial regeneration in vitro. Am. J. Physiol. Heart Circ. Physiol. V. 284. P. H1388.
Liu Y., Mollaeian K., Shamim M.H., Ren J. 2020. Effect of F‑actin and microtubules on cellular mechanical behavior studied using atomic force microscope and an image recognition-based cytoskeleton quantification approach. Int. J. Mol. Sci. V. 21. P. 392.
Neuhaus J.-M., Wanger M., Keiser T., Wegner A. 1983. Treadmilling of actin. J. Muscle Res. Cell Motil. V. 4. P. 507.
Mandelbrot B. B. 1983. The irregular and fragmented nature in the fractal geometry of nature. N.Y.: Macmillan Publishers.
Pepper M.S., Vassalli J.D., Orci L., Montesano R. 1993. Biphasic effect of transforming growth factor-beta 1 on in vitro angiogenesis. Exper. Cell Res. V. 204. P. 356.
Reynolds A.R. 2010. Potential relevance of bell-shaped and u-shaped dose-responses for the therapeutic targeting of angiogenesis in cancer. Dose-Response. V. 8. P. 253.
Revittser A., Selin I., Negulyaev Y., Chubinskiy-Nadezhdin V. 2021. The analysis of F-actin structure of mesenchymal stem cells by quantification of fractal dimension. PloS One. V. 16. P. e0260727. https://doi.org/10.1371/journal.pone.0260727
Spector I., Shochet N.R., Blasberger D., Kashman Y. 1989. Latrunculins–novel marine macrolides that disrupt microfilament organization and affect cell growth: I. Comparison with cytochalasin D. Cell Motil. Cytoskeleton. V. 13. P. 127.
Veschini L., Belloni D., Foglieni C., Cangi M.G., Ferrarini M., Caligaris-Cappio F., Ferrero E. 2007. Hypoxia-inducible transcription factor-1 alpha determines sensitivity of endothelial cells to the proteosome inhibitor bortezomib. Blood. V. 109. P. 2565.
Wakatsuki T., Schwab B., Thompson N.C., Elson E.L. 2001. Effects of cytochalasin D and latrunculin B on mechanical properties of cells. Journal of cell science. V. 114. P. 1025.
Дополнительные материалы отсутствуют.


