Цитология, 2022, T. 64, № 4, стр. 396-403
Криорезистентность клеток с фенотипом, подобным мезенхимным стволовым, выделенным из подкожной жировой ткани человека
И. П. Савченкова 1, *, Е. А. Савченкова 1, М. И. Гулюкин 1
1 Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии
им. К.И. Скрябина и Я.Р. Коваленко РАН (ФГБНУ ФНЦ ВИЭВ РАН)
109428 Москва, Россия
* E-mail: s-ip@mail.ru
Поступила в редакцию 17.03.2022
После доработки 20.04.2022
Принята к публикации 25.04.2022
- EDN: DHFULX
- DOI: 10.31857/S0041377122040095
Аннотация
В медицине, в том числе ветеринарной, интенсивно развивается направление, которое рассматривает применением низких температур в лечении различных заболеваний человека и животных. Конкретные механизмы устойчивости различных типов клеток к холоду до сих пор остаются неясными и требуют дальнейшего изучения. Ранее была получена линия клеток с фенотипом, подобным мезенхимным стволовым клеткам (МСК), из подкожно-жировой ткани (ПЖТ) человека, замороженной без криопротектора (–70°С). Представляло интерес сравнить in vitro реакцию этих клеток на действие низких температур (–70 и –196°С при времени экспозиции 15, 30 и 60 с), с реакцией МСК, выделенными из свежеизолированной ПЖТ. Анализ результатов продемонстрировал, что МСК из ПЖТ устойчивы к воздействию изученных параметров низких температур. Температура –70°С не оказывала отрицательного действия на клетки обоих вариантов ни в одном из указанных временных параметров. После пребывание в жидком азоте и оттаивания во всех вариантах наблюдали разрыв монослоя и высокую долю клеток с поврежденной цитоплазматической мембраной. Клетки формировали монослой, но с различной скоростью, размножались, сохраняли иммунофенотип (CD29+, CD44+, CD49a+, CD90+, CD105+, HLA ABC+) и способность при индукции формировать клетки жировой ткани in vitro. Наиболее устойчивыми к действию низких температур являются МСК, выделенные ранее из замороженной ПЖТ человека. Полученные результаты могут быть полезными для дальнейшего изучения процессов и механизмов, лежащих в основе адаптации клеток млекопитающих к холоду.
Изучение действия низких температур на молекулярно-клеточные изменения биологических объектов и их функцию позволяет создать новейшие криотехнологии и внедрять в медицину методы улучшения здоровья людей и животных. Исследования патофизиологических, биохимических, морфологических и иммунологических процессов на клеточном, тканевом и организменном уровнях позволили научно обосновать применение криохирургии, криотерапии и гипотермии в медицинской практике, а также обеспечить развитие нового направления в современной медико-биологической науке – биомедицинские клеточные продукты и их потенциальные возможности для медицины (Федеральный закон № 180-ФЗ от 23 июня 2016 г. “О биомедицинских клеточных продуктах”).
Все существующие подходы к лечению болезней с помощью криохирургии и криотерапии сформировались на основе данных классической криобиологии и методов, разработанных для криоконсервации клеток (Ревишвили и др., 2019). Криобиология обеспечила длительное хранение клеток и тканей различного происхождения (Грищенко, 2008). Вместе с тем конкретные механизмы, лежащие в основе разной устойчивости клеток и тканей организма к действию низких температур, остаются невыясненными до сих пор и требуют дальнейшего изучения. Вопрос о реакции клеток раннего гистогенеза (эмбрионального, плодового), стволовых и их потомков на охлаждение и криоконсервирование и характере изменений в биологических структурах разного срока развития при этом остается недостаточно изученным. Использование лечебного действия холода на организм невозможно без углубленного понимания явлений и процессов, которые происходят в охлаждаемых и замораживаемых клетках и тканях (Gao, Crister, 2000; Fowler, Toner, 2005).
В криотерапии воспаления забрюшинной (парапанкреатической) жировой ткани, которая окружает поджелудочную железу, используют обработку жидким азотом. Ранее мы показали, что в жировой ткани человека, подвергнутой низкотемпературному шоку (–70°С без криопротектора) сохраняется клеточная популяция со свойствами мезенхимных стволовых клеток (МСК) (Савченкова, Коржикова, 2009). Поэтому мы предположили, что после криотерапии жировой клетчатки поджелудочной железы в ней могут сохраняться популяции клеток, подобные полученной нами, которые не теряют свои свойства, в том числе способность к регенерации.
Представляло интерес предварительно изучить действие низких температур, в том числе жидкого азота, на клетки с фенотипом мезенхимных стволовых, выделенных из подкожно-жировой ткани (ПЖТ) человека in vitro. Клетки, выделенные из стромальной фракции ПЖТ человека обладают свойствами, схожими с МСК, полученными из костного мозга человека (Тепляшин и др., 2005). В настоящий момент МСК из ПЖТ человека рассматриваются как перспективный материал для регенеративной и восстановительной медицины, который требует стандартизации и безопасности. Не менее важным является изучение молекулярно-генетических свойств МСК в условиях хранения при низких температурах, которые могут оказывать существенноe влияние на качество клеточного материала (Erol et al., 2021).
Кроме того, использование низких температур представляет собой усовершенствованный подход к краткосрочному сохранению для обеспечения готовых источников клеток для стремительно развивающейся клеточной медицины и биоинженерии (Huang et al., 2020). Биологический метаболизм в живых клетках резко снижается при низких температурах, что позволяет долгосрочно сохранять живые клетки и ткани in vitro, как для научных исследований, так и для многих медицинских и промышленных применений, например, переливания крови, трансплантации костного мозга, искусственного оплодотворения. Выживаемость клеток связана с физическими реакциями всей клетки в ответ на физико-химические события, вовлеченные в процесс действия низких температур (Cusker, 2020). Поэтому адаптация клеток к холоду, в том числе стволовых, представляет интерес.
Цель данной работы заключалась в изучении реакции клеток с фенотипом, подобным мезенхимным стволовым, выделенным из подкожно-жировой ткани млекопитающих, в том числе ранее подвергнутой низкотемпературному шоку, на быстрое охлаждение в отсутствие криопротектора.
МАТЕРИАЛ И МЕТОДИКА
Клетки и культивирование. Эксперименты проводили на клетках с фенотипом, подобным МСК, которые были выделены из стромально-васкулизированной фракции свежеизолированной ПЖТ человека и собак, а также из ПЖТ, подвергнутой ранее низкотемпературному шоку (–70°С без криопротектора). Клетки были взяты из криобанка лаборатории стволовых клеток при ФНЦ ВИЭВ РАН.
Все МСК культивировали в среде DMEM с низким (1 г/л) содержанием глюкозы, с 10% сыворотки крови плодов коровы (СКПК) (HyClone, Perbio, Бельгия) и с однократным раствором заменимых аминокислот и антибиотиков. Конечная концентрация стрептомицина в среде составляла 50 мкг/мл, а пенициллина – 50 ед/мл. Для культивирования клетки пассировали в плотности 5 × 103 кл./см2. Все перечисленные реактивы от фирмы ПанЭко (Россия).
Быстрое охлаждение клеток. Для изучения действия низких температур один из двух культуральных флаконов (площадь 25 см2) с монослоем одних и тех же клеток на 3-м пассаже, помещали в холодильник при –70°С (Haier, Китай), а второй – в жидкий азот при –196°С. Время нахождения клеток при указанных температурах составляло 15, 30 и 60 с. Оценку клеток проводили сразу после оттаивания (при комнатной температуре), через 24 ч, 3, 5, 7 и 9 сут культивирования. Эксперименты повторяли трижды.
Жизнеспособность и морфология клеток. Жизнеспособность (целостность мембраны) определяли по стандартной методике окраской трипановым синим (0.02% раствор), который проникает в клетки с поврежденной плазматической мембраной и окрашивает их в синий цвет. Неокрашенные клетки считали жизнеспособными и оценивали их как отношение числа жизнеспособных клеток к общему числу клеток в суспензии (в %). Далее МСК оценивали визуально по морфологии, адгезии к дну культурального пластика, скорости и качеству формируемого клеточного монослоя, способности клеток к размножению.
Проточная цитометрия. Наличие поверхностных антигенов анализировали с помощью проточной цитофлуориметрии на цитометре Epics Elite Cоulter (США). Для этого МСК человека на 2-ом пассаже после воздействия низких температур снимали с субстрата 0.25%-ным раствором трипсина, подсчитывали, отмывали и аликвоты по 2 × 105 клеток инкубировали с мышиными антителами против следующих антигенов человека: CD29, CD31, CD34, CD44, CD49a, CD90, CD105, CD166, HLA ABC (Becton Dickinson, США), в разведении 1 : 30 (фосфатно-солевой раствор, дополненный 2% СКПК) при 4ºС в течение 45 мин в темноте. В качестве вторых антител использовали анти-мышиные IgG, меченые фикоэритрином (Becton Dickinson, США). Анализ повторяли несколько раз. Контролем были МСК из ПЖТ человека без воздействия низких температур.
Дифференцировка МСК. Способность МСК человека к индукционной дифференцировке в адипогенном направлении in vitro изучали с использованием набора StemPro® Adipogenesis Differentiation Kit фирмы Gibco, США. Для этого МСК на 2-ом пассаже высевали в 6-луночные планшеты в плотности 105 клеток на лунку. По достижении клетками 80%-ного монослоя, рабочую питательную среду удаляли и добавляли индукционную среду по рекомендации производителя. Индукционную среду меняли каждые 4 сут. Анализ дифференцировки МСК человека и собаки проводили на 21-е сут культивирования. Клетки фиксировали метанолом при –20°С в течение 10 мин и окрашивали специфическим красителем жировым красным О (Oil Red O; Sigma-Aldrich, США).
Клетки визуализировали с помощью инвертированного фазово-контрастного микроскопа Axio Observer D.1 (Carl Zeiss, Германия), используя объектив с увеличением 10, 20, 40 и 63× и программное обеспечение AxioVision Rel. 4.8 (Carl Zeiss, Германия).
Статистическая обработка. Результаты выражали значениями среднего арифметического и его стандартной ошибки. Достоверность различий оценивали по t-критерию Стьюдента при P < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Помещение всех экспериментальных клеток в холодильник при –70°С не оказывало отрицательного действия ни на один из указанных параметров. Во всех экспериментальных группах наблюдали целостность клеточного монослоя. Окраска образцов полученных клеточных суспензий трипановым синим выявила высокую витальность, которая при самой длительной экспозиции (1 мин) составляла 98.5 ± 0.3; 99.5 ± 0.01; 99.1 ± 0.01 для МСК из ПЖТ человека, МСК из ранее замороженной (–70°С без криопротектора) ПЖТ человека и МСК-ПЖТ собак соответственно. Окраска клеток продемонстрировала целостность плазматической мембраны после воздействия холода во всех образцах. Клетки оставались не только жизнеспособными, но и сохраняли способность к делению и размножались после низкотемпературного воздействия не зависимо от времени охлаждения до 3-го пассажа включительно, после чего они были заморожены. Морфологических изменений в клетках после воздействия холодом и при пассировании не было выявлено. При помещении их в среду с индукторами через 21 сут культивирования все МСК человека и собаки сохраняли способность к дифференцировке в адипогенном направлении.
После изъятия клеток из жидкого азота на 15, 30 или 60 с сразу после оттаивания наблюдали разрыв монослоя во всех культуральных флаконах. Большая часть клеток отделялась от субстрата клеточными пластами, переходя в суспензионное состояние. Другая часть клеток (меньшая) оставалась прикрепленной к поверхности культурального флакона. На рис. 1 представлены результаты реакций МСК-ПЖТ человека (рис. 1а), МСК из ранее замороженной ПЖТ человека (рис. 1б) и МСК из ПЖТ собак (рис. 1в) в ответ на самое длительное криовоздействие (60 с). Окраска трипановым синим клеток, которые находились в суспензии, продемонстрировала наличие среди них большой доли клеток с криотравмой плазматической мембраны при воздействии холодом в течение 15, 30 и 60 с, которая составляла соответственно 70 ± 0.1, 76 ± 0.01 и 79.5 ± 0.3 для МСК-ПЖТ человека, 77 ± 0.6, 80 ± 0.2 и 88. 5± 0.1 для МСК ПЖТ человека с предварительным низкотемпературным шоком (–70°С без криопротектора) и 67 ± 0.5, 69 ± 0.01, и 83.1 ± 0.04 для МСК-ПЖТ собак соответственно. Известно, что клеточная выживаемость в низкотемпературных условиях, в первую очередь, зависит от целостности ее мембраны после оттаивания − основного места криотравмы.
Рис. 1.
Монослои клеточных популяций, подвергшихся воздействию низких температур (–196°С) в течение 1 мин. а – МСК из ПЖТ человека. б – МСК из ПЖТ человека, ранее подвергнутой низкотемпературному шоку при –70°С без криопротектора. в – ММСК из ПЖТ собаки сразу после оттаивания. г, д, е – эти же клетки на 3 сут (г), на 5 сут (ж, з, и) и на 7 сут (к, л, м) после оттаивания соответственно. Увел. об.: 20×.
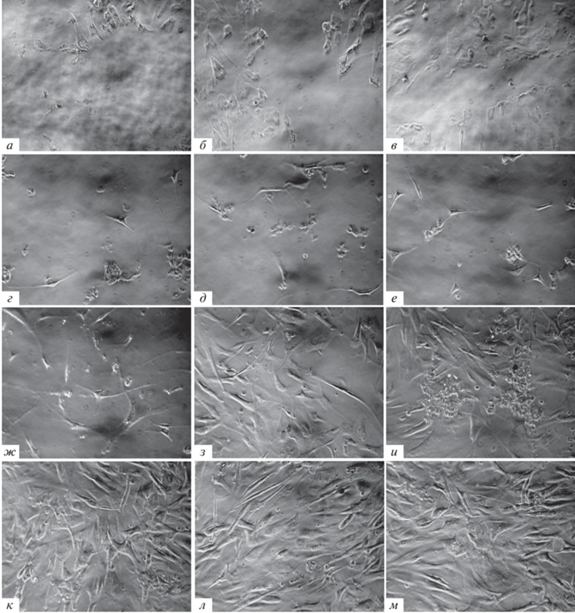
Очевидно, что целостность плазматической мембраны необходима для функционального выживания клеток. Однако во многих случаях, например, для гранулоцитов (Armitage, Mazur, 1984), неповрежденной плазматической мембраны недостаточно для клеточной витальности с сохранением функциональных особенностей. В пределах плазматической мембраны находятся другие связанные с ней структуры и органеллы, необходимые для функций клетки. Мало что известно о том, как эти внутриклеточные структуры и органеллы реагируют на холод и замораживание из-за сложности оценки их состояния и функции in situ (McGann et al., 1988; Reardon et al., 2015). Поэтому важно оценить способность клеток после низкотемпературного шока к последующему росту и развитию. Для этого культуральные флаконы после оттаивания и подсчета числа жизнеспособных клеток в суспензии переносили для дальнейшего культивирования в инкубатор при 37°С и 5% СО2 без смены среды.
На третьи сутки в культуральных матрасах с клетками, подвергнутых обработкой жидким азотом, визуализировались живые прикрепленные ко дну культурального пластика клетки, которые размножались (рис. 1г–е). Как видно (оценивали спонтанно выбранные по диагоналям 10 полей зрения микроскопа в трех повторах), наибольшее число клеток было в популяции МСК, которые были выделены из ПЖТ человека, претерпевшей заморозку ранее (–70°С без криопротектора). Оставшиеся жизнеспособными клетки формировали монослой, но с различной скоростью. На 5-е сут культивирования МСК, выделенные из ПЖТ собак и ПЖТ человека (–70°С без криопротектора) формировали субконфлуентный монослой (рис. 1з, и), в то время как МСК, выделенные из ПЖТ человека (рис. 1ж) достигали 30%-ного монослоя. В МСК собак визуализировали клетки, которые округлялись и откреплялись (рис. 1и), но оставались жизнеспособными. Сравнительный анализ скорости формирования монослоя клетками представлен на рис. 1к–м и демонстрирует незначительное отставание МСК из ПЖТ человека, которые формировали монослой на 9-е сут (рис. 1к), в то время как МСК из ПЖТ человека, ранее подвергшейся низкотемпературному шоку и из ПЖТ собак формировали его на 7 сут.
Следует отметить, что доля клеток, открепившихся от субстрата и перешедших в суспензию (окрашиваемых трипановым синим), была выше у клеток, выделенных из ранее замороженной ПЖТ, чем из свежеизолированного жира человека и собаки. С одной стороны, этот факт может свидетельствовать о недостаточной оценке жизнеспособности клеток только по окраске трипановым синим; оценивать жизнеспособность надо дополнительно еще другими методами, в том числе по способности размножаться в культуре. С другой стороны, это наблюдение можно объяснить тем, что окрашивали трипановым синим только клетки, которые были в суспензии (т.е. открепились после нахождения в жидком азоте). А визуальный анализ показал, что число клеток, не открепившихся от культурального пластика после экстремального охлаждения в группе МСК из замороженной ПЖТ человека, было выше во всех вариантах воздействия холодом. Чтобы лучше понять влияние низких температур на фенотип МСК-ПЖТ человека, мы исследовали присутствие некоторых антигенов на их поверхности до и после воздействия холода. В табл. 1 представлены результаты окраски МСК из ПЖТ человека с помощью антител против 8-ми антигенов. Цитофлуориметрический анализ (данные по 3-м образцам) показал, что клетки положительно окрашивались на следующие антигены: CD29, CD44, CD49a, CD90, CD105, HLA ABC. На клетках не были выявлены CD34 (маркер клеток крови) и СD31 (маркер эндотелиальных клеток).
Таблица 1.
Поверхностные антигены МСК, выделенных из ПЖТ человека до (контроль) и после воздействия низких температур
| Антиген | Доля положительно окрашенных клеток, % | |||||
|---|---|---|---|---|---|---|
| из свежеизолированной ПЖТ | из ранее замороженной ПЖТ без криопротектора (–70°С) | |||||
| контроль | –70°С | –196°С | контроль | –70°С | –196°С | |
| СD29 | 97.9 ± 0.2 | 98.8 ± 0.01 | 79.7 ± 07 | 97.6 ± 0.1 | 99.2 ± 0.2 | 77.3 ± 0.5 |
| CD31 | 4.3 ± 0.5 | 3.0 ± 0.4 | 2.0 ± 0.1 | 0.6 ± 0.02 | 0.0 | 0.1 ± 0.01 |
| CD34 | 8.2 ± 0.7 | 4.2 ±.01 | 3.9 ± 0.1 | 0.8 ± 0.01 | 0.1 ± 0.01 | 0.8 ± 0.01 |
| CD44 | 99.1 ± 0.4 | 98.2 ± 0.5 | 98.9 ± 0.3 | 99.0 ± 0.2 | 98.8 ± 0.6 | 98.6 ± 0.5 |
| CD49a | 96.2 ± 0.2 | 94.1 ± 0.6 | 45.2 ± 0.3 | 95.9 ± 0.2 | 96.2 ± 0.6 | 30.1 ± 0.5 |
| CD90 | 99.4 ± 0.5 | 98.4 ± 0.3 | 99.8 ± 0.1 | 99.3 ± 0.6 | 99.1 ± 0.4 | 99.5 ± 0.7 |
| CD105 | 98.8 ± 0.1 | 99.8 ± 0.2 | 99.2 ± 0.7 | 98.5 ± 0.3 | 97.5 ± 0.01 | 92.8 ± 0.2 |
| HLA ABC | 99.6 ±0.8 | 99.6 ± 0.3 | 99.4 ± 0.5 | 99.3 ± 0.1 | 98.4 ± 0.2 | 98.3 ± 0.5 |
Считается, что МСК, выделенные из костного мозга, а также других соединительных тканей человека, характеризуются высокой экспрессией антигенов СD29, CD44, CD49a-f, CD51, CD73, CD105, CD106, CD166 и Stro-1 (Tepliashin et al., 2005; Dominici et al., 2006). Наши результаты показывают, что нет статистически значимой разницы (P > 0.1) между контрольными клетками и клетками, подвергшимися воздействию заданных низких температур (–70 или –196°C) по доле клеток положительно окрашенных против этих антигенов (табл. 1). Однако в клеточной популяции, подвергшейся обработке жидким азотом в течение 1 мин, снижалась доля клеток, окрашенных против CD29 (интегрин β) и СD49a (интегрин α-1) по сравнению с контролем (табл. 1). Это может свидетельствовать о влиянии холода на адгезивные способности МСК человека (Савченкова, Савченкова, 2015).
Представляло интерес изучить влияние холода на одну из функциональных характеристик этих клеток – способность при индукции образовывать клетки других тканей, имеющих то же происхождение. В качестве контроля использовали эти же клетки без воздействия низких температур. Результаты представлены на рис. 2. Окраска жировым красным демонстрирует обильные липиды в МСК-ПЖТ человека и собак при индукции (рис. 2а–в). Все клетки, подвергшиеся охлаждению, также были способны формировать клетки жировой ткани in vitro (рис. 2г–е). При культивировании в среде, индуцирующей адипогенную дифференцировку, морфологические изменения в клетках, выделенных как из ПЖТ человека, так и из ПЖТ собаки, наблюдали на 21 сут. Адипогенная дифференцировка сопровождалась появлением клеток округлой формы с липидными везикулами в цитоплазме, которые выявлялись окраской специфическим красителем жировым красным O. Как видно из результатов, представленных на рис. 2г, МСК, полученные из свежеизолированной ПЖТ человека, помещенные в жидкий азот (–196°C в течение 1 мин), демонстрируют способность к дифференцировке, но степень дифференцировки была снижена по сравнению с другими группами (рис. 2д, е). Нельзя исключить, что процессы и степень дифференцировки стволовых клеток также регулируются другими факторами, такими как уровень напряжения кислорода или микросреда культивирования.
Рис. 2.
Сохранение МСК, выделенными из ПЖТ, способности к дифференцировке в адипогенном направлении. а – ММСК из ПЖТ человека; б – ММСК из ПЖТ человека ранее подвергнутой низкотемпературному шоку при –70°С без криопротектора; в – МСК из ПЖТ собаки до воздейстия; г–е – те же клетки после воздействия –196°С в течение 1 мин соответственно. Увел. об.: 20×.

Анализ данных по вопросу о влиянии низких температур на реакцию клеток в культуре, представленных в научной литературе, показывает, что их не так много. Возможно, это связано с тем, что резистентность клетки к холоду зависит от многих факторов и, в первую очередь, от особенностей метаболизма клетки в ткани, в том числе в зависимости от степени дифференцировки и анатомотопографических свойств. Райданом с соавторами (Райдан и др., 2011б) были описаны фенотипические изменения в МСК, выделенных из костного мозга крыс, в процессе обработки их парами азота до 5 мин с максимальной температурой охлаждения (–40°С). Наши данные согласуются с данными, полученными этой группой исследователей, которые выявили устойчивость недифференцированных стволовых клеток костного мозга (СК-КМ) к действию низких температур до и после их направленной дифференцировки в адипо- и остеогенном направлениях и продемонстрировали, что степень дифференцировки у клеток СК-КМ играет важную роль в их устойчивости к кратковременному воздействию низких температур.
Ранее было обнаружено, что СК и транзиторные кератиноциты обладают большей устойчивостью к действию низких температур по сравнению с кератиноцитами и клетками постоянной линии А431, полученной из эпидермоидной карциномы человека, а также с клетками, выделенными из саркомы мыши (Райдан и др., 2011а). В отличие от этих работ мы подвергали кратковременному воздействию холодом клетки в монослое в питательной среде, а не подвергали клетки дополнительному стрессу, чтобы снять их с субстрата ферментативной обработкой и перевести в суспензию, или в осадок низкоскоростным центрифугированием. Имеется сообщение о сохранении СК, полученных из ПЖТ человека, при глубоком переохлаждении (до низких температур без замораживания) для длительного хранения (Huang et al., 2020). Авторами показано, что клеточная суспензия может храниться в жидком состоянии при температуре –13 и –16°C в течение 7 сут, сохраняя высокую жизнеспособность, адгезивные способности и мультипотентность in vitro. Авторы предполагают, что проблема для клеток во время замораживания заключается не в сохранении ими способности к долгому выдерживанию очень низких температур (менее –180°C), а скорее, в летальном действии промежуточной температурной зоны (от –15 до –60°C), которую клетка должна пройти дважды – один раз во время охлаждения и второй раз во время нагревания (Huang et al., 2020).
Таким образом, в ходе проведенных нами исследований было обнаружено, что наиболее устойчивыми к действию низких температур являются МСК, которые были выделены нами из ПЖТ человека, замороженной при –70°С без криопротектора (Савченкова, Коржикова, 2010) по сравнению с МСК, выделенными из нормальной ПЖТ человека. Их устойчивость была сопоставима со степенью криорезистентности МСК, выделенных из ПЖТ собак (Савченкова и др., 2019). Собаки по сравнению с человеком легко переносят низкие температуры, поэтому МСК из ПЖТ этого вида были включены в наши эксперименты. МСК из ПЖТ человека и собак обладают схожими свойствами: сильной адгезией к поверхности дна культурального флакона, высокой клонообразующей способностью, наличием или отсутствием на поверхности клеточной мембраны определенных поверхностных молекул и способностью при индукции формировать в культуре клетки костной, жировой и хрящевой ткани. Все эти параметры согласуется с критериями, которым должны соответствовать МСК млекопитающих в культуре (Dominici et al., 2006; Murray et al., 2014).
Полученные результаты по изучению комплекса морфо-функциональных особенностей МСК, выделенных из ПЖТ человека при кратковременных холодовых воздействиях, особенно ранее подвергшихся криошоку, могут подтвердить наше предположение о возможности сохранения в жировой ткани человека после криотерапии клеточной популяции с фенотипом, подобным МСК. Полученные новые данные могут быть полезными для дальнейшего изучения процессов и механизмов, лежащих в основе адаптации клеток млекопитающих к холоду и быть рекомендованы к использованию при дальнейшей разработке вопросов экологической физиологии, а также в качестве обоснования роли холодового фактора в стимуляции терморегуляционной функции организма. Эти клетки могут иметь и особое значение для идентификации генов (гена), ответственных за гипотермию клеток млекопитающих.
Список литературы
Грищенко В.И. 2008. Достижения криобиологии и криомедицины во имя здоровья нации. Проблемы криобиол. Т. 18. С. 269. (Grischenko V.I. 2008. Achievements in cryobiology and cryomedicine for national. Problems Сryobiol. V. 18. P. 269.)
Райдан М., Шубин Н.А., Блинова М.И., Прохоров Г.Г., Пинаев Г.П. 2011а. Влияние охлаждения до низких температур на жизнеспособность кератиноцитов кожи человека, находящихся на разных стадиях дифференцировки. Цитология. Т. 53. С. 22. (Raydan M., Shubin N.A., Blinova M.I., Pinaev G.P., Prokhorov G.G. 2010. Effect of cooling to low temperatures on viability of human skin keratinocytes at different stages of differentiation. Cell Tiss. Biol. V. 4. P. 529.)
Райдан М., Шубин Н.А., Николаенко Н.С., Блинова М.И., Прохоров Г.Г., Пинаев Г.П. 2011б. Устойчивость к действию низких температур стромальных клеток костного мозга при их дифференцировке. Цитология. Т. 53. С. 221. (Raydan M., Shubin N.A., Nikolaenko N.S., Blinova M.I., Pinaev G.P., Prokhorov G.G. 2011. Stability of bone marrow stromal cells to low temperatures depending on degree of differentiation. Cell Tiss. Biol. V. 5. P. 294.)
Ревишвили А., Чжао А., Ионкин Д. (Ред.) 2019. Криохирургия. Руководство. М.; ГЭОТАР-Медиа. 376 с. (Revishvili A., Zhao A., Ionkin D. (Eds.). 2019. Cryosurgery. Moscow: GEOTAR-Media. 376 pp.)
Савченкова И.П., Коржикова С.В. 2009. Линия мультипотентных мезенхимных стволовых клеток подкожно-жировой клетчатки человека (panniculus adiposus homo sapiense) для клеточной и тканевой инженерии. Патент на изобретение: RU 2354693 C2, 10.05.2009. Заявка № 2007122713/13 от 19.06.2007.
Савченкова И.П., Коржикова С.В. 2010. Подкожно-жировая ткань человека, подвергнутая низкотемпературному шоку, как источник жизнеспособной клеточной популяции с характеристиками мультипотентных мезенхимных стромальных клеток. Цитология. Т. 52. С. 621. (Savchenkova I.P., Korzhikova S.V. 2010. Human subcutaneous adipose tissue subjected to cold shock as source of viable cell population with characteristics of multipotent mesenchymal stromal cells. Cell Tiss. Biol. V. 4. P. 539.)
Савченкова И.П., Савченкова Е.А. 2015. Влияние интегринов на адгезию мультипотентных мезенхимных стромальных клеток, выделенных из жировой ткани человека, к белкам внеклеточного матрикса. Цитология. Т. 57. С. 650. (Savchenkova I.P., Savchenkova E.A. 2015. The effect of integrins on the adhesion of multipotent mesenchymal stromal cells isolated from human adipose tissue to extracellular matrix proteins. Tsitologiya. V. 57. P. 650.)
Савченкова И.П., Васильева С.А., Коровина Д.Г., Шабейкин А.А., Гулюкин А.М. 2019. Мезенхимные стволовые клетки из жировой ткани кошек и собак в культуре. Сельскохоз. биол. Т. 54. С. 395. (Savchenkova I.P., Vasilyeva S.A., Korovina D.G., Shabeikin А.А., Gulyukin A.M. 2019. Сharacterization of mesenchymal stem cells isolated from feline and canine adipose tissue. S-kh. Agric. Biol. V. 54. P. 395.)
Тепляшин А.С., Коржикова С.В., Шарифуллина С.З., Чупикова Н.И., Ростовская М.С., Савченкова И.П. 2005. Характеристика мезенхимальных стволовых клеток человека, выделенных из костного мозга и жировой ткани. Цитология. Т. 47. С. 130. (Tepliashin A.S., Korzhikova S.V., Sharifullina S.Z., Chupikova N.I., Rostovskaia M.S., Savchenkova I.P. 2005. Characteristics of human mesenchymal stem cells isolated from bone marrow and adipose tissue. Tsitologiya. V. 47. P. 130.)
Armitage W.J., Mazur P. 1984. Toxic and osmotic effects of glycerol on human granulocytes. Am. J. Physiol. V. 247. P. C382. https://doi.org/10.1152/ajpcell.1984.247.5.C382
Cusker D. Mc. 2020. Cellular self-organization: generating order from the abyss. Mol. Biol. Cel. V. 31. P. 143. https://doi.org/10.1091/mbc.E19-04-0207
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. V. 8. P. 315. https://doi.org/10.1080/14653240600855905
Erol O.D., Pervin B., Seker M.E., Aerts-Kaya F. 2021. Effects of storage media, supplements and cryopreservation methods on quality of stem cells. World J. Stem Cells. V. 13. P. 1197. https://doi.org/10.4252/wjsc.v13.i9.1197
Fowler A., Toner M. 2005. Cryo-injury and biopreservation. Ann N.Y. Acad. Sci. V. 1066. P. 119. https://doi.org/10.1196/annals.1363.010
Gao D., Critser J.K. 2000. Mechanisms of cryoinjury in living cells. ILAR J. V. 41. P. 187. https://doi.org/10.1093/ilar.41.4.187
Huang H., Rey-Bedón C., Yarmush M.L., Usta O.B. 2020. Deep-supercooling for extended preservation of adipose-derived stem cells. Cryobiology. V. 1. P. 67. https://doi.org/10.1016/j.cryobiol.2019.11.004
McGann L.E., Yang H.Y., Walterson M. 1988. Manifestations of cell damage after freezing and thawing. Cryobiol. V. 25. P. 178. https://doi.org/10.1016/0011-2240(88)90024-7
Murray I.R., West C.C., Hardy W.R., James A.W., Park T.S., Nguyen A., Tawonsawatruk T., Lazzari L., Soo C., Peault B. 2014. Natural history of mesenchymal stem cells, from vessel walls to culture vessels. Cell Mol. Life Sci. V. 71. P. 1353. https://doi.org/10.1007/s00018-013-1462-6
Reardon A.J.F. Elliott J.A.W., McGann L.E. 2015. Investigating membrane and mitochondrial cryobiological responses of HUVEC using interrupted cooling protocols. Cryobiol. V. 71. P. 3067. https://doi.org/10.1016/j.cryobiol.2015.08.004
Дополнительные материалы отсутствуют.


