Цитология, 2022, T. 64, № 5, стр. 411-426
Получение и характеристика разных популяций мезенхимных стволовых клеток, выделенных из эмбриональных стволовых клеток человека линии SC7
А. М. Кольцова 1, *, В. В. Зенин 1, В. И. Турилова 1, А. Н. Шатрова 1, Т. К. Яковлева 1, Г. Г. Полянская 1, **
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: koltsova.am@mail.ru
** E-mail: gpolanskaya@gmail.com
Поступила в редакцию 23.06.2022
После доработки 17.07.2022
Принята к публикации 20.07.2022
- EDN: LSQHDZ
- DOI: 10.31857/S0041377122050054
Аннотация
Проведен сравнительный анализ трех клеточных популяций, выделенных независимо из эмбриональных стволовых клеток человека линии SC7. Анализ характеристик проводили на 6-м и более поздних пассажах. Полученные результаты по ростовым характеристикам и репликативному старению показали, что две популяции (SC7-MSC-1 и SC7-MSC-2) имеют низкий индекс пролиферации, раннее репликативное старение и быструю гибель клеток. Эти 2 варианта можно было охарактеризовать только на 6-м пассаже. В отличие от них, третья клеточная популяция SC7-MSC-3 активно пролиферирует (индекс пролиферации высокий) и позже стареет, что позволило провести анализ клеточных характеристик на поздних пассажах. Так, обнаружены различия дифференцировочного потенциала у клеток SC7-MSC-3 между 6-м и 13-м пассажами. Кариотипический анализ трех полученных клеточных популяций выявил различия по кариотипической стабильности. На пассаже 6 показаны различия между тремя популяциями по доле клеток, несущих маркеры CD90 и CD105, по наличию маркеров ранней дифференцировки ЭСК и по дифференцировочному потенциалу в адипогенном, остеогенном и хондрогенном направлениях. Причины межпопуляционных различий могут быть связаны с процессом дифференцировки МСК из ЭСК. Таким образом, из трех независимых популяций МСК, выделенных из линии SC7, только одна популяция соответствует определению полноценной линии МСК с наличием статусных характеристик, которая названа нами SC7-MSC.
Мезенхимные стволовые клетки человека (МСК) широко используются для фундаментальных и прикладных биомедицинских исследований. Линии МСК человека, будучи неиммортализованными, диплоидными клеточными популяциями, являются удобной моделью для изучения биологических процессов, как в здоровом организме, так и при его патологических состояниях. В настоящее время значительно расширяется использование МСК человека разного происхождения в биомедицинских исследованиях, охватывающих широкий спектр заболеваний (Shin et al., 2020; Adak et al., 2021; Albu et al., 2021; Taei et al., 2021; Vasudevan et al., 2021; Wang et al., 2021; Wangler et al., 2021; Xiao et al., 2021; Yu et al., 2021; Guo et al., 2022; Oh, Lee, 2021; Zhang et al., 2022).
Согласно требованиям Международного общества клеточной терапии, статус МСК разного происхождения определяется рядом характеристик (Dominici et al., 2006; Sensebé et al., 2010). Тем не менее, есть некоторые различия между линиями МСК, выделенными из разных источников, по характеристикам определяющим статус МСК, и по другим, важным для жизнедеятельности клеток. В частности, обнаружены межлинейные различия по дифференцировочному потенциалу, секреции цитокинов, ростовым характеристикам, характеру репликативного старения (РС), кариотипической нестабильности. Функциональная гетерогенность МСК может зависеть от многих факторов, в частности от происхождения, от индивидуальных характеристик донора, условий культивирования, неконтролируемых внешних факторов (Montesinos et al., 2009; Brown et al., 2014; Stanko et al., 2014; Воронкина и др., 2016, 2020; Li et al., 2018; Полянская, 2018; Jin et al., 2019; Yang et al., 2019; Кольцова и др., 2020; Costa et al., 2021; Semenova et al., 2021; Shin et al., 2021; Tai et al., 2021; Yigitbilek et al., 2021, Zhang et al., 2021). Помимо межлинейных различий, имеют место клональные различия внутри одной линии по разным признакам.
Причиной этому является, в основном, гетерогенность клеточных популяций разных клеточных линий, включая МСК, обычно выделенных из массовой культуры (Полянская и др., 1981; Muraglia et al., 2000; Somosa et al., 2008; Russell et al., 2010; Sworder et al., 2015; Kobayashi et al., 2020). Показано, что изначально выделенная популяция МСК состоит из разнообразных субпопуляций, различающихся различными классами регуляторных белков. Так, анализ взрослых МСК, полученных из костного мозга человека, показал биохимическую внутрипопуляционную гетерогенность по содержанию разных биологически активных веществ, способных изменять микроокружение поврежденной ткани и, таким образом, улучшать тканевую репарацию. Многие из описанных авторами субпопуляций могут быть более предпочтительными в лечении определенных заболеваний (Caplan, Dennis, 2006; Phinney, 2007).
Известно, что при переводе клеток в состояние in vitro существенно нарушаются условия их существования, прежде всего, исключается контроль со стороны систем организма. Основными типами клеточного взаимодействия в культуре становятся физический контакт между клетками, клеток с субстратом, а также химическая связь через метаболиты в культуральной среде. Эти взаимодействия объединяют клетки, составляющие клеточную популяцию in vitro, в автономную единую систему (Poljanskaya, Vakhtin, 2003; Полянская, 2008). Но эта система не является такой устойчивой, как организм в целом. Сам процесс перевода клеток в условия in vitro является для них стрессом, способствующим эпигенетическим и генетическим изменениям. А отсутствие организменного (интегрального) контроля, включая стабилизирующий отбор, приводит к образованию гетерогенности внутри их новой системы. В результате, в выделенной культуре МСК выявляются клетки с разными свойствами, но, поскольку они образовались из одного типа клеток и из одной локализации, т.е. одного источника, различия в большинстве случаев носят единичный и непринципиальный характер для общей характеристики МСК. В большинстве случаев они различаются только по отдельным характеристикам. Все различия изначально носят клональный характер, но в процессе культивирования могут возникнуть популяции измененных клеток, которые будут сосуществовать в общей культуре МСК. Таким образом, представляет определенный интерес проведение анализа разных популяций МСК, выделенных из одного источника при соблюдении максимально одинаковых условий культивирования.
Одним из широко используемых типов клеток для получения МСК являются эмбриональные стволовые клетки (ЭСК). ЭСК являются иммортализованными плюрипотентными клеточными популяциями, обладающими способностью, как к самообновлению, так и к дифференцировке во все типы клеток. ЭСК человека являются адекватной моделью для проведения многосторонних фундаментальных исследований. Тем не менее, для использования их в клеточной терапии, необходимо преодолеть ряд препятствий (Полянская, Мусорина, 2018). Одним из препятствий является высокий уровень геномной нестабильности по сравнению с другими стволовыми клетками. В ЭСК часть геномных изменений носит адаптивный характер, способствующий не только самообновлению клеток, но и малигнизации (Полянская, 2014). Тем не менее, ЭСК могут быть удобной моделью для получения на их основе МСК, обладающих гораздо меньшей геномной нестабильностью и позволяющих получить большую клеточную массу МСК без использования инвазивных процедур.
Ранее нами получены 3 линии, выделенные из ЭСК: SC5, SC6 и SC7, которые имели все характеристики, необходимые для подтверждения статуса ЭСК. Все 3 линии имели нормальный кариотип (Кольцова и др., 2011). Из линий SC5, SC6 были получены линии МСК: первая линия SC5-MSC оказалась нормальной, а вторая – SC6-MSC – имела преобладающий кариотип 46, X0 и изменения по ряду характеристик, несмотря на нормальный кариотип в исходной линии SC6 (Крылова и др., 2012; Кольцова и др., 2015).
В настоящей работе, основываясь на выше описанных данных о наличие гетерогенности в линиях МСК по ряду признаков, мы выделили несколько независимых популяций МСК из линии ЭСК человека SC7, полагая, что каждая является отдельной популяцией с конкретными характеристиками, отражающими, в частности, возможные отклонения от нормы. Такая постановка работы в некоторой степени соответствует проведенному в других исследованиях клональному анализу при учете, что изначально изменение происходит в одной клетке с последующим образованием клеточной популяции.
Задачи данной работы состояли в следующем: 1) получить из клеток линии SC7 три популяции фибробластоподобных клеток; 2) определить статус этих популяций на 6-м и более поздних пассажах; 3) провести сравнительный количественный анализ активности фермента β-галактозидазы, характеризующей процесс РС; 4) охарактеризовать МСК при длительном культивировании по основным показателям, подтверждающим статус МСК.
МАТЕРИАЛ И МЕТОДИКА
Выделение клеток. Для получения МСК из линии ЭСК человека SC7, колонии ЭСК диссоциировали до единичных клеток при помощи 0.05%-ной смеси трипсина и версена (Tripsin/EDTA, Invitrogen, США), переводили на гидрофобную (неадгезионную) поверхность пластиковой чашки и культивировали в среде для ЭСК без добавления основного фактора роста фибробластов (bFGF, Sigma, США). В этих условиях клетки культивировали в течение 10 сут до образования эмбриоидных телец (ЭТ). Через 10 сут образовавшиеся ЭТ переносили на гидрофильную (адгезионную) поверхность чашки и последующее культивирование проводили в среде DMEM/F12, содержащей 10% эмбриональной бычьей сыворотки (FBS, HyClone, США). Через несколько суток вокруг прикрепившихся ЭТ выявляли зону роста дифференцированных клеток. Из полученной популяции выделяли однородные зоны пролиферирующих фибробластоподобных клеток, аккуратно изолировали их, контролируя под микроскопом, и после диссоциации до единичных клеток переносили на новые пластиковые чашки. В результате длительного культивирования получили популяцию фибробластоподобных клеток. Описанную процедуру выполняли 3 раза. В результате было получено 3 отдельных варианта популяций МСК, названные SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3. Полученные клеточные популяции постоянно культивировали в условиях 5% СО2 при 37°С и 90% влажности. Криоконсервацию проводили в кондиционированной среде, содержащей 10% криопротектора диметилсульфоксида (DMSO; Биолот, Россия).
Все основные характеристики, подтверждающие статус МСК, получали на пассажах 6, 10, 13 и 18 после выделения фибробластоподобных клеток.
Репликативное старение клеток. Оценивали активность фермента β-галактозидазы. Клетки выращивали в чашках Петри (3.5 мм: Nunc, Дания) до образования cубконфлюента. Затем среду удаляли и окрашивали клетки с помощью набора реактивов (Senescence β-galactosidase staining kit; Cell Signaling, США) согласно инструкции. У клеток, вступающих в фазу РС, цитоплазма окрашивается в ярко синий цвет. Анализ проводили с помощью инвертированного микроскопа (NICON, Япония) на пассажах 6, 10, 13 и 18. Долю окрашенных клеток (в %) определяли при подсчете не менее 1000 клеток в разных полях зрения на одну временную точку.
Эффективность клонирования варианта клеточной линии определяли в чашках Петри в условиях редкого посева – 2–3 кл./см2 (50 клеток на 1 чашку 60 мм). Через 14 сут клетки окрашивали 1%-ным водным раствором кристалл-виолета и считали колонии. Эффективность клонирования определяли в % как отношение числа выросших колоний (клонов) к числу посеянных клеток. Учитывали колонии, состоящие из не менее 20 клеток. Анализировали по 8 экспериментов на ранних и поздних пассажах.
Характеристика пролиферативной активности. Оценивали индекс пролиферации (ИП) – отношение числа клеток в текущий момент к исходному числу посеянных клеток и строили кривые роста клеточных популяций. Для измерения среднего времени удвоения клеточной популяции каждый экспериментальный вариант повторяли 3 раза, ежедневно считали клетки в течение 6 сут (144 ч). Среднее время одного удвоения клеточной популяции (ao) определяли по формуле (Седова, 2008):
ao = t ln 2/ln (Mt/Mo),
где Mt – число клеток в момент времени t; Mo – начальное число клеток; t – время логарифмической фазы роста клеточной культуры. Анализ проводили на пассажах 6, 13 и 18.
Кариотипический анализ полученных клеточных популяций. Для получения препаратов метафазных хромосом за 4 ч до фиксации в культуру вводили колцемид (KaryoMAX, 0.1 мкг/мл; GIBCO, США), снимали клетки с субстрата смесью трипсина и версена (1 : 3), проводили гипотоническую обработку смесью 0.075 М раствора КСl и 1%-ного раствора цитрата натрия. Клетки фиксировали смесью метанола с ледяной уксусной кислотой (3 : 1). Для количественного кариотипического анализа препараты метафазных хромосом окрашивали водным раствором Гимза (1 : 50). Модальное число хромосом и пределы изменчивости клеток по числу хромосом определяли при анализе 100 метафазных пластинок; долю полиплоидных клеток оценивали при анализе 1000 метафазных пластинок для клеточных популяций SC7-MSC-1 и SC7-MSC-2 и 700 для SC7-MSC-3.
Для структурного кариотипического анализа проводили дифференциальное G-окрашивание хромосом в соответствии с ранее описанной методикой (Ozkinay, Mitelman, 1979). Анализировали 100 метафаз в каждом варианте. Клетки вариантов SC7-MSC-1 и SC7-MSC-2 анализировали только на пассаже 6 в связи с низкой пролиферацией; клетки варианта SC7-MSC-3 – на пассажах 6 и 13. Kариотипы анализировали с помощью микроскопа Axio Imager.M1 (Carl Zeiss, ФРГ) с системой автоматического кариотипирования Ikaros 4 Karyotyping System (MetaSystems, Germany) и описывали в соответствии с Международной номенклатурой хромосом человека ISCN (McGovan-Jordan et al., 2016).
Иммунофлуоресцентный анализ. Для иммунофлуоресцентного анализа экспрессии поверхностных маркеров, характерных для ЭСК, и экспрессии маркеров ранней дифференцировки в производные 3-х зародышевых листков использовали антитела против SSEA-4, TRA-1-60 (Chemicon, США) и транскрипционного фактора Oct-4 (Santa Cruz, США), а также против α-актинина (тест на мезодерму), α-фетопротеина (тест на энтодерму) (Sigma, США) и нестина (тест на эктодерму) (Chemicon, США). Клетки фиксировали 4%-ным раствором параформальдегида в течение 20 мин при комнатной температуре, блокировали 0.1%-ным раствором BSA (Sigma, США) в течение 1 ч, пермеабилизовали 0.1%-ным раствором Тритона Х100 в течение 15 мин при комнатной температуре и инкубировали в течение ночи при 4°С с первыми антителами. Все антитела разводили в соотношении 1 : 50. Вторые антитела (FITC; Chemicon, США) разводили в соотношении 1 : 500 и инкубировали с ними препараты в течение 1 ч в темноте при комнатной температуре. После 3-х отмывок препараты докрашивали ядерным красителем DAPI (0.1 мкг/мл; Sigma, США) в течение 10 мин при комнатной температуре. В качестве отрицательного контроля использовали клетки, меченные только вторыми антителами. Визуализацию проводили с помощью микроскопа Olympus FV3000 (Япония). Анализ проводили на пассаже 6.
Определения статуса МСК с помощью проточной цитофлуориметрии. Анализировали наличие поверхностных антигенов с помощью проточной цитофлуориметрии на цитометре Beckman Coulter (США). Экспрессию каждого маркера оценивали по результатам 3-х экспериментов для клеток, находящихся на 6-м пассаже для клеточных популяций SC7-MSC-1 и SC7-MSC-2 и на пассажах 6 и 13 для клеточной популяции SC7-MSC-3. Иммунофенотипирование полученных клеточных линий проводили с помощью панели конъюгатов CD-маркерных моноклональных антител с флуорохромами. В работе использовали моноклональные антитела против CD-34, HLA-ABC и HLA-DR (Caltac, США), CD-44, CD-73, CD-105 (Beckman Coulter, США), СD-90 (Chemicon, США), а также виментина (BD Pharmigen, США). В качестве негативного контроля использовали очищенные мышиные антитела IgG1/FITC и IgG1/RFE (DAKO, Дания). Клетки снимали с поверхности чашки с помощью 0.05%-ного раствора трипсина с версеном (Gibco, США) и отмывали от него раствором РВS, не содержащем ионов Са2+ и Mg2+ (Биолот, Россия). Полученную суспензию клеток (1 млн/мл) в РВS делили на пробы по 30 мкл, добавляли к каждой из них по 3 мкл антител и инкубировали при 4°С в течение 30 мин. Далее пробы доводили до оптимального объема (0.3–0.4 мл) буфером FACS (PBS, содержащий 1% бычьего сывороточного альбумина (BSA) и 0.05% азида натрия).
Индукция остеогенной, адипогенной и хондрогенной дифференцировки для определения статуса МСК. Использовали модифицированный метод (Reyes et al., 2001). Клетки (10 000 кл./см2) высевали в остеогенную и адипогенную дифференцировочные среды (HyClone Thermo Scientific HyClone Product, США). Хондрогенную дифференцировку проводили в культуре микромасс в хондрогенной дифференцировочной среде (HyClone Thermo Scientific HyClone Product, США). Индукцию проводили в течение трех недель, меняя среду каждые 3 сут.
Для идентификации хондрогенной дифференцировки из сформированных микромасс готовили мазки на трех предметных стеклах, фиксировали их содержимое 4%-ным раствором параформальдегида в течение 20 мин и далее каждый из мазков окрашивали в течении 30 мин при комнатной температуре 1%-ным раствором толуидинового синего в 50%-ном изопропаноле, или 0.1%-ным водным раствором сафранина, или 1%-ным раствором альцианового синего в 3%-ной уксусной кислоте (Sigma, США). Окрашенные мазки промывали дистиллированной водой, высушивали и монтировали под покровное стекло.
Для идентификации остеогенной дифференцировки использовали реакцию Вон Косса. Для этого клетки фиксировали 2 мин в метаноле при −20°С и окрашивали 2%-ым раствором нитрата серебра (Вектон, Россия) в течение 1 ч под лампой мощностью 60 Вт. Окрашенные клетки промывали дистиллированной водой и помещали на 5 мин в 2.5%-ный раствор тиосульфата натрия. Затем клетки снова промывали водой и заливали 70%-ным глицерином.
Для идентификации адипогенной дифференцировки клетки промывали PBS без ионов Ca2+ и Mg2+, фиксировали в метаноле в течение 2 мин при −20°С. Фиксированные клетки промывали 50%-ным этанолом и окрашивали красным масляным (Oil Red) в течение 10 мин. Далее клетки промывали 50%-ным этанолом, затем дистиллированной водой и заливали 70%-ным глицерином. Идентификацию дифференцировок для всех вариантов проводили на 6-м пассаже, а для варианта SC7-MSC-3 – и на пассаже 13.
Результаты обрабатывали статистически с использованием t-критерия Стьюдента. Различия считали достоверными при вероятности нулевой гипотезы Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
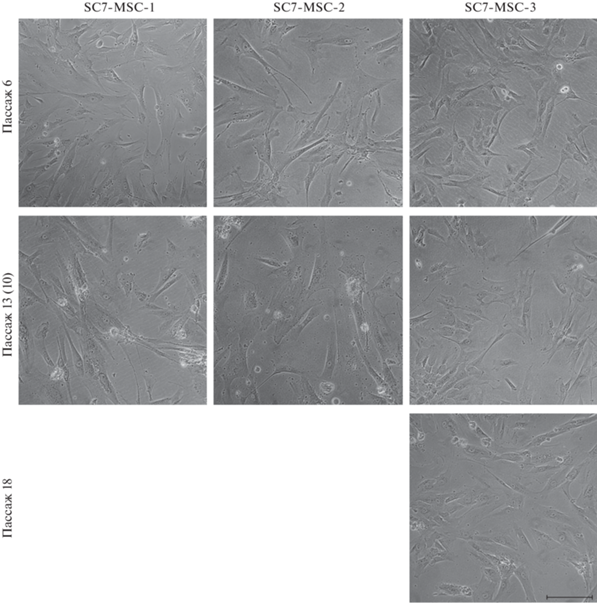
Морфологический анализ. Выделение клеток из линии ЭСК человека SC7 было проведено трижды. В результате были получены 3 отдельные клеточные популяции (варианты). Морфологический анализ этих вариантов на 6-м пассаже показал однородность клеточных популяций, представленных средними по размеру вытянутыми фибробластоподобными клетками (рис. 1). На 13- и 10-м пассаже обе клеточные популяции (SC7-MSC-1 и SC7-MSC-2) увеличивают размеры и степень распластанности клеток. Клеточный вариант SC7-MSC-3, в отличие от предыдущих популяций, на 13-м пассаже имеет ту же морфологию, что и на 6-м. Увеличение размеров и степени распластанности клеток в этом варианте проявляется только на 18-м пассаже. Таким образом, обнаружены различия между популяциями по морфологическим характеристикам.
Рис. 1.
Прижизненные фотографии клеток SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3 на на пассажах 6, 13 (или 10 для SC7-MSC‑2) и 18. Инвертированный световой микроскоп Nicon Eclipse TS100, Япония. Масштабная линейка: 200 мкм.
Репликативное старение клеток. Старение клеток SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3 оценивали по активности β-галактозидазы в клеточных популяциях (табл. 1).
Таблица 1.
Доля клеток популяций SC7-MSC-1 и SC7-MSC-2 с выраженной активностью (окраской) β-галактозидазы на разных пассажах в процессе культивирования
| Пассаж | SC7-MSC-1 | SC7-MSC-2 | SC7-MSC-3 | |||
|---|---|---|---|---|---|---|
| число клеток | окрашенные клетки, % | число клеток | окрашенные клетки, % |
число клеток | окрашенные клетки, % | |
| 6 | 1881 | 20.3 ± 0.9 | 1435 | 22.0 ± 0.2 | 1424 | 21.7 ± 1.1 |
| 10 | 1336 | 40.0 ± 1.3 | 1064 | 79.1 ± 1.2 | ||
| 13 | 1497 | 33.6 ± 1.2 | ||||
| 18 | 1576 | 36.7 ± 1.2 | ||||
Анализ РС показал, что уже на 6-м пассаже в вариантах SC7-MSC-1 и SC7-MSC-2 имеет место повышенная частота стареющих клеток, которая существенно увеличивается к пассажу 10; популяции входят в стадию активного РС. Клетки варианта SC7-MSC-1 на 13 пассаже погибают. Клеточная популяция SC7-MSC-2, имеющая значительно большее количество стареющих клеток, после 10 пассажа прекращает деления и погибает. Анализ РС клеточного варианта SC7-MSC-3 свидетельствует о более длительном процессе РС. На 6-м пассаже наблюдается повышенная частота стареющих клеток, подобно первым двум популяциям. Затем имеет место постепенное увеличение частоты этих клеток, переходящее в стадию активного РС на 13-м пассаже (Р < 0.05) и продолжающееся до пассажа 18. На 20-м пассаже клетки перестают делиться и быстро погибают. Таким образом, все 3 популяции различаются по характеру РС, определяемому по уровню активности лизосомального фермента β-галактозидазы в клеточных популяциях в процессе длительного культивирования. Наибольшие отличия от 2-х других популяций имеет вариант SC7-MSC-3.
Ростовые характеристики. Клоногенная активность не выявлена во всех 3-х клеточных популяциях на ранних и поздних пассажах, что позволяет считать, что пролиферативный потенциал снижен по сравнению с большинством линий МСК человека.
Характеристика пролиферативной активности клеток SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3 в процессе длительного культивирования свидетельствуют о различиях между вариантами; кривые роста представлены на рис.2.
Рис. 2.
Кривые роста клеток SC7-MSC-1 на пассаже 6 (кривая 1), SC7-MSC-2 на пассаже 6 (кривая 2) и SC7-MSC-3 на пассажах 6 (кривая 3.1), 13 (кривая 3.2) и 18 (кривая 3.3).
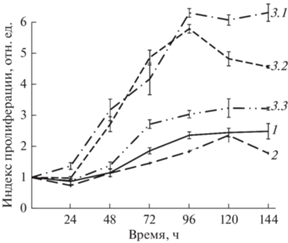
Анализ пролиферативной активности в варианте SC7-MSC-1 на 6-м пассаже свидетельствует о том, что логарифмическая фаза роста составляет 24 ч (от 48 до 72 ч), затем имеет место незначительное снижение ИП. Среднее время удвоения популяции составляет 27.5 ± 2.4 ч. У клеток SC7-MSC-2 логарифмическая фаза роста составляет 24 ч (от 72 до 96 ч), далее ИП не увеличивается; среднее время удвоения 27.5 ± 1.4 ч. Таким образом, оба варианта сходны по характеру пролиферативной активности и среднему времени удвоения. Следует подчеркнуть, что обе популяции характеризуются низким уровнем пролиферации. Так, средние индексы пролиферации, согласно кривым роста, составляют 1.85 и 1.58 соответственно.
Анализ пролиферативной активности у клеток третьего варианта SC7-MSC-3 (рис. 2) свидетельствует о том, что логарифмическая фаза роста составляет на 6-м пассаже 96 ч (от 0 до 96 ч), далее ИП не увеличивается. Время удвоения – 36.0 ± 0.5 ч. В отличие от клеток 1-й и 2-й популяций, наблюдается активный рост клеточной популяции при длительном культивировании до 13 пассажа. Анализ пролиферативной активности на 13-ом пассаже также показал активную пролиферацию. Логарифмическая фаза роста длится 72 ч (от 24 до 96 ч). Время удвоения составляет 28.4 ± 0.4 ч, т.е. укорачивается по сравнению с ранним пассажем. ИП при культивировании в течение 144 ч незначительно снижается по сравнению с 6-м пассажем (средние ИП: 4.57 и 3.96 на пассажах 6 и 13 соответственно). Дальнейшее культивирование до 18-ого пассажа показало значительное снижение пролиферативной активности, т.е. наступление активной стадии РС. Логарифмическая фаза роста составляет 24 ч (от 48 до 72 ч, затем ИП не изменяется). Средний ИП – 2.42 значительно ниже, чем на предыдущих сроках (пассажи 6 и 13). Среднее время удвоения – 16.6 ± 0.8 ч, что также меньше, чем на предыдущих пассажах.
Таким образом, в отличие от большинства линий МСК, полученных нами из разных источников, для которых показано увеличение времени удвоения в процессе РС, в этом варианте клеток показано укорочение среднего времени удвоения в процессе РС. Надо подчеркнуть, что в клетках линии МСК, выделенной из пульпы молочного зуба ребенка (MSC-DP), ранее было показано одинаковое среднее время удвоения клеток в процессе РС на раннем и позднем пассажах (Кольцова и др., 2018). В настоящей работе обнаружено укорочение времени удвоения, несмотря на присутствие признаков активной стадии РС: значительного снижения пролиферативной активности на пассаже 18, морфологическиx изменений, повышенного уровеня активности β-галактозидазы, остановки пролиферации на 20-ом пассаже и быстрой последующей гибели клеток.
Основываясь на формуле расчета среднего времени удвоения клеточной популяции, можно полагать, что причиной отсутствия различий по данному параметру является несоответствие длительности логарифмической фазы и величины ИП. Для увеличения времени удвоения популяции при данной длительности логарифмической фазы, ИП должен быть еще ниже, чем показанный на рис. 2. По-видимому, результаты исследования, а также данные, полученные ранее (Кольцова и др., 2018), свидетельствуют о том, что не все соотношения длительности логарифмической фазы роста и величины ИП приводят к увеличению среднего времени удвоения. По-видимому, среднее время удвоения клеточной популяции не является обязательным признаком РС, хотя во многих работах, включая и собственные исследования, показано увеличение этого параметра в процессе длительного культивирования МСК (Garcia et al., 2016; de Witte et al., 2017; Кольцова и др., 2017, 2018).
Анализируя результаты по ростовым характеристикам и РС в трех выделенных клеточных популяциях, надо сказать, что для вариантов SC7-MSC-1 и SC7-MSC-2 ростовые характеристики получены только на пассаже 6 в связи с низким ИП, ранним РС и быстрой гибелью клеток. В этих вариантах в процессе культивирования не происходит значительного увеличения клеточной массы за счет активно делящихся клеток. В отличие от них, вариант SC7-MSC-3 показывает активную пролиферацию, высокий ИП, более позднее старение, что сходно с другими линиями МСК. Исходя из строгого определения клеточной линии, согласно которому клеточной линией называется культура, прошедшая 1-й пересев, все 3 популяции можно назвать линиями. Но поскольку наша задача состояла в получении линий именно МСК из одного источника, то две выделенные нами популяции не соответствуют по характеру ростовых характеристик линиям МСК.
Согласно статусу, МСК должны обладать высокой пролиферативной активностью, что позволяет исследовать их характеристики при длительном культивировании. Такая характеристика соответствует определению диплоидных клеточных линий (Dominici et al., 2006; Пинаев, 2008; Sensebé et al., 2010). В связи с полученными ростовыми характеристиками, очевидно, что варианты SC7-MSC-1 и SC7-MSC-2 не соответствуют этому критерию, а вариант SC7-MSC-3 соответствует. Поэтому мы условно назвали варианты SC7-MSC-1 и SC7-MSC-2 клеточными популяциями, а не сублиниями, а вариант SC7-MSC-3, по-видимому, можно назвать линией, но для окончательного подтверждения необходимо провести исследование всех статусных характеристик МСК полученных вариантов.
Кариотипический анализ. Анализ метафазных пластинок во всех трех клеточных популяциях показал соответствие кариотипу исходной линии ЭСК человека SC7 согласно требованиям Международного общества клеточной терапии, которые исключают клеточные культуры, имеющие 10% и более клональных хромосомных нарушений при анализе не менее 20 метафаз для использования их в регенеративной медицине. Тем не менее, выделенные клеточные популяции показали различия по кариотипической стабильности. Так, клеточный вариант SC7-MSC-1 на пассаже 6 имеет нормальный диплоидный кариотип 46, XY (100 ± 1%); не выявлено количественных или структурных изменений хромосом (рис. 3); доля полиплоидных клеток составляет 0.6 ± 0.2%. В клеточной популяции SC7-MSC-2 на пассаже 6 имеет место значительная кариотипическая нестабильность, несмотря на преобладание нормального кариотипа – 46, XY (98.0 ± 1.4%) с долей полиплоидных клеток 1.2 ± 0.3%. В этом варианте обнаружено 15% клеток, имеющих отклонения от нормального кариотипа (рис. 3). Так, в двух клетках с числом хромосом 47 выявлена численная клональная перестройка – трисомия по хромосоме 8 (47, XY,+8); в восьми клетках с числом хромосом 46 обнаружена структурная клональная перестройка – транслокация хромосом 6 и 7, t(6;7)(p21.3~22;q11.2); в пяти клетках наблюдали различные неклональные структурные перестройки: транслокацию хромосом 1 и 7, t(1;7)(q12;q35); транслокацию хромосом 4 и 15, t(4;15)(q13;q26); дицентрическую хромосому dic(15;15)(p11.2;p11.2); делецию длинного плеча хромосомы 18, del(18)(q21.1). Транслокации t(1;7)(q12;q35) и t(15;15)(p11.2;p11.2) приводили к хромосомному дисбалансу в клетках – трисомии по длинному плечу хромосомы 1 и хромосомы 15 соответственно. В одной клетке обнаружили нарушение структуры хромосом 5 и 6 с образованием двух аномальных хромосом add(5)(q11.1) и del(6)(q23) и двух ацентрических фрагментов; хроматидный разрыв в том же локусе 5q11.1 был выявлен в одной клетке (рис. 3б). Следует подчеркнуть, что имеет место корреляция между наличием существенной кариотипической нестабильности, сниженным дифференцировочным потенциалом (рис. 6), низкой пролиферативной активностью, преждевременным РС и ранней гибелью клеток. Тем не менее, возможны варианты, когда и при нормальном кариотипе в варианте SC7-MSC-1 имеют место изменения других характеристик. По-видимому, возможны не только кариотипические изменения, но и генные нарушения, выявляемые молекулярно-генетическим анализом.
Рис. 3.
Кариотипы клеточных популяций SC7-MSC-1 и SC7-MSC-2 на 6-м пассаже. Клетки SC7-MSC-1: нормальный кариотип, 46,XY; клетки SC7-MSC-2: нормальный кариотип 46,XY. На врезке показаны аномалии хромосом, выявленные в отдельных клетках популяции SC7-MSC-2; в верхнем ряду – трисомия по хромосоме 8; транслокация хромосом 6 и 7 t(6;7)(p21.3~22;q11.2): дериваты хромосом 6 и 7 der(6)(7qter→7q11.2::6p21.3~22→6qter), der(7)(7pter→7q11.2::6p21.3~22→6pter); структурная перестройка хромосом 1 и 7, приводящая к трисомии по длинному плечу хромосомы 1: дериват хромосомы 7 der(7)(7pter→7q35::1q12→1qter); в нижнем ряду – транслокация хромосом 4 и 15 t(4;15)(q13;q26): дериваты хромосом 4 и 15 der(4)(4pter→4q13::15q26→15qter), der(15)(15pter→15q26::4q13→4qter); хроматидный разрыв хромосомы 5 chtb(5)(q11.1); структурные перестройки хромосом 5 и 6: add(5)(pter→q11.1::?), ацентрический фрагмент хромосомы 5 ace(5)(:q11.1→qter), del(6)(pter→q23:) и неидентифицированный парный фрагмент; дицентрическая хромосома dic(15;15)(15qter→15p11.2::15p11.2→15qter) в клетке с кариотипом 46,XY,dic(15;15)(p11.2;p11.2); делеция длинного плеча хромосомы 18 del(18)(pter→q21.1:). Стрелками указаны структурно перестроенные хромосомы, ацентрические фрагменты и хроматидный разрыв; звездочкой отмечены клональные перестройки хромосом.
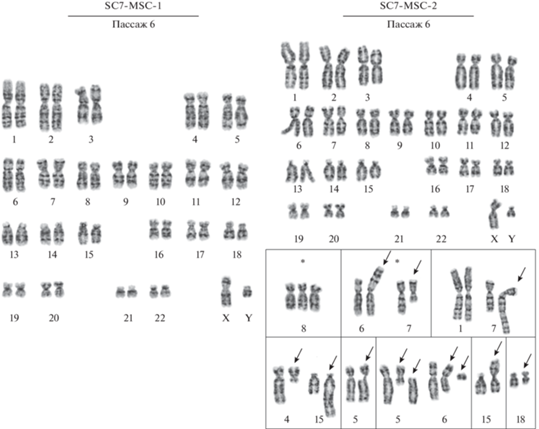
Рис. 4.
Кариотипы клеточной популяции SC7-MSC-3 на 6-м и 13-м пассажах. Пассаж 6: нормальный кариотип, 46,XY. На врезке показана дицентрическая хромосома dic(5;15)(5pter→5q31::15q22~24→15pter) (стрелка) и сопутствующий парный фрагмент (стрелка) в клетке с кариотипом 45,XY,dic(5;15)(q31;q22~24). Пассаж 13: нормальный кариотип 46,XY.
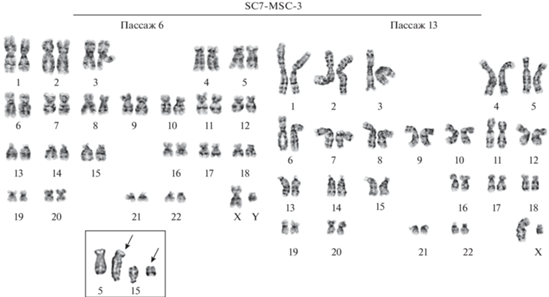
Рис. 5.
Флуоресценция маркеров ранней дифференцировки мезенхимных стволовых клеток человека вариантов SC7-MSC-1, SC7-MSC-2, SC7-MSC-3 на 6-м пассаже. Показаны маркеры эктодермы (нестина), мезодермы (α-актинина) и энтодермы (α‑фетопротеина). Окраска соответствующими моноклональными антителами. Масштабная линейка: 50 мкм.
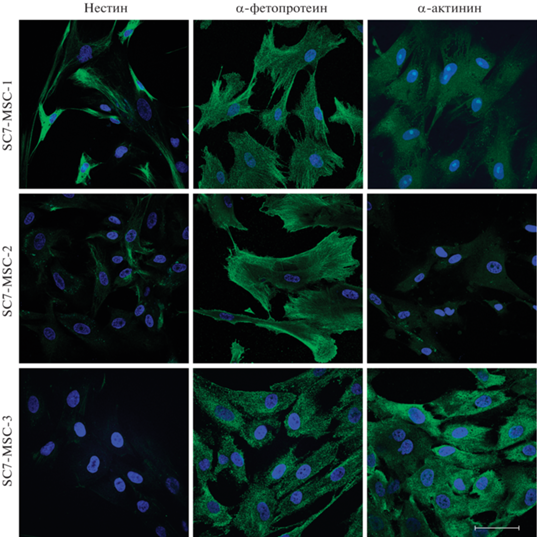
Рис. 6.
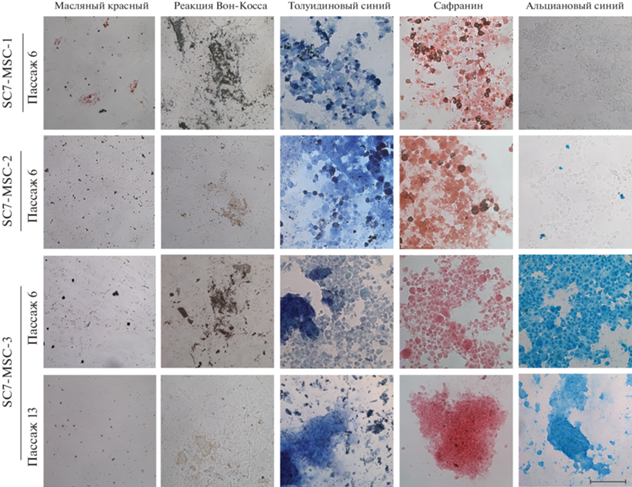
Дифференцировка клеток вариантов SC7-MSC-1, SC7-MSC-2 в адипогенном, остеогенном и хондрогенном направлении на 6-м пассаже; дифференцировка в этих же направлениях варианта SC7-MSC-3 на 6-м и 13-м пассажах. Показаны окрашивание жировых включений масляным красным (адипогенез), реакция Вон Косса, выявляющая нерастворимые соли кальция в межклеточном пространстве (остеогенез) и окрашивание толуидиновым синим сульфатированных гликозаминогликанов, сафранином – протеогликанов или альциановым синим – кислых гликозаминогликанов (хондрогенез). Масштабная линейка: 100 мкм.
Проведение кариотипического анализа в процессе длительного культивирования оказалось возможным только для клеточной популяции SC7-MSC-3. Кариотипический анализ показал, что в этом варианте сохраняется нормальный кариотип 46,XY (99 ± 1%), как на раннем 6-м пассаже, так и на позднем 13-м пассаже, соответствующем началу активной стадии РС (рис. 4). Доля полиплоидных клеток в популяции составляет 5.7 ± 0.9% на пассаже 6 и 3.1 ± 0.6% на пассаже 13.
Единственная клетка с дицентрической хромосомой в кариотипе 45,XY, dic(5;15)(q31;q22~24) была выявлена в этом варианте на пассаже 6.
Анализ поверхностных антигенов для определения статуса МСК. Проведен анализ поверхностных маркеров на 6-м пассаже 3-х клеточных вариантов SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3 (табл. 2).
Таблица 2.
Поверхностные маркеры в клеточных популяциях SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3
| Маркер | SC7-MSC-1, пассаж 6 | SC7-MSC-2, пассаж 6 | SC7-MSC-3, пассаж 6 | SC7-MSC-3, пассаж 13 |
|---|---|---|---|---|
| CD44 | 99.43 ± 0.24 | 99.78 ± 0.13 | 96.27 ± 1.23 | 99.90 ± 0.04 |
| CD73 | 98.70 ± 0.47 | 82.67 ± 0.63 | 97.74 ± 0.30 | 96.00 ± 0.88 |
| CD90 | 21.95 ± 0.20 | 3.21 ± 0.41 | 95.50 ± 2.38 | 99.78 ± 0.07 |
| CD105 | 98.28 ± 0.95 | 99.13 ± 0.10 | 8.40 ± 0.70 | 13.19 ± 1.72 |
| Виментин | 38.43 ± 1.76 | 44.27 ± 7.69 | 36.03 ± 1.48 | 55.19 ± 0.72 |
| CD34 | 0.98 ± 0.08 | 0.82 ± 0.32 | 0.05 ± 0.03 | 0.79 ± 0.36 |
| CD45 | 3.00 ± 0.67 | 0.77 ± 0.25 | 0.03 ± 0.01 | 0.39 ± 0.01 |
| HLA-ABC | 80.95 ± 2.90 | 51.47 ± 1.40 | 99.75 ± 1.40 | 99.80 ± 0.05 |
| HLA-DR | 1.06 ± 0.22 | 0.51 ± 0.16 | 0.51 ± 0.16 | 0.42 ± 0.04 |
Из этих результатов следует, что в обоих вариантах присутствуют характерные для МСК маркеры (Полянская, 2018). Тем не менее, обнаружен ряд количественных отличий от других линий. Так, маркер CD90 в вариантах SC7-MSC-1 и SC7-MSC-2 присутствует на низком уровне. Причем, если в варианте SC7-MSC-1 его мало, но он присутствует, то в варианте SC7-MSC-2 его выраженность крайне слаба, близка к отсутствию. В третьем варианте SC7-MSC-3 наблюдается высокий, не отличающийся от большинства других линий, уровень CD90, но наблюдается значительно пониженный уровень маркера CD105.
Возможно, что сниженный уровень этих поверхностных антигенов отражает иное физиологическое состояние клеточной популяции по сравнению с остальными монослойными клеточными культурами. Так, для того чтобы получить МСК из ЭСК, необходимо провести ЭСК через стадию клеточных сфероидов (3D) (Крылова и др., 2012). Ранее было показано снижение уровня CD90 в клеточных сфероидах по сравнению с монослойной культурой (Крылова и др., 2015). Данные других авторов также свидетельствуют о том, что уровень поверхностных маркеров зависит от условий культивирования (Frith et al., 2010; Alimperti et al., 2014). Таким образом, колебания уровня поверхностных маркеров могут быть, в частности, связаны с эпигенетическими изменениями. Нами ранее было показано, что содержание маркера CD90 может изменяться в активной стадии РС, а также зависеть от локализации источника получения МСК в одном органе (Кольцова и др., 2020). Надо подчеркнуть, что функционально CD90 и CD105 связаны с важнейшими клеточными процессами, такими как межклеточные взаимодействия, миграция, клеточная пролиферация и дифференцировка (Maleki et al., 2014). Тем не менее, пока сложно установить коррелятивные отношения между количеством поверхностных маркеров и другими характеристиками МСК. В представленном случае наблюдаются различия между исследуемыми популяциями.
Результаты иммунофлуоресцентного анализа. Присутствие маркеров ранней дифференцировки ЭСК в производные трех зародышевых листков в клетках SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3 на 6-м пассаже показано на рис. 5. Идентифицированы следующие маркеры: нестин (маркер эктодермы), альфа-фетопротеин (маркер энтодермы) и альфа-актинин (маркер мезодермы). Имеют место различия между популяциями. Так, в популяции SC7-MSC-1 присутствуют все маркеры; в популяции SC7-MSC-2 присутствует маркер альфа-фетопротеина, тогда как маркеры нестина и альфа-актинина выражены крайне слабо; в линии SC7-MSC-3 отсутствует нестин, остальные 2 маркера присутствуют. Возможно, что с присутствием маркеров ранней дифференцировки ЭСК связана дифференцировочная пластичность МСК (Riekstina et al., 2009; Huang et al., 2010; Antonucci et al., 2011; Mamidi et al., 2011; Wu et al., 2013).
Существенно отметить, что на пассаже 6 во всех 3-х вариантах отсутствуют клетки, несущие маркеры недифференцированных ЭСК: SSEA-4, Oct-4, TRA-1-60, SOX2 (данные не представлены). Информация по наличию этих маркеров в разных МСК противоречива. Есть исследования, свидетельствующие об их отсутствии, или присутствии некоторых из них. Есть данные, подтверждающие их участие в процессах пролиферации и дифференцировки МСК (Крылова и др., 2012; Полянская, 2018).
Индукция остеогенной, адипогенной и хондрогенной дифференцировки для определения статуса МСК. Результаты анализа дифференцировочного потенциала в клеточных вариантах SC7-MSC-1, SC7-MSC-2 и SC7-MSC-3 на 6-м пассаже представлены на рис. 6 и 7. Так, в варианте SC7-MSC-1 наблюдается ослабленная дифференцировка в адипогенном направлении: наблюдается незначительное количество жировых капель. В этом варианте присутствует остеогенная дифференцировка, выражающаяся в формировании минеральных комплексов, идентифицированных с помощью реакции Вон Косса, выявляющей нерастворимые соли кальция в межклеточном пространстве. Обнаружено также наличие хондрогенной дифференцировки, идентифицированной с помощью окрашивания толуидиновым синим, выявляющим сульфатированные гликозаминогликаны, и сафранином, выявляющим протеогликаны; не обнаружены кислые гликозаминогликаны, выявляющиеся при окрашивании альциановым синим.
Рис. 7.
Подтверждение дифференцировки клеток варианта SC7-MSC-3 в адипогенном направлении на 6-м пассаже при большем увеличении. Убедительно показано наличие жировых включений, окрашенных масляным красным, внутри клеток. Масштабная линейка: 30 мкм.
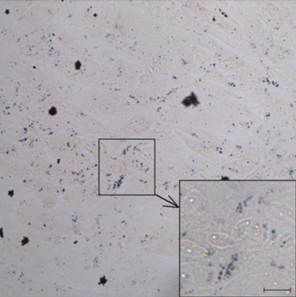
В отличие от варианта SC7-MSC-1, в варианте SC7-MSC-2 отсутствуют адипогенная и остеогенная дифференцировки. Хондрогенная дифференцировка проявляется подобно SC7-MSC-1. В связи с тем, что в обоих вариантах не обнаружены кислые гликозаминогликаны, выявляющиеся при окрашивании альциановым синим, можно предположить, что эта дифференцировка проявляется в обоих вариантах не полностью, т.е. дифференцировка ослаблена. В клеточном варианте (линии) SC7-MSC-3 присутствуют все 3 дифференцировки в полном объеме. Адипогенная дифференцировка представлена в виде крайне мелких капель жира, на первый взгляд схожих с агрегатами красителя Масляного красного, неспецифически оседающего на монослой клеток. Однако при большем увеличении (с некоторой потерей четкости из-за оптических свойств культурального пластика, на котором ведется съемка) видно, что это именно капли жира, расположенные внутри клеток (рис. 7).
Таким образом, можно утверждать, что 3 выделенные клеточные популяции принципиально различаются между собой по дифференцировочному потенциалу.
Продолжение культивирования линии SC7-MSC-3 до 13 пассажа выявило изменения в дифференцировочном потенциале. На этом пассаже отсутствуют адипогенная и остеогенная дифференцировки; обнаружена только хондрогенная дифференцировка (рис. 6). На 13-м пассаже, согласно активности β-галактозидазы, наступает РС, но, по-видимому, находящееся в начале этого процесса, т. к. существенного снижения ИП не происходит; согласно кривым роста, снижение ИП наблюдается только через 120–144 ч культивирования. Значительное снижение ИП имеет место на 18 пассаже (рис. 2). Полученные данные о снижения активности β-галактозидазы и изменении дифференцировочного потенциала свидетельствует о начале процесса активного РС на пассаже 13.
В заключение рассмотрим наблюдающиеся корреляции между полученными характеристиками 3-х клеточных популяций. Так, анализ РС показал, что во всех вариантах на 6-м пассаже имеет место повышенная частота стареющих клеток. Но в SC7-MSC-1 и SC7-MSC-2 наблюдается быстрое значительное увеличение стареющих клеток, способствующее их гибели. Тогда как в SC7-MSC-3 процесс старения идет медленнее. Есть данные, указывающие, что степень старения клеточной популяции связана с характером дифференцировочного потенциала (Park et al., 2005; Bonab et al., 2006; Lo Surgo et al., 2013; Bianchi et al., 2017; Кольцова и др., 2017; 2020; Крылова и др., 2018; Мусорина и др., 2019). Возможно, что повышенный уровень стареющих клеток на 6-м пассаже и дальнейшее быстрое старение способствует сниженному уровню дифференцировочного потенциала. Особенно ярко это проявляется в варианте SC7-MSC-2, у которого к пассажу 10 уже накапливается около 80% старых клеток и при этом отсутствуют адипогенная и отеогенная дифференцировки, а хондрогенная дифференцировка снижена. В клетках SC7-MSC-3, у которых старение идет медленнее, дифференцировочный потенциал развит полностью. Кроме корреляции между этими двумя признаками, обнаружена корреляция между сниженным уровнем поверхностного маркера CD90 и уровнем дифференцировки; особенно ярко это выражено в варианте SC7-MSC-2. Подобные данные описаны и в других работах (например: Brown et al., 2014).
Следует подчеркнуть, что причина получения нами клеточных популяций, различных по ряду свойств, может быть связана с процессом дифференцировки МСК из ЭСК. Как указывалось выше, процесс получения МСК из ЭСК человека может иметь ряд особенностей по сравнению с получением других МСК. В результате в процессе дифференцировки ЭСК в МСК из-за существенных изменений условий культивирования могут образоваться новые геномные варианты, или увеличиваться немногочисленные геномные изменения уже имеющиеся в ЭСК, которые не всегда можно выявить цитогенетическими методами. В некоторых случаях необходим молекулярно-биологический анализ (Полянская, 2014). Возникшие изменения могут дестабилизировать некоторые статусные или существенные для клеточной жизнедеятельности характеристики МСК.
Таким образом, проведенный анализ клеточных характеристик трех независимых популяций МСК, выделенных из линии SC7, свидетельствует о том, что только одна популяция (SC7-MSC-3) соответствует определению полноценной линии МСК с наличием статусных характеристик, которая названа нами SC7-MSC.
Список литературы
Воронкина И.В., Смагина Л.В., Бильдюг Н.Б., Мусорина А.С., Плянская Г.Г. 2020. Динамика активности матриксных металлопротеиназ и содержание белков внеклеточного матрикса в процессе репликативного старения линий мезенхимных стволовых клеток человека. Цитология. Т. 62. № 3. С. 210. (Voronkina I.V., Smagina L.V., Bildyug N.B., Musorina A.S., Poljanskaya G.G. 2020. Dynamics of matrix metalloproteinase activity and extracellular matrix proteins content in the process of replicative senescence of human mesenchymal stem cells. Cell Tiss. Biol. V. 14. P. 349.)https://doi.org/10.31857/S0041377120030086
Воронкина И.В., Смагина Л.В., Крылова Т.А., Мусорина А.С., Полянская Г.Г. 2016. Сравнительный анализ динамики активности матриксных металлопротеиназ в процессе дифференцировки мезенхимных стволо вых клеток человека, выделенных из разных тканей одного донора. Цитология. Т. 58. № 11. С. 865. (Voronkina I.V., Smagina L.V., Krylova T.A., Musorina A.S., Poljanskaya G.G. 2017. Analysis of matrix metalloproteinase activity during differentiation of mesenchymal stem cells isolated from different tissues of one donor. Cell Tiss. Biol. V. 11. P. 95.)
Кольцова А.М., Гордеева О.Ф., Крылова Т.А., Лифанцева Н.В., Мусорина А.С., Яковлева Т.К., Полянская Г.Г. 2011. Сравнительные характеристики новых линий эмбриональных стволовых клеток человека SC5, SC6, SC7 и SC3a. Онтогенез. Т. 42. № 4. С. 249. (Koltsova A.M., Gordeeva O.F., Krylova T.A., Lifantseva N.V., Musorina A.S., Yakovleva T.K., Poljanskaya G.G. 2011. Comparative characteristics of new human embryonic stem cell lines SC5, SC6, SC7, and SC3a. Ontogenez. V. 42. № 4. P. 249.)
Кольцова А.М., Зенин В.В., Яковлева Т.К., Полянская Г.Г. 2015. Характеристика новой линии мезенхимных стволовых клеток, выделенных из эмбриональных стволовых клеток человека. Цитология. Т. 57. № 11. С. 761. (Koltsova A.M., Zenin V.V., Yakovleva T.K., Poljanskaya G.G. 2016. Characterization of a novel mesenchymal stem cell line derived from human embryonic stem cells. Cell Tiss. Biol. V. 10. P. 1.)
Кольцова А.М., Зенин В.В., Петросян М.А., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2020. Получение и характеристика линий мезенхимных стволовых клеток, выделенных из разных областей плаценты одного донора. Цитология. Т. 62 № 9. С. 713. (Koltsova A.M., Zenin V.V., Petrosyan M.A., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2021. Isolation and characterization of Mesenchymal Stem Cell Line Derived from different regions of the placenta of the same donor. Cell Tiss. Biol. V. 15. P. 356.) https://doi.org/10.31857/S0041377120090035
Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и характеристика линии мезенхимных стволовых клеток, выделенных из пульпы молочного зуба человека. Цитология. Т. 60. № 12. С. 955. (Koltsova A.M., Zenin V.V., Turilova V.I., Yakovle-va T.K., Poljanskaya G.G. 2018. The derivation and characterization of mesenchymal stem cell line, isolated from human pulp of a deciduous tooth. Tsitologiya. V. 60. P. 955.)https://doi.org/10.1134/S0041377118120015
Кольцова А.М. Крылова Т.А., Мусорина А.С., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2017. Динамика свойств двух линий мезенхимных стволовых клеток, полученных из Вартонова студня пупочного канатика человека, при длительном культивировании. Цитология. Т. 59. С. 574. (Koltsova A.M., Krylova T.A., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2017. Dynamics properties of two lines of mesenchymal stem cells, derived from the Wharton’ jelly of the human umbilical cord, during long-term cultivation. Tsitologiya. V. 59. P. 574.)
Крылова Т.А., Кольцова А.М., Зенин В.В., Мусорина А.С., Яковлева Т.К., Полянская Г.Г. 2012. Сравнительные характеристики новых линий мезенхимных стволовых клеток, полученных из эмбриональных стволовых клеток, костного мозга и крайней плоти человека. Цитология. Т. 54. № 1. С. 5. (Krylova T.A., Koltsova A.M., Zenin V.V., Musorina A.S., Yakovleva T.K., Poljanskaya G.G. 2012. Comparative characteristics of new mesenchymal stem cells lines derived from human embryonic stem cells, bone marrow, and foreskin. Tsitologiya. V. 54. P. 5.)
Крылова Т.А., Мусорина А.С., Зенин В.В., Полянская Г.Г. 2015. Характеристика клеточных сфероидов, полученных из линий мезенхимных стволовых клеток, выделенных из костного мозга и зачатка конечности раннего эмбриона человека. Цитология. Т. 57. № 7. С. 480. (Krylova T. A., Musorina A.S., Zenin V.V., Poljanskaya G.G. 2015. Cellular spheroids obtained from mesenchymal stem cells derived from bone marrow and limb muscle of early human embryo. Tsitologiya. V. 57. № 7. P. 480).
Крылова Т.А., Мусорина А.С., Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и сравнительная характеристика линий мезенхимных стволовых клеток, полученных из крайней плоти двух доноров одного возраста. Цитология. Т. 60. № 4. С. 262. (Krylova T.A., Musorina A.S., Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The derivation and comparative characterization of mesenchymal stem cell lines, isolated from the foreskin of two donors of the same age. Tsitologiya. V. 60. P. 262).https://doi.org/10.31116/tsitol.2018.04.04
Мусорина А.С., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2019. Характеристика неиммортализованной линии мезенхимных стволовых клеток, выделенных из эпикардиальной жировой ткани человека. Цитология. Т. 61. № 4. С. 272. (Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2019. Characterization of a nonimmortalized mesenchymal stem cell line isolated from human epicardial adipose tissue. Cell Tiss. Biol. V. 13. P. 247.)
Пинаев Г.П. 2008. Клеточные культуры в фундаментальных и прикладных исследованиях (обзор). В кн. “Методы культивирования клеток”. СПб. Изд-во Политехн. Ун-та. С. 7–21. (Pinaev G.P. 2008. Cell cultures in fundamental and applied research (review). In: Methods of cell cultivation. St. Petersburg: Publishing house of the Polytechnic University. P. 7.
Полянская Г.Г. 2008. Типы клеточных культур. Образование, основные характеристики и изменчивость клеточных линий (обзор). В кн. Методы культивирования клеток. СПб. Изд-во Политехн. Ун-та. С. 22–40. (Poljanskaya G.G. 2008. Types of cell cultures. Formation, main characteristics and variability of cell lines. In: Methods of cell cultivation. St. Petersburg: Publishing house of the Polytechnic University. P. 22–40.
Полянская Г.Г. 2014. Проблема нестабильности генома культивируемых стволовых клеток человека (обзор). Цитология. Т. 56. № 10. С. 697. (Poljanskaya G.G. 2014. The problem of genomic instability of cultivated human stem cells. (review). Tsitologiya. V. 56. P. 697.)
Полянская Г.Г. 2018. Сравнительный анализ характеристик линий мезенхимных стволовых клеток человека, полученных в коллекции культур клеток позвоночных (обзор). Сб. “Клеточные культуры”, вып. 34. С. 3. (Poljanskaya G.G. 2018. Comparative analysis of the lines of human mesenchymal stem cells derived in the collection of cell cultures of vertebrates (review). Collection “Cell cultures”. V. 34. P. 3).
Полянская Г.Г., Абрамян Д.С., Глебов О.К. 1981. Кариотипическая структура клоновых популяций клеток китайского хомячка при длительном культивировании. Цитология. Т. 23. № 7. С. 818. (Poljanskaya G.G., Abramyan D.S., Glebov O.K. 1981. The karyotypic structure of clonal population of Chinese hamster cells during a prolonged cultivation. Tsitologiya. V. 23. P. 818.)
Полянская Г.Г., Вахтин Ю.Б. (Poljanskaya G.G., Vakhtin Yu.B). 2003. Кариотипическая структура клеточных популяций in vitro как целостная система (The karyotypic structure of cell populations in vitro as integral system) (обзор). Цитология. Т. 45. С. 115. (Tsitologiya. V. 45. P. 115).
Полянская Г.Г., Мусорина А.С. 2018. Коллекция культур клеток позвоночных: создание, деятельность, каталог. СПб.: Изд-во Политехнического ун-та. 184 с. (Poljanskaya G.G., Musorina A.S. 2018. Collection of vertebrate cell cultures: creation, activity, catalogue. SPb.: Polytechnic Univ. Publishing House. 184 p.)
Седова Г.П. 2008. Количественные аспекты злокачественного роста. Математическая морфология. Электронный математический и медико-биологический журн. Т. 7. URL: Http://www.smolensk.ru/user/sgma/ mmorph/n-18-html/cont.htm (Sedova G.P. 2008. Quantitative aspects of malignant body height. Mathematical morphology. Electronic Math. Medicobiol. J. V. 7. URL: http://www.smolensk.ru/user/sgma/mmorph/n-18-html/cont.htm)
Adak S., Magdalene D., Deshmukh S., Das D., Jaganathan B. 2021. A review on mesenchymal stem cells for treatment of retinal diseases. stem cell reviews and reports. V. 6. P. 1. https://doi.org/10.1007/s12015-020-10090-x
Albu S., Kumru H., Coll R., Vives J., Vallés M., Denito-Penalva J., Rodriguez L., Codinach M., Hernández J., Navarro X., Vidal J. 2021.Clinical effects of intrathecal administration of expanded Wharton jelly mesenchymal stromal cells in patients with chronic complete spinal cord injury: a randomized controlled study. Cytotherapy. V. 23. P. 146. https://doi.org/10.1016/j.jcyt.2020.08.008
Alimperti S., Lei P., Wen Y., Tian J., Campbell A.M., Andreadis S.T. 2014. Serum-free spheroid suspension culture maintains mesenchymal stem cell proliferation and differentiation potential. Biotechnol. Prog. V. 30. P. 974. https://doi.org/10.1002/btpr.1904
Antonucci I., Stuppia L., Kaneko Y., Yu S., Tajiri N., Bae E.C., Chheda S.H., Weinbren N.L., Borlongan C.V. 2011. Amniotic fluid as rich source of mesenchymal stromal cells for transplantation therapy. Cell Transplant. V. 20. P. 789. https://doi.org/10.3727/096368910X539074
Bianchi M.V., Awaja F., Altankov G. 2017. Dynamic adhesive environment alters the differentiation potential of young and ageing mesenchymal stem cells. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 78. P. 467.
Bonab M.M., Alimoghaddam K., Talebian F., Ghaffari S.H., Ghavamzadeh A., Nikbin B. 2006. Aging of mesenchymal stem cell in vitro. BMC Cell Biol. V. 7. P. 14.
Brown P.T., Squire M.W., Li W.J. 2014. Characterization and evaluation of mesenchymal stem cells derived from human embryonic stem cells and bone marrow. Cell Tissue Res. V. 358. P. 149. https://doi.org/10.1007/s00441-014-1926-5
Caplan A., Dennis J.E. 2006. Mesenchymal stem cells as trophic mediators. J. Cell Biochem. V. 98. P. 1076.
Chi Y., Han Z.-B., Xu F.-Y., Wang Y.-W., Feng X.-M., Chen F., Ma F.-X., Du W.-J., Han Z.-C. 2014. V. 22. P. 588. https://doi.org/10.7534/j.iccn.1009-2137.2014.03.003
Costa L., Eiro N., Fraile M., Gonzalez L., Saá J., Garcia-Portabella P., Vega B., Schneider J., Vizoso F. 2021. Functional heterogeneity of mesenchymal stem cells from natural niches to culture conditions: implications for further clinical uses. Cell Mol. Life Sci. V. 78. P. 447. https://doi.org/10.1007/s00018-020-03600-0
De Witte S.F.H., Lambert E.E., Merino A., Strini T., Douben H.J.C.W., O’Flynn L., Elliman S.J., de Klein A.J.E.M.M., Newsome P.N., Baan C.C., Hoogduijn M.J. 2017. Aging of bone marrow- and umbilical cord-derived mesenchymal stromal cells during expansion. Cytotherapy. V. 19. P. 798. https://doi.org/10.1016/j.jcyt.2017.02.074
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Int. Soc. Cell. Ther. position statement. Cytother. V. 8. P. 315.
Frith J.E., Thomson B., Genever P.G. 2010. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng. (C) Methods. V. 16. P. 735. https://doi.org/10.1089/ten.TEC.2009.0432
Garcia J., Wright K., Roberts S., Kuiper J.H., Mangham C., Richardson J., Mennan C. 2016. Characterisation of synovial fluid and infrapatellar fat pad derived mesenchymal stromal cells: The influence of tissue source and inflammatory stimulus. Sci. Rep. V. 6. P. 24295. https://doi.org/10.1038/srep24295
Guo M., Li D., Feng Y., Li Mu., Yang Bo. 2022. Adipose-derived stem cell-derived extracellular vesicles inhibit neuroblastoma growth by regulating GABBR1 activity through LINC00622-mediated transcription factor AR. J. Leukoc. Biol. V. 111. P. 19. https://doi.org/10.1002/JLB.1MIA0321-164R
Jin Q., Yuan K., Lin W., Niu C., Ma R., Huang Z. 2019. Comparative characterization of mesenchymal stem cells from human dental pulp and adipose tissue for bone regeneration potential. Artif. Cells Nanomed. Biotechnol. V. 47. P. 1577. https://doi.org/10.1080/21691401.2019.1594861
Huang H.I., Chen S.K., Ling Q.D., Chien C.C., Liu H.T., Chan S.H. 2010. Multilineage differentiation potential of fibroblast-like stromal cells derived from human skin. Tiss. Eng. (A). V. 16. P. 1491. https://doi.org/10.1089/ten.TEA.2009.0431
Kobayashi T., Torii D., Iwata T., Izumi Y., Nasu M., Tsutsui T.W. 2020. Characterization of proliferation, differentiation potential, and gene expression among clonal cultures of human dental pulp cells. Hum. Cell. V. 33. P. 490. https://doi.org/10.1007/s13577-020-00327-9
Li J., Xu S.-Q., Zhao Y.-M., Yu S., Ge L.-H., Xu B.-H. 2018. Comparison of the biological characteristics of human mesenchymal stem cells derived from exfoliated deciduous teeth, bone marrow, gingival tissue, and umbilical cord. Mol. Med. Rep. V. 18. P. 4969. https://doi.org/10.3892/mmr.2018.9501
Lo Surdo J.L., Millis B.A., Bauer S.R. 2013. Automated microscopy as a quantitative method to measure differences in adipogenic differentiation in preparations of human mesenchymal stromal cells. Cytotherapy. V. 15. P. 1527.
Maleki M., Ghanbarvand F., Reza Behvarz M., Ejtemaei M., Ghadirkhomi E. 2014. Comparison of mesenchymal stem cell markers in multiple human adult stem cells. Int. J. Stem Cells. V. 7. P. 118. https://doi.org/10.15283/ijsc.2014.7.2.118
Mamidi M.K., Pal R., Mori N.A., Arumugam G., Thrichelvam S.T., Noor P.J., Abdullah H.M., Gupta P.K., Das A.K., Zakaria Z., Bhonde R. 2011. Co-culture of mesenchymal-like stromal cells derived from human foreskin permits long term propagation and differentiation of human embryonic stem cells. J. Cell Biochem. V. 112. P. 1353. doi.org/https://doi.org/10.1002/jcb.23052
McGowan-Jordan J., Simons A., Schmid M. 2016. An international system for human cytogenetic nomenclature. Basel: S. Karger. 140 p.
Montesinos J., Flores-Figueroa E., Castillo-Medina S., Flores-Guzman P., Hermandez-Estevez E., Fajard0-Orduna G., Orozco S., Mayani H. 2009. Human mesenchymal stromal cells from adult and neonatal sources: comparative analysis of their morphology, immunophenotype, differentiation patterns and neural protein expression. V. 11. P. 163. https://doi.org/10.1080/14653240802582075
Muraglia A., Cancedda R., Quarto R. 2000. Clonal mesenchymal progenitors from human bone marrow differentiate in vitro accoding to a hierarchical model. J. Cell Sci. V. 7. P.1161. https://doi.org/10.1242/jcs.113.7.1161
Oh J., Lee R. 2021. Mesenchymal stromal cells for the treatment of ocular autoimmune diseases. Prog.Retin.Eye Res. V. 85. https://doi.org/10.1016/jpreteyeres.2021.100967
Ozkinay C., Mitelman F. 1979. A simple trypsin-Giemsa technique producing simultaneous G- and C-banding in human chromosomes. Hereditas. V. 90. P. 1.
Park J.S., Kim H.Y., Kim H.W., Chae G.N., Oh H.T., Park J.Y., Shim H., Seo M., Shin E.Y., Kim E.G., Park S.C., Kwak S.J. 2005. Increased caveolin-1, a cause for the declined adipogenic potential of senescent human mesenchymal stem cells. Mech. Ageing Dev. V. 126. P. 551.
Phinney D.G. 2007. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy. Cell Cycle. V. 6. P. 2884.
Reyes M., Lund T., Lenvik T., Aguiar D., Koodie L., Verfaillie C.M. 2001. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood. V. 98. P. 2615.
Riekstina U., Cakstina I., Parfejevs V., Hoogduijn M., Jankovskis G., Muiznieks I., Muceniece R., Ancans J. 2009. Embryonic stem cell marker expression pattern in human mesenchymal stem cells derived from bone marrow, adipose tissue, heart and dermis. Stem Cell Rev. V. 5. P. 378. https://doi.org/10.1007/s12015-009-9094-9
Russell K.C., Phinney D.G., Lacey M.R., Barrilleaux B.L., Meyertholen K.E., O’Connor K.C. 2010. In vitro high-capacity assay to quantify the clonal heterogeneity in trilineage potential of mesenchymal stem cells reveals a complex hierarchy of lineage commitment. Stem cells. V. 28. P. 788. https://doi.org/10.1002/stem.312
Sensebé L., Krampera M., Schrezenmeier H., Bourin P., Giordano R. 2010. Mesenchymal stem cells for clinical application. Vox Sang. V. 98. P. 93.
Shin S., Lee J., Kwon Y., Park K.-S., Jeong J.-H., Choi S.-J., Bang S., Chang J., Lee C. 2021. Comparative proteomic analysis of the mesenchymal stem cells secretome from adipose, bone marrow, placenta and Wharton’s jelly. Int. J. Mol. Sci. V. 22. P. 845. https://doi.org/10.3390/ijms22020845
Shin J., Ryu C-.M., Ju H., Yu H., Song S., Hong K.-S., Chung H.-M., Park J., Shin D.-M., Choo M.-S. 2020. Therapeutic efficacy of human embryonic stem cells-derived multipotent stem/stromal cells in diabetic detrusor underactivity: A preclinical study. J. Clin. Med. V. 9. P. 2853. https://doi.org/10.3390/jcm.9092853
Semenova E., Grudniak M.P., Machaj E.K., Bocian K., Chroscinska-Krawczyk M., Trochonowicz M., Stepaniec I.M., Murzyn M., Zagorska K.E., Boruczkowski D., Kolanowski T.J., Oldak T., Rozwadowska N. 2021. Mesenchymal stromal cells from different parts of umbilical cord: Approach to comparison & characteristics. Stem Cell Rev. Rep. https://doi.org/10.1007/s12015-021-10157-3
Somoza R., Conget P., Rubio F. 2008. Neuropotency of human mesenchymal stem cell cultures: clonal studies reveal the contribution of cell plasticity and cell contamination. Biol. Blood Marrow Transplant. V. 14. P. 546. https://doi.org/10.1016/j.bbmt.2008.02.017
Stanko P., Kaiserova K., Altanerova V., Altaner C. 2014. Comparison of human mesenchymal stem cells derived from dental pulp, bone marrow, adipose tissue, and umbilical cord tissue by gene expression. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech. Repub. V. 158. P. 373. https://doi.org/10.5507/bp.2013.078
Sworder B.J., Yoshizawa S., Mishra P.J., Cherman N., Kuznetsov S.A., Merlino G., Balakumaran A., Robey P.G. 2015. Molecular profile of clonal strains of human skeletal stem/progenitor cells with different potencies. Stem Cell Res. V. 14. P. 297. https://doi.org/10.1016/j.scr.2015.02.005
Taei A., Dargahi L., Nasoohi S., Hassanzadeh G., Kadivar M., Farahmandfar M. 2021. The conditioned medium of human embryonic stem cell-derived mesenchymal stem cells alleviates neurological deficits and improves synaptic recovery in experimental stroke. J. Cell Physiol. V. 236. P.1967. https://doi.org/10.1002/jcp.29981
Tai C., Wang L., Xie Y., Gao T., Huang F., Wang B. 2021 Analysis of key distinct biological characteristics of human placenta-derived mesenchymal stromal cells and individual heterogeneity attributing to donors. P. 1. Online ahead of printhttps://doi.org/10.1159/000513038
Vasudevan A., Bruining D., Loftus E., Faubion W., Ehman E., Raffals L. 2021. Approach to medical therapy in perianal Crohn’s disease. V. 27. P. 3693. https://doi.org/10.3748/wjg.v27.i25.3693
Wang J., Shi P., Chen D., Wang S., Wang P., Feng X., Zhang L. 2021. Research status of the safety and efficacy of mesenchymal stem cells in the treatment of COVID-19-related pneumonia: a systematic review and meta-analysis. Stem Cells Dev. V. 30. P. 947. https://doi.org/10.1089/scd.2021.0179
Wangler S., Kamali A., Wapp C., Wuertz-Kozak K., Häckel S., Fortes C., Lorin M., Benneker L.M., Haglund L., Richards R.G., Alini M., Peroglio M., Grad S. 2021. Uncovering the secretome of mesenchymal stromal cells exposed to healthy, traumatic, and degenerative intervertebral discs: a proteomic analysis. Stem Cell Res. Ther. V. 12. P. 11. https://doi.org/10.1186/s13287-020-02062-2
Wu R., Gu B., Zhao X., Tan Z., Chen L., Zhu J., Zhang M. 2013. Derivation of multipotent nestin(+)/CD271(–STRO-1(–) mesenchymal-like precursors from human embryonic stem cells in chemically defined conditions. Hum. Cell. V. 26. P. 19. https://doi.org/10.1007/s13577-011-0022-3
Xiao Z., Lei T., Liu Y., Yang Y., Bi W., Du H. 2021. The potential therapy with dental tissue-derived mesenchymal stem cells in Parkinson’s disease. Stem Cell Res. Ther. V. 12. P. 5. https://doi.org/10.1186/s13287-020-01957-4
Yang C., ChenY., Zhong L., You M., Ya Z., Luo M., Zhang B., Yang B., Chen Q. 2019. Homogeneity and heterogeneity of biological characteristics in mesenchymal stem cells from human umbilical cords and exfoliated deciduous teeth. V.98. P. 415. https://doi.org/10.1139/bcb-2019-0253
Yigitbilek F., Conley S.M., Tang H., Saadiq I.M., Jordan K.L., Lerman L.O., Taner T. 2021. Comparable in vitro function of human liver-derived and adipose tissue-derived mesenchymal stromal cells: Implications for cell-based therapy. Front. Cell Dev. Biol. V. 9. eCollection 2021. https://doi.org/10.3389/fcell.2021.641792
Yu H.Y., Shin J.H., Yun H., Ryu C.-M., Lee S., Heo J., Park J., Hong K.-S., Chung H.-M., Shin D.-M., Choo M.-S. 2021. A preclinical study of human embryonic stem cell-derived mesenchymal stem cells for treating detrusor underactivity by chronic bladder ischemia. Stem Cell Rev. Rep. V. 17. P. 2139. https://doi.org/10.1007/s12025-021-10204-z
Zhang K., Li F., Yan B., Xiao D.-J., Wang Y.-S., Liu H. 2021. Comparison of the cytokine profile in mesenchymal stem cells from human adipose, umbilical cord and placental tissues. Cell Reprogram. V. 23. P. 336. https://doi.org/10.1089/cell.2021.0043
Zhang X., Wang N., Huang Y., Li Y., Li G., Lin Y., Atala A., Hou J., Zhao W. 2022. Extracellular vesicles from three dimensional culture of human placental mesenchymal stem cells ameliorated renal ischemia/reperfusion injury. Int. J. Artif. Organs. https://doi.org/10.1177/0391398820986809
Дополнительные материалы отсутствуют.
Инструменты
Цитология


