Цитология, 2022, T. 64, № 5, стр. 427-447
Существует ли капсула кариосферы в ооцитах травяной лягушки? Критический анализ проблемы
Д. С. Боголюбов 1, *, А. О. Травина 1, И. О. Боголюбова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: dbogol@mail.ru
Поступила в редакцию 12.05.2022
После доработки 25.05.2022
Принята к публикации 29.05.2022
- EDN: MVLGXS
- DOI: 10.31857/S0041377122050029
Аннотация
Кариосфера (кариосома) – мейоз-специфическая эволюционно консервативная структура, представляющая собой конденсированные биваленты, которые на стадии диплотены профазы мейоза собраны вместе в ограниченном пространстве крупного ядра. У некоторых организмов кариосфера дополнительно отделена от окружающей нуклеоплазмы надструктурным экстрахромосомным компартментом, называемым капсулой кариосферы (КК). Традиционно считают, что КК – специализированный элемент ядра ооцита (зародышевого пузырька, ЗП), который поддерживает кариосферу за счет присутствия структурных белков, прежде всего F-актина. Мы представляем новый взгляд на КК, которая, как считали прежде, формируется в ЗП травяной лягушки Rana temporaria. Кариосфера R. temporaria представляет собой простой “клубок” хромосом, или кариосому. ЗП R. temporaria в высокой степени обогащен филаментами F-актина, которые формируют обширную сеть в ядре, но не концентрируются в особой зоне (капсуле) вокруг конденсированных хромосом. В этом смысле структура ЗП R. temporaria существенно не отличается от таковой Xenopus laevis, у которого кариосфера и, соответственно, ее капсула не выражены. Легко идентифицируются типичные для ЗП R. temporaria немембранные тяжи (прежде называемые “псевдомембранами”), а также “колечки” (annuli), которые, как считали ранее, представляют собой автономные поровые комплексы. Однако annuli не содержат нуклеопорина 35 (Nup35) и, следовательно, не могут рассматриваться в качестве аналогов ядерных поровых комплексов. Электронно-плотные тяжи, которые связывают annuli, не содержат ни F-актина, ни ламина B и не образуют покрова вокруг кариосферы. Структурные белки, такие как ламины, присутствуют в нуклеоплазме и концентрируются в локальных электронно-плотных сгустках – специфических биомакромолекулярных конденсатах полимерных молекул – белков и, возможно, РНК. Таким образом, кариосфера R. temporaria не имеет фиброзного скаффолда. Для сравнения использован материал КК жука Tribolium castaneum, в ЗП которого действительно формируется стабильный и обширный слой (оболочка, или shell), состоящий из F-актина. Мы полагаем, что структурная роль КК в ЗП R. temporaria несколько преувеличена. Однако кариосфера R. temporaria заключена в большое скопление сотен свободных амплифицированных ядрышек, напоминающее КК. Это скопление ядрышек весьма стабильно и легко может быть изолировано под обычным бинокулярным стереомикроскопом. Поскольку ядрышки представляют собой отдельные жидкие капли, их нельзя рассматривать в качестве структур, формирующих типичную КК, которая по определению имеет фиброзную структуру. Сходная ситуация характеризует ЗП жука Tenebrio molitor, в котором отсутствуют ядрышки, но кариосома может располагаться внутри фиброгранулярного материала, который не содержит F-актина.
В самом начале XX в. американский энтомолог Молсби Уилетт Блэкмэн, изучая сперматогенез некоторых многоножек, описал своеобразную ядерную структуру, которую назвал кариосферой (Blackman, 1903, 1905). Согласно современному определению, кариосфера – мейоз-специфическая и эволюционно консервативная структура, образованная конденсированными хромосомами, объединенными вместе в ограниченном пространстве крупного ядра на стадии диплотены профазы мейоза (Bogolyubov, 2018). Блэкмэн (Blackman, 1903) предложил различать кариосферу и кариосому; последняя представляет собой простой “клубок” хромосом, в то время как кариосфера организована более сложно, фактически представляя собой “миниатюрное ядро”.
У многих организмов хромосомы ооцита, собранные в кариосферу, дополнительно ограничены сложной многокомпонентной структурой, называемой капсулой кариосферы (КК), что создает еще большее впечатление о существовании “ядра в ядре” (Gruzova, 1988), или Innenkern по-немецки (Vejdovský, 1911–1912; цит. по: Gruzova, Parfenov, 1993). Термин “капсула” (Kapsel) был введен Вагнером (Wagner, 1923), чтобы различать волокнистую субстанцию, которая, как он считал, отделяет хромосомы от периферической области, занимаемой ядрышками в ядре ооцитов (зародышевом пузырьке, ЗП) лягушек. В настоящее время считают, что ключевым компонентом КК служат филаменты полимеризованного ядерного актина (F-актина), который играет главную структурную роль и может рассматриваться в качестве маркерного белка КК (Bogolyubov, 2018).
В течение многих лет после открытия Блэкмэна кариосферу описывали у многих организмов, от гидры до человека, особенно в ЗП и менее часто – в ядре сперматоцитов (Gruzova, Parfenov, 1993). Если в мужском мейозе хромосомы и формируют кариосферу (кариосому), она никогда не имеет КК.
Несмотря на большое морфологическое разнообразие кариосфер, наблюдаемых в ооцитах беспозвоночных и позвоночных животных, можно выделить 3 основных их типа (Bogolyubov, 2018): 1) кариосферу с внешней КК; 2) кариосому, т. е. кариосферу без КК, и 3) “инвертированную” кариосферу. Последнее из перечисленных понятий является весьма формальным, охватывая морфологически различные типы кариосфер, когда хромосомы присоединены к наружной стороне “центрального тела” (Gruzova, 1988), такого как центромерное белковое тело птиц (Гагинская, 1972; Krasikova et al., 2004) или атипичное ядрышко (ядрышкоподобное тело) мыши и человека (Parfenov et al., 1989; De La Fuente et al., 2004).
Если у какого-либо организма в течение определенного периода продолжительной диплотены существует стадия ламповых щеток (ЛЩ), кариосфера формируется после этой стадии, когда хромосомы-ЛЩ теряют латеральные петли, сокращаются и имеют тенденцию к локализации в ограниченном пространстве ЗП (Bogolyubov, 2018). Формирование кариосферы обычно сопровождается затуханием транскрипционной активности хромосом. У травяной лягушки R. temporaria полностью сформированная кариосфера, представляющая собой рыхлый клубок хромосом, сохраняет заметный уровень остаточной транскрипционной активности, в то время как позже, в более компактной кариосфере, транскрипция прекращается полностью (Ilicheva et al., 2018).
У многих амфибий, включая R. temporaria, конденсированные хромосомы, собранные в кариосферу, заключены в компактный агломерат размером примерно 150 мкм, сформированный многочисленными амплифицированными ядрышками и занимающий примерно 1/1000 объема ЗП (Duryee, 1950). На протяжении многих десятилетий считали, что кариосфера R. temporaria имеет типичную КК (Gruzova, Parfyonov, 1973; Gruzova, Parfenov, 1977, 1993; Почукалина, Парфенов, 1994; Bogolyubov, 2018) – сложную многослойную структуру, состоящую из фиброзного эластичного материала и амплифицированных ядрышек (Парфенов, 1995). Считают, что в вителлогенных ооцитах R. temporaria КК появляется вокруг ЛЩ в осеннее-зимний период и достигает максимального развития весной, перед овуляцией (Gruzova, Parfyonov, 1973), при этом хромосомы прикреплены к КК теломерами (Парфенов, 1995).
Постоянно сообщалось, что КК весьма стабильная структура и может быть легко изолирована из ЗП R. temporaria GVs, сохраняя целостность после обработок концентрированными растворами солей (1.5 M NaCl), неионными детергентами и нуклеазами (Engelhardt et al., 1982). Это позволило считать КК специализированным компонентом ядерного матрикса (Gruzova, Parfenov, 1993). Однако противоречивая теория ядерного матрикса, популярная в конце XX в., в настоящее время признана несостоятельной (Razin et al., 2014). Относительная устойчивость кариосферного комплекса, по-видимому, обеспечивается огромным количеством амплифицированных ядрышек, окутывающих кариосферу лягушки наподобие массивного облака, которое, по-видимому, стабилизируется сетью актиновых филаментов (Parfenov et al., 1995). Однако такие скопления, изолированные в физиологических растворах, довольно быстро рассыпаются на отдельные ядрышки.
В этом году мы начали работу над исследовательским проектом, посвященным дальнейшему исследованию кариосферы R. temporaria, надеясь в первую очередь проверить, может ли КК участвовать в мейоз-специфической пространственной организации диплотенных хромосом. В частности, мы собирались исследовать, могут ли некоторые ключевые белки, обеспечивающие динамические взаимодействия хромосом с ядерной оболочкой (ЯО) в митотическом цикле соматических клеток (Foisner, 2003; Segurra-Totten, Wilson, 2004), участвовать в формировании и поддержании КК.
Начиная работу над проектом, мы сначала предприняли ультраструктурное исследование, в том числе с помощью иммуноэлектронной микроскопии (ИЭМ), чтобы ответить на вопросы: 1) формируют ли актиновые филаменты КК? 2) являются ли другие структурные белки, такие как ядерные ламины, компонентами КК? 3) действительно ли характерные annuli в КК R. temporaria, демонстрирующие морфологическое сходство с ядерными поровыми комплексами (ЯПК), являются “автономными” поровыми комплексами, принимая во внимание возможность неканонического механизма их образования в ооплазме Drosophila (Hampoelz et al., 2019)?
Мы ожидали, что ответы на эти вопросы могут служить морфологической основой дальнейших исследований. Однако в ЗП весенних лягушек мы к своему удивлению обнаружили отсутствие заметной капсулы Вагнера (Wagner, 1923). Вместо этого ядро заполнено сетью актиновых филаментов, которые заметным образом не концентрируются в области, содержащей хромосомы, как и в ЗП Xenopus (Kiseleva et al., 2004; Maslova, Krasikova, 2012). Эта сеть, очевидно, придает структурную стабильность скоплению ядрышек с находящейся внутри кариосомой (Il-icheva et al., 2019), однако F-актин не концентрируется в структуре, напоминающей КК. Сходное поведение демонстрируют филаменты, содержащие ламин B, которые тоже там не концентрируются. Кроме того, мы не подтвердили, что annuli – это аналоги ЯПК, поскольку они не содержат, по крайней мере, нуклеопорина Nup35.
Эти и другие морфологические особенности, заставляющие пересмотреть классические представления о КК в ооцитах травяной лягушки, обсуждаются в свете представлений о кариосфере амфибий, накопленных с середины XIX в. (Schultze, 1887) до наших дней. С целью дополнительного обсуждения мы также представили данные по структуре кариосферы двух видов жуков-чернотелок (Tenebrionidae): Tribolium castaneum, у которого кариосфера имеет типичную КК, и Tenebrio molitor, у которого кариосфера (кариосома) не имеет типичной КК, содержащей F-актин.
МАТЕРИАЛ И МЕТОДИКА
Самок травяной лягушки Rana temporaria L. в возрасте 2–3 г отбирали из естественной среды обитания в окрестностях Санкт-Петербурга в апреле месяце. Лягушек декапитировали и немедленно разрушали спинной мозг. Яичники и ооциты изолировали в среде OR2 (Wallace et al., 1973), содержащей 82.5 мM NaCl, 2.5 мM KCl, 1.0 мM CaCl2, 1.0 мM MgCl2, 1.0 мM Na2HPO4, 5.0 мM HEPES, pH ~7.8. ЗП изолировали в растворе “5 : 1 + PO4” (Gall et al., 1981), содержащем 83.0 мM KCl, 17.0 мM NaCl, 6.5 мM Na2HPO4, 3.5 мM KH2PO4, 1.0 мM MgCl2, 1.0 мM DTT, pH 7.2. Яичники насекомого Tribolium castaneum (Herbst) изолировали в растворе для Drosophila (128.3 мM NaCl, 4.7 мM KCl, 1.9 мM CaCl2).
Для выявления F-актина образцы, фиксированные в 2%-ном формальдегиде на PBS, окрашивали фаллоидин-родамином (2 мкг/мл) в течение 1 ч во влажной камере при комнатной температуре, отмывали в PBS и заключали в среду Vectashield (Vector Laboratories), содержащую 1 мкг/мл DAPI для выявления ДНК. Препараты просматривали в конфокальном микроскопе Leica TCS SP5.
Для стандартной трансмиссионной ЭМ образцы фиксировали 2.5%-ным глутаральдегидом, затем 1.0%-ным OsO4 и заключали в Epon–Araldite. Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца. Для ИЭМ образцы префиксировали в течение 2 ч в 4%-ном формальдегиде, свежеприготовленном из параформальдегида, и 0.5%-ном глутаральдегиде на PBS, затем фиксировали в 2%‑ном формальдегиде при 4°C в течение ночи. После промывки в PBS, содержащем 0.05 M NH4Cl, и дегидратации в серии спиртов возрастающей концентрации образцы заключали в смолу LR White. Ультратонкие срезы инкубировали в течение 10 мин в блокирующем буферном растворе (PBS с добавлением 0.5% желатина из кожи холодноводных рыб (Sigma) и 0.02% Tween-20, pH 7.4). После этого срезы инкубировали в растворе первичных антител во влажной камере в течение ночи при 4°C. Использованные первичные антитела: мышиные моноклональные антитела к двухцепочечной ДНК (Hemicon, MAB 030, разведение от 1 : 200 до 1 : 300), козьи поликлональные антитела к Nup35 (Santa Cruz, sc-74762, разведение от 1 : 20 до 1 : 50), мышиные моноклональные антитела к Nup93 (Santa Cruz sc-374399, разведение 1 : 20)11, козьи поликлональные антитела к ламину B (Santa Cruz, sc-6217, разведение от 1: 20 до 1 : 50) и кроличьи поликлональные антитела к N-концу молекулы актина (Sigma, A2103, разведение 1 : 20–1 : 50). После отмывки в PBS, содержащем 0.1% желатина и 0.02% Tween-20, срезы инкубировали в растворе вторичных антител (козьих к иммуноглобулинам кролика, ослиных к иммуноглобулинам кролика или козьих к иммуноглобулинам кролика), конъюгированных с частицами коллоидного золота размером 10 нм, во влажной камере в течение 1.5 ч при комнатной температуре. Срезы контрастировали уранилацетатом и исследовали с помощью электронного микроскопа Leica 120 при 80 кВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данное исследование посвящено ультраструктурному анализу кариосферы в ЗП травяной лягушки Rana temporaria с особым вниманием к КК, которая, по идее, должна формироваться в поздних вителлогенных ооцитах. Несмотря на целый век, прошедший с первого подробного описания КС этого вида (Wagner, 1923), после чего последовали электронно-микроскопические (Gruzova, Parfenov, 1977; Почукалина, Парфенов, 1994), биохимические (Engelhardt et al., 1982; Podgornaya et al., 2000) и иммунофлуоресцентные исследования (Ильичева и др., 2016; Ilicheva et al., 2018, 2019), мы представляем новые данные, полученные с помощью электронной и иммуноэлектронной микроскопии, которые заставляют усомниться в существовании КК как специализированного ядерного компартмента ЗП R. temporaria (Gruzova, Parfenov, 1993). В то же время обширная КК, в высокой степени обогащенная F-актином, формируется в ЗП других организмов, например модельного насекомого Tribolium castaneum.
Кариосфера в зародышевом пузырьке травяной лягушки. В своей работе мы не обнаружили каких-то значимых структурных особенностей ЗП R. temporaria по сравнению с теми, которые были ранее описаны у зимующих и пробуждающихся лягушек этого вида (Gruzova, Parfyonov, 1973; Gruzova, Parfenov, 1977). ЗП лягушек, собранных в естественных местообитаниях в апреле месяце, содержит развитую кариосферу в виде более или менее компактного клубка хромосом, собранных вместе в ограниченном объеме ядра, что соответствуют стадии, завершающей стадию ЛЩ. Кариосфера расположена внутри большого (более 150 мкм) компактного скопления сотен амплифицированных ядрышек и занимает в нем центральное положение (рис. 1a). Область, содержащая хромосомы, выглядит на срезах прозрачной, поскольку в значительной степени лишена ядрышек. О формировании подобного рода скопления ядрышек в центре ЗП амфибий постоянно сообщали, начиная с конца XIX в.22 (Schultze, 1887; Born, 1894; Carnoy, Lebrun, 1898; Wagner, 1923; Duryee, 1950), и уже ранние цитологии наблюдали в центре этого скопления почти лишенное ядрышек пространство с расположенными в нем хромосомами (рис. 1б–д, ж).
Рис. 1.
Морфологические особенности кариосферы амфибий. a – Полутонкий срез ядра ооцита Rana temporaria на стадии компактной кариосферы (стрелка), которая локализована в центре скопления амплифицированных ядрышек; окраска метиленовым синим. б–д, ж – Исторические рисунки скоплений ядрышек с расположенными внутри хромосомами (кариосферой) в ооцитах различных амфибий по данным Шульце (Schultze, 1887 – б), Карнуа и Леблона (Carnoy, Leblond, 1898 – в–г), Дюрьи (Duryee, 1950 – д) и Вагнера (Wagner, 1923 – ж); стрелки на фрагменте д указывают капсулу Вагнера; Biodiversity Heritage Library (https://www.biodiversitylibrary.org/), в свободном доступе согласно лицензии CC0 1.0 Public Domain Dedication. е, з – Ранняя (е) и поздняя (з) кариосфера R. temporaria, соответствующие стадии 6 по Дюрьи (Duryee, 1950 – д) и хромосомному узлу (Chromosomenknäuel) по Вагнеру (Wagner, 1923 – ж); окраска DAPI. и – Кариосфера R. temporaria при малом увеличении электронного микроскопа, заметно отсутствие капсулы; хр – хромосомы, яш – ядрышко. к – Хромосома ооцита R. temporaria на стадии кариосферы после иммуноэлектронного мечения антителами к двухцепочечной ДНК (частицы размером 10 нм).
В середине XX в. американский цитолог Уильям Дюрьи предложил периодизацию стадий роста ЗП R. temporaria, уделяя особое внимание структуре диплотенных хромосом (Duryee, 1950). Наиболее поздняя стадия, представленная в этой работе (стадия 6) соответствует полностью развитой кариосфере (кариосоме), представляющей собой поздние ЛЩ, собранные в центре скопления ядрышек (рис. 1д–е) – “хромосомном каркасе” (chromosomal frame). В этой важной работе Дюрьи не проиллюстрировал более поздние стадии развития кариосферы, следующие за стадией 6, на которых хромосомы, утратившие структуру ЛЩ, представляли бы собой более или менее компактный клубок, описанный ранее Вагнером (Wagner,1923) (рис. 1ж–з)33. В нашем материале присутствовали ЗП с обеими конфигурациями кариосферы (рис. 1е, з).
Немецкий зоолог Карл Вагнер был первым, кто предложил термин “капсула” (Kapsel) в работе, посвященной развитию ооцитов лягушек, включая R. temporaria, в которой акцент был сделан на особенностях сезона и возрастных особенностях размножения лягушек (Wagner, 1923). Он отметил, что ранней весной, во время формирования хромосомного клубка (Chromosomenknäuel), известного теперь как кариосфера, вокруг поздних ЛЩ обнаруживается фиброзная субстанция (faserigen Substanz), окрашивающаяся кислыми красителями (рис. 1ж). Согласно Вагнеру (Wagner, 1923), “фибриллы” (Fasern) этой субстанции (капсулы) наиболее хорошо заметны после фиксации по Жильсону с последующим окрашиванием железным гематоксилином Хайденгайна (Heidenhain’s iron hematoxylin), но не детектируются после окрашивания гематоксилином Делафильда.
Капсула Вагнера (капсула кариосферы, КК), окружающая поздние ЛЩ, собранные в кариосферу, была также изображена в работе Дюрьи (Duryee, 1950) (рис. 1д, стрелки). Он отмечал, что кариосфера “окружена более плотной субстанцией”, так что хромосомы, расположенные в “центральном облаке ядрышек”, встроены в “гель”, физически изолирующий их “внутри хромосомного каркаса”. Однако фотографии нефиксированных ЗП, представленные в работе, включая “изолированные центральные ядрышки и хромосомный каркас”, не позволяют различить какие-либо детали структуры КК.
Хромосомы ооцитов травяной лягушки, собранные в кариосферу, демонстрируют довольно рыхлую ультраструктуру даже на финальных этапах диплотены, в поздних вителлогенных ооцитах (рис. 1и–к). Использование антител к ДНК (рис. 1к) позволяет отличить хромосомы от, например, структур, возникающих в результате слияния ядрышек (не показано). Кроме того, на ультраструктурном уровне вокруг хромосом мы не наблюдали заметного “каркаса” или фиброзной структуры, которую можно было бы трактовать как капсулу Вагнера. Особенно убедительно это видно при малом увеличении электронного микроскопа (рис. 1и). Эти данные противоречат более ранним наблюдениям Почукалиной и Парфенова (1994), которые на полутонких срезах показывали присутствие грубых тяжей, интерпретированных как филаментозная КК R. temporaria.
О так называемых “псевдомембранах”. Согласно ранним ЭМ-наблюдениям (Gruzova, Parfenov, 1977), собранные в кариосферу хромосомы ооцитов R. temporaria ассоциированы с филаментозным материалом, главные морфологические элементы которого названы псевдомембранами44. Эти характерные образования представляют ряды структур (annuli), морфологически напоминающие “автономные” поровые комплексы (ЯПК), связанные фибриллярным материалом; в результате формируются электронно-плотные тяжи55. Авторы считали, что они наблюдают на ультраструктурном уровне капсулу Вагнера. Подобные тяжи были также описаны в составе КК комаров (Fiil, Moens 1973; Fiil, 1974, 1976).
В нашем материале мы наблюдали все эти экстрахромосомные образования ЗП R. temporaria (тяжи и annuli), описанные ранее (Gruzova, Parfenov, 1977), включая расположенные в непосредственной близости от хромосом и ядрышек (рис. 2а–б). Кроме того, мы наблюдали внутриядерные мембранные структуры, такие как внутриядерные пузырьки, трубчатые конструкции и внутриядерные пористые пластинки (intranuclear annulata lamellae) (Парфенов, 1995), в том числе на периферии участков ЗП R. temporaria, содержащих кариосферу (не показано). Обнаружено, что вышеупомянутые электронно-плотные искривленные тяжи занимают весьма ограниченные участки в ЗП. Как показал анализ серийных срезов, этот материал никогда не формирует что-либо напоминающее капсулу66.
Рис. 2.
Ультраструктурные особенности кариосферы Rana temporaria. a – Грубофибриллярный материал (стрелки), локализованный в области, содержащей хромосомы (хр). б – Электронно-плотные тяжи (стрелки), ассоциированные с тонкофибриллярным материалом; яш – фрагмент ядрышка. в – Срез, проходящий через тяжи, на котором видны “колечки” (annuli) (головки стрелок). г – Продольный срез через ядерную оболочку (ЯО), демонстрирующий морфологическое сходство между ядерными поровыми комплексами (головки стрелок) и “колечками”, показанными на (в); Я и Ц – соответственно ядерная и цитоплазматическая стороны.

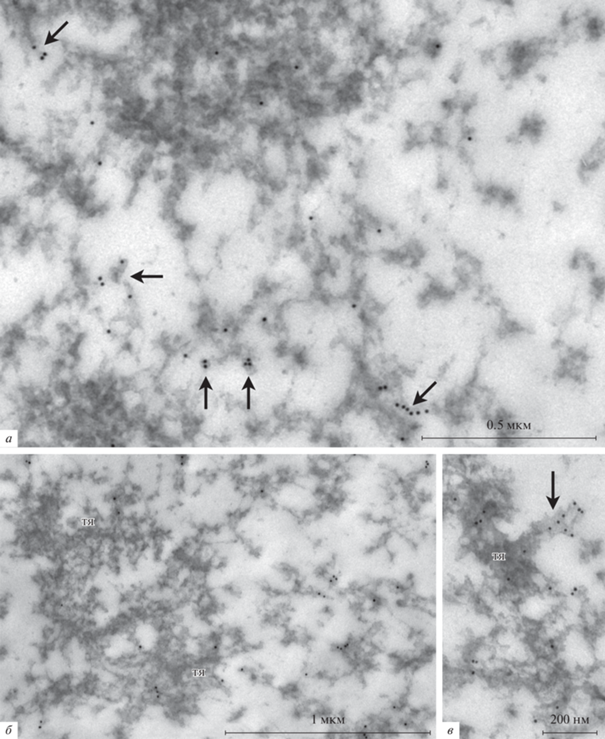
Характерные annuli в этом материале (рис. 2в), по нашему мнению, хотя они морфологически напоминают ЯПК (Gruzova, Parfenov, 1977) (рис. 2г), нельзя считать аналогами ЯПК, поскольку большинство их них не содержит нуклеопорина Nup35 – ключевого белка ЯПК, что отчетливо видно при помощи ИЭМ (рис. 3, головки стрелок; рис. 4a). ИЭМ-мечение ядерной оболочки (ЯО) служило в качестве позитивного контроля (рис. 4б).
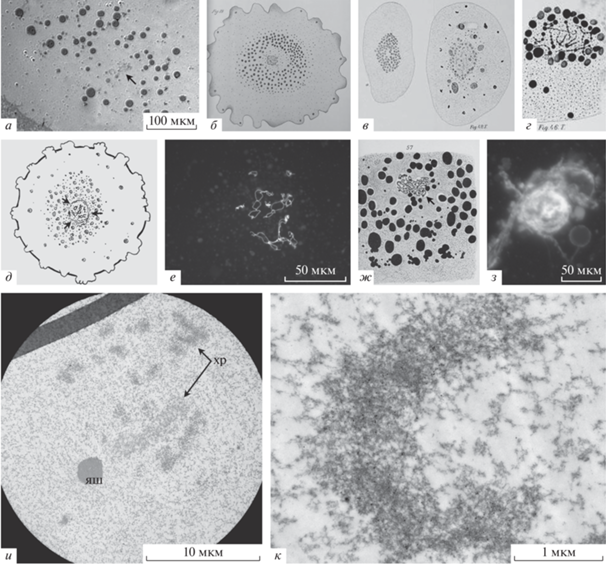
Рис. 3.
Фибриллярные тяжи кариосферы Rana temporaria после ультраструктурного иммуномечения антителами к нуклеопорину Nup35. Подавляющее большинство annuli (головки стрелок) не мечены и, следовательно, не могут рассматриваться в качестве “автономных поровых комплексов”.
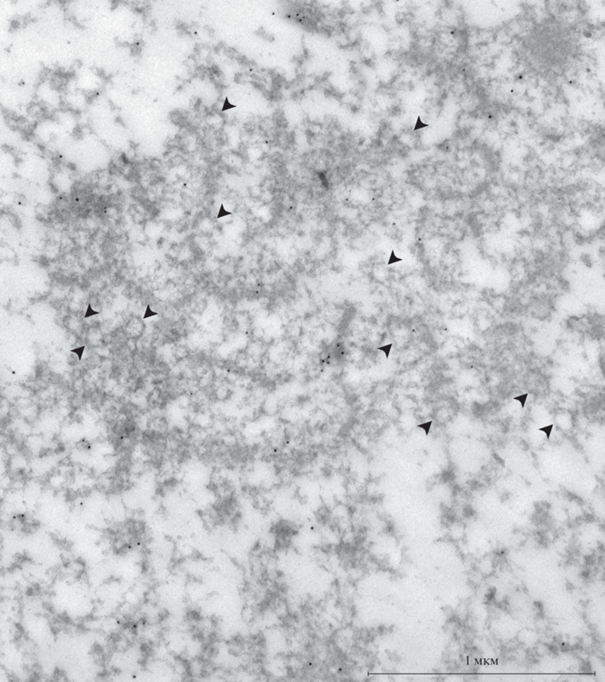
Рис. 4.
Особенности распределения Nup35 в ядре ооцита Rana temporaria по данным иммуноэлектронной микроскопии. (a) Нуклеопорин Nup35 накапливается в заметных биомолекулярных конденсатах (стрелки), но не в тяжах (тя). (б) Срез через ядерную оболочку (ЯО), использованный в качестве контроля мечения антителами к Nup35; Я и Ц – соответственно ядерная и цитоплазматическая стороны.
В то же самое время довольно много метки обнаруживается над материалом экстрахромосомных тяжей, расположенных в центральной, кариосферосодержащей области ЗП. Кроме того, посреди этого материала обнаруживаются заметные биомолекулярные конденсаты, интенсивно меченные антителами к Nup35 (рис. 4a, стрелки). Известно, что внутренне неупорядоченные (intrinsically disordered) нуклеопорины, богатые остатками фенилаланина и глицина (FG-Nups), способны к фазовому разделению (Nag et al., 2022), что является фундаментальным процессом, лежащим в основе формирования биомолекулярных конденсатов (Banani et al., 2017). Nup35 не является FG-нуклеопорином, но некоторые такие нуклеопорины (non-FG-Nups), включая Nup35, взаимодействуют с определенным набором FG-Nups и усиливают взаимодействия с другими FG-Nups в ходе самосборки нуклеопориновых частиц (Konishi, Yoshimura, 2020). Это может приводить к формированию крупных биомолекулярных конденсатов, принимая во внимание возможный избыток нуклеопоринов в ЗП.
Наши наблюдения показывают, что Nup35 и, возможно, другие нуклеопорины, несомненно, присутствуют в кариосферосодержащем участке ЗП R. temporaria, что ранее было показано с помощью иммунофлуоресцентной микроскопии (Ilicheva et al., 2018). Однако пока остается неясным вопрос, имеют ли annuli и ЯПК какие-либо общие признаки, кроме морфологических.
В соматических клетках Nup35 необходим для сборки ЯО, но напрямую не участвует в ее ассоциации с хромосомами. Однако он взаимодействует с другими нуклеопоринами, включая хроматинсвязывающий Nup93, с которым образует стабильные комплексы (Ródenas et al., 2009). В свою очередь Nup93, участвуя в связывании хроматина с ЯО, вовлечен в эпигенетическое подавление некоторых генов (Labade et al., 2016). В частности, взаимодействия Nup93 с хроматином влияют на экспрессию генов, связанных с ремоделированием актинового цитоскелета (Bersini et al., 2020). К сожалению, пока мы не можем установить, является ли Nup93 компонентом тяжей и (или) annuli, поскольку антитела к нему продемонстрировали низкую эффективность на ультраструктурном уровне, несмотря на то, что Nup93 был выявлен в центральной части ЗП R. temporaria с помощью иммунофлуоресцентной микроскопии (Ilicheva et al., 2018).
Принимая во внимание, что Nup35 взаимодействует с ламинами типа B (Ródenas et al., 2009), что ламин III (ламин B3 амфибий) в большом количестве присутствует в кариосферосодержащей части ЗП R. temporaria (Парфенов, 1995) и что антитела к ламинам A/C и B на иммунофлуоресцентном уровне метят участки ЗП в области кариосферы (Ильичева и др., 2016; Ilicheva et al., 2018), мы проверили, являются ли ламины компонентами тяжей, связанных с annu-li.
К сожалению, имевшиеся в нашем распоряжения антитела к ламинам A/C млекопитающих не метили ЯО на ЭМ-уровне (не показано) и в дальнейшем не использовались. Однако антитела к ламину B, ранее успешно протестированные на материале эволюционно далеких друг от друга организмов, например насекомых (Bogolyubov et al., 2013), метили фибриллярный материал в ЗП лягушки (Fig. 5), но не тяжи, связывающие annuli (рис. 6a). В ЗП, в том числе вблизи тяжей, часто наблюдали заметные биомолекулярные конденсаты, интенсивно меченные антителами к ламину B (рис. 6б).
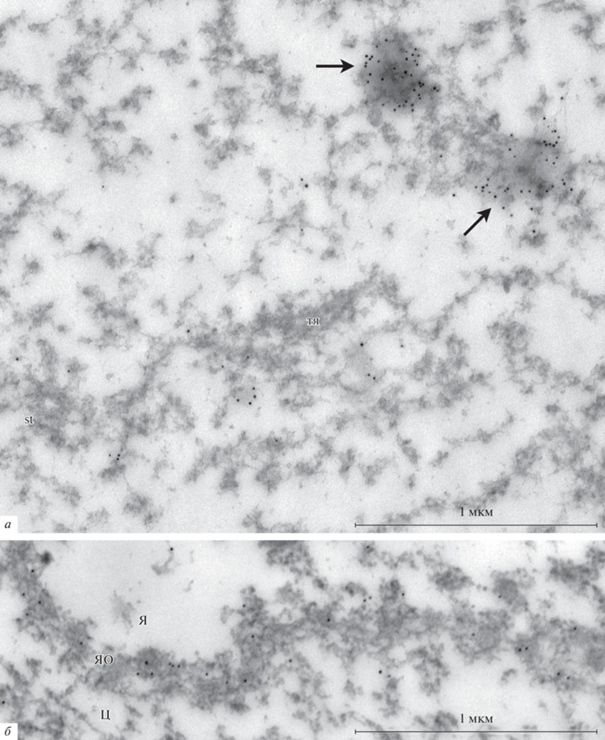
Рис. 5.
Ультраструктурное иммуномечение антителами к ламину B, демонстрирующее присутствие ламинсодержащего фибриллярного материала (стрелки) в ядре ооцита Rana temporaria.

Рис. 6.
Особенности распределения ламина B в ядре ооцита Rana temporaria. a – Характерные тяжи (тя) в кариосферосодержащей части ядра полностью лишены меток, в то время как белок, выявляемый антителами к ламину B, выявляется в аморфных локальных областях (стрелка). б – Срез через ядерную оболочку (ЯО), использованный в качестве контроля мечения антителами к ламину B; Я и Ц – соответственно ядерная и цитоплазматическая стороны.
F-актин – ключевой структурный белок зародышевого пузырька. Наконец мы проверили, связан ли ядерный актин с филаментозным материалом ЗП R. temporaria и можно ли считать F-актин главным компонентом КК. Давно известно, что актин – наиболее распространенный белок ЗП амфибий, количество которого составляет примерно 6% от общего количества белков в ЗП Xenopus в концентрации более чем 2 мг/мл (Clark, Merriam, 1977; Clark, Rosenbaum, 1979). Такое высокое значение превышает критическую концентрацию, необходимую для полимеризации актина, что приводит к быстрому гелеобразованию при нарушениях целостности ЗП (Gall, 2006).
В ЗП Xenopus полимерный актин составляет примерно 37% или даже больше от общего количества ядерного актина (Clark, Merriam, 1979); таким образом, F-актин – превалирующая форма актина в ЗП (Bohnsack et al., 2006). Установлено (Bohnsack et al., 2006), что столь значительное накопление F-актина в ЗП X. laevis достигается за счет отсутствия экспортина-6 – специфического фактора экспорта ядерного актина (Stüven et al., 2003). В ЗП амфибий и птиц F-актин легко выявляется с помощью обычного окрашивания флуоресцентно меченым фаллоидином (Морозова, Киселева, 2008; Maslova, Krasikova, 2012; Ilicheva et al., 2019).
В ЗП X. laevis на ультраструктурном уровне ядерный F-актин формирует сеть, состоящую из пучков и разветвленных филаментов толщиной примерно 12–100 нм (в среднем примерно 40 нм), которая простирается от ЯПК через всe ядро. Это отчетливо показано с помощью сканирующей ЭМ с использованием эмиссии под действием электрического поля (полевой эмиссии) – field emission scanning EM (Kiseleva et al., 2004). Считают, что сеть F-актина играет архитектурную роль и заякоривает органеллы, такие как тельца гистоновых локусов77, спеклы (кластеры интерхроматиновых гранул) и ядрышки, а также, возможно, участвует в координации ядерно-цитоплазматических взаимоотношений и транспорте ядерных компонентов (Kiseleva et al., 2004).
Советско-российский клеточный биолог и эмбриолог Владимир Николаевич Парфенов и его коллеги были одними из первых, кто подтвердил наличие микрофиламентов и пучков полимерного актина в ЗП R. temporaria, в том числе на ультраструктурном уровне (Parfenov et al., 1995). Ими показано, что в поздних ооцитах короткие фрагменты пучков F-актина обнаруживаются в центральной части ЗП, в основном в ассоциации с ядрышками. Хотя в этой работе не упоминаются ни кариосфера, ни КК, с этого времени утвердилась точка зрения о том, что F-актин является одним из главных компонентов КК R. temporaria (Ильичева и др., 2016; Bogolyubov, 2018; Ilicheva et al., 2018, 2019).
С помощью стандартной ЭМ мы подтвердили, что ЗП R. temporaria заполнен обширной сетью филаментов, некоторые из которых тесно ассоциированы с хромосомами (рис. 7a) и ядрышками (рис. 7б). ЗП R. temporaria интенсивно окрашивается фаллоидин-родамином, однако это окрашивание довольно равномерное, в том числе в перинуклеолярных областях и участке, содержащем кариосферу (рис. 8). Мы пока не можем объяснить грубое окрашивание фаллоидин-родамином области, содержащей кариосферу, и выявление заметных F-актиновых “колец” вокруг ядрышек, о чем сообщалось ранее в результате иммунофлуоресцентных исследований (Ilicheva et al., 2018, 2019) и что было интерпретировано как выявление КК R. temporaria. В нашем материале мы никогда не наблюдали подобных картин. После окрашивания фаллоидин-родамином и обработки антителами к актину заметные тяжи F-актина не выявляются на световом уровне, что напоминает характер окрашивания ЗП X. laevis (Морозова, Киселева, 2008; Maslova, Krasikova, 2012). По нашему мнению, распределение F-актина в ЗП R. temporaria существенно не отличается от такового в ЗП шпорцевой лягушки, у которой слабо выражена кариосфера.
Рис. 7.
Ядерные филаменты (стрелки) в ассоциации с хромосомой (a) и ядрышком (б), выявляемые с помощью стандартной трансмиссионной электронной микроскопии. хр – хроматин, яш – ядрышко.
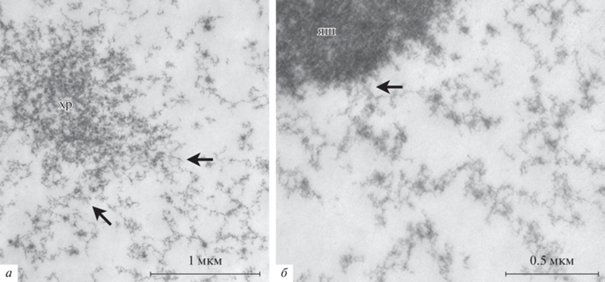
Рис. 8.
Окрашивание ядра ооцита Rana temporaria родамин-фаллоидином для выявления F-актина (красный цвет) и DAPI (синий цвет); конфокальная микроскопия, максимальная проекция.

Ультраструктурное (ИЭМ) исследование показало, что антитела к актину действительно выявляют филаментозную сеть в ЗП R. temporaria, подтверждая присутствие в нем филаментов актина (рис. 9a). Эти филаменты заполняют нуклеоплазму, но не концентрируются ни в кариосферосодержащей области, ни вокруг ядрышек. Во всяком случае, вышеупомянутые тяжи, “претендующие” на роль элементов КК, не содержат актина, а антитела к актину маркируют ассоциированный фибриллярный материал, но не сами тяжи (рис. 9б). В то же время некоторое количество актинсодержащего материала находится в физической ассоциации с этими тяжами (рис. 9в).
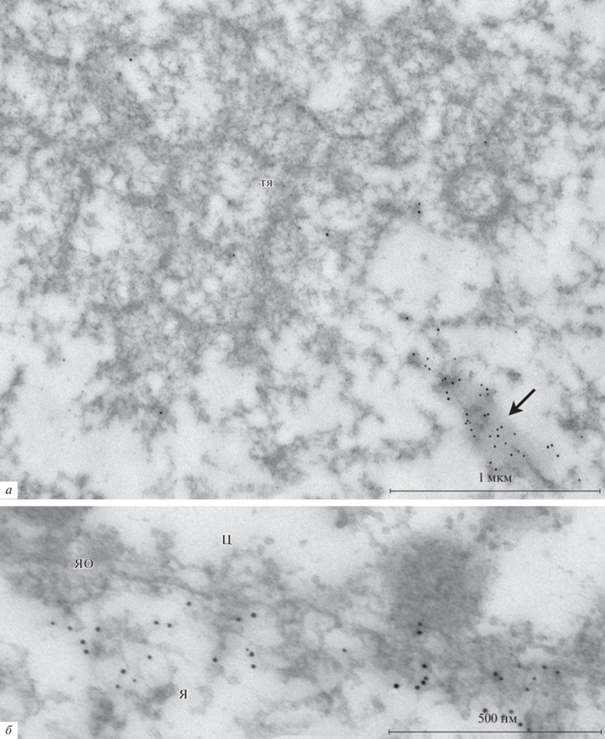
Рис. 9.
Иммуноэлектронное мечение ядра ооцита Rana temporaria антителами к N-концу молекулы актина. a – Актиновые филаменты (стрелки) в участке ядра, содержащем кариосферу. б – Тяжи (тя) не содержат актина. в – Фрагмент актинового пучка (стрелка), находящегося в физической ассоциации с тяжом (тя).
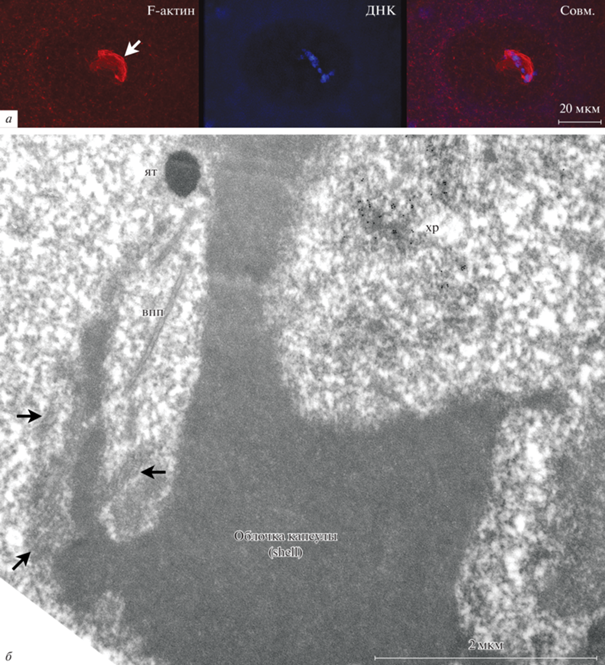
Следует подчеркнуть, что за пределами амфибий, а именно у насекомых, ядерный F-актин действительно может рассматриваться в качестве маркерного белка КК (Bogolyubov, 2018) – конечно, у тех видов, у которых развивается надструктурный комплекс “кариосфера–КК”. Наиболее впечатляющим примером служит ЗП некоторых сетчатокрылых (Rübsam, Büning, 2001) и некоторых жуков (Świątek, 1999; Bogolyubov, 2018), у которых КК интенсивно и избирательно окрашивается с помощью флуоресцентно меченого фаллоидина. В ЗП булавоусого мучного хрущака Tribolium castaneum F-актин формирует обширный “кожух” (рис. 10a), который также хорошо виден на ультраструктурном уровне как электронно-плотная оболочка (shell) кариосферы (рис. 10б). У T. castaneum эта “оболочка” часто ассоциирована с тяжами, которые, в отличие от тяжей в кариосферосодержащей области ЗП R. temporaria, содержат ламин B (Bogolyubov et al., 2013).
Рис. 10.
Кариосфера в ядре ооцита булавоусого мучного хрущака Tribolium castaneum, представленная здесь для демонстрации существенных различий в ее строении по сравнению с кариосферой лягушки. a – Окраска родамин-фаллоидином (красный цвет), демонстрирующая присутствие типичной капсулы кариосферы, богатой F-актином (стрелка), ДНК (собственно кариосфера) окрашена DAPI (синий цвет); конфокальная микроскопия, максимальная проекция. б – Ультраструктура капсулы кариосферы T. castaneum; стрелки указывают актиновые филаменты (Bogolyubov et al., 2013), ассоциированные с мощно развитой стенкой (shell) капсулы, окружающей хроматин (хр), иммуноэлектронное мечение антителами к ДНК; ят – ядерное тельце (кластер интерхроматиновых гранул), впп – внутриядерные пористые пластинки (intranuclear annulata lamella).
Что актин, особенно F-актин, делает в ядре? Времена, когда само существование актина в ядре вызывало изрядную долю скептицизма, закончились более чем 20 лет тому назад, породив бурно развивающуюся область исследований (Pederson, Aebi, 2002, 2005; Pederson, 2008). Теперь нет уже никаких сомнений, что актин в ядре выполняет множество функций и, помимо всего прочего, широко вовлечен в регуляцию экспрессии генов и поддержание целостности генома (Visa, Percipalle, 2010; Kyheröinen, Vartiainen, 2020), что напрямую связано с оогенезом и формированием кариосферы. Ядерный актин также важен в процессах определения судьбы клеток в ходе дифференцировки тканей, а также эмбрионального развития (Kloc et al., 2021).
Актин в ядре входит в состав хроматинремоделирующих комплексов и связан со всеми тремя РНК-полимеразами, а также РНП-комплексами процессинга и экспорта мРНК; при этом ядерный F-актин также обладает специфическими функциями (Gieni, Hendzel, 2009), участвуя, например, в репарации разрывов двухцепочечной ДНК и в ответе на репликационный стресс (Lamm et al., 2020). Нарушения функций ядерного актина, в том числе в результате нарушений его полимеризации/деполимеризации, имеют отношение к этиологии многих заболеваний человека, включая рак (Hyrskyluoto, Vartiainen, 2020) и ламинопатии (Bera, Sengupta, 2020). В последнем случае нарушения взаимодействия ядерного актина (и миозина) с ламиновой сетью, поврежденной в результате мутаций LMNA, но в норме обеспечивающей механическую жесткость хромосом, нарушают хромосомный ландшафт и экспрессию генов.
Специфические ядерные функции полимеров актина особенно важны для ооцитов, в которых полимеризация актина играет ключевую роль в сегрегации хромосом (Dunkley et al., 2022). Однако фундаментальные механизмы функционирования мономерного актина и актиновых филаментов в ядре все еще недостаточно изучены и служат предметом дискуссий (Ulferts et al., 2021).
Механизмы, посредством которых F-актин вовлечен в формирование кариосферы и ее капсулы, также еще предстоит расшифровать. Не вызывает, однако, сомнений тот факт, что актинсодержащие филаменты являются важнейшими компонентами ЗП (Морозова, Киселева, 2008). Эксперименты с агентами, деполимеризующими актин, такими как латрункулин и цитохалазин D, убедительно доказывают ключевую роль F-актина в поддержании структурной целостности надмолекулярных комплексов ЗП. У шпорцевой лягушки X. laevis, у которой хромосомы не формируют выраженную кариосферу, разрушение актиновых филаментов приводит к коллапсу хромосом и их “слипанию” в компактную кариосомоподобную массу (Maslova, Krasikova, 2012).
В качестве необходимого уточнения стоит отметить, что в конце диплотены хромосомы ооцита X. laevis “короткие и ретрагированные” (short and retracted) и вместе с амплифицированными ядрышками “формируют массу в центре ядра” (Dumont, 1972). С формальной точки зрения это описание соответствует описанию кариосферы, однако, как показано на рис. 16 в статье Дюмона (Dumont, 1972), на этой стадии хромосомы ооцита Xenopus не образуют компактного клубка. Вокруг хромосом не наблюдается филаментозного материла, который мог бы рассматриваться в качестве КК. Довольно странно, что заключительные стадии роста ооцита у такого распространенного модельного организма, которым является X. laevis, до сих пор исследованы недостаточно, а подавляющее большинство исследований касается предшествующих стадий хромосом-ЛЩ.
В ЗП R. temporaria, в котором уже сформирована более или менее компактная кариосфера, воздействие цитохалазином D существенно не влияет на хромосомы и транскрипцию, приводя лишь к некоторому сжатию кариосферы (Ilicheva et al., 2019). При этом цитохалазин D полностью разрушает окружающее скопление ядрышек, что приводит к их слиянию в единую гигантскую каплю. Авторы полагают, что в этом случае цитохалазин D разрушает КК. Однако на самом деле мы имеем дело с разрушением всей сети актиновых филаментов в ЗП.
Заключающие уточнения. Считают, что кариосфера и ее капсула – специализированные ядерные структуры ооцитов, участвующие в создании специфической структурно-функциональной компартментализации ЗП (Gruzova, Parfenov, 1993; Bogolyubov, 2018). Наши наблюдения над ЗП R. temporaria показали, что кариосфера (хромосомный аппарат вителлогенных ооцитов) травяной лягушки представляет собой простой клубок хромосом, что полностью соответствует оригинальному определению кариосомы (Blackman, 1903). В то же время мы не подтвердили присутствия вокруг этого “хромосомного клубка” заметной фиброзной капсулы Вагнера (Wagner, 1923), в то время как в ЗП других организмов, особенно насекомых, подобного рода КК действительно существует. Центральные скопления ядрышек, характерные для ЗП различных амфибий, по нашему мнению, не могут считаться настоящими КК, поскольку они образованы отдельными жидкими каплями (ядрышками), которые отделены друг от друга и в нормальных условиях не сливаются в единую массу, хотя картины слияния отдельных ядрышек в ЗП R. temporaria наблюдаются довольно часто.
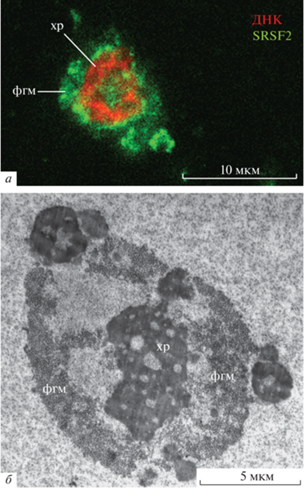
Присутствие экстрахромосомного материала, который иногда охватывает хромосомы, собранные в кариосому, продемонстрировано, например, в ЗП большого мучного хрущака Tenebrio molitor. Этот фиброгранулярный материал, в частности, содержит избыток РНК-полимеразы II, факторов сплайсинга пре-мРНК и другие молекулярные компоненты, не участвующие в синтезе/процессинге РНК в транскрипционно инертных поздних ооцитах (Bogolyubov, Parfenov, 2008) (рис. 11). Однако этот материал, по-видимому, лишен структурных белков, таких как F-актин, и потому не может считаться КК.
Рис. 11.
Кариосфера в ядре ооцита большого мучного хрущака Tenebrio molitor. a – Иммунофлуоресцентное окрашивание с помощью антител к фактору сплайсинга пре-мРНК SRSF2 (зеленый цвет), которые локализован в фиброгранулярном материале (фгм), окружающем хроматин (хр), ДНК (красный цвет) окрашена TO-PRO-3. б – Фиброгранулярный материал окружает хроматин, но оболочка (shell) или филаментозные тяжи, напоминающие капсулу кариосферы у другого жука-тенебриониды Tribolium castaneum (рис. 10), отсутствуют (Боголюбов и др., 2012, с изменениями).
КК насекомых не является полностью замкнутым барьером, изолирующим кариосферу, и отдельные фрагменты конденсированного хроматина могут находиться за ее пределами, по крайней мере, на некоторых стадиях роста ооцита сетчатокрылого насекомого – златоглазки Chrysopa carnea (Rübsam, Büning, 2001). КК насекомых аккумулирует значительные количества F-актина, который можно считать маркерным (signature) компонентом КК (Bogolyubov, 2018).
ЗП лягушек также содержит невероятные количества распределенного по нуклеоплазме F-актина независимо от того, формируется ли компактная кариосфера или нет. У травяной лягушки структурную стабильность комплексу “кариосфера–ядрышки” также в первую очередь придает обширная сеть F‑актиновых филаментов и их пучков, которая заполняет ЗП. Ключевая структурная роль F-актина в поддержании стабильности структур ЗП неоспоримо доказана в экспериментах с соединениями, деполимеризующими актин (Maslova, Krasikova, 2012), в том числе на ЗП травяной лягушки (Ilicheva et al., 2019). Однако в этом случае мы говорим о ядерной сети F-актина в целом, а не о специализированной ее части, которая могла бы представлять КК. В этом отношении структура ЗП R. temporaria принципиально не отличается от структуры ЗП X. laevis.
В то время как фундаментальные принципы формирования кариосферы (кариосомы) в основном расшифрованы, по крайней мере в отношении Drosophila melanogaster (Cullen et al., 2005; Ivanovska et al., 2005; Lancaster et al., 2007, 2010; Singh et al., 2018; Kenny et al., 2021), меньше известно о биологическом значении КК.
Формирование кариосомы в ЗП дрозофилы, по-видимому, не зависит от белков синаптонемных комплексов (СК), а мутанты с нарушениями формирования СК не имеют дефектов формирования кариосомы (Takeo et al., 2011). С другой стороны, мутации различных генов, которые необходимы для правильного завершения мейоза и оогенеза, приводят к аномалиям кариосомы, включая такие, когда хромосомы неправильно конденсируются и остаются связанными с ЯО (Morris et al., 2003).
Главными “участниками” формирования кариосомы Drosophila являются ферменты, модифицирующие гистоны (Flora et al., 2017), такие как консервативная нуклеосомная киназа гистонов 1 (nucleosomal histone kinase-1, NHK-1, она же Vrk-1 дрозофилы) (Cullen et al., 2005; Ivanovska et al., 2005; Lancaster et al., 2007, 2010). Согласно предложенной схеме, фосфорилирование BAF киназой NHK-1 позволяет хромосомам отсоединиться от ЯО, что приводит к формированию нормальной кариосомы. Однако при нарушении фосфорилирования BAF – хорошо известного связующего звена между хроматином и ЯО благодаря его взаимодействиям с ДНК и LEM-D-белками ядерной оболочки (Jamin, Wiebe, 2015) – хромосомы остаются связанными с ЯО (Lancaster et al., 2007). Весьма вероятно, что это эволюционно консервативный механизм, принимая во внимание консерватизм BAF и NHK-1.
“Сгустки” электронно-плотных тяжей – единственные структуры, которые потенциально могли бы претендовать на роль элементов КК. Эти тяжи связывают “колечки” (annuli), демонстрирующие большое морфологическое сходство с “автономными” поровыми комплексами (Gruzova, Parfenov, 1977), и ассоциированы с тонкофибриллярным актинсодержащим материалом. По-видимому, annuli в действительности не являются аналогами ЯПК, поскольку они не содержат по крайней мере одного необходимого нуклеопорина – Nup35. Более того, тяжи не содержит ни актина, ни ламина B и потому не могут считаться КК-подобными структурами, в особенности потому, что они формируют только “сгустки”, но не протяженные образования. Интересно, что у озерной лягушки Pelophylax ridibundus (ранее R. ridibunda) хромосомы в составе кариосферы присоединены к наружной стороне центрального тела, которое состоит из материала, морфологически сходного с тяжами и annuli ЗП R. temporaria (Parfenov, 1979).
Резонно предполагалось, что тяжи являются производными СК, прежде всего их центральных элементов (Gruzova, Parfenov, 1993). В ЗП некоторых двукрылых насекомых, таких как малярийный комар Aedes aegypti, формируется сложная КК, которая, как считают, образована несколькими слоями множественных аномальных СК, называемых поликомплексами. Кроме того, на ультраструктурном уровне в КК комаров подробно охарактеризованы внутриядерные пористые пластинки (intranuclear annulata lamellae), которые содержат annuli, напоминающие по своей структуре автономные ЯПК (Fiil, Moens, 1973; Fiil, 1974, 1976). Природу всех типов этого специфического экстрахромосомного материала еще предстоит установить.
В заключение, наши знания о клеточном ядре, особенно ЗП, несомненно, еще далеко не полные даже на уровне морфологии клетки. Приведенные здесь данные следует обязательно учитывать как основу для дальнейших исследований ЗП амфибий, широко используемого в качестве экспериментальной модели.
Список литературы
Боголюбов Д.С., Киселев А.М., Шабельников С.В., Парфенов В.Н. 2012. Полиаденилированные РНК и факторы экспорта мРНК в связи с экстрахромосомными ядерными доменами вителлогенных ооцитов насекомого Tenebrio molitor. Цитология. Т. 54. № 6. С. 497. (Bogolyubov D.S., Kiselyov A.M. Shabelnikov S.V., Parfenov V.N. 2012. Polyadenylated RNA and mRNA export factors in extrachromosomal nuclear domains of vitellogenic oocytes of the insect, Tenebrio molitor. Cell Tissue Biol. V. 6. P. 412.)https://doi.org/10.1134/S1990519X12050045
Гагинская Е.Р. 1972. Ядерные структуры в ооцитах половозрелых птиц. II. Белковые тела и кариосфера. Цитология. Т. 14. № 5. С. 568. (Gaginskaya E.R. 1972. The nuclear structures in oocytes of adult birds. II. Protein bodies and the karyosphere. Tsitologiia. V. 14. P. 568.)
Ильичева Н.В., Кирюшина Д.Ю., Баскаков А.В., Подгорная О.И., Почукалина Г.Н. 2016. Капсула кариосферы ооцитов зимующих лягушек Rana temporaria содержит актин, ламины и белки малых ядерных РНП. Цитология. Т. 58. № 6. С. 451. (Ilicheva N.V., Kiryushina D.Y., Baskakov A.V., Podgornaya O.I., Pochukalina G.N. 2016. The karyosphere capsule in oocytes of hibernating frogs Rana temporaria contains actin, lamins, and SnRNP. Cell Tissue Biol. V. 10. P. 422. )https://doi.org/10.1134/S1990519X16050059
Морозова К.Н., Киселева Е.В. 2008. Изменение организации ядра и цитоплазмы ооцитов ксенопуса после разрушения актиновых филаментов латрункулином. Цитология. Т. 50. № 5. С. 394. (Morozova K.N., Kiseleva E.V. 2008. Nuclear and cytoplasmic organization in Xenopus oocytes after disruption of actin filaments by latrunculin. Cell Tissue Biol. V. 2. P. 300. )https://doi.org/10.1134/S1990519X08030115
Парфенов В.Н. 1995. Преобразования ядерных структур в оогенезе некоторых позвоночных (к вопросу о морфогенезе капсулы кариосферы). Автореф. дис. ... докт. биол. наук. Санкт-Петербург. 51 с. (Parfenov V.N. 1995. Transformations of nuclear structures during oogenesis of some vertebrates (on the morphogenesis of the karyosphere capsule). D. Sci. Thesis, St. Petersburg, 51 pp.)
Почукалина Г.Н., Парфенов В.Н. 1994. Организация кариосферы с капсулой перед созреванием ооцитов травяной лягушки. Цитология. Т. 36. № 11. С. 1027. (Pochukalina G.N., Parfenov V.N. 1994. Organization of karyosphere with the capsule in oocytes of Rana temporaria before maturation. Tsitologiia. V. 36. P. 1027.)
Banani S.F., Lee H.O., Hyman A.A., Rosen M.K. 2017. Biomolecular condensates: organizers of cellular biochemistry. Nat. Rev. Mol. Cell Biol. V. 18. P. 285. https://doi.org/10.1038/nrm.2017.7
Bera M., Sengupta K. 2020. Nuclear filaments: role in chromosomal positioning and gene expression. Nucleus. V. 11. P. 99. https://doi.org/10.1080/19491034.2020.1769445
Bersini S., Lytle N.K., Schulte R., Huang L., Wahl G.M., Hetzer M.W. 2020. Nup93 regulates breast tumor growth by modulating cell proliferation and actin cytoskeleton remodeling. Life Sci. Alliance. V. 3. e201900623. https://doi.org/10.26508/lsa.201900623
Blackman M.W. 1903. The spermatogenesis of the myriapods. II. On the chromatin in the spermatocytes of Scolopendra heros. Biol. Bull. V. 5. P. 187. https://doi.org/10.2307/1535736
Blackman M.W. 1905. The spermatogenesis of the myriapods. IV. On the karyosphere and nucleolus in the spermatocytes of Scolopendra subspinipes. Proc. Am. Acad. Arts Sci. V. 41. P. 331. https://doi.org/10.2307/20022075
Bogolyubov D.S. 2018. Karyosphere (karyosome): a peculiar structure of the oocyte nucleus. Int. Rev. Cell Mol. Biol. V. 337. P. 1. https://doi.org/10.1016/bs.ircmb.2017.12.001
Bogolyubov D., Parfenov V. 2008. Structure of the insect oocyte nucleus with special reference to interchromatin granule clusters and Cajal bodies. Int. Rev. Cell Mol. Biol. V. 269. P. 59. https://doi.org/10.1016/S1937-6448(08)01002-2
Bogolyubov D.S., Batalova F.M., Kiselyov A.M., Stepanova I.S. 2013. Nuclear structures in Tribolium castaneum oocytes. Cell Biol. Int. V. 37. P. 1061. https://doi.org/10.1002/cbin.10135
Bohnsack M.T., Stüven T., Kuhn C., Cordes V.C., Görlich D. 2006. A selective block of nuclear actin export stabilizes the giant nuclei of Xenopus oocytes. Nat. Cell Biol. V. 8. P. 257. https://doi.org/10.1038/ncb1357
Born G. 1894. Die Struktur des Keimbläschens im Ovarialei von Triton taoniatus. Arch. Mikrosk. Anat. Bd. 43. S. 1. https://doi.org/10.1007/BF02933867
Carnoy J.B., Lebrun H. 1898. La vésicule germinative et les globules polaires chez les Batraciens. Cellule. V. 14. P. 113.
Clark T.G, Merriam R.W. 1977. Diffusible and bound actin nuclei of Xenopus laevis oocytes. Cell. V. 12. P. 883. https://doi.org/10.1016/0092-8674(77)90152-0
Clark T.G, Rosenbaum J.L. 1979. An actin filament matrix in hand-isolated nuclei of X. laevis oocytes. Cell. V. 18. P. 1101. https://doi.org/10.1016/0092-8674(79)90223-x
Cullen C.F., Brittle A.L., Ito T., Ohkura H. 2005. The conserved kinase NHK-1 is essential for mitotic progression and unifying acentrosomal meiotic spindles in Drosophila melanogaster. J. Cell Biol. V. 171. P. 593. https://doi.org/10.1083/jcb.200508127
De La Fuente R., Viveiros M.M., Burns K.H., Adashi E.Y., Matzuk M.M., Eppig J.J. 2004. Major chromatin remodeling in the germinal vesicle (GV) of mammalian oocytes is dispensable for global transcriptional silencing but required for centromeric heterochromatin function. Dev. Biol. V. 275. P. 447. https://doi.org/10.1016/j.ydbio.2004.08.028
Dumont J.N. 1972. Oogenesis in Xenopus laevis (Daudin). I. Stages of oocyte development in laboratory maintained animals. J. Morphol. V. 136. P. 153. https://doi.org/10.1002/jmor.1051360203
Dunkley S., Scheffler K., Mogessie B. 2022. Cytoskeletal form and function in mammalian oocytes and zygotes. Curr. Opin. Cell Biol. V. 75. 102073. https://doi.org/10.1016/j.ceb.2022.02.007
Duryee W.R. 1950. Chromosomal physiology in relation to nuclear structure. Ann. N.Y. Acad. Sci. V. 50. P. 920. https://doi.org/10.1111/j.1749-6632.1950.tb39892.x
Engelhardt P., Plagens U., Zbarsky I.B., Filatova L.S. 1982. Granules 25–30 nm in diameter: basic constituent of the nuclear matrix, chromosome scaffold, and nuclear envelope. Proc. Natl. Acad. Sci. USA. V. 79. P. 6937. https://doi.org/10.1073/pnas.79.22.6937
Fiil A. 1974. Structural and functional modifications of the nucleus during oogenesis in the mosquito Aedes aegypti. J. Cell Sci. V. 14. P. 51. https://doi.org/10.1242/jcs.14.1.51
Fiil A. 1976. Polycomplexes and intanuclear annulate lamellae in mosquito oocytes. Hereditas. V. 84. P. 117. https://doi.org/10.1111/J.1601-5223.1976.TB01200.X
Fiil A., Moens P. 1973. The development structure and function of modified synaptonemal complexes in mosqito oocytes. Chromosoma. V. 41. P. 37. https://doi.org/10.1007/BF00284073
Flora P., McCarthy A., Upadhyay M., Rangan P. 2017. Role of chromatin modifications in Drosophila germline stem cell differentiation. Results Probl. Cell Differ. V. 59. P. 1. https://doi.org/10.1007/978-3-319-44820-6_1
Foisner R. 2003. Cell cycle dynamics of the nuclear envelope. Scientific World Journal. V. 3. 450586.https://doi.org/10.1100/tsw.2003.06
Fulka J.J., Benc M., Loi P., Langerova A., Fulka H. 2019. Function of atypical mammalian oocyte/zygote nucleoli and its implications for reproductive biology and medicine. Int. J. Dev. Biol. V. 63. P. 105. https://doi.org/10.1387/ijdb.180329jf
Gaginskaya E., Kulikova T., Krasikova A. 2009. Avian lampbrush chromosomes: a powerful tool for exploration of genome expression. Cytogenet. Genome Res. V. 124. P. 251. https://doi.org/10.1159/000218130
Gall J.G. 2006. Exporting actin. Nat. Cell Biol. V. 8. P. 205. https://doi.org/10.1038/ncb0306-205
Gall J.G., Stephenson E.C., Erba H.P., Diaz M.O., Barsacchi-Pilone G. 1981. Histone genes are located at the sphere loci of newt lampbrush chromosomes. Chromosoma. V. 84. P. 159. https://doi.org/10.1007/BF00399128
Gall J.G., Tsvetkov A., Wu Z., Murphy C. 1995. Is the sphere organelle/coiled body a universal nuclear component? Dev Genet. V. 16. P. 25. https://doi.org/10.1002/dvg.1020160107
Gruzova M.N. 1988. The nucleus during oogenesis with special reference to extrachromosomal structures. In Oocyte Growth and Maturation. N.Y.: Consultants Bureau. P. 77.
Gruzova M.N., Parfenov V.N. 1977. Ultrastructure of late oocyte nuclei in Rana temporaria. J. Cell Sci. V. 28. P. 1. https://doi.org/10.1242/jcs.28.1.1
Gruzova M.N., Parfenov V.N. 1993. Karyosphere in oogenesis and intranuclear morphogenesis. Int. Rev. Cytol. V. 144. P. 1. https://doi.org/10.1016/s0074-7696(08)61512-0
Gruzova M.N., Parfyonov V.N. 1973. The karyosphere in late oogenesis of frogs. Monit. Zool. Ital. V. 7. P. 225. https://doi.org/10.1080/00269786.1973.10736215
Hampoelz B., Schwarz A., Ronchi P., Bragulat-Teixidor H., Tischer C., Gaspar I., Ephrussi A., Schwab Y., Beck M. 2019. Nuclear pores assemble from nucleoporin condensates during oogenesis. Cell. V. 179. P. 671.e17. https://doi.org/10.1016/j.cell.2019.09.022
Hyrskyluoto A., Vartiainen M.K. 2020. Regulation of nuclear actin dynamics in development and disease. Curr. Opin. Cell Biol. V. 64. P. 18. https://doi.org/10.1016/j.ceb.2020.01.012
Ilicheva N., Podgornaya O., Bogolyubov D., Pochukalina G. 2018. The karyosphere capsule in Rana temporaria oocytes contains structural and DNA-binding proteins. Nucleus. V. 9. P. 516. https://doi.org/10.1080/19491034.2018.1530935
Ilicheva N.V., Pochukalina G.N., Podgornaya O.I. 2019. Actin depolymerization disrupts karyosphere capsule integrity but not residual transcription in late oocytes of the grass frog Rana temporaria. J. Cell. Biochem. V. 120. P. 15057. https://doi.org/10.1002/jcb.28767
Ivanovska I., Khandan T., Ito T., Orr-Weaver T.L. 2005. A histone code in meiosis: the histone kinase, NHK-1, is required for proper chromosomal architecture in Drosophila oocytes. Gen. Dev. V. 19. P. 2571. https://doi.org/10.1101/gad.1348905
Jamin A., Wiebe M.S. 2015. Barrier to Autointegration Factor (BANF1): interwoven roles in nuclear structure, genome integrity, innate immunity, stress responses and progeria. Curr. Opin. Cell Biol. V. 34. P. 61. https://doi.org/10.1016/j.ceb.2015.05.006
Kenny A., Morgan M.B., Mohr S., Macdonald P.M. 2021. Knock down analysis reveals critical phases for specific oskar noncoding RNA functions during Drosophila oogenesis. G3 (Bethesda). V. 11. jkab340. https://doi.org/10.1093/g3journal/jkab340
Kiseleva E., Drummond S.P., Goldberg M.W., Rutherford S.A., Allen T.D., Wilson K.L. 2004. Actin- and protein-4.1-containing filaments link nuclear pore complexes to subnuclear organelles in Xenopus oocyte nuclei. J. Cell Sci. V. 117. P. 2481. https://doi.org/10.1242/jcs.01098
Kloc M., Chanana P., Vaughn N., Uosef A., Kubiak J.Z., Ghobrial R.M. 2021. New insights into cellular functions of nuclear actin. Biology (Basel). V. 10. 304. https://doi.org/10.3390/biology10040304
Konishi H.A., Yoshimura S.H. 2020. Interactions between non-structured domains of FG- and non-FG-nucleoporins coordinate the ordered assembly of the nuclear pore complex in mitosis. FASEB J. V. 34. P. 1532. https://doi.org/10.1096/fj.201901669R2020
Krasikova A., Kulikova T., Saifitdinova A., Derjusheva S., Gaginskaya E. 2004. Centromeric protein bodies on avian lampbrush chromosomes contain a protein detectable with an antibody against DNA topoisomerase II. Chromosoma. V. 113. P. 316. https://doi.org/10.1007/s00412-004-0321-5
Kyheröinen S., Vartiainen M.K. 2020. Nuclear actin dynamics in gene expression and genome organization. Semin. Cell Dev. Biol. V. 102. P. 105. https://doi.org/10.1016/j.semcdb.2019.10.012
Labade A.S., Karmodiya K., Sengupta K. 2016. HOXA repression is mediated by nucleoporin Nup93 assisted by its interactors Nup188 and Nup205. Epigenetics Chromatin. V. 9. 54. https://doi.org/10.1186/s13072-016-0106-0
Lamm N., Read M.N., Nobis M., Van Ly D., Page S.G., Masamsetti V.P., Timpson P., Biro M., Cesare A.J. 2020. Nuclear F-actin counteracts nuclear deformation and promotes fork repair during replication stress. Nat. Cell Biol. V. 22. P. 1460. https://doi.org/10.1038/s41556-020-00605-6
Lancaster O.M., Cullen C.F., Ohkura H. 2007. NHK-1 phosphorylates BAF to allow karyosome formation in the Drosophila oocyte nucleus. J. Cell Biol. V. 179. P. 817. https://doi.org/10.1083/jcb.200706067
Lancaster O.M., Breuer M., Cullen C.F., Ito T., Ohkura H. 2010. The meiotic recombination checkpoint suppresses NHK-1 kinase to prevent reorganisation of the oocyte nucleus in Drosophila. PLoS Genet. V. 6. e1001179. https://doi.org/10.1371/journal.pgen.1001179
Maslova A., Krasikova A. 2012. Nuclear actin depolymerization in transcriptionally active avian and amphibian oocytes leads to collapse of intranuclear structures. Nucleus. V. 3. P. 300. https://doi.org/10.4161/nucl.20393
Morris J.Z., Navarro C., Lehmann R. 2003. Identification and analysis of mutations in bob, Doa and eight new genes required for oocyte specification and development in Drosophila melanogaster. Genetics. V. 164. P. 1435. https://doi.org/10.1093/genetics/164.4.1435
Nag N., Sasidharan S., Uversky V.N., Saudagar P., Tripathi T. 2022. Phase separation of FG-nucleoporins in nuclear pore complexes. Biochim. Biophys. Acta Mol. Cell. Res. V. 1869. 119205. https://doi.org/10.1016/j.bbamcr.2021.119205
Nizami Z., Deryusheva S., Gall J.G. 2010. The Cajal body and histone locus body. Cold Spring Harb. Perspect. Biol. V. 2. a000653. https://doi.org/10.1101/cshperspect.a000653
Parfenov V.N. 1979. The karyosphere during late oogenesis in Rana ridibunda. Eur. J. Cell Biol. V. 19. P. 102.
Parfenov V., Potchukalina G., Dudina L., Kostyuchek D., Gruzova M. 1989. Human antral follicles: oocyte nucleus and the karyosphere formation (electron microscopic and autoradiographic data). Gamete Res. V. 22. P. 219. https://doi.org/10.1002/mrd.1120220209
Parfenov V.N., Davis D.S., Pochukalina G.N., Sample C.E., Bugaeva E.A., Murti K.G. 1995. Nuclear actin filaments and their topological changes in frog oocytes. Exp. Cell Res. V. 217. P. 385. https://doi.org/10.1006/excr.1995.1101
Pederson T. 2008. As functional nuclear actin comes into view, is it globular, filamentous, or both? J. Cell Biol. V. 180. P. 1061. https://doi.org/10.1083/jcb.200709082
Pederson T., Aebi U. 2002. Actin in the nucleus: what form and what for? J. Struct. Biol. V. 140. P. 3. https://doi.org/10.1016/s1047-8477(02)00528-2
Pederson T., Aebi U. 2005. Nuclear actin extends, with no contraction in sight. Mol. Biol. Cell. V. 16. P. 5055. https://doi.org/10.1091/mbc.e05-07-0656
Podgornaya O.I., Bugaeva E.A., Voronin A.P., Gilson E., Mitchell A.R. 2000. Nuclear envelope associated protein that binds telomeric DNAs. Mol. Reprod. Dev. V. 57. P. 16. https://doi.org/10.1002/1098-2795(200009)57:1<16::AID-MRD4>3.0.CO;2-8
Razin S.V., Iarovaia O.V., Vassetzky Y.S. 2014. A requiem to the nuclear matrix: from a controversial concept to 3D organization of the nucleus. Chromosoma. V. 123. P. 217. https://doi.org/10.1007/s00412-014-0459-8
Ródenas E., Klerkx E.P.F., Ayuso C., Audhya A, Askjaer P. 2009. Early embryonic requirement for nucleoporin Nup35/NPP-19 in nuclear assembly. Dev. Biol. V. 327. P. 399. https://doi.org/10.1016/j.ydbio.2008.12.024
Rübsam R., Büning J. 2001. F-actin is a component of the karyosome in neuropteran oocyte nuclei. Arthropod Struct. Dev. V. 30. P. 125. https://doi.org/10.1016/s1467-8039(01)00026-3
Schultze O. 1887. Untersuchungen über die Reifung und Befruchtung des Amphibieneies. Z. Wiss. Zool. Bd. 45. S. 177.
Segura-Totten M., Wilson K.L. 2004. BAF: roles in chromatin, nuclear structure and retrovirus integration. Trends Cell Biol. V. 14. P. 261. https://doi.org/10.1016/j.tcb.2004.03.004
Singh A., Dutta D., Paul M.S., Verma D., Mutsuddi M., Mukherjee A. 2018. Pleiotropic functions of the chromodomain-containing protein Hat-trick during oogenesis in Drosophila melanogaster. G3 (Bethesda). V. 8. P. 1067. https://doi.org/10.1534/g3.117.300526
Stüven T., Hartmann E., Görlich D. 2003. Exportin 6: a novel nuclear export receptor that is specific for profilin-actin complexes. EMBO J. V. 22. P. 5928. https://doi.org/10.1093/emboj/cdg565
Świątek P. 1999. Formation of the karyosome in developing oocytes of weevils (Coleoptera, Curculionidae). Tissue Cell. V. 31. P. 587. https://doi.org/10.1054/tice.1999.0073
Takeo S., Lake C.M., Morais-de-Sá E., Sunkel C.E., Hawley R.S. 2011. Synaptonemal complex-dependent centromeric clustering and the initiation of synapsis in Drosophila oocytes. Curr. Biol. V. 21. P. 1845. https://doi.org/10.1016/j.cub.2011.09.044
Ulferts S., Prajapati B., Grosse R., Vartiainen M.K. 2021. Emerging properties and functions of actin and actin filaments inside the nucleus. Cold Spring Harb. Perspect. Biol. V. 13. a040121. https://doi.org/10.1101/cshperspect.a040121
Visa N., Percipalle P. 2010. Nuclear functions of actin. Cold Spring Harb. Perspect. Biol. V. 2. a000620. https://doi.org/10.1101/cshperspect.a000620
Wagner K. 1923. Über die Entwicklung des Froscheies. Arch. Zellforsch. Bd. 17. S. 1.
Wallace R.A., Jared D.W., Dumont J.N., Sega M.W. 1973. Protein incorporation by isolated amphibian oocytes. III. Optimum incubation conditions. J. Exp. Zool. V. 184. P. 321. https://doi.org/10.1002/jez.1401840305
Дополнительные материалы отсутствуют.


