Цитология, 2023, T. 65, № 1, стр. 82-91
Влияние 2,3-бутандион-моноксима на взаимодействие миозина с актином в норме и при врожденной миопатии
Д. Д. Андреева 1, Н. А. Рысев 1, Ю. С. Боровиков 1, О. Е. Карпичева 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: olexiya6@yandex.ru
Поступила в редакцию 02.08.2022
После доработки 18.08.2022
Принята к публикации 31.08.2022
- EDN: GORVHZ
- DOI: 10.31857/S0041377123010029
Аннотация
Врожденные миопатии представляют собой неоднородную группу заболеваний скелетной мышечной ткани человека, характеризуемых мышечной гипотонией и слабостью. Клиническая картина миопатии значительно отличается у разных пациентов, что крайне затрудняет диагностику варианта миопатии и разработку подходов к лечению. Существует несколько применяемых в клинике или проходящих клинические исследования фармакологических агентов для лечения кардиомиопатий, механизм действия которых можно использовать для лечения и врожденных миопатий. Одним из таких агентов является 2,3-бутандион-моноксим (BDM) – неконкурентный ингибитор АТФазной активности миозина, использующийся для подавления острых повреждений миокарда. Молекулярные механизмы ингибирования миозина в присутствии BDM в скелетных мышцах не исследованы, поэтому цель настоящей работы заключалась в изучении влияния этого агента на взаимодействие миозина с актином при моделировании нескольких стадий АТ-Фазного цикла в скелетном мышечном волокне, чтобы оценить перспективы применения BDM для лечения врожденных миопатий. Мы обнаружили, что BDM в отсутствие регуляторных белков тропомиозина и тропонина усиливает жесткость связывания миозина с актином при моделировании слабых форм связывания этих мышечных белков, что может замедлить переход актомиозина из состояния A ∙ M ∙ АДФ ∙ Фн в состояние A ∙ M ∙ АДФ и является одной из причин снижения АТФазной активности миозина. При моделировании последовательных стадий АТФазного цикла с использованием АДФ, AMPPNP, ATPγS и АТФ происходит постепенный перевод головок миозина в состояние слабого взаимодействия с актином. В присутствии тропомиозина и тропонина в мышечном волокне BDM не влияет на образование слабой формы связывания актомиозина, однако увеличивает число головок миозина, существенных для генерации усилия. BDM может быть использован для увеличения эффективности конформационных перестроек миозина в присутствии тропомиозина с мутацией R90P, связанной с врожденной миопатией, поскольку этот реагент увеличивает число головок миозина в мышечном волокне, способных к эффективным конформационным перестройкам в АТФазном цикле и частично ингибирует патологические эффекты мутации.
Известно, что в основе сокращения скелетных мышц лежит взаимодействие актина и миозина, сопровождаемое гидролизом АТФ в активном центре миозина. Регуляцию мышечного сокращения осуществляет тропонин-тропомиозиновый комплекс, связанный с актином и придающий тонким нитям Са2+-зависимость для оперативного переключения между разными функциональными состояниями, в которых тонкие нити могут активировать или блокировать цикл миозиновых поперечных мостиков, лежащий в основе развития силы. Механизмы регуляции сокращения мышц могут быть нарушены вследствие мутаций в генах белков саркомера, что приводит к развитию мышечной дисфункции. По-видимому, вначале происходят незначительные (казалось бы) отклонения сократительной функции от нормы, такие как смещение равновесия между открытым и блокирующим функциональными состояниями тонких нитей в сторону активации или ингибирования актин-миозинового взаимодействия. В ответ на образование открытого функционального состояния тонких нитей увеличивается количество миозиновых мостиков, сильно связанных с актином и существенных для генерации силы, и дополнительное количество мономеров актина переходит во включенное состояние (при котором актин способен активировать гидролиз АТФ в активном центре миозина). И наоборот, если регуляторный комплекс вследствие мутации в одном из мышечных белков находится преимущественно в блокирующем состоянии, то количество миозиновых мостиков в сильной форме связывания значительно снижается и часть мономеров актина переходит в выключенное состояние (при котором актин не способен активировать гидролиз АТФ в миозине). Такие отклонения в функционировании белкового комплекса внутри саркомера способны усиливаться и накапливаться, запуская компенсаторные процессы, и вызывать мышечную слабость или контрактуры, появление агрегатов белков в виде разнообразных внутриклеточных включений (немалиновых телец, кэп-структур, ядер и стержней различной природы и локализации) и, как результат, приводить к ограничению двигательной функции, астении и (или) быстрой утомляемости мышц.
Обнаружено большое количество генетических причин возникновения заболеваний скелетных мышц человека, характеризующихся мышечной слабостью и гипотонией. Прямая корреляция между конкретной генетической причиной и фенотипом заболевания отсутствует, определение патологического варианта крайне затруднено, а терапевтические подходы до сих пор не разработаны. В этой научной проблеме важно выделить то, что пациент после выявления мышечной слабости и постановки диагноза врожденной миопатии не получает своевременного и соответствующего лечения, из-за чего со временем может потребоваться регулярный мониторинг дыхательной недостаточности и назначение неинвазивной и инвазивной вентиляции легких, а также терапия, направленная на предупреждение сердечной недостаточности. Таким образом, имеет место острая необходимость разработки принципов этиотропного лечения врожденных миопатий.
Существует несколько применяемых в клинике и проходящих клинические испытания лекарственных препаратов для лечения кардиомиопатий, механизм действия которых можно использовать для формирования основных принципов лечения и заболеваний скелетных мышц. Это такие химические соединения, которые способны модулировать функцию тропонина и миозина. Однако исследования, посвященные изучению молекулярных механизмов действия потенциальных лекарственных препаратов при заболеваниях скелетных мышц практически отсутствуют.
Одним из фармакологических агентов, перспективных для лечения миопатий является 2,3-бутандион-моноксим (BDM) – неконкурентный ингибитор химической и двигательной активности миозина II (McKillop et al., 1994). Было продемонстрировано, что при выполнении сердечно-легочной реанимации у свиней, у которых моделировали остановку сердца, BDM обращал ишемию сердечной мышцы (Lee et al., 2015). BDM оказывает защитное действие на структуру кардиомиоцитов (Wheeler, Chien, 2012). Предполагается, что BDM стабилизирует конвертерный домен сердечного миозина в промежуточном конформационном состоянии, характерном для слабого связывания с актином и ингибирует скорость высвобождения фосфата из активного центра. Несмотря на имеющиеся в литературе исследования, до сих пор неизвестны молекулярные механизмы действия BDM в скелетном мышечном волокне.
Цель настоящей работы заключалась в исследовании ответа миозиновых головок на присутствие в скелетном мышечном волокне BDM. Работа была выполнена на одиночных мышечных волокнах, вначале лишенных миозина и регуляторных белков (так называемых “теневых” волокнах), а затем реконструированных с помощью необходимых белков. Информацию о влиянии BDM на взаимодействие миозина и актина получали путем анализа поляризованной флуоресценции зондов 1,5-IAEDANS, связанных с субфрагментом-1 миозина (S1), который был инкорпорирован в мышечное волокно. Измерения поляризованной флуоресценции осуществляли при моделировании нескольких стадий АТФазного цикла в отсутствие или в присутствии АДФ, AMPPNP, ATPγS, АТФ и 20 мМ BDM. Регуляторную систему в теневом волокне восстанавливали с помощью скелетно-мышечного тропонина и рекомбинантного тропомиозина дикого типа или тропомиозина с аминокислотной заменой R90P (Arg90Pro), обнаруженной при врожденной миопатии человека (Lawlor et al., 2010). Функциональные состояния тонких нитей моделировали при низкой и высокой концентрациях ионов кальция.
Результаты проведенного нами исследования показали перспективность использования BDM для коррекции нарушений в работе миозинового поперечного мостика в скелетных мышцах.
МАТЕРИАЛ И МЕТОДИКА
Получение моделей мышечных волокон и мышечных белков. Работа выполнена на одиночных мышечных волокнах кролика с реконструированной сократительной системой. Такие волокна являются перспективной и адекватной моделью для исследования молекулярных механизмов мышечного сокращения (Borovikov et al., 2009). Источником мышечных волокон служила большая поясничная мышца кролика, из которой выделяли небольшие пучки длиной 4–5 см. Волокна помещали на лигатурах в глицеринизирующий раствор, в котором они хранились при –20°С в течение 3–36 мес. Затем отделяли одиночные мышечные волокна и экстрагировали из них мышечные белки до получения теневых волокон, состоящих на 80–90% из чистого фибриллярного актина (UniProt P68135), который на 100% идентичен актину скелетных мышц человека (UniProt P68133). Экстрагирующий раствор содержал 800 мМ KCl, 1 мМ MgCl2, 67 мМ Na,K-фосфатный буфер рН 7.0 и 10 мМ АТФ. Далее теневые мышечные волокна закрепляли на предметных стеклах и помещали в отмывающий раствор, содержащий 10 мМ KCl, 3 мМ МgCl2, 6.7 мМ K,Na-фосфатный буфер рН 7.0.
Сократительный аппарат мышечных волокон восстанавливали с помощью фрагмента миозина (S1) из скелетных мышц кролика, легко проникающего через мембрану теневого волокна и способного активировать и деактивировать регулируемые тонкие нити и изменять свою конформацию при связывании нуклеотидов и аналогов АТФ. Раствор для инкубации включал в себя 50 мМ KCl, 3 мМ MgCl2, 1 мМ DTT, 6.7 мМ Na,K-фосфатный буфера рН 7.0 и S1 в концентрации 2–3 мг/мл.
Рекомбинантные препараты тропомиозина дикого типа изоформы Tpm2.2, кодируемой геном TPM2, а также тропомиозина с аминокислотной заменой R90P были любезно предоставлены для исследований д-ром C. Redwood (Оксфордский университет, Великобритания). Миозин и тропонин выделяли из быстрых скелетных мышц кролика согласно методам, разработанным ранее (Margossian, Lowey, 1982; Potter, 1982). S1, не имеющий регуляторных легких цепей, получали расщеплением скелетно-мышечного миозина α-химотрипсином в течение 20 мин при 25°С при весовом соотношении 300 : 1, осаждали с помощью насыщенного раствора сульфата аммония и очищали путем диализа (Okamoto, Sekine, 1985). Диализный раствор включал 10 мМ KCl, 1 мМ MgCl2, 0.1 мМ NaN3, 0.1 мМ DTT, 20 мM Tris-HCl (рН 7.5). Затем S1 модифицировали флуоресцентным зондом 1,5-IAEDANS по описанной методике (Borejdo et al., 1982), согласно которой специфически модифицируется наиболее реактивный остаток цистеина в головке миозина Cys707. Чистоту препарата S1 и состав мышечных волокон определяли с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия. Согласно анализу электрофоретического разделения белков, молярное отношение S1 к актину составляло 1 : 4 (±2).
Измерение поляризованной флуоресценции S1, связанного с актином в мышечном волокне. С помощью метода поляризационной микрофлуориметрии исследовали конформационные перестройки S1, происходящие при моделировании разных структурно-функциональных состояний тонких нитей и стадий АТФазного цикла в одиночном мышечном волокне. Флуоресценцию зондов 1,5-IAEDANS, связанных с Cys707 S1, возбуждали при длине волны 407 ± 5 нм; интенсивность флуоресценции регистрировали в диапазоне длин волн 500–600 нм. Измерения проводили в проточной камере в отсутствие или в присутствии нуклеотидов (3 мМ АДФ, 15 мМ ATPγS, 15 мМ AMPPNP или 3 мМ АТФ, содержащих Mg), имитирующих различные стадии цикла гидролиза АТФ (Borovikov et al., 2009, 2017). Низкую и высокую концентрацию ионов кальция в мышечном волокне моделировали в присутствии 4 мМ ЭГТА и 0.1 мМ CaCl2 соответственно.
Интенсивности компонентов поляризованной флуоресценции ||I⊥, ⊥I⊥, ⊥I||, ||I|| регистрировали с помощью поляризационного флуориметра в проточной камере (Borovikov et al., 2004). Полученные данные обрабатывали с помощью модель-зависимого метода (Tregear, Mendelson, 1975; Borovikov et al., 2009). Предполагали, что в мышечном волокне имеется две популяции флуорофоров: популяция упорядоченных флуорофоров (1 – N), осцилляторы поглощения и излучения которых расположены под углами ФА и ФЕ относительно оси мышечного волокна, и популяция хаотически расположенных флуорофоров N. Поскольку характер изменений ФА и ФE совпадал, то в работе рассматривается только один из этих параметров (ФE). Параметры поляризованной флуоресценции (ФЕ, N) вычисляли с помощью математической обработки измеренных интенсивностей флуоресценции. Результаты были получены на 5–6 волокнах (25–30 измерений). Статистическую значимость изменений параметров оценивали с использованием t-теста Стьюдента при P < 0.05.
Определение актин-активированной АТФазы S1. Актин-содержащий ацетоновый порошок получали из скелетных мышц кролика по методике, описанной ранее (Spudich, Watt, 1971), и хранили при –45°С в течение 1–3 лет. Перед экспериментом актин выделяли из ацетонового порошка и очищали с помощью как минимум 3 циклов полимеризации−деполимеризации. Фибриллярный актин (Ф-актин) хранили в растворе, содержащем 60 мМ KCl, 0.2 мМ ATP, 0.2 мМ CaCl2, 1 мМ MgCl2, 0.2 мМ NaN3 и 20 мМ Tris-HCl (pH 8.0).
Скорость АТФазной реакции определяли в растворе, содержащем 1 мкМ S1, 7 мкМ Ф-актина в буфере следующего состава: 12 мМ трис-HCl (pH 7.9), 2.5 мМ MgCl2, 15 мМ КСl, 20 мМ NaCl, 0.2 мМ DTT и 2 мМ АТФ при 25°C. Концентрацию белков оценивали с помощью метода Брэдфорда (Bradford, 1976). Реакцию проводили в диапазоне концентраций Са2+ от 10–10 до 10–4 М в отсутствие или в присутствии 20 мМ BDM. Реакцию останавливали через 10 мин, добавляя трихлоруксусную кислоту до конечной концентрации 5%. Количество образовавшегося неорганического фосфата определяли методом Фиске и Субарроу (Fiske, Subbarow, 1925) на основании 3 экспериментов. Статистическую обработку данных и построение графиков осуществляли с помощью программы GraphPadPrism.
РЕЗУЛЬТАТЫ
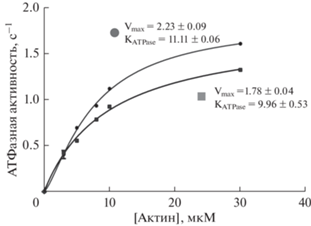
Влияние BDM на АТФазную активность S1 миозина. В присутствии BDM наблюдали снижение количества неорганического фосфата и уменьшение максимальной АТФазной активности головок миозина (рис. 1). Полученные результаты согласуются с опубликованными ранее данными (Higuchi, Takemori, 1992).
Рис. 1.
Актин-активируемая Mg2+-АТФазная активность головок миозина (S1 миозина) в отсутствие (круглые символы) и в присутствии (квадратные символы) 20 мМ BDM. Снижение величин Vmax (максимальной скорости АТФазной реакции) и KATPase (концентрации актина, при которой АТФазная активность равна половине максимума) в присутствии BDM указывает на то, что скорость освобождения неорганического фосфата из активного центра миозина ингибируется.
Влияние нуклеотидов на параметры поляризованной флуоресценции зондов 1,5-IAEDANS, связанных с S1 в скелетном мышечном волокне. Связывание S1, модифицированного флуоресцентными зондами 1,5-IAEDANS по Cys707 (S1-AEDANS), с Ф-актином теневых мышечных волокон инициировало появление поляризованной флуоресценции, которая регистрировалась нами с помощью поляризационного микрофлуориметра. Величина степени поляризации флуоресценции при ориентации волокна параллельно (P∥) и перпендикулярно (P⊥) плоскости поляризации света возбуждения была соответственно высокой (P∥ = 0.432 ± 0.003) и низкой (P⊥ = = ‒0.004 ± 0.004) (табл. 1). Подобные величины степени поляризации для S1-AEDANS неоднократно наблюдались нами ранее (Borovikov et al., 2009; Karpicheva et al., 2017).
Таблица 1.
Степени поляризации флуоресценции молекул 1,5-IAEDANS, связанных с Cys707 субфрагмента-1 миозина, при моделировании промежуточных стадий АТФазного цикла в отсутствие и в присутствии 20 мМ BDM
| Нуклеотид | Степень поляризации | |||
|---|---|---|---|---|
| в отсутствие BDM | в присутствии BDM | |||
| P∥ | P⊥ | P∥ | P⊥ | |
| ‒ | 0.432 ± 0.003 | ‒0.004 ± 0.006 | 0.450 ± 0.002 | ‒0.011 ± 0.006 |
| АДФ | 0.437 ± 0.004 | 0.201 ± 0.010 | 0.468 ± 0.004 | 0.014 ± 0.011 |
| АТФ | 0.346 ± 0.003 | 0.307 ± 0.019 | 0.452 ± 0.002 | 0.005 ± 0.008 |
Математический анализ измеренных параметров флуоресценции показал, что величина ФE – угла ориентации диполей излучения 1,5-IAEDANS относительно оси волокна для головок миозина, связанных с актиновыми нитями, составляла 42.9 ± 0.1 град. (рис. 2а). Известно, что в отсутствие нуклеотидов головки миозина ориентированы вдоль актиновой нити по спирали и образуют с тонкой нитью угол, близкий к 45 град. (Reedy et al., 1965). Следовательно, осцилляторы излучения зондов 1,5-IAEDANS располагались практически параллельно моторному домену миозина. Помимо упорядоченных флуорофоров в волокне имеется фракция неориентированных осцилляторов, которая отражает, главным образом, колебательные и вращательные движения головки миозиновой молекулы в мышечном волокне (Andreev et al., 1995). Количество неупорядоченных флуорофоров характеризуется параметром N, который можно использовать для характеристики сродства или жесткости связывания миозина к актину, изменяющегося при образовании слабой или сильной форм связывания этих двух белков. Согласно полученным данным (рис. 2б), в отсутствие нуклеотида величина N составляла 0.223 ± 0.004 отн. ед. (т.е. менее 25%, P < 0.05), что свидетельствует о низкой подвижности головок миозина, а следовательно, о большой области взаимодействия миозина с актином и жестком связывании этих белков (Borovikov et al., 2009, 2017; Karpicheva et al., 2017).
Рис. 2.
Влияние 20 мМ BDM на величину угла ориентации диполей излучения флуорофоров относительно оси мышечного волокна ΦE, (а) и количество неориентированных флуорофоров N (б) для зонда 1,5-IAEDANS, связанного с S1 в Cys707 в теневом волокне при моделировании основных состояний АТФазного цикла в отсутствие нуклеотида и в присутствии АДФ или АТФ. Данные получены в отсутствие регуляторных белков тропомиозина и тропонина. (*): здесь и далее изменения параметров по сравнению с состоянием в отсутствие BDM достоверны при P < 0.05. Поскольку флуоресцентный краситель жестко связан с SH1-спиралью миозина, то изменения параметра ΦE отражают наклон SH1-спирали миозина относительно оси мышечного волокна и изменение ориентации или конформации всей головки миозиновой молекулы, а изменения параметра N – характер связывания головки миозина с актином (чем больше количество неориентированных флуорофоров, тем слабее связывание миозина с актином).

Рассмотрим изменения параметров ФE и N при моделировании основных стадий цикла гидролиза АТФ (рис. 2). В отсутствие нуклеотидов имитировалось состояние актомиозина А ∙ М, где символы А (актин) и М (миозин) обозначают конформационные состояния актина и головки миозина соответственно. АДФ и АТФ в комплексе с Mg2+ использовали для имитации промежуточных структурных состояний актомиозина A ∙ M^ ∙ АДФ и A ∙ M** ∙ АДФ ∙ Фн соответственно (Roopnarine, Thomas, 1996; Goody, Hofmann, 1980), где M^ и M** – отличные от первоначального конформационные состояния головки миозина, Фн – неорганический фосфат.
АДФ и АТФ значительно изменяли параметры поляризованной флуоресценции. Добавление АДФ к мышечному волокну вызывало небольшое снижение величины ФE, что можно объяснить поворотом SH1-спирали миозина по направлению к оси мышечного волокна и “обратным движением” поперечного мостика к оси мышечного волокна (Takezawa et al., 1999).
При моделировании перехода актомиозина от сильного к слабому связыванию (от состояния в отсутствие нуклеотида и в присутствии АДФ к состоянию в присутствии АТФ), величины ФE и N увеличивались соответственно до 51.3 град. (рис. 2а) и 0.486 отн. ед. (рис. 2б), что говорит о повороте диполей излучения красителя вместе с областью их связывания (SH1-спиралью) от оси мышечного волокна и об увеличении подвижности флуорофоров. Достоверно известно, что головка миозина в АТФазном цикле значительно изменяет свою ориентацию относительно оси волокна (Burghardt et al., 1997), и изменения величин ФE и N, по-видимому, некоторым образом отражают изменение азимутальной ориентации всего моторного домена миозина и силы его взаимодействия с актином, а не только движение SH1-спирали, с которой связаны флуорофоры.
Стоит отметить, что в присутствии каждого из нуклеотидов или аналогов АТФ в мышечном волокне присутствует некоторая разнородность в конформациях головок миозина, то есть одномоментно наблюдается смесь миозиновых головок в сильной и слабой формах взаимодействия с актином, одна из которых является преобладающей (Nesmelov et al., 2008). Мы предполагаем, что изменения параметров флуоресценции S1-AEDANS свидетельствуют о смещении равновесия в сторону одного из преобладающих состояний – сильно- или слабосвязанного конформационного состояния головок миозина. Результаты исследований трехмерной структуры S1 обнаружили, что максимальные изменения в конформации головок миозина происходят в регуляторном домене, так называемом “рычаге”, при переходе миозина из структурного состояния M** · АДФ · Фн в состояние M^ · АДФ (Volkmann, Hanein, 2000).
Согласно данным, полученным в настоящей работе, область моторного домена миозина, содержащая краситель, то есть SH1-спираль, поворачивается при переходе от сильной к слабой форме связывания на 8.4 град. (рис. 2а). Амплитуда этого изменения может колебаться в зависимости от качества препаратов мышечных белков, мышечных волокон и белкового состава в пределах 4–11 град. (Borovikov et al., 2009). Выявленные тенденции будут использованы нами далее для характеристики влияния ингибитора миозина BDM на конформационные перестройки S1.
Влияние ингибитора миозина BDM на параметры поляризованной флуоресценции зондов 1,5-IAEDANS, связанных с S1 миозина в скелетном мышечном волокне. При добавлении 20 мМ BDM к мышечному волокну параметры поляризованной флуоресценции 1,5-IAEDANS существенно изменялись (табл. 1, рис. 2). Величины степени поляризации флуоресценции при ориентации волокна параллельно (P∥) и перпендикулярно (P⊥) плоскости поляризации света возбуждения были существенно выше и ниже соответственно тех значений, которые наблюдались нами в отсутствие BDM. Изменения флуоресценции при добавлении BDM сопровождались наклоном диполей излучения зондов 1,5-IAEDANS, связанных с S1, к оси мышечного волокна: величина ФE снижалась с 42.9 до 42.3 град. (рис. 2а), тогда как величина N, свидетельствующая о подвижности головoк миозина, не изменялась (рис. 2б). При добавлении АДФ к мышечному волокну также происходило снижение величины ФE в присутствии BDM с 42.3 до 41.8 град, величина N снижалась с 0.337 до 0.244 отн. ед. (рис. 2а, 2б). Таким образом, в отсутствие и в присутствии АДФ при добавлении 20 мМ BDM наблюдалиcь изменения, характерные для увеличения фракции головок миозина, образующих с актином сильную форму связывания, с большой областью актин-миозинового взаимодействия и с наклоном головок миозина по направлению к оси мышечного волокна. При моделировании перехода в слабую форму связывания миозина с актином (в присутствии АТФ) BDM приводил к существенному снижению величин ФE c 51.3 до 42.8 град и N с 0.486 до 0.213 отн. ед. (рис. 2). Если в отсутствие BDM при переходе головки миозина в конформационное состояние слабого связывания с актином SH1-спираль S1 поворачивалась от оси мышечного волокна на 8.4 град., то в присутствии BDM это изменение составляло всего лишь 1.0 град. Подвижность головки миозина, оцениваемая по величине N, не изменялась. Следовательно, данные измерения поляризованной флуоресценции от зондов 1,5-IAEDANS, связанных с SH1-спиралью миозина, свидетельствуют о значительном влиянии BDM на взаимодействие между миозином и актином, которое выражается в увеличении фракции сильносвязанных с актином миозиновых головок при моделировании как сильного, так и слабого связывания этого белкового комплекса и значительном подавлении конформационных перестроек миозиновых головок в АТФазном цикле.
BDM, как известно, снижает АТФазную активность миозина. Снижение АТФазной активности в присутствии BDM может быть напрямую связано с “замораживанием” конформации головок миозина, наблюдаемых нами при моделировании перехода между сильной и слабой формами связывания актомиозина. То есть ингибиторное действие BDM обусловлено не тем, что этот реагент ингибирует связывание миозина с актином, а тем, что он, наоборот, потенциирует расщепление фосфата в активном центре миозина и переводит часть головок миозина из слабой формы связывания в промежуточную или сильную форму, однако при этом выделение неорганического фосфата снижается.
В дополнительно проведенном эксперименте (рис. 3) было исследовано влияние BDM на конформационные перестройки миозина при моделировании дополнительных промежуточных стадий АТ-Фазного цикла A ∙ M’ ∙ АДФ и A ∙ M** ∙ АДФ ∙ Фн (в присутствии AMPPNP и AТPγS). При сравнении с данными, полученными в отсутствие BDM, можно выявить существенное увеличение величин ФE и N в присутствии AMPPNP и AТPγS (рис. 3а, б), что указывает на поворот SH1-спирали от оси мышечного волокна и образование конформации миозина, характерной для слабой формы связывания с актином. Следовательно, последовательная инкубация мышечного волокна в растворах AMPPNP, ATPγS и АТФ приводит к постепенному переходу головок миозина в слабую форму связывания и не вызывает задерживания миозина в сильной форме связывания, как это наблюдалось при переходе из состояния с АДФ сразу в состояние с АТФ.
Рис. 3.
Влияние 20 мМ BDM на величины ΦE и N для S1, связанного с 1,5-AEDANS в теневом волокне при последовательном моделировании ряда состояний АТФазного цикла в отсутствие нуклеотида и в присутствии АДФ, AMPPNP, ATPγS или АТФ. Данные получены в отсутствие регуляторных белков тропомиозина и тропонина.

Влияние BDM на конформационное состояние S1 миозина в скелетном мышечном волокне, содержащем тропонин и тропомиозин дикого типа или тропомиозин с аминокислотной заменой R90P. В настоящей работе тонкие нити теневых волокон были реконструированы с помощью рекомбинантного тропомиозина дикого типа Tpm2.2 или мутантного тропомиозина, имеющего аминокислотную замену R90P, обнаруженную при врожденной диспропорции мышечных волокон человека (CFTD) (Lawlor et al., 2010).
BDM был добавлен к теневым волокнам, содержащим тропомиозин, тропонин и S1-AEDANS в отсутствие и в присутствии АТФ с последовательным переводом комплекса актин-миозин от сильной к слабой форме связывания, как это было описано выше. Измеряли поляризованную флуоресценция зондов 1,5-IAEDANS, связанных с S1, и оценивали влияние BDM в норме и при моделировании в мышечном волокне патологического состояния регуляторного комплекса тропомиозин-тропонин, который может формироваться в мышцах у человека, несущего мутацию R90P в гене TPM2. Согласно полученным данным (рис. 4а), BDM снижал величину ФE c 44.9 до 43.8 град. в присутствии тропомиозина дикого типа и не изменял этот параметр при других моделируемых состояниях. Такое снижение угла описывалось нами ранее (см. выше) при добавлении BDM к теневым волокнам, содержащим только S1, и указывает на увеличение фракции головок миозина в сильной форме связывания с актином.
Рис. 4.
Влияние 20 мМ BDM на величины угла ΦE (а) и параметра N (б) для S1, связанного с 1,5-IAEDANS, в теневом волокне, содержащем тропонин, а также тропомиозин дикого типа (WT) или тропомиозин с заменой R90P при моделировании сильного (в отсутствие нуклеотида) и слабого (в присутствии АТФ) связывания актомиозина. Данные получены при высокой (+Са2+) и низкой (–Са2+) концентрациях ионов кальция.

Это предположение подтверждается снижением параметра N, которое свидетельствует о снижении подвижности SH1-спирали миозина и об увеличении жесткости связывания миозина с актином. Тем не менее, в мышечном волокне с реконструированной регуляторной системой, BDM не оказывал влияния на конформационное состояние миозина при моделировании слабой формы связывания в присутствии АТФ, а только снижал параметр N. Таким образом, эффект BDM практически нивелируется в присутствии тропомиозина и тропонина. Когда в тонкую нить встраивался тропомиозин с заменой R90P, то при низкой концентрации ионов кальция головки миозина образовывали с актином все больше сильных форм связывания, что подробно было описано в предыдущей работе (Borovikov et al., 2021). Такое патологическое увеличение головок миозина в сильной форме связывания с актином при деактивирующих условиях может являться одной из причин снижения эффективной работы миозиновых поперечных мостиков и приводить к мышечной слабости, наблюдаемой при CFTD. BDM в присутствии мутантного тропомиозина, тропонина и АТФ увеличивал величины ФE c 48.5 до 50.3 град и N – c 0.100 до 0.428 отн. ед. при низких концентрациях ионов кальция (рис. 4а), т.е. смягчал последствия мутации, позволяя головкам миозина образовывать с актином больше слабых форм и увеличивая конформационные изменения головок при переходе между сильной и слабой формами взаимодействия. Так, если ФE увеличивался на 4.3 град в отсутствие BDM, то в его присутствии эта величина составляла уже 5.6 град. В присутствии тропомиозина дикого типа величина ФE увеличивалась на 6.5 град в отсутствие BDM и на 7.5 град. в присутствии BDM.
Таким образом, BDM приводил к частичному восстановлению конформационных перестроек S1, нарушенных вследствие замены R90P в тропомиозине: величина ФE в присутствии BDM приближается к тем величинам, которые мы наблюдали в присутствии тропомиозина дикого типа, а увеличение величины N свидетельствует о возможности образования слабых форм связывания в присутствии АТФ.
ОБСУЖДЕНИЕ
BDM относится к классу оксимов, которые являются перспективными фармакологическими агентами для регуляции многочисленных клеточных процессов. Связываясь с миозином непосредственно рядом с его активным центром, BDM способен изменять степень фосфорилирования этого мышечного белка и модулировать его АТФазную активность. Изучение кинетики связывания (Herrmann et al., 1992) показало, что взаимодействие между BDM и γ-фосфатной группой АТФ в АТФ-связывающем сайте миозина потенцирует стадию расщепления, сдвигая равновесие от состояния М^ ∙ АТФ к состоянию М** ∙ АДФ ∙ Фн, а далее стерическим образом замедляет стадию высвобождения Фн и образование комплекса М** ∙ АДФ (McKillop, 1994; Herrmann et al., 1992). Из этого следует, что актомиозин задерживается в состоянии А ∙ М** ∙ АДФ ∙ Фн, т.е. в промежуточном состоянии между слабой и сильной формами связывания. Таким образом, ингибиторный эффект BDM состоит в замедлении высвобождения неорганического фосфата из активного центра миозина, что является одной из причин снижения активности миозиновой АТФазы и сократительной функции в присутствии BDM (Higuchi, Takemori, 1989).
Наши данные подтверждают, что главный эффект BDM заключается в потенцировании расщепления АТФ в активном центре миозина. В первой части работы мы моделировали три состояния А-ТФазного цикла: А ∙ М, А ∙ М^ ∙ АДФ и А ∙ М* ∙ АТФ. Если BDM ускоряет процесс расщепления АТФ в активном центре головки миозина, то при моделировании слабого связывания в присутствии АТФ можно было ожидать появления головок миозина в промежуточной или сильной форме связывания. Нами установлено, что инкубация мышечного волокна в растворе, содержащем BDM в присутствии АТФ, провоцирует смещение равновесия актин-миозиновых состояний к образованию конформации сильного связывания в цикле гидролиза АТФ. Следовательно, процесс перехода миозиновых головок в слабую форму связывания с актином ингибируется.
Противоречивыми данными стали результаты, полученные при моделировании сильных форм связывания А ∙ М и А ∙ М^ ∙ АДФ (в отсутствие и в присутствии АДФ). Добавление BDM инициировало переход большего числа головок миозина в сильную форму связывания с актином, что не соответствует роли BDM как ингибитора миозина. Тем не менее, сразу в нескольких экспериментах при добавлении BDM к мышечным волокнам, содержащим S1-A-EDANS, SH1-спираль миозина наклонялась по направлению к оси мышечного волокна, что, несомненно, указывает на образование конформации головки миозина, характерной для сильного связывания с актином. Однако стоит отметить, что результаты кинетических исследований были получены при моделировании перехода миозина от конформации с АТФ в конформацию с АДФ.
Специфика нашего исследования заключается в том, что сначала моделируются состояния сильного связывания, а затем переход в слабое связывание. Такая последовательность продиктована тем, что в присутствии АТФ количество головок миозина, связанных с актином, резко снижается вследствие падения сродства миозина к актину и дальнейшие измерения флуоресценции затрудняются. Можно предположить, что головки миозина после воздействия на них АТФ и BDM сложнее бы осуществляли переход к сильной форме связывания с актином.
Промежуточное состояние А ∙ М** ∙ АДФ ∙ Фн, в котором, как предполагается, задерживается миозин в присутствии BDM, можно смоделировать с помощью аналогов АТФ AMPPNP или ATPγS. Во второй части работы нами было промоделировано 5 состояний АТФазного цикла: А ∙ М, А ∙ М^ ∙ АДФ, А ∙ М’ ∙ АДФ, А ∙ М** ∙ АДФ-Фн и А ∙ М* ∙ АТФ, т.е. проведена последовательная инкубация мышечных волокон в растворах АДФ, AMPPNP, ATPγS и АТФ.
Ранее с помощью спектроскопии ядерного магнитного резонанса (Komatsu et al., 2017) было обнаружено, что BDM изменяет микроокружение вокруг фосфатных групп AMPPNP при связывании с головкой миозина, предполагая взаимодействие между BDM и фосфатными группами AMPPNP. Теоретические подходы позволяют предполагать, что BDM располагается близко к γ-сульфату ATPγS и может способствовать расщеплению фосфоэфирных связей АТФ в активном центре миозина. Другими словами, оксимная группа BDM может непосредственно дефосфорилировать АТФ с образованием АДФ и фосфорилоксима. Мы наблюдали увеличение числа головок миозина в слабой форме связывания под действием BDM в состояниях с AMPPNP и ATPγS, и при таком последовательном переходе головки миозина эффективно переходили в состояние слабого связывания с актином, в отличие от результатов, полученных при инкубации волокон сначала в АДФ, а потом сразу в АТФ.
В мышечных волокнах с реконструированной регуляторной системой характер действия BDM изменялся. Этот реагент уже не влиял на образование слабой формы связывания миозина с актином, но увеличивал фракцию сильно связанных головок миозина при низкой концентрации ионов кальция в саркомере, таким образом стимулируя эффективные конформационные перестройки миозиновых поперечных мостиков в АТФазном цикле.
Действие BDM на конформацию миозина может быть использовано для восстановления актин-миозинового взаимодействия в присутствии мутаций в мышечных белках, связанных с врожденными миопатиями, что показано нами на примере тропомиозина с заменой R90P, встроенного в мышечное волокно. Патологическое действие мутации R90P связано с увеличением АТФазной активности миозина и относительного количества головок миозина, которые находятся в конформации сильного связывания, при моделировании различных стадий цикла гидролиза АТФ (Borovikov et al., 2021). Одним из главных эффектов мутации являлось снижение амплитуды движения головок миозина (или SH1-спирали миозина) в цикле гидролиза АТФ. Добавление BDM к мышечным волокнам, содержащим мутантный тропомиозин, частично нормализовало конформационные перестройки миозина, нарушенные в присутствии мутантного тропомиозина, позволяя головкам миозина эффективнее переходить между конформациями слабого и сильного связывания с актином. Из данных следует, что BDM может быть использован для восстановления нормальной регуляции взаимодействия миозина с актином и должен быть протестирован в дальнейшем на других модельных системах и в модельных животных.
Список литературы
Andreev O.A., Takashi R., Borejdo J. 1995. Fluorescence polarization study of the rigor complexes formed at different degrees of saturation of actin filaments with myosin subfragment-1. J. Muscle Res. Cell Motil. V. 16. P. 353.
Borejdo J., Assulin O., Ando T., Putnam S. 1982. Cross-bridge orientation in skeletal muscle measured by linear dichroism of an extrinsic chromophore. J. Mol. Biol. V. 158. P. 391.
Borovikov Y.S., Andreeva D.D., Avrova S.V., Sirenko V.V., Simonyan A.O., Redwood C.S., Karpicheva O.E. 2021.Molecular mechanisms of the deregulation of muscle contraction induced by the R90P mutation in Tpm3.12 and the weakening of this effect by BDM and W7. Int. J. Mol. Sci. V. 22. P. 6318. https://doi.org/10.3390/ijms22126318
Borovikov Y.S., Dedova I.V., dos Remedios C.G., Vikhoreva N.N., Vikhorev P.G., Avrova S.V., Hazlett T.L., Van Der Meer B.W. 2004. Fluorescence depolarization of actin filaments in reconstructed myofibers: the effect of S1 or pPDM-S1 on movements of distinct areas of actin. Biophys J. V. 86. P. 3020. https://doi.org/101016/S0006-3495(04)74351-9
Borovikov Y.S., Karpicheva O.E., Avrova S.V., Redwood C.S. 2009. Modulation of the effects of tropomyosin on actin and myosin conformational changes by troponin and Ca2+. Biochim. Biophys. Acta. V. 1794. P. 985. https://doi.org/10.1016/j.bbapap.2008.11.014
Borovikov Y.S., Rysev N.A., Avrova S.V., Karpicheva O.E., Borys D., Moraczewska J. 2017. Molecular mechanisms of deregulation of the thin filament associated with the R167H and K168E substitutions in tropomyosin Tpm 1.1. Arch. Biochem. Biophys. V. 614. P. 28. https://doi.org/10.1016/j.abb.2016.12.004
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. V. 72. P. 248. https://doi.org/10.1006/abio.1976.9999
Burghardt T.P., Garamszegi S.P., Ajtai K. 1997. Probes bound to myosin Cys-707 rotate during length transients in contraction. Proc. Natl. Acad. Sci. USA. V. 94. P. 9631. https://doi.org/10.1073/pnas.94.18.9631
Fiske C.H., Subbarow Y. 1925. Determination of inorganic phosphate. J. Biol. Chem. V. 66. P. 375.
Herrmann C., Wray J., Travers F., Barman T. 1992. Effect of 2,3-butanedione monoxime on myosin and myofibrillar ATPases. An example of an uncompetitive inhibitor. Biochemistry. V. 31. P. 12227. https://doi.org/10.1021/bi00163a036
Higuchi H., Takemori S. 1989. Butanedione monoxime suppresses contraction and ATPase activity of rabbit skeletal muscle. J. Biochem. V. 105. P. 638. https://doi.org/10.1093/oxfordjournals.jbchem.a122717
Karpicheva O.E., Sirenko V.V., Rysev N.A., Simonyan A.O., Borys D., Moraczewska J., Borovikov Y.S. 2017. Deviations in conformational rearrangements of thin filaments and myosin caused by the Ala155Thr substitution in hydrophobic core of tropomyosin. Biochim. Biophys. Acta. V. 1. P. 1790. https://doi.org/10.1016/j.bbapap.2017.09.008
Komatsu H., Koseki Y., Kanno T., Aoki S., Kodama T. 2017. 2,3-Butandione 2-monoxime inhibits skeletal myosin II by accelerating ATP cleavage. Biochem. Biophys. Res. Commun. V. 490. P. 849. https://doi.org/10.1016/j.bbrc.2017.06.130
Lawlor M.W., Dechene E.T., Roumm E., Geggel A.S., Moghadaszadeh B., Beggs A.H. 2010. Mutations of tropomyosin 3 (TPM3) are common and associated with type 1 myofiber hypotrophy in congenital fiber type disproportion. Hum. Mutat. V. 31. P. 176. https://doi.org/10.1002/humu.21157
Lee B.K., Jeung K.W., Choi S.S., Park S.W., Yun S.W., Lee S.M., Kim N.Y., Heo T., Min Y.I. 2015. Effects of the administration of 2,3-butanedione monoxime during conventional cardiopulmonary resuscitation on ischaemic contracture and resuscitability in a pig model of out-of-hospital cardiac arrest. Resuscitation. V. 87. P. 26. https://doi.org/10.1016/j.resuscitation.2014.11.011
Margossian S., Lowey S. 1982. Preparation of myosin and its subfragments from rabbit skeletal muscle. Methods Enzym. V. 85. P. 55.
McKillop D.F., Fortune N.S., Ranatunga K.W., Geeves M.A. 1994. The influence of 2,3-butanedione 2-monoxime (BDM) on the interaction between actin and myosin in solution and in skinned muscle fibres. J. Muscle Res. Cell Motil. V. 15. P. 309. https://doi.org/10.1007/BF00123483
Nesmelov Y.E., Agafonov R.V., Burr A.R., Weber R.T., Thomas D.D. 2008. Structure and dynamics of the force-generating domain of myosin probed by multifrequency electron paramagnetic resonance. Biophys. J. V. 95. P. 247. https://doi.org/10.1529/biophysj.107.124305
Okamoto Y., Sekine T. 1985. A streamlined method of subfragment one preparation from myosin. J. Biol. Chem. V. 98. P. 1143.
Potter J.D. 1982. Preparation of troponin and its subunits. Methods Enzym. V. 85. P. 241.
Reedy M.K., Holmes K.C., Tregear R.T. 1965. Induced changes in orientation of the cross-bridges of glycerinated insect flight muscle. Nature. V. 207. P. 1276. https://doi.org/10.1038/2071276a0
Robinson P., Lipscomb S., Preston L.C., Altin E., Watkins H., Ashley C.C., Redwood C.S. 2007. Mutations in fast skeletal troponin I, troponin T, and beta-tropomyosin that cause distal arthrogryposis all increase contractile function. FASEB J. V. 21. P. 896. https://doi.org/10.1096/fj.06-6899com
Roopnarine O., Thomas D.D. 1996. Orientation of intermediate nucleotide states of indane dione spin- labeled myosin heads in muscle fibers. Biophys. J. V. 70. P. 2795.
Spudich J.A., Watt S.1971. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. J. Biol. Chem. V. 246. P. 4866.
Takezawa Y., Kim D.S., Ogino M., Sugimoto Y., Kobayashi T., Arata T., Wakabayashi K. 1999. Backward movements of cross-bridges by application of stretch and by binding of MgADP to skeletal muscle fibers in the rigor state as studied by X-ray diffraction. Biophys. J. V. 76. P. 1770. https://doi.org/10.1016/S0006-3495(99)77338-8
Tregear R.T., Mendelson R.A. 1975. Polarization from a helix of fluorophores and its relation to that obtained from muscle. Biophys. J. V. 15. P. 455.
Volkmann N., Hanein D. 2000. Actomyosin: law and order in motility. Curr. Opin. Cell Biol. V. 12. P. 26. https://doi.org/10.1016/s0955-0674(99)00053-8
Wheeler T.J., Chien S. 2012. Protection of rat cardiac myocytes by fructose-1,6-bisphosphate and 2,3-butanedione. PLoSOne. V. 7. P. e35023. https://doi.org/10.1371/journal.pone.0035023
Дополнительные материалы отсутствуют.


