Цитология, 2023, T. 65, № 1, стр. 11-19
Потенциал биомедицинского использования децеллюляризованных матриксов культивируемых клеток
Р. Е. Ушаков *
Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: uszakow@yandex.ru
Поступила в редакцию 05.09.2022
После доработки 10.12.2022
Принята к публикации 15.12.2022
- EDN: GLGYRX
- DOI: 10.31857/S004137712301011X
Аннотация
Децеллюляризованные внеклеточные матриксы являются перспективным материалом для биоинженерии и регенеративной медицины. В последнее время возрастает интерес к использованию внеклеточного матрикса культивируемых клеток (ВКМ-КК). В представленном небольшом обзоре оцениваются преимущества и недостатки такого подхода, описывается многообразие способов модификации ВКМ-КК, рассматриваются сферы возможного применения ВКМ-КК: в качестве субстрата для культивирования, как основы для создания биосовместимых скаффолдов, как препарата для непосредственного применения в бесклеточной терапии и как модели для исследования заболеваний.
Многоклеточный организм существует как единое целое благодаря внеклеточному матриксу. ВКМ – это многокомпонентная система, которая, в общих чертах, состоит из трехмерной сети белковых волокон, погруженных в протеогликановый гель. Помимо чисто структурных компонентов, ВКМ содержит белки-регуляторы клеточной активности (“матрицеллюлярные” белки), а также депонированные ростовые факторы и другие сигнальные молекулы. С функциональной точки зрения ВКМ – не просто “цемент”, скрепляющий клетки воедино, это субстрат для адгезии и передвижения клеток, это среда, формирующая надлежащее микроокружение, а также резервуар питательных веществ и источник биологических сигналов, контролирующих жизнедеятельность клетки во всех ее проявлениях – от пролиферации и дифференцировки до гибели; кроме того, ВКМ определяет форму органов и механические характеристики тканей, играет ключевую роль в процессах развития и регенерации, поддерживает тканевый гомеостаз.
В свете современных представлений о функциях ВКМ становится очевидным, что ВКМ – наиболее естественный субстрат для существования и функционирования клеток. Уникальная биологическая активность и высочайшая биосовместимость ВКМ делают его крайне привлекательным материалом для регенеративной медицины и тканевой инженерии: интенсивное применение ВКМ в биоинженерных разработках (создание искусственных органов и тканей, сосудистых и других протезов) является трендом в исследованиях последних десяти–двадцати лет. ВКМ также успешно используется в клинической практике. В настоящее время известно более 80 зарегистрированных препаратов на основе ВКМ, которые употребляются в ортопедии, стоматологии, а также в реконструктивной и сердечно-сосудистой хирургии (Parmaksiz et al., 2016). К примеру, свою эффективность доказал препарат AlloDerm® (бесклеточный матрикс, выделяемый из кожи человека), использованный уже более миллиона раз для лечения ожогов, ран, рецессий десны, в маммопластике и т.д. (Konofaos et al., 2017). Применение ВКМ открывает новые возможности в медицине: вдохновляющим примером является регенерация мышц и восстановление способности к ходьбе после терапии с использованием ВКМ мочевого пузыря свиньи у пациентов со значительной потерей мышечной ткани (volumetric muscle loss), которым изначально рекомендовалась ампутация (Sicari et al., 2014).
Традиционным источником ВКМ являются децеллюляризованные органы и ткани, т.е. подвергнутые удалению клеточных компонентов с помощью различных физических и химических методов. В последние годы исследователи все чаще обращаются к альтернативному подходу, в рамках которого источником ВКМ являются культивируемые клетки.
В представленном небольшом обзоре современной литературы мы рассмотрим преимущества и недостатки такого подхода, а также оценим перспективы использования ВКМ-КК.
ПРЕИМУЩЕСТВА И НЕДОСТАТКИ ВКМ-КК
ВКМ-КК обладают следующими преимуществами. Во-первых, ВКМ-КК могут служить альтернативой ксено- и аллогенному материалу. Зарегистрированные препараты бесклеточных ВКМ выделяются из тканей животных и человека, и, хотя компоненты ВКМ считаются неиммуногенными в силу своей эволюционной консервативности (Cheng et al., 2014), было показано, что ксено- и аллотрансплантаты ВКМ могут вызывать иммунный ответ и отторжение (Methe, 2020; Massaro et al., 2021). Этих трудностей, а также проблем, связанных с работой с кадаверным материалом (этических, логистических, рисков передачи болезней и др.) можно избежать при использовании ВКМ, полученного с помощью культивированя клеток реципиента. Аналогичным образом материалы на основе ВКМ-КК могут представлять собой альтернативу аутотрансплантатам. Хотя аутотрансплантаты считаются “золотым стандартом”, например, при замещении костных дефектов, их использование сопряжено с рядом затруднений: с ограниченным объемом донорского материала, осложнениями в месте взятия, предварительной заданностью размеров и формы аутотрансплантата. Эти проблемы могут быть преодолены, если использовать как основу для создания соответствующих трансплантатов ВКМ, полученный in vitro с помощью мезенхимных стволовых (стромальных клеток) (МСК) или остеогенных клеток пациента (Cheng et al., 2014).
Во-вторых, с помощью культивируемых клеток можно получать такие ВКМ, которые сложно или невозможно выделить из тканей. К примеру, плотный матрикс хрящевой ткани имеет плохую проницаемость для децеллюляризующих агентов, чего нельзя сказать о клетках в культуре (Zhu et al., 2021); кроме того, едва ли возможно вычленить из ткани нишу стволовых клеток, однако характерное для ниши микроокружение можно воспроизвести с помощью ВКМ МСК (Assunção et al., 2020). Сравнительная простота децеллюляризации ВКМ-КК также дает возможность использовать более мягкие методы выделения ВКМ – например, без использования детергентов, что гарантирует отсутствие в ВКМ остаточных количеств веществ, которые могут приводить к нежелательным эффектам, а также позволяет сохранить состав ВКМ как можно более интактным (Nellinger et al., 2022).
В-третьих, ВКМ-КК обладает значительным потенциалом кастомизации. Если ВКМ органов или тканей имеет детерминированные состав и структуру, то с помощью культивируемых клеток можно получать ВКМ с желаемыми свойствами для решения определенных задач (рис. 1). При этом может быть использовано все многообразие клеточных линий (как для получения тканеспецифичных ВКМ, так и для выделения ВКМ стволовых клеток), а также их генетическая модификация, например, для оверэкспрессии компонентов ВКМ или матрикс-ассоциированных белков. Так, был создан скаффолд на основе полилактида и децеллюляризованного матрикса клеток карциномы мочевого пузыря (линия 5637), трансфицированных вектором, несущим ген фибронектина; было показано, что полученный скаффолд поддерживает функциональную активность гепатоцитов HepG2 и поэтому потенциально может быть применен в тканевой инженерии печени (Grant et al., 2018). Иммортализация МСК плаценты с помощью трансдукции гена обратной транскриптазы теломеразы (hTERT) позволила получить биологически активный ВКМ из клеток, прошедших через большое количество пассажей (Kusuma et al., 2017). В контексте разнообразия типов культивируемых клеток-продуцентов ВКМ интерес также представляют индуцированные плюрипотентные стволовые клетки (ИПС); было показано, что полученные из ИПС фибробласты демонстрируют повышенную продукцию белков ВКМ по сравнению с исходными дермальными фибробластами до репрограммирования (Shamis et al., 2012).
Рис. 1.
Потенциал кастомизации внеклеточного матрикса (ВКМ) культивируемых клеток. Создано с помощью BioRender.com
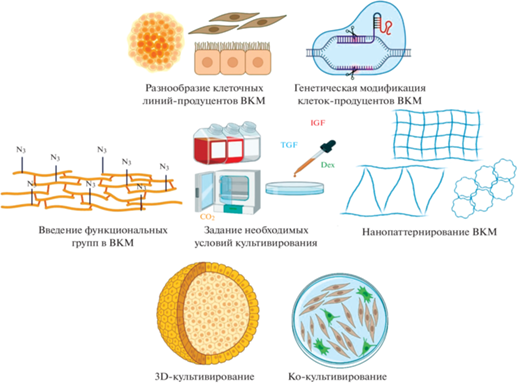
Для получения ВКМ-КК также может применяться и трехмерное культивирование. Известно, что МСК после агрегации в сфероиды демонстрируют повышенную экспрессию и секрецию паракринных факторов; культивирование сфероидов в присутствии макромолекулярных краудеров, ускоряющих депонирование ВКМ и способствующих аккумуляции секретируемых факторов, и последующая децеллюляризация позволили получить трехмерный скаффолд, способствующий адгезии и пролиферации клеток, а также ангиогенезу in vivo (Chiang et al., 2021).
Кроме того, отметим потенциал техники ко-культивирования: с помощью смешанной культуры фибробластов и остеобластов был получен ВКМ, который превосходил матриксы каждой из клеточных линий в отдельности по способности стимулировать остеогенную дифференцировку in vitro и поддерживать регенерацию кости in vivo (Li et al., 2020). Композицию ВКМ-КК также можно задавать, варьируя условия культивирования (Матвеева, Андреева, 2020); например, использование хондроиндуктивной среды при культивировании МСК позволило выделить ВКМ, воспроизводящий микроокружение на раннем этапе хондрогенеза, и полученный ВКМ был использован для создания гидрогеля, стимулирующего хондрогенез и формирование гиалинового хряща in vivo (Antich et al., 2021). Кроме того, в ВКМ-КК можно вводить дополнительные функциональные группы прямо в процессе культивирования: так, с помощью добавления в ростовую среду модифицированного моносахарида удалось получить ВКМ, содержащий азидные группы; используя высокоспецифичную биоортогональную клик-реакцию азид-алкинового циклоприсоединения, такому ВКМ можно легко придать желаемые свойства путем ковалентного введения сигнальных пептидов, ростовых факторов, антибиотиков или других молекул (Ruff et al., 2017). Еще один подход к кастомизации ВКМ-КК – культивирование клеток-продуцентов ВКМ на подложках с предзаданной топографией; например, было показано, что полученный таким образом нанопаттернированный ВКМ может изменять профиль экспрессии генов посеянных на него клеток и, в том числе, приводить к апрегуляции генов, связанных с хондрогенезом (Ozguldez et al., 2018).
Теперь перечислим недостатки ВКМ-КК. Во-первых, по сравнению с органами и тканями, при децеллюляризации культивируемых клеток получается небольшое количество материала, поэтому наработка ВКМ-КК для биомедицинского применения нуждается в масштабировании. Масштабное культивирование влечет за собой ряд трудностей, таких как потребность в соответствующей инфраструктуре (автоматизированное оборудование для культивирования, биобанки), необходимость стандартизации протоколов культивирования, культуральных сред и ростовых добавок, а также самих клеточных линий-продуцентов ВКМ; разумеется, надлежащее оснащение и собственно культивирование требуют и существенных финансовых затрат. Тем не менее, разработка оптимизированной технологии масштабирования теоретически позволила бы нарабатывать ВКМ желаемой композиции в неограниченных количествах (Chan et al., 2021). Заметим также, что в литературе описаны подходы к стимуляции депонирования ВКМ-КК – среди них культивирование в условиях гипоксии (Gilkes et al., 2013; Du et al., 2017), использование краудинг-агентов (Marinkovic et al., 2021) и ингибиторов матриксных металлопротеиназ (Han et al., 2016).
Во-вторых, ВКМ-КК уступают ВКМ нативных тканей по своим физико-механическим характеристикам. Среди возможных способов преодоления этого недостатка можно упомянуть введение сшивок в структуру ВКМ-КК (Nyambat et al., 2020), а также создание композитных материалов, в которых необходимые деформационно-прочностные параметры воспроизводятся синтетическими полимерами, а специфически биологические свойства задаются ВКМ культивируемых клеток. Так, поликапролактоновый скаффолд был модифицирован ВКМ ко-культивируемых МСК и эндотелия пупочной вены; получившийся композит не потерял своих механических свойств и был способен поддерживать пролиферацию и остеогенную дифференцировку засеянных в него клеток (Carvalho et al., 2019).
ПОТЕНЦИАЛ ИСПОЛЬЗОВАНИЯ ВКМ-КК
Дадим характеристику основным направлениям биомедицинского приложения ВКМ-КК.
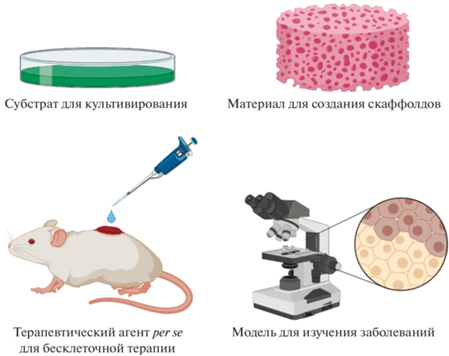
Субстрат для культивирования. Очевидно, что стандартное культивирование на пластике не является в полной мере физиологически релевантным. ВКМ in vivo оказывает существенное влияние на клеточную физиологию, поскольку он имеет оптимальную жесткость, определяет полярность и морфологические особенности клеток, формирует специфическое микроокружение. Лишенные естественных условий, клетки в культуре демонстрируют хромосомную нестабильность, утрачивают дифференцировочный потенциал и претерпевают преждевременное старение. Эти проблемы актуальны, прежде всего, при наработке большого количества клеток для терапевтического применения, когда клетки в течение длительного времени проводятся через серию пассажей. По сравнению с пластиком, ВКМ-КК представляется более физиологичным субстратом для культивирования. В ряде работ было показано, что культивирование на ВКМ-КК стимулирует пролиферацию и миграцию (Lin et al., 2012) и вызывает апрегуляцию соответствующих генов (Ragelle et al., 2017), поддерживает стволовость (Lai et al., 2010), способствует дифференцировке в различных направлениях (Rao Pattabhi et al., 2014; Novoseletskaya et al., 2020) и приводит к омоложению культивируемых клеток (Choi et al., 2011; Joergensen, Rattan, 2014; Yu et al., 2019). Кроме того, ВКМ-КК может применяться как субстрат для бесфидерного культивирования ИПС и ЭСК. Собственно говоря, широко используемый в этих целях коммерческий субстрат Матригель представляет собой ВКМ мышиной саркомы; вместе с тем было показано, что в качестве субстрата для ИПС могут использоваться децеллюляризованные матриксы и других клеточных культур, таких как линия человеческой хориосаркомы и МСК пульпы зуба (Vuoristo et al., 2013; Chen et al., 2015).
Использование в тканевой инженерии и регенеративной медицине. В ряде исследований показано, что ВКМ-КК является перспективным материалом для инженерии костей (Cheng et al., 2014; Li et al., 2020; Junka, Yu, 2020; He et al., 2021), хрящей (Dikina et al., 2017; Tang et al., 2019; Zhu et al., 2021; Antich et al., 2021) и скелетных мышц (Zhang et al., 2020), причем в качестве источника ВКМ для этих нужд зачастую используются МСК. ВКМ фибробластов был применен для создания композитных тканеинженерных трансплантатов сосудов (L’Heureux et al., 2006), сердечных клапанов (Weber et al., 2013) и скаффолда для постинфарктной клеточной терапии (Kim et al., 2019). Изучается возможность употребления ВКМ-КК в регенеративной эндодонтии (Aksel et al., 2022).
ВКМ-КК может использоваться не только как основа для скаффолдов, служащих для доставки культивируемых клеток в организм пациента, но и как терапевтическое средство per se, стимулирующее репаративные процессы за счет активации эндогенных клеток. Протеомный анализ матриксов клеточных культур показал, что они содержат белки, вовлеченные в регуляцию иммунных процессов, пролиферации, дифференцировки, миграции, адгезии и ангиогенеза (Ragelle et al., 2017; Li et al., 2020), и терапевтический эффект апплицированного к поврежденной ткани ВКМ, по всей видимости, связан с его деградацией в месте повреждения и высвобождением его биоактивных компонентов (Lee et al., 2019). В этом контексте, применение ВКМ-КК можно считать разновидностью бесклеточной терапии (cell-free therapy). Так, было продемонстрировано, что ВКМ астроцитов и нейральных стволовых клеток может стимулировать регенерацию спинного мозга и препятствовать воспалению при его травмах (Thompson et al., 2018; Chen et al., 2022); ВКМ культивируемых шванновских клеток был применен для восстановления поврежденных нервов (Gu et al., 2014); было показано, что ВКМ стволовых клеток жировой ткани и МСК костного мозга обладают ранозаживляющими свойствами (Du et al., 2017; Lee et al., 2019); был запатентован скаффолд на основе ВКМ сердечных фибробластов для лечения ишемической болезни сердца, который может применяться и как средство для трансплантации клеток, и как самостоятельный терапевтический агент (Schmuck, Raval, 2016). В нашей стране разработан и запатентован способ получения бесклеточного матрикса на основе децеллюляризованных клеточных пластов МСК жировой ткани, предназначенного для стимуляции регенеративных процессов (Нимирицкий и др., 2016; Ткачук и др., 2020).
Модель для исследования заболеваний. Известно, что при целом ряде патологических состояний (нейродегенеративные и онкологические заболевания, остеоартрит, фиброз и др.) имеет место аномальное ремоделирование ВКМ, включающее в себя количественные и качественные изменения состава ВКМ, перестройку нативной архитектуры ткани, нарушение динамического равновесия между деградацией и синтезом ВКМ, изменение жесткости ВКМ (Sonbol, 2018; Theocharis et al., 2019). Поскольку ВКМ всесторонним образом контролирует клеточные функции, аномальное ремоделирование нарушает функциональность тканей и усугубляет течение болезни. Таким образом, установление роли ВКМ в патогенетических механизмах тех или иных заболеваний может послужить основой для разработки новых способов диагностики или поиска терапевтических мишеней (Rubi-Sans et al., 2020). В этой связи, например, большой интерес представляет ВКМ как компонент опухолевой ниши, способствующий прогрессии опухоли и метастазированию (Xiong, Xu, 2016). В качестве модели для изучения опухолевого микроокружения наряду с ВКМ злокачественных тканей используют и ВКМ, синтезированный линиями опухолевых клеток; хотя ВКМ-КК не может в полной мере воспроизвести микроокружение опухолевой ткани, это методологически удобная, масштабируемая модель для in vitro исследований (Hoshiba, 2019). Помимо двухмерных моделей опухолевой ниши также ведутся разработки трехмерных искусственных опухолей на основе ВКМ-КК (Malakpour-Permlid et al., 2021); так, с помощью полилактидного скаффолда, модифицированного ВКМ МСК жировой ткани, была создана макроскопическая (более сантиметра) трехмерная модель опухоли, схожая по фибриллярной структуре и механическим характеристикам с опухолевой тканью и повышающая устойчивость заселенных опухолевых клеток к доксорубицину (Rubi-Sans et al., 2021). ВКМ-КК, а именно ВКМ клеток трабекулярной сети (HTMC), также используется для изучения роли ВКМ в развитии глаукомы (Raghunathan, 2018). Децеллюляризованным матриксом фибробластов удалось модифицировать микрофлюидное устройство (Hong et al., 2017), и такой подход в перспективе может быть использован в создании “органов-на-чипе” для учета микроокружения, создаваемого внеклеточным матриксом, при моделировании заболеваний или скрининге лекарственных соединений (в том числе персонализированном).
ЗАКЛЮЧЕНИЕ
Культивируемые клетки представляются привлекательной альтернативой органам и тканям – традиционным источникам ВКМ. Основным преимуществом ВКМ-КК является возможность задания свойств ВКМ в контролируемых условиях, причем конструирование ВКМ может опираться не только на богатый опыт клеточной биологии, но и на достижения из других дисциплин. Публикации последних лет демонстрируют, что ВКМ-КК потенциально могут быть применены для решения широкого спектра биомедицинских задач. Тем не менее, связанные с ВКМ-КК исследования пока что проводятся только на клеточных и животных моделях. По всей видимости, переход к клиническим испытаниям сдерживается малым выходом ВКМ, получаемого из культивируемых клеток, и трансляция ВКМ-КК в клинику потребует решения соответствующей задачи масштабирования.
Список литературы
Матвеева Д.К., Андреева Е.Р. 2020. Регуляторная активность децеллюляризованного матрикса мультипотентных мезенхимных стромальных клеток. Цитология. Т. 62. № 10. С. 699. (Matveeva D.K., Andreeva E.R. 2020. Regulatory Activity of Decellularized Matrix of Multipotent Mesenchymal Stromal Cells. Tsitologia. V. 62. № 10. P. 699.) https://doi.org/10.31857/S004137712010003X
Нимирицкий П.П., Дусь Т.А., Григорьева О.А., Сагарадзе Г.Д., Ефименко А.Ю., Макаревич П.И. 2016. Клеточные пласты из мезенхимных стромальных клеток жировой ткани человека и получение препаратов внеклеточного матрикса методом децеллюляризации. Технологии живых систем. Т. 13. № 6. С. 4. (Nimiritskiy P.P., Dus’ T.A., Grigor’eva O.A., Sagaradze G.D., Efimenko A.Yu., Makarevich P.I. 2016. Cell sheets from human adipose tissue mesenchymal stromal cells and derivation of decellularized native extracellular matrix components. Tekhnologii zhivykh sistem = Technologies of living systems. V. 13. № 6. P. 4.)
Ткачук В.А., Акопян Ж.А., Ефименко А.Ю., Григорьева О.А., Макаревич П.И., Нимирицкий П.П., Новоселецкая Е.С. 2020. Пат. 2718907С1 Российская Федерация, МПК A61K35/28 C12N5/775. Биоматериал на основе бесклеточного матрикса, производимого мезенхимными стромальными клетками человека, способ его получения и способ применения для стимуляции регенеративных процессов / заявитель и патентообладатель ФГБОУ ВО “Московский государственный университет имени М.В. Ломоносова” (МГУ). № 2018143484; заявл. 07.12.2018; опубл. 15.04.2020, Бюл. № 11. (Tkachuk V.A., Akopyan Zh.A., Efimenko A.Yu., Grigoreva O.A., Makarevich P.I., Nimiritskij P.P., Novoseletskaya E.S. 2020. Invention 2718907С1 Russian Federation, Int. Cl. A61K35/28 C12N5/775. Biomaterial based on cell-free matrix produced by human mesenchymal stromal cells, method for preparing thereof and method of using thereof to stimulate regenerative processes. / proprietor FGBOU VO “Moskovskij gosudarstvennyj universitet imeni M.V. Lomonosova” (MGU) № 2018143484; date of filing 07.12.2018; date of publication 15.04.2020, Bull. № 11.)
Aksel H., Sarkar D., Lin M.H., Buck A., Huang G.T. 2022. Cell-derived Extracellular Matrix Proteins in Colloidal Microgel as a Self-Assembly Hydrogel for Regenerative Endodontics. J. Endod. V. 48. P. 527. https://doi.org/10.1016/j.joen.2022.01.011
Antich C., Jiménez G., de Vicente J., López-Ruiz E., Chocarro-Wrona C., Griñán-Lisón C., Carrillo E., Montañez E., Marchal J.A. 2021. Development of a biomimetic hydrogel based on predifferentiated mesenchymal stem-cell-derived ECM for cartilage tissue engineering. Adv. Healthc. Mater. V. 10. P. e2001847. https://doi.org/10.1002/adhm.202001847
Assunção M., Dehghan-Baniani D., Yiu C.H.K., Später T., Beyer S., Blocki A. 2020. Cell-derived extracellular matrix for tissue engineering and regenerative medicine. Front. Bioeng. Biotechnol. V. 8. P. 602009. https://doi.org/10.3389/fbioe.2020.602009
Carvalho M.S., Silva J.C., Udangawa R. N., Cabral J.M.S., Ferreira F.C., da Silva C.L., Linhardt R.J., Vashishth D. 2019. Co-culture cell-derived extracellular matrix loadedelectrospunmicrofibrous scaffolds for bone tissue engineering. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 99. P. 479. https://doi.org/10.1016/j.msec.2019.01.127
Chan W.W., Yu F., Le Q.B., Chen S., Yee M., Choudhury D. 2021. Towards Biomanufacturing of cell-derived matrices. Int. J. Mol. Sci. V. 22. P. 11929. https://doi.org/10.3390/ijms222111929
Chen Y., Zheng Y.L., Qiu D.B., Sun Y.P., Kuang S.J., Xu Y., He F., Gong Y.H., Zhang Z. G.2015. An extracellular matrix culture system for induced pluripotent stem cells derived from human dental pulp cells. Eur. Rev. Med. Pharmacol. Sci. V. 19. P. 4035.
Chen Z., Wang L., Chen C.,Sun J., Luo J., Cui W., Zhu C., Zhou X., Liu X., Yang H., Shi Q. 2022. NSC-derived extracellular matrix-modified GelMA hydrogel fibrous scaffolds for spinal cord injury repair. NPG Asia Mater. V. 14. P. 20. https://doi.org/10.1038/s41427-022-00368-6
Cheng C.W., Solorio L.D., Alsberg E. 2014. Decellularized tissue and cell-derived extracellular matrices as scaffolds for orthopaedic tissue engineering. Biotechnol. Adv. V. 32. P. 462. https://doi.org/10.1016/j.biotechadv.2013.12.012
Chiang C.-E., Fang Y.-Q., Ho C.-T., Assunção M., Lin S.-J., Wang Y.-C., Blocki A., Huang C.-C. 2021. Bioactive Decellularized Extracellular Matrix Derived from 3D Stem Cell Spheroids under Macromolecular Crowding Serves as a Scaffold for Tissue Engineering. Adv. Healthcare Mater. V. 10. P. 2100024. https://doi.org/10.1002/adhm.202100024
Choi H.R., Cho K.A., Kang H.T., Lee J.B., Kaeberlein M., Suh Y., Chung I.K., Park S.C. 2011. Restoration of senescent human diploid fibroblasts by modulation of the extracellular matrix. Aging Cell. V. 10. P. 148. https://doi.org/10.1111/j.1474-9726.2010.00654.x
Dikina A.D., Almeida H.V., Cao M., Kelly D.J., Alsberg E. 2017. Scaffolds derived from ECM produced by chondrogenically induced human MSC condensates support human MSC chondrogenesis. ACS Biomater. Sci. Eng. V. 3. P. 1426. https://doi.org/10.1021/acsbiomaterials.6b00654
Du H.-C., Jiang L., Geng W.-X., Li J., Zhang R., Dang J.-G., Shu M.-G., Li L.-W. 2017. Evaluation of xenogeneic extracellular matrix fabricated from CuCl2-conditioned mesenchymal stem cell sheets as a bioactive wound dressing material. J. Biomater. Appl. V. 32(4). P. 472. https://doi.org/10.1177/0885328217731951
Gilkes D.M., Bajpai S., Chaturvedi P., Wirtz D., Semenza G.L. 2013. Hypoxia-inducible factor 1 (HIF-1) promotes extracellular matrix remodeling under hypoxic conditions by inducing P4HA1, P4HA2, and PLOD2 expression in fibroblasts. J. Biol. Chem. V. 288. P. 10819. https://doi.org/10.1074/jbc.M112.442939
Grant R., Hay D., Callanan A. 2018. From scaffold to structure: the synthetic production of cell derived extracellular matrix for liver tissue engineering. Biomed. Phys. Eng. Express. V. 4. P. 065015. https://doi.org/10.1088/2057-1976/aacbe1
Gu Y., Zhu J., Xue C., Li Z., Ding F., Yang Y., Gu X. 2014. Chitosan/silk fibroin-based, Schwann cell-derived extracellular matrix-modified scaffolds for bridging rat sciatic nerve gaps. Biomaterials. V. 35. P. 2253. https://doi.org/10.1016/j.biomaterials.2013.11.087
Han S., Li Y.Y., Chan B.P. 2016. Extracellular protease inhibition alters the phenotype of chondrogenically differentiating human mesenchymal stem cells (MSCs) in 3D collagen microspheres. PLoS One. V. 11. P. e0146928. https://doi.org/10.1371/journal.pone.0146928
He S.K., Ning L.J., Yao X., Hu R.N., Cui J., Zhang Y., Ding W., Luo J.C., Qin T.W. 2021. Hierarchically demineralized cortical bone combined with stem cell-derived extracellular matrix for regeneration of the tendon-bone interface. Am. J. Sports Med. V. 49. P. 1323. https://doi.org/10.1177/0363546521994511
Hong Y., Koh I., Park K., Kim P. 2017. On-Chip fabrication of a cell-derived extracellular matrix sheet. ACS Biomater. Sci. Eng. V. 3. P. 3546. https://doi.org/10.1021/acsbiomaterials.7b00613
Hoshiba T. 2019. Decellularized extracellular matrix for cancer research. Materials (Basel). V. 12. P.1311. https://doi.org/10.3390/ma12081311
Joergensen P., Rattan S.I.S. 2014. Extracellular matrix modulates morphology, growth, oxidative stress response and functionality of human skin fibroblasts during aging in vitro. J. Aging Sci. V. 2. P. 122. https://doi.org/10.4172/2329-8847.1000122
Junka R., Yu X. 2020. Polymeric nanofibrous scaffolds laden with cell-derived extracellular matrix for bone regeneration. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 113. P. 110 981. https://doi.org/10.1016/j.msec.2020.110981
Kim I.G., Hwang M.P., Park J.S., Kim S.H., Kim J.H., Kang H.J., Subbiah R., Ko U.H., Shin J.H., Kim C.H., Choi D., Park K. 2019. Stretchable ECM patch enhances stem cell delivery for post-MI cardiovascular repair. Adv. Healthc. Mater. V. 8. P. e1900593. https://doi.org/10.1002/adhm.201900593
Konofaos P., Szpalski C., Rogers G.F., Rae M.M., Bumgardner J., Warren S.M. 2017. Biomaterials and their application in craniomaxillofacial surgery. Comprehensive Biomat. II. V. 7. P. 406. https://doi.org/10.1016/B978-0-12-803581-8.10166-3
Kusuma G.D., Brennecke S.P., O’Connor A.J., Kalionis B., Heath D.E. 2017. Decellularized extracellular matrices produced from immortal cell lines derived from different parts of the placenta support primary mesenchymal stem cell expansion. PLoS One. V. 12(2). P. e0171488. https://doi.org/10.1371/journal.pone.0171488
Lai Y., Sun Y., Skinner C.M., Son E.L., Lu Z., Tuan R.S., Jilka R.L., Ling J., Chen X.D. 2010. Reconstitution of marrow-derived extracellular matrix ex vivo: a robust culture system for expanding large-scale highly functional human mesenchymal stem cells. Stem Cells Dev. V. 19. P. 1095. https://doi.org/10.1089/scd.2009.0217
Lee Y.J., Baek S.E., Lee S., Cho Y.W., Jeong Y.J., Kim K.J., Jun Y.J., Rhie J.W. 2019. Wound-healing effect of adipose stem cell-derived extracellular matrix sheet on full-thickness skin defect rat model: histological and immunohistochemical study [published correction appears in Int. Wound J. 2019. V. 16. P. 873]. Int. Wound J. V. 16. P. 286. https://doi.org/10.1111/iwj.13030
L’Heureux N., Dusserre N., Konig G., Victor B., Keire P., Wight T.N., Chronos N.A., Kyles A.E., Gregory C.R., Hoyt G., Robbins R.C., McAllister T.N. 2006. Human tissue-engineered blood vessels for adult arterial revascularization. Nat. Med. V. 12. P. 361. https://doi.org/10.1038/nm1364
Li M., Zhang A., Li J., Zhou J., Zheng Y., Zhang C., Xia D., Mao H., Zhao J. 2020. Osteoblast/fibroblast coculture derived bioactive ECM with unique matrisome profile facilitates bone regeneration. Bioact. Mater. V. 5. P. 938. https://doi.org/10.1016/j.bioactmat.2020.06.017
Lin H., Yang G., Tan J., Tuan R.S. 2012. Influence of decellularized matrix derived from human mesenchymal stem cells on their proliferation, migration and multi-lineage differentiation potential. Biomaterials. V. 33. P. 4480. https://doi.org/10.1016/j.biomaterials.2012.03.012
Malakpour-Permlid A., Buzzi I., Hegardt C., Johansson F., Oredsson S. 2021. Identification of extracellular matrix proteins secreted by human dermal fibroblasts cultured in 3D electrospun scaffolds. Sci. Rep. V. 11. P. 6655. https://doi.org/10.1038/s41598-021-85742-0
Marinkovic M., Sridharan R., Santarella F., Smith A., Garlick J.A., Kearney C.J. 2021. Optimization of extracellular matrix production from human induced pluripotent stem cell-derived fibroblasts for scaffold fabrication for application in wound healing. J. Biomed. Mater. Res. A. V. 109. P. 1803. https://doi.org/10.1002/jbm.a.37173
Massaro M.S., Pálek R., Rosendorf J., Červenková L., Liška V., Moulisová V. 2021. Decellularized xenogeneic scaffolds in transplantation and tissue engineering: Immunogenicity versus positive cell stimulation. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 127. P. 112203. https://doi.org/10.1016/j.msec.2021.112203
Methe K. 2020. Transplantation of normal and decellularized syngeneic, allogeneic and xenogeneic cardiac tissue in mice and non-human primates. Doctoral thesis. University of Gothenburg. Sahlgrenska Academy.
Nellinger S., Mrsic I., Keller S., Heine S., Southan A., Bach M., Volz A.C., Chassé T., Kluger P.J. 2022. Cell-derived and enzyme-based decellularized extracellular matrix exhibit compositional and structural differences that are relevant for its use as a biomaterial. Biotechnol. Bioeng. V. 119. P. 1142. https://doi.org/10.1002/bit.28047
Novoseletskaya E., Grigorieva O., Nimiritsky P.,Basalova N., Eremichev R., Milovskaya I., Kulebyakin K., Kulebyakina M., Rodionov S., Omelyanenko N., Efimenko A. 2020. Mesenchymal stromal cell-produced components of extracellular matrix potentiate multipotent stem cell response to differentiation stimuli. Front. Cell Dev. Biol. V. 8. P. 555378. https://doi.org/10.3389/fcell.2020.555378
Nyambat B., Manga Y.B., Chen C.H., Gankhuyag U., PratomoWp A., Kumar Satapathy M., Chuang E.Y. 2020. New insight into natural extracellular matrix: genipin cross-linked adipose-derived stem cell extracellular matrix gel for tissue engineering. Int. J. Mol. Sci. V. 21. P. 4864. https://doi.org/10.3390/ijms21144864
Ozguldez H.O., Cha J., Hong Y., Koh I., Kim P. 2018. Nanoengineered, cell-derived extracellular matrix influences ECM-related gene expression of mesenchymal stem cells. Biomater. Res. V. 22. P. 32. https://doi.org/10.1186/s40824-018-0141-y
Parmaksiz M., Dogan A., Odabas S., Elçin A.E., Elçin Y.M. 2016. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomed. Mater. V. 11. P. 022003. https://doi.org/10.1088/1748-6041/11/2/022003
Ragelle H., Naba A., Larson B.L., Zhou F., Prijić M., Whittaker C.A., Del Rosario A., Langer R., Hynes R.O., Anderson D.G. 2017. Comprehensive proteomic characterization of stem cell-derived extracellular matrices. Biomaterials. V. 128. P. 147. https://doi.org/10.1016/j.biomaterials.2017.03.008
Raghunathan V.K. 2018. Cell-derived matrices as a model to study ocular hypertension. In: Glaucoma Research and Clinical Advances: 2018 to 2020. Amsterdam: Kugler Publications. P. 69.
Rao Pattabhi S., Martinez J.S., Keller T.C. 3rd. 2014. Decellularized ECM effects on human mesenchymal stem cell stemness and differentiation. Differentiation. V. 88. P. 131. https://doi.org/10.1016/j.diff.2014.12.005
Rubi-Sans G., Castaño O., Cano I., Mateos-Timoneda M.A., Perez-Amodio S., Engel E. 2020. Engineering cell-derived matrices: from 3D models to advanced personalized therapies. Adv. Funct. Mater. V. 30. P. 2000496. https://doi.org/10.1002/adfm.202000496
Rubí-Sans G., Nyga A., Rebollo E., Pérez-Amodio S., Otero J., Navajas D., Mateos-Timoneda M.A., Engel E. 2021. Development of cell-derived matrices for three-dimensional in vitro cancer cell Models. ACS Appl. Mater. Interfaces. V. 13. P. 44108. https://doi.org/10.1021/acsami.1c13630
Ruff S.M., Keller S., Wieland D.E.,Wittmann V., Tovar G.E.M., Bach M., Kluge P.J. 2017. clickECM: Development of a cell-derived extracellular matrix with azide functionalities. ActaBiomater. V. 52. P. 159. https://doi.org/10.1016/j.actbio.2016.12.022
Schmuck E., Raval A. 2016. Cardiac fibroblast-derived extracellular matrix and injectable formulations thereof for treatment of ischemic disease or injury. Int. Publ. Number WO2016197038A1
Shamis Y., Hewitt K.J., Bear S.E., Alt-Holland A., Qari H., Margvelashvilli M., Knight E.B., Smith A., Garlick J.A. 2012. iPSC-derived fibroblasts demonstrate augmented production and assembly of extracellular matrix proteins. In vitro Cell Dev. Biol. Anim. V. 48. P. 112. https://doi.org/10.1007/s11626-011-9478-4
Sicari B.M., Rubin J.P., Dearth C.L., Wolf M.T., Ambrosio F., Boninger M., Turner N.J., Weber D.J., Simpson T.W., Wyse A., Brown E.H.P., Dziki J.L., Fisher L.E., Brown S., Badylak S.F. 2014. An acellular biologic scaffold promotes skeletal muscle formation in mice and humans with volumetric muscle loss. Sci. Transl. Med. V. 6. P. 234ra58. https://doi.org/10.1126/scitranslmed.3008085
Sonbol H.S. 2018. Extracellular matrix remodeling in human disease. J. Microsc. Ultrastruct. V. 6. P. 123. https://doi.org/10.4103/JMAU.JMAU_4_18
Tang C., Jin C., Li X., Li J., Du X., Yan C., Lu S., Wei B., Xu Y., Wang L. 2019. Evaluation of an autologous bone mesenchymal stem cell-derived extracellular matrix scaffold in a rabbit and minipig model of cartilage repair. Med. Sci. Monit. V. 25. P. 7342. https://doi.org/10.12659/MSM.916481
Theocharis A.D., Manou D., Karamanos N.K. 2019. The extracellular matrix as a multitasking player in disease. FEBS J. V. 286. P. 2830. https://doi.org/10.1111/febs.14818
Thompson R.E., Pardieck J., Smith L., Kenny P., Crawford L., Shoichet M., Sakiyama-Elbert S. 2018. Effect of hyaluronic acid hydrogels containing astrocyte-derived extracellular matrix and/or V2a interneurons on histologic outcomes following spinal cord injury. Biomaterials. V. 162. P. 208. https://doi.org/10.1016/j.biomaterials.2018.02.013
Vuoristo S., Toivonen S., Weltner J., Mikkola M., Ustinov J., Trokovic R., Palgi J., Lund R., Tuuri T., Otonkoski T. 2013. A novel feeder-free culture system for human pluripotent stem cell culture and induced pluripotent stem cell derivation. PLoS One. V. 8. P. e76205. https://doi.org/10.1371/journal.pone.0076205
Weber B., Dijkman P.E., Scherman J., Sanders B., Emmert M.Y., Grünenfelder J., Verbeek R., Bracher M., Black M., Franz T., Kortsmit J., Modregger P., Peter S., Stampanoni M., Robert J. et al. 2013. Off-the-shelf human decellularized tissue-engineered heart valves in a non-human primate model. Biomaterials. V. 34. P. 7269. https://doi.org/10.1016/j.biomaterials.2013.04.059
Xiong G.F., Xu R. 2016. Function of cancer cell-derived extracellular matrix in tumor progression. J. Cancer Metastasis Treat. V. 2. P. 357. https://doi.org/10.20517/2394-4722.2016.08
Yu X., He Y., Chen Z., Qian Y., Wang J., Ji Z., Tan X., Li L., Lin M. 2019. Autologous decellularized extracellular matrix protects against H2O2-induced senescence and aging in adipose-derived stem cells and stimulates proliferation in vitro. Biosci. Rep. V. 39. P. BSR20182137. https://doi.org/10.1042/BSR20182137
Zhang X., Liu Y., Clark K.L., Padget A.M., Alexander P.G., Dai J., Zhu W., Lin H. 2020. Mesenchymal stem cell-derived extracellular matrix (mECM): a bioactive and versatile scaffold for musculoskeletal tissue engineering. Biomed. Mater. V. 16. P. 012002. https://doi.org/10.1088/1748-605X/abb6b3
Zhu W., Cao L., Song C., Pang Z., Jiang H., Guo C. 2021. Cell-derived decellularized extracellular matrix scaffolds for articular cartilage repair. Int. J. Artif. Organs. V. 44. P. 269. https://doi.org/10.1177/0391398820953866
Дополнительные материалы отсутствуют.