Доклады Российской академии наук. Физика, технические науки, 2021, T. 500, № 1, стр. 26-33
АНАЛИЗ ПРИРОДНЫХ И СИНТЕТИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ПОЛИЕНОВЫЕ ЦЕПИ, МЕТОДОМ СПЕКТРОСКОПИИ КОМБИНАЦИОННОГО РАССЕЯНИЯ
В. С. Новиков 1, *, С. М. Кузнецов 1, В. В. Кузьмин 1, К. А. Прохоров 1, Е. А. Сагитова 1, М. Е. Дарвин 2, Ю. Ладеманн 2, Л. Ю. Устынюк 3, Г. Ю. Николаева 1
1 Институт общей физики им. А.М. Прохорова Российской академии наук
Москва, Россия
2 Charité – Universitätsmedizin Berlin, Corporate Member
of Freie Universität Berlin and Humboldt-Universität
zu Berlin, Department of Dermatology, Venerology
and Allergology, Center of Experimental and Applied Cutaneous Physiology
Berlin, Germany
3 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
* E-mail: vs.novikov@kapella.gpi.ru
Поступила в редакцию 28.07.2021
После доработки 28.07.2021
Принята к публикации 02.08.2021
Аннотация
Проведен теоретический анализ зависимости спектров комбинационного рассеяния молекул, содержащих полиеновые цепи, от длины сопряжения, структуры боковых и концевых групп и типа изомера.
ВВЕДЕНИЕ
Наличие в структуре молекулы полиеновой цепи объединяет, казалось бы, абсолютно разные вещества: природные соединения каротиноиды и синтетический полимер поливинилхлорид (ПВХ), подвергнутый деградации (например, УФ-облучению или нагреванию).
Каротиноиды жизненно необходимы человеку, так как эти вещества выполняют защитные функции антиоксидантов и нейтрализуют свободные радикалы в организме человека, обладают провитаминными, иммуностимулирующими и лечебно-профилактическими свойствами [1, 2]. Каротиноиды не синтезируются в организме человека и поступают в него только с пищей (в основном, с овощами и фруктами), а также в составе биодобавок, лечебных и косметических средств для наружного применения.
Свойства каротиноидов (провитаминная активность, биодоступность, антиоксидантные свойства) зависят как от химической структуры молекулы, так и от изомерного состава молекул каждого каротиноида [1, 3, 4]. Изомерный состав каротиноидов может меняться под воздействием внешних факторов, например, УФ-облучения или нагревания. Ввиду этого очень важно определять не только содержание и химический состав, но и изомерный состав каротиноидов в биотканях, продуктах питания, лекарственных препаратах.
ПВХ широко используется во многих сферах деятельности человека, в том числе для производства строительных материалов, изоляции кабелей, одноразовых медицинских изделий и искусственной кожи [5, 6]. Однако под воздействием УФ-излучения или повышенной температуры вследствие выделения хлористого водорода (HCl) в ПВХ образуются полиены [5–9]. Содержание и распределение по длинам полиенов в ПВХ зависит от способа деградации и значительно влияет на свойства (электрические, оптические, механические) этого полимера [5–9]. Признаком образования полиенов в ПВХ является изменение цвета (пожелтение) полимера, которое начинает наблюдаться, когда потери HCl достигают 0.1% [7]. Для изучения процессов деградации и улучшения эксплуатационных свойств ПВХ необходимы более точные методы определения содержания и распределения по длинам полиенов – при потерях HCl от 0.0001% [7].
Таким образом, актуальной задачей является структурный анализ природных и синтетических соединений, содержащих полиены. Такой анализ может быть эффективно проведен методом спектроскопии комбинационного рассеяния (КР) света, так как резонансное усиление интенсивности линий КР полиенов при возбуждении спектров излучением с длиной волны в видимой области позволяет детектировать полиены в очень малых концентрациях (при потерях HCl менее 0.0001% в случае ПВХ) [7]. При возбуждении спектров КР лазерным излучением с определенной длиной волны резонансные условия оптимальны для полиенов с конкретной длиной [9], и это дает возможность селективно исследовать полиены разной длины [5].
Спектроскопия КР света – это высокоинформативный и неразрушающий метод анализа молекулярных веществ [10]. В настоящее время спектроскопия КР все чаще используется для исследования биотканей, анализа состава и качества пищевых продуктов, лекарственных и косметических препаратов, структуры полимерных изделий и степени их деградации в процессе эксплуатации, во многих других практических применениях. Этот метод также применялся при исследовании каротиноидов в чистом виде, биотканей [11, 12] и ПВХ, подвергнутого термо- и фотодеградации [5, 9, 13]. Как для каротиноидов [14], так и для деградированного ПВХ [13] были предложены феноменологические формулы, связывающие частоту валентного колебания C=C- связей и длину полиена. Интересно, что традиционно для этих двух классов веществ для оценки длины полиенов используются разные зависимости: экспоненциальная для ПВХ и гиперболическая для каротиноидов [13, 14].
До настоящего времени остаются нерешенными многие задачи спектроскопии КР молекул, содержащих полиеновые цепи. В частности, мало исследована зависимость спектров КР каротиноидов от изомерного состава молекул, и практически нет данных о зависимости спектров КР каротиноидов от наличия боковых и концевых групп. Для ПВХ нет данных о влиянии на линии полиенов колебаний участков молекул ПВХ, которые расположены с двух сторон от полиеновой цепи и могут иметь как разную длину, так и разный конфигурационный состав.
Теоретическое исследование спектров КР каротиноидов является очень полезным вследствие крайне низкой фото-, термо- и окислительной стабильности этих соединений. Кроме того, получение изомеров каротиноидов в чистом виде для экспериментальных исследований является трудоемкой и дорогостоящей процедурой.
Моделирование спектров КР полиенов, встроенных в молекулу ПВХ, является очень важной задачей, так как на практике невозможно приготовить образец ПВХ, в котором содержались бы полиены одной длины или с заданным распределением полиенов по длинам.
Целью данной работы являлось изучение влияния длины сопряжения, структуры боковых и концевых групп, а также типа изомера полиена на спектр КР молекул, содержащих полиеновые цепи.
ЭКСПЕРИМЕНТАЛЬНЫЕ ИЗМЕРЕНИЯ И МОДЕЛИРОВАНИЕ
Были зарегистрированы экспериментальные спектры КР β-каротина и биотканей, содержащих каротиноиды: моркови, листа растения Crassula ovata и рогового слоя кожи ладони человека. Кроме того, был записан спектр КР ПВХ, подвергнутого УФ-облучению и содержащего вследствие фотодеструкции полиены различной длины.
Спектры КР коммерческого кристаллического порошка β-каротина и кожи были записаны при использовании конфокальных микроскопов [15] при длинах волн возбуждающего излучения соответственно 473 и 514 нм. Для регистрации спектров КР деградированного ПВХ, листа и моркови использовался двойной монохроматор U1000 (Jobin Yvon, France) [16] и возбуждающее излучение с длиной волны 532 нм. Спектральное разрешение составляло 4–5 см–1.
Для моделирования структуры и спектров КР всех исследуемых молекул использовалась теория функционала плотности (ТФП). Расчеты проводились в некоммерческой программе “Природа” с использованием функционала OLYP и расширенного базиса гауссова типа (4z.bas) [16, 17]. Для учета конечной ширины линий в экспериментальных спектрах к рассчитанным спектрам применялась процедура уширения [16]. Для исключения из теоретического анализа зависимости интенсивностей линий КР от длины волны возбуждающего излучения, рассчитывались значения Raman Scattering Activity (R.S.A., формула (4) из работы [16]).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 показаны экспериментальные спектры КР кристаллического β-каротина, моркови, листа Crassula ovata, кожи человека и деградированного ПВХ. Все эти спектры объединяет наличие двух интенсивных линий КР, соответствующих валентным колебаниям С–С- и С=С-связей в полиенах и наблюдающихся около 1150 и 1520 см–1 соответственно. Малоинтенсивная линия около 1000 см–1 отвечает деформационным колебаниям боковых СН3-групп в каротиноидах.
Рис. 1.
Экспериментальные спектры КР деградированного ПВХ (длина волны возбуждения 532 нм), рогового слоя кожи человека in vivo (длина волны возбуждения 514 нм), листа растения Crassula ovata и моркови (длина волны возбуждения 532 нм) и кристаллического β-каротина (длина волны возбуждения 473 нм). На спектрах обозначены положения максимумов линий КР.

С целью определения зависимости спектров КР молекул, содержащих полиеновые цепи, от длины сопряжения и от структуры боковых и концевых групп на основе ТФП были рассчитаны структуры и спектры КР транс-изомеров ряда соединений: полиенов CH3(–CH=CH–)nCH3 различной длины n; молекулы β-каротина, содержащей полиен с 9 С=С-связями; модифицированных молекул β-каротина, в которых боковые или концевые группы замещались соответственно атомами H и CH3-группами; ликопина, α- и γ-каротинов. Кроме того, расчеты также проводились для полиенов с 9 С=С-связями, в которых концевые CH3-группы были заменены на группы (–CH2–CHCl–)kH, k = 3–6, т.е. последовательностями мономеров винилхлорида различной длины. Такая полиеновая цепь, встроенная в олигомер винилхлорида, представляет собой модель молекулы деградированного ПВХ.
При моделировании структуры и спектров КР молекулы ПВХ следует учитывать ее конфигурационный состав, т.е. расположение атомов хлора относительно углеродного скелета. Промышленный ПВХ является атактическим полимером, в котором атомы хлора расположены беспорядочно по одну и по другую сторону от углеродного скелета. С применением генератора случайных чисел была построена и оптимизирована структура атактического олигомера винилхлорида. Затем из этого олигомера удалили по 9 атомов H и Cl из центральной части каждого олигомера, моделируя таким способом образование полиенов в деградированном ПВХ. В качестве примера, рис. 2 демонстрирует рассчитанные структуры транс-изомеров полиена CH3(–CH=CH–)9CH3, β-каротина и полиенов с 9 С=С-связями, встроенных в олигомеры винилхлорида различной длины.
Рис. 2.
Рассчитанные структуры транс-изомеров полиена (n = 9), β-каротина, полиена (n = 9) с 3 и 4 мономерами винилхлорида на концах и полиена (n = 9) с 5 и 6 мономерами винилхлорида на концах.

На рис. 3 приведены рассчитанные зависимости частот валентных колебаний С–С- и С=С-связей в спектрах транс-изомеров полиенов от длины полиена n. Были проанализированы полиены с числом С=С-связей от 7 до 12, так как в этот диапазон попадают наиболее важные для жизнедеятельности человека каротиноиды. Из рис. 3 видно, что частоты валентных колебаний С–С- и С=С-связей уменьшаются с увеличением длины сопряжения в полиене. Полученная на основе ТФП зависимость для полиенов с n = 7–12 находится в согласии с экспериментальными данными из работ [14, 18].
Рис. 3.
Зависимость частот валентных колебаний C–C- и C=C-связей в рассчитанных спектрах КР от количества сопряженных C=C-связей для транс-изомеров следующих молекул: полиенов CH3(–CH=CH–)nCH3 (n = 7–12), α-, β-, γ-каротинов, ликопина, полиена (n = 9) с 3 и 4 мономерами винилхлорида на концах и полиена (n = 9) с 5 и 6 мономерами винилхлорида на концах. Для γ-каротина и ликопина наблюдается расщепление линии, отвечающей валентным колебаниям С–С-связи.

Частоты валентных колебаний С=С связей для полиенов, встроенных в олигомеры винилхлорида разной длины, и для ликопина совпадают с частотами для полиенов CH3(–CH=CH–)nCH3 (рис. 3). Этот результат подтверждает, что частота валентных колебаний С=С связей для транс-изомеров полиенов определяется, в основном, числом этих связей. В случае α-, β- и γ-каротинов частоты валентных колебаний С=С-связей меньше, чем частоты для полиенов. Этот результат объясняется тем, что С=С-связь в концевых группах (иононовых кольцах) этих каротиноидов находится в частичном сопряжении с полиеновой цепью, и, как следствие, длина сопряжения для этих каротиноидов больше, чем длина полиеновой цепи [14].
В области валентного колебания С–С-связей в спектрах полиенов, встроенных в олигомеры винилхлорида, и α- и β-каротинов наблюдается только одна интенсивная линия, в то время как для γ-каротина и ликопина – дублет интенсивных линий. Из рис. 3 видно, что частота валентного колебания С–С-связей сложным образом зависит от длины полиена, структуры концевых и боковых групп.
На рис. 4 приведены рассчитанные спектры КР полиена CH3(–CH=CH–)9CH3, полиенов с 9 С=С-связями, встроенных в олигомеры винилхлорида, β-каротина, модифицированных молекул β-каротина, в которых все боковые или все концевые группы замещались атомами H и CH3-группами соответственно.
Рис. 4.
Рассчитанные спектры КР транс-изомеров следующих молекул: полиена (n = 9) с различными концевыми группами (СН3-группами или последовательностями мономеров винилхлорида), β-каротина и модифицированных молекул β-каротина: 2e0s – концевые группы (иононовые кольца) заменены на CH3-группы; 0e4s – боковые CH3-группы заменены атомами водорода.
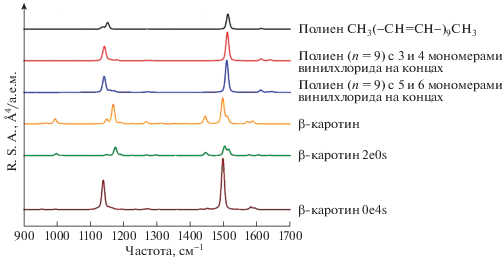
Из рис. 3 и 4 видно, что в спектрах полиена CH3(–CH=CH–)9CH3 и полиенов с 9 С=С-связями, встроенных в олигомеры винилхлорида, т.е. имеющих одинаковую длину сопряжения, частота и форма линии валентного колебания С=С-связей одинаковые.
Увеличение массы концевых групп полиенов, встроенных в олигомеры винилхлорида, приводит к сдвигу линии КР в низкочастотную область, соответствующей валентному колебанию С–С- связей, и к увеличению интенсивности обеих линий в этом диапазоне спектра.
Как уже было сказано выше, длина сопряжения для β-каротина больше, чем для полиена CH3(–CH=CH–)9CH3. При сравнении спектров этих соединений видно, что интенсивность линий, соответствующих валентным колебаниям С–С- и С=С-связей, увеличивается при увеличении длины сопряжения. Этот результат также подтверждается расчетами, приведенными в работе [16].
Значение частоты валентных С–С-колебаний для β-каротина, превышающее частоту этих колебаний для полиена CH3(–CH=CH–)9CH3, можно объяснить только влиянием боковых групп. Этот вывод подтверждают рассчитанные спектры КР модифицированных молекул β-каротина, в которых все боковые или все концевые группы замещались атомами H- и CH3-группами соответственно. При удалении концевых групп в молекуле β-каротина длина сопряжения становится меньше, и линии валентных колебаний С–С- и С=С-связей смещаются в высокочастотную область спектра. Этот результат также подтверждается приведенной на рис. 3 зависимостью для полиенов. При удалении всех боковых групп в молекуле β-каротина частота валентного колебания С=С-связей не меняется, так как не меняется длина сопряжения, а линия валентного колебания С–С-связей значительно смещается в низкочастотную область спектра. При удалении всех боковых групп также исчезает расщепление линий, отвечающих валентным колебаниям С–С- и С=С-связей, и пропадает линия КР около 1000 см–1, соответствующая деформационным колебаниям боковых СН3-групп. При этом интенсивности линий КР значительно возрастают, что мы объясняем выпрямлением полиеновой цепи и исчезновением расщепления линий.
Таким образом, можно сделать вывод, что частота валентного колебания С=С-связей в основном определяется длиной сопряжения, а частота валентного колебания С–С-связей зависит как от длины сопряжения, так и от структуры боковых и концевых групп. На интенсивность линий, отвечающих валентным колебаниям С–С- и С=С-связей, влияют длина сопряжения, масса концевых групп, наличие заместителей в полиеновой цепи, приводящее к изгибу цепи и расщеплению линий в спектре.
Для демонстрации зависимости спектров КР полиенов и каротиноидов от типа изомера на рис. 5 приведены спектры КР изомеров полиенов с n = 9 и 11, β-каротина и ликопина. Изомеры 3-цис- и 7‑цис-полиена CH3(–CH=CH–)9CH3 соответствуют 9-цис- и 13-цис-изомерам β-каротина, а изомер 9-цис-полиена CH3(–CH=CH–)11CH3 соответствует 13-цис-изомеру ликопина.
Рис. 5.
Рассчитанные спектры КР: а – транс- и 9-цис-изомеров β-каротина, транс- и 3-цис-изомеров полиена CH3(–CH=CH–)9CH3; б – транс- и 13-цис-изомеров β-каротина, транс- и 7-цис-изомеров полиена CH3(–CH=CH–)9CH3; в – транс- и 13-цис-изомеров ликопина, транс- и 9-цис-изомеров полиена CH3(–CH=CH–)11CH3.
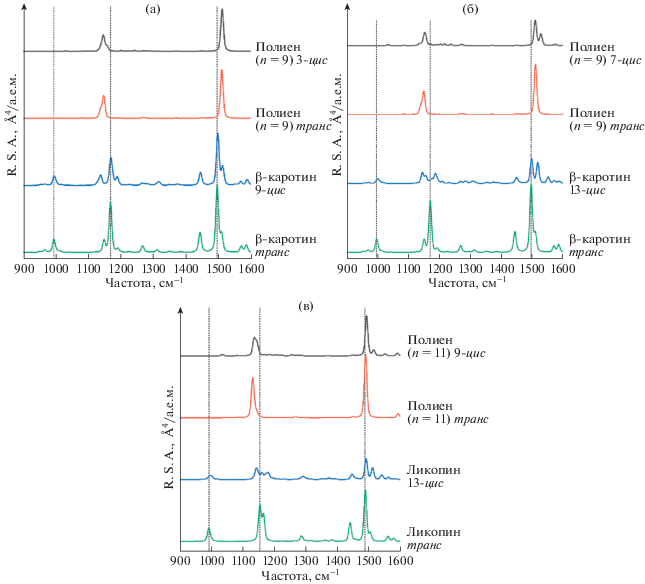
Из рис. 5 видно, что спектры КР изомеров каротиноидов заметно отличаются, и это потенциально позволяет различать изомеры этих соединений по спектрам КР. В спектрах 13-цис-изомеров β-каротина и ликопина возникает заметное расщепление обеих линий. Из сравнения спектров, приведенных на рис. 5, следует, что полиены с n = 9 и 11 не могут быть использованы в качестве модели для описания спектров КР цис-изомеров каротиноидов, так как такая модель только частично отражает различия в спектрах КР транс- и цис-изомеров молекул каротиноидов.
ЗАКЛЮЧЕНИЕ
В работе приведены теоретические спектры КР ряда веществ, содержащих полиеновые цепи. Расчет был выполнен с использованием теории функционала плотности. Показано, что для транс-изомеров полиенов частота валентного колебания С=С-связей определяется числом С=С-связей в полиене и уменьшается с увеличением длины сопряжения.
Частота валентного колебания С–С-связей для транс-изомеров полиенов зависит сложным образом от длины сопряжения, а также от структуры боковых и концевых групп. При увеличении длины сопряжения частота валентного колебания С–С-связей уменьшается. При увеличении массы концевых групп эта линия смещается в низкочастотную область, а при наличии боковых СН3-групп значительно смещается в высокочастотную область.
Интенсивность линий, отвечающих валентным колебаниям С–С- и С=С-связей, возрастает с увеличением длины сопряжения и массы концевых групп. Наличие боковых СН3-групп приводит к изгибу полиеновой цепи в каротиноидах, уменьшению интенсивности и расщеплению линий, соответствующих валентным колебаниям С–С- и С=С-связей.
Наличие атактических последовательностей мономеров винилхлорида (–CH2–CHCl–)kH, k = 3–6 не влияет на частоту валентного колебания С=С-связей полиенов в деградированном ПВХ. В связи с этим при изучении связи частоты этого колебания с длиной полиена в деградированном промышленном ПВХ можно заменить расчеты макромолекулы рассмотрением полиена подходящей длины.
Спектры КР цис-изомеров β-каротина и ликопина отличаются от спектров транс-изомеров этих молекул, что потенциально позволяет различать эти вещества по спектрам КР. Показано, что использование полиенов в качестве модельных объектов не подходит для описания спектров КР цис-изомеров каротиноидов.
Список литературы
Elvira-Torales L.I., García-Alonso J., Periago-Castón M.J. Nutritional Importance of Carotenoids and Their Effect on Liver Health: A Review // Antioxidants. 2019. V. 8. № 7. P. 229. https://doi.org/10.3390/antiox8070229
Meléndez-Martínez A.J., Stinco C.M., Mapelli-Brahm P. Skin Carotenoids in Public Health and Nutricosmetics: The Emerging Roles and Applications of the UV Radiation-Absorbing Colourless Carotenoids Phytoene and Phytofluene // Nutrients. 2019. V. 11. № 5. P. 1093. https://doi.org/10.3390/nu11051093
von Doering W., Sotiriou-Leventis C., Roth W.R. Thermal interconversions among 15-cis-, 13-cis-, and all-trans-.beta.-carotene: kinetics, Arrhenius parameters, thermochemistry, and potential relevance to anticarcinogenicity of all-trans-.beta.-carotene // J. Amer. Chem. Soc. 1995. V. 117. № 10. P. 2747–2757. https://doi.org/10.1021/ja00115a010
Khoo H.-E. et al. Carotenoids and Their Isomers: Color Pigments in Fruits and Vegetables // Molecules. 2011. V. 16. № 2. P. 1710–1738. https://doi.org/10.3390/molecules16021710
Kuznetsov S.M. et al. Raman spectroscopic detection of polyene-length distribution for high-sensitivity monitoring of photo- and thermal degradation of polyvinylchloride // Spectrochim. Acta Part A Mol. Biomol. Spectrosc. Elsevier B.V., 2021. V. 252. P. 119494. https://doi.org/10.1016/j.saa.2021.119494
Yousif E., Hasan A. Photostabilization of poly(vinyl chloride) – Still on the run // J. Taibah Univ. Sci. Taibah University. 2015. V. 9. № 4. P. 421–448. https://doi.org/10.1016/j.jtusci.2014.09.007
Kip B.J. et al. Considerations for Raman Spectroscopic Determination of Polyene Length Distribution in Degraded Poly(vinyl chloride) // Macromolecules. 1992. V. 25. № 17. P. 4290–4296. https://doi.org/10.1021/ma00043a008
Gilbert M. et al. Assessment of PVC stabilisation using hydrotalcites – Raman spectroscopy and other techniques // Polym. Degrad. Stab. Moscow: Elsevier B.V., 2013. V. 98. № 8. P. 1537–1547. https://doi.org/10.1016/j.polymdegradstab.2013.04.005
Hillemans J.P.H.M. et al. An in situ Raman spectroscopic study of the degradation of PVC // Polym. Degrad. Stab. 1993. V. 42. № 3. P. 323–333. https://doi.org/10.1016/0141-3910(93)90228-B
Smith, Ewen. Modern Raman spectroscopy : a practical approach / Ewen Smith, Geoff Dent. p. cm. Includes bibliographical references and index. ISBN 0-471-49668-5 (cloth : alk. paper) — ISBN 0-471-49794-0 (pbk. : alk. paper).
Darvin M.E. et al. Noninvasive selective detection of lycopene and β-carotene in human skin using Raman spectroscopy // Laser Phys. 2004. V. 14. № 2. P. 231–233.
Ishigaki M. et al. Unveiling the Aggregation of Lycopene in Vitro and in Vivo: UV–Vis, Resonance Raman, and Raman Imaging Studies // J. Phys. Chem. B. 2017. V. 121. № 34. P. 8046–8057. https://doi.org/10.1021/acs.jpcb.7b04814
Baruya A., Gerrard D.L., Maddams W.F. Resonance Raman spectrum of degraded poly(vinyl chloride). 4. Determination of conjugated polyene sequence lengths // Macromolecules. 1983. V. 16. № 4. P. 578–580. https://doi.org/10.1021/ma00238a018
Finkelshtein E.I., Shamsiev R.S. Spectral and structural properties of carotenoids - DFT and thermochemical calculations // J. Mol. Struct. Elsevier B.V, 2019. V. 1197. P. 583–593. https://doi.org/10.1016/j.molstruc.2019.07.067
Darvin M.E. et al. Optical methods for noninvasive determination of carotenoids in human and animal skin // J. Biomed. Opt. 2013. V. 18. № 6. P. 061230. https://doi.org/10.1117/1.jbo.18.6.061230
Novikov V.S. et al. DFT study of Raman spectra of polyenes and ß-carotene: Dependence on length of polyene chain and isomer type // Spectrochim. Acta Part A Mol. Biomol. Spectrosc. Elsevier B.V., 2021. V. 255. P. 119668. https://doi.org/10.1016/j.saa.2021.119668
Laikov D.N., Ustynyuk Y.A. PRIRODA-04: a quantum-chemical program suite. New possibilities in the study of molecular systems with the application of parallel computing // Russ. Chem. Bull. 2005. V. 54. № 3. P. 820–826. https://doi.org/10.1007/s11172-005-0329-x
Schaffer H.E. et al. Conjugation length dependence of Raman scattering in a series of linear polyenes: Implications for polyacetylene // J. Chem. Phys. 1991. V. 94. № 6. P. 4161–4170. https://doi.org/10.1063/1.460649
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Физика, технические науки


