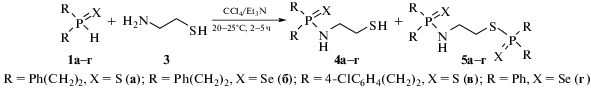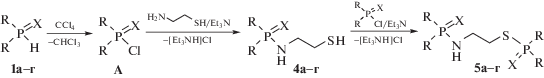Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 490, № 1, стр. 19-23
ОКИСЛИТЕЛЬНОЕ КРОСС-СОЧЕТАНИЕ ЦИСТЕАМИНА С ВТОРИЧНЫМИ ФОСФИНХАЛЬКОГЕНИДАМИ: АСПЕКТЫ ХЕМОНАПРАВЛЕННОСТИ РЕАКЦИИ
К. О. Храпова 1, Н. К. Гусарова 1, А. А. Тележкин 1, П. А. Волков 1, Н. И. Иванова 1, Л. И. Ларина 1, К. А. Апарцин 2, В. В. Киреева 2, академик РАН Б. А. Трофимов 1, *
1 Иркутский институт химии им. А.Е. Фаворского Сибирского отделения Российской академии наук
Иркутск, Россия
2 Иркутский научный центр Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: boris_trofimov@irioch.irk.ru
Поступила в редакцию 20.11.2019
После доработки 20.11.2019
Принята к публикации 20.11.2019
Аннотация
Цистеамин (2-аминоэтантиол) вступает в окислительное кросс-сочетание с вторичными фосфинсульфидами и фосфинселенидами в мягких условиях (комнатная температура, 2–5 ч, система CCl4/Et3N), образуя продукты моносочетания по аминогруппе (амиды этилхалькогенофосфиновых кислот со свободными SH-функциями) и дисочетания (1-халькогенофосфориламино-2-халькогентиоэтаны), суммарный выход которых 72–85%. В аналогичных условиях перемешивание эквимольной смеси бис(2-фенилэтил)фосфинсульфида (или фосфинселенида), 1-бутиламина и 1-бутантиола приводит к хемоселективному образованию с высоким выходом амидов соответствующих халькогенофосфиновых кислот.
Реакция Атертона–Тодда – фосфорилирование аминов диалкилфосфонатами в присутствии оснований и тетрахлорида углерода [1] – продолжает развиваться и совершенствоваться [2]. В последние десятилетия успешно реализовано и изучено окислительное кросс-сочетание доступных сейчас вторичных фосфинхалькогенидов (легко получаются из красного фосфора, стиролов и халькогенов [3]) с различными NH-, OH- и SH-соединениями [4–8]. Реакции протекают в системе CCl4/Et3N (реже без основания [8]) с образованием амидов, эфиров и тиоэфиров халькогенофосфиновых кислот – востребованных прекурсоров для дизайна лекарственных средств [9, 10] и интермедиатов для получения современных инновационных материалов [11, 12]. Постулируется, что данное кросс-сочетание протекает через промежуточное образование хлоридов халькогенофосфиновых кислот, которые далее реагируют с NH-, OH- или SH-нуклеофилами [2, 5–8, 13]. В то же время данные о взаимодействии вторичных фосфинхалькогенидов с соединениями, содержащими одновременно различные ХН-группы (где X = N, O, S), ограничиваются публикацией о кросс-сочетании вторичных фосфинхалькогенидов с аминофенолами в среде CCl4/Et3N, приводящем хемоселективно к образованию О-эфиров аминофенилхалькогенофосфиновых кислот, т.е. фосфорилирование аминофенолов проходило с участием только фенольных гидроксилов [13].
Настоящая работа посвящена изучению реакции вторичных фосфинхалькогенидов с бифункциональным 2-аминоэтантиолом (цистеамин) в системе CCl4/Et3N, определению ее хемонаправленности, а также синтезу новых востребованных функциональных производных халькогенофосфиновых кислот. Выбор цистеамина оправдан также с практической точки зрения, поскольку это соединение является эффективным радиопротектором и используется при лечении лучевых повреждений, онкологических заболеваний, малярии, шизофрении, болезней Паркинсона и Гентингтона [14].
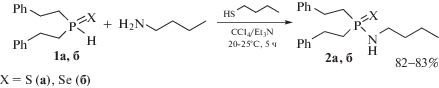
Для получения предварительных данных о возможном направлении изучаемого кросс-сочетания мы провели конкурентную реакцию между алифатическими амином, тиолом и вторичным фосфинхалькогенидом. Оказалось, что перемешивание смеси 1-бутиламина, 1-бутантиола и бис(2-фенилэтил)фосфинсульфида 1а или бис(2-фенилэтил)фосфинселенида 1б (все три реагента были взяты в равном мольном соотношении) при комнатной температуре (5 ч, система CCl4/Et3N) приводит к хемоселективному образованию новых представителей амидов соответствующих халькогенофосфиновых кислот 2а, б (данные ЯМР 31Р), т.е. в этом случае конкуренцию за электрофил полностью выигрывает 1-бутиламин (схема 1). Препаративный выход амидов 2а, б 82–83%.
В то же время 2-аминоэтантиол 3 реагирует с вторичными фосфинсульфидами 1а, в и фосфинселенидами 1б, г в аналогичных условиях (мольное соотношение реагентов 1 : 1, комнатная температура, 2–5 ч, система CCl4/Et3N), образуя не только ожидаемые амиды халькогенофосфиновых кислот 4а–г, но также и продукты дисочетания 5а–г, т.е. в последнем случае фосфорилирование бинуклеофила 3 протекает как по амино-, так и по тиогруппе (схема 2). Суммарный выход соединений 4, 5 73–85% при их соотношении от 1 : 0.9 до 1 : 2.4 (табл. 1, оп. 1–4), конверсия исходных вторичных фосфинхалькогенидов при этом количественная (данные ЯМР 31Р).
Таблица 1
| № опыта | R2P(X)H | Время, ч | Соотношение продуктов | Суммарный выход соединений 4 и 5, % |
|---|---|---|---|---|
| 1* | [Ph(CH2)2]2P(S)H, 1а | 5 | 4а : 5а = 1 : 0.9 | 73 |
| 2* | [4-ClC6H4(CH2)2]2P(S)H, 1в | 5 | 4в : 5в = 1 : 0.8 | 80 |
| 3* | [Ph(CH2)2]2P(Se)H, 1б | 3 | 4б : 5б = 1 : 2.4 | 85 |
| 4* | Ph2P(Se)H, 1г | 2 | 4г : 5г = 1 : 2.0 | 76 |
| 5** | [Ph(CH2)2]2P(S)H, 1а | 5 | 4а : 5а = 1 : 2.0 | 72 |
| 6** | [Ph(CH2)2]2P(Se)H, 1б | 5 | 4б : 5б = 1 : 6.3 | 84 |
Индивидуальные продукты моно- и дисочетания 4в и 5в, синтезированные в условиях оп. 2 (табл. 1), были выделены с препаративным выходом 43 и 37% соответственно.
Анализ полученных результатов (табл. 1) свидетельствует, что вторичные фосфинселениды 1б, г проявляют большую реакционную способность в изучаемом процессе, чем вторичные фосфинсульфиды, поскольку требуют меньшее время для завершения реакции. Кроме того, в случае вторичных фосфинселенидов доля соединений 5 (продукты дисочетания), более чем в 2 раза больше по сравнению с экспериментами для вторичных фосфинсульфидов (табл. 1, ср. оп. 1 и 3, 2 и 4). Соотношение соединений 4 : 5 также сдвигается в пользу последних при введении в реакцию двукратного мольного избытка вторичного фосфинхалькогенида 1а, б (табл. 1, оп. 5, 6).
Окислительное кросс-сочетание вторичных фосфинхалькогенидов 1 с 2-аминоэтантиолом 3 протекает в системе CCl4/Et3N, вероятно, через первоначальное образование бис(органилхалькогенофосфорил)хлорида А [5]. Последний далее атакует 2-аминоэтантиол как по аминогруппе с образованием соединений 4, так и по обоим нуклеофильным центрам, что приводит к продуктам дисочетания 5 (схема 3).
Нарушение хемоселективности изучаемого кросс-сочетания (схемы 2, 3), т.е. снижение нуклеофильности NH2-группы в 2-аминоэтантиоле 3 по сравнению с 1-бутиламином, который на 100% выигрывает конкуренцию у 1-бутантиола (см. схему 1), можно объяснить известным фактом [15] существования внутримолекулярной водородной связи между тиогидроксильным заместителем и атомом азота в 2-аминоэтантиоле.
Схема 3 позволяет также объяснить более высокую реакционную способность вторичных фосфинселенидов 1б, г по сравнению с фосфинсульфидами 1а, в. Действительно, образование промежуточного хлорида А реализуется легче в случае более “кислых” фосфинселенидов 1б, г [7].
Таким образом, получена фундаментальная информация о хемонаправленности реакции окислительного кросс-сочетания между 2-аминоэтантиолом (цистеамин) и вторичными фосфинхалькогенидами в системе CCl4/Et3N, протекающей не только по NH2-группе (преимущественное направление), но также и с участием SH-функции. Изучение конкурентной реакции между 1-бутиламином, 1-бутантиолом и бис(2-фенилэтил)фосфинсульфидом или -фосфинселенидом в системе CCl4/Et3N показало, что кросс-сочетание реализуется хемоселективно и эффективно с образованием неизвестных ранее амидов соответствующих халькогенофосфиновых кислот.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1H, 13C, 15N, 31P и 77Se получены на спектрометрах Bruker DPX-400 и Bruker AV-400 (400.13, 100.62, 40.56, 161.98 и 76.31 МГц соответственно) в CDCl3, внутренний стандарт – ГМДС (1H, 13C), MeNO2 (15N), Me2Se (77Se), внешний – 85%-ная Н3РО4 (31P). Элементный анализ выполнен на анализаторе Flash EA 1112 Series. Эксперимент проводили в инертной атмосфере (аргон). Мониторинг реакции осуществляли методом ЯМР 31Р. В качестве побочных соединений образуются соответствующие ангидриды халькогенофосфиновых кислот (идентифицированы методом ЯМР 31Р с использованием заведомых образцов [7]).
Реакция вторичных фосфинхалькогенидов 1а–г с цистеамином 3. К раствору вторичного фосфинхалькогенида 1а-г (1.0 ммоль) в CCl4 (3 мл) добавляли Et3N (1.0 ммоль). Полученную смесь перемешивали при 20–25°C в течение 10 мин, затем добавляли цистеамин 3 (1.0 ммоль) и продолжали перемешивание при комнатной температуре (20–25°С) в течение 2–5 ч. Растворитель упаривали при пониженном давлении, остаток очищали методом колоночной хроматографии на SiO2, элюент – толуол:эфир (10:1). Выделяли вязкое масло, которое сушили при пониженном давлении.
N-(2-Сульфанилэтил)амид бис(2-фенилэтил)тиофосфиновой кислоты (4а) (описан из смеси 4а и 5а). Спектр ЯМР 13C (CDCl3), δC, м.д.: 28.5 д (PhСН2, 2JPС 3.1 Гц), 32.6 д (CH2S, 3JPС 4.4 Гц), 35.5 д (СН2Р, 1JPС 63.1 Гц), 39.6 (CH2N), 126.4 (Сп), 128.2 (См), 128.6 (Со), 140.6 д (Cипсо, 3JPС 14.7 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –335.7. Спектр ЯМР 31P (CDCl3), δP, м.д.: 71.4.
2-{[Бис(2-фенилэтил)фосфортиоил]амино}этил бис(2-фенилэтил)фосфинодитиоат (5а) (описан из смеси 4а и 5а). Спектр ЯМР 13C (CDCl3), δC, м.д.: 28.7; 29.1 д (PhСН2, 2JPС 2.8 Гц, 2JPС 3.2 Гц), 32.8 д (CH2S, 3JPС 4.5 Гц), 35.5; 39.3 д (СН2Р, 1JPС 62.7 Гц, 1JPС 48.9 Гц), 42.4 (CH2N), 126.5; 126.7 (Сп), 128.3; 128.4 (См), 128.7; 128.8 (Со), 140.1; 140.8 д (Cипсо, 3JPС 15.9 Гц, 3JPС 14.9 Гц). Спектр ЯМР 15N (CDCl3), δN, м. д.: –337.5. Спектр ЯМР 31P (CDCl3), δP, м.д.: 71.2; 75.8.
N-(2-Сульфанилэтил)амид бис(2-фенилэтил)селенофосфиновой кислоты (4б) (описан из смеси 4б и 5б). Спектр ЯМР 13C (CDCl3), δC, м.д.: 29.1 д (PhСН2, 2JPС 1.8 Гц), 34.3 д (CH2S, 3JPС 6.7 Гц), 35.7 д (СН2Р, 1JPС 54.5 Гц), 39.6 (CH2N), 126.5 (Сп), 128.4 (См), 128.8 (Со), 140.3 д (Cипсо, 3JPС 15.1 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –338.1. Спектр ЯМР 31P (CDCl3), δP, м.д. 65.9 (+ дублет сателлитов 1JPSe 732.0 Гц). Спектр ЯМР 77Se (CDCl3), δSe, м.д.: –316.0 д (1JPSe 732.0 Гц).
S-(2-{[Бис(2-фенилэтил)фосфорселеноил]амино}этил) бис(2-фенилэтил)фосфиноселенотиоат (5б) (описан из смеси 4б и 5б). Спектр ЯМР 13C (CDCl3), δC, м.д.: 29.3; 29.8 д (PhСН2, 2JPС 2.2 Гц, 2JPС 3.2 Гц), 34.5 д (CH2S, 3JPС 6.9 Гц), 35.9; 39.1 д (СН2Р, 1JPС 54.3 Гц, 1JPС 41.4 Гц), 43.1 (CH2N), 126.6; 126.7 (Сп), 128.3; 128.4 (См), 128.7; 128.8 (Со), 139.9; 140.5 д (Cипсо, 3JPС 16.4 Гц, 3JPС 14.7 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –336.6. Спектр ЯМР 31P (CDCl3), δP, м.д.: 65.5 (+ дублет сателлитов 1JPSe 734.3 Гц), 66.1 (+ дублет сателлитов 1JPSe 760.1 Гц). Спектр ЯМР 77Se (CDCl3), δSe, м.д.: –320.3 д (1JPSe 734.3 Гц), –267.7 д (1JPSe 760.1 Гц).
N-(2-Сульфанилэтил)амид бис[2-(4-[хлорфенил]этил)тиофосфиновой кислоты (4в). Выход 180 мг (43%), вязкое масло. Спектр ЯМР 1H (CDCl3), δ, м.д.: 2.19–2.33 м (5H, SH, СН2Р), 2.59–2.64 м (1H, NH), 2.88 д (2H, CH2S, 3JHH 6.1 Гц), 3.02–3.12 м (4H, PhСН2), 3.35–3.39 м (2H, CH2N), 7.26 д (4H, Hо, 3JHH 8.1 Гц), 7.38–7.40 м (4H, Hм). Спектр ЯМР 13C (CDCl3), δC, м.д.: 28.9 д (PhСН2, 2JPС 2.5 Гц), 35.3 д (СН2Р, 1JPС 63.1 Гц), 39.6 (CH2N), 40.1 д (CH2S, 3JPС 6.1 Гц), 128.8 (См), 129.7 (Со), 132.3 (Cп), 139.0 д (Cипсо, 3JPС 14.5 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –337.8. Спектр ЯМР 31P (CDCl3), δP, м.д.: 71.0. Найдено, %: С 51.89; Н 5.45; Cl 16.73; N 3.44; Р 7.57; S 15.11. С18Н22Cl2NPS2. Вычислено, %: С 51.67; Н 5.30; Cl 16.95; N 3.35; Р 7.40; S 15.33.
2-({Бис[2-(4-хлорфенил)этил]фосфортиоил}амино)этил бис[2-(4-хлорфенил)этил]фосфиндитиоат (5в). Выход 281 мг (37%), вязкое масло. Спектр ЯМР 1H (CDCl3), δ, м.д.: 2.17–2.37; 2.41–2.48 м (8H, СН2Р), 2.67–2.73 м (1H, NH), 2.99–3.22 м (10H, CH2S, PhСН2), 3.28–3.32 м (2H, CH2N), 7.22–7.28 м (8H, Hо), 7.37–7.41 м (8H, Hм). Спектр ЯМР 13C (CDCl3), δC, м.д.: 28.0; 28.4 д (PhСН2, 2JPС 1.9 Гц, 2JPС 2.4 Гц), 33.0 д (CH2S, 3JPС 6.9 Гц), 35.4; 39.2 д (СН2Р, 1JPС 63.6 Гц, 1JPС 49.4 Гц), 42.3 (CH2N), 128.8; 129.0 (См), 129.7; 129.8 (Со), 132.3; 132.6 (Сп), 138.4; 139.2 д (Cипсо, 3JPС 16.2 Гц, 3JPС 15.9 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –334.3. Спектр ЯМР 31P (CDCl3), δP, м.д.: 70.7; 75.3. Найдено, %: С 53.99; Н 5.05; Cl 18.53; N 1.78; Р 8.06; S 12.52. С34Н37Cl4NP2S3. Вычислено, %: С 53.76; Н 4.91; Cl 18.67; N 1.84; Р 8.16; S 12.66.
N-(2-Сульфанилэтил)амид дифенилселенофосфиновой кислоты (4г) (описан из смеси 4г и 5г). Спектр ЯМР 13C (CDCl3), δC, м.д.: 39.3 д (CH2S, 3JPС 7.8 Гц), 40.7 (CH2N), 128.3 (См), 131.8 (Со), 131.9 (Сп), 133.5 д (Cипсо, 3JPС 91.7 Гц). Спектр ЯМР 31P (CDCl3), δP, м.д.: 57.4 (+ дублет сателлитов 1JPSe 753.8 Гц). Спектр ЯМР 77Se (CDCl3), δSe, м.д.: –261.9 д (1JPSe 753.8 Гц).
S-{2-[(Дифенилфосфорселеноил)амино]этил} дифенилфосфиноселенотиоат (5г) (описан из смеси 4г и 5г). Спектр ЯМР 13C (CDCl3), δC, м.д.: 34.5 д (CH2S, 3JPС 8.8 Гц), 41.9 (CH2N), 128.4; 128.6 (См), 131.6; 131.7 (Со), 132.0; 132.1 (Сп), 133.3; 133.4 д (Cипсо, 3JPС 80.4 Гц, 3JPС 86.1 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –334.1. Спектр ЯМР 31P (CDCl3), δP, м.д. 56.8 (+ дублет сателлитов 1JPSe 755.0 Гц), 57.3 (+ дублет сателлитов 1JPSe 778.8 Гц). Спектр ЯМР 77Se (CDCl3), δSe, м.д.: –261.3 д (1JPSe 755.0 Гц), –204.2 д (1JPSe 778.8 Гц).
Конкурентная реакция 1-бутиламина и 1-бутантиола с вторичными фосфинхалькогенидами 1а, б. К раствору вторичного фосфинхалькогенида 1а, б (1.0 ммоль) в CCl4 (3 мл) добавляли Et3N (1.0 ммоль). Полученную смесь перемешивали при 20–25°C в течение 10 мин, затем добавляли раствор 1-бутиламина (1.0 ммоль) и 1-бутантиола (1.0 ммоль) в CCl4 (1 мл) и продолжали перемешивание при комнатной температуре в течение 5 ч. Растворитель упаривали при пониженном давлении, остаток очищали методом колоночной хроматографии на SiO2, элюент – толуол : эфир (10 : 1). Полученный продукт сушили при пониженном давлении, получили амиды 2а, б.
N-Бутиламид бис(2-фенилэтил)тиофосфиновой кислоты (2а). Выход 283 мг (82%), вязкое масло. Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.94 тр (3H, Me, 3JHH 7.2 Гц), 1.32–1.37 м (2H, NCH2CH2CH2), 1.42–1.47 м (2H, NCH2CH2), 1.95–2.00 м (1H, NH), 2.15–2.26 м (4H, СН2Р), 2.81–2.88 м (2H, CH2N), 2.95–3.06 м (4H, PhСН2), 7.23–7.34 м (10H, Ph). Спектр ЯМР 13C (CDCl3), δC, м.д.: 13.6 (Me), 19.7 (NCH2CH2CH2), 28.4 д (PhСН2, 2JPС 2.9 Гц), 33.7 д (NCH2CH2, 3JPС 7.3 Гц), 34.4 д (СН2Р, 1JPС 62.9 Гц), 39.6 д (CH2N, 2JPС 3.4 Гц), 126.2 (Сп), 128.1 (См), 128.4 (Со), 140.8 д (Cипсо, 3JPС 14.4 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –335.0. Спектр ЯМР 31P (CDCl3), δP, м.д. 70.5. Найдено, %: С 69.71; Н 8.25; N 4.12; P 8.73; S 9.07. С20Н28NPS. Вычислено, %: С 69.53; Н 8.17; N 4.05; P 8.97; S 9.28.
N-Бутиламид бис(2-фенилэтил)селенофосфиновой кислоты (2б). Выход 326 мг (83%), вязкое масло. Спектр ЯМР 1H (CDCl3), δ, м.д.: 0,93 тр (3H, Me, 3JHH 7.3 Гц), 1.30–1.36 м (2H, NCH2CH2CH2), 1.40–1.45 м (2H, NCH2CH2), 1.96–2.00 м (1H, NH), 2.22–2.42 м (4H, СН2Р), 2.78–2.85 м (2H, CH2N), 2.94–3.07 м (4H, PhСН2), 7.21–7.33 м (10H, Ph). Спектр ЯМР 13C (CDCl3), δC, м.д.: 13.6 (Me), 19.7 (NCH2CH2CH2), 29.0 д (PhСН2, 2JPС 1.5 Гц), 33.5 д (NCH2CH2, 3JPС 7.5 Гц), 34.9 д (СН2Р, 1JPС 54.7 Гц), 41.7 д (CH2N, 2JPС 3.9 Гц), 126.2 (Сп), 128.1 (См), 128.4 (Со), 140.4 д (Cипсо, 3JPС 14.7 Гц). Спектр ЯМР 15N (CDCl3), δN, м.д.: –334.8. Спектр ЯМР 31P (CDCl3), δP, м.д. 64.2 (+ дублет сателлитов 1JPSe 723.8 Гц). Спектр ЯМР 77Se (CDCl3), δSe, м.д.: –316.2 д (1JPSe 723.8 Гц). Найдено, %: С 61.43; Н 7.30; N 3.49; Р 7.72; Se 19.95. С20Н28NPSe. Вычислено, %: С 61.22; Н 7.19; N 3.57; Р 7.89; Se 20.12.
Список литературы
Atherton F.R., Openshw H.T., Todd A.R. // J. Chem. Soc. 1945. P. 660–663. https://doi.org/10.1039/JR9450000660
Le Corre S.S., Berchel M., Couthon-Gourvès H., Haelters J.-P., Jaffrès P.-A. // Beilstein J. Org. Chem. 2014. V. 10. P. 1166–1196. https://doi.org/10.3762/bjoc.10.117
Gusarova N.K., Arbuzova S.N., Trofimov B.A. // Pure Appl. Chem. 2012. V. 84. P. 439–459. https://doi.org/10.1351/PAC-CON-11-07-11
Wang G., Shen R., Xu Q., Goto M., Zhao Y., Han L.-B. // J. Org. Chem. 2010. V. 75. P. 3890–3892. https://doi.org/10.1021/jo100473s
Gusarova N.K., Volkov P.A., Ivanova N.I., Larina L.I., Trofimov B.A. // Tetrahedron Lett. 2011. V. 52. P. 2367–2369. https://doi.org/10.1016/j.tetlet.2011.02.095
Wagner S., Rakotomalala M., Bykov Y., Walter O., Dőring M. // Heteroatom Chem. 2012. V. 23. P. 216–222. https://doi.org/10.1002/hc.21006
Gusarova N.K., Volkov P.A., Ivanova N.I., Larina L.I., Trofimov B.A. // Heteroatom Chem. 2012. V. 23. P. 322–328. https://doi.org/10.1002/hc.21020
Гусарова Н.К., Волков П.А., Иванова Н.И., Храпова К.О., Трофимов Б.А. // ЖОХ. 2015. Т. 85. С. 206–208. https://doi.org/10.1134/S107036321502005X
Ravaschino E.L., Docampo R., Rodriguez J.B. // J. Med. Chem. 2006. V. 49. P. 426–435. https://doi.org/10.1021/jm050922i
Alexandre F.-R., Amador A.S., Bot S., Caillet C.T., Convard T., Jakubik J., Musiu C., Poddesu B., Vargiu L., Liuzzi M., Roland A., Seifer M., Standring D., Storer R., Dousson C.B. // J. Med. Chem. 2011. V. 54. P. 392–395. https://doi.org/10.1021/jm101142k
Burgos P.O., Fernandez I., Iglesias M.J., Garcia-Granda S., Ortiz F.L. // Org. Lett. 2008. V. 10. P. 537–540. https://doi.org/10.1021/ol7028096
Crampton R.H., Hajjaji S.E., Fox M.E., Woodward S. // Tetrahedron: Asymmetry. 2009. V. 20. P. 2497–2503. https://doi.org/10.1016/j.tetasy.2009.09.020
Храпова К.О., Волков П.А., Иванова Н.И., Тележ-кин А.А., Гусарова Н.К., Трофимов Б.А. // ЖОХ. 2018. Т. 88. С. 1739–1742. https://doi.org/10.1134/S0044460X1810027X
Besouw M., Masereeuw R., Heuvel1 L., Levtchenko E. // Drug Discovery Today. 2013. V. 18. P. 785–792. https://doi.org/10.1016/j.drudis.2013.02.003
Сигэру Оаэ. Химия органических соединений серы (Пер. с япон. Под ред. Прилежаевой Е.Н.). М.: Химия, 1975. 512 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах