Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 492-493, № 1, стр. 104-110
Синтез, фото- и электрофизические свойства 7'-[7,10-бис-(4'-фторфенил)-флуорантен-8-ил](9,9-дидоцил)флуорена в качестве перспективного активного материала для светодиодов синего свечения
Д. Ю. Годовский 1, *, С. А. Куклин 1, Ю. Зоу 2, академик РАН А. Р. Хохлов 1, Чж. Се 3, М. Л. Кештов 1
1 Федеральное государственное бюджетное учреждение науки Институт элементоорганических соединений
им. А.Н. Несмеянова Российской академии наук
Москва, Россия
2 Центральный Южный университет
Чанша, Китай
3 Чанчуньский институт прикладной химии,
Академия наук Китая
Чанчунь, Китай
* E-mail: dmigo@yandex.ru
Поступила в редакцию 04.03.2020
После доработки 23.04.2020
Принята к публикации 06.05.2020
Аннотация
Синтезирован новый олигомер-люминофор, сочетающий в себе преимущества полициклических ароматических соединений и флуореновых структур. Новое соединение обладает необходимыми пленкообразующими свойствами, легко растворяется в большинстве органических растворителей и излучает в синей области солнечного света с максимумом 465 нм. Оно обладает достаточно высоким квантовым выходом и может выступать как в качестве электролюминесцентного допанта, так и в роли проводящей светоизлучающей матрицы для создания полностью растворимых органических светодиодов с синим и белым спектром излучения, как при струйной печати, так и при нанесении покрытия методом центрифугирования. Новый олигомер-люминофор представляет собой перспективный пример высокофлуоресцентного олигомера — не так часто используемоего класса материалов, в отличие от полимеров и небольших молекул. Такие олигомеры могут быть весьма полезны для будущих полностью растворимых органических светодиодов.
ВВЕДЕНИЕ
В последнее время органические светодиоды (ОСИД) привлекают большое внимание исследователей не только с академической, но и практической точки зрения, благодаря успешному использованию в плоских дисплеях следующего поколения, таких как телевизоры и мобильные телефоны [1]. Голубой цвет является одним из очень важных и основных цветов RGB (красный, зеленый и синий) для ОСИД, поскольку он необходим не только для полноцветных изображений, но также для получения другого цветового излучения [2]. Однако изготовление ОСИД голубого свечения и голубых ОСИД-пикселей затруднено из-за широкой запрещенной зоны (>2.9 эВ) и более низких HOMO и более высоких LUMO, чем у зеленого и красного излучателей, приводящих к большим барьерам, нестабильной инжекции и транспорту зарядов [3]. Синие ОСИД также часто характеризуются отсутствием фотостабильности от собственного излучения при собственных высоких энергиях фотонов. В последние годы ученые сосредоточились на изготовлении высокоэффективных голубых излучающих материалов с высокой внешней квантовой эффективностью (EQE) с использованием фосфоресцирующих [4] или термически активированных флуоресцентных (TADF) материалов [5]. Однако разработка таких материалов пока ограничена. Поэтому исследование синих флуоресцентных материалов является актуальной задачей, и много усилий было посвящено разработке высокоэффективного синего флюоресцентного излучателя для потенциального применения в экранах телевизоров и мобильных телефонов [6].
Производные флуорена являются привлекательными фото- и электролюминесцентными материалами, широко используемыми в молекулярных светодиодах голубого свечения, благодаря термической стабильности, хорошей растворимости в обычных органических растворителях, высокому квантовому выходу флуоресценции и привлекательным дырочно-транспортным свойствам [7]. Тем не менее, флуоренам присущ ряд недостатков [8]: длинный путь синтеза конечных продуктов, низкие выходы (например, при синтезе бороновых производных), плохие электроно-транспортные свойства, нестабильность чистоты цвета, вызванная образованием агрегатов, эксимеров, а также оксо-групп, что ведет к красному смещению эмиссии и уменьшению ее эффективности [9]. Разрушение, вызванное кристаллизацией и термическим разложением при работе светоизлучающих диодов, происходит быстро из-за низкой температуры стеклования [10]. Ранее сообщалось, что введение спиробифлуорена в структуру алкилфлуорена уменьшает кристаллизацию, предотвращает тушение люминесценции, увеличивает температуру стеклования, улучшает растворимость и термическую стабильность [11]. Для подавления межцепных взаимодействий и улучшения термической стабильности в производные флуорена нами был введен флуорантеновый фрагмент, сочетающий высокую термическую стабильность с улучшенными дырочно-транспортными свойствами.
На основании проведенных нами квантово-химических расчетов мы постарались выбрать класс олигомеров, имеющих энергию синглетного экситона в синей области видимого спектра и устойчивых как относительно фотоиндуцированного разложения, так и относительно собственно возбуждения экситона в олигомере. Мы увеличивали количество конденсированных циклов в олигомере, чтобы соблюсти и синий характер эмиссии, и стабильность синглетного экситона.
В этом исследовании мы попытались найти замену флуорену, используя его родственные производные – флуорантены – в качестве излучателей синего света.
Частичная или полная замена алкилфлуорена фенилированными флуорантеновыми производными в флуорене вследствие наличия большого количества боковых объемных групп будет ограничивать агрегацию, полностью подавлять образование эксимеров при сохранении высокой электролюминесценции в пленках. Для получения новых флуорантенсодержащих флуоренов нами разработано и синтезировано новое соединение, 7'_[7,10_бис_(4'_фторфенил)флуорантен_8_ил](9,9-дидоцил)-флуорен 7, которое показало широкую полосу испускания с синим цветом излучения в твердом состоянии. Для изучения электролюминесцентных свойств мы изготовили ОСИД, используя этот материал в качестве излучающего слоя, и оценили его эффективность.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
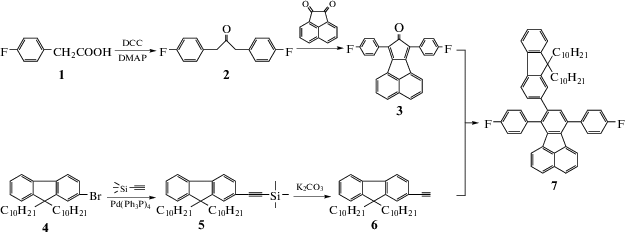
Синтез целевого продукта 7'-[7,10-бис-(4'_фторфенил)флуорантен-8-ил](9,9-дидоцил)флуорена (7) был осуществлен согласно схеме 1, предполагающей превращение (4_фторфенил)уксусной кислоты (1) в 1,3-бис-(4'-фторфенил)-пропанон-2 (2) в присутствии дициклогексилкарбодиимида (DCC) и N,N_диметиламинопиридина (DMAP) в качестве катализаторов. Выход соединения 2 составил 82%. Взаимодействием эквимолярного количества α-дикетона 2 с аценафтенхиноном получили промежуточное соединение 7,9-бис-(4'-фторфенил)циклопента[a]аценафтиленон-8 (3) в виде желтых кристаллов с высоким выходом 93%. Наконец, конденсация последнего с 2_этинил(9,9-дидодецил)флуореном (6) [12] в условиях реакции Дильса–Альдера в α-хлорнафталине привела к получению целевого продукта 7 в виде желтых кристаллов с количественным выходом (97%).
Состав и строение промежуточных соединений и целевого продукта были подтверждены данными элементного анализа, ИК- и ЯМР-спектроскопии. В частности, в ИК-спектрах соединения 3 в области 1700–1710 см–1 присутствует интенсивная полоса поглощения, характерная для группы С=О циклопентадиенонового фрагмента. В спектрах 1Н ЯМР соединения 7 все ароматические протоны резонируют в интервале δ = = 7.90–6.50 м. д., в котором присутствуют четыре явно выраженных дублета и пять мультиплетов, соответствующих протонам фенильного, флуорантенового и флуоренового фрагментов. В сильнопольной области в интервале 2.00–0.40 м. д. обнаруживаются сигналы, характерные для 42 алифатических протонов. Хотя протонный спектр соединения 7 сложный, отношение интегральных интенсивностей ароматической части к алифатической соответствует предлагаемой структуре. В спектре 13С ЯМР соединения 7 в области δ = = 108–155 м. д. присутствуют 40 сигналов, 18 из которых четвертичные, что хорошо согласуется с предлагаемой структурой. В спектре 19F ЯМР целевого продукта при значениях δ = –113.90 и 114.32 м. д. резонируют два пика, принадлежащих двум различным атомам фтора. Спектры ЯМР вместе с элементным анализом полностью подтверждают состав и строение предложенного целевого соединения 7. Термическая стабильность соединения 7 была исследована методом ТГА. Температура потери 5% массы образца равна 362°С, что предполагает высокую термостабильность полученного соединения.
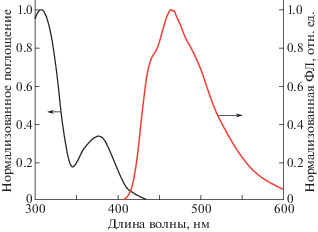
Оптические свойства соединения 7 были исследованы с помощью УФ-спектроскопии, результаты которой приведены в табл. 1, а соответствующие спектры поглощения и флуоресценции представлены на рис. 1. Максимумы спектров поглощения соединения 7 проявляются при 306 и 375 нм соответственно. Интенсивный пик поглощения в области 306 нм может быть отнесен к π–π* переходам сопряженных ароматических сегментов, а слабый пик поглощения при 375 нм может быть присущ n–π* переходу для сопряженного молекулярного скелета. Значение оптической ширины запрещенной зоны ($E_{g}^{{{\text{опт}}}}$) соединения 7, найденное из края спектра поглощения (λкр) согласно уравнению $E_{g}^{{{\text{опт}}}}$ = 1240/λкр, равно 2.80 эВ. Нормированный на 1 спектр флуоресценции этого соединения показан на рис. 2. Соединение 7 в толуоле излучает синий свет (λмакс = 465 нм). Вдобавок, cтоксов сдвиг этого соединения превышает 100 нм и может быть отнесен к образованию стерически смещенных друг относительно друга структур, что делает основное и возбужденное состояние различными. Квантовый выход соединения 7 равный 0.85 (λвоз = 380 нм) был измерен в разбавленном растворе толуола с использованием 9,10-дифенилантрацена в качестве эталона. Спектр флуоресценции в основном определяется полициклическим ядром и не зависит от длины волны возбуждения. Фторсодержащие заместители лишь незначительно увеличили длину π-сопряжения, что привело к сдвигу полос флуоресценции приблизительно на 20 нм в красную область спектра.
Таблица 1.
Оптические и электрохимические свойства соединения 7
| Соединение | $\lambda _{{{\text{макс}}}}^{{{\text{погл}}}}$*, нм | $\lambda _{{{\text{макс}}}}^{{{\text{фл}}}}$*, нм | ЕВЗМО, эВ | ЕНСMO, эВ | $E_{g}^{{{\text{ех}}}}$**, эВ | $E_{g}^{{{\text{опт}}}}$***, эВ |
|---|---|---|---|---|---|---|
| 7 | 306, 375 | 465 | –5.75 | –2.97 | 2.78 | 2.8 |
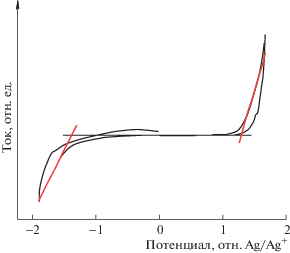
Электрохимические свойства соединения 7 исследовали с помощью циклической вольтамперометрии, результаты которой приведены в табл. 1, а соответствующие кривые представлены на рис. 2. Циклическую вольтамперометрию пленок проводили в 0.1 М ацетонитрильном растворе тетрабутиламмоний гексафторфосфата (Bu4NPF6) при скорости сканирования 50 мВ/с. В качестве противоэлектрода использовали платиновый электрод, а в роли внешнего стандарта – Fс/Fс+. Соединение 7 обладает обратимыми окислительно-восстановительными свойствами благодаря его высокой электроактивности. На циклической вольтамперограмме (рис. 3) наблюдаются один пик восстановления в отрицательной и один пик окисления в положительной областях напряжения. Из начала потенциала окисления ($E_{{{\text{нач}}}}^{{{\text{ок}}}}$) и восстановления ($E_{{{\text{нач}}}}^{{{\text{вос}}}}$) циклической вольтамперограммы (рис. 3) были найдены энергии ВЗMO и НСMO и ширина запрещенной зоны ($E_{g}^{{{\text{эх}}}}$) согласно уравнениям:
Энергии ВЗMO/НСMO и $E_{g}^{{{\text{эх}}}}$ соединения 7 равны –5.75/–2.97 эВ и 2.78 эВ соответственно. Соединение 7 имеет хорошую дырочно-инжекционную и дырочно-транспортную способность, поскольку НОМО соединения 7 близок к обычным дырочно-инжекционным материалам, таким как РЕDОТ:PSS (–5.2 эВ) (H.C. Starсk, Германия). Такие благоприятные НОМО/LUMO уровни излучателя способствуют сбалансированной инжекции и транспорту зарядов при электролюминесцентном процессе, а низко лежащий уровень ВЗМО благоприятствует хорошей стабильности на воздухе. Следует отметить, что энергия $E_{g}^{{{\text{эх}}}}$ соединения 7, найденная из данных электрохимических исследований, хорошо согласуется со значением $E_{g}^{{{\text{оп}}}}$, полученным из данных спектров поглощения.
Для исследования электролюминесцентных свойств соединения 7 нами разработаны ОСИД структуры ITO/PEDOT:PSS/HTL/EML/ETL/ LiF/Al. PEDOT:PSS использовали в качестве инжекционно-транспортного слоя. Полимер на основе N,N'-дифенил-N,N'-бис(м-толил)-1,1'-бифенил-4,4'-диамина использовали в роли дырочно-проводящего слоя (HTL), а 9,10-ди-(нафталин-2-ил)антрацен-2-ил-(4,1-фенилен)-1-фенил-1H-бензо[d]имидазол как электроно-транспортный слой (ETL). Светоизлучающий слой (EML) являлся комбинацией матрицы А или соединения 7 (хозяин) и легирующей добавки П или соединения 7 (6 вес. %) во всех ОСИД-образцах. Матрица А представляет собой производное 9,10-диарилантрацена (LG Chem, Южная Корея), а легирующая добавка П - производное пирена (LG Chem, Южная Корея). Матрицу A, наряду с соединением 7, использовали в качестве хозяина, в то время как соединение 7, наряду с добавкой П, также использовали в роли допанта. Электролюминесцентные свойства целевого продукта 7 были изучены путем введения его в качестве светоизлучающего слоя в структуру ОСИД, для чего нами были изготовлены следующие структуры: допант П/матрица А (структура 1), допант П/соединение 7 (структура 2), соединение 7/матрица А (структура 3).
Образцы ОСИД были изготовлены совместно с корпорацией LG Chem (Южная Корея), работы велись параллельно. Образцы формировали на стеклянных подложках, покрытых слоем ITO (оксид индия-олова) с поверхностным сопротивлением 10–15 Ом/□. Подложки непосредственно перед использованием были тщательно очищены: механическая обработка батистом в мыльном растворе, обработка в ультразвуковой ванне в различных растворах (щелочное ПАВ, деионированная вода, перегнанный изопропанол), отжиг в кислородной плазме.
Изготовление и измерение характеристик образцов ОСИД производилось в перчаточном боксе MBraun (Германия) в атмосфере аргона (99.998%) с контролем содержания кислорода и воды. Растворы высокомолекулярных материалов 7, PEDOT:PSS наносили методом центрифугирования из раствора. Формирование катодного слоя и слоев низкомолекулярной органики производилось вакуум-термическим способом в вакуумной камере бокса при давлении 5 × 10–4 Па. Контроль скорости напыления и толщины слоев осуществляли с помощью колеблющегося вблизи резонансной частоты кварцевого датчика. Для контроля толщины полимерных пленок использовали микроинтерферометр МИИ-4М (Россия) и атомно-силовой микроскоп EnviroScope (Bruker, США). Измерение вольтамперных и вольтяркостных характеристик (ВАХ, ВЯХ) проводили при помощи программируемого источника постоянного напряжения (тока) – измерителя тока (напряжения) SoursMeterKeithley 2601 (США), сочлененного с пикоамперметром Keithley 6485 (США) для измерения токов с фотодиода яркомера ТКА-04/3 (Россия). Спектры электролюминесценции регистрировали при помощи волоконного спектрофлуориметра AvaSpec 2048 (Россия).
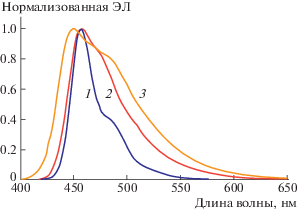
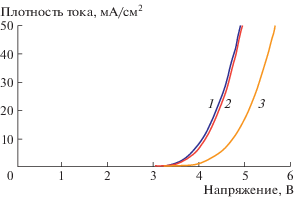
Структура 1 (Допант П/матрица А) была выбрана нами в качестве устройства сравнения. На рис. 3 представлены спектры электролюминесценции структур 1–3, а основные электролюминесцентные (ЭЛ) характеристики приведены в табл. 2. Как видно из рис. 3, спектры электролюминесценции всех образцов обнаруживают интенсивное синее излучение с максимумом около 458 нм, слегка сдвинутым в коротковолновую область по сравнению со спектром ФЛ соединения 7. Структуры 2 и 3 излучают интенсивный синий свет с CIE координатами цветности (0.164; 0.225) и (0.154; 0.141) соответственно (табл. 2). Структуры 2 и 3 при плотности тока 10 мА/см2 показывают напряжения начала свечения 4.71 и 4.15 В, высокие яркости 240.92 и 358.16 кд/м2, эффективности 1.6 и 2.71 лм/Вт с внешней квантовой эффективностью 1.41 и 2.96% соответственно (рис. 4). Лучшая эффективность 2.71 лм/Вт получена для структуры 3 при напряжении 4.15 В, плотности тока 10 мА/см–2 и яркости 358.16 кд/м2 (рис. 4).
Таблица 2.
Некоторые характеристики ОСИД в сравнении с эталонным устройством (структура 1)*
| Параметр ОСИД | Допант П/матрица A (структура 1) | допант П/7 (структура 2) | 7/матрица A (структура 3) |
|---|---|---|---|
| Напряжение свечения, В | 4.21 | 4.74 | 4.15 |
| Эффективность токовая, кд/А | 4.08 | 2.41 | 3.58 |
| Эффективность, лм/Вт | 3.05 | 1.6 | 2.71 |
| EQE, % | 4.3 | 1.41 | 2.96 |
| Светимость, кд/м2 | 408.46 | 240.92 | 358.16 |
| CIE (x; y) | 0.141; 0.103 | 0.164; 0.225 | 0.154; 0.141 |
Контрольный образец 1 (структура 1) оказался удобной исходной структурой для изучения ЭЛ свойств соединения 7. Следует отметить (табл. 2), что структура 3 по своим характеристикам сравнима с контрольной структурой 1. Полученные свойства вместе с термическими характеристиками и хорошей растворимостью (20 мг/мл в толуоле и хлороформе) делают соединение 7 потенциальным кандидатом для электрооптических ОСИД применений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1,3-Бис(4-фторфенил)пропан-2-он (2). В трехгорлую колбу емкостью 500 мл, снабженную магнитной мешалкой, капельной воронкой и вводом для аргона, помещали 22.8 г (110.4 ммоль) дициклогексилкарбодиимида, 3.69 г (30.0 ммоль) 4_диметиламинопиридина, 210 мл дихлорметана. К этой смеси по каплям при 25°С прибавляли раствор 100.0 ммоль (4-фторфенил)уксусной кислоты в 90 мл дихлорметана. Реакционную смесь перемешивали 12 ч, после чего выпавший осадок мочевины отфильтровывали. Фильтрат упаривали на роторном испарителе, остаток перекристаллизовывали из гексана, получая кристаллы желтого цвета. Выход 82%. ИК (KBr, ν, см–1): 1680 (CO). 1Н ЯМР (CDCl3, 400 МГц, δН, м. д.): 7.44 (д, 4H, Ar), 7.01 (д, 4H, Ar), 3.67 (c, 4H, CH2). 13С ЯМР (CDCl3, 100 МГц, δ, м. д.): 204.1 (СО), 132.45 (С), 131.67 (СН), 131.03 (СН), 121.08 (С), 48.28 (СН). Найдено, %: С 48.74; Н 3.21; F 43.28. Для С15H12F2O вычислено, %: С 48.95; Н 3.28; Br 43.42.
7,9_Бис(4-фторфенил)циклопента[a]аценафтилен-8-он (3). Смесь 2.475 г (13.6 ммоль) аценафтенхинона и 13.6 ммоль соединения 2 в 45 мл этанола нагревали до кипения и добавляли по каплям раствор 0.78 г (13.9 ммоль) КОН в 4 мл этанола, после чего реакционную массу кипятили в течение 2 ч. Затем смесь охлаждали до комнатной температуры, выпавший осадок отфильтровывали, промывали этанолом, дистиллированной водой и перекристаллизовывали из этанола. Выход 93%. ИК (KBr, ν, см–1): 1705 (CO). 1Н ЯМР (CDCl3, 400 МГц, δН, м. д.): 7.92 (дд, 2H), 7.85 (дд, 2H), 7.69 (т, 2Н), 7.62 (дд, 4Н), 7.43 (дд, 4Н). 13C ЯМР (CDCl3, 100 МГц, δС, м. д.): 198.44 (СО), 170.74 (С), 147.62 (С), 136.56 (С), 133.78 (С), 147.62 (С), 131.75 (CH), 131.21 (C), 130.5 (CH), 128.4 (CH), 128.33 (C), 124.04 (СH), 122.96 (С), 118.04 (С). Найдено, %: С 63.10; Н 2.59; F 30.47. Для С27H14F2O вычислено, %: С 63.07; Н 2.74; N 31.08.
7'-[7, 10-бис-(4'-фторфенил)флуорантен-8-ил](9,9дидоцил)флуорен (7). В трехгорлую колбу емкостью 25 мл, снабженную обратным холодильником и магнитной мешалкой, помещали 5.0 ммоль соединения 3, 5.0 ммоль 7-этинил(9,9-дидодецил)флуорена и 7.5 мл хлорнафталина. Реакционную смесь перемешивали при 180°C в течение 10 ч, после чего охлаждали до комнатной температуры, растворитель отгоняли в вакууме. Остаток перекристаллизовывали из толуола, получая желтые кристаллы. Выход 97%, Тпл = 243–245°C. 1H ЯМР (CDCI3, 400 МГц, δН, м. д.): 8.15 (м, 2Н), 8.08–7.95 (м, 6Н), 7.79 (м, 3Н), 7.65 (м, 4Н), 7.49–7.33 (м, 6Н), 7.07 (д, 1Н), 7.00 (д, 1Н), 6.76 (д, 1Н). 13C ЯМР (CDCl3, 100 МГц, δС, м. д.): 139.66 (С), 139.28 (С), 138.15 (С), 137.78 (С), 136.52 (С), 136.36 (С), 135.94 (C), 135.63 (C), 135.45 (C), 132.91 (C), 132.88 (CН), 131.77 (СH), 131.65 (СН), 131.5 (СН), 131.22 (С), 131.14 (СН), 130.81 (СН), 130.75 (С).
ВЫВОДЫ
Синтезирован новый олигомер (соединение 7), сочетающий в себе преимущества полициклических ароматических соединений и флуореновых структур. Соединение 7 обладает необходимыми пленкообразующими свойствами, легко растворяется в большинстве органических растворителей и излучает в синей области солнечного света с максимумом 465 нм. Оно обладает достаточно высоким квантовым выходом и может выступать как в качестве электролюминесцентного допанта, так и в роли проводящей светоизлучающей матрицы (хозяин) для создания полностью растворимых ОСИД с синим и белым спектром излучения, как при струйной печати, так и при нанесении покрытия методом центрифугирования. Мы считаем, что это перспективный пример высокофлуоресцентного олигомера – не так часто используемоего класса материалов, в отличие от полимеров и небольших молекул. Такие олигомеры могут быть весьма полезны для будущих полностью растворимых ОСИД.
Список литературы
D`Andrade B.W., Forrest S.R. White Organic Light-Emitting Devicesfor Solid-State Lighting // Adv. Mater. 2004, V. 16. P. 1585–1595.
Chen B., Liu B., Zheng J., Nie H., Xiong Y., Zou J., Ning H., Wang Z., Zhao Z., Tang B.Z. Efficient Bipolar Blue AIEgens for High-Performance Nondoped Blue OLEDs and Hybrid White OLEDs // Adv. Funct. Mater. 2018. V. 28. 1803369.
Lee K.H., Park J.K., Seo J.H., Park S.W., Kim Y.S., Kim Y.K., Yoon S.S. Efficient deep-blue and white organic light-emitting diodes based on triphenylsilane-substituted anthracene derivatives // J. Mater. Chem. 2011. V. 21. P. 13640–13648.
Xiao L., Su S.J., Agata Y., Lan H., Kido J. Nearly 100% Internal Quantum Efficiency in an Organic Blue-Light Electrophosphorescent Device Using a Weak Electron Transporting Material with a Wide Energy Gap // Adv. Mater. 2009. V. 21. P. 1271–1274.
Uoyama H., Goushi K., Shizu K., Nomura H., Adachi C. Highly efficient organic light-emitting diodes from delayed fluorescence // Nature 2012. V. 492. P. 234-238.
Zhu X.H., Peng J., Cao Y., Roncali J. Solution-processable single-material molecular emitters for organic light-emitting devices // Chem. Soc. Rev. 2011. V. 40. P. 3509–3524.
Klärner G., Lee J., Davey M.H., Miller R.D. Exciton migration and trapping in copolymers based on dialkylfluorenes. // Adv. Mater. 1999. V. 11. № 2. P. 115–119.
Wu C.-C., Lin Y.-T., Wong K.-T., et al. Efficiency and Stability of polyfluorene-based OLED emitters // Adv. Mater. 2004. V. 16. P. 61–65.
Gong X., Iyer P.K., Moses D., Bazan G.C., Heeger A.J., Xiao S.S. Stabilized Blue Emission from Polyfluorene-Based Light-Emitting Diodes: Elimination of Fluorenone Defects // Adv. Funct. Mater. 2003. V. 13. P. 325–330.
Wu C., Chen Y. Copolyfluorenes containing pendant bipolar groups: Synthesis, optoelectronic properties and applications // J. Mater. Chem. 2010. V. 20. P. 7700–7709.
Peng Z., Bao Z., Galvin M.E. Polymers with Bipolar Carrier Transport Abilities for Light Emitting Diodes // Chem. Mater. 1998. V. 10. P. 2086–2090.
Matussek M., Filapek M., Gancarz P., Krompiec S., Małecki J.G., Kotowicz S., Siwy M., Maćkowski S., Chrobok A., Schab-Balcerzak E., Słodek A. Synthesis and photophysical properties of new perylene bisimide derivativesfor application as emitting materials in OLEDs. Dyes and Pigments. 2018. V. 159. P. 590–599.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах