Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 492-493, № 1, стр. 23-30
Замена гетареновой части молекулы при синтезе индолинового спиропирана с катионным фрагментом
А. Д. Пугачев 1, *, М. Б. Лукьянова 1, Б. С. Лукьянов 1, И. В. Ожогин 1, А. С. Козленко 1, В. В. Ткачев 2, 3, П. Б. Чепурной 1, Г. В. Шилов 2, академик РАН В. И. Минкин 1, академик РАН С. М. Алдошин 2
1 Научно-исследовательский институт физической
и органической химии Южного федерального университета
Ростов-на-Дону, Россия
2 Институт проблем химической физики Российской академии наук
Черноголовка, Московской обл., Россия
3 Институт физиологически активных веществ Российской академии наук
Черноголовка, Московской обл., Россия
* E-mail: artem_d_pugachev@mail.ru
Поступила в редакцию 11.03.2020
После доработки 26.05.2020
Принята к публикации 19.07.2020
Аннотация
В работе описывается получение нового солевого спиропирана индолинового ряда, содержащего в качестве заместителя в положении 8' 2Н-хроменовой части молекулы винил-3H-индолиевый фрагмент и атом хлора в бензольном ядре индолинового фрагмента. Структура продукта реакции исследована с помощью ИК-, 1Н и 13С ЯМР-спектроскопии. Данные рентгеноструктурного анализа позволили установить, что в результате реакции происходит частичный обмен индолинового гетаренового фрагмента с образованием описанного нами ранее солевого спиропирана, не содержащего атома хлора в индолиновой части молекулы.
Спиропираны являются одним из наиболее изученных классов органических фотохромных соединений [1]. Благодаря возможности контролировать характеристики молекулы стало возможным широкое использование этого класса соединений в разных областях науки и техники [2–4].
Спироциклические соединения в солевой форме представляют некоторый интерес в области фармацевтики [5]. Также считается, что благодаря наличию объемного противоиона в кристаллической решетке солевые спиропираны могут демонстрировать фотохромное поведение в твердой фазе. Замена обычных анионов на содержащие d-металлы комплексные, например, хром(III)-оксалаты [6] или железо(III)-тиооксалаты [7], позволяет использовать такие соединения в качестве молекулярных фотомагнетиков [6, 7]. Солевые структуры, подобные изучаемым в данной работе соединениям, характеризуются отличным от нуля поглощением и фотолюминесценцией в ближнем ИК диапазоне [8].
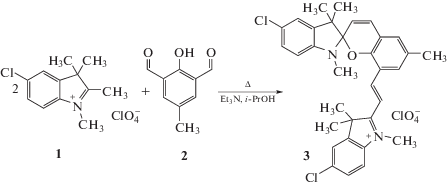
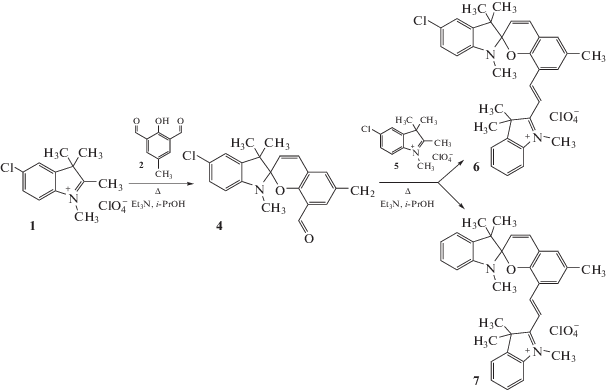
Ранее нами был описан однореакторный синтез 1,3,3,6'-тетраметил-5-хлор-8'[(Е)-2-(1'',3'',3''-триметил-5''-хлор-3Н-индолий-2''-ил)винил]-спиро[индолин-2,2'-2Н-хромен] перхлората 3 по схеме 1 [9].
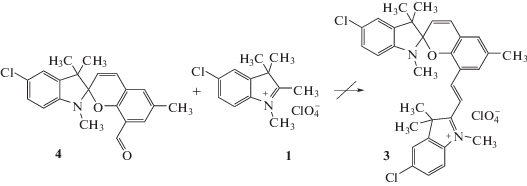
Неудавшаяся ранее в работе [9] попытка получения спиропирана 3 из 1,3,3,6'-тетраметил-5-хлор-спиро[индолин-2,2'-2Н-хромена] 4 (Схема 2), вероятно, связана с тем, что формильная группа спиропирана в нем имеет меньшую реакционную способность, чем в 2-гидрокси-3-формил-5-метилбензальдегиде 2, с одной стороны, а атом хлора в бензольном цикле перхлората 1,2,3,3-тетраметил-5-хлор-3Н-индолия 1 отрицательно влияет на реакционную способность метильной группы в положении 2, с другой стороны.
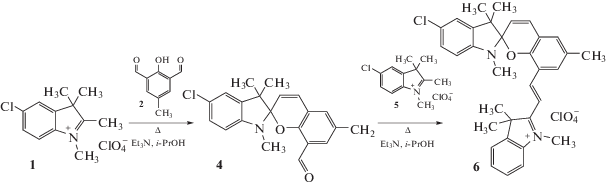
В связи с этим для получения нового солевого спиропирана, содержащего лишь один атом хлора (в индолиновом фрагменте), была применена двухстадийная методика с использованием солей 1,2,3,3-тетраметил-3Н-индолия 1 и 5 разного строения (схема 3).
Продукты реакции были исследованы методами ИК-, 1Н и 13С ЯМР- спектроскопии.
В ИК спектре соединения 4, помимо сигналов связей C=C (1608 см–1), Car–N (1291, 1258 см–1), Cспиро–О (927 см–1) и С–Сl (730 см–1), присутствует полоса поглощения связи C=O при 1693 см–1, а спектры 1Н и 13С ЯМР соответствуют структуре 4. В ИК спектрах спиропирана 6 присутствуют характерные полосы поглощения, соответствующие валентным колебаниям связей С=С (1605 см–1), С–N (1308 и 1260 см–1), Cl=O перхлорат-аниона (1091 см–1), Сспиро–О (931 см–1), а также C–Cl (1021 и 760 см–1).
Однако, спектр 1Н ЯМР имеет сложный вид, указывающий на наличие в продукте реакции двух соединений схожего строения. Для соединения 6 гем-диметильные группы катионного фрагмента проявляются в виде шестипротонного синглетного сигнала при 1.34 м. д. У гем-диметильных групп гетареновой части магнитная неэквивалентность более ярко выражена, потому они проявляются двумя трехпротонными синглетными сигналами (1.17 и 1.24 м. д.). Характерные сигналы протона в положениях 3' и 4' наблюдаются при 5.98 и 7.12 м. д. в виде дублетных сигналов с константой спин-спинового взаимодействия 10.3 Гц, что свидетельствует о цис-конфигурации винильного фрагмента С3'=С4'. Трехпротонный синглетный сигнал N–CH3 группы проявляется при 2.68 м. д., а N+–CH3 группы – при 3.65 м. д.
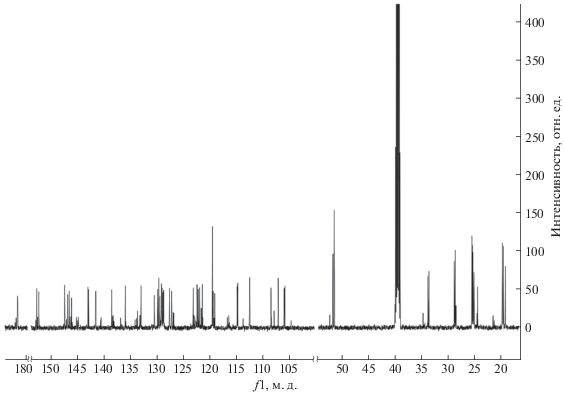
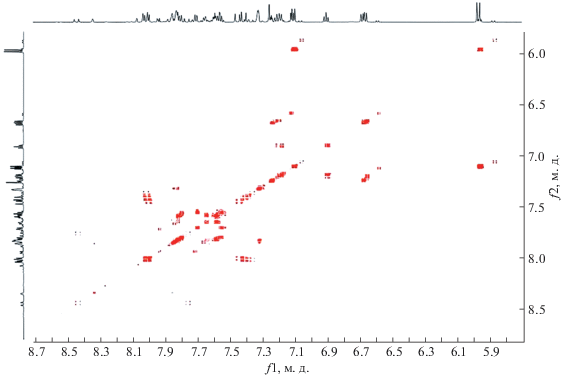
В спектре 13С ЯМР (рис. 1) присутствуют сигналы всех атомов углерода, однако сложный вид спектра вызывает затруднение при их отнесении.
Для более корректного соотнесения сигналов целевого соединения и возможного побочного продукта реакции были проведены дополнительные исследования методом двумерной ЯМР спектроскопии COSY 1H–1H, что позволило определить положения всех ароматических протонов (рис. 2). Протоны винильного фрагмента катионного заместителя проявились как дублетные сигналы при 7.42 и 8.03 м. д. с константами спин-спинового взаимодействия 16.5 Гц, что говорит о транс-конфигурации. Присутствие атома хлора в положениях 5 и вызвало расщепление сигналов близлежащих атомов водорода.
Присутствие сигналов двух 3' протонов, а также наблюдаемое в некоторых случая удвоение и наложение сигналов, позволяет говорить о том, что строение соединений действительно схоже. Путем сравнения интегральных интенсивностей характерных сигналов удалось установить, что соотношение соединений 6 : 7 = 1 : 0.6.
Попытка разделения смеси продуктов реакции с помощью метода хроматографии оказалась неудачной вне зависимости от сорбента и элюента. Тем не менее, из этанольного раствора продукта реакции удалось вырастить кристаллы и провести их рентгеноструктурное исследование.
В результате проведенного рентгеноструктурного исследования оказалось, что выращенные кристаллы соответствуют структуре соединения 7, изученной нами ранее [10]. СIF-файл полученных ранее результатов кристаллографического исследования был депонирован в Кембриджский центр структурных данных (CCDC) под номером 1468145.
Несмотря на структурное сходство, наблюдались некоторые отличия в упаковке кристалла, а также в кристаллографических данных (табл. 1). Для исследованной ранее структуры соединения 7 характерно вращение метильной группы только при атоме углерода C-6', а в последнем случае – только при атомах азота гетареновой части и катионного фрагмента.
Таблица 1.
Сравнение кристаллографических данных
| Параметр | Для соединения 7 (CCDC № 1468145) | Данные РСА соединения 7 |
|---|---|---|
| Пространственная группа | P 21/n | |
| Параметры ячейки | a = 12.6223(5) Å | a = 12.6473(7) Å |
| b = 13.7507(7) Å | b = 13.9521(10) Å | |
| c = 16.8751(8) Å | c = 16.8292(10) Å | |
| β = 96.353(4)° | β = 96.799(5)° | |
| α = γ = 90° | α = γ = 90° | |
| Объем ячейки, Å3 | 2910.95 | 2948.74 |
| Количество укороченных контактов в кристалле | 11 | 24 |
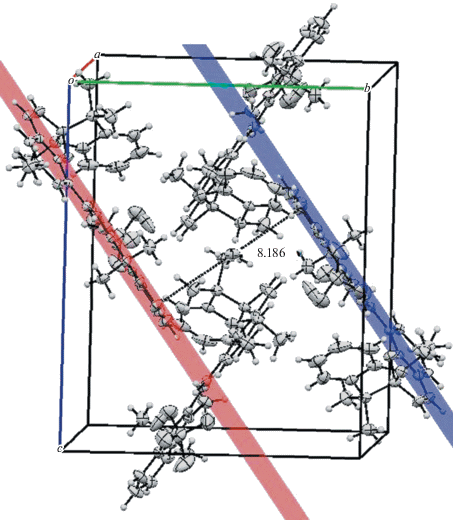
Также интересно, что в последнем случае наблюдалось большее количество укороченных контактов, что способствовало более плотной упаковке молекул в кристалле. На рисунках ниже видно, что лежащие в выбранных плоскостях молекулы в последнем случае (рис. 3) располагаются на 2.153 Å ближе друг к другу относительно предыдущих результатов (рис. 4).
Рис. 3.
Расположение молекул в ячейке кристалла соединения 7 по результатам РСА. Расстояние между выбранными плоскостями 6.033 Å.
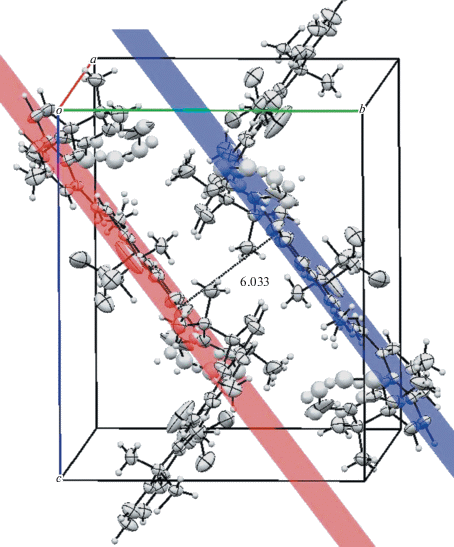
Рис. 4.
Расположение молекул в ячейке кристалла соединения 7 по результатам РСА для структуры № 1468145 (CCDC). Расстояние между выбранными плоскостями 8.186 Å.
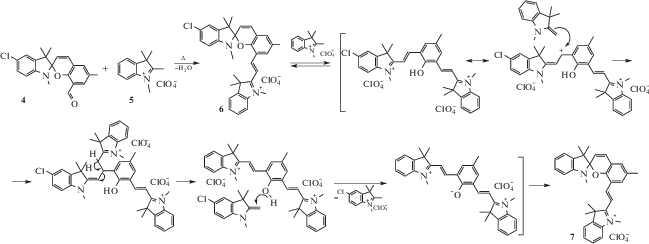
С учетом полученных методом РСА данных реакция может быть представлена схемой 4.
Предположительный механизм образования солевого спиропирана 7 в следствие замены гетаренового фрагмента приводится на схеме 5.
Таким образом, в результате проведенных структурных исследований был обнаружен эффект частичного обмена индолинового гетаренового фрагмента, в результате чего образуются два спиропирана – 1,3,3,6'-тетраметил-5-хлор-8'[(Е)-2-(1'',3'',3''-триметил-3Н-индолий-2''-ил)винил]-спиро[индолин-2,2'-2Н-хромен] перхлорат 6 и 1,3,3,6'-тетраметил-8'[(Е)-2-(1'',3'',3''-триметил-3Н-индолий-2''-ил)винил]-спиро[индолин-2,2'-2Н-хромен] перхлорат 7.
Ранее подобная замена гетаренового фрагмента не наблюдалась. Известен лишь единичный случай обмена бензопиранового фрагмента в спиропиранах путем действия орто-гидроксибензальдегидов при 60ºС и рН среды 5 на 6′-нитро-индолиноспиропиран, включенный в олигонуклеотид [11].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР регистрировали на спектрометре Bruker AVANCE-600 (600 МГц) (Германия). Положение сигналов исследуемых веществ определялось по δ‑шкале и проведено относительно сигналов остаточных протонов дейтерорастворителя: CDCl3 (7.26 м. д.) и DMSO-d6 (2.49 м. д.).
ИК спектры соединений получены на приборе Varian Excalibur 3100 FT‑IR (США) методом неполного внутреннего отражения.
Элементный анализ проведен классическим методом микроанализа [12]. Температуры плавления определены на приборе Фишера–Джонса Fisher Scientific (США).
Рентгеноструктурное исследование соединения 7 выполнено на автоматическом дифрактометре XCalibur фирмы Agilent (США) с координатным CCD детектором EOS (Agilent Technologies UK Ltd, Yarnton, Oxfordshire, England). Сбор отражений, определение и уточнение параметров элементарной ячейки проведено с использованием специализированного программного пакета CrysAlis PRO [Agilent (2011). CrysAlis PRO version 171.35.19, Agilent Technologies UK Ltd, Yarnton, Oxfordshire, England]. Рентгенодифракционные данные были получены при температуре образца 100.0(1) K с использованием MoKα (λ = 0.71073 Å) излучения. Заполняемость экспериментального массива (2θ = 52.64°) составляет 99.8%. Структура была решена прямыми методами. Полноматричное уточнение позиций и тепловых параметров неводородных атомов выполнялось изотропно, а затем анизотропно по МНК. Все вычисления проведены по комплексу программ SHELXTL [13].
1,3,3,6'-Тетраметил-5-хлор-8'-формил-спиро[индолин-2,2'-2Н-хромен] 4. К смеси 0.82 г (0.005 моль) 2-гидрокси-3-формил-5-метилбензальдегида 2 и 1.54 г (0.005 моль) перхлората 1,2,3,3-тетраметил-5-хлор-3Н-индолия 1 в 25 мл пропанола-2 при нагревании добавили по каплям 0.7 мл (один молярный эквивалент) триэтиламина. Реакционную смесь кипятили 10 мин, а затем после охлаждения вылили в 60 мл воды и экстрагировали бензолом. Органический слой отделили, промыли водой, высушили б/в сульфатом натрия, упаривали в вакууме водоструйного насоса до объема 15 мл и хроматографировали на колонке с окисью кремния (элюэнт – хлороформ). Остаток, полученный после отгонки растворителя, перекристаллизовали из этанола. Выход 0.605 г (34.2%). Тпл = 124°С (из этанола).
ИК (ν, см-1): 1693 (C=O); 1608 (C=C); 1291, 1258 (Car–N); 927 (Cспиро–О); 730 (С–Сl). 1Н ЯМР (CDCl3, δ, м. д.): 10.09 (с, 1Н, –СНО), 7.42 (дд, J = = 2.3, 0.7 Гц, 1Н, Н-7'), 7.09 (дд, J = 8.2, 2.1 Гц, 1H, Н-6), 7.08 (дд, J = 2.3, 0.7 Гц, 1H, Н-5'), 6.99 (d, J = = 2.1 Hz, Н-4), 6.85 (д, J = 10.3 Гц, 1H, Н-4'), 6.40 (д, J = 8.2 Гц, 1H, Н-7), 5.74 (д, J = 10.3 Гц, 1Н, H-3'), 2.70 (с, 3Н, N–СН3), 2.26 (т, 3Н, J = 0.7 Гц, C(6')–CH3), 1.29 (с, 3Н, C(3)–CH3), 1.17 (с, 3Н, C(3)–CH3). 13C ЯМР (CDCl3, δ, м. д.): 188.75 (–СНО), 155.22 (C-9'), 146.46 (C-9), 138.31 (C-8), 133.51 (C-5'), 129.55 (C-6'), 129.11 (C-4'), 127.62 (C-7'), 127.39 (C-6), 124.22 (C-5), 122.31 (C-8'), 122.02 (C-4), 119.78 (C-10'), 119.72 (C-3'), 107.81 (C-7), 105.41 (C-2'2), 52.04 (C-3), 29.03 (N–СН3), 25.60 (C(3)–CH3), 20.25 (C(6')–CH3), 20.20 (C(3)–CH3).
Найдено, %: С, 71.38; Н, 5.61; Cl, 10.16; N, 3.87. C21H20ClNO2. Вычислено для C21H20ClNO2, %: С,Параметр71.28; Н, 5.70; Cl, 10.02; N 3.96.
1,3,3,6'-тетраметил-5-хлор-8'[(Е)-2-(1'',3'',3''-триметил-3Н-индолий-2''-ил)винил]-спиро[индолин-2,2'-2Н-хромен] перхлорат 6. В раствор 0.605 г (0.0017 моль) спиропирана 4 в 15 мл изопропилового спирта внесли 0.465 г (0.0017 моль) перхлората 1,2,3,3-тетраметил-3Н-индолия 5. Реакционную смесь кипятили 90 мин при перемешивании с обратным холодильником, а затем охладили. На следующий день выпавший осадок отфильтровали и перекристаллизовали из ацетонитрила. Выход смеси соединений 6 и 7 0.709 г (68.5%); из них 0.443 г (42.8%) – соединение 6 и 0.266 г (25.7%) – соединение 7. Тпл (смеси) = 231°С (из ацетонитрила).
Данные спектров ИК и ЯМР для соединения 6 приведены ниже на основании вычитания имеющихся данных о соединении 7 из результатов, полученных для смеси сединений 6 и 7.
ИК (ν, см–1): 1605 (C=С); 1308, 1260 (Car–N); 1091 (Cl=O, ClO$_{4}^{ - }$); 931 (Cспиро–О); 1021, 760 (С–Сl). 1H ЯМР (DMSO-d6, δ, м. д.): 8.03 (д, J = 16.5 Гц, 1H, H-12'), 7.89 (д, J = 2.0, 1H, H-7'), 7.86 (д, J = 8.6 Гц, 1H, H-7''), 7.81 (д, J = 7.4 Гц, H-4''), 7.60 (м, 1H, H-6''), 7.57 (тд, J = 7.4, 1.5 Гц, 1H, H-5''), 7.42 (д, J = 16.5 Гц, 1H, H-13'), 7.26 (с, 1H, H-5'), 7.20 (м, 2H, H-6, H-4), 7.12 (д, J = 10.3 Гц, 1H, H-4'), 6.67 (д, J = 7.7 Гц, 1H, H-7), 5.98 (д, J = 10.3 Гц, 1H, H-3'), 3.65 (с, 3H, N+–CH3), 2.68 (с, 3H, N–CH3), 2.30 (с, 3H, C–CH3), 1.34 (с, 6H, C(3'')-CH3), 1.24 (с, 3H, C(3)-CH3), 1.17 (с, 3H, C(3)-CH3).
Список литературы
Bouas-Laurent H., Dürr H. Organic Photochromism (IUPAC Technical report) // Pure Appl. Chem. 2001. V. 73. № 4. P. 639–665.
Szymański W., Beierle J.M., Kistemaker H.A.V., et al. Reversible photocontrol of biological systems by the incorporation of molecular photoswitches // Chem. Rev., 2013. V. 113. № 8. P. 6114–6178.
Klajn R. Spiropyran-based dynamic materials // Chem. Soc. Rev. 2014. V. 43. № 1. P. 148–184.
Olejniczak J., Carling C.-J., Almutairi A. Photocontrolled release using one-photon absorption of visible or NIR light // J. Controlled Release. 2015. V. 219. P. 18–30.
Moldenhauer D., Gröhn F. Water-soluble spiropyrans with inverse photochromism and their photoresponsive electrostatic self-assembly // Chem. Eur. J. 2017. V. 23. №. 16. P. 3966–3978.
Bénard S., Rivière E., Yu P., et al. A Photochromic molecule-based magnet // Chem. Mater. 2001. V. 13. № 1. P. 159–162.
Kida N., Hikita M., Kashima I., et al. Control of charge transfer phase transition and ferromagnetism by photoisomerization of spiropyran for an organic-inorganic hybrid system, (SP)[FeIIFeIII(dto)3] (SP = spiropyran, dto = C2O2S2) // J. Am. Chem. Soc. 2009. V. 131. № 1. P. 212–220.
Pugachev A.D., Ozhogin I.V., Lukyanova M.B., et al. Visible to near-IR molecular switches based on photochromic indoline spiropyrans with a conjugated cationic fragment // Spectroch. Acta, Part A. 2020. V. 230. P. 118041.
Пугачев А.Д., Козленко А.С., Лукьянова М.Б. и др. Однореакторный синтез и исследование структуры нового индолинового спиропирана с катионным заместителем // ДАН. 2019. Т. 488. № 5. С. 498-503.
Ткачев В.В., Лукьянова М.Б., Лукьянов Б.С. и др. Исследование нового продукта реакции конденсации перхлората 1,2,3,3-тетраметилиндоленилия с 2,6-диформил-4-метил-фенолом // Журн. структ. химии. 2016. Т. 57. № 6. С. 1334–1335.
Brieke C., Heckel A. Spiropyran photoswitches in the context of DNA: Synthesis and photochromic properties // Chem. Eur. J. 2013. V. 19. № 46. P. 15726–15734.
Гельман Н.Э., Терентьева Е.А., Шанина Т.М., Кипаренко Л.М., Резл В. Методы количественного органического элементного анализа. М.: Химия; 1987. 293 с.
Sheldrick G.M. // SHELXTL Bruker AXS Inc., Madison, Wisconsin, USA, 2000.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах